WYDZIAŁ CHEMII UMCS
POLSKIE TOWARZYSTWO CHEMICZNE ODDZIAŁ LUBELSKI
DORADCA METODYCZNY DS. NAUCZANIA CHEMII W LUBLINIE
LUBELSKIE SAMORZ
Ą
DOWE CENTRUM DOSKONALENIA NAUCZYCIELI –
ODDZIAŁ W ZAMO
Ś
CIU
KONKURS CHEMICZNY
„ROK PRZED MATURĄ”
ROK SZKOLNY 2008/2009
ETAP WOJEWÓDZKI
Numer kodowy
Suma punktów
Podpisy Komisji:
1. ...........................................
2. ...........................................
3. ...........................................
4. ...........................................
Informacje dla ucznia:
1.
Otrzymujesz do rozwiązania 21 zadań.
2.
Pisemnych odpowiedzi udziel zgodnie z poleceniami w oznaczonych miejscach.
3.
Podczas rozwiązywania zadań możesz korzystać z dołączonych tablic chemicznych
i kalkulatora.
4.
Nie używaj korektora.
5.
Na rozwiązanie zadań masz 120 minut.
śyczymy powodzenia
Uzyskane wyniki /wypełnia komisja konkursowa/:
Nr
zadania
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
19
20
21
Punkty
2
Zadanie 1. [2 pkt.]
Na podstawie zapisanej poniżej konfiguracji elektronowej atomów ( I – IV) podaj symbole
chemiczne pierwiastków i uszereguj je według rosnącej elektroujemności:
I. 1s
2
2s
2
2p
6
3s
2
3p
5
; II. 1s
2
2s
2
2p
6
3s
2
3p
6
4s
1
; III. 1s
2
2s
2
2p
5
; IV. 1s
2
2s
2
2p
6
3s
2
3p
1
Symbole pierwiastków uszeregowane według rosnącej elektroujemności: …………………….
Zadanie 2. [2 pkt.]
Fosgen COCl
2
jest trującym gazem stosowanym w niektórych syntezach. Napisz wzór
elektronowy cząsteczki fosgenu i podaj liczbę wolnych (niewiążących) par elektronowych
występujących w tej cząsteczce.
liczba wolnych (niewiążących) par elektronowych – ............
Zadanie 3. [1 pkt.]
Zaznacz znakiem x prawidłowe dokończenie zdania:
W cząsteczce dichlorometanu konfigurację gazu szlachetnego posiada
I
tylko atom węgla,
II
tylko atomy wodoru,
III
tylko atomy chloru,
IV
każdy atom w cząsteczce.
Zadnie 4. [2 pkt.]
Podkreśl wzory związków o budowie jonowej:
HBr, Na
2
O, KNO
3
, SO
2
, H
3
PO
4
, CCl
4
, H
2
S, BaBr
2
, HCl, NH
4
Cl

3
Zadanie 5. [4 pkt.]
Oleum jest roztworem SO
3
w bezwodnym kwasie siarkowym (VI). 80 g 20 % oleum
zmieszano ze 120 g wody. Oblicz stężenie procentowe H
2
SO
4
w uzyskanym roztworze oraz
stężenie molowe tego roztworu, jeżeli jego gęstość wynosiła 1,32 g/cm
3
.
Obliczenia:
Odpowiedź: …………………………………………………………………………………
………………………………………………………………………………………………
Informacja do zadań 6. i 7.
Pewien roztwór zawierał jony Fe
2+
, Fe
3+
, Cl
-
i SO
4
2-
. Stężenia jonów chlorkowych
i siarczanowych (VI) oznaczono metodą analizy wagowej strącając z zakwaszonego roztworu
osady odpowiednich soli. Stężenia te wynosiły: [Cl
-
]=0,4 mol/dm
3
, [SO
4
2-
]=0,3 mol/dm
3
.
Jony Fe
3+
zredukowano jonami Sn
2+
do jonów Fe
2+
a następnie oznaczono łączne stężenie
jonów Fe
2+
, które wynosiło 0,35 mol/dm
3
.
Zadanie 6. [3 pkt.]
Zapisz w formie jonowej równania opisanych reakcji.
.......................................................................................................................................................
.......................................................................................................................................................
.......................................................................................................................................................
4
Zadanie 7. [2 pkt.]
Oblicz stężenia molowe jonów Fe
2+
i Fe
3+
w wyjściowym roztworze. (W obliczeniach nie
uwzględniaj stężenia jonów tworzących się w wyniku hydrolizy soli).
Obliczenia:
Odpowiedź: …………………………………………………………………………………
Zadanie 8. [3 pkt.]
Zaplanuj doświadczenie, w którym można wykazać, że jony manganianowe(VII) ulegają
reakcjom, w których powstaną kationy Mn
2+
. Odczynniki do doświadczenia dobierz spośród
następujących substancji: K
2
MnO
4
, KMnO
4
,
H
2
SO
4
, NaOH, KNO
3
, Na
2
SO
3
, K
2
SO
4
.
Opis doświadczenia podaj w tabelce:
Odczynniki (wzory związków):
………………………………………………………………………………………………
Wykonanie doświadczenia
(opis słowny lub rysunek)
Obserwacje

5
Zadanie 9. [3 pkt.]
Do 400 cm
3
roztworu NaOH o pH = 12 dodano 600 cm
3
roztworu mocnego kwasu
HX o pH = 2. Oblicz stężenie molowe jonów H
+
w otrzymanym roztworze.
Obliczenia:
Odpowiedź: …………………………………………………………………………………
Zadanie 10. [4 pkt.]
Napisz jonowe skrócone równania reakcji następujących przemian:
Cr
2
O
3
→
.
1
Cr
2
(SO
4
)
3
→
.
2
Cr(OH)
3
→
.
3
Na
3
[Cr(OH)
6
]
4.
↓
CrCl
3
1. ………………………………………………………………………………………………
2. ………………………………………………………………………………………………
3. ………………………………………………………………………………………………
4. ………………………………………………………………………………………………
6
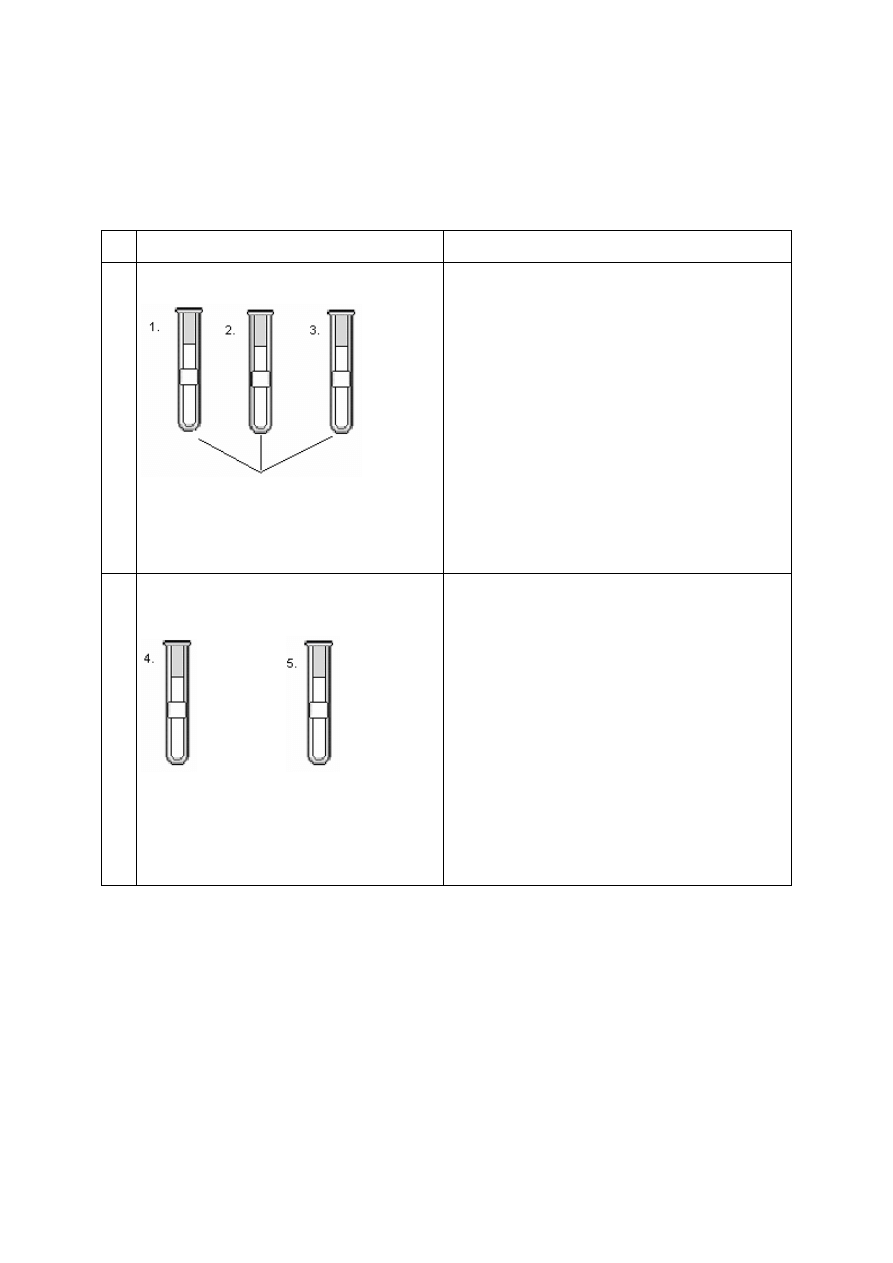
Zadanie 11. [4 pkt.]
Uzupełnij podany poniżej opis doświadczenia, którego celem było porównanie aktywności
miedzi, cynku i srebra. W doświadczeniu użyto: badane metale, roztwór kwasu solnego,
roztwór azotanu(V) srebra i roztwór siarczanu(VI) miedzi(II).
Lp.
Opis czynności
Obserwacje i wniosek
1.
Cu Zn Ag
↓ ↓ ↓
roztwór HCl
Obserwacje: .....................................................
..........................................................................
...........................................................................
………………………………………………..
Wniosek: .........................................................
...........................................................................
..........................................................................
2.
……. …….
↓ ↓
↑
↑
roztwór ……….. roztwór …………
Obserwacje: .....................................................
..........................................................................
..........................................................................
……………………………………………….
Wniosek: .........................................................
...........................................................................
..........................................................................
Napisz równanie (równania) reakcji, które zaszły w drugiej części doświadczenia
…………………………………………………………………………………………………
…………………………………………………………………………………………………

7
Zadanie 12. [5 pkt.]
Mieszanina zawiera łącznie 0,6 mola wapnia, tlenku wapnia i węgliku wapnia zmieszanych
w stosunku molowym n
Ca
: n
CaO
: n
CaC2
= 1 : 2 : 3. Na tę mieszaninę podziałano wodą.
a.
Napisz równania zachodzących reakcji.
…………………………………………………………………………………………………
…………………………………………………………………………………………………
…………………………………………………………………………………………………
b.
Oblicz ile gramów wody przereagowało z tą mieszaniną.
Obliczenia:
Odpowiedź: ………………………………………………………………………………….
Zadanie 13. [2 pkt.]
Komórka bakterii zawiera 3,2 • 10
8
cząsteczek tłuszczu. Oblicz masę molową tego tłuszczu,
wiedząc, że masa komórki wynosi 3,5 • 10
-12
g i zawiera 5% tłuszczu.
Obliczenia:
Odpowiedź: ………………………………………………………………………………….

8
Zadanie 14. [3 pkt.]
W wyniku utlenienia p-nitrotoluenu anionami dichromianowymi (VI) w środowisku kwaśnym
powstaje między innymi kwas p-nitrobenzoesowy. Uzupełnij równanie tej reakcji oraz napisz
bilans elektronowy.
NO
2
CH
3
+ Cr
2
O
7
2-
+ H
+
bilans elektronowy: ………………………………………………………………………….
…………………………………………………………………………
Zadanie 15. [1 pkt.]
Poliakrylany to tworzywa stosowane jako kleje, lakiery, środki impregnujące. Przykładem
takiego tworzywa jest polimer o wzorze:
CH
2
CH
COOCH
3
n
Podaj wzór monomeru
Zadanie 16. [2pkt.]
Wyjaśnij jak zmieni się (wzrośnie czy zmaleje) pH po rozpuszczeniu w wodzie metyloaminy.
Napisz odpowiednie równanie reakcji.
.......................................................................................................................................................
.......................................................................................................................................................
.......................................................................................................................................................

9
Zadanie 17. [3 pkt.]
W reakcji 2- chloropentanu z gorącym, alkoholowym roztworem KOH otrzymano mieszaninę
trzech izomerycznych alkenów. Podaj ich wzory strukturalne i nazwy.
Wzór strukturalny:
Nazwa:……………………………………..
Wzór strukturalny:
Nazwa:……………………………………..
Wzór strukturalny:
Nazwa:……………………………………..
Zadanie 18. [5 pkt.]
Ustal wzór węglowodoru X na podstawie podanych informacji.
Po każdej informacji
zapisz jeden wniosek dotyczący jego składu lub budowy, który z tej
informacji wynika.
I. Po dodaniu do węglowodoru X mieszaniny nitrującej ciecz zabarwia się na żółto.
………………………………………………………………………………………………..
II. Węglowodór X ma masę cząsteczkową 106 u
……………...……………………………………………………….........................................
III. W cząsteczce tego węglowodoru jest jeden pierwszorzędowy atom węgla
………………………………………………………………………………………………..
Zapisz wzór strukturalny węglowodoru i podaj jego nazwę
Wzór strukturalny:
Nazwa:
………………………………………………………………………………………….

10
Zadanie 19. [3 pkt.]
Ester o zapachu ananasów i masie molowej 116 g/mol, przereagował z wodą a jednym
z produktów tej reakcji była substancja o zapachu zjełczałego masła. Na podstawie podanych
informacji wykonaj obliczenia i ustal wzór estru.
Obliczenia:
Odpowiedź: ……………………………………………………………………………………
Zadanie 20. [2 pkt.]
Do wykrywania chloru może posłużyć papierek jodoskrobiowy. Jest to pasek bibuły
nasączony roztworem skrobi i roztworem jodku potasu. Jeżeli na papierek jodoskrobiowy
skierujemy chlor to zabawi się on na kolor granatowy.
Wyjaśnij przyczynę zmiany zabarwienia papierka.
…………………………………………………………………………………………………
…………………………………………………………………………………………………
Napisz równanie reakcji, w której bierze udział chlor
……………………………………………………………………………………………

11
Zadanie 21. [4 pkt.]
W mieszaninie zawierającej alaninę i glicynę zaszły reakcje kondensacji aminokwasów.
Podaj wzory strukturalne 4 różnych dipeptydów, które mogły powstać w tych reakcjach

12
BRUDNOPIS
Wyszukiwarka
Podobne podstrony:
2009 II etap zadania
II etap zadania rozwiazania
2009 zadania II etap
Łamigłówki liczbowe 2009 - 2010 Etap II, ĆWICZENIA OGÓLNOUSPRAWNIAJĄ, Matematyka, Łamigłówki liczbow
Egzamin 2009 11 26 zadania, MEiL, [NW 125] Podstawy konstrukcji maszyn II, Egzaminy
2008 zadania II etap
Łamigłówki liczbowe 2009 - 2010 Etap II Rozwiązania, ĆWICZENIA OGÓLNOUSPRAWNIAJĄ, Matematyka, Łamigł
gim II etap 2009 10
46 Olimpiada chemiczna Etap I Zadania teoretyczne
54 Olimpiada chemiczna Etap I Zadania teoretyczne
windows, 12.PRACA W SZKOLE, ZSG 4 2008-2009 II
Kolokwium fizjologia krążenie 2009, II rok, fizjologia
PODSTAWA PROGRAMOWA PRZEDMIOTU MATEMATYKA II etap?ukacyjny
Rynki finansowe - wykłady (2009) - II wersja, FIR UE Katowice, SEMESTR IV, Rynki finansowe, Rynki fi
więcej podobnych podstron