
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
MINISTERSTWO EDUKACJI
NARODOWEJ
Agnieszka Szota
Zastosowanie technik laboratoryjnych do sporządzania
preparatów chemicznych 311[02].Z1.03
Poradnik dla nauczyciela
Wydawca
Instytut Technologii Eksploatacji – Państwowy Instytut Badawczy
Radom 2007

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
1
Recenzenci:
mgr Barbara Przedlacka
mgr Urszula Cios-Rawluk
Opracowanie redakcyjne:
mgr Jolanta Łagan
Konsultacja:
mgr inż. Gabriela Poloczek
Poradnik stanowi obudowę dydaktyczn
ą
programu jednostki modułowej 311[02].Z1.03,
„Zastosowanie technik laboratoryjnych do sporządzania preparatów chemicznych”, zawartego
w modułowym programie nauczania dla zawodu technik analityk.
Wydawca
Instytut Technologii Eksploatacji – Państwowy Instytut Badawczy, Radom 2007

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
2
SPIS TREŚCI
1.
Wprowadzenie
3
2.
Wymagania wstępne
5
3.
Cele kształcenia
6
4.
Przykładowe scenariusze zajęć
7
5.
Ćwiczenia
11
5.1. Wybrane techniki pracy w laboratorium chemicznym
11
5.1.1. Ćwiczenia
11
5.2. Właściwości związków nieorganicznych i organicznych
15
5.2.1. Ćwiczenia
15
5.3. Preparatyka związków nieorganicznych
19
5.3.1. Ćwiczenia
19
5.4 Preparatyka związków organicznych
22
5.4.1. Ćwiczenia
22
5.5. Przemiany fazowe
25
5.5.1. Ćwiczenia
25
6.
Ewaluacja osiągnięć ucznia
27
7.
Literatura
41

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
3
1. WPROWADZENIE
Przekazujemy Państwu Poradnik dla nauczyciela „Zastosowanie technik laboratoryjnych
do sporządzania preparatów chemicznych”, który będzie pomocny w prowadzeniu zajęć
dydaktycznych w szkole kształcącej w zawodzie technik analityk 311[02].
W poradniku zamieszczono:
−
wymagania wstępne,
−
cele kształcenia, i wykaz umiejętności jakie uczeń ukształtuje podczas pracy
z poradnikiem,
−
przykładowe scenariusze zajęć,
−
przykładowe ćwiczenia, które pomogą uczniowi zweryfikować wiadomości teoretyczne
oraz ukształtować umiejętności praktyczne,
−
ewaluację osiągnięć ucznia z przykładowymi narzędziami pomiaru dydaktycznego,
−
literaturę.
Wskazane jest, aby zajęcia dydaktyczne były prowadzone różnymi metodami ze
szczególnym uwzględnieniem aktywizujących metod nauczania:
−
samokształcenia kierowanego,
−
ć
wiczeń laboratoryjnych,
−
gier dydaktycznych,
−
dyskusji dydaktycznej
Formy organizacyjne pracy uczniów mogą być zróżnicowane, począwszy od
samodzielnej pracy uczniów do pracy w grupie.
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
4
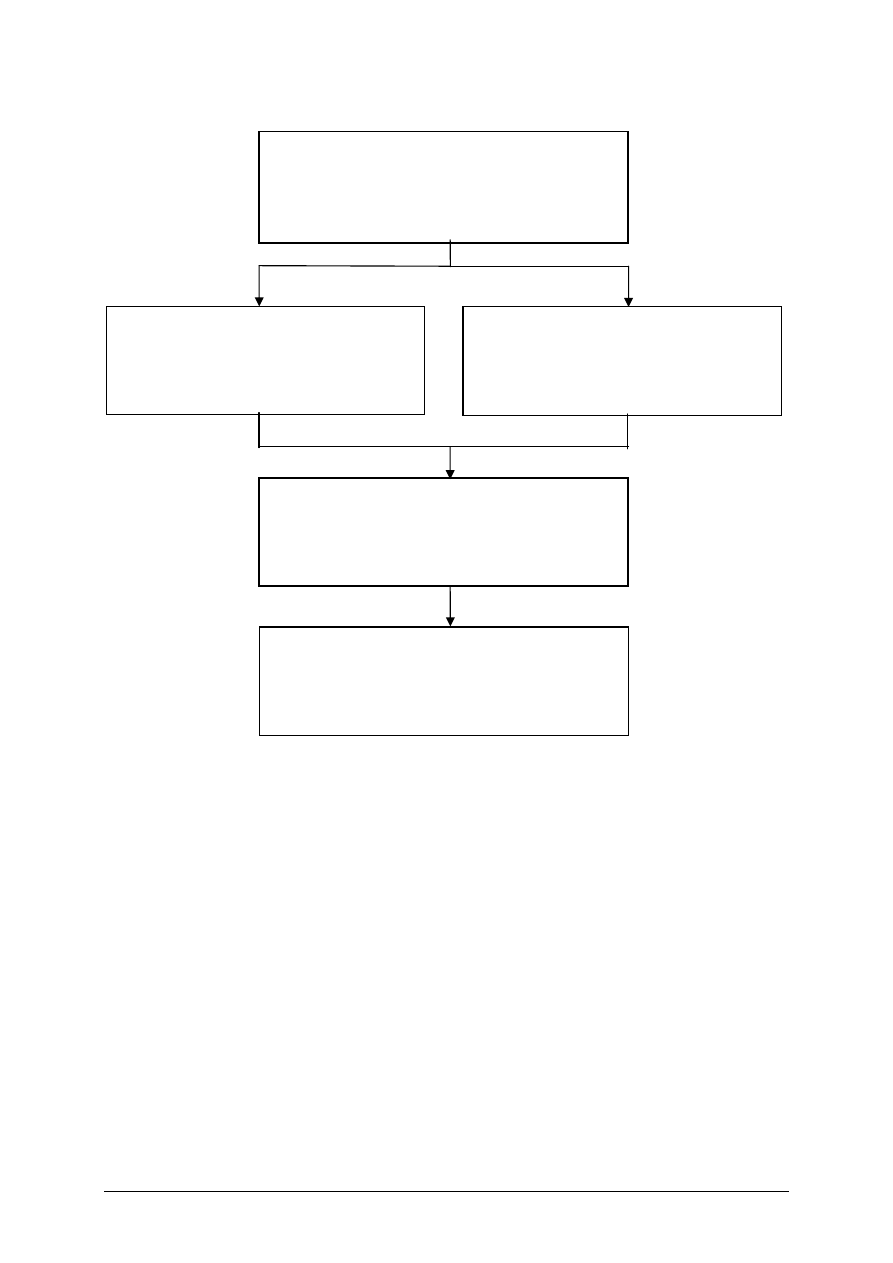
Schemat układu jednostek modułowych
311[02].Z1.01
Stosowanie zasad bezpiecznej pracy
w laboratorium
311[02].Z1
Podstawowe czynności preparatywne
oraz pomiary parametrów procesowych
311[02].Z1.02
Zastosowanie technik komputerowych
do obliczeń chemicznych
311[02].Z1.03
Zastosowanie technik laboratoryjnych do
sporządzania preparatów chemicznych
311[02].Z1.04
Wykonywanie pomiarów parametrów
procesowych

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
5
2. WYMAGANIA WSTĘPNE
Przystępując do realizacji programu jednostki modułowej uczeń powinien umieć:
–
przestrzegać przepisów bezpieczeństwa i higiena pracy, ochrony przeciwpożarowej oraz
ochrony środowiska,
–
przestrzegać zasad dobrej techniki laboratoryjnej,
–
przestrzegać zasad bezpieczeństwa podczas wykonywania ćwiczeń,
–
posługiwać się nomenklaturą związków nieorganicznych i organicznych,
–
klasyfikować związki nieorganiczne i organiczne,
–
określać właściwości fizyko-chemiczne substancji nieorganicznych i organicznych,
–
stosować stechiometrię do obliczeń chemicznych,
–
stosować obowiązujące jednostki układu SI,
–
obliczać stężenie roztworów,
–
sporządzać roztwory o określonym stężeniu,
–
przygotowywać sprzęt laboratoryjny, aparaturę, odczynniki,
–
montować zestawy do prowadzenia reakcji chemicznych,
–
korzystać z norm, przepisów, procedur i dostępnych instrukcji,
–
stosować podstawowe prawa i wzory elektrochemiczne,
–
współpracować w grupie.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
6
3. CELE KSZTAŁCENIA
W wyniku realizacji programu jednostki modułowej uczeń powinien umieć:
–
scharakteryzować typy reakcji chemicznych występujących w preparatyce,
–
określić właściwości oraz scharakteryzować metody otrzymywania grup związków
nieorganicznych i organicznych,
–
obliczyć stężenia substancji biorących udział w procesach równowagowych roztworów
wodnych,
–
scharakteryzować przemiany fazowe substancji czystych w zakresie wykorzystywanym
w praktyce laboratoryjnej,
–
określić efekty energetyczne przemian fazowych, procesów fizycznych i sporządzania
roztworów,
–
zastosować teorie elektrochemiczne do interpretacji procesów,
–
określić właściwości granicy faz, zastosować teorie kinetyki chemicznej do opisu
zachodzących reakcji,
–
określić znaczenie stałej równowagi oraz wpływ czynników zewnętrznych na wydajność
reakcji,
–
wykorzystać racjonalnie odczynniki i czynniki energetyczne,
–
zorganizować stanowisko pracy z uwzględnieniem przepisów bezpieczeństwa i higieny
pracy, ochrony przeciwpożarowej oraz ochrony środowiska,
–
zorganizować i wyposażyć stanowisko pracy w sprzęt laboratoryjny i odczynniki
chemiczne odpowiednio do wykonywanych badań,
–
zmontować zestawy do prowadzenia reakcji,
–
wykonać czynności związane z otrzymywaniem preparatów nieorganicznych
i organicznych,
–
sporządzić dokumentację przebiegu badań laboratoryjnych,
–
sporządzić bilans materiałowy reakcji oraz wykonać obliczenia z wykorzystaniem metod
statystycznych,
–
skorzystać z tekstowych i pozatekstowych źródeł informacji.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
7
4. PRZYKŁADOWE SCENARIUSZE ZAJĘĆ
Scenariusz zajęć 1
Osoba prowadząca:
…………………………………………..
Modułowy program nauczania:
Technik analityk 311[02]
Moduł:
Podstawowe czynności preparatywne oraz pomiary
parametrów procesowych 311[02].Z1
Jednostka modułowa:
Zastosowanie technik laboratoryjnych do sporządzania
preparatów chemicznych 311[02].Z1.03
Temat: Otrzymywanie estru octanu butylu z kwasu octowego i butanolu.
Cel ogólny: Praktyczne poznanie procesu otrzymywania octanu butylu.
Po zakończeniu zajęć edukacyjnych uczeń powinien umieć:
−
przedstawić przebieg reakcji estryfikacji i wyjaśnić jej mechanizm,
−
zapisać równania reakcji estryfikacji na wzorach ogólnych oraz równanie reakcji
otrzymywania octanu butylu,
−
określić własności ogólne preparatu i jego zastosowanie w praktyce,
−
wykonać praktycznie preparat na podstawie podanego opisu wykonania z zachowaniem
zasad bezpiecznej pracy
Metody nauczania–uczenia się:
−
pogadanka,
−
ć
wiczenia laboratoryjne.
Środki dydaktyczne:
Sprzęt:
−
kolba kulista, poj. 250 cm
3
,
−
kolba destylacyjna, poj. 100 cm
3
,
−
chłodnica zwrotna kulkowa,
−
chłodnica Liebiga,
−
rozdzielacz, poj. 250 cm
3
,
−
zlewki poj. 50 cm
3
i 100 cm
3
,
−
stojak do lejków,
−
kolba stożkowa, poj. 50 cm
3
,
−
cylinder miarowy, poj. 100 cm
3
,
−
waga techniczna, odważniki,
−
termometr 200°C,
−
miska,
−
bagietka.
Odczynniki:
−
alkohol butylowy,
−
lodowaty kwas octowy,
−
kwas siarkowy,
−
wodorowęglan sodu – r-r nasycony,
−
bezwodny siarczan (VI) sodu,
−
woda destylowana.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
8
Materiały:
−
instrukcja do ćwiczeń,
−
dziennik pracy laboratoryjnej,
−
kalendarz chemiczny,
−
zeszyt przedmiotowy.
Formy organizacyjne pracy uczniów:
−
praca w zespole,
−
praca indywidualna.
Czas: 225 min dydaktycznych.
Uczestnicy:
−
uczniowie szkoły kształcącej w zawodzie technik analityk.
Przebieg zajęć:
1.
Wprowadzenie.
2.
Nawiązanie do tematu, omówienie celów zajęć.
3.
Plan zajęć:
−
przygotować stanowisko pracy zgodnie z wymaganiami bezpieczeństwa i higieny
pracy,
−
sporządzić potrzebne roztwory do ćwiczeń,
−
zmontować zestaw zgodnie z rysunkiem do ogrzewania z chłodnicą zwrotną
mieszaniny alkoholu butylowego z lodowatym kwasem octowym,
−
sporządzić preparat zgodnie z przepisem laboratoryjnym,
−
zważyć otrzymany preparat i obliczyć jego wydajność,
−
dokonać neutralizacji odczynników i zlikwidować stanowisko pracy,
−
prowadzić dziennik pracy laboratoryjny,
−
sporządzić sprawozdanie.
Zakończenie zajęć:
−
podsumowanie poznanych treści zajęć,
−
ocena pracy uczniów przez nauczyciela.
Praca domowa
Korzystając z różnych źródeł informacje podaj inne metody otrzymywania estrów na
dowolnych przykładach.
Sposób uzyskania informacji zwrotnej od ucznia po zakończonych zajęciach:
−
sporządzone sprawozdanie przez ucznia,
−
karta ewaluacyjna.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
9
Scenariusz zajęć 2
Osoba prowadząca:
……………………………………………….
Modułowy program nauczania:
Technik analityk 311[02]
Moduł:
Podstawowe czynności preparatywne oraz pomiary
parametrów procesowych. 311[02].Z1
Jednostka modułowa:
Zastosowanie technik laboratoryjnych do sporządzania
preparatów chemicznych.311[02].Z1.03
Temat: Reakcje endoenergetyczne i egzoenergetyczne.
Cel ogólny: Zapoznanie uczniów z istotą przebiegu reakcji cieplnych.
Po zakończeniu zajęć edukacyjnych uczeń powinien umieć:
−
zdefiniować podstawowe pojęcia: reakcja egzo- i endoenergetyczna, energia aktywacji,
reakcja rozkładu, wymiany syntezy,
−
podać przykłady reakcji chemicznych z wydzieleniem ciepła do otoczenia i pobraniem
ciepła z układu,
−
udowodnić zależność miedzy rodzajem reakcji, a zasobem energii wewnętrznej
substratów i produktów reakcji,
−
zorganizować stanowisko pracy,
−
udoskonalić umiejętności pracy zespołowej,
−
skonstruować logiczne obserwacje i wnioski,
−
skorzystać z różnych źródeł informacji,
−
dostrzec powiązania chemii z innymi dziedzinami nauk.
Metody nauczania–uczenia się:
−
pokaz,
−
dyskusja dydaktyczna – burza mózgów,
−
ć
wiczenie.
Środki dydaktyczne:
–
podręcznik – Litwin M., Styka–Wlazło S., Szymońska J.: Chemia ogólna i nie
organiczna. Nowa Era, Warszawa 2002,
–
odczynniki:
tlenek miedzi (II), węgiel, woda wapienna, kwas solny, magnez,
–
sprzęt laboratoryjny:
probówki, statyw, palnik, korki, termometry, rurka odprowadzająca.
Formy organizacyjne pracy uczniów:
−
praca zespołowa,
−
praca indywidualna.
Czas: 135 min.
Uczestnicy: uczniowie szkoły kształcącej w zawodzie technik analityk.
Przebieg zajęć:
1.
Faza wprowadzająca:
−
przypomnienie przeprowadzanych reakcji, w których do otoczenia była przekazana
energia na sposób ciepła (reakcje spalania w tlenie),

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
10
−
przypomnienie przeprowadzanych reakcji, którym trzeba dostarczać energię –
otrzymywanie tlenu w wyniku rozkładu manganianu (VII) potasu.
2.
Faza realizacyjna:
−
instruktaż bezpieczeństwa i higieny pracy,
−
podanie tematu zajęć,
−
nauczyciel wykonuje doświadczenia – redukcja tlenku miedzi (II) węglem. Do
probówki z trudno topliwego szkła wsypuje tlenek miedzi (II) zmieszany z węglem
drzewnym. Probówkę zamyka korkiem z rurką odprowadzającą zanurzoną w zlewce
z wodą wapienną. Mieszaninę ogrzewa i uczniowie obserwują przebieg reakcji,
−
zapis spostrzeżeń ucznia: układ się nagrzewa, korek został wyrzucony z probówki,
−
zapis wniosków ucznia: prowadzona reakcja jest egzotermiczna, układ wykonał pracę,
−
uczniowie zapisują równanie reakcji: 2CuO + C → 2Cu + CO2,
−
wyjaśnienie, że reakcja ta zachodzi tylko wtedy, gdy jest jej dostarczana energia
w postaci ciepła – taką nazywamy endoenergetyczną,
−
wykonanie doświadczenia przez uczniów – do probówki wlewają kilka centymetrów
sześciennych kwasu solnego i następnie wsypują wiórki magnezowe i probówkę lekko
zamykają korkiem, po zakończeniu reakcji mierzą temperaturę mieszaniny poreakcyjnej,
−
zapis spostrzeżeń ucznia: układ się nagrzewa, korek został wyrzucony z probówki,
−
zapis wniosków ucznia: reakcja, w czasie której wydziela się energia do otoczenia
w postaci ciepła lub pracy, nazywa się reakcja egzoenergetyczną,
−
burza mózgów – podawanie przykładów reakcji egzo – i endoenergetycznych,
−
uczniowie odpowiadają na pytanie nauczyciela: dlaczego reakcjom chemicznym
towarzyszy wymiana energii z otoczeniem?,
−
uczniowie analizują wykresy zmian energii dla różnych reakcji chemicznych,
−
wprowadzenie pojęcia energia aktywacji,
−
pogadanka na temat reakcji zachodzących w czasie spalania różnych paliw: węgla,
torfu itp.,
−
uczniowie przypominają z lekcji biologii proces oddychania. Wykazują
podobieństwa miedzy oddychaniem a spalaniem. Zapisują równanie reakcji
zachodzącej w czasie oddychania
C
6
H
12
O
6
→ 6CO
2
+ 6H
2
O + energia,
3.
Faza podsumowująca:
−
określenie przez uczniów, co to jest reakcja egzo – i endoenergetyczna,
−
wyjaśnienie zmian energii w czasie przemian chemicznych,
−
wyjaśnienie co to jest energia aktywacji,
−
wyjaśnienie, dlaczego reakcje spalania należą do reakcji egzoenergetycznej a reakcje
rozkładu do endoenergetycznych.
Zakończenie zajęć:
−
ocena pracy uczniów,
−
podsumowanie pracy uczniów,
−
wnioski końcowe.
Praca domowa
Kiedy substraty mają wyższy zasób energii, w reakcji egzo– czy endoenergetycznej?
Odpowiedź uzasadnij.
Sposób uzyskania informacji zwrotnej od ucznia po zakończonych zajęciach:
Nauczyciel prowadzi obserwacje uczniów podczas pracy w grupach oraz w czasie
wykonywania ćwiczeń. Ocenia poprawność wykonywania ćwiczeń i końcowe efekty pracy
poszczególnych grup uczniowskich.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
11
5. ĆWICZENIA
5.1. Wybrane techniki pracy w laboratorium chemicznym
5.1.1. Ćwiczenia
Ćwiczenie 1
Otrzymaj wodorotlenek magnezu z tlenku magnezu.
Wskazówki do realizacji
Przed przystąpieniem do realizacji ćwiczenia nauczyciel powinien omówić zakres
i technikę wykonania ćwiczenia z uwzględnieniem przepisów bezpieczeństwa i higieny pracy.
Ć
wiczenie powinno być wykonane indywidualnie przez każdego ucznia. Nauczyciel
obserwuje i kontroluje pracę uczniów. Przewidywany czas trwania ćwiczenia 135 min.
Sposób wykonania ćwiczenia
Uczeń powinien:
1)
przygotować stanowisko pracy zgodnie z wymaganiami bezpieczeństwa i higieny pracy,
2)
napisać równanie reakcji w wyniku której można otrzymać preparat oraz sporządzić
potrzebne roztwory do ćwiczenia,
3)
umieścić w zlewce 20 g tlenku magnezu dodać wody destylowanej do około 2/3 jej
pojemności,
4)
włożyć do zlewki bagietkę szklaną i często mieszając ogrzewać roztwór do wrzenia przez
½ godziny,
5)
uważać, aby nie doprowadzić do przegrzania cieczy,
6)
ostudzić po zakończeniu ogrzewania zawartość zlewki do temperatury pokojowej,
7)
zdekantować roztwór znad osadu,
8)
przesączyć osad i osuszyć w temperaturze nie wyższej niż 50°C,
9)
zważyć suchy preparat i obliczyć wydajność,
10)
dokonać neutralizacji odczynników zgodnie z instrukcją i uporządkować stanowisko
pracy,
11)
uzupełnić dziennik pracy laboratoryjnej zgodnie z ustaleniami.
Zalecane metody nauczania–uczenia się:
−
pogadanka,
−
ć
wiczenia laboratoryjne.
Ś
rodki dydaktyczne:
–
szkło laboratoryjne: bagietka szklana, probówki, zlewka 600 cm
3
,
–
zestaw do ogrzewania,
–
zestaw do sączenia,
–
czasomierz,
–
instrukcja do ćwiczeń,
–
odczynniki chemiczne: tlenek magnezu, 1 mol/dm
3
roztwór kwasu solnego, 1 mol/dm
3
,
roztwór chlorku amonu,
–
waga analityczna.
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
12
Ćwiczenie 2
Otrzymaj kwas solny z soli kuchennej.
Wskazówki do realizacji
Przed przystąpieniem do realizacji ćwiczenia nauczyciel powinien omówić metody
otrzymywania kwasów i technikę wykonania ćwiczenia z uwzględnieniem przepisów
bezpieczeństwa i higieny pracy. Ćwiczenie powinno być wykonane indywidualnie przez
każdego ucznia. Nauczyciel obserwuje i kontroluje pracę uczniów. Przewidywany czas
trwania ćwiczenia 225 min.
Sposób wykonania ćwiczenia
Uczeń powinien:
1)
przygotować stanowisko pracy zgodnie z wymaganiami bezpieczeństwa i higieny pracy,
2)
napisać równanie reakcji oraz sporządzić potrzebne roztwory do ćwiczeń,
3)
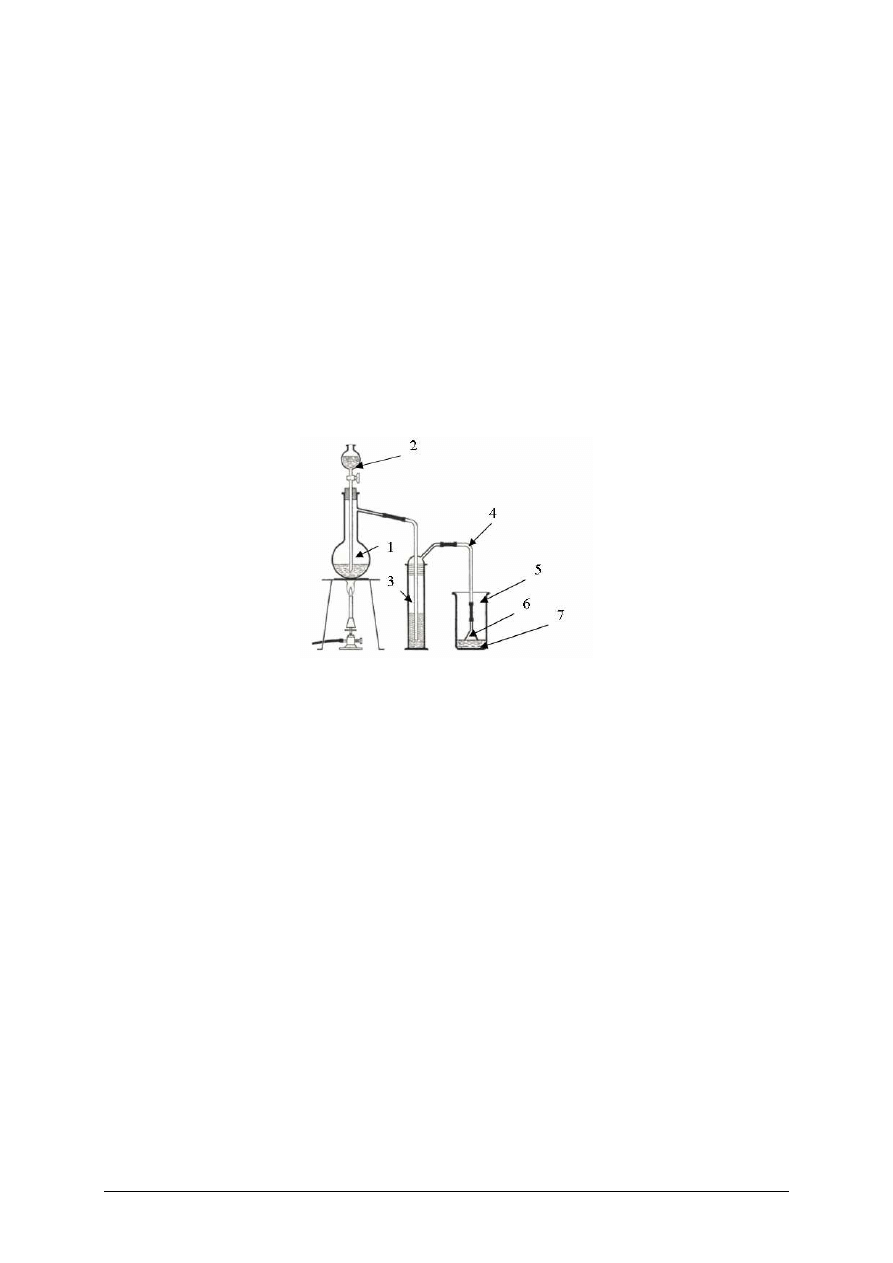
zestawić aparaturę zgodnie z rysunkiem:
Rysunek do ćwiczenia 2. Zestaw do otrzymywania kwasu solnego:
1 – kolba destylacyjna, 2 – wkraplacz, 3 – płuczka z H
2
SO
4
, 4 – rurka szklana,
5 – zlewka z woda, 6 – lejek, 7 – kwas solny [8, s. 99]
4)
wlać do zlewki 5 100 cm
3
wody i całość zważyć na wadze analitycznej,
5)
sprawdzić czy lejek, który będzie doprowadzał chlorowodór do zlewki 5 dotyka
powierzchni wody,
6)
wsypać 58,5 g soli do kolby destylacyjnej 1,
7)
wlać 200 cm
3
2,5 mol/dm
3
roztworu kwasu siarkowego (VI) do wkraplacza,
8)
rozpocząć dodawanie kwasu siarkowego (VI) z wkraplacza po kropli w takim tempie,
aby zawartość kolby 1 nie pieniła się i nie przedostawała się do płuczki,
9)
zamknąć korek wkraplacza po dodaniu całej ilości kwasu siarkowego (VI),
10)
ogrzać kolbę aż do momentu wydzielania się gazowego chlorowodoru, oraz skraplania
się gazu w bocznej rurce kolby destylacyjnej,
11)
przerwać ogrzewanie i do kolby 1 wlać górą destylowaną wodę do około ¾ jej
pojemności,
12)
odłączyć kolbę od płuczki,
13)
zważyć otrzymany roztwór kwasu solnego w zlewce 5 na wadze analitycznej, obliczyć
wydajność oraz stężenie procentowe otrzymanego roztworu,
14)
dokonać neutralizacji odczynników zgodnie z instrukcją i uporządkować stanowisko
pracy,
15)
uzupełnić dziennik pracy laboratoryjnej zgodnie z ustaleniami.
3

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
13
Zalecane metody nauczania–uczenia się:
−
pogadanka,
−
ć
wiczenia laboratoryjne.
Ś
rodki dydaktyczne:
–
szkło laboratoryjne: kolba destylacyjna 500 cm
3
, wkraplacz 200 cm
3
, kolba stożkowa,
zlewka 250 cm
3
,cylinder miarowy 100 cm
3
, probówki,
–
rurka szklana,
–
wąż gumowy,
–
łapy,
–
statywy,
–
zestaw do ogrzewania,
–
instrukcja do ćwiczeń,
–
waga analityczna,
–
odczynniki chemiczne: chlorek sodu, 2,5 mol/dm
3
roztwór kwasu siarkowego (VI).
Ćwiczenie 3
Otrzymaj siarczan (VI) cynku z cynku i kwasu siarkowego (VI) jako przykład reakcji
wymiany.
Wskazówki do realizacji
Przed przystąpieniem do realizacji ćwiczenia nauczyciel powinien omówić zakres
i technikę wykonania ćwiczenia z uwzględnieniem przepisów bezpieczeństwa i higieny pracy.
Ć
wiczenie powinno być wykonane indywidualnie przez każdego ucznia. Nauczyciel
obserwuje i kontroluje pracę uczniów. Przewidywany czas trwania ćwiczenia 255 min.
Sposób wykonania ćwiczenia
Uczeń powinien:
1)
przygotować stanowisko pracy zgodnie z wymaganiami bezpieczeństwa i higieny pracy,
2)
napisać równanie reakcji,
3)
sporządzić potrzebne roztwory do ćwiczenia w cylindrze miarowym,
4)
prowadzić reakcje pod wyciągiem,
5)
wlać 115 g 20% kwasu siarkowego do porcelanowej parownicy,
6)
dodać do parownicy 17 g granulowanego cynku,
7)
ogrzać mieszaninę nad palnikiem gazowym, do momentu ustania burzliwej reakcji,
8)
za pomocą lejka i sączków, przesączyć mieszaninę w celu usunięcia resztek cynku,
9)
odparować przesącz w parownicy na łaźni wodnej do początku krystalizacji,
10)
ochłodzić ciecz z kryształami w celu wydzielenia się jak największej ilości kryształów,
11)
odsączyć wydzielone kryształy siarczanu (VI) cynku,
12)
przemyć otrzymany preparat niewielka ilością zimniej wody,
13)
wysuszyć otrzymany preparat w temperaturze pokojowej,
14)
zważyć na wadze analitycznej suchy preparat i obliczyć wydajność,
15)
dokonać neutralizacji odczynników zgodnie z instrukcją i uporządkować stanowisko
pracy,
16)
uzupełnić dziennik pracy laboratoryjnej zgodnie z ustaleniami.
Zalecane metody nauczania–uczenia się:
−
pogadanka,
−
ć
wiczenia laboratoryjne.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
14
Ś
rodki dydaktyczne:
–
szkło laboratoryjne: zlewka,
–
parownica porcelanowa 200 cm
3
,
–
kolba ssawkowa,
–
papier pergaminowy,
–
łaźnia wodna,
–
instrukcja do ćwiczeń,
–
odczynniki chemiczne: 20% roztwór kwasu siarkowego (VI), cynk,
–
waga analityczna,
–
aerometr,
–
palnik gazowy,
–
lejek i sączki.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
15
5.2. Właściwości związków nieorganicznych i organicznych.
5.2.1. Ćwiczenia
Ćwiczenie 1
Otrzymaj siarczan (VI) amonu żelaza (II) z siarczanu (VI) żelaza (II).
Wskazówki do realizacji
Przed przystąpieniem do realizacji ćwiczenia nauczyciel powinien omówić zakres
i technikę wykonania ćwiczenia czyli zasadę prowadzenia procesu krystalizacji uwzględniając
przepisy bezpieczeństwa i higieny pracy. Ćwiczenie powinno być wykonane indywidualnie
przez każdego ucznia. Nauczyciel obserwuje i kontroluje pracę uczniów. Przewidywany czas
trwania ćwiczenia 225 min.
Sposób wykonania ćwiczenia
Uczeń powinien:
1)
przygotować stanowisko pracy zgodnie z wymaganiami bezpieczeństwa i higieny pracy,
2)
napisać równanie reakcji, sporządzić potrzebne roztwory do ćwiczenia,
3)
rozpuścić 20g FeSO
4
·7H
2
O w 20 cm
3
gorącej wody,
4)
obliczyć stechiometryczną ilość (NH
4
)
2
SO
4
i rozpuścić w 20 cm
3
wody,
5)
przesączyć roztwór,
6)
zmieszać otrzymany roztwór z roztworem FeSO
4
,
7)
zakwasić (używając wkraplacza) roztwór kilkoma kroplami H
2
SO
4
oraz ogrzać roztwór
do wrzenia przy użyciu palnika gazowego,
8)
przesączyć roztwór w celu usunięcia zanieczyszczeń,
9)
pozostawić do krystalizacji,
10)
wysuszyć kryształy na bibule filtracyjnej,
11)
zważyć kryształy na wadze analitycznej i obliczyć wydajność,
12)
dokonać neutralizacji odczynników zgodnie z instrukcją i uprzątnąć stanowisko pracy,
13)
uzupełnić dziennik pracy laboratoryjnej zgodnie z ustaleniami.
Zalecane metody nauczania–uczenia się:
−
pogadanka,
−
ć
wiczenia laboratoryjne.
Ś
rodki dydaktyczne:
−
szkło laboratoryjne: zlewka 600–800 cm
3
, kolba ssawkowa, lejek Buchnera, bagietka
szklana, cylinder miarowy, krystalizator, termometr,
−
lejek,
−
bibuła filtracyjna,
−
sączek karbowany,
−
statyw do sączenia,
−
pompka wodna,
−
instrukcja do ćwiczeń,
−
odczynniki chemiczne: FeSO
4
·7H
2
O
,
(NH
4
)
2
SO
4
, H
2
SO
4
,
−
waga analityczna,
−
palnik gazowy.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
16
Ćwiczenie 2
Otrzymaj hydroksowęglan miedzi (II) z soli miedzi (II).
Wskazówki do realizacji
Przed przystąpieniem do realizacji ćwiczenia nauczyciel powinien omówić metody
otrzymywania hydroksosoli i technikę wykonania ćwiczenia z uwzględnieniem przepisów
bezpieczeństwa i higieny pracy. Ćwiczenie powinno być wykonane indywidualnie przez
każdego ucznia. Nauczyciel obserwuje i kontroluje pracę uczniów. Przewidywany czas
trwania ćwiczenia 225 min.
Sposób wykonania ćwiczenia
Uczeń powinien:
1)
przygotować stanowisko pracy zgodnie z wymaganiami bezpieczeństwa i higieny pracy,
2)
napisać równanie reakcji,
3)
sporządzić potrzebne roztwory do ćwiczenia,
4)
rozpuścić 25 g krystalicznego siarczanu miedziowego CuSO
4
·5H
2
O w 250 cm
3
wody,
5)
ogrzać roztwór do temperatury 60
o
C stale mieszając przy użyciu palnika gazowego,
6)
dodawać do otrzymanego roztworu ogrzany roztwór sporządzony z 28,6 g krystalicznego
węglanu sodowego Na
2
CO
3
·10H
2
O i 250 cm
3
wody,
7)
utrzymać mieszaninę w temperaturze 60
o
C stale mieszając,
8)
odsączyć powstały osad i przemyć wodą w celu usunięcia siarczanu sodowego,
9)
suszyć otrzymany produkt w suszarce w temperaturze 80
o
C,
10)
zważyć i obliczyć wydajność,
11)
dokonać neutralizacji odczynników zgodnie z instrukcją i uprzątnąć stanowisko pracy,
12)
uzupełnić dziennik pracy laboratoryjnej zgodnie z ustaleniami.
Zalecane metody nauczania–uczenia się:
−
pogadanka,
−
ć
wiczenia laboratoryjne.
Ś
rodki dydaktyczne:
−
szkło laboratoryjne: zlewka 600–800 cm
3
, kolba ssawkowa, lejek Buchnera,
−
bagietka szklana ,cylinder miarowy, krystalizator, termometr,
−
suszarka,
−
lejek,
−
bibuła filtracyjna,
−
sączek karbowany,
−
statyw do sączenia,
−
pompka wodna,
−
instrukcja do ćwiczeń,
−
odczynniki chemiczne: CuSO
4
·5H
2
O, Na
2
CO
3
·10H
2
O,
−
waga analityczna,
−
palnik gazowy.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
17
Ćwiczenie 3
Otrzymaj triszczawianochromian (IV) potasu z dichromianu (VI) potasu.
Wskazówki do realizacji
Przed przystąpieniem do realizacji ćwiczenia nauczyciel powinien omówić metody
otrzymywania soli i technikę wykonania ćwiczenia z uwzględnieniem przepisów
bezpieczeństwa i higieny pracy. Ćwiczenie powinno być wykonane indywidualnie przez
każdego ucznia. Nauczyciel obserwuje i kontroluje pracę uczniów. Przewidywany czas
trwania ćwiczenia 225 min.
Sposób wykonania ćwiczenia
Uczeń powinien:
1)
zorganizować stanowisko pracy zgodnie z wymaganiami bezpieczeństwa i higieny pracy,
2)
napisać równanie reakcji,
3)
sporządzić potrzebne roztwory do ćwiczenia,
4)
sproszkować w moździerzu porcelanowym 9,5 g dichromianu (VI) potasu,
5)
rozpuścić w zlewce w 400 cm
3
wody 11,5 g szczawianu potasu, oraz 27,5 g
krystalicznego kwasu szczawiowego,
6)
dodać do otrzymanego roztworu małymi porcjami stale mieszając sproszkowane
dichromian (VI) potasu,
7)
odparować do małej objętości roztwór i pozostawić do krystalizacji,
8)
odsączyć powstały osad i przemyć wodą,
9)
suszyć w temperaturze pokojowej,
10)
zważyć i obliczyć wydajność,
11)
dokonać neutralizacji odczynników zgodnie z instrukcją i uprzątnąć stanowisko pracy,
12)
uzupełnić dziennik pracy laboratoryjnej zgodnie z ustaleniami.
Zalecane metody nauczania–uczenia się:
−
pogadanka,
−
ć
wiczenia laboratoryjne.
Ś
rodki dydaktyczne:
−
szkło laboratoryjne: zlewka 600–800 cm
3
, bagietka szklana, cylinder miarowy,
−
krystalizator, termometr,
−
moździerz porcelanowy,
−
zestaw do sączenia pod zmniejszonym ciśnieniem,
−
zestaw do ogrzewania,
−
instrukcja do ćwiczeń,
−
odczynniki chemiczne: dichromian (VI) potasu, szczawian potasu, kwas szczawiowy
krystaliczny,
−
waga analityczna.
Ćwiczenie 4
Otrzymaj srebro z odpadów laboratoryjnych.
Wskazówki do realizacji
Przed przystąpieniem do realizacji ćwiczenia nauczyciel powinien omówić możliwości
wykorzystania
odpadów
laboratoryjnych
i
technikę
wykonywania
ć
wiczenia
z uwzględnieniem przepisów bezpieczeństwa i higieny pracy. Ćwiczenie powinno być

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
18
wykonane indywidualnie przez każdego ucznia. Nauczyciel obserwuje i kontroluje pracę
uczniów. Przewidywany czas trwania ćwiczenia 225 min.
Sposób wykonania ćwiczenia
Uczeń powinien:
1)
strącić chlorek srebra (etap 1):
−
do 100g odpadów laboratoryjnych zawierających sole srebra dodać 100 cm
3
6 mol/dm
3
roztworu kwasu solnego i pozostawić na okres pół godziny,
−
przemyć odsad przez dekantację najpierw kwasem solnym, a potem wodą, cały czas
obserwując przebieg ćwiczenia,
−
napisać równanie reakcji,
−
zapisać dziennik laboratoryjny zgodnie z ustaleniami.
2)
zredukować chlorek srebra do metalicznego srebra przy użyciu cynku (etap 2):
−
zmieszać chlorek srebra z 2 mol/dm
3
kwasem solnym na gęstą papkę,
−
włożyć blachę cynkową do przygotowanej mieszaniny i pozostawić na kilka godzin
aż przestanie wytrącać się ciemny osad metalicznego srebra,
−
usunąć blachę, osad starannie wymyć woda i wygotować w rozcieńczonym
1 mol/dm
3
kwasie siarkowym (VI),
−
odsączyć osad i wysuszyć w temperaturze 100
o
C, cały czas obserwując przebieg
ć
wiczenia,
−
przeprowadzić obserwację,
−
zapisać dziennik laboratoryjny zgodnie z ustaleniami.
3)
zredukować chlorek srebra do srebra metalicznego formaliną (etap 3):
−
zalać chlorek srebra nadmiarem 10% wodorotlenku sodu,
−
ogrzać roztwór do 60–80
o
C i mieszając dodawać roztworu formaliny (40% wodny
roztwór aldehydu mrówkowego) aż srebro ulegnie całkowicie redukcji, tj. poddaniu
kolejnej porcji formaliny nie strąci się osad srebra,
−
wymyć otrzymany osad srebra wymyć dokładnie wodą przez dekantacje,
−
przesączyć osad, przepłukać wodą i wysuszyć w temperaturze 100
o
C, cały czas
obserwując przebieg ćwiczenia,
−
zapisać dziennik laboratoryjny zgodnie z ustaleniami.
Zalecane metody nauczania–uczenia się:
−
pogadanka,
−
ć
wiczenia laboratoryjne.
Ś
rodki dydaktyczne:
−
szkło laboratoryjne: zlewka – 2 szt. – 400 cm
3
, bagietka, termometr,
−
palnik,
−
zestaw do sączenia,
−
instrukcja do ćwiczeń,
−
układ okresowy pierwiastków,
−
kalendarz chemiczny,
−
odczynniki chemiczne: 6 mol/dm
3
roztwór kwasu solnego, 1 mol/ldm
3
roztwór kwasu
siarkowego (VI), chlorek srebra surowy (z odpadów), blacha cynkowa, formalina.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
19
5.3
. Preparatyka związków nieorganicznych
5.3.1.
Ćwiczenia
Ćwiczenie 1
Otrzymaj siarczan (VI) żelaza (II) z żelaza metalicznego.
Wskazówki do realizacji
Przed przystąpieniem do realizacji ćwiczenia nauczyciel powinien omówić zakres
i technikę wykonania ćwiczenia czyli zasadę prowadzenia procesu krystalizacji uwzględniając
przepisy bezpieczeństwa i higieny pracy. Ćwiczenie powinno być wykonane indywidualnie
przez każdego ucznia. Nauczyciel obserwuje i kontroluje pracę uczniów. Przewidywany czas
trwania ćwiczenia 225 min.
Sposób wykonania ćwiczenia
Uczeń powinien:
1)
przygotować stanowisko pracy zgodnie z wymaganiami bezpieczeństwa i higieny pracy,
2)
napisać równanie reakcji oraz sporządzić potrzebne roztwory do ćwiczenia,
3)
odtłuścić 10 g żelaza pod wyciągiem płucząc go kilka razy małymi porcjami benzyny
ekstrakcyjnej,
4)
rozłożyć żelazo na bibule i bardzo dokładnie wysuszyć, poczekać, aż rozpuszczalnik
odparuje,
5)
wsypać żelazo do zlewki, zalać 90 cm
3
2 mol/dm
3
roztworu kwasu siarkowego (VI),
6)
ogrzać na łaźni wodnej, do całkowitego roztworzenia żelaza,
7)
przesączyć gorący roztwór pod próżnią i odstawić do krystalizacji,
8)
odsączyć wydzielone kryształy od roztworu i przemyć kilkoma cm
3
zimnej wody,
9)
wysuszyć osad w temperaturze 30
o
C w eksykatorze,
10)
zważyć suchy preparat i obliczyć wydajność,
11)
dokonać neutralizacji odczynników zgodnie z instrukcją i uprzątnąć stanowisko pracy,
12)
uzupełniać dziennik pracy laboratoryjnej zgodnie z ustaleniami.
Zalecane metody nauczania–uczenia się:
−
pogadanka,
−
ć
wiczenia laboratoryjne.
Ś
rodki dydaktyczne:
−
szkło laboratoryjne: 3 zlewki 100–150 cm
3
, krystalizator, bagietka, cylinder 50 cm
3
,
−
łaźnia wodna,
−
zestaw do sączenia pod próżnią,
−
tryskawka,
−
eksykator,
−
instrukcja do ćwiczenia,
−
odczynniki chemiczne: żelazo (cienki drut, małe gwoździe lub opiłki), 2 mol/dm
3
roztwór
kwasu siarkowego (VI), benzyna ekstrakcyjna,
−
waga analityczna.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
20
Ćwiczenie 2
Otrzymaj siarczan (VI) chromu potasu z dichromianu (VI) potasu.
Wskazówki do realizacji
Przed przystąpieniem do realizacji ćwiczenia nauczyciel powinien omówić metody
otrzymywania soli i technikę wykonania ćwiczenia z uwzględnieniem przepisów
bezpieczeństwa i higieny pracy. Ćwiczenie powinno być wykonane indywidualnie przez
każdego ucznia. Nauczyciel obserwuje i kontroluje pracę uczniów. Przewidywany czas
trwania ćwiczenia 225 min.
Sposób wykonania ćwiczenia
Uczeń powinien:
1)
przygotować stanowisko pracy zgodne z wymaganiami bezpieczeństwa i higieny pracy,
2)
napisać równanie reakcji oraz sporządzić potrzebne roztwory do ćwiczenia,
3)
odważyć na wadze analitycznej a następnie dodać 20 g dwuchromianu potasowego do
zlewki zawierającej 150 cm
3
3 mol/dm
3
roztwór kwasu siarkowego (VI),
4)
podgrzać zlewkę z zawartością na siatce azbestowej aż do całkowitego rozpuszczenia
dichromianu (VI) potasu,
5)
ochłodzić otrzymany roztwór w łaźni wypełnionej wodą z lodem do temperatury około
10
o
C,
6)
mieszać powoli roztwór bagietką i jednocześnie wkraplać z wkraplacza 15 cm
3
alkoholu
etylowego,
7)
pozostawić do krystalizacji w niskiej temperaturze intensywnie zielony roztwór po
zakończonej reakcji,
8)
odsączyć pod zmniejszonym ciśnieniem wydzielone kryształy na sączku w lejku sitowym
a następnie przepłukać 3–5 cm
3
zimnej wody destylowanej,
9)
przelać przesącz do zlewki i zagęścić do 0,5 objętości ogrzewając na siatce azbestowej
pod wyciągiem, gdyż wraz z wodą odparuje z roztworu trujący aldehyd octowy,
10)
pozostawić zagęszczony roztwór do wykrystalizowania drugiej frakcji,
11)
połączyć kryształy obydwu frakcji, przemyć alkoholem etylowym,
12)
wysuszyć otrzymany preparat w temperaturze pokojowej,
13)
zważyć na wadze analitycznej suchy produkt i obliczyć wydajność,
14)
dokonać neutralizacji odczynników zgodnie z instrukcją i uprzątnąć stanowisko pracy,
15)
uzupełnić dziennik pracy laboratoryjnej zgodnie z ustaleniami.
Zalecane metody nauczania–uczenia się:
−
pogadanka,
−
ć
wiczenia laboratoryjne.
Ś
rodki dydaktyczne:
−
szkło laboratoryjne: zlewka – 250 cm
3
,cylinder miarowy – 25 cm
3
, wkraplacz – 100 cm
3
,
bagietka szklana,
−
łaźnia wodna,
−
zestaw do sączenia pod zmniejszonym ciśnieniem,
−
tryskawka,
−
statyw z łapą,
−
palnik,
−
instrukcja do ćwiczenia,

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
21
−
odczynniki chemiczne: dichromian (VI) potasu, 3 mol/dm
3
roztwór kwasu siarkowego
(VI), alkohol etylowy,
−
woda destylowana,
−
waga analityczna.
Ćwiczenie 3
Otrzymaj wodorowęglan sodu z wodorotlenku sodu.
Wskazówki do realizacji
Przed przystąpieniem do realizacji ćwiczenia nauczyciel powinien omówić metody
otrzymywania soli i technikę wykonania ćwiczenia z uwzględnieniem przepisów
bezpieczeństwa i higieny pracy. Ćwiczenie powinno być wykonane indywidualnie przez
każdego ucznia. Nauczyciel obserwuje i kontroluje pracę uczniów. Przewidywany czas
trwania ćwiczenia 225 min.
Sposób wykonania ćwiczenia
Uczeń powinien:
1)
przygotować stanowisko pracy zgodne z wymaganiami bezpieczeństwa i higieny pracy,
2)
napisać równanie reakcji oraz sporządzić potrzebne roztwory do ćwiczenia,
3)
rozpuścić 20 g wodorotlenku sodu (zważonego wcześniej na wadze analitycznej)
w kolbie stożkowej w 60 cm
3
wody,
4)
zamknąć kolbę korkiem z rurką odprowadzającą i połączyć z butlą dwutlenku węgla,
5)
otworzyć dopływ gazu i uchylić lekko korek,
6)
zamknąć szczelnie korek i nie odłączając od źródła gazu mieszając nasycać roztwór
dwutlenkiem węgla,
7)
odsączyć wytrącony osad na lejku sitowym,
8)
suszyć osad w temperaturze pokojowej,
9)
zważyć osad na wadze analitycznej i obliczyć wydajność preparatu,
10)
dokonać neutralizacji odczynników i zlikwidować stanowisko pracy,
11)
prowadzić dziennik pracy laboratoryjnej zgodnie z ustaleniami.
Zalecane metody nauczania–uczenia się:
−
pogadanka,
−
ć
wiczenia laboratoryjne.
Ś
rodki dydaktyczne:
−
szkło laboratoryjne: kolba stożkowa 250 cm
3
, cylinder miarowy 100 cm
3
, biureta 50 cm
3
,
−
eksykator,
−
zestaw do sączenia pod zmniejszonym ciśnieniem,
−
lejek sitowy,
−
korek gumowy,
−
rurka,
−
statyw z łapą,
−
wąż gumowy,
−
instrukcja do ćwiczenia,
−
odczynniki chemiczne: stały wodorotlenek sodu, dwutlenek węgla, 96% alkohol etylowy,
kwas solny,
−
waga analityczna.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
22
5.4. Preparatyka związków organicznych
5.4.1. Ćwiczenia
Ćwiczenie 1
Otrzymaj kwas sulfanilowy z aniliny.
Wskazówki do realizacji
Przed przystąpieniem do realizacji ćwiczenia nauczyciel powinien omówić zakres
i technikę wykonania ćwiczenia oraz zasadę prowadzenia procesu sulfonowania
z uwzględnieniem przepisów bezpieczeństwa i higieny pracy. Ćwiczenie powinno być
wykonane indywidualnie przez każdego ucznia. Nauczyciel obserwuje i kontroluje pracę
uczniów. Przewidywany czas trwania ćwiczenia 225 min.
Sposób wykonania ćwiczenia
Uczeń powinien:
1)
przygotować stanowisko pracy zgodnie z wymaganiami bezpieczeństwa i higieny pracy,
2)
napisać równanie reakcji oraz sporządzić potrzebne roztwory do ćwiczenia,
3)
wlać 4 cm
3
stęż. H
2
SO
4
do suchej okrągłodennej kolbki dwuszyjnej zaopatrzonej,
w termometr i chłodnicę zwrotną powietrzną,
4)
dodać 7 cm
3
aniliny,
5)
ogrzać mieszaninę w elektrycznym płaszczu grzejnym do temperatury 170–180°C,
6)
oziębić mieszaninę i wlać ją stale mieszając do zimnej wody, a wtedy kwas sulfanilowy
wydziela się w postaci kryształów,
7)
odsączyć kryształy i przemyć wodą,
8)
dokonać neutralizacji odczynników zgodnie z instrukcją i uporządkować stanowisko
pracy,
9)
uzupełnić dziennik pracy laboratoryjnej zgodnie z ustaleniami.
Zalecane metody nauczania–uczenia się:
−
pogadanka,
−
ć
wiczenia laboratoryjne.
Ś
rodki dydaktyczne:
–
szkło laboratoryjne: okrągłodenna kolba dwuszyjna ze szlifem, termometr, chłodnica
zwrotna, dwie zlewki, krystalizator,
–
statyw żelazny z łapą,
–
elektryczny płaszcz grzejny, instrukcja do ćwiczenia,
–
odczynniki chemiczne: stęż. kwas siarkowy (VI), anilina.
Ćwiczenie 2
Otrzymaj octan etylu z kwasu octowego i etanolu.
Wskazówki do realizacji
Przed przystąpieniem do realizacji ćwiczenia nauczyciel powinien omówić zakres
i technikę
wykonania
ć
wiczenia
oraz
zasadę
prowadzenia
procesu
estryfikacji
z uwzględnieniem przepisów bezpieczeństwa i higieny pracy. Ćwiczenie powinno być
wykonane indywidualnie przez każdego ucznia. Nauczyciel obserwuje i kontroluje pracę
uczniów. Przewidywany czas trwania ćwiczenia 225 min.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
23
Sposób wykonania ćwiczenia
Uczeń powinien:
1)
wlać do kolby destylacyjnej 7,5 cm
3
etanolu i 7,5 cm
3
stężonego H
2
SO
4
,
2)
dodać kamyczki wrzenne i zamknąć kolbę wkraplaczem,
3)
wlać do wkraplacza 20 cm
3
lodowatego kwasu octowego o gęstości d= 1,371 g/cm
3
i 20 cm
3
etanolu,
4)
wymieszać dokładnie zawartość wkraplacza wraz z kolbą,
5)
zmontować zestaw do destylacji zgodnie z instrukcją stanowiskową na łaźni wodnej
i rozpocząć powolne ogrzewanie,
6)
dodać mieszaninę z wkraplacza wtedy gdy ciecz w kolbce zacznie wrzeć, (szybkość
dodawania musi być równa szybkości oddestylowania estru),
7)
przerwać ogrzewanie po dodaniu całej zawartości wkraplacza,
8)
zebrać destylowany ester w uprzednio zważonej kolbce stożkowej,
9)
zważyć preparat na wadze analitycznej i obliczyć wydajność.
Zalecane metody nauczania–uczenia się:
−
pogadanka,
−
ć
wiczenia laboratoryjne.
Ś
rodki dydaktyczne:
–
rozdzielacz o poj. 500 cm
3
,
–
kolba destylacyjna,
–
chłodnica Liebiga,
–
przedłużacz,
–
odbieralnik,
–
łaźnia wodna,
–
węże gumowe do chłodnicy,
–
cylinder miarowy o poj. 400 cm
3
, 200 cm
3
i 10 cm
3
,
–
dwie zlewki o poj. 400 cm
3
i 200 cm
3
,
–
statyw,
–
dwie łapy metalowe,
–
odczynniki chemiczne: alkohol etylowy, kwas siarkowy (VI) stężony, lodowaty kwas
octowy,
–
waga analityczna,
–
instrukcja stanowiskowa.
Ćwiczenie 3
Otrzymaj nitrobenzen z benzenu i kwasu azotowego (V).
Wskazówki do realizacji
Przed przystąpieniem do realizacji ćwiczenia nauczyciel powinien omówić zakres
i technikę
wykonania
ć
wiczenia
oraz
zasadę
prowadzenia
procesu
nitrowania
z uwzględnieniem przepisów bezpieczeństwa i higieny pracy. Ćwiczenie powinno być
wykonane indywidualnie przez każdego ucznia. Nauczyciel obserwuje i kontroluje pracę
uczniów. Przewidywany czas trwania ćwiczenia 225 min.
Sposób wykonania ćwiczenia
Uczeń powinien:
1)
przygotować stanowisko pracy zgodnie z wymaganiami bezpieczeństwa i higieny pracy,

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
24
2)
napisać równanie reakcji oraz sporządzić potrzebne roztwory do ćwiczenia,
3)
wlać do kolby okrągłodennej trójszyjnej o poj. 250 cm
3
zaopatrzonej w chłodnicę
powietrzną, wkraplacz i termometr 20 cm
3
stęż. HNO
3
,
4)
dodać bardzo powoli delikatnie mieszając 20 cm
3
stęż. H
2
SO
4
,
5)
wkroplić do mieszaniny nitrującej 18 cm
3
benzenu, co spowoduje wytworzenie się na
powierzchni cieczy oleistej warstwy koloru słomkowo żółtego,
6)
ogrzać mieszaninę przez pół godziny utrzymując temperaturę 60°C,
7)
przelać zawartość kolby do rozdzielacza i oddzielić warstwę dolną składającą się
z mieszaniny HNO
3
i H
2
SO
4
od warstwy górnej, która zawiera nitrobenzen,
8)
wytrząsnąć oddzieloną organiczną warstwę nitrobenzenu z 1 mol/dm
3
Na
2
CO
3
(aż do
chwili gdy przestaną się wydzielać banieczki CO
2
), a następnie z 20 cm
3
wody,
9)
oddzielić warstwę nitrobenzenu do suchej kolbki,
10)
dodać 1 g bezwodnego CaCl
2
i pozostawić dotąd, aż ciecz początkowo mleczna stanie się
zupełnie przeźroczysta,
11)
sączyć otrzymany produkt przez mały lejek zapatrzony w bibułę,
12)
zważyć preparat na wadze analitycznej i obliczyć wydajność,
13)
dokonać neutralizacji odczynników zgodnie z instrukcją i uporządkować stanowisko
pracy,
14)
prowadzić dziennik pracy laboratoryjnej zgodnie z ustaleniami.
Zalecane metody nauczania–uczenia się:
−
pogadanka,
−
ć
wiczenia laboratoryjne.
Ś
rodki dydaktyczne:
–
szkło laboratoryjne: kolba okrągłodenna trójszyjna 250 cm
3
ze szlifem, chłodnica
powietrzna, wkraplacz, termometr, rozdzielacz, dwie zlewki, lejek,
–
palnik,
–
mieszadło mechaniczne,
–
zestaw do sączenia,
–
instrukcja do ćwiczenia,
–
odczynniki chemiczne: benzen, stęż. kwas azotowy (V), stęż. kwas siarkowy (VI),
bezwodny chlorek wapnia, 1 mol/dm
3
roztwór węglanu sodu,
–
waga analityczna.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
25
5.5. Przemiany fazowe
5.5.1. Ćwiczenia
Ćwiczenie 1
Zbadaj wpływ zmiany stężeń regentów na kierunek przebiegu reakcji chemicznych.
Wskazówki do realizacji
Przed przystąpieniem do realizacji ćwiczenia nauczyciel powinien omówić pojęcie stanu
równowagi odwracalnej reakcji chemicznej oraz technikę wykonywania ćwiczenia
z uwzględnieniem przepisów bezpieczeństwa i higieny pracy. Ćwiczenie powinno być
wykonane indywidualnie przez każdego ucznia. Nauczyciel obserwuje i kontroluje pracę
uczniów. Przewidywany czas trwania ćwiczenia 225 min.
Sposób wykonania ćwiczenia
Uczeń powinien:
1)
przygotować stanowisko pracy zgodnie z wymaganiami bezpieczeństwa i higieny pracy,
2)
napisać równanie reakcji oraz sporządzić potrzebne roztwory do ćwiczenia,
3)
wykonać kolejno doświadczenia w 4 probówkach,
–
wlać do 4 probówek po 1 cm
3
0,002 mol/dm
3
roztworu chlorku żelaza (III), dodać po
1 cm
3
0,006 mol/dm
3
roztworu tiocyjanianu potasu,
–
dodać do pierwszej probówki kilka kropel 0,2 mol/dm
3
roztworu chlorku żelaza (III),
–
dodać do drugiej probówki kilka kropel 0,6 mol/dm
3
roztworu tiocyjanianu potasu,
–
dodać do trzeciej probówki kilka kropel 4 mol/dm
3
roztworu chlorku potasu
(zawartość czwartej probówki służy jak roztwór porównawczy),
4)
dokonać obserwacji reakcji zachodzących we wszystkich probówkach,
5)
napisać równanie zachodzącej reakcji chemicznej,
6)
uzupełnić tabelę,
7)
sformułować wniosek,
8)
dokonać neutralizacji odczynników zgodnie z instrukcją i uporządkować stanowisko
pracy,
9)
prowadzić dziennik pracy laboratoryjnej zgodnie z ustaleniami.
Lp.
Rodzaje działań
Kierunek przesunięcia
równowagi reakcji
Skutek zmian
1
2
3
4
Zalecane metody nauczania–uczenia się:
−
pogadanka,
−
ć
wiczenia laboratoryjne.
Ś
rodki dydaktyczne:
−
odczynniki chemiczne: 0,002 mol/dm
3
roztwór chlorku żelaza (III), 0,006 mol/dm
3
roztwór tiocyjanianu potasu, 0,2 mol/dm
3
roztwór chlorku żelaza (III), 0,6 mol/dm
3
roztwór tiocyjanianu potasu, 4 mol/dm
3
roztwór chlorek potasu,

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
26
−
probówki,
−
5 pipet,
−
kalendarz chemiczny,
−
układ okresowy pierwiastków,
−
tabela do uzupełnienia.
Ćwiczenie 2
Otrzymaj tlenek magnezu przez prażenie MgCO
3
.
Wskazówki do realizacji
Przed przystąpieniem do realizacji ćwiczenia nauczyciel powinien omówić pojęcie
zjawiska endo- i egzoenergetyczne zachodzące w przyrodzie oraz technikę wykonywania
ć
wiczenia uwzględniając przepisy bezpieczeństwa i higieny pracy. Ćwiczenie powinno być
wykonane indywidualnie przez każdego ucznia. Nauczyciel obserwuje i kontroluje pracę
uczniów. Przewidywany czas trwania ćwiczenia 225 min.
Sposób wykonania ćwiczenia
Uczeń powinien:
1)
przygotować stanowisko pracy zgodnie z wymaganiami bezpieczeństwa i higieny pracy,
2)
wyprażyć w tyglu w temperaturze 110
o
C ok. 10 g węglanu magnezu ,
3)
ubić 7 g wyprażonego węglanu magnezu dokładnie w tyglu i przykryć pokrywką,
4)
ogrzać niewielkim płomieniem, a później ogrzewać tygiel w wyższej temperaturze,
5)
dodać 18 cm
3
do wnętrza tygla 10 mol/dm
3
roztwór kwasu solnego,
6)
ogrzać tygiel do momentu aż przestana się wydzielać pęcherzyki CO
2,
7)
wyjąć po zakończeniu prażenia otrzymany tlenek magnezu z tygla,
8)
sproszkować produkt w moździerzu,
9)
zważyć i obliczyć wydajność otrzymanej substancji w stosunku do użytego MgCO
3,
10)
prowadzić dziennik pracy laboratoryjnej zgodnie z ustaleniami.
Zalecane metody nauczania–uczenia się:
−
pogadanka,
−
ć
wiczenia laboratoryjne.
Ś
rodki dydaktyczne:
–
węglan magnezu ok. 10 g,
–
1mol/dm
3
roztwór kwasu solnego,
–
tygiel porcelanowy z pokrywką,
–
moździerz porcelanowy,
–
bagietka,
–
zestaw do ogrzewania,
–
układ okresowy pierwiastków,
–
kalendarz chemiczny,
–
dziennik pracy laboratoryjnej,
–
waga analityczna.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
27
6. EWALUACJA OSIĄGNIĘĆ UCZNIA
Przykłady narzędzi pomiaru dydaktycznego
Test 1
Test dwustopniowy do jednostki modułowej
„Zastosowanie technik
laboratoryjnych do sporządzania preparatów chemicznych”
Test składa się z 20 zadań wielokrotnego wyboru, z których:
−
zadania 1, 2, 3, 4, 5, 6, 7, 9, 12, 13, 15, 16, 17, 18, 19 są z poziomu podstawowego,
−
zadania 8, 10, 11, 14, 20 są z poziomu ponadpodstawowego.
Punktacja zadań: 0 lub 1 punkt
Za każdą prawidłową odpowiedź uczeń otrzymuje 1 punkt. Za złą odpowiedź lub jej brak
uczeń otrzymuje 0 punktów.
Proponuje się następujące normy wymagań – uczeń otrzyma następujące
oceny szkolne:
−
dopuszczający – za rozwiązanie co najmniej 8 zadań z poziomu podstawowego,
−
dostateczny – za rozwiązanie co najmniej 10 zadań z poziomu podstawowego,
−
dobry – za rozwiązanie 14 zadań, w tym co najmniej 3 z poziomu ponadpodstawowego,
−
bardzo dobry – za rozwiązanie 18 zadań, w tym 5 z poziomu ponadpodstawowego.
Klucz odpowiedzi: 1. b, 2. d, 3. b, 4. a, 5. d, 6. c, 7. b, 8. a, 9. b, 10. d, 11. b,
12. c, 13. b, 14. c, 15. d, 16. c, 17. c, 18. d, 19. d, 20. d
Plan testu
Nr
zad.
Cel operacyjny
(mierzone osiągnięcia ucznia)
Kategoria
celu
Poziom
wymagań
Poprawna
odpowiedź
1
Rozróżnić charakter chemiczny
tlenków
B
P
b
2
Wybrać właściwą reakcję otrzymania
soli
C
P
d
3
Wybrać poprawne sformułowanie
C
P
b
4
Wybrać właściwą reakcję rozkładu
C
P
a
5
Określić rodzaj reakcji
C
P
d
6
Wybrać związki utleniające
C
P
c
7
Rozróżnić rodzaj układu
wieloskładnikowego
B
P
b

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
28
8
Przewidzieć rodzaj wymiany ciepła
D
PP
a
9
Podać definicję energii wewnętrznej
A
P
b
10
Podać wzór opisujący I zasadę
termodynamiki
A
P
d
11
Sklasyfikować przemiany do
odpowiedniego typu reakcji.
C
PP
b
12 Wybrać właściwy substrat
C
P
c
13 Wybrać właściwy reagent
C
P
b
14
Ocenić możliwości przeprowadzenia
reakcji estryfikacji
D
PP
c
15 Podać nazwę substancji
B
P
d
16 Wybrać definicję błędną
C
P
c
17 Wybrać właściwy produkt
C
P
c
18 Podać rodzaj procesu
B
P
d
19 Określić właściwy mechanizm
C
PP
d
20 Wybrać prawidłowy rodzaj reakcji
C
PP
d

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
29
Przebieg testowania
Instrukcja dla nauczyciela
1.
Ustal z uczniami termin przeprowadzenia sprawdzianu z wyprzedzeniem co najmniej
jednotygodniowym.
2.
Przygotuj odpowiednią liczbę testów.
3.
Zapewnij samodzielność podczas rozwiązywania zadań.
4.
Przed rozpoczęciem testu przeczytaj instrukcję dla ucznia.
5.
Zapytaj czy uczniowie wszystko zrozumieli.
6.
Nie przekraczaj przeznaczonego czasu na test.
Instrukcja dla ucznia
1.
Przeczytaj uważnie instrukcję.
2.
Podpisz imieniem i nazwiskiem kartę odpowiedzi.
3.
Zapoznaj się z zestawem zadań testowych.
4.
Udzielaj odpowiedzi na załączonej karcie odpowiedzi, wstawiając w odpowiedniej
rubryce znak X. W przypadku pomyłki należy błędną odpowiedź zaznaczyć kółkiem,
a następnie ponownie zaznaczyć odpowiedź prawidłową.
5.
Test zawiera 20 zadań, w tym: 15 z poziomu podstawowego, 5 z poziomu
ponadpodstawowego.
6.
Do każdego zadania dołączone są 4 możliwe odpowiedzi. Tylko jedna jest prawdziwa.
7.
Pracuj samodzielnie, bo tylko wtedy będziesz miał satysfakcję z wykonanego zadania.
8.
Kiedy udzielanie odpowiedzi będzie Ci sprawiało trudność, wtedy odłóż jego
rozwiązanie na później i wróć do niego, gdy zostanie Ci wolny czas.
9.
Na rozwiązanie testu masz 40 min.
Powodzenia
Materiały dla ucznia:
–
instrukcja,
–
zestaw zadań testowych,
–
karta odpowiedzi.
ZESTAW ZADAŃ TESTOWYCH
1.
Wiersz, w którym wymieniono tylko tlenki nie reagujące z wodą to
a)
SiO
2
, CO, ZnO, BaO SO
2
.
b)
NO, CuO, Al
2
O
3
, CO, SiO
2
.
c)
Fe
2
O
3
, MgO, SO
2
, SiO
2
, CO
2
.
d)
Al
2
O
3
FeO, ZnO, SrO, MgO.
2.
Chlorek miedzi (II) można otrzymać w reakcji
I.
miedź + chlor
II.
miedź + kwas solny
III.
tlenek miedzi(II) + kwas solny
IV.
wodorotlenek miedzi (II) + kwas solny

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
30
a)
we wszystkich podanych reakcjach.
b)
w reakcji I, II i III.
c)
w reakcji I, II i IV.
d)
w reakcji I, III i IV.
3.
Wybierz poprawne sformułowania dotyczące właściwości kwasów
I.
Stężony H
2
SO
4
ma właściwości higroskopijne.
II.
Kwas metakrzemowy jest nietrwały i rozkłada się na tlenek krzemu i wodę.
III.
Wodne roztwory kwasów powodują zabarwienie oranżu metylowego na czerwono.
IV.
Wszystkie kwasy są dobrze rozpuszczalne w wodzie.
V.
Stężony HNO
3
reaguje z miedza w wydzielaniem wodoru.
VI.
Kwasy to związki chemiczne, które reagują z zasadami.
VII.
Wszystkie kwasy można otrzymać w reakcji tlenku kwasowego z wodą.
a)
I, III, VI i VII.
b)
I, II, III, i VI.
c)
I, II, III, IV, V i VI.
d)
II, V.
4.
Wodorotlenki, które ulegają rozkładowi pod wpływem temperatury to
a)
Fe(OH)
3
, Cu(OH)
2,
AgOH, Hg(OH)
2.
b)
Mg(OH)
2,
Zn(OH)
2,
Al(OH)
3
, RbOH.
c)
Ba(OH)
2
, KOH, Sr(OH)
2
, Mg(OH)
2
.
d)
Cu(OH)
2,
NaOH, Pb(OH)
2
, Cd(OH)
2
.
5.
Wodorotlenek wapnia można otrzymać w reakcji
a)
syntezy.
b)
wymiany pojedynczej.
c)
wymiany podwójnej.
d)
syntezy, wymiany pojedynczej i podwójnej.
6.
Zbiór utleniaczy to
a)
atomy sodu, atomy siarki, jony azotanowe (III).
b)
jony sodu, atomy siarki, atomy magnezu.
c)
jony sodu, atomy siarki, jony azotanowe (V).
d)
atomy sodu , cząsteczki wodoru, jony azotanowe (V).
7.
Układ metanol - woda jest układem
a)
dwuskładnikowym i dwufazowym.
b)
dwuskładnikowym i jednofazowym.
c)
jednoskładnikowym i jednofazowym.
d)
jednoskładnikowym i dwufazowym.
8.
W układzie otwartym (w sensie mechanicznym)
a)
może nastąpić wymiana energii i masy ciała między układem a otoczeniem.
b)
może nastąpić wyłącznie wymiana energii miedzy układem a otoczeniem.
c)
może nastąpić wyłącznie wymiana masy miedzy układem otoczeniem.
d)
nie może nastąpić ani wymiana energii, ani wymiana masy miedzy układem
a otoczeniem.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
31
9.
Energia wewnętrzna układu
a)
nie zależy od temperatury układu.
b)
jest termodynamiczną funkcja stanu, a jej zmiana nie zależy od drogi przemiany.
c)
nie ulega zmianie w wyniku reakcji chemicznej.
d)
określa tylko energie kinetyczna ruchu postępowego układu.
10.
Zmianę energii wewnętrznej układu obrazuje zależność stanowiąca matematyczny zapis
I zasady termodynamiki
a)
∆
U + Q = W.
b)
∆
U = Q
.
W.
c)
∆
U = Q/W.
d)
∆
U = Q + W.
11.
Do reakcji podstawienia nukleofilowego zaliczamy reakcje
I.
C
3
H
7
Br + H
2
O → C
3
H
7
OH + HBr
II.
C
4
H
9
Cl+OH
-
→
C
4
H
9
OH + Cl
-
III.
C
2
H
5
Br + NH
3
→
C
2
H
5
NH
2
+ HBr
IV.
C
6
H
6
+Br
2
→
C
6
H
5
Br + HBr
a)
I,II ,III, i IV.
b)
I, II i III.
c)
I i II.
d)
III i IV.
12.
Polimeryzacji ulegają
a)
alkohole jednowodorotlenowe nasycone.
b)
cukry proste.
c)
alkeny.
d)
aminokwasy.
13.
Aldehyd powstaje w reakcji utleniania
a)
kwasu.
b)
alkoholu I–rzędowego.
c)
alkoholu II–rzędowego.
d)
alkoholu III–rzędowego.
14.
Do przeprowadzenia reakcji estryfikacji między alkoholem etylowym, a kwasem
octowym zamiast stężonego kwasu siarkowego (VI) można użyć
a)
HNO
3
stęż.
b)
HCl stęż.
c)
CaCl
2
stały.
d)
NaCl.
15.
Pewna substancja jest produktem reakcji nitrowania, cieczą o żółtawej barwie, trującą.
Służy ona do otrzymywania wielu barwników, lekarstw i materiałów wybuchowych.
Substancja tą jest
a)
nitroceluloza.
b)
nitrogliceryna.
c)
kwas salicylowy.
d)
nitrobenzen.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
32
16.
Sformułowanie które jest fałszywe to
a)
destylacja to proces rozdzielania mieszanin ciekłych, których składniki różnią się
temperaturami wrzenia.
b)
chromatografia jest metoda rozdziału mieszanin wykorzystującą różnicę ruchliwości
poszczególnych składników mieszaniny na specjalnie przygotowanym podłożu.
c)
odparowanie jest metodą rozdziału polegającą na wykorzystaniu różnic w masach
i rozmiarach rozdzielanych składników.
d)
ekstrakcja
jest
metodą
rozdzielania
mieszaniny
wykorzystującą
różnicę
rozpuszczalności składników mieszaniny w użytym rozpuszczalniku.
17.
W wyniku redukcji propanonu otrzymano
a)
kwas protonowy.
b)
tylko propan–1–ol.
c)
tylko propan–2–ol.
d)
propan–1–ol, propan–2–ol.
18.
W celu wydzielenia NaCl z wodnego roztworu należy zastosować
a)
dekantację.
b)
sączenie.
c)
ekstrakcję.
d)
odparowanie.
19.
Reakcja estryfikacji zachodzi według mechanizmu
a)
addycji elektrofilowej.
b)
substytucji elektrofilowej.
c)
addycji wodorotlenkowej.
d)
substytucji nukleofilowej.
20.
Reakcja, którą należy przeprowadzić, aby otrzymać z oleju słonecznikowego margarynę
to
a)
uwodornienie.
b)
bromowanie.
c)
ekstrakcję.
d)
utlenianie.
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
33
KARTA ODPOWIEDZI
Imię i nazwisko..........................................................................................
Zastosowanie technik laboratoryjnych do sporządzania preparatów
chemicznych
Zakreśl poprawną odpowiedź
.
Nr
zadania
Odpowiedź
Punkty
1.
a
b
c
d
2.
a
b
c
d
3.
a
b
c
d
4.
a
b
c
d
5.
a
b
c
d
6.
a
b
c
d
7.
a
b
c
d
8.
a
b
c
d
9.
a
b
c
d
10.
a
b
c
d
11.
a
b
c
d
12.
a
b
c
d
13.
a
b
c
d
14.
a
b
c
d
15.
a
b
c
d
16.
a
b
c
d
17.
a
b
c
d
18.
a
b
c
d
19.
a
b
c
d
20.
a
b
c
d
Razem:

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
34
Test 2
Test dwustopniowy do jednostki modułowej
„Zastosowanie technik
laboratoryjnych do sporządzania preparatów chemicznych”
Test składa się z 20 zadań wielokrotnego wyboru, z których:
–
zadania 1, 3, 4, 5, 6, 7, 9, 11, 12, 13, 14, 15, 16, 17, 20 są z poziomu podstawowego,
–
zadania 2, 8, 10, 18, 19, są z poziomu ponadpodstawowego.
Punktacja zadań: 0 lub 1 punkt
Za każdą prawidłową odpowiedź uczeń otrzymuje 1 punkt. Za złą odpowiedź lub jej brak
uczeń otrzymuje 0 punktów.
Proponuje się następujące normy wymagań – uczeń otrzyma następujące
oceny szkolne:
–
dopuszczający – za rozwiązanie co najmniej 8 zadań z poziomu podstawowego,
–
dostateczny – za rozwiązanie co najmniej 10 zadań z poziomu podstawowego,
–
dobry – za rozwiązanie 14 zadań, w tym co najmniej 3 z poziomu ponadpodstawowego,
–
bardzo dobry – za rozwiązanie 18 zadań, w tym 5 z poziomu ponadpodstawowego.
Klucz odpowiedzi: 1. c, 2. c, 3. a, 4. d, 5. a, 6. c, 7. a, 8. c, 9. a, 10. a, 11. d,
12. c, 13. b, 14. b, 15. b, 16. b, 17. d, 18. d, 19. a, 20. a
Plan testu
Nr
zad.
Cel operacyjny
(mierzone osiągnięcia ucznia)
Kategoria
celu
Poziom
wymagań
Poprawna
odpowiedź
1
Rozróżnić charakter chemiczny
tlenków
B
P
c
2
Wybrać reakcję otrzymywania soli
C
PP
c
3
Wybrać właściwości kwasów
C
P
a
4
Wybrać wodorotlenki ulegające
rozkładowi termicznemu
C
P
d
5
Nazwać reakcje w wyniku, których
można otrzymać NaOH
C
P
a
6
Wybrać związki redukujące
C
P
c
7
Rozróżnić rodzaj układu
B
P
a
8
Przewidzieć rodzaj wymiany ciepła
C
PP
c

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
35
9
Wybrać definicję energii wewnętrznej
B
P
a
10
Przeanalizować dane określające I
zasadę termodynamiki
B
PP
a
11 Określić warunki reakcji
D
P
d
12 Wybrać właściwy produkt
C
P
c
13 Wybrać właściwy reagent
C
P
b
14 Wybrać właściwą reakcję
C
P
b
15 Wybrać właściwy produkt
C
P
b
16 Rozróżnić definicję prawdziwą
B
P
b
17 Wybrać właściwy substrat
C
P
d
18
Przeanalizować możliwość doboru
właściwej metody
D
PP
d
19 Przewidzieć typ reakcji
D
PP
a
20 Określić właściwy mechanizm
C
P
a

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
36
Przebieg testowania
Instrukcja dla nauczyciela
1.
Ustal z uczniami termin przeprowadzenia sprawdzianu z wyprzedzeniem o najmniej
jednotygodniowym.
2.
Przygotuj odpowiednią liczbę testów.
3.
Zapewnij samodzielność podczas rozwiązywania zadań.
4.
Przed rozpoczęciem testu przeczytaj instrukcję dla ucznia.
5.
Zapytaj czy uczniowie wszystko zrozumieli.
6.
Nie przekraczaj przeznaczonego czasu na test.
Instrukcja dla ucznia
1.
Przeczytaj uważnie instrukcję.
2.
Podpisz imieniem i nazwiskiem kartę odpowiedzi.
3.
Zapoznaj się z zestawem zadań testowych.
4.
Udzielaj odpowiedzi na załączonej karcie odpowiedzi, wstawiając w odpowiedniej
rubryce znak X. W przypadku pomyłki należy błędną odpowiedź zaznaczyć kółkiem,
a następnie ponownie zaznaczyć odpowiedź prawidłową.
5.
Test zawiera 20 zadań, w tym: 15 z poziomu podstawowego, 5 z poziomu
ponadpodstawowego.
6.
Do każdego zadania podane są 4 odpowiedzi. Tylko jedna jest prawdziwa.
7.
Pracuj samodzielnie, bo tylko wtedy będziesz miał satysfakcję z wykonanego zadania.
8.
Kiedy udzielanie odpowiedzi będzie Ci sprawiało trudność, wtedy odłóż jego
rozwiązanie na później i wróć do niego, gdy zostanie Ci wolny czas.
9.
Na rozwiązanie testu masz 40 min.
Powodzenia
Materiały dla ucznia:
−
instrukcja,
−
zestaw zadań testowych,
−
karta odpowiedzi.
ZESTAW ZADAŃ TESTOWYCH
1.
Wskaż zestaw zawierający tlenki wyłącznie reagujące z wodą
a)
Na
2
O, BaO, ZnO, CO
2
, Al
2
O
3
.
b)
CuO, NO, BaO, SO
2
, SiO
2
.
c)
MgO, BaO, CO
2
, P
4
O
10
, Na
2
O.
d)
K
2
O, CaO, CO, SO
2 ,
N
2
O
5
.
2.
Chlorek miedzi (II) można otrzymać w reakcji
I.
miedź + kwas solny
II.
miedź + chlor
III.
tlenek miedzi (II) + kwas solny
IV.
wodorotlenek miedzi (II) + kwas solny

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
37
a)
w reakcji II i IV.
b)
w reakcji I, II i IV.
c)
w reakcji II, III i IV.
d)
we wszystkich podanych reakcjach.
3.
Wybierz poprawne sformułowania dotyczące kwasów
I.
Kwasy to związki chemiczne, które reagują z zasadami
II.
Wodne roztwory kwasów powodują zabarwienie oranżu metylowego na czerwono.
III.
Kwas metakrzemowy jest nietrwały i rozkłada się na tlenek krzemu i wodę.
IV.
Wszystkie kwasy można otrzymać w reakcji tlenku kwasowego z wodą.
V.
Stężony HNO
3
reaguje z miedzią z wydzielaniem wodoru.
VI.
Stężony H
2
SO
4
ma własności higroskopijne.
VII.
Wszystkie kwasy są dobrze rozpuszczalne w wodzie.
a)
I, II, III i VI.
b)
I, II, IV, V i VI.
c)
I, III, IV, V i VII.
d)
I, II, III, IV, V, VI, VII.
4.
Wybierz wodorotlenki ulegające rozpadowi pod wpływem temperatury
a)
Cu(OH)
2
,
NaOH, Cd(OH)
2
,
Pb(OH)
2
.
b)
Ba(OH)
2
,
KOH, Sn(OH)
2
,
Mg(OH)
2
.
c)
Hg(OH)
2
, Zn(OH)
2
, Al(OH)
3
, RbOH.
d)
Fe(OH)
3,
Cu(OH)
2,
AgOH, Hg(OH)
2
.
5.
Wodorotlenek sodu można otrzymać w reakcji
a)
syntezy.
b)
wymiany pojedynczej.
c)
wymiany podwójnej.
d)
analizy.
6.
Wskaż zbiór reduktorów
a)
jony żelaza (II), jony manganianowi (VII), jony sodu.
b)
jony żelaza (III), jony manganianowi (VII), atomy sodu.
c)
atomy żelaza, jony azotanowe (III), jony tlenkowe.
d)
atomy żelaza, jony manganianowi (VII), jony tlenkowe.
7.
Układ kwas oleinowy – woda jest układem
a)
dwuskładnikowym i dwufazowym.
b)
dwuskładnikowym i jednofazowym.
c)
jednoskładnikowym i jednofazowym.
d)
jednoskładnikowym i dwufazowym.
8.
W układzie zamkniętym (w sensie mechanicznym)
a)
nie może nastąpić ani wymiana energii, ani wymiana masy miedzy układem
a otoczeniem.
b)
może nastąpić wyłącznie wymiana masy miedzy układem otoczeniem.
c)
może nastąpić wyłącznie wymiana energii miedzy układem otoczeniem.
d)
może nastąpić wyłącznie wymiana energii i masy miedzy układem otoczeniem.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
38
9.
Zmiana energii układu ∆U
a)
nie zależy od drogi przemiany , a zależy tylko od stanu początkowego układu.
b)
określa tylko ilość energii wymienionej z otoczeniem na sposób ciepła Q.
c)
zależy od drogi przemiany , czyli od stanu początkowego i końcowego układu.
d)
zależy od energii przemiany , a nie zależy od stanu początkowego i końcowego
układu.
10.
W układach chemicznych wymiana energii na sposób pracy dotyczy głównie pracy
wynikającej ze zmiany objętości. Wyrażenie określające I zasadę termodynamiki
przyjmuję wiec postać
a)
∆
U = Q -p
.
∆V.
b)
∆
U = Q
.
p
.
∆
V.
c)
∆
U = Q/W.
d)
∆
U = 2Q-3p
.
∆
V.
11.
Warunki jakie musi spełniać elektrofil w substytucji elektrofilowej niektórych związków
organicznych to że
a)
jest to atom z jednym niesparowanym elektronem, który powstał z rozpadu (np. pod
wpływem światła) cząsteczki X
2
.
b)
jest to atom dowolnego jednowartościowego pierwiastka o elektroujemności
większej od elektroujemności wodoru.
c)
wystarczy tylko , że jest jonem dodatnim.
d)
jest jonem dodatnim o elektroujemności mniejszej od elektroujemności wodoru.
12.
Polimerem otrzymywanym w wyniku reakcji polikondensacji jest
a)
polipropylen.
b)
poli(matakrylan metylu).
c)
poliamid.
d)
polistyren.
13.
Aldehyd powstaje w reakcji utleniania
a)
kwasu.
b)
alkoholu I–rzędowego.
c)
alkoholu II–rzędowego.
d)
alkoholu III–rzędowego.
14.
Reakcja która jest reakcją estryfikacji to
a)
CH
3
OH +CH
3
CH
2
OH → CH
3
– O – C
2
H
5
+ H
2
O.
b)
HCOOH + CH
3
OH →HCOOCH
3
+ H
2
O.
c)
HCOOH + NaOH →HCOONa +H
2
O.
d)
C
3
H
7
COOC
2
H
5
+ H
2
O → C
3
H
7
COOH + C
2
H
5
OH.
15.
Głównym produktem nitrowania nitrobenzenu będzie
a)
o – dinitrobenzen.
b)
m – dinitrobenzen.
c)
p – dinitrobenzen.
d)
o – dinitrobenzen i p – dinitrobenzen.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
39
16.
Z podanych poniżej sformułowań prawdziwe jest
a)
destylacja jest metoda rozdziału składników mieszaniny wykorzystująca różnice
rozpuszczalności tych składników w użytym rozpuszczalniku.
b)
chromatografia jest metodą rozdzielania składników mieszaniny wykorzystującą
szybkości wędrówki różnych składników w specjalnie przygotowanym podłożu.
c)
ekstrakcja jest metodą rozdzielania składników mieszaniny wykorzystującą różnicę
temperatur wrzenia.
d)
adsorpcja jest metoda rozdzielania składników mieszaniny wykorzystującą różnice
w masie i rozmiarach rozdzielanych składników.
17.
W celu otrzymania kwasu benzoesowego należy poddać utlenieniu
a)
tylko toluen.
b)
tylko fenylometanol.
c)
tylko aldehyd benzoesowy.
d)
toluen, fenylometanol, aldehyd benzoesowy.
18.
W celu wydzielenia kwasu octowego z wodnego roztworu należy zastosować
a)
tylko separacje magnetyczną.
b)
tylko ekstrakcje wodną.
c)
tylko rozdzielanie grawitacyjne.
d)
separacje magnetyczną, ekstrakcje wodną, rozdzielanie grawitacyjne.
19.
Anilina jako związek aromatyczny ulega reakcjom
a)
nitrowania.
b)
eliminacji amoniaku.
c)
substytucji wolnorodnikowej.
d)
eliminacji amoniaku i substytucji wolnorodnikowej.
20.
Mechanizm, z którym zachodzi reakcja estryfikacji to
a)
addycja elektrofilowa.
b)
substytucja elektrofilowa.
c)
addycja wolnorodnikowa.
d)
substytucja nukleofilowa.
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
40
KARTA ODPOWIEDZI
Imię i nazwisko..........................................................................................
Zastosowanie technik laboratoryjnych do sporządzania preparatów
chemicznych
Zakreśl poprawną odpowiedź.
Nr
zadania
Odpowiedź
Punkty
1.
a
b
c
d
2.
a
b
c
d
3.
a
b
c
d
4.
a
b
c
d
5.
a
b
c
d
6.
a
b
c
d
7.
a
b
c
d
8.
a
b
c
d
9.
a
b
c
d
10.
a
b
c
d
11.
a
b
c
d
12.
a
b
c
d
13.
a
b
c
d
14.
a
b
c
d
15.
a
b
c
d
16.
a
b
c
d
17.
a
b
c
d
18.
a
b
c
d
19.
a
b
c
d
20.
a
b
c
d
Razem:

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
41
7. LTERATURA
1.
Bojarski J.: Ćwiczenia z preparatyki i analizy organicznej. CM UJ, Kraków 1996
2.
Dominiak A.: Tematy i zagadnienia maturalne z chemii. OMEGA, Kraków 1999
3.
Drapała T.: Chemia fizyczna z zadaniami. PWN, Warszawa 1982
4.
Galaska- Krajewska A. (red): Kinetyka chemiczna. WSiP, Warszawa 1984
5.
Hejwowska S. (red).: Zbiór zadań. OPERON, Gdynia 2003
6.
Karpiński W.: Chemia fizyczna. WSiP, Warszawa 1998
7.
Klepaczko-Filipiak.: Narzędzia pomiaru dydaktycznego do badania umiejętności
uczniów szkół kształcących w zawodzie technika analizy chemicznej. WODN, Łódź
1994
8.
Klepaczko-Filipiak.: Produkcja chemiczna. WSiP, Warszawa 2000
9.
Koszmider M.: Chemia. WSiP, Warszawa 1998
10.
Lewandowski R.: Pracownia preparatyki nieorganicznej. WSiP, Łódź 1999
11.
Persona A. (red).: Chemia dla szkół średnich w testach. WSiP, Warszawa 1998
12.
Warych J.: Podstawowe procesy przemysłu chemicznego i przetwórczego. WSiP,
Warszawa 1996
Literatura metodyczna
1.
Jeruszka U., Niemierko B. (red.): Zastosowania pomiaru sprawdzającego w kształceniu
zawodowym. MEN, Warszawa 1997
2.
Szlosek F.: Wstęp do dydaktyki przedmiotów zawodowych. ITE, Radom 1998
Wyszukiwarka
Podobne podstrony:
03 Zastosowanie technik laborat Nieznany
TARCIE, PW Transport, Gadżety i pomoce PW CD2, MECHANIKA, MECHANIKA !!, mechanika techniczna - labor
03 2 Zastosowanie całki krzywoliniowej w mechanice
BOSSA Zastosowanie techniki Heikin Ashi na rynku kapitałowym
Zastosowanie technik werbalnych w wywieraniu wpływu przez telefon.x, Ekonomia Biznesu, coaching, nlp
03 opis technicznyaaa
7 Zastosowanie techniki mikroprocesorowej II
03 Stosowanie technik informatycznych w pracy biurowej
1g zastosowania techniki mikroprocesorowej
03.Strona techniczna, BMR, Broń Jądrowa
Or Biologiczne u technika laboratorium, Ocena-Ryzyka-DOC
03 Wykorzystanie technik inform Nieznany (2)
18.03.2012 Techniczne bezpieczeństwo pracy
Spektrofotometryczne oznaczanie żelaza z zastosowaniem techniki wstrzykowo-przepływowej
25.03.2012 Techniczne bezpieczeństwo pracy
więcej podobnych podstron