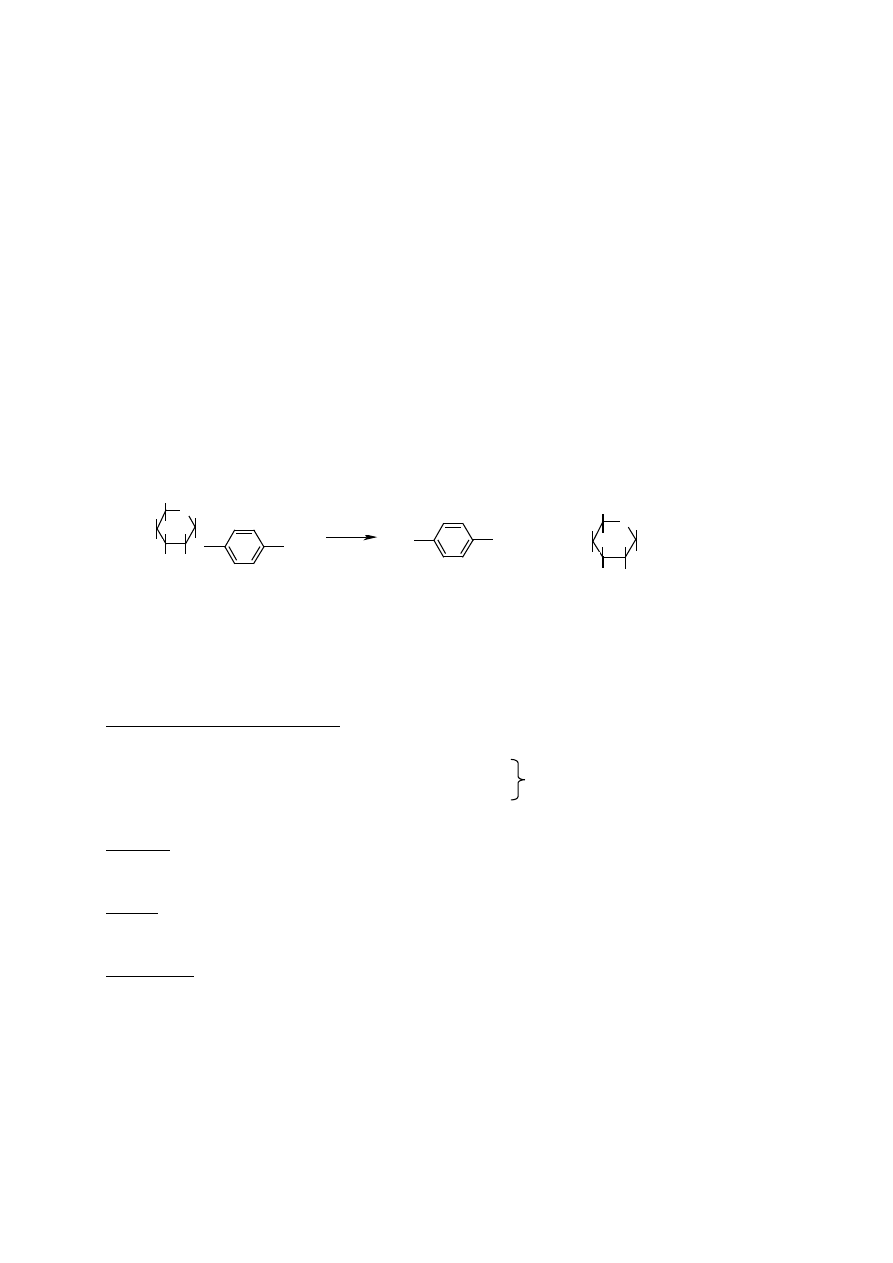
WICZENIE
5
K
INETYKA
E
NZYMÓW
Wyci g z kart charakterystyki substancji niebezpiecznych
Kwas octowy – C
Triton X-100 – Xn, Rakotw. kat.3
Wyznaczanie stałej Michaelisa-Menten dla N-acetylo-ββββ-D-glukozaminidazy
ze linianek szczura
N-acetylo-
β-D-glukozaminidaza (EC.3.2.1.30) hydrolizuje wi zanie β-N-acetyloglukoz-
aminylowe (na nieredukuj cym ko cu ła cucha cukrowego) w oligosacharydach takich jak
kwas hialuronowy czy siarczan chondroityny. W celu wyznaczenia aktywno ci acetylo-
glukozaminidazy stosuje si substraty syntetyczne: glikozydy np. fenylowe lub p-nitrofenylo-
we.
O
NO
2
O
CH
2
OH
O
OH
NHAc
O
CH
2
OH
OH
HO
NHAc
OH
NO
2
HO
H
2
O
+
p-nitrofenylo-N-acetylo-
β
-D-glukozamina
p-nitrofenol
N-acetylo-
β
-D-glukozamina
Uwolniony p-nitrofenol wykazuje charakterystyczne maksimum absorbancji przy długo ci
fali
λ = 405 nm.
Bufor do reakcji enzymatycznej:
st enie ko cowe ilo
58 mM kwas cytrynowy
1,520 g
41 mM NaH
2
PO
4
0,707 g
100 ml, doprowadzi przy u yciu
0,1% Triton X-100
0,1 ml
NaOH do pH 4.2
Substrat:
p-nitrofenylo-N-acetylo-
β-D-glukozamina
2 mg/ml buforu
Stoper:
0,4 M glicyna – NaOH pH 10.7
Wykonanie:
Przygotowa kolejne rozcie czenia wyj ciowego roztworu substratu o st eniu 2mg/ml – w
tym celu pobra do oddzielnej probówki 200
µl wyj ciowego roztworu substratu i uzupełni
buforem do obj to ci 400
µl. Cało wymiesza . Z tak przygotowanego rozcie czenia pobra
obj to 200
µl i uzupełni buforem do obj to ci 400 µl. Otrzymany roztwór wymiesza .
Post powa analogicznie, a do otrzymania 5 kolejnych rozcie cze .
Do pi ciu oddzielnych probówek odpipetowa po: 600
µl buforu i 180 µl homogenatu.
Nast pnie do ka dej mieszaniny doda substratu o innym st eniu w ilo ci 180
µl.
Wymiesza . Mieszaniny inkubowa w temp. 37
°C i po czasie 1, 2, 4, 6 i 8 min pobiera po
160
µl mieszaniny i przenosi do uprzednio przygotowanych probówek zawieraj cych 0.5 ml
stopera. Absorbancj powstałego produktu zmierzy wobec lepych odczynnikowych
(przygotowanych dla ka dego st enia substratu) przy długo ci fali
λ = 405 nm w
spektrofotometrze Bio-Rad. lepe odczynnikowe przygotowa nast puj co: do pi ciu
kolejnych probówek odpipetowa po 130
µl buforu i 30 µl odpowiedniego st enia substratu,
inkubowa w temp. 37
°C przez 5 min, a nast pnie zatrzyma reakcje dodaj c po 0,5 ml
stopera. Mno c warto absorbancji przez stał k = 1007 otrzymujemy st enie rozło onego
substratu/powstałego produktu w nmol/ml. Masa 1 mola substratu = 342.3 g.
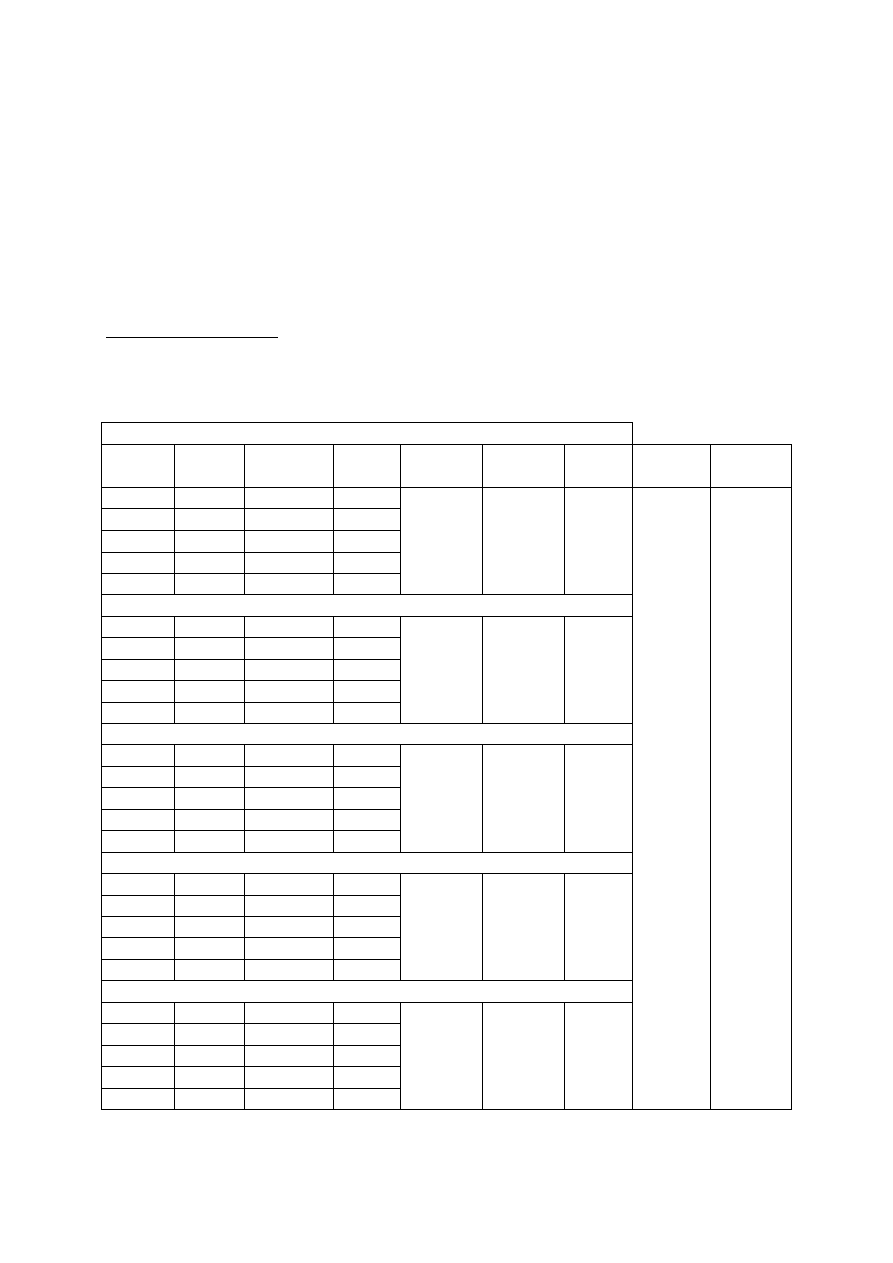
Opracowanie wyników:
Dla ka dego z u ytych st e substratu
s wykre li krzywe kinetyczne wyra aj ce zale no
przyrostu produktu
c od czasu inkubacji t. Znale graficzne szybko ci pocz tkowe V
0
i po
sporz dzeniu wykresu Lineweavera-Burka wyznaczy graficznie warto ci
K
m
i
V
max
.
s = 0,125 (mg/ml) =
(mmol/l)
nr
próbki
A
405
c
(
µM)
t
(min)
v
0
(
µM/min)
1/v
0
(min/
µM)
1/s
(1/mM)
K
m
(mM)
V
max
(
µM/min)
1
1
2
2
3
4
4
6
5
8
s = 0,250 (mg/ml) =
(mmol/l)
6
1
7
2
8
4
9
6
10
8
s = 0,500 (mg/ml) =
(mmol/l)
11
1
12
2
13
4
14
6
15
8
s = 1,000 (mg/ml) =
(mmol/l)
16
1
17
2
18
4
19
6
20
8
s = 2,000 (mg/ml) =
(mmol/l)
21
1
22
2
23
4
24
6
25
8
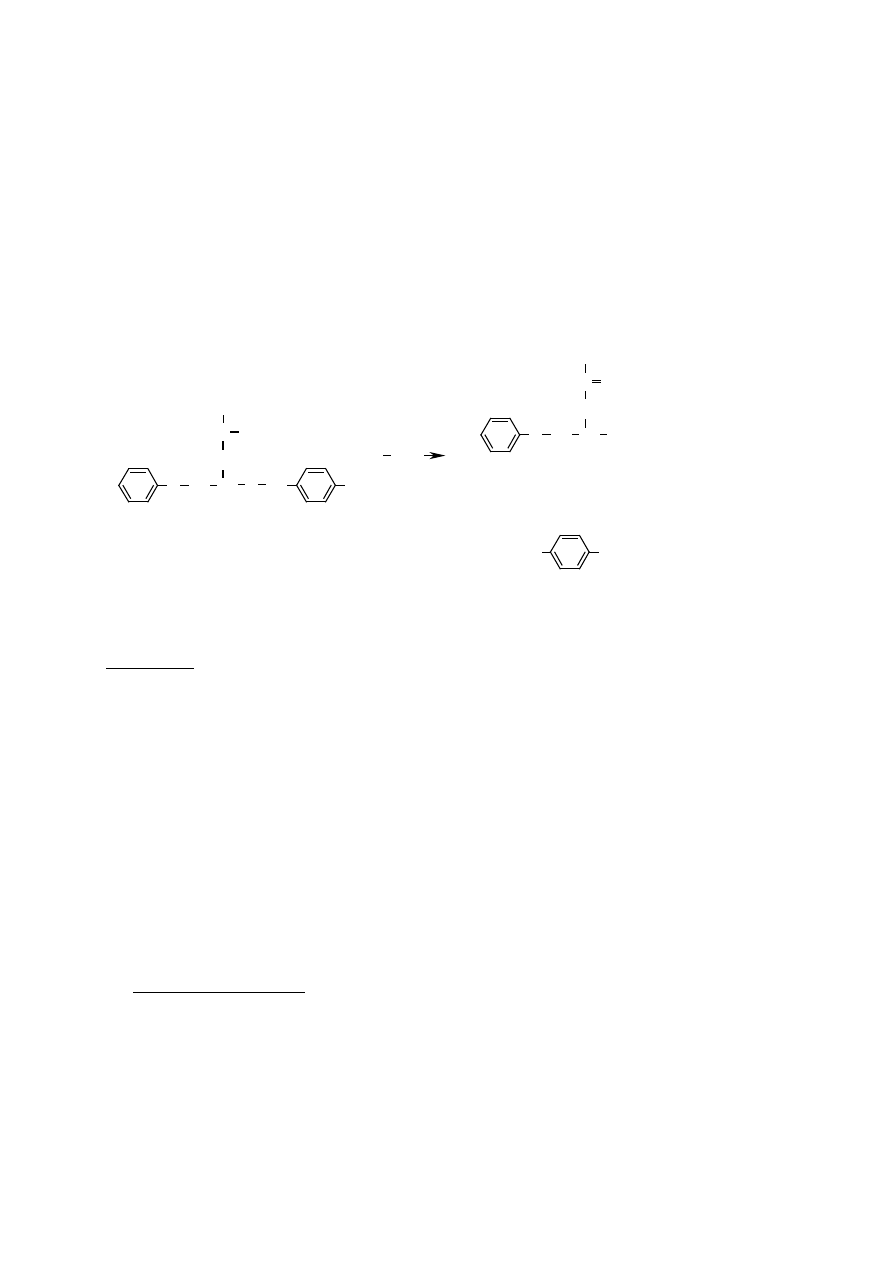
Oznaczanie aktywno ci trypsyny na substracie syntetycznym – wpływ pH i
temperatury na aktywno enzymatyczn .
Trypsyna (EC 3.4.21.4; enzym proteolityczny soku trzustkowego, endopeptydaza z klasy
hydrolaz) katalizuje m.in. reakcj hydrolizy wi za peptydowych, utworzonych przez grupy
karboksylowe argininy (Arg) lub lizyny (Lys), w ła cuchu polipeptydów i białek.
Trypsyna katalizuje równie hydroliz wi zania estrowego czy amidowego w substratach
syntetycznych b d cych pochodnymi Arg lub Lys. Je li substratem jest benzoilo-L-argininy
p-nitroanilid (BAPNA) to po reakcji hydrolizy uwalnia si wolna p-nitroanilina, która
wykazuje charakterystyczne maksimum absorbancji przy długo ci fali
λ = 405 nm.
trypsin
H
2
O
H
2
N
NO
2
C
NH
2
+
Cl
-
COOH
C
NH
CH
(CH
2
)
3
NH
2
C
NH
2
+
Cl
-
NO
2
C
NH
C
NH
CH
(CH
2
)
3
NH
2
+
BAPNA (bezbarwny)
p-nitroanilina (zólty)
Wykonanie:
1. Do jednej probówki odpipetowa 100
µl roztworu trypsyny roboczej a do drugiej
100
µl 1 mM HCl. Do obu probówek doda po 1 ml 0,2 M buforu Tris-HCl o pH 8,0 i
po 20
µl roztworu substratu BAPNA. Wymiesza i inkubowa 15 min w temp. 37°C.
Reakcj zatrzyma dodaj c 100
µl st onego kwasu octowego i zmierzy , wzgl dem
wody destylowanej, absorbancj powstałej p-nitroaniliny przy długo ci fali
λ = 405
nm w spektrofotometrze Bio-Rad. Oceni przydatno metody.
2. Do siedmiu probówek odpipetowa po 100
µl roboczego roztworu trypsyny, a do
ósmej 100
µl 1 mM HCl. Do siedmiu pierwszych probówek doda po 1 ml buforów o
pH 4, 5, 6, 7, 8, 9, 10, a do ostatniej probówki doda 1 ml buforu o pH 7. Nast pnie do
ka dej probówki doda po 20
µl substratu BAPNA i inkubow w temp. 37°C przez 15
min. Reakcje zatrzyma dodaj c po 100
µl st onego kwasu octowego i dokona
pomiaru absorbancji wzgl dem próby lepej (ósma probówka) przy długo ci fali
λ =
405 nm w spektrofotometrze Bio-Rad.
Opracowanie wyników:
Wykre li wykres zale no ci aktywno ci wła ciwej od pH roztworu i wyznaczy
optimum działania trypsyny dla BAPNA jako substratu, przyjmuj c jako jednostk
aktywno ci przyrost absorbancji o 0,1 w warunkach do wiadczenia. Aktywno wła ciwa
to ilo jednostek aktywno ci przypadaj ca na 1 mg enzymu.
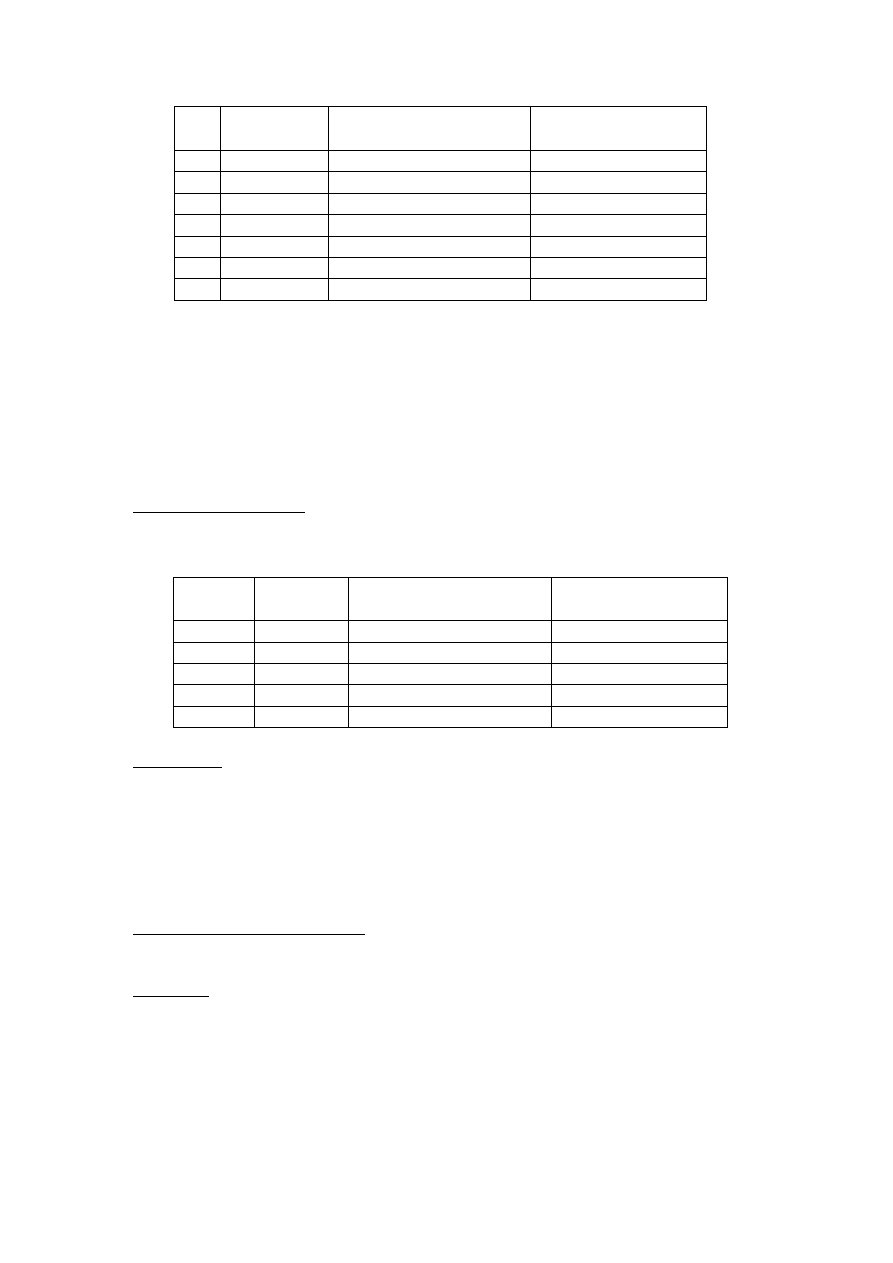
pH A (405 nm) Aktywo enzymatyczna
U (
µmol/min)
Aktywno wła ciwa
U/mg
4
5
6
7
8
9
10
3. Do pi ciu probówek odpipetowa po 50
µl roboczego roztworu trypsyny a do szóstej
probówki 50
µl 1 mM HCl. Nast pnie do wszystkich probówek doda po 1 ml 0,2 M
buforu Tris-HCl o pH 8,0 i po 20
µl roztworu substratu BAPNA. Wymiesza i
inkubowa 30 min w temp. 0, 25, 37, 48 i 60
°C. Reakcj zatrzyma dodaj c po 100 µl
st onego kwasu octowego i zmierzy absorbancj wzgl dem próby lepej (szósta
probówka) przy długo ci fali
λ = 405 nm w spektrofotometrze Bio-Rad.
Opracowanie wyników:
Wykre li wykres zale no ci aktywno ci wła ciwej trypsyny od temperatury inkubacji.
Przedyskutowa wyniki.
Temp.
(
°C)
A (405 nm) Aktywo enzymatyczna
U (
µmol/min)
Aktywno wła ciwa
U/mg
0
25
37
48
60
Odczynniki:
0,01 mM trypsyna (2,4 mg trypsyny w 10 ml 1 mM HCl) – przechowywana w lodzie.
Roztwór trypsyny roboczej – rozcie czy trypsyn 10 razy przy pomocy 1 mM HCl tzn.
odpipetowa 100
µl wyj ciowego roztworu trypsyny i doda 900 µl 1 mM HCl. Roztwór
roboczy enzymu przechowywa w lodzie. Substrat – 25 mM benzoilo-L-argininy p-
nitroanilid (BAPNA) w dimetylosulfotlenku (DMSO) (11 mg/ml). St ony kwas octowy
do przerywania reakcji enzymatycznej. Bufory: 0,2 M Tris-HCl o pH 4, 5, 6, 7, 8, 9 i 10.
Materiały i sprz t laboratoryjny:
pipety automatyczne, termostatowana ła nia wodna, spekrofotometr, probówki, lód
Literatura:
1) B.D. Hames, N.M.Hooper: „Krótkie wykłady. Biochemia” (red. J. Michajda, A.
Augustyniak, K. Ziemnicki), Wydawnictwo naukowe PWN, Warszawa 2004, str. 95-
104.
2) „Techniki bada fizjologicznych” (red. A. Lity ska, M.H. Lewandowski), str. 78-79.
Wyszukiwarka
Podobne podstrony:
cw.5-kinetyka enzymow
Biotechnologia-cw.-4-unieruchamianie-enzymow-2014-zima-dla-stud, Biotechnologia SGGW
Sprawozdanie, ćw 3, Kinetyka chemiczna
cw 9 Właściwości enzymów pankreatyna
kinetyka enzymów
Kinetyka enzymów
Ćw 6 kinetyka
enzymologia cw 1
(), Biochemia L, sprawozdanie kinetyka enzymatyczna (ćw A)(1)
(), biochemia L, Wpływ temperatury na aktywność enzymów (ćw E)
Enzymologia – zajęcia 1 - sprawozdanie, enzymologia, ćw, sprawozdania
enzymologia cw 2 id 162154 Nieznany
enzymologia ćw 14
cw 12 13 kinetyka octan etylu
A cw 2 koło 1 kinetyka reakcji zadania dodatkowe 2
ćw 3 mechanika laboratorium Doświadczalne wyznaczanie współczynnika tarcia kinetycznego 2009(1)
więcej podobnych podstron