Choroby układowe tkanki łącznej
dr n. med. Sylwia Kołtan
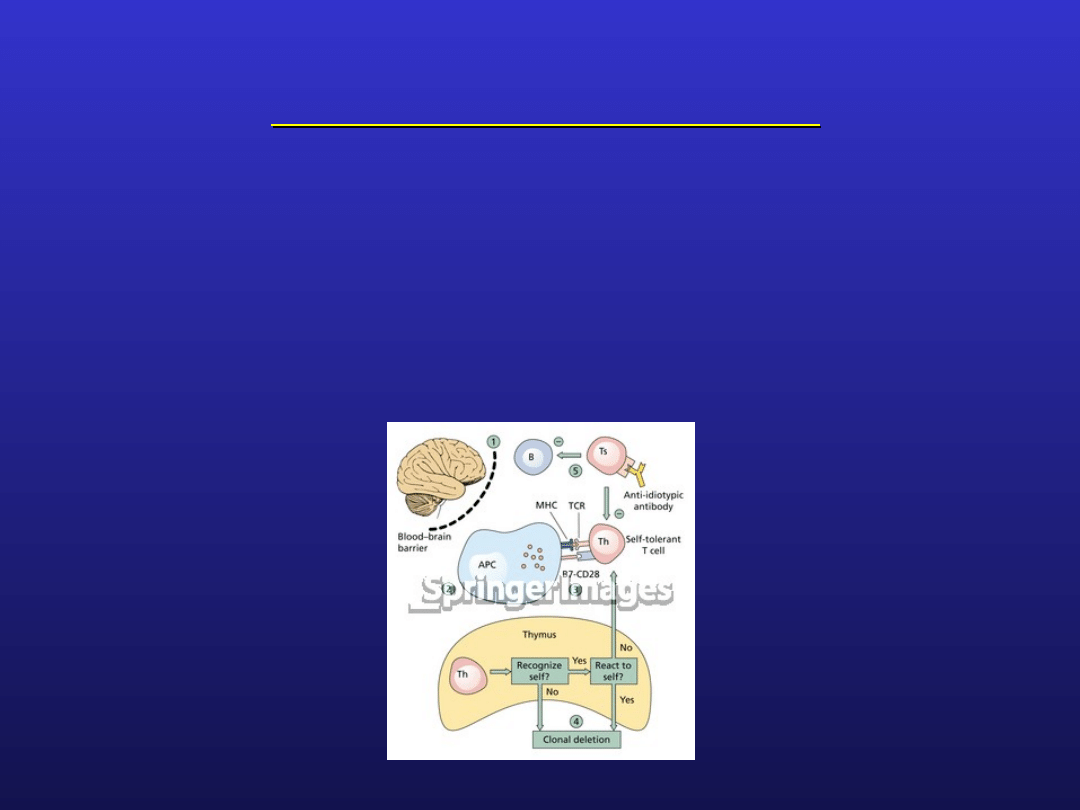
Mechanizmy autotolerancji
Mechanizmy autotolerancji
podstawowa cecha układu odporności: odróżnienie
komórek, tkanek i narządów własnych i ich ochrona
przed zniszczeniem przez układ immunologiczny
gospodarza
realizacja ochrony przed autodestrukcją następuje
poprzez różnorodne mechanizmy:

Mechanizmy autotolerancji
Mechanizmy autotolerancji
sekwestracja narządów i tkanek (np. podstawowe białko
mieliny, soczewka oka) – anatomiczna izolacja przed
ekspozycją na limfocyty; bariery anatomiczne, np.
bariera krew – mózg zapobiega przed kontaktem tkanek
mózgowia z limfocytami Th
zaburzenia izolacji „wydzielonych” tkanek i narządów
może skutkować ich ekspozycją i kontaktem z
komórkami immunologicznie kompetentnymi, które
mogą rozpoznawać je jako obce

Mechanizmy autotolerancji
Mechanizmy autotolerancji
brak możliwości prezentowania antygenów: niektóre
tkanki zawierają komórki, nie posiadające na swojej
powierzchni cząstek głównego kompleksu zgodności
tkankowej (MHC), zatem nie mogą być prezentowane
limfocytom przez komórki prezentujące antygen (APC) –
przykład: neurony
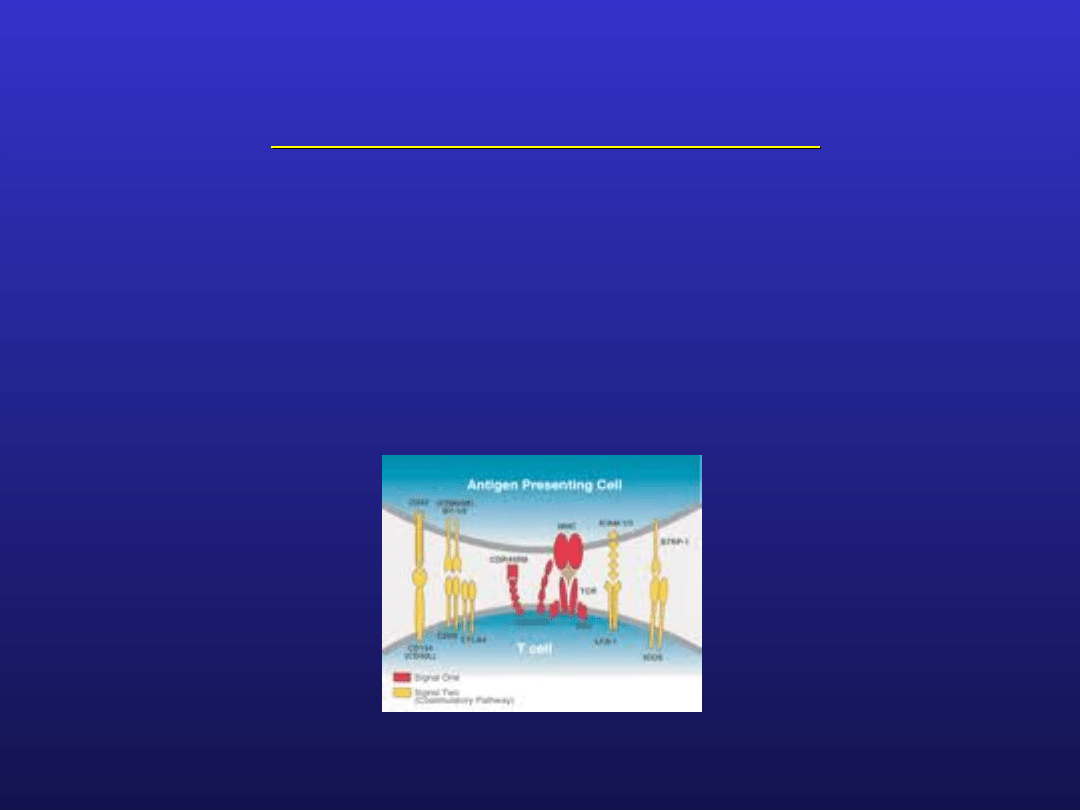
Mechanizmy autotolerancji
Mechanizmy autotolerancji
anergia klonalna: aktywacja limfocytów T wymaga
wtórnych sygnałów kostymulujących, np. pomiędzy
receptorem CD28 na limfocytach a proteiną B7 na
komórkach docelowych; brak na komórkach proteiny B7
powoduje, iż limfocyty T stają się w stosunku do nich
nieaktywne lub tolerancyjne
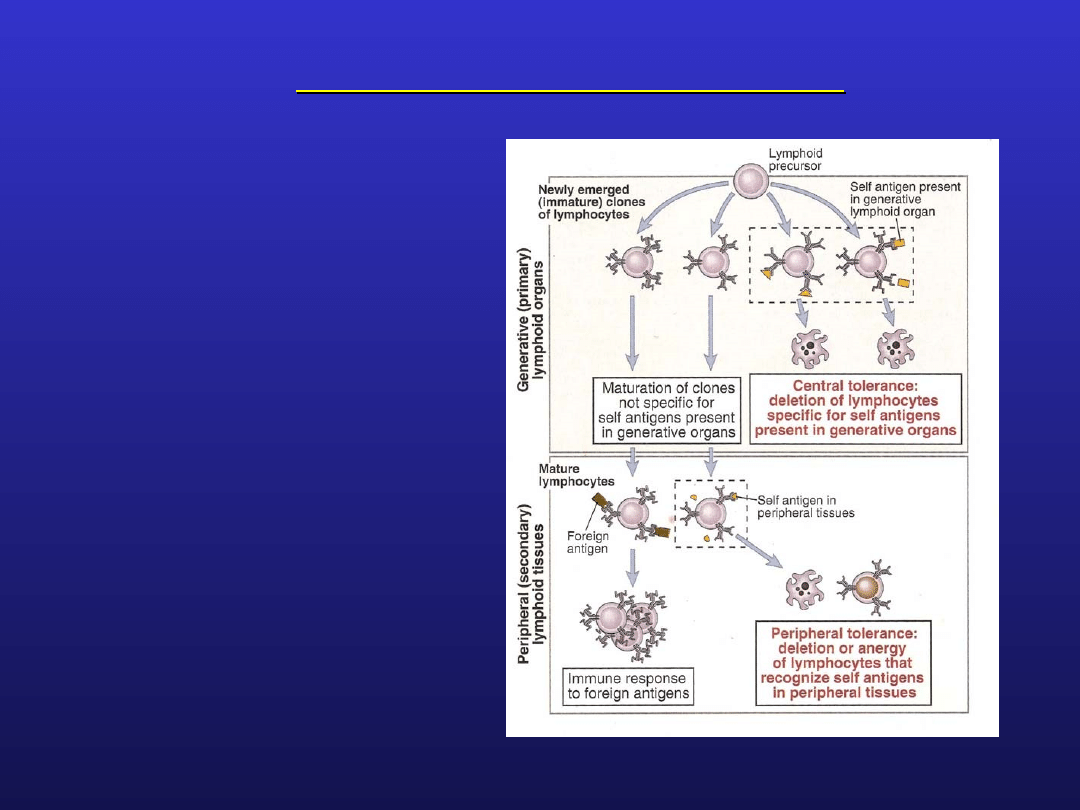
Mechanizmy autotolerancji
Mechanizmy autotolerancji
klonalna delecja:
podczas dojrzewania
limfocyty T muszą
„nauczyć” się
rozpoznawać antygeny
własne i rozwinąć w
stosunku do nich
tolerancję; kontakt w
pierwotnym narządzie
limfatycznym (grasica)
autoantygenu z
limfocytem T, wiążącym
go z dużym
powinowactwem jest
sygnałem do likwidacji
klonu jako
autoreaktywnego
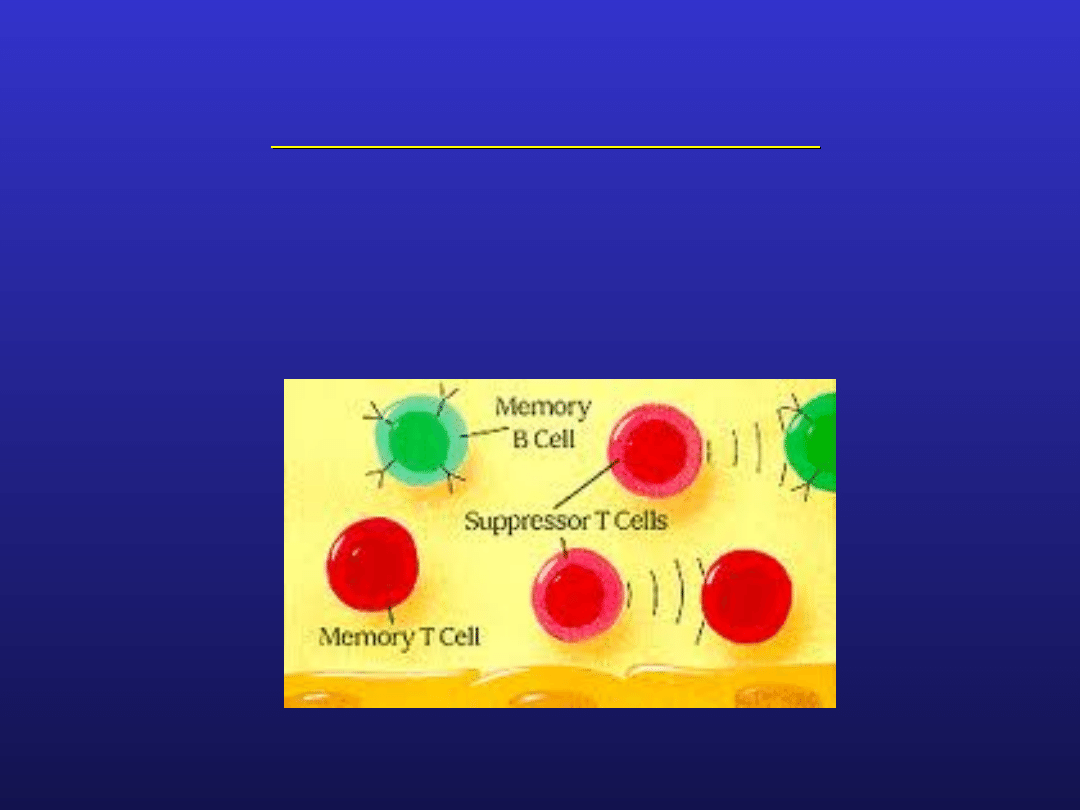
Mechanizmy autotolerancji
Mechanizmy autotolerancji
komórki supresorowe, głównie T regulatorowe, mogą
indukować i podtrzymywać tolerancję w stosunku do
własnych tkanek i narządów

Autoimmunizacja fizjologiczna
Autoimmunizacja fizjologiczna
reaktywność komórek układu odporności swoistej
(nabytej, adaptacyjnej) przeciwko własnym antygenom
ustroju
u każdego osobnika istnieje typowy dla niego
„fizjologiczny, niski poziom autoimmunizacji”; jej
natężenie zależy od czynników genetycznych oraz
uwarunkowań środowiskowych; jest ona niezbędna do
stymulacji limfocytów przez autoantygeny do ich
odnowy i przeżycia obwodowych „dziewiczych”
limfocytów T
wykładnikiem fizjologicznej autoimmunizacji jest
występowanie tzw. naturalnych przeciwciał oraz kilku
reaktywności komórkowych, mających znaczenie dla
odnowy limfocytów

Znaczenie przeciwciał naturalnych
Znaczenie przeciwciał naturalnych
funkcje efektorowe
eliminacja wielu bakterii i wirusów
inaktywacja toksyn
działania opsonizujące
usuwanie zużytego materiału komórkowego i
cząsteczkowego
indukcja odnowy mieliny
osłabienie litycznego działania dopełniacza poprzez
wiązanie aktywowanych komponent C3b i C4b na
komórkach docelowych
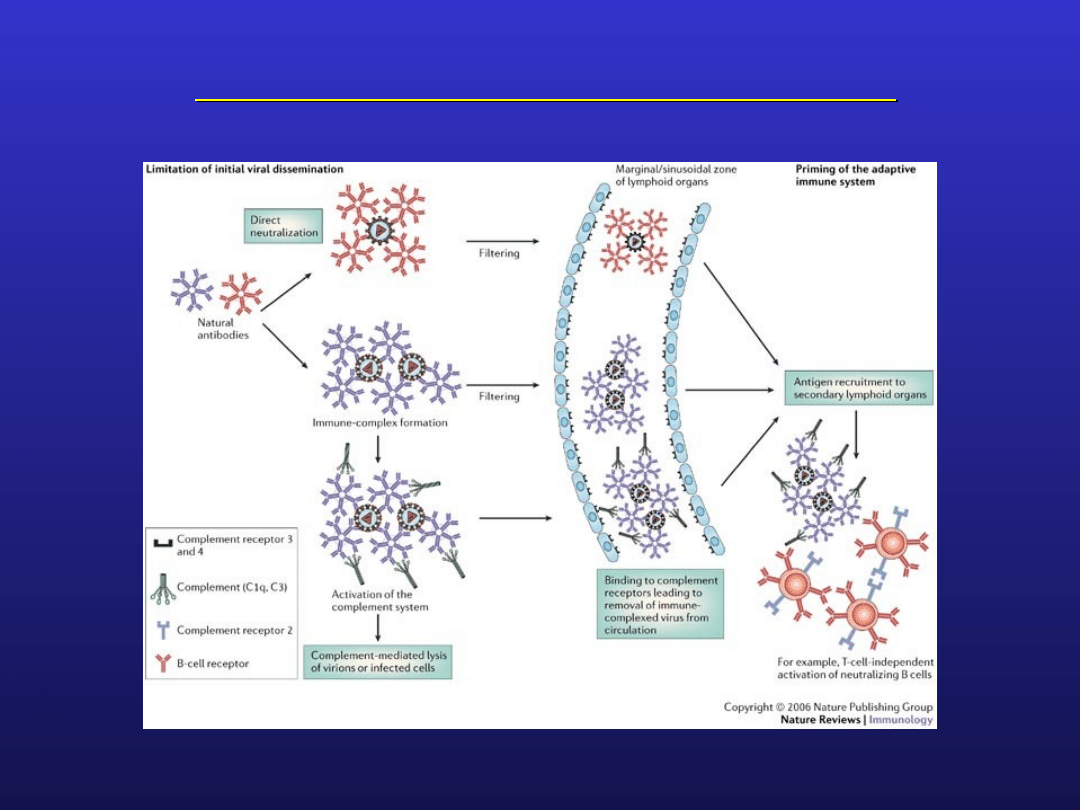
Znaczenie przeciwciał naturalnych
Znaczenie przeciwciał naturalnych

Znaczenie przeciwciał naturalnych
Znaczenie przeciwciał naturalnych
funkcje immunoregulacyjne realizowane poprzez
wiązanie z cząsteczkami o funkcji regulacyjnej:
receptory komórek T (CD4, CD8, TcR)
antygeny HLA klasy I i II
receptory dla fragmentu FcIgG i receptory dla
dopełniacza
cytokiny (np. Il6, Il1, TNF alfa, INF alfa, GM-CSF)
Interakcje te mają znaczenie dla utrzymania określonego
poziomu pobudzenia wielu komórek układu odporności
(limfocyty T, B, monocyty, makrofagi, granulocyty)

Choroby autoimmunologiczne
Choroby autoimmunologiczne
autoreaktywność w stosunku do własnych antygenów
przekracza natężenie, które można uznać za
fizjologiczne i doprowadza do uszkodzenia tkanek i
narządów
niezwykle zróżnicowana grupa chorób, o często wciąż
nieznanej etiologii
występują u ok. 5% populacji w krajach zachodniej
Europy

Zaburzenia immunologiczne w chorobach
Zaburzenia immunologiczne w chorobach
układowych
układowych
zależne od defektu limfocytów
zaburzone mechanizmy eliminacji autoreaktywnych
limfocytów zarówno w mechanizmie delecji klonalnej jak
i inaktywacji klonalnej
duża liczba autoreaktywnych limfocytów, szeroki zakres
ich swoistości
częste zmiany w składzie subpopulacji limfocytów
obwodowych i ich uogólniony defekt funkcjonalny
zaburzenia w zakresie produkcji immunoglobulin:
hypergammaglobulinemia lub dysimmunoglobulinemia
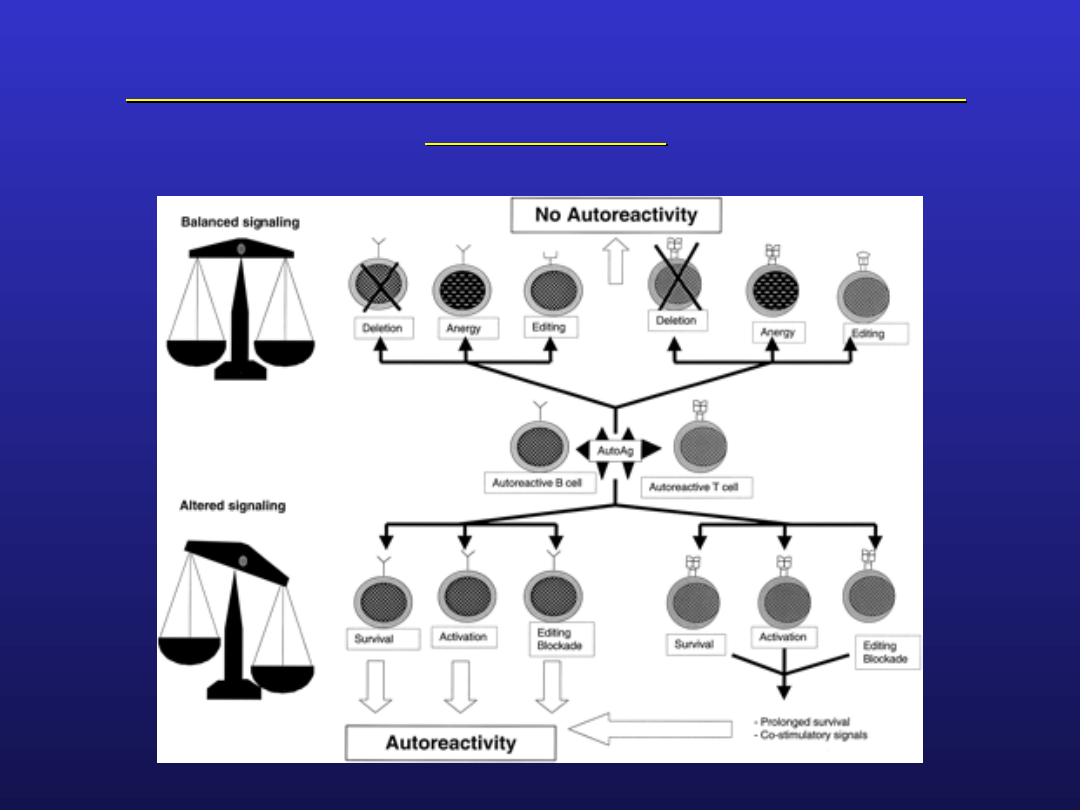
Zaburzenia immunologiczne w chorobach
Zaburzenia immunologiczne w chorobach
układowych
układowych
Zaburzenia immunologiczne w chorobach
Zaburzenia immunologiczne w chorobach
układowych
układowych
zależne od autoantygenów i poziomu ich ekspresji
są nimi najczęściej struktury jądra komórkowego,
chromatyny, cytoplazmy, błon komórkowych wielu
typów komórek, obecnych w różnych tkankach i
narządach
zazwyczaj wysoki poziom i zakres wykrywanych
autoprzeciwciał

Zaburzenia immunologiczne w chorobach
Zaburzenia immunologiczne w chorobach
narządowo swoistych
narządowo swoistych
stymulacja autoreaktywnych limfocytów przez antygeny
o swoistości tkankowej – przykłady:
choroba Graves Basedowa – przeciwciała przeciwko
receptorowi dla TSH
zapalenie tarczycy typu Hashimoto – przeciwciała
przeciwko peroksydazie tarczycy
cukrzyca typu 1 – przeciwciała przeciwko insulinie
Mechanizmy efektorowe w chorobach
Mechanizmy efektorowe w chorobach
autoimmunologicznych
autoimmunologicznych
uszkodzenie tkanek powstaje wskutek działania różnych
komórek efektorowych, stymulowanych przez
autoantygeny
proces ma charakter przewlekły ze względu na stałą
stymulację przez autoantygeny, pojawiające się w
trakcie choroby
wyjąte
k
cukrzyca t.
1
całkowite zniszczenie komórek β wysp trzustkowych →
ustanie produkcji insuliny, najważniejszego
autoantygenu w chorobie

Mechanizmy efektorowe w chorobach
Mechanizmy efektorowe w chorobach
autoimmunologicznych
autoimmunologicznych
są takie same jak w przypadku odpowiedzi
immunologicznej indukowanej przez antygeny obce
(bakterie, wirusy, grzyby, pasożyty)
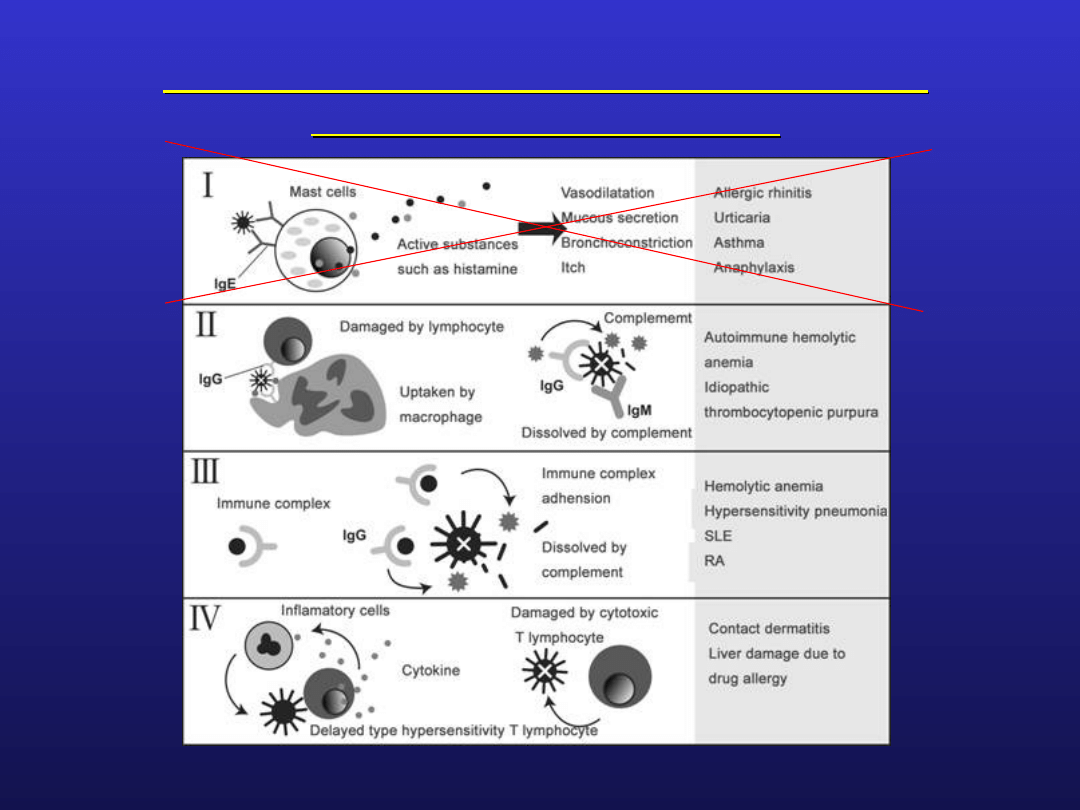
klasyfikuje się je zgodnie z podziałem Gella-Coombsa:
typu II – cytotoksyczny
typ III – kompleksów immunologicznych
typ IV – komórkowy
Typ I związany z działaniem przeciwciał klasy IgE nie biorą
istotnego udziału w reakcjach autoimmunologicznych
Mechanizmy efektorowe w chorobach
Mechanizmy efektorowe w chorobach
autoimmunologicznych
autoimmunologicznych
Mechanizmy efektorowe w chorobach
Mechanizmy efektorowe w chorobach
autoimmunologicznych – reakcja typu II
autoimmunologicznych – reakcja typu II

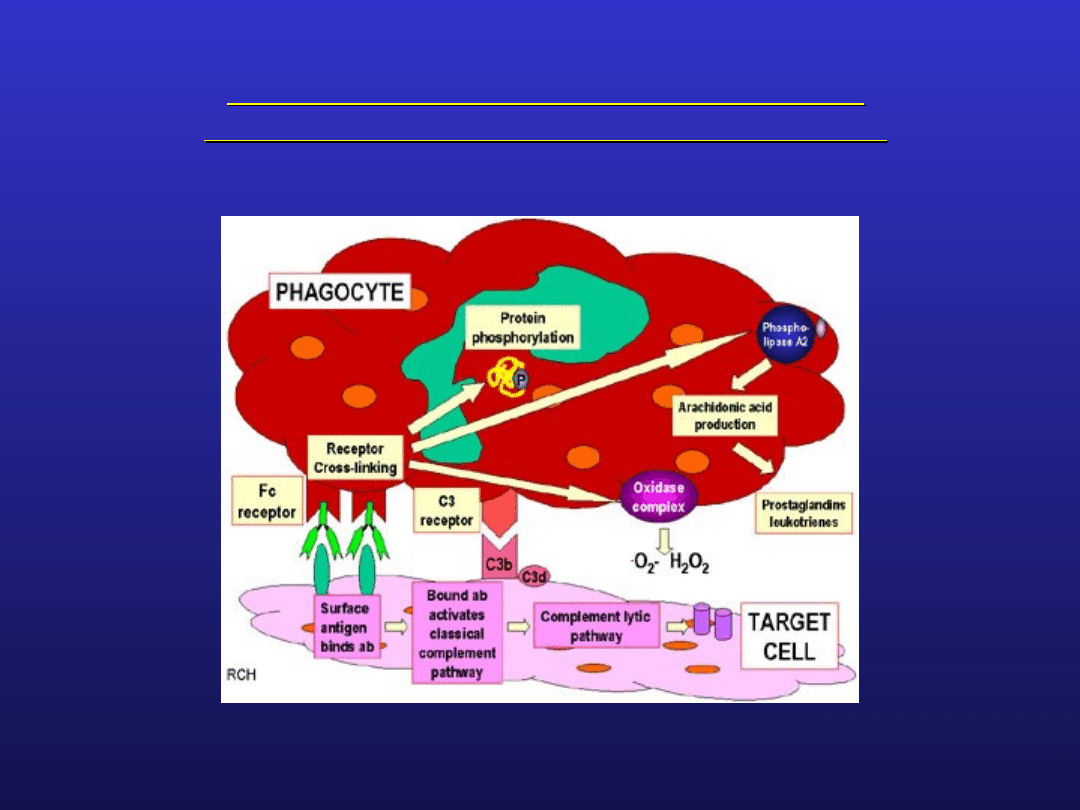
Uszkodzenie komórek następuje wskutek:
fagocytozy z udziałem granulocytów i makrofagów
efektu litycznego dopełniacza
cytotoksyczności zależnej od przeciwciał (ADCC)
Mechanizmy efektorowe w chorobach
Mechanizmy efektorowe w chorobach
autoimmunologicznych – reakcja cytotoksyczna
autoimmunologicznych – reakcja cytotoksyczna
typu II
typu II
Mechanizmy efektorowe w chorobach
Mechanizmy efektorowe w chorobach
autoimmunologicznych – reakcja typu III – z
autoimmunologicznych – reakcja typu III – z
udziałem kompleksów immunologicznych
udziałem kompleksów immunologicznych

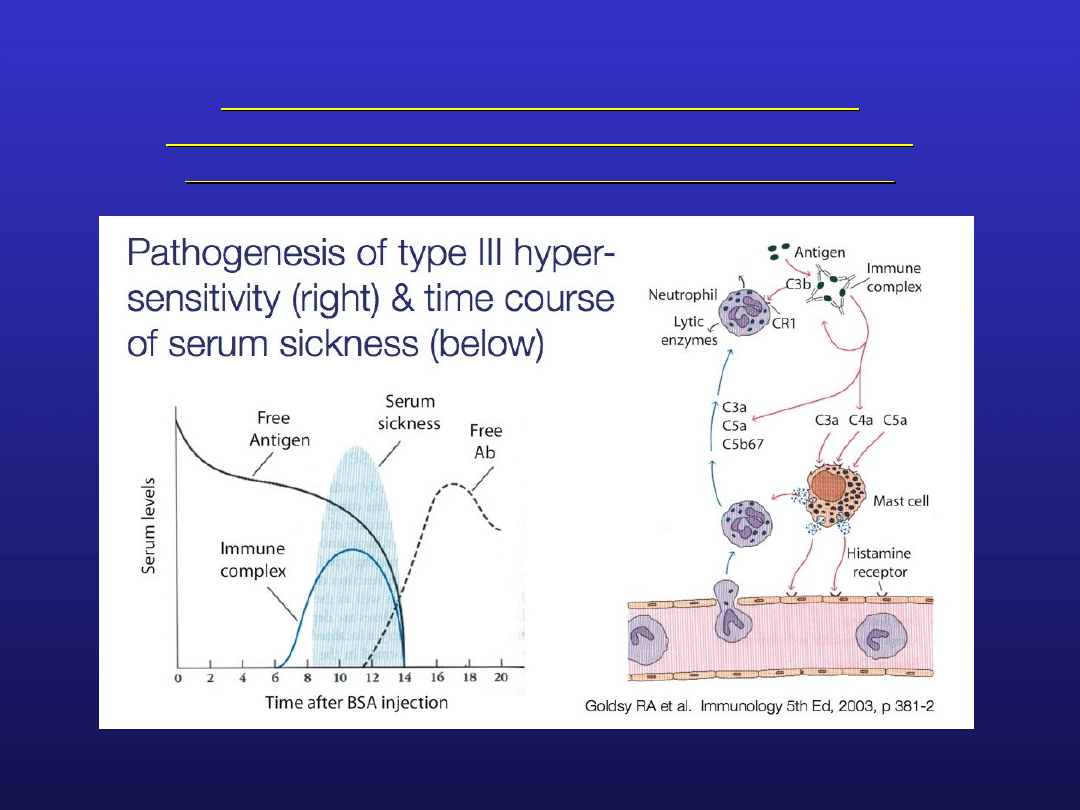
w warunkach fizjologicznych powstają duże, trudno
rozpuszczalne kompleksy antygen – przeciwciało, w
sytuacji nadmiaru przeciwciał w stosunku do antygenu i
szybko są eliminowane w różnych mechanizmach
efekt patogenny wywołany przez małe rozpuszczalne
kompleksy antygen – przeciwciało, powstające w
sytuacji nadmiaru antygenu w stosunku do
przeciwciała; odkładają się one w śródbłonku drobnych
naczyń w różnych tkankach (płuca, nerki, serce,
wątroba, siatkówka, stawy, skóra) i uruchamiają reakcje
cytotoksyczne, doprowadzające do uszkodzenia
narządów
odgrywa ważną rolę w patogenezie SLE, reumatoidalne
zapalenie stawów
Mechanizmy efektorowe w chorobach
Mechanizmy efektorowe w chorobach
autoimmunologicznych – reakcja typu III – z
autoimmunologicznych – reakcja typu III – z
udziałem kompleksów immunologicznych
udziałem kompleksów immunologicznych

zależy od antygenowo swoistych limfocytów T
faza indukcyjna: antygen prezentowany limfocytom Th
przez komórki prezentujące antygen (APC), w
kontekście odpowiednich antygenów zgodności
tkankowej klasy II (HLA-DR)
faza efektorowa: realizowana przez cytotoksyczne
limfocyty Tc (CD8+)
Mechanizmy efektorowe w chorobach
Mechanizmy efektorowe w chorobach
autoimmunologicznych – reakcja komórkowa typu
autoimmunologicznych – reakcja komórkowa typu
IV
IV

mechanizmy efektorowa w chorobach
autoimmunologicznych są bardzo skomplikowane i
obejmują najczęściej zarówno reakcje humoralne (t. II i
III) oraz komórkowe (t. IV)
Mechanizmy efektorowe w chorobach
Mechanizmy efektorowe w chorobach
autoimmunologicznych
autoimmunologicznych
efektem klinicznym reakcji efektorowych jest stan
zapalny tkanek i narządów
stan zapalny ma charakter przewlekły
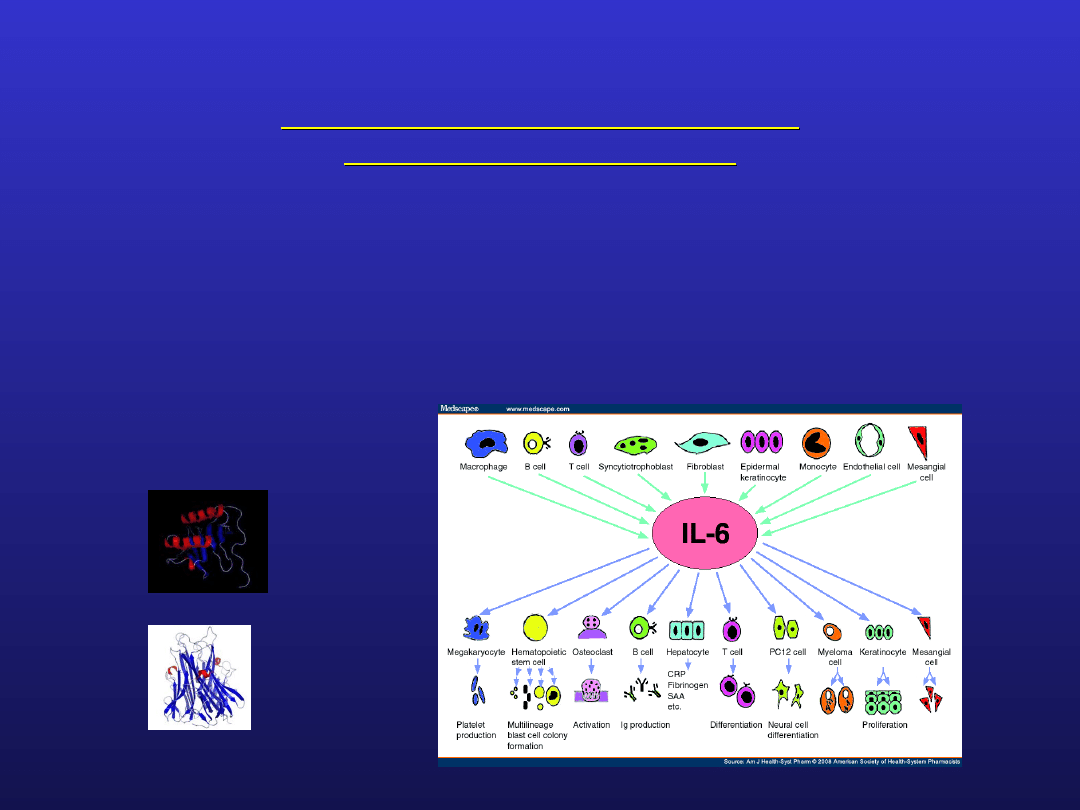
bardzo ważną rolę odgrywają cytokiny prozapalne:
interleukina 1
interleukina 6
TNF α
Proces zapalny w w chorobach
Proces zapalny w w chorobach
autoimmunologicznych
autoimmunologicznych
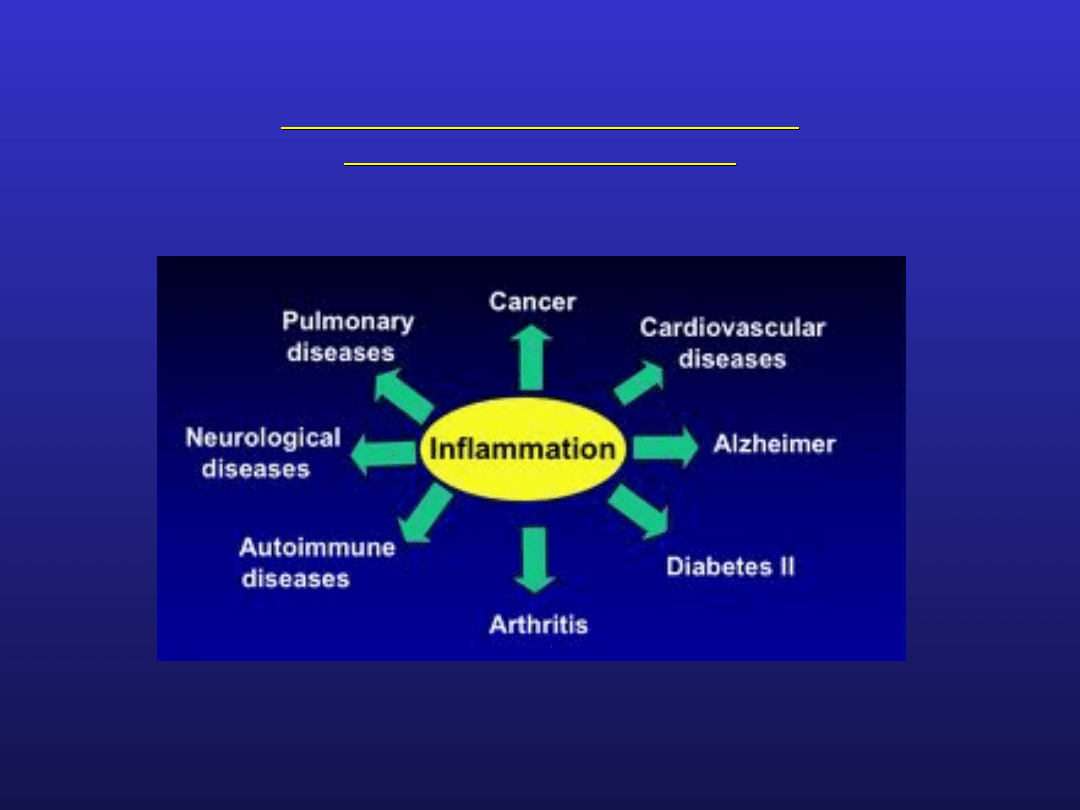
Proces zapalny w w chorobach
Proces zapalny w w chorobach
autoimmunologicznych
autoimmunologicznych
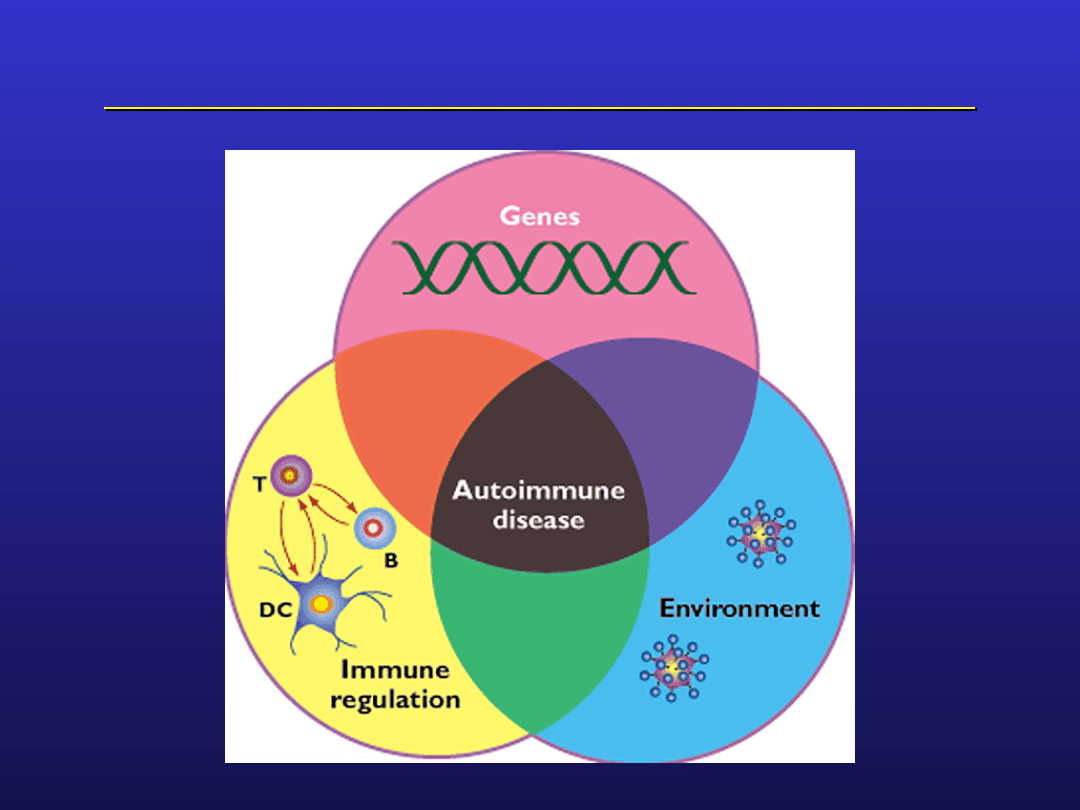
Patogeneza chorób autoimmunologicznych
Patogeneza chorób autoimmunologicznych

Czynniki genetyczne w patogenezie chorób
Czynniki genetyczne w patogenezie chorób
autoimmunologicznych
autoimmunologicznych
wpływają na ekspresję chorób autoagresyjnych
znane tylko nieliczne geny, wpływające na indukcję i
przebieg chorób
udowodniony wpływ genów:
związanych z głównym układem zgodności tkankowej
(HLA)
kontrolujących ekspresję receptorów komórkowych i
cytokin o funkcjach regulacyjnych
Innych nie związanych bezpośrednio z kontrolą
reaktywności układu odpornościowego
Czynniki genetyczne w patogenezie chorób
Czynniki genetyczne w patogenezie chorób
autoimmunologicznych
autoimmunologicznych
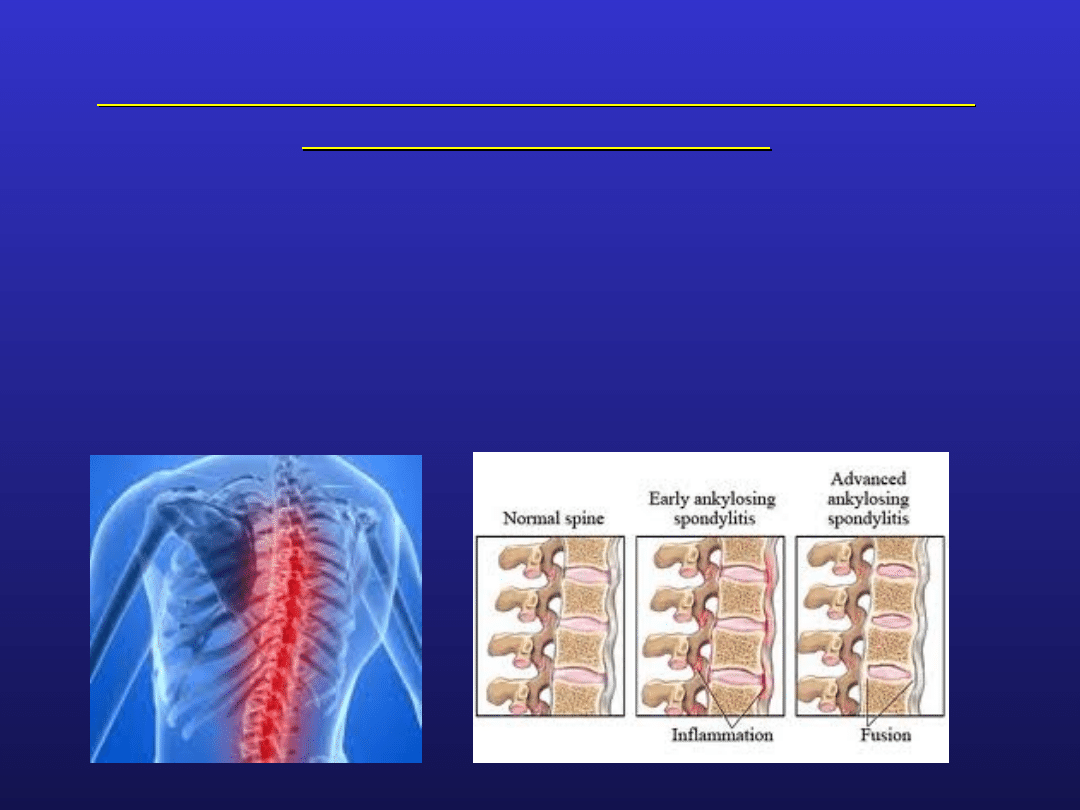
najsilniejsza udowodniona asocjacja: HLA B27 i
zesztywniające zapalenie stawów kręgosłupa
u 90% osób rasy białej z rozpoznanym zesztywniającym
zapaleniem stawów kręgosłupa wykazano ekspresję
HLA B27
wśród osób zdrowych tylko 9% jest nosicielem HLA B27

Czynniki genetyczne w patogenezie chorób
Czynniki genetyczne w patogenezie chorób
autoimmunologicznych
autoimmunologicznych
Choroba
Antygen HLA
Względne
ryzyko
Stwardnienie
rozsiane
DR2
4.0
Toczeń
rumieniowaty
układowy
DR2
DR3
3.0
3.0
Miastenia
DR3
3.0
Reumatoidalne
zapalenie stawów
DR4
6.0
Wole Hashimoto
DR5
3.0
Cukrzyca
insulinozależna
Heterozygota
DR3/DR4
2.0 – 5.0
Związek alleli HLA-DR z wybranymi chorobami
autoimmunizacyjnymi

Inne czynniki wpływające na częstość
Inne czynniki wpływające na częstość
zachorowania na choroby
zachorowania na choroby
autoimmunizacyjne
autoimmunizacyjne
Płeć
Płeć
Choroba
Kobiety : mężczyźni
Reumatoidalne zapalenie
stawów
3:1
Toczeń rumieniowaty
układowy
4:1
Zespół Sjögrena
1:1
Zapalenie
wielomięśniowo-skórno-
mięśniowe
2:1
Zesztywniające zapalenie
stawów kręgosłupa
1:1
częstość schorzeń autoimmunologicznych wzrasta z
wiekiem; szczyt zachorowań występuje między 20-40
rokiem życia
Czynniki środowiskowe
Czynniki środowiskowe
Wpływ infekcji na indukcję chorób
Wpływ infekcji na indukcję chorób
autoimmunologicznych
autoimmunologicznych
stymulacja autoreaktywnych limfocytów T i B może
następować w różnych mechanizmach:
mimikra molekularna
działanie superantygenów bakteryjnych i wirusowych
wzmożona prezentacja autoantygenów autoreaktywnym
limfocytom T przez komórki prezentujące antygen
(APC)
proliferacja limfocytów autoreaktywnych poprzez
stymulację czynnikami wzrostowymi, wytwarzanymi w
miejscu infekcji
aktywacja limfocytów autoreaktywnych przez wirusy
limfocytotropowe

Choroby autoimmunologiczne – klasyfikacja
Choroby autoimmunologiczne – klasyfikacja
patogenetyczna
patogenetyczna
w oparciu o kryteria kliniczne:
choroby układowe – dotyczą wielu narządów (np. toczeń
układowy)
choroby narządowo swoiste – proces chorobowy dotyczy
jednego narządu (np. cukrzyca t. 1)
w oparciu o kryteria immunologiczne
uogólniony defekt limfocytów w zakresie ich selekcji,
funkcji efektorowych i regulacyjnych (choroby
układowe)
nieprawidłowa odpowiedź limfocytów tylko w
odniesieniu do określonych autoantygenów (w
chorobach swoistych narządowo)

Choroby autoimmunologiczne – manifestacja
Choroby autoimmunologiczne – manifestacja
kliniczna
kliniczna
mogą występować pojedynczo lub w kombinacji (np.
toczeń układowy i zespół Sjögrena, cukrzyca t.1 i wole
Hashimoto)
manifestacje narządowe mogą być elementem choroby
układowej, np. anemia autoimmunohemolityczna w
toczniu układowym
zakres ekspresji klinicznej zależy od czynników
genetycznych i środowiskowych, zarówno endogennych
jak i egzogennych
Choroby autoimmunologiczne
Choroby autoimmunologiczne

Choroby autoimmunologiczne - rozpoznanie
Choroby autoimmunologiczne - rozpoznanie
Oznaki ogólne:
podwyższone stężenie gamma-globulin
obecność różnych autoprzeciwciał
obniżone stężenie dopełniacza w surowicy
kompleksy immunologiczne w surowicy
Obniżony odsetek i/lub liczba bezwzględna limfocytów
Ts
wykrywanie uszkodzeń w biopsji, np. wskutek
odkładania kompleksów immunologicznych

Choroby autoimmunologiczne - rozpoznanie
Choroby autoimmunologiczne - rozpoznanie
testy diagnostyczne do wykrywania przeciwciał
swoistych wobec określonego antygenu związanego z
chorobą autoimmunologiczną
u jednego chorego może występować więcej niż jeden
rodzaj przeciwciał, np. w przypadku równoczasowego
występowania kilku chorób autoimmunologicznych (np.
ok. 50% osób z zespołem Sjögrena cierpi na RZS)
wielorakie przeciwciała
autoprzeciwciała nie występują wyłącznie w chorobach
autoimmunizacyjnych – przeciwciała jądrowe można
wykrywać w gruźlicy, histoplazmozie, chłoniakach
złośliwych i innych nowotworach

Rodzaje autoprzeciwciał
Rodzaje autoprzeciwciał
przeciwjądrowe (ANA)
przeciw cytoplazmie granulocytów (ANCA)
przeciw mięśniom gładkim (SMA)
przeciwmitochondrialne (AMA)
przeciw mikrosomom nerki i wątroby (LKM)
przeciw mikrosomom tarczycy
przeciwtyreoglobulinowe
przeciw komórkom nadnerczy
przeciw retikulinie
przeciw endomysium
przeciw komórkom jajnika
przeciw plemnikom
przeciw komórkom beta wysp trzustkowych
przeciw ds DNA

Znaczenie diagnostyczne ANA
Znaczenie diagnostyczne ANA
występują w wielu chorobach autoimmunologicznych
czułość najczęściej wysoka, swoistość niska
występują u 15% zdrowej populacji dziecięcej
mogą pojawić się w przebiegu przewlekłych infekcji (np.
EBV, HCV), nowotworów
ich produkcja może być indukowana przez niektóre leki
(np. hydralazyna)
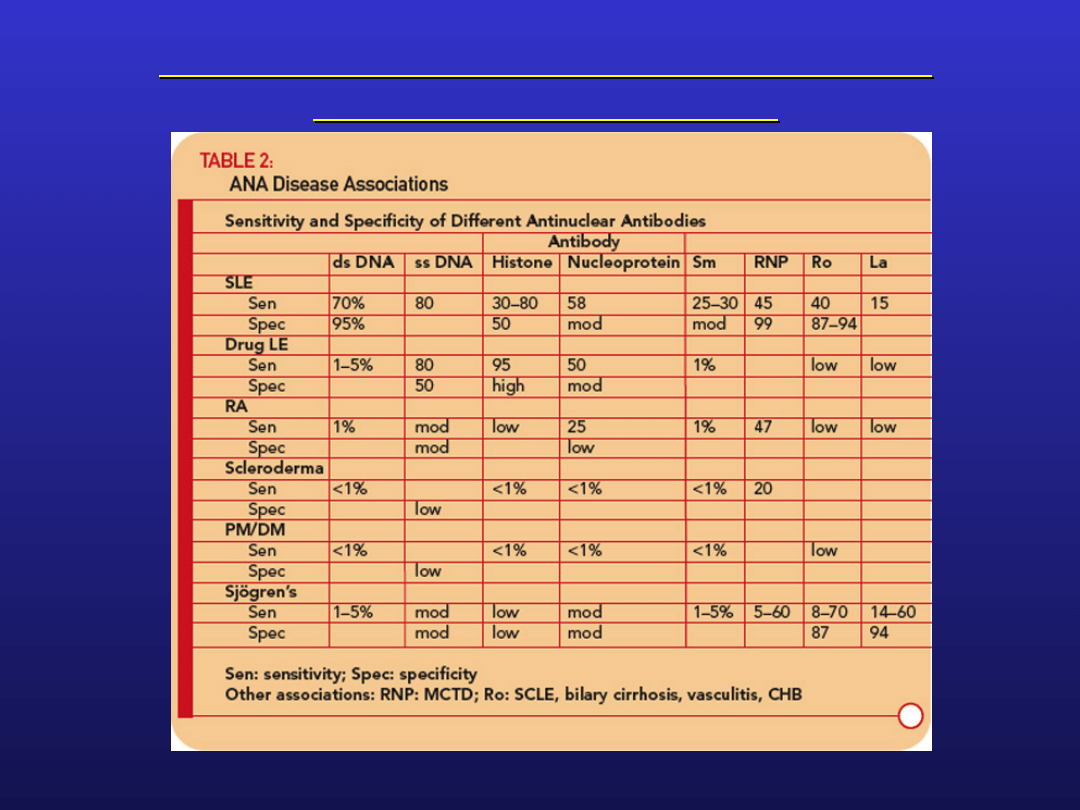
Czułość i swoistość przeciwciał ANA w
Czułość i swoistość przeciwciał ANA w
chorobach układowych
chorobach układowych

Młodzieńcze idiopatyczne zapalenie stawów
Młodzieńcze idiopatyczne zapalenie stawów
najczęstsza przewlekła artropatia zapalna
rozpoczyna się przed 16 rokiem życia, trwa co najmniej
6 tygodni
warunkiem rozpoznania – wykluczenie innych przyczyn
zapalenia stawów
częstość zachorowań 80-100/100 000 dzieci
częściej występuje u dziewcząt
udowodnione znaczenie czynników infekcyjnych w
załamaniu autotolerancji
wpływ czynników genetycznych i środowiskowych
najważniejsze czynniki podtrzymujące zapalenie : TNF
alfa i interleukina 1
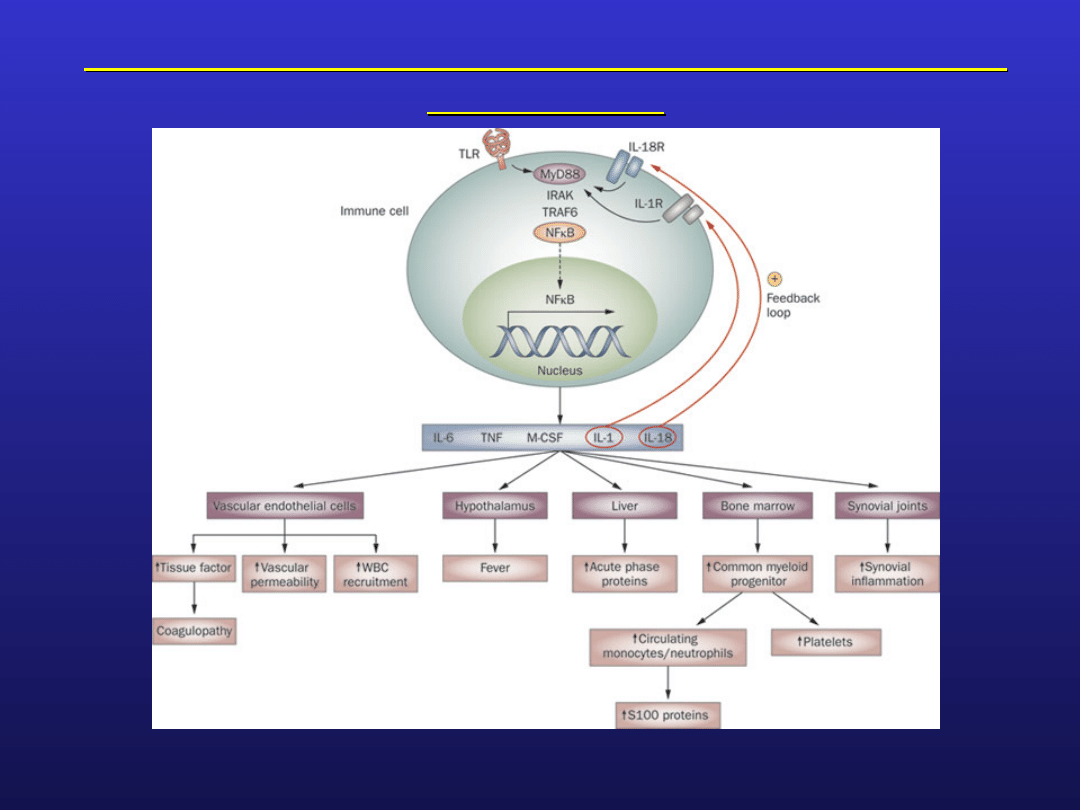
Młodzieńcze idiopatyczne zapalenie stawów -
Młodzieńcze idiopatyczne zapalenie stawów -
patogeneza
patogeneza
E D. Mellins, C. Macaubas & Alexei A. Grom: Nature Reviews Rheumatology 7, 416-426
(July 2011)
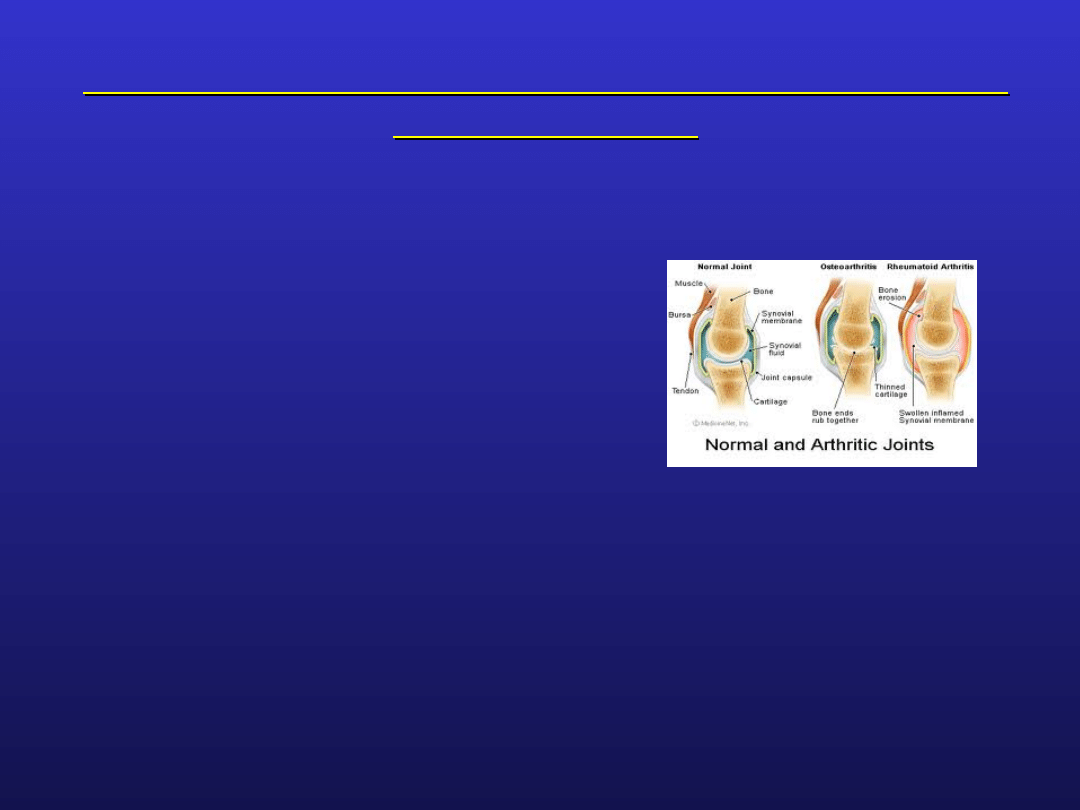
Młodzieńcze idiopatyczne zapalenie stawów –
Młodzieńcze idiopatyczne zapalenie stawów –
obraz kliniczny
obraz kliniczny
cecha wspólna - zapalenie stawów, powodujące:
bolesność
wysięk
obrzęk
ograniczenie ruchomości
zniekształcenia
zaniki mięśniowe
charakterystyczna, choć u dzieci trudna do stwierdzenia
sztywność poranna
podstawowa zmiana morfologiczna: przerost błony
maziowej, nacieki zapalne, martwica włóknikowata
w późniejszym okresie wytwarza się łuszczka,
uniemożliwiająca odżywianie chrząstki, a w efekcie –
zniszczenie stawu
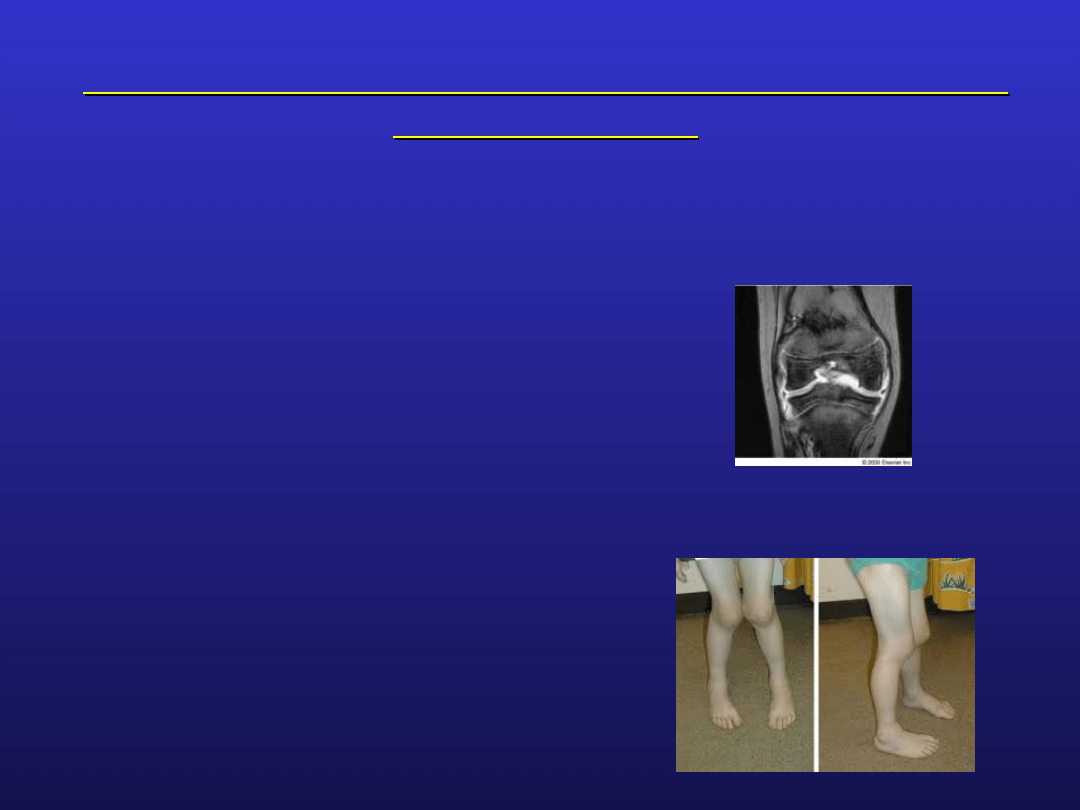
Młodzieńcze idiopatyczne zapalenie stawów –
Młodzieńcze idiopatyczne zapalenie stawów –
obraz kliniczny
obraz kliniczny
wczesny okres choroby:
w obrazie radiologicznym obrzęk tkanek miękkich i
osteoporoza przystawowa
zaawansowana choroba
zwężenie szpar stawowych
obecność geod zapalnych
obecność nadżerek
zniekształcenia stawów do zrostów włącznie (ankyloza)
dla wieku rozwojowego typowe zaburzenia rozwojowe
wydłużenie
lub zahamowanie wzrostu kości

Młodzieńcze idiopatyczne zapalenie stawów –
Młodzieńcze idiopatyczne zapalenie stawów –
postacie kliniczne
postacie kliniczne
MIZS o początku uogólnionym (hektyczna gorączka,
nawracające polimorficzne gorączki, powiększenie
wątroby, śledziony, węzłów chłonnych, zapalenie błon
surowiczych); zmiany dotyczą najczęściej wielu stawów,
wysokie wykładniki stanu zapalnego, głęboka
niedokrwistość (ok. 15% dzieci)
MIZS o początku wielostawowym – zapalenie co
najmniej 5 stawów
serododatnia – z obecnością czynnika reumatoidalnego
(RF) – rzadka u dzieci (ok. 5%)
seroujemna – bez obecności RF – ok. 20% dzieci
MIZS o początku z zajęciem niewielu stawów (< 5) –
niskie wykładniki stanu zapalnego, proces zapalny
dotyczy zazwyczaj dużych stawów, niesymetrycznie;
najczęstsza postać u dzieci (ok. 50%)
łuszczycowe zapalenie stawów
zapalenie stawów z towarzyszącym zapaleniem
przyczepów stawowych
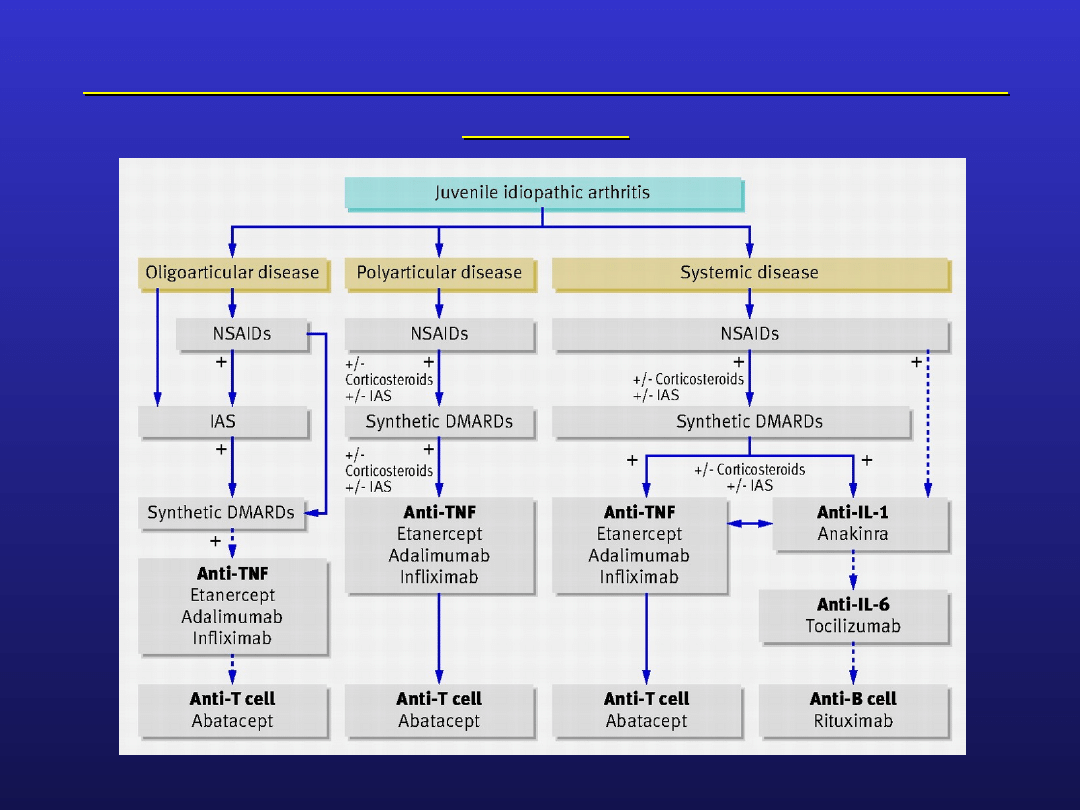
Młodzieńcze idiopatyczne zapalenie stawów –
Młodzieńcze idiopatyczne zapalenie stawów –
leczenie
leczenie
BMJ 2010; 341
intraarticular corticosteroid (IAS)
synthetic disease-modifying
antirheumatic drugs, DMARDs
Methotrexate
Leflunomide
Sulfasalazine
biological therapy
Młodzieńcze idiopatyczne zapalenie stawów –
Młodzieńcze idiopatyczne zapalenie stawów –
leczenie
leczenie
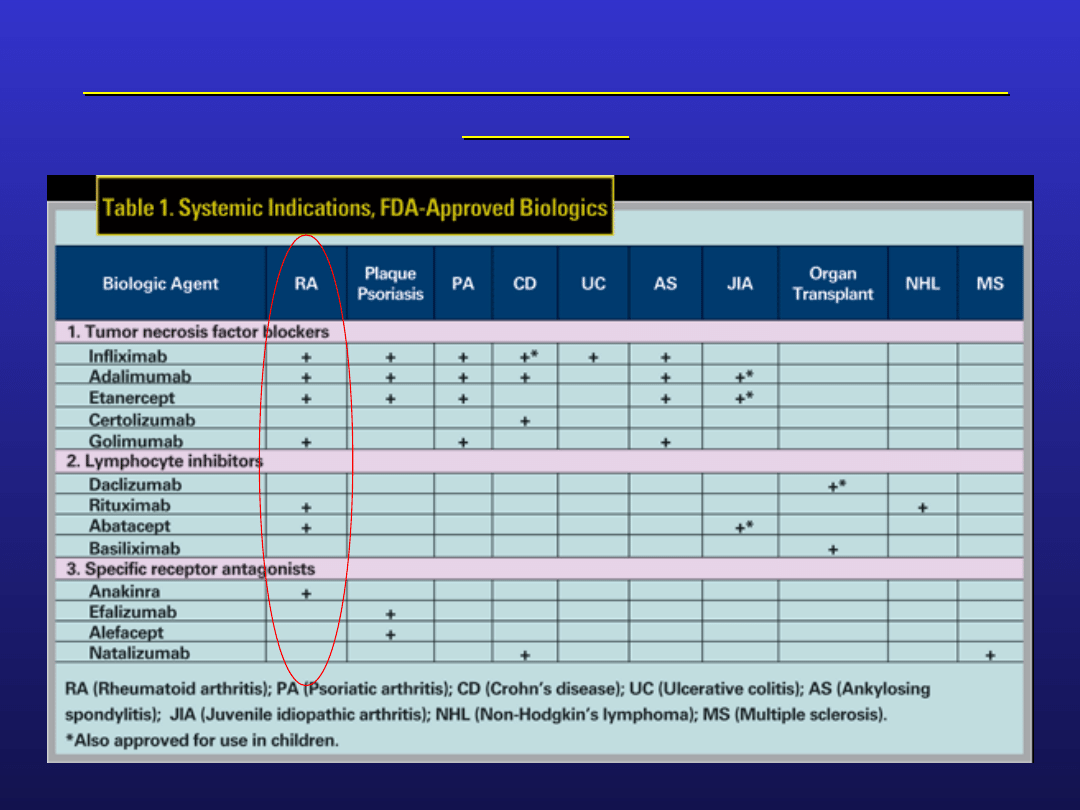
Młodzieńcze idiopatyczne zapalenie stawów –
Młodzieńcze idiopatyczne zapalenie stawów –
leczenie
leczenie
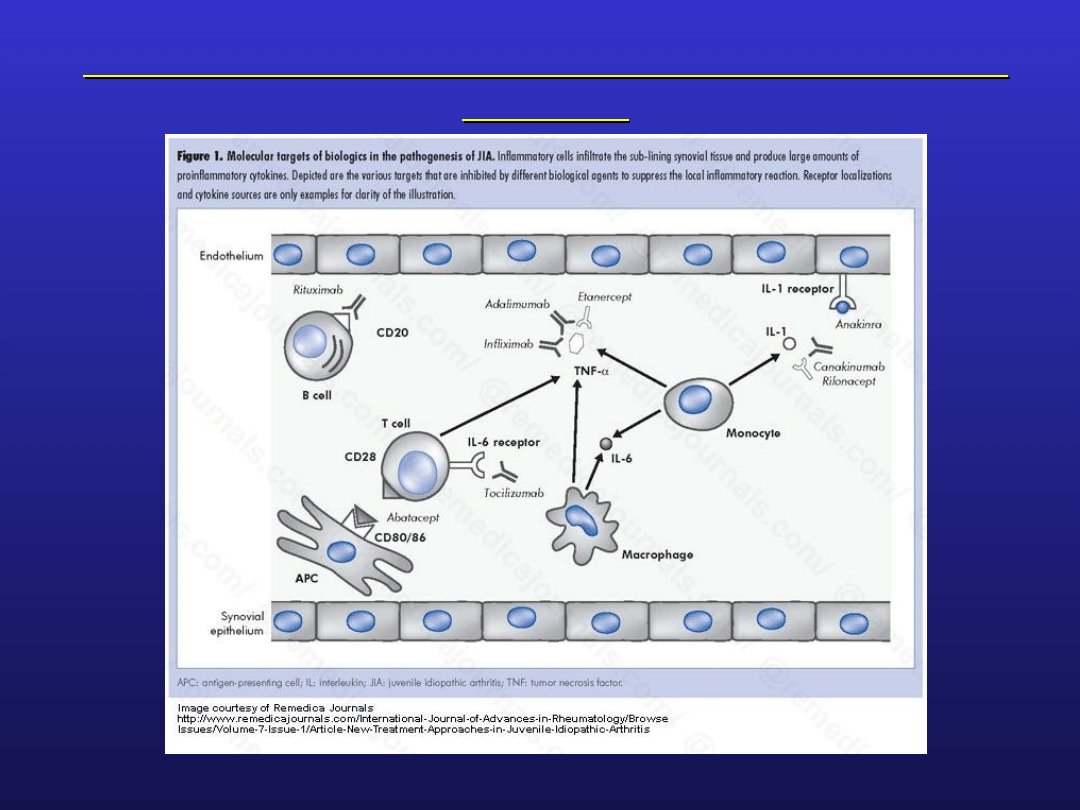
Int J Adv Rheumatol 2009;7(1):1–9
Młodzieńcze idiopatyczne zapalenie stawów –
Młodzieńcze idiopatyczne zapalenie stawów –
leczenie
leczenie
Toczeń rumieniowaty układowy
Toczeń rumieniowaty układowy
charakteryzuje się uogólnionym zapaleniem naczyń i
uszkodzeniem wielu narządów
dotyczy głównie młodych kobiet w wieku rozrodczym
wśród ogółu chorych 5 – 10% dotyczy wieku
rozwojowego
przyczyną śmierci jest najczęściej niewydolność nerek
lub ciężkie zakażenie u chorych w immunosupresji
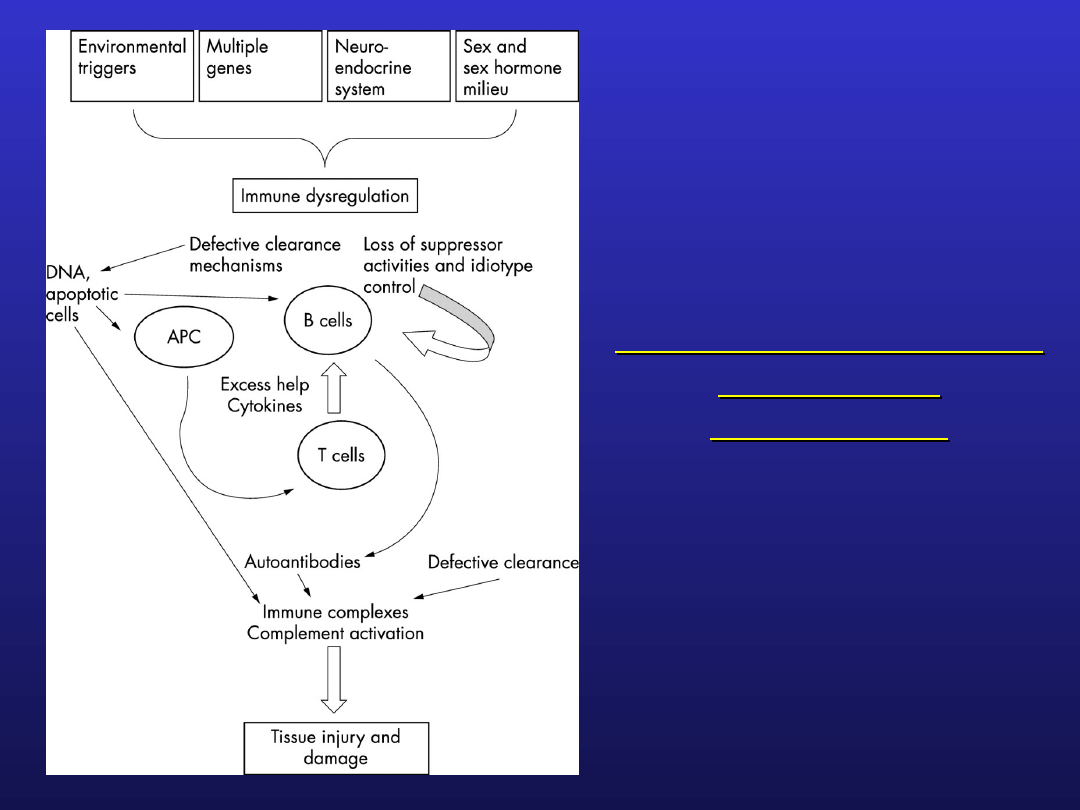
Toczeń rumieniowaty
Toczeń rumieniowaty
układowy -
układowy -
patogeneza
patogeneza
J Clin Pathol 2003;56:481-490

Toczeń rumieniowaty układowy
Toczeń rumieniowaty układowy
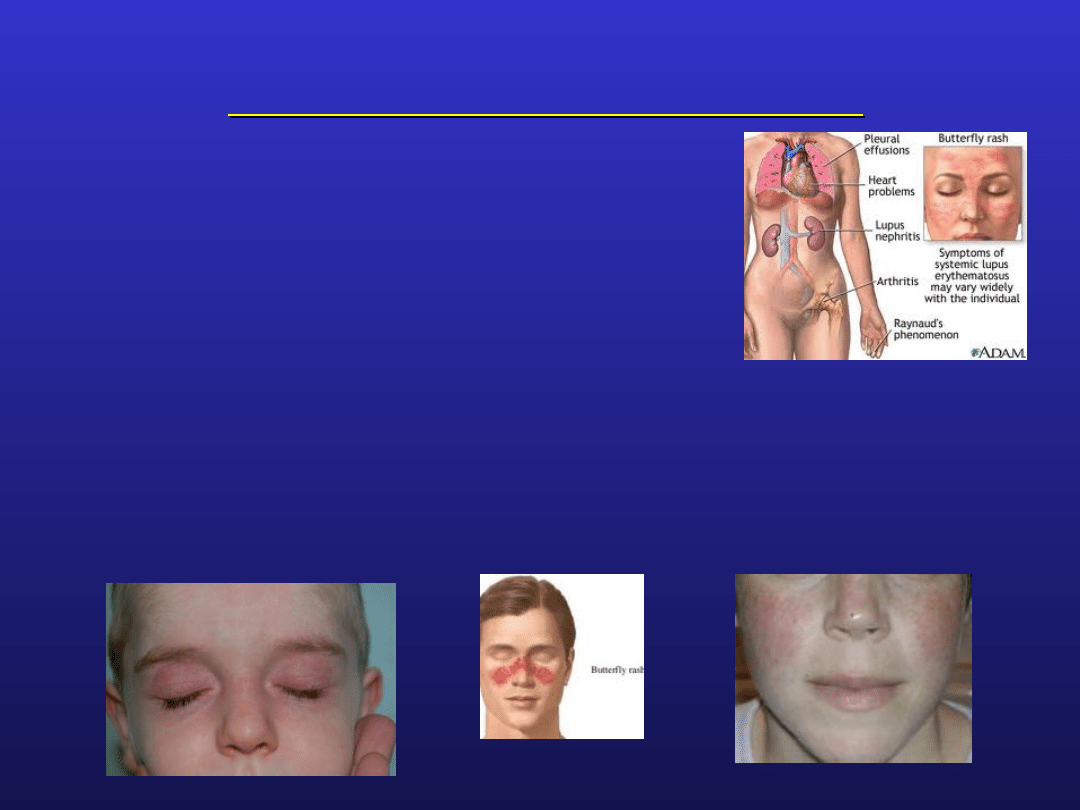
Toczeń rumieniowaty układowy
Toczeń rumieniowaty układowy
objawy ogólne
złe samopoczucie
gorączka
senność
utrata masy ciała
objawy narządowe dotyczą skóry, śluzówek, nerek,
mózgu, układu krążenia
najbardziej typowy objaw skórny: rumień motylowaty –
rumieniowata wysypka na nosie i policzkach,
przyjmująca kształt motyla
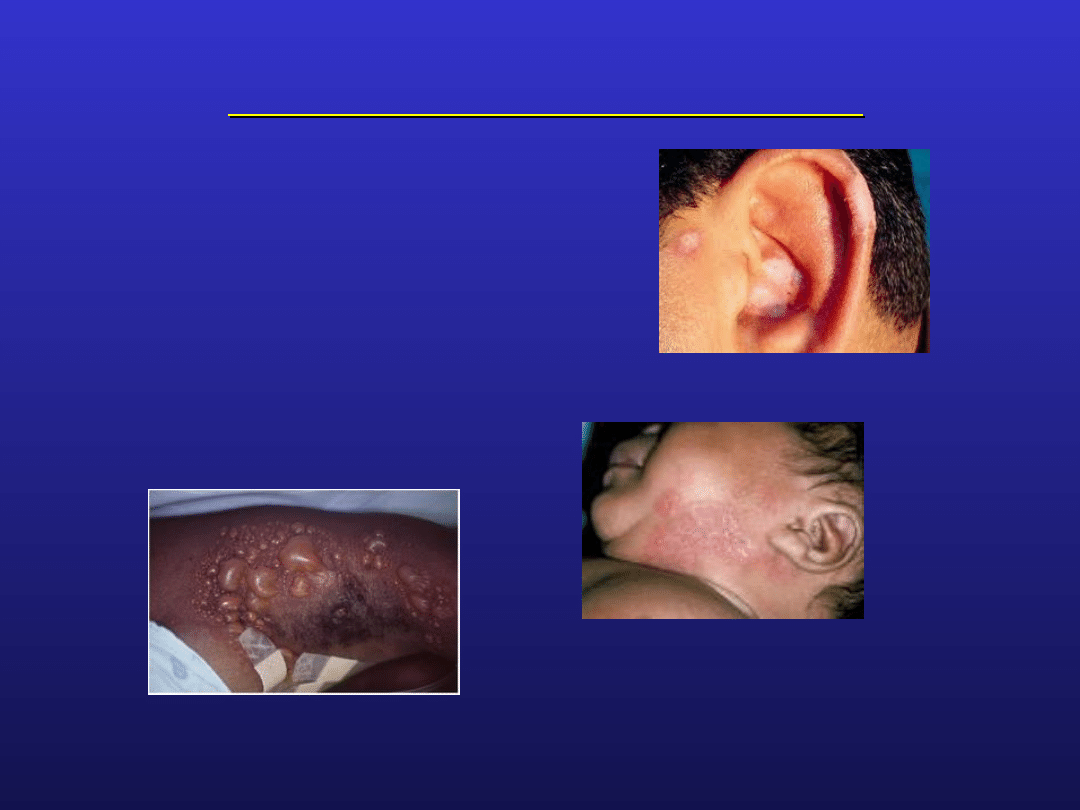
Toczeń rumieniowaty układowy
Toczeń rumieniowaty układowy
inne uszkodzenia skóry
krążkowe
Łuszczycowate
grudkowo-plamiste
pęcherzowe
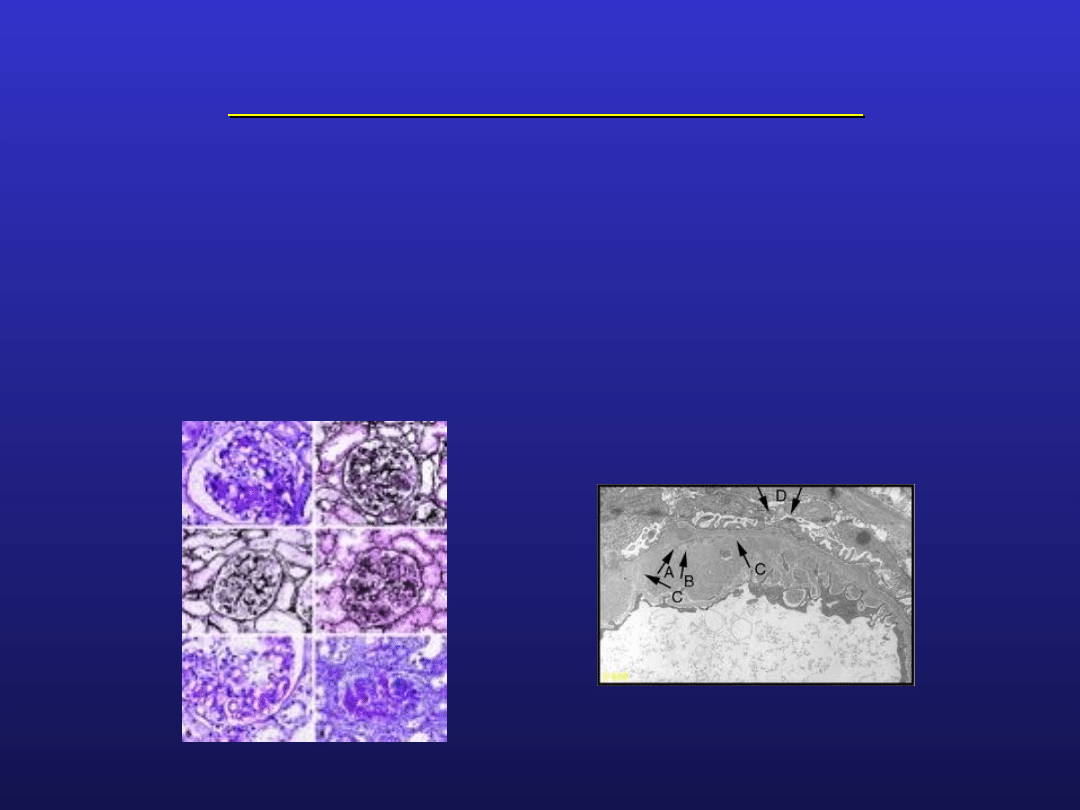
Toczeń rumieniowaty układowy
Toczeń rumieniowaty układowy
u 50% chorych zajęte są nerki
rozsiane rozrostowe zapalenie kłębuszków nerkowych
błoniaste zapalenie kłębuszków nerkowych
uszkodzenie nerek jest głównym czynnikiem
determinującym przeżycie chorych

Toczeń rumieniowaty układowy
Toczeń rumieniowaty układowy
u 50% chorych występują objawy ze strony OUN
depresja
psychozy
napady padaczki – charakterystyczne dla młodzieńczego
TRU; występują częściej niż u dorosłych
neuropatie czuciowo-ruchowe
leukopenia
obniżenie aktywności hemolitycznej dopełniacza
obecność przeciwciał przeciwjądrowych
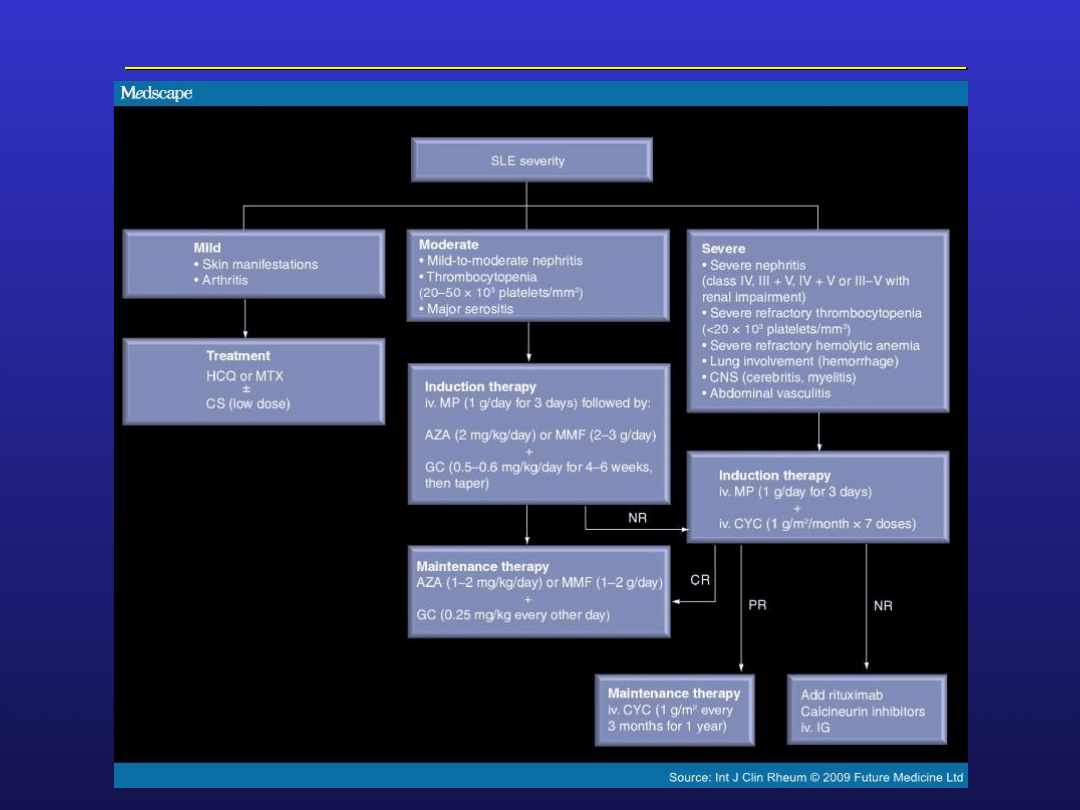
Toczeń rumieniowaty układowy - leczenie
Toczeń rumieniowaty układowy - leczenie
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
- Slide 40
- Slide 41
- Slide 42
- Slide 43
- Slide 44
- Slide 45
- Slide 46
- Slide 47
- Slide 48
- Slide 49
- Slide 50
- Slide 51
- Slide 52
- Slide 53
- Slide 54
- Slide 55
- Slide 56
- Slide 57
- Slide 58
Wyszukiwarka
Podobne podstrony:
Choroby układowe tkanki łącznej
CHOROBY UKŁADOWE TKANKI ŁĄCZNEJ, INTERNA, reumatologia
Choroby układowe tk łącznej pediatria
Choroby kolagenowe tkanki łacznej
Układowe choroby tkanki łącznej, Pediatria
Zajęcie układu oddechowego w przebiegu układowych chorób tkanki łącznej, INTERNA, reumatologia
Zmiany w ukł odd w przebiegu układowych chorób tkanki łącznej, INTERNA, reumatologia
Układowe choroby tkanki łącznej
choroby tkanki lacznej
Diagnostyka chorob tkanki lacznej studenci ppt
Przewlekłe choroby tkanki łącznej, MEDYCYNA i RATOWNICTWO, Pediatria
Diagnostyka chorób tkanki łącznej, dermatologia
Kolagenozy - choroby tkanki łącznej, Dermatologia
wrodzone choroby tkanki łącznej(w tym z ł Ehlersa Danlosa)
Immunopatogeneza chorób tkanki łącznej
więcej podobnych podstron