1
Równowaga
ciecz - para
w układach
dwuskładnikow
ych
(b)
Waldemar Ufnalski
Wprowadzenie do termodynamiki
chemicznej
Wykład 12b
25
50
75
100
0,00
0,25
0,50
0,75
1,00
x
B
, y
B
P
/T
r
A
B
c + g
g
P*
A
P*
B
c + g

2
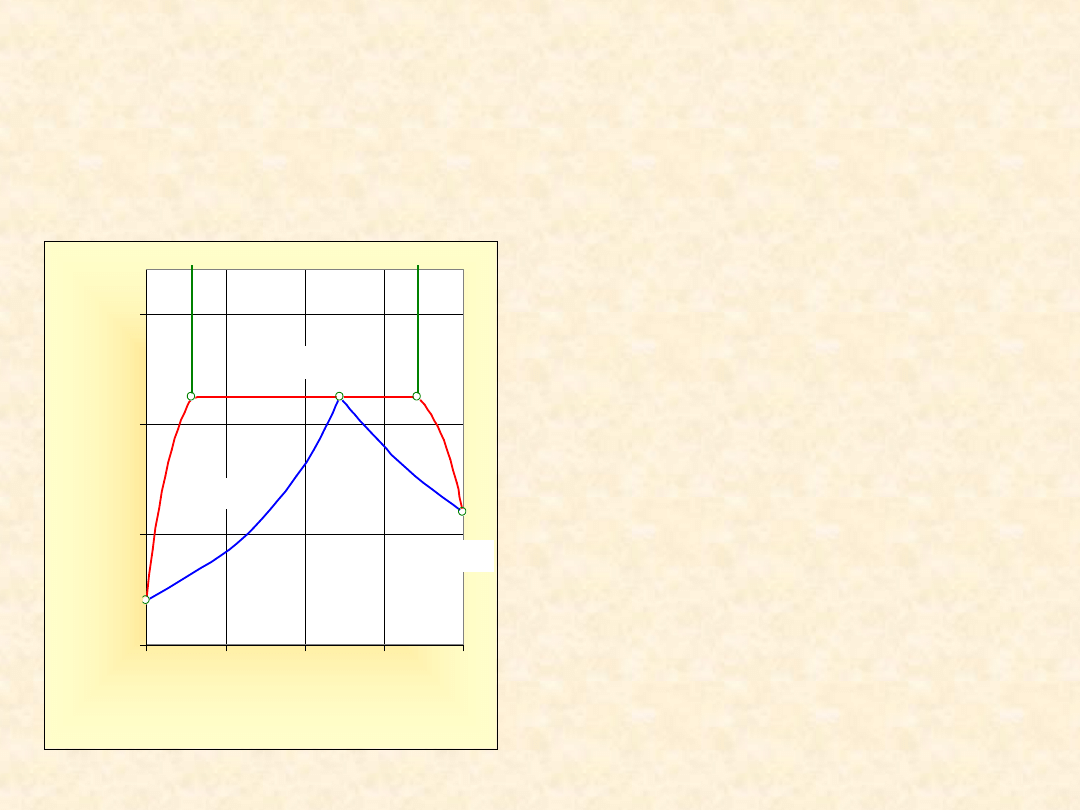
12.4. Układy rzeczywiste
z nieograniczoną
mieszalnością w fazie
ciekłej
Wykład 12b
3
Układ rzeczywisty (T =
const)...
Czysty B
(g)
P
*B
Czysty B
(c)
P
*B
Czysty B
(c)
P
B
(g)
w parze nad
roztworem P, y
B
B
(c)
w roztworze
P, x
B
T=co
nst
B
(
4)
B
(
3)
B
(
2)
B
(
1)
B
(
5)

4
Układ rzeczywisty (T =
const)...
0
2
B
0
5
B
*
ln
B
B
B
f
f
RT
1
B
B
a
RTln
4
*
*
B
B
B
P
P
V
3
Przeniesienie składnika B między
fazami będącymi w stanie równowagi
Izotermiczna zmiana
ciśnienia gazu rzeczywistego
Izotermiczne przeniesienie
do roztworu rzeczywistego
Izotermiczna zmiana
ciśnienia substancji ciekłej
Bilans:
0
1
5
4
3
2
B
B
B
B
B
5
Układ rzeczywisty
(T=const)...
Wobec:
Bilans:
0
*
*
*
ln
ln
B
B
B
B
B
P
P
V
a
RT
f
f
RT
RT
P
P
V
a
f
f
B
B
B
B
B
*
*
*
ln
(18
)
4
10
RT
P
P
V
B
B
*
*
1
B
B
B
a
f
f
*
B
B
B
a
f
f
*
- dla dowolnego
składnika
(19
a)
B
B
B
B
B
B
x
P
Py
*
*
(19
b)
6
Układ rzeczywisty
(T=const)...
A
A
A
A
A
B
B
B
B
B
x
P
Py
P
x
P
Py
P
*
*
Jeżeli P 0,1 MPa
(20a/
b)
1
*
B
B
Wnioski:
•Pod umiarkowanymi ciśnieniami o charakterze
izotermy decydują praktycznie odchylenia od
doskonałości w fazie ciekłej
•Jeżeli
A/B
> 1 (tzn. G
E
>0)
P
A/B
> P
A/Bid
P > P
id
•Jeżeli
A/B
< 1 (tzn. G
E
<0)
P
A/B
< P
A/Bid
P < P
id
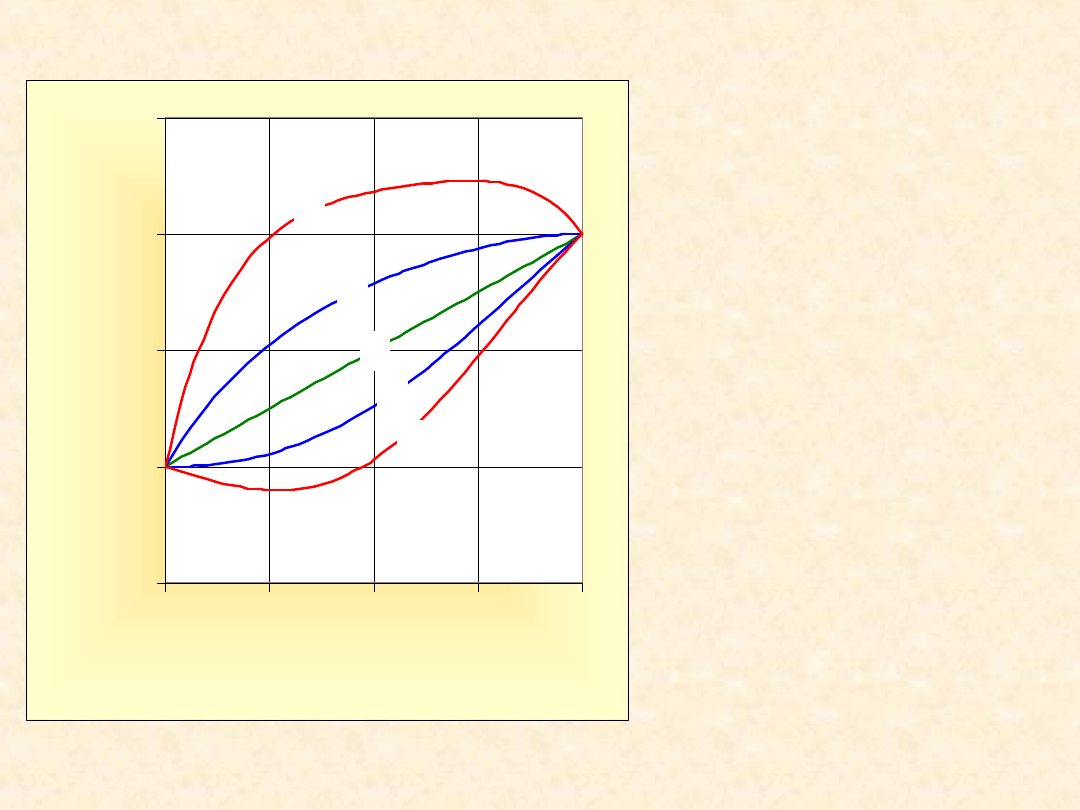
7
Układ rzeczywisty dwuskładnikowy
(T=const)...
1) G
E
= 0
(doskonały)
Homo -
2) G
E
> 0
(
- zeotrop dodatni
)
3) G
E
>> 0
(
-
azeotrop
dodatni
)
4) G
E
< 0
(
-
zeotrop ujemny
)
5) G
E
<< 0
(
-
azeotrop ujemny
)
50
100
150
200
250
0,00
0,25
0,50
0,75
1,00
x
B
P
/T
r
A
B
1
2
3
4
5

8
Układ rzeczywisty dwuskładnikowy (P
= const)...
Izobara van Laara...
(22a/
b)
B
B
A
A
A
A
B
x
exp
exp
exp
1
B
B
A
A
B
B
B
A
B
A
B
y
exp
exp
exp
exp
T
T
T
R
S
T
B
A
B
A
par
B
A
*
/
*
/
/
Krzywa wrzenia
(21a)
Krzywa
kondensacji(21b)
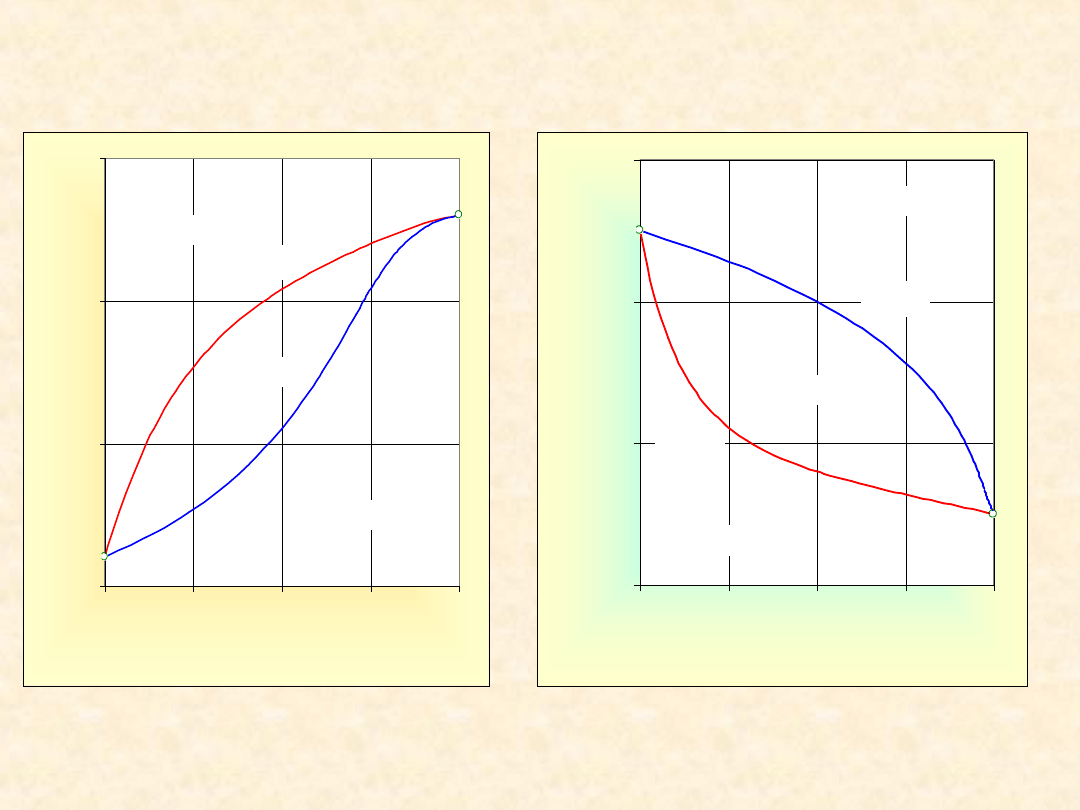
9
Układ rzeczywisty dwuskładnikowy...
Homozeotrop dodatni
Izoterma
równowagi
Izobara
równowagi
50
100
150
200
0,00
0,25
0,50
0,75
1,00
x
B
, y
B
P
/T
r
P(x
B
)
P(y
B
)
ciecz (c)
para (g)
c + g
300
350
400
450
0,00
0,25
0,50
0,75
1,00
x
B
, y
B
T
/K
ciecz (c)
T
w
(x
B
)
para (g)
T
w
(y
B
)
c + g
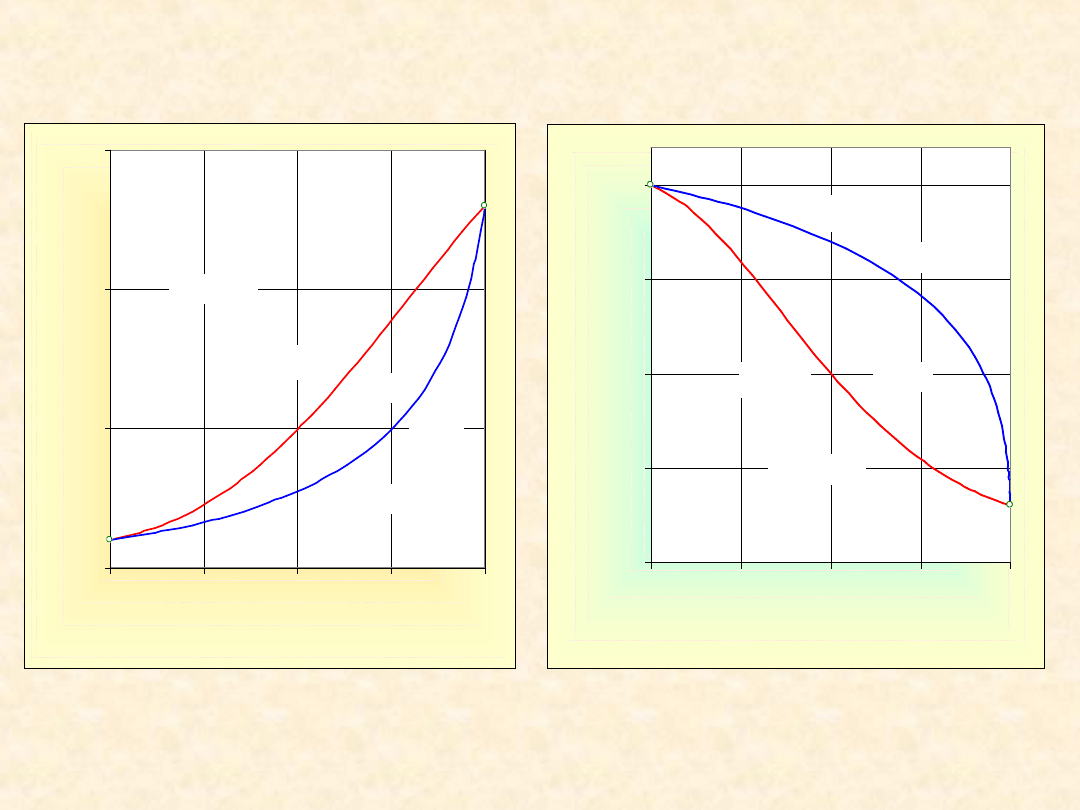
10
Układ rzeczywisty dwuskładnikowy...
Homozeotrop ujemny
Izoterma
równowagi
Izobara
równowagi
50
100
150
200
0,00
0,25
0,50
0,75
1,00
x
B
, y
B
P
/T
r
P(x
B
)
A
B
P(y
B
)
ciecz (c)
para (g)
c + g
300
325
350
375
400
0,00
0,25
0,50
0,75
1,00
x
B
, y
B
T
/K
A
B
ciecz (c)
T
w
(x
B
)
para (g)
T
w
(y
B
)
c + g
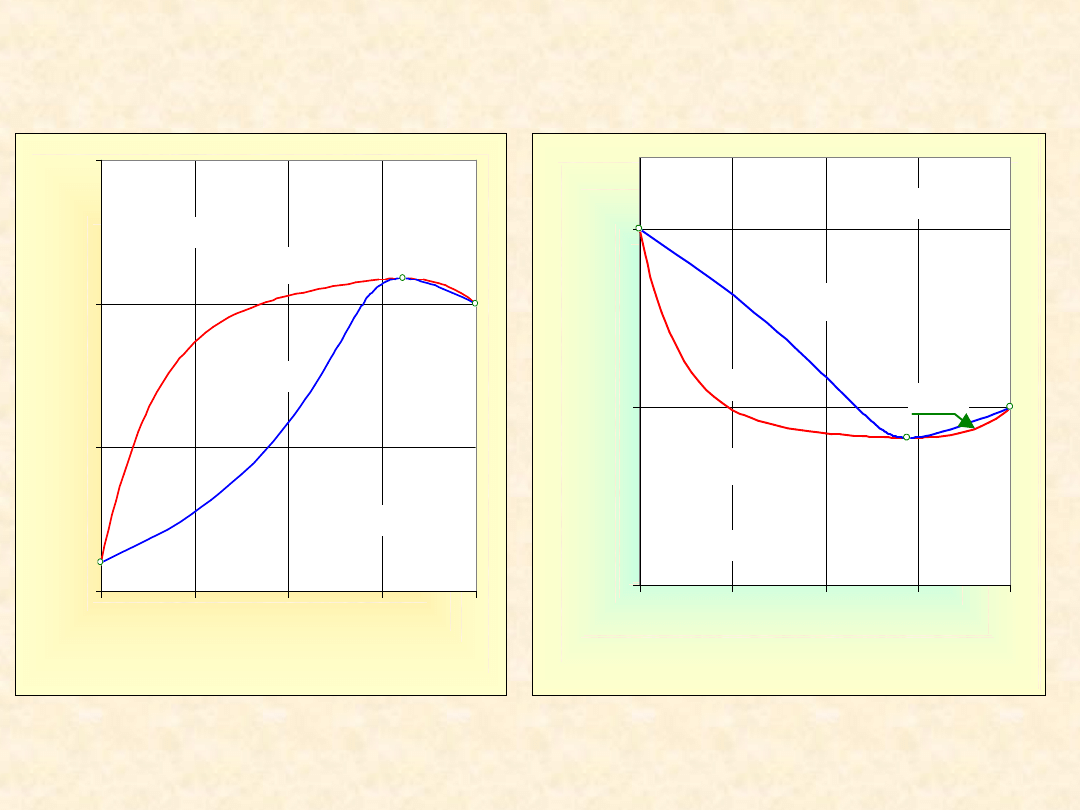
11
Układ rzeczywisty dwuskładnikowy...
Homoazeotrop dodatni
Izoterma
równowagi
Izobara
równowagi
350
375
400
0,00
0,25
0,50
0,75
1,00
x
B
, y
B
T
/K
A
B
ciecz (c)
T
w
(x
B
)
para (g)
T
w
(y
B
)
c + g
c + g
az
50
100
150
200
0,00
0,25
0,50
0,75
1,00
x
B
, y
B
P
/T
r
P(x
B
)
A
B
P(y
B
)
ciecz (c)
para (g)
c + g
az
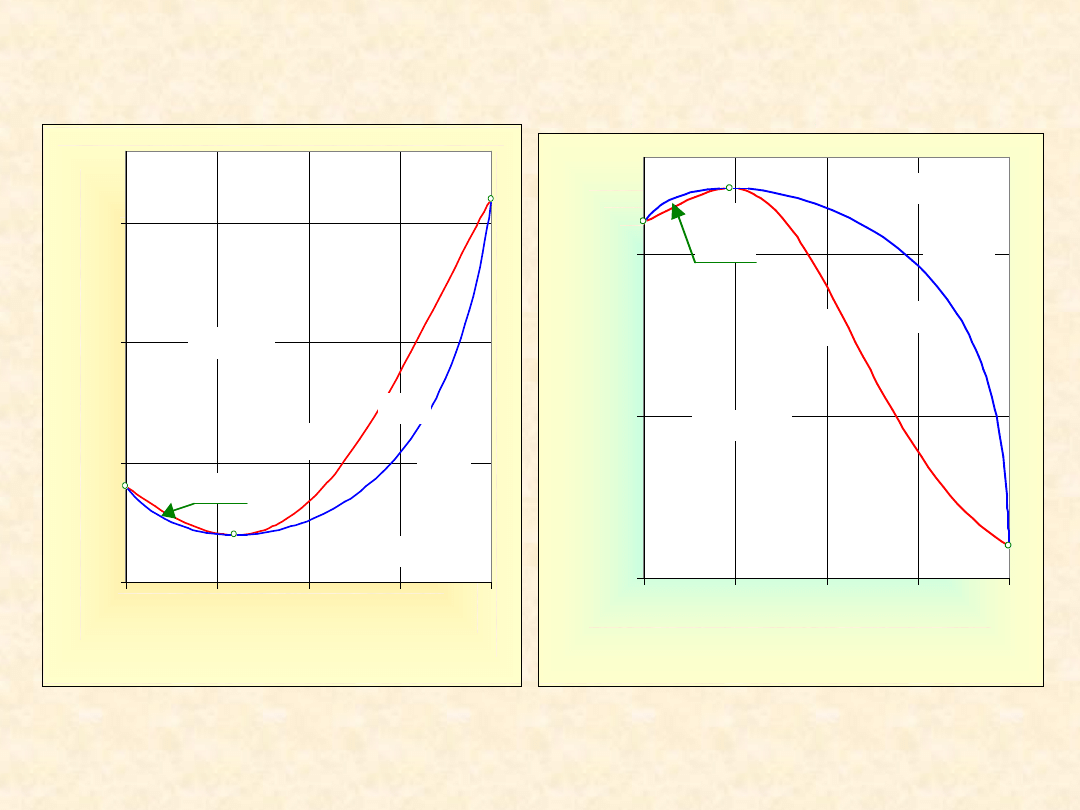
12
Układ rzeczywisty dwuskładnikowy...
Homoazeotrop ujemny
Izoterma
równowagi
Izobara
równowagi
100
125
150
175
0,00
0,25
0,50
0,75
1,00
x
B
, y
B
P
/T
r
P(x
B
)
A
B
P(y
B
)
ciecz (c)
para (g)
c + g
c + g
az
325
350
375
0,00
0,25
0,50
0,75
1,00
x
B
, y
B
T
/K
A
B
ciecz (c)
T
w
(x
B
)
para (g)
T
w
(y
B
)
c + g
az
c + g
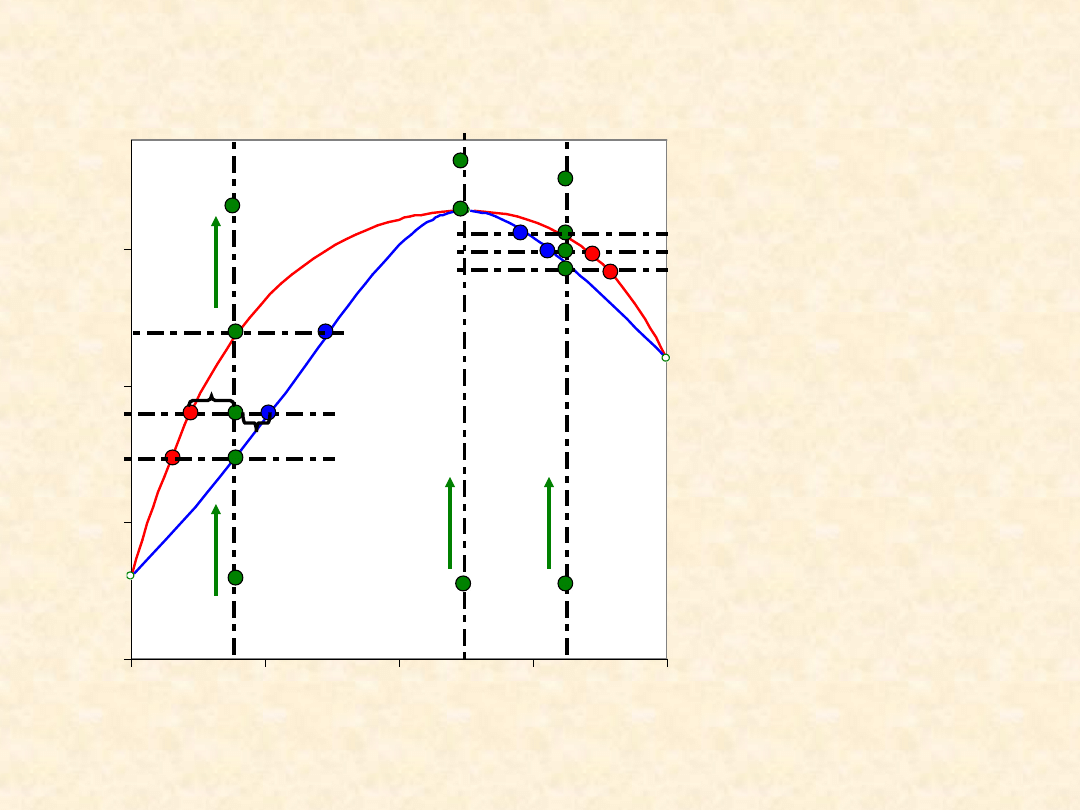
13
Układ rzeczywisty dwuskładnikowy...
Homoazeotrop dodatni - izoterma równowagi
Sprężanie/
rozprężanie
Bilans
materiałow
y (reguła
dźwigni)
a n
C
= b n
G
125
150
175
200
0,00
0,25
0,50
0,75
1,00
x
B
, y
B
P
/T
r
A
B
C
G
S
b
a
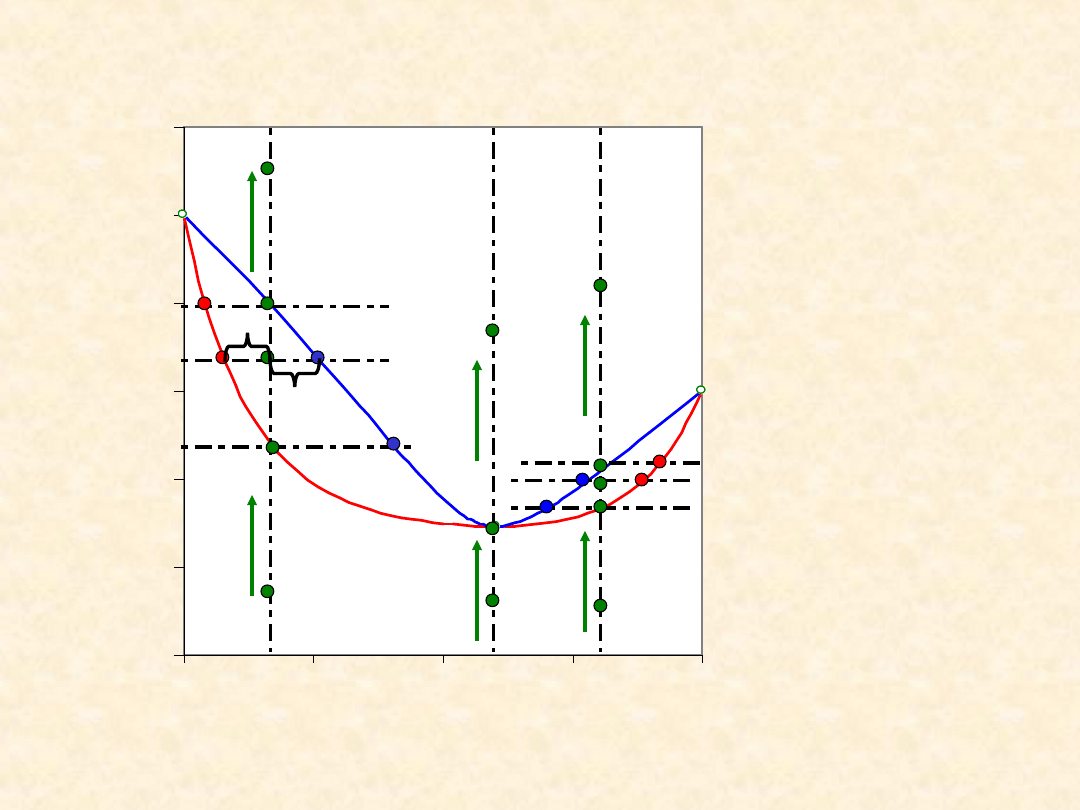
14
Układ rzeczywisty dwuskładnikowy...
Homoazeotrop dodatni - izobara równowagi
Ogrzewanie
/ oziębianie
Bilans
materiałow
y (reguła
dźwigni)
a n
C
= b n
G
355
360
365
370
375
380
385
0,00
0,25
0,50
0,75
1,00
x
B
, y
B
T
/K
A
B
C
G
S
b
a

15
Układ rzeczywisty dwuskładnikowy...
W układzie zawierającym jedną fazę
ciekłą i fazę gazową:
B
B
T
B
x
y
x
P
0
Izoterma Gibbsa - Konowałowa
B
B
P
B
x
y
x
T
0
Izobara Gibbsa - Konowałowa
16
Układ rzeczywisty dwuskładnikowy
(T=const)...
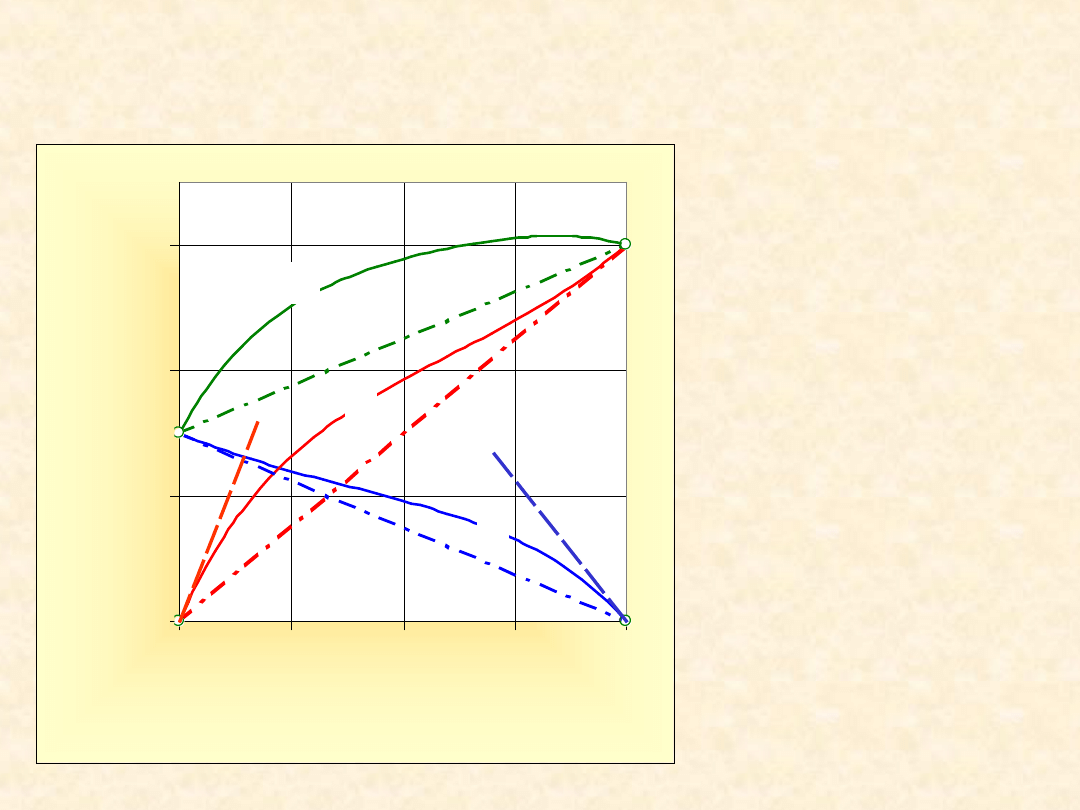
Homoazeotropia w roztworach prostych...
az
B
az
B
az
A
az
B
A
az
B
az
B
az
B
B
az
B
x
y
x
P
y
P
x
P
Py
1
1
*
*
az
B
az
A
A
B
P
P
*
*
(2
3)
2
2
1
az
B
az
B
A
B
x
RT
T
g
x
RT
T
g
P
P
exp
exp
*
*
(2
4)
17
Układ rzeczywisty dwuskładnikowy
(T=const)...
Homoazeotropia w roztworach prostych...
(2
5)
(2
6)
T
g
P
P
RT
x
A
B
az
B
2
2
1
*
*
ln
Wobe
c
1
0
az
B
x
1
T
g
T
P
T
P
RT
A
B
*
*
ln
Warunek
wystąpienia
homoazeotropii w
roztworze
prostym
18
Układ rzeczywisty dwuskładnikowy
(T=const)...
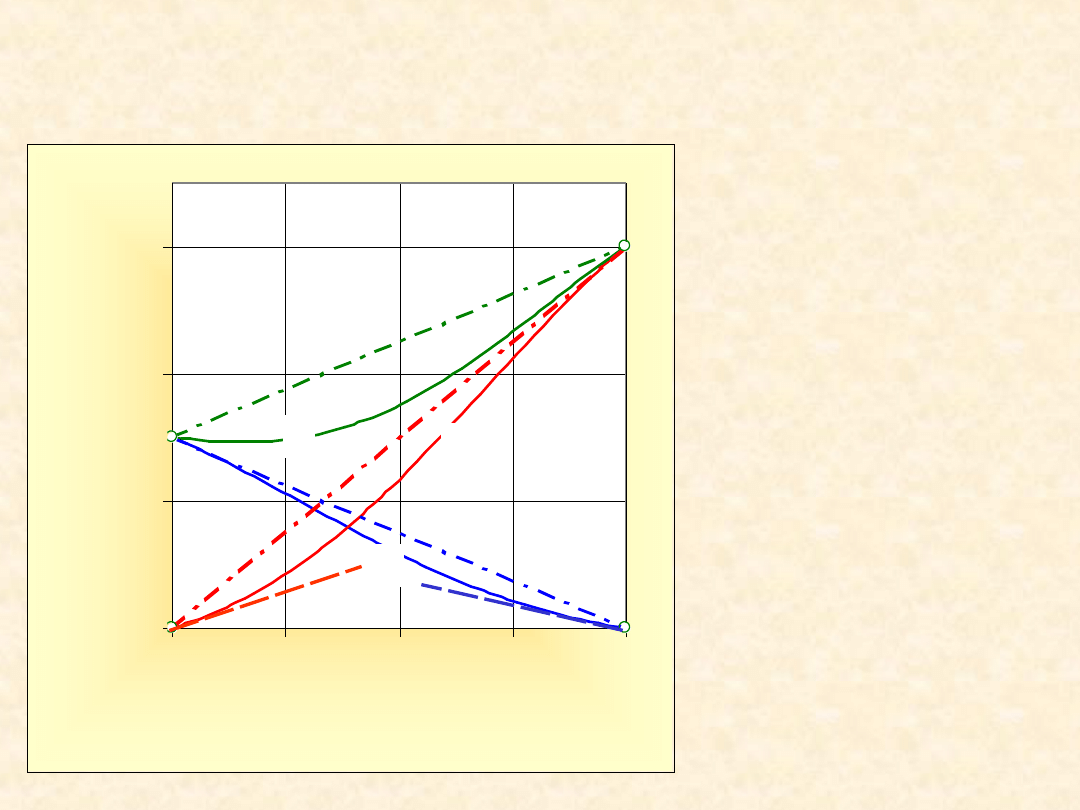
Graniczne prężności cząstkowe składników...
1)
P
A
(x
B
)
2)
P
B
(x
B
)
3)
P(x
B
)
0
50
100
150
0,00
0,25
0,50
0,75
1,00
x
B
P
/T
r
P
*
A
A
B
P
*
B
1
2
3
19
Układ rzeczywisty dwuskładnikowy
(T=const)...
Graniczne prężności cząstkowe składników...
1)
P
A
(x
B
)
2)
P
B
(x
B
)
3)
P(x
B
)
0
50
100
150
0,00
0,25
0,50
0,75
1,00
x
B
P
/T
r
P
*
A
A
B
P
*
B
1
2
3
20
Układ rzeczywisty dwuskładnikowy
(T=const)...
Graniczne prężności cząstkowe składników...
0
B
x
c
B
g
B
Warunek równowagi np. dla składnika B:
Dla
B
c
o
B
o
B
g
o
B
x
RT
T
P
P
RT
T
ln
ˆ
ln
B
A
B
H
o
B
x
T
K
P
P
/
RT
T
T
T
K
g
o
B
c
o
B
A
B
H
ˆ
exp
/
Prawo Henry’ego:
(2
7)
(2
8)

21
12.5. Układy rzeczywiste
z luką mieszalności
składników w fazie
ciekłej
Wykład 12b
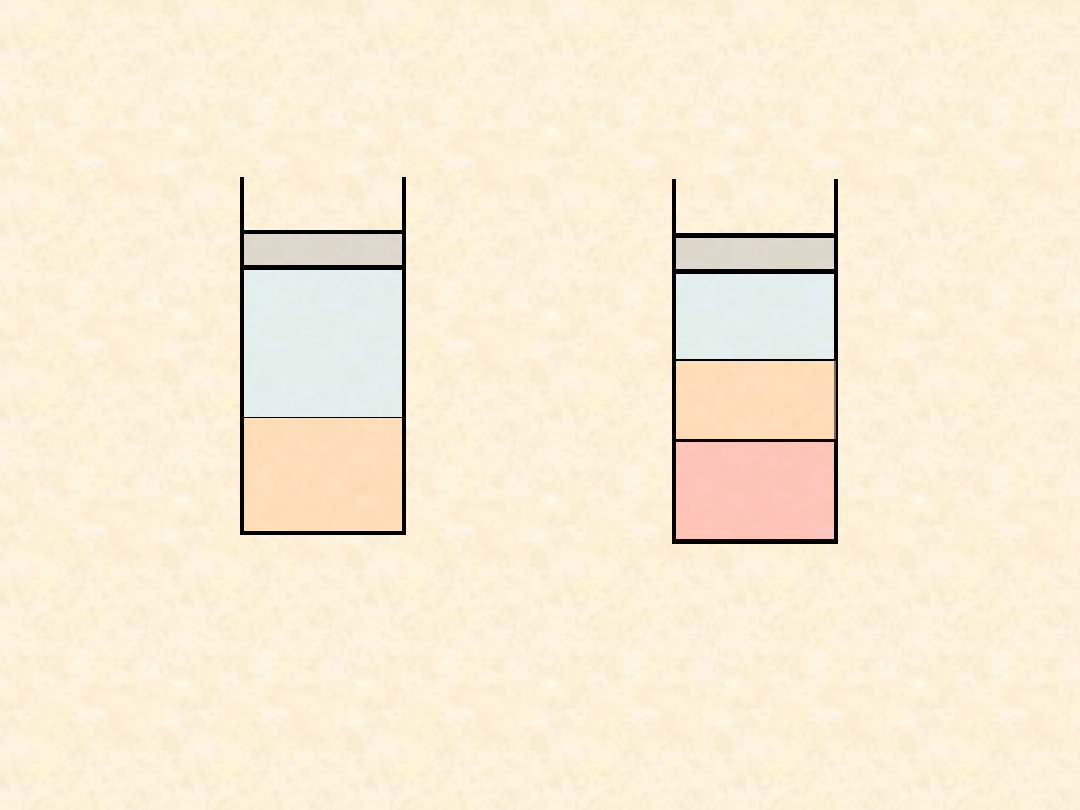
22
Układ rzeczywisty dwuskładnikowy...
Luka mieszalności w fazie ciekłej...
g
c
y
B
x
B
P, T = const
g
y
B
P, T = const
x
B
x
B
Możliwe typy równowag ciecz - para

23
Układ rzeczywisty dwuskładnikowy...
Luka mieszalności w fazie ciekłej...
Warunek równowagi dyfuzyjnej:
A
g
A
A
A
A
A
y
P
T
x
P
T
x
P
T
,
,
,
,
,
,
B
g
A
B
A
B
B
y
P
T
x
P
T
x
P
T
,
,
,
,
,
,
(29
a)
(29
b)
Wniosek:
Jeżeli układ zawiera dwie fazy ciekłe
to niezależne od średniego składu układu
pozostają:
•składy faz ciekłych
•potencjały chemiczne składników
•ciśnienia cząstkowe składników
•skład fazy gazowej
•ciśnienie sumaryczne (temperatura wrzenia)
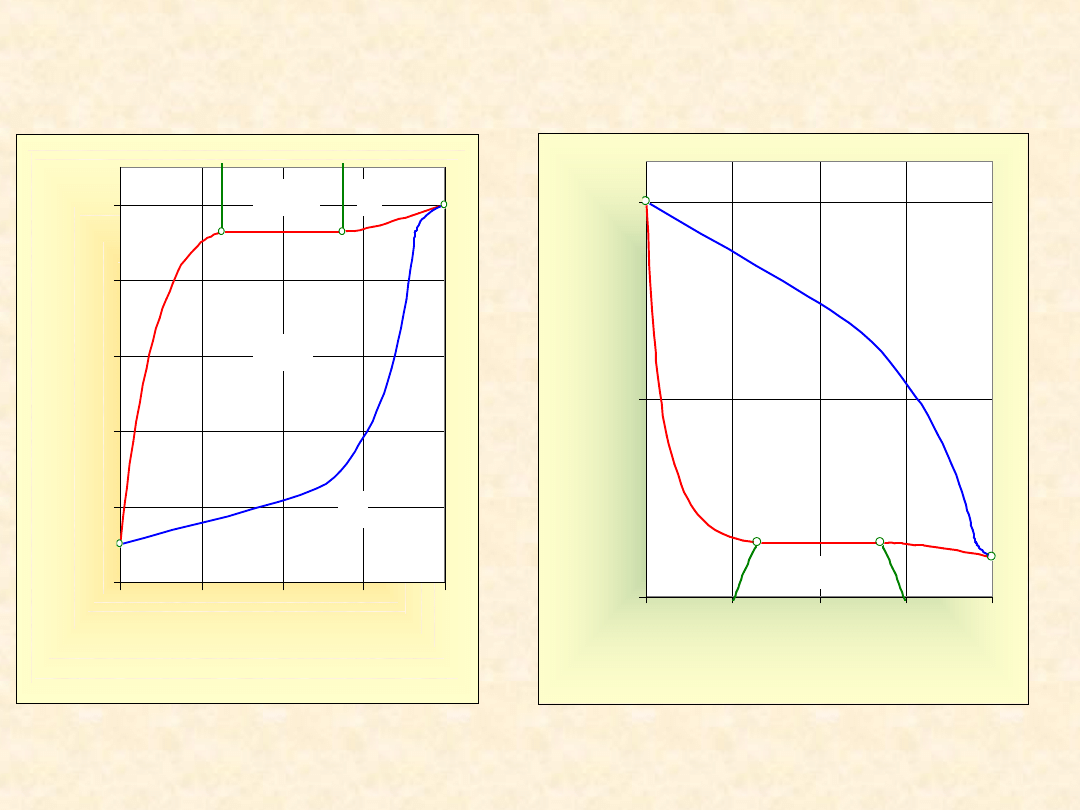
24
Układ rzeczywisty dwuskładnikowy...
Heterozeotrop (dodatni)
Izoterma
równowagi
Izobara
równowagi
0
100
200
300
400
500
0,00
0,25
0,50
0,75
1,00
x
B
, y
B
P
/T
r
A
B
c + g
g
P*
A
P*
B
300
350
400
0,00
0,25
0,50
0,75
1,00
x
B
, y
B
T
/K
A
B
T*
A
T*
B
c+g
g
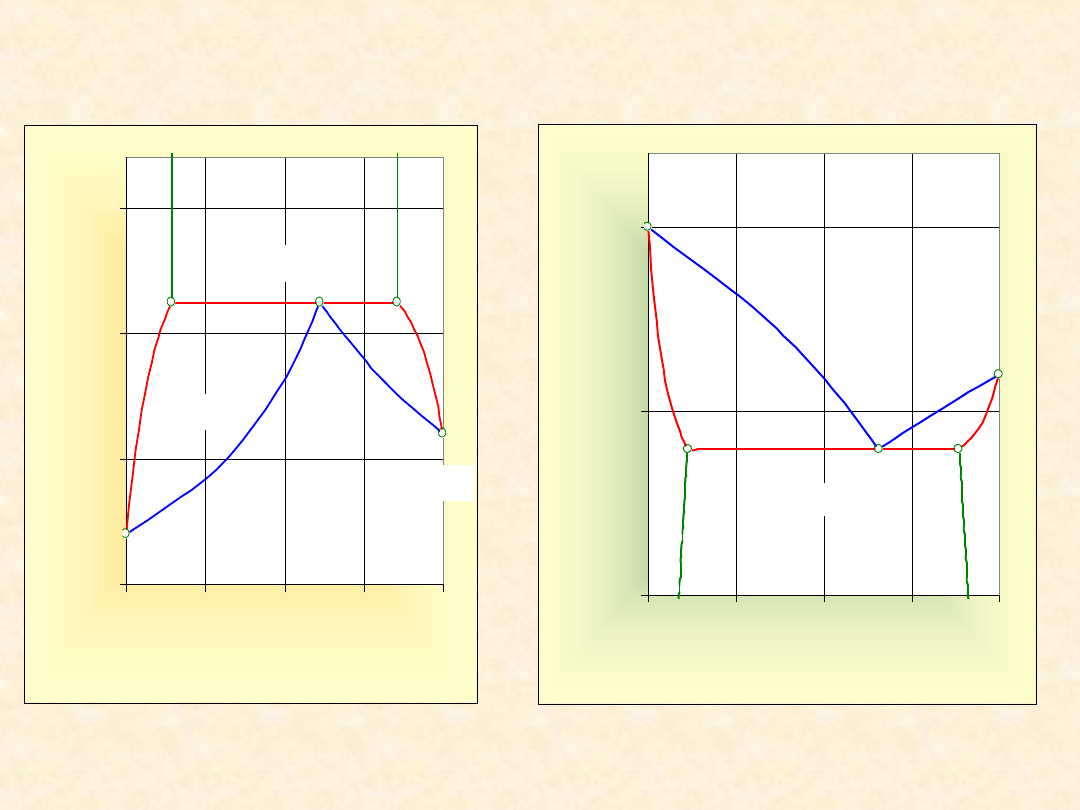
25
Układ rzeczywisty dwuskładnikowy...
Heteroazeotrop (dodatni)
Izoterma
równowagi
Izobara
równowagi
25
50
75
100
0,00
0,25
0,50
0,75
1,00
x
B
, y
B
P
/T
r
A
B
c + g
g
P*
A
P*
B
c + g
300
325
350
0,00
0,25
0,50
0,75
1,00
x
B
, y
B
T
/K
A
B
T*
A
T*
B
c+g
g
c+g
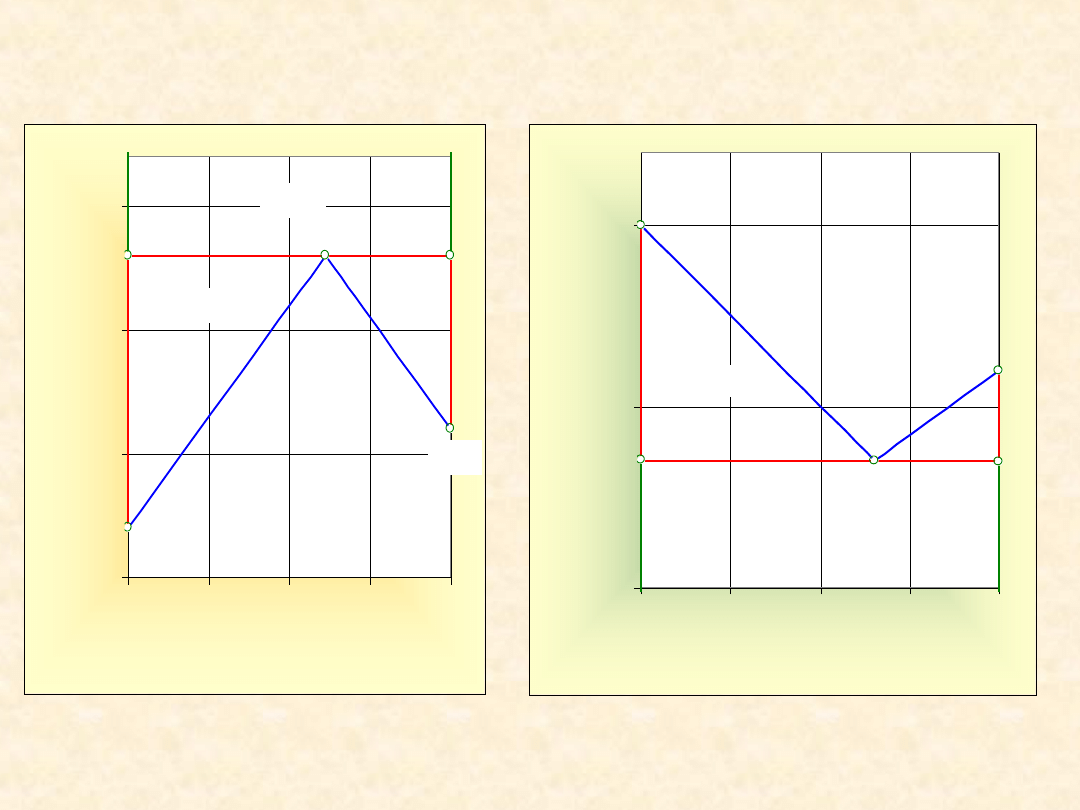
26
Układ rzeczywisty dwuskładnikowy...
Heteroazeotrop (dodatni) - granica dla G
E
+ niesk.
Izoterma
równowagi
Izobara
równowagi
25
50
75
100
0,00
0,25
0,50
0,75
1,00
x
B
, y
B
P
/T
r
A
B
A + g
A + B
g
P*
A
P*
B
B + g
300
325
350
0,00
0,25
0,50
0,75
1,00
x
B
, y
B
T
/K
A
B
T*
A
T*
B
A + g
A + B
g
B + g
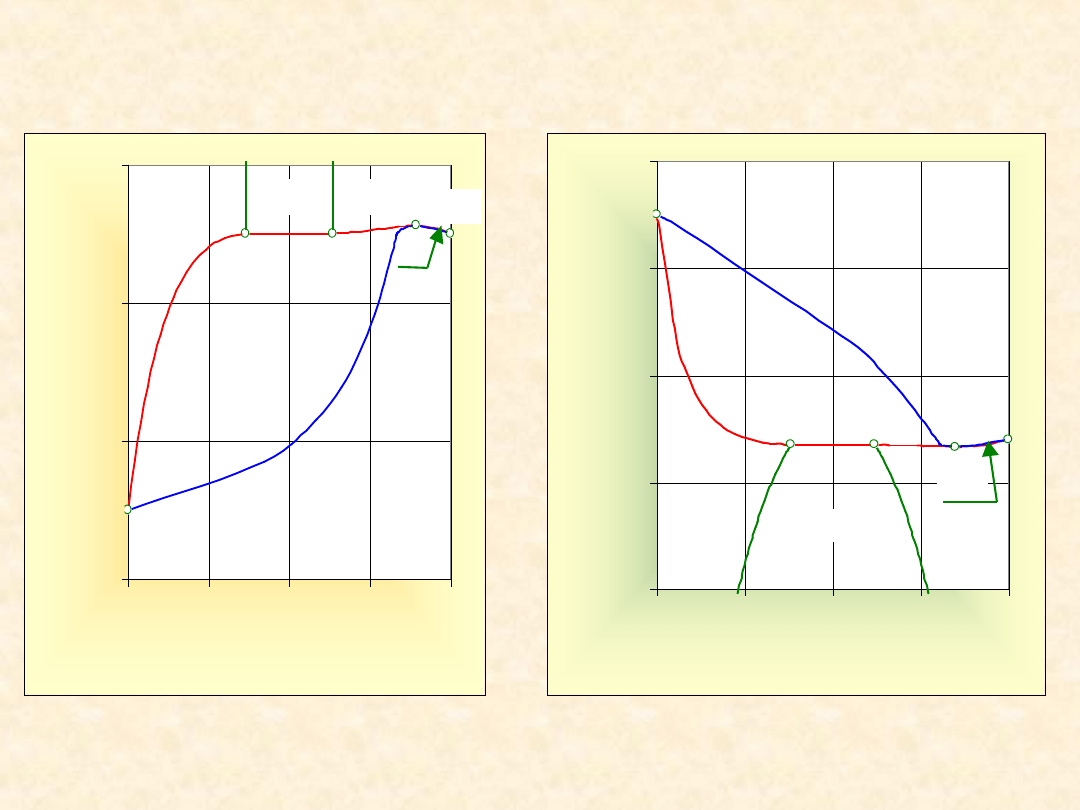
27
Układ rzeczywisty dwuskładnikowy...
Homoazeotrop (+) w układzie z luką mieszalności
Izoterma
równowagi
Izobara
równowagi
0
100
200
300
0,00
0,25
0,50
0,75
1,00
x
B
, y
B
P
/T
r
A
B
c + g
g
P*
A
P*
B
c + g
280
300
320
340
360
0,00
0,25
0,50
0,75
1,00
x
B
, y
B
T
/K
A
B
T*
A
T*
B
c + g
g
c+g
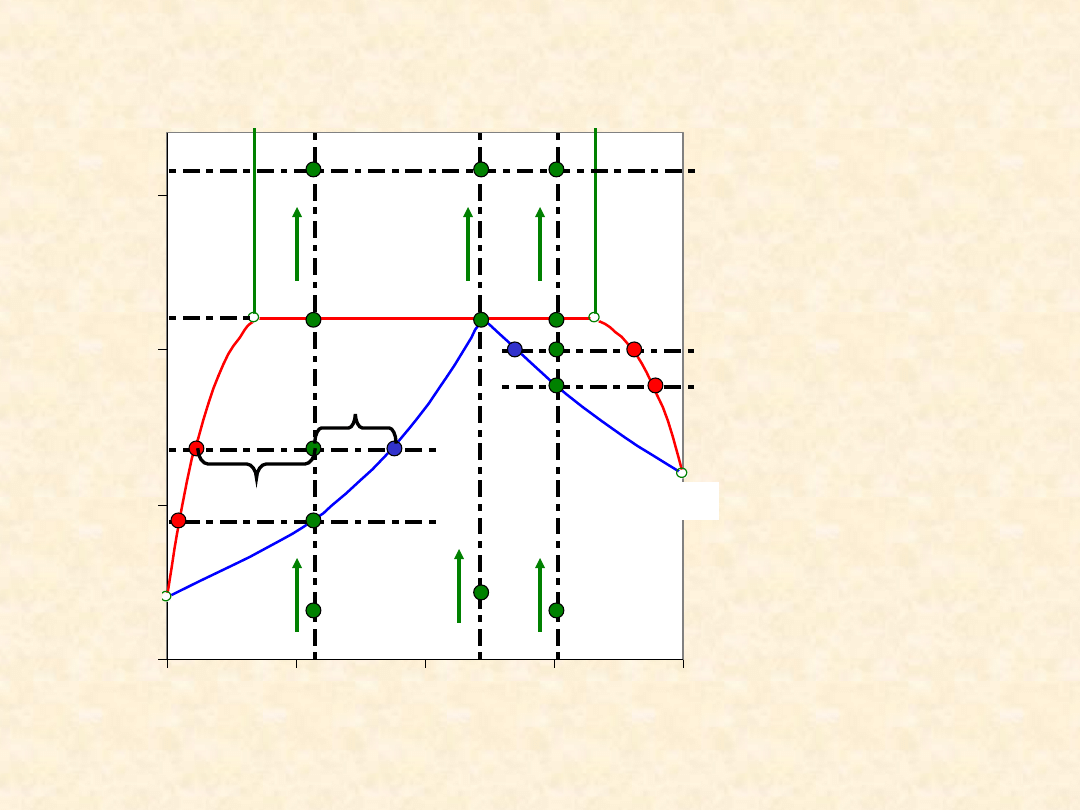
28
Układ rzeczywisty dwuskładnikowy...
Heteroazeotrop - izoterma równowagi
Sprężanie/
rozprężanie
Bilans
materiałow
y (reguła
dźwigni)
a n
C
= b n
G
25
50
75
100
0,00
0,25
0,50
0,75
1,00
x
B
, y
B
P
/T
r
g
P*
A
P*
B
a
b
S
C
G
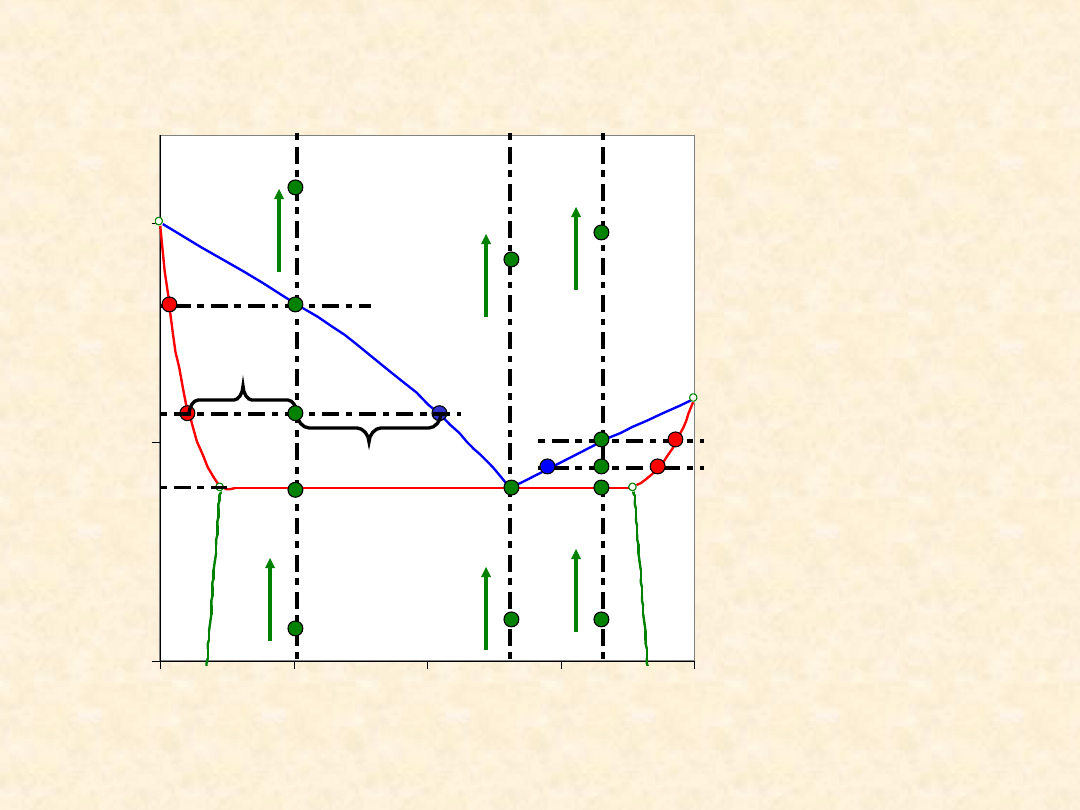
29
Układ rzeczywisty dwuskładnikowy...
Heteroazeotrop - izobara równowagi
Ogrzewanie
/ oziębianie
Bilans
materiałow
y (reguła
dźwigni)
a n
C
= b n
G
300
325
350
0,00
0,25
0,50
0,75
1,00
x
B
, y
B
T
/K
A
B
T*
A
T*
B
g
G
C
S
b
a

30
12.6. Układy zawierające
składnik praktycznie
nielotny
Wykład 12b
31
Układ zawierający nielotny składnik B
(T = const)
...
3
10
*
*
B
A
P
P
A
A
A
A
A
a
P
x
P
P
P
*
*
A
(30
)
*
A
P
P
(31
)
A
A
A
A
A
A
x
P
a
P
P
P
P
1
1
*
*
*
Obniżenie prężności pary:
1
1
A
A
A
A
A
A
x
a
P
P
P
P
P
*
*
*
B
A
dosk
x
P
P
*
)
(
B
A
dosk
x
P
P
*
)
(
Obniżenie prężności pary - układ doskonały:
(31
a)
(31
b)
(32
b)
(32
a)
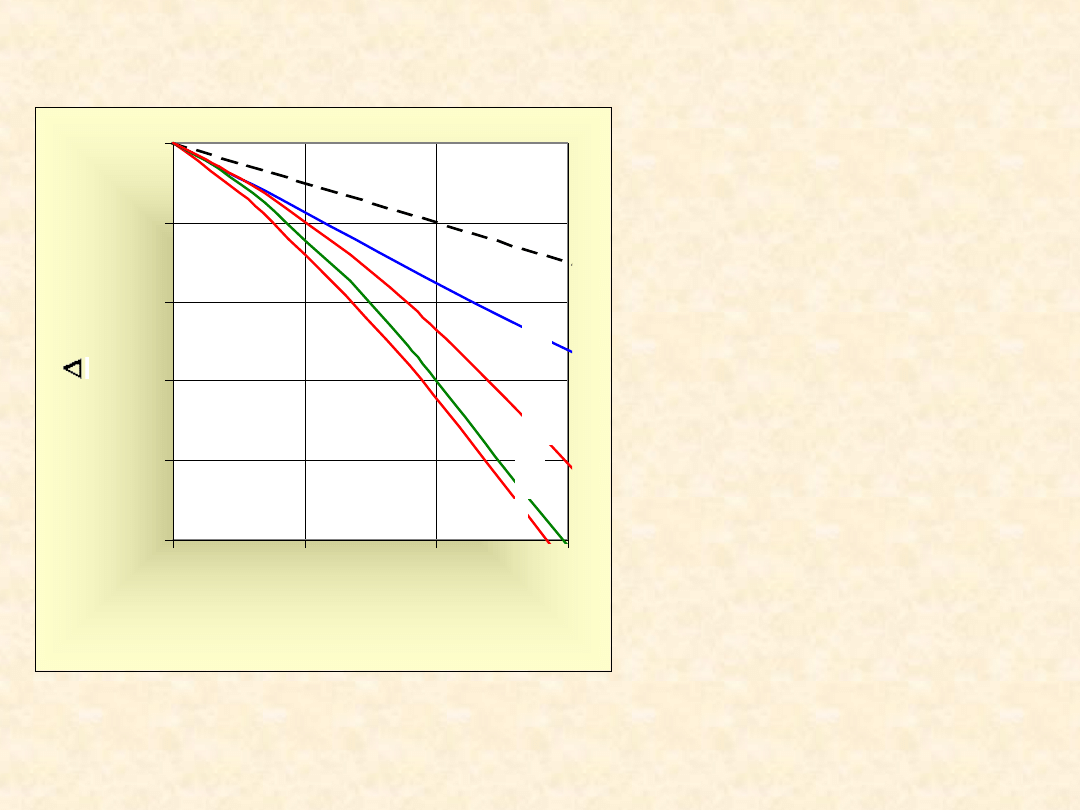
32
Układ zawierający nielotny składnik B
(T = const)
...
-0,5
-0,4
-0,3
-0,2
-0,1
0,0
0,00
0,05
0,10
0,15
x
B
P
/P
*
4
1
2
3
Obniżenie
prężności pary
nad roztworami
wodnymi:
1) NaNO
3
2) LiCl
3) NaOH
4) H
2
SO
4
33
Układ zawierający nielotny składnik B
(P = const)
...
P
z
=
const
T*
A
T
A
P*
A
P
A
P
T
*
A
w
w
T
T
T
(3
3)
2
*
*
*
*
A
A
A
p
w
A
T
R
P
H
T
P
dT
dP
(3
4)
(34)
+
(32a
)
Założenie x
B
<
0,1
B
A
p
A
w
x
H
T
R
T
*
*
2
(3
5)
B
m
A
e
w
c
K
T
*
*
A
p
A
A
A
e
H
M
T
R
K
1000
2
A
B
B
A
B
B
n
n
n
n
n
x
(35a)
(35
b)

34
Układ zawierający nielotny składnik B
(P = const)
...
Ebuliometria - zastosowania:
•Wyznaczanie masy molowej (średniej
masy molowej w przypadku asocjacji)
substancji B
•Wyznaczanie entalpii parowania
rozpuszczalnika
R o zp u szczaln ik T *
A
/K
K
e
(A )
W od a
373,15
0,51
B en zen
353,35
2,57
S O
2
263,00
1,49
1,4 – d iok san
373,45
3,13
J od ek m ety lu
314,45
5,01

35
12.7. Rozpuszczalność
gazów w cieczach
Wykład 12b
36
Rozpuszczalność gazów (B) w
cieczach (A)
...
Fakty doświadczalne:
•x
B
(P
B
)
T=const
jest zawsze
funkcją rosnącą
•x
B
(T)
P=const
jest na ogół
funkcją malejącą (istnieją
układy dla których jest to
zależność nie
monotoniczna)
•x
B
(T, P
B
) zależy bardzo
istotnie od natury gazu B i
rozpuszczalnika A
g
c
P
B
x
B
T = const
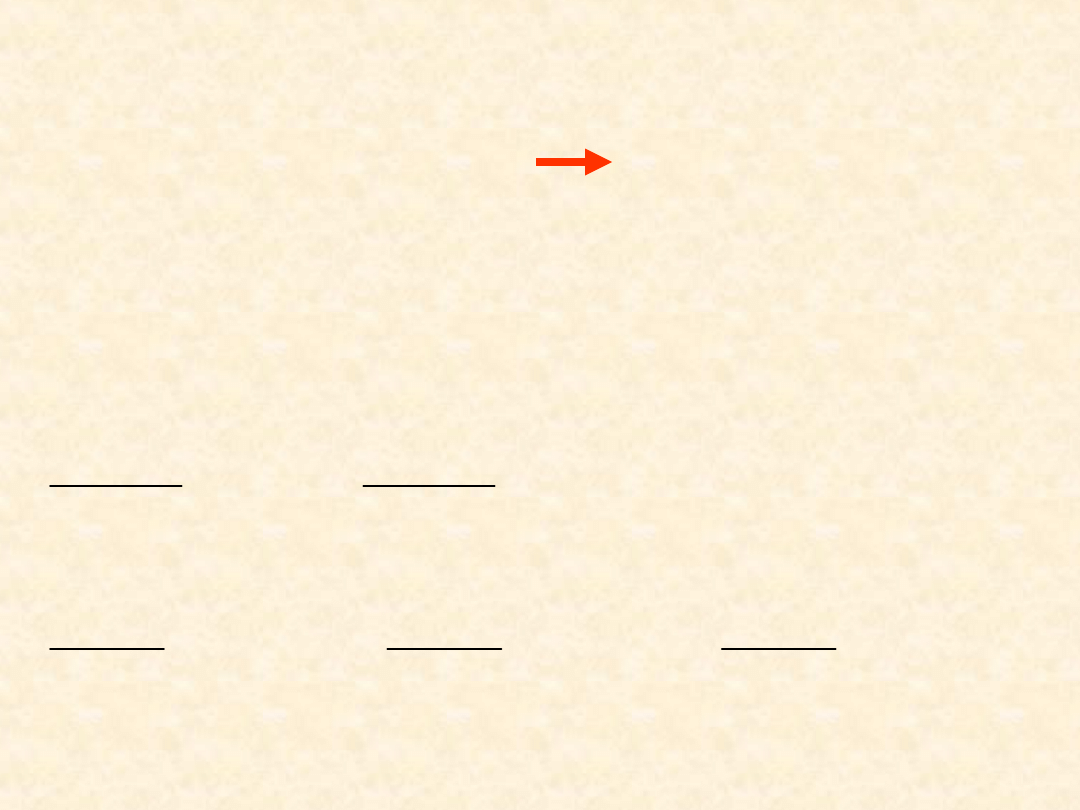
37
Rozpuszczalność gazów (B) w
cieczach (A)
...
(36
)
T
P
T
P
B
A
*
*
Założeni
a:
*
*
B
B
A
P
P
P
Warunek równowagi
dyfuzyjnej:
B
c
B
g
B
x
P
T
P
T
,
,
,
)
(
)
*(
B
P
T
B
c
B
x
T
c
B
x
P
c
B
T
g
B
P
g
B
dx
x
dP
P
dT
T
dP
P
dT
T
B
B
,
)
(
,
)
(
,
)
(
)
*(
)
*(
(37
)
38
Rozpuszczalność gazów (B) w
cieczach (A)
...
(38
)
Wobe
c:
Dla T =
const
(39
)
0
B
P
T
B
c
B
g
B
c
B
g
B
c
B
dx
x
dP
V
V
dT
S
S
,
)
(
)
(
*
)
(
)
(
*
)
(
P
T
B
c
B
g
B
c
B
T
B
x
V
V
P
x
,
)
(
)
*(
)
(
0
P
T
B
c
B
x
,
)
(
)
*(
)
(
g
B
c
B
V
V
0
T
B
P
x
(40
)
39
Rozpuszczalność gazów (B) w
cieczach (A)
...
(39
)
Dla niezbyt wysokich ciśnień -
uproszczenia:
)
*(
)
(
g
B
c
B
V
V
B
g
B
P
RT
V
)
*(
B
c
o
B
c
B
x
RTln
ˆ
)
(
)
(
(41
)
B
B
B
B
T
B
B
P
x
x
RT
P
RT
P
x

40
Rozpuszczalność gazów (B) w
cieczach (A)
...
Dla niezbyt wysokich ciśnień...
(42
)
const
x
P
B
B
ln
ln
Prawo
Henry’ego:
B
A
B
H
B
x
T
K
P
)
/
(
Stała Henry’ego K
H
(B/A)
jest funkcją
temperatury - indywidualną dla każdej
pary składników A + B
41
Rozpuszczalność gazów (B) w
cieczach (A)
...
Wobe
c:
Dla P = const
(38)
(43
)
(44
)
P
T
B
c
B
B
rozp
P
T
B
c
B
g
B
c
B
P
B
x
S
x
S
S
T
x
,
)
(
,
)
(
)
*(
)
(
)
*(
)
*(
)
(
)
(
g
B
g
B
c
B
c
B
TS
H
S
T
H
P
T
B
c
B
B
rozp
P
T
B
c
B
g
B
c
B
P
B
x
T
H
x
T
H
H
T
x
,
)
(
,
)
(
)
*(
)
(
42
Dla roztworów rozcieńczonych -
uproszczenie:
B
c
o
B
c
B
x
RTln
ˆ
)
(
)
(
Rozpuszczalność gazów (B) w
cieczach (A)
...
(44
)
B
B
rozp
B
B
rozp
P
B
x
RT
H
x
RT
T
H
T
x
2
dT
RT
H
x
d
B
rozp
B
2
ln
const
T
R
H
x
B
rozp
B
1
ln
(45
)

43
12.8. Równowaga
osmotyczna
Wykład 12b
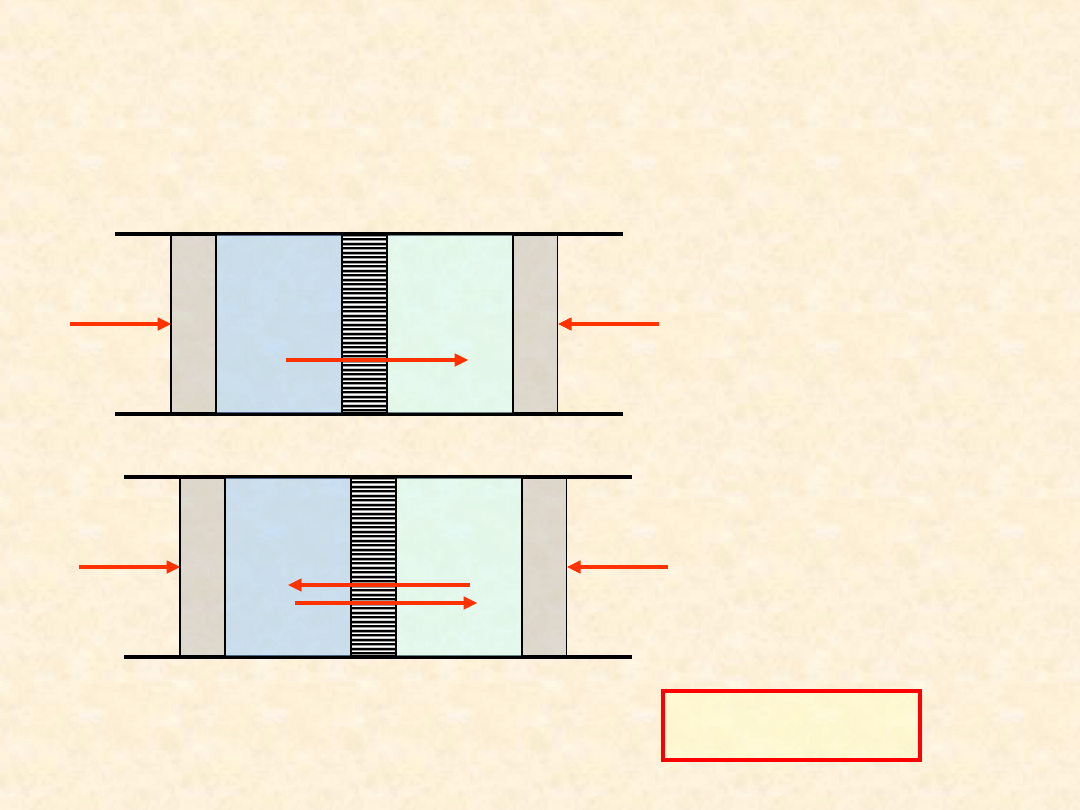
44
Równowaga
osmotyczna
...
A - rozpuszczalnik
B - substancja
rozpuszczona
- czysty
rozpuszczalnik
- roztwór B + A
P
P
P
P
A
A
P
P
P
P
A
A
Ciśnienie osmotyczne
roztworu:
P
P
(46
)

45
Równowaga
osmotyczna
...
P
= P
- spontaniczna migracja
rozpuszczalnika - uzasadnienie:
A
A
A
A
A
x
P
T
a
RT
P
T
x
P
T
,
,
ln
,
,
,
*
(47
)
Wobec x
A
<
1
1
A
A
x
P
T
a
,
,
P
T
x
P
T
A
A
A
,
,
,
*
(48
)
Wniosek:
Rozpuszczalnik A migruje spontanicznie
z fazy
do roztworu
- proces
przebiega nieodwracalnie aż do
wyczerpania rozpuszczalnika (zaniku
fazy
)
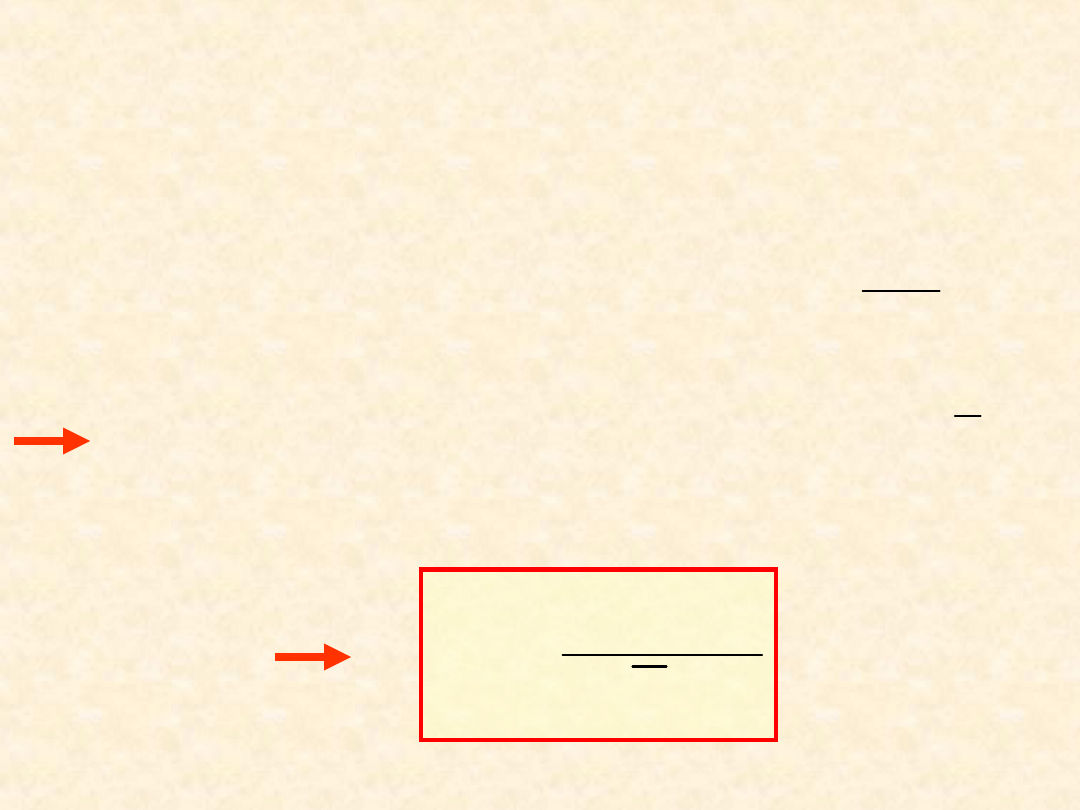
46
Równowaga
osmotyczna
...
P
> P
- stan równowagi
osmotycznej...
(49
)
(50
)
P
T
x
P
T
A
A
A
,
,
,
*
dP
P
x
P
T
a
RT
P
T
x
P
T
P
P
x
T
A
A
A
A
A
A
,
*
,
,
ln
,
,
,
(51
)
A
A
A
A
A
A
V
x
P
T
a
RT
P
T
x
P
T
,
,
ln
,
,
,
*
(49) +
(51)
A
A
V
a
RTln
(52
)
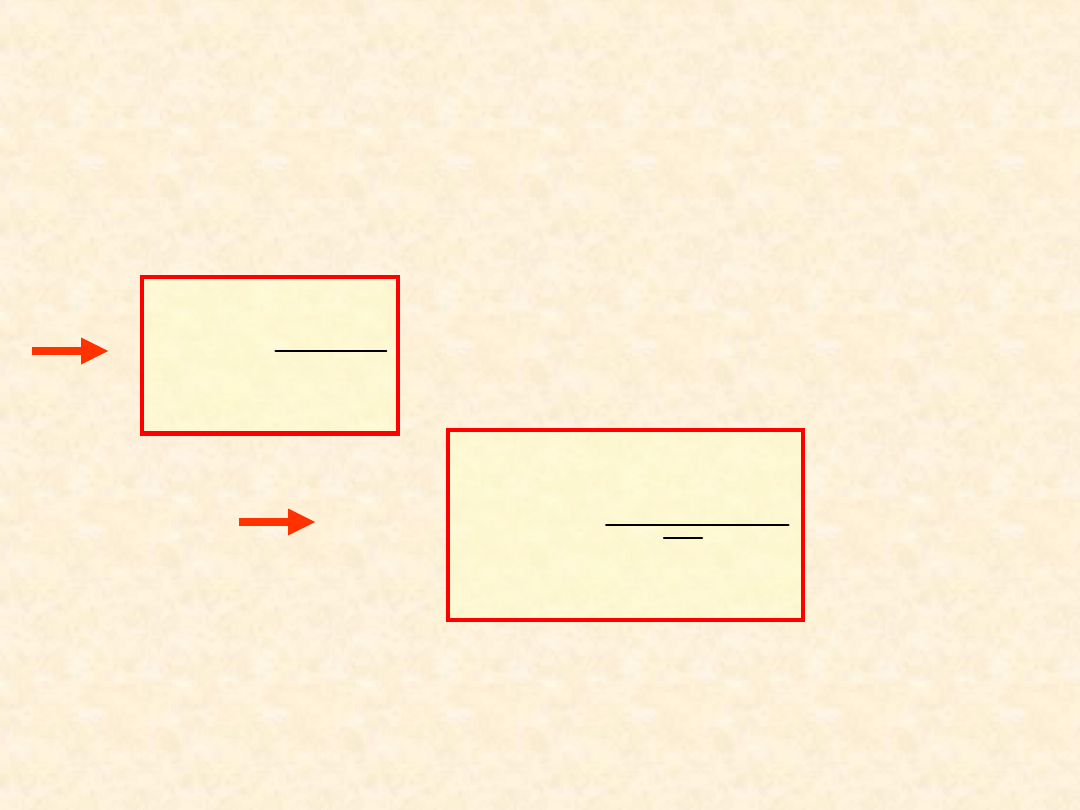
47
Równowaga
osmotyczna
...
P
> P
- stan równowagi
osmotycznej...
(53
)
(54
)
(52) +
(53)
Praktyczny współczynnik osmotyczny
- definicja (N. Bjerrum, 1916):
B
A
A
A
x
RT
P
T
x
P
T
,
,
,
*
B
A
x
a
ln
A
B
V
x
RT
Praktyczny współczynnik osmotyczny
roztworu rozcieńczonego istotnie zależy od
x
B
- jest dogodny do opisu roztworów
rozcieńczonych.
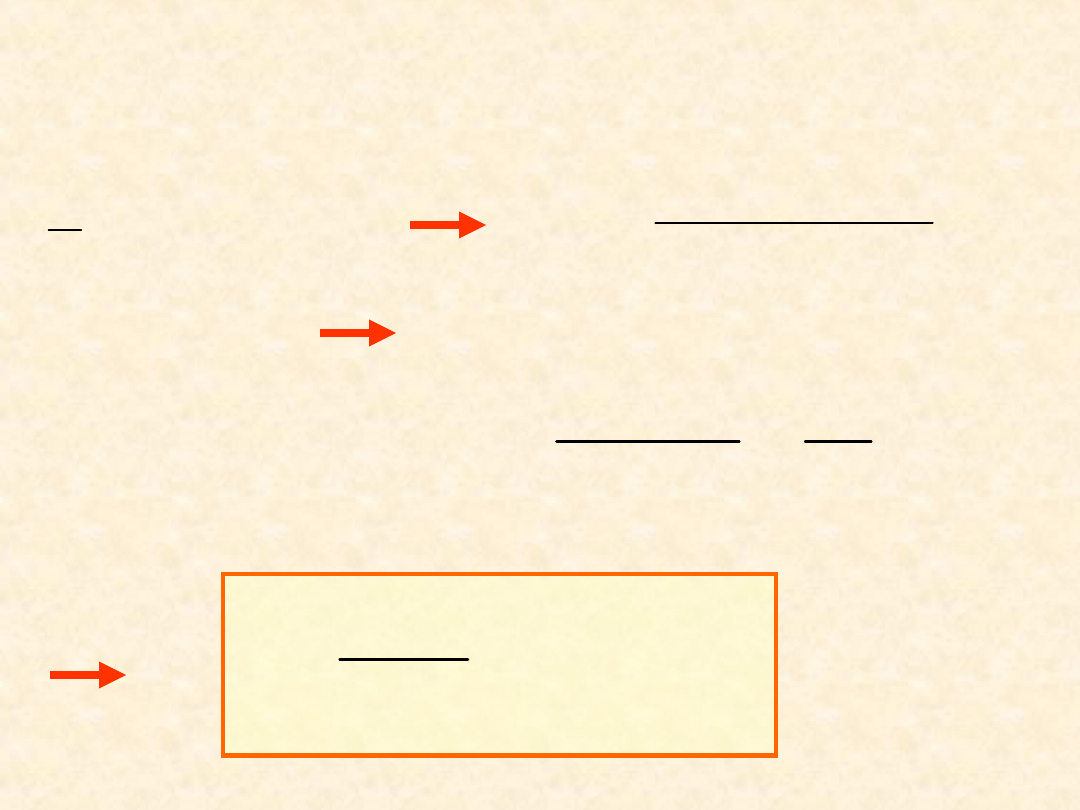
48
Równowaga
osmotyczna
...
Roztwory bardzo
rozcieńczone...
(55
)
(56
)
Wobec x
B
<<1
B
A
A
x
x
a
1
*
A
A
V
V
*
ln
A
B
V
x
RT
1
B
B
x
x
1
ln
A
B
B
A
B
B
n
n
n
n
n
x
RT
c
RT
V
n
n
B
A
A
B
*

49
Osmoza i równowaga osmotyczna -
znaczenie i zastosowanie
...
•Transport wody przez błony komórkowe
roślin i zwierząt;. sztywność (turgor) liści
roślin oraz elastyczność tkanek zwierząt.
•Ciśnienie osmotyczne osocza krwi ludzkiej
wynosi ok. 0,6 MPa (ok. 0.9 % wag. NaCl);
wprowadzenie do krwi wody destylowanej
powoduje hemolizę tzn. pękanie
czerwonych ciałek krwi, które "pęcznieją"
wskutek migracji do ich wnętrza wody -
płyny injekcyjne muszą być izotoniczne z
osoczem krwi

50
Osmoza i równowaga osmotyczna -
znaczenie i zastosowanie
...
•”Mięknięcie" liści sałaty, kapusty lub
pokrojonych ogórków po ich posoleniu
wynika z utraty przez ich komórki wody
wskutek osmozy
.
• Pomiar ciśnienia osmotycznego
rozcieńczonego roztwo- ru nieelektrolitu
umożliwia wyznaczenie jego stężenia
molowego (masy molowej) - jest to jedna z
metod wyznaczania średnich mas
molowych polimerów.
•
Jeżeli roztworowi zamkniętemu przegrodą
półprzepu - szczalną narzuci się ciśnienie
większe od jego ciśnienia osmotycznego, to
zawarty w nim rozpuszczalnik będzie
migrował z roztworu do czystego
rozpuszczalnika - jest to jedna z metod
odsalania wody morskiej.

51
12.9. Podstawy
rozdzielania substancji
metodą destylacji
Wykład 12b
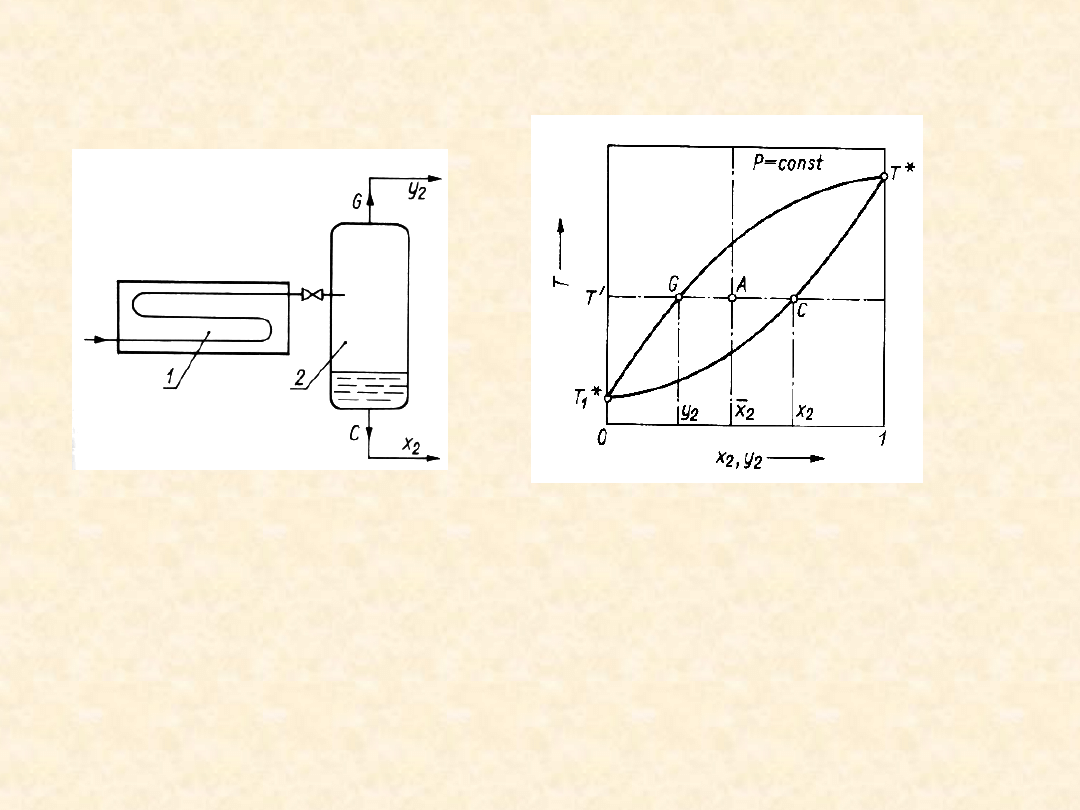
52
Destylacja rzutowa
Faza ciekła (A + B) jest przegrzewana pod
zwiększonym ciśnieniem w wymienniku
ciepła (1), a następnie rozprężana w dyszy i
wprowadzana do separatora (2), w którym
ustala się stan równowagi fazowej
(teoretycznie). Układ rozdziela się na fazę
gazową i ciekłą o różnych składach.
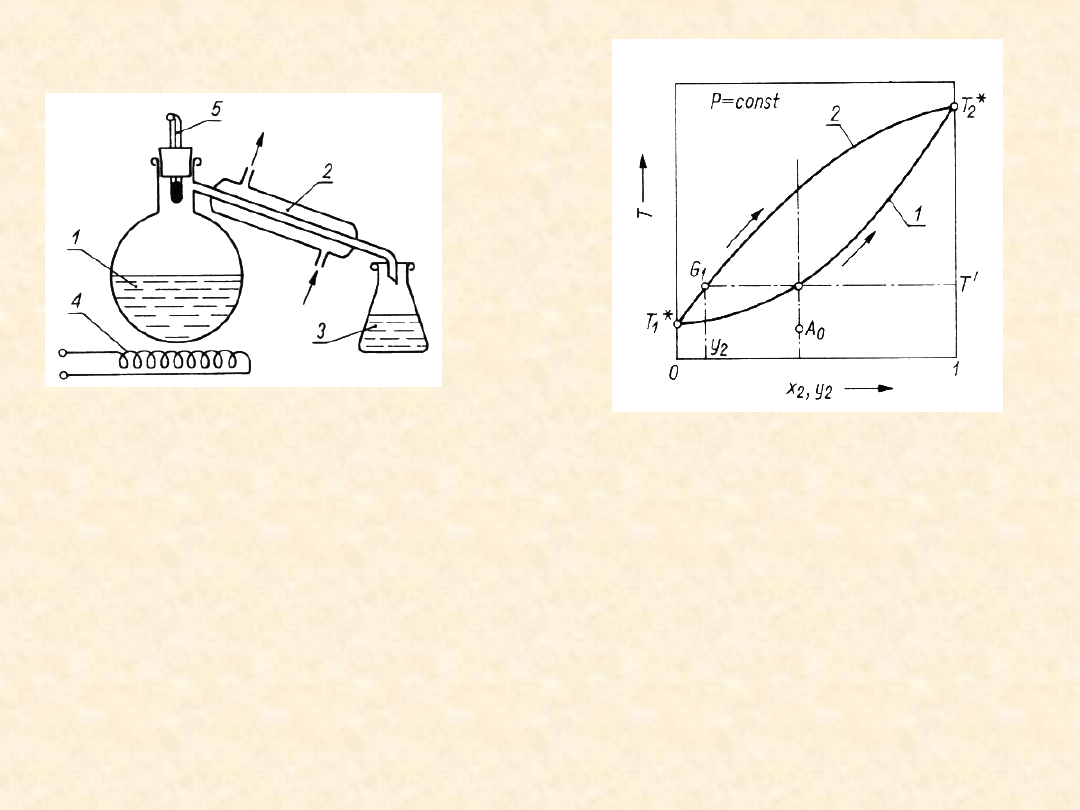
53
Destylacja różniczkowa prosta
Podgrzewana faza ciekła (A + B) wrze (P=const)
w zbiorniku (1). Pary o składzie równowagowym
względem fazy ciekłej (teoretycznie) są
skraplane całkowicie w chłodnicy (2). Ich
chwilowy skład różni się od chwilowego składu
fazy ciekłej. W miarę odparowywania cieczy jej
skład ulega zmianie, zmienia się też średni skład
skroplin. Metoda ta pozwala uzyskać destylat
(skropliny) wzbogacone w jeden ze składników w
porównaniu z początkowym składem cieczy
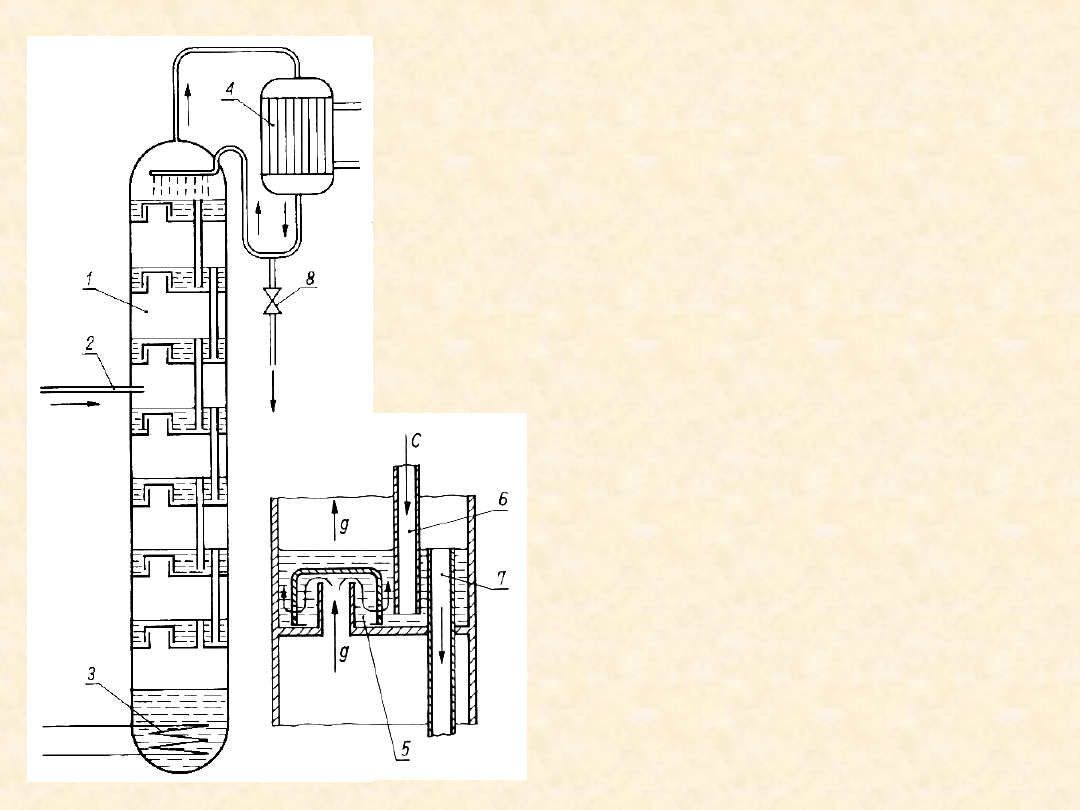
54
Rektyfikacja na
kolumnie
Podgrzana wstępnie mieszanina
cieczy i pary (2) jest
wprowadzana do kolumny. Na
kolejnych półkach ustala się
stan rów- nowagi (teoret.)
między parą (wędrującą do
góry) i spływająca z góry cieczą,
w wyniku czego obie fazy
zmieniają swój skład. Para
opuszczająca kolumnę jest
skraplana w deflegmatorze (4).
Część skroplin wraca do
kolumny, reszta stanowi
rektyfikat wzbogacony
istotnie w jeden ze
składników. Spływająca
z kolumny ciecz jest
ponownie
odparowywana w kotle
(3).
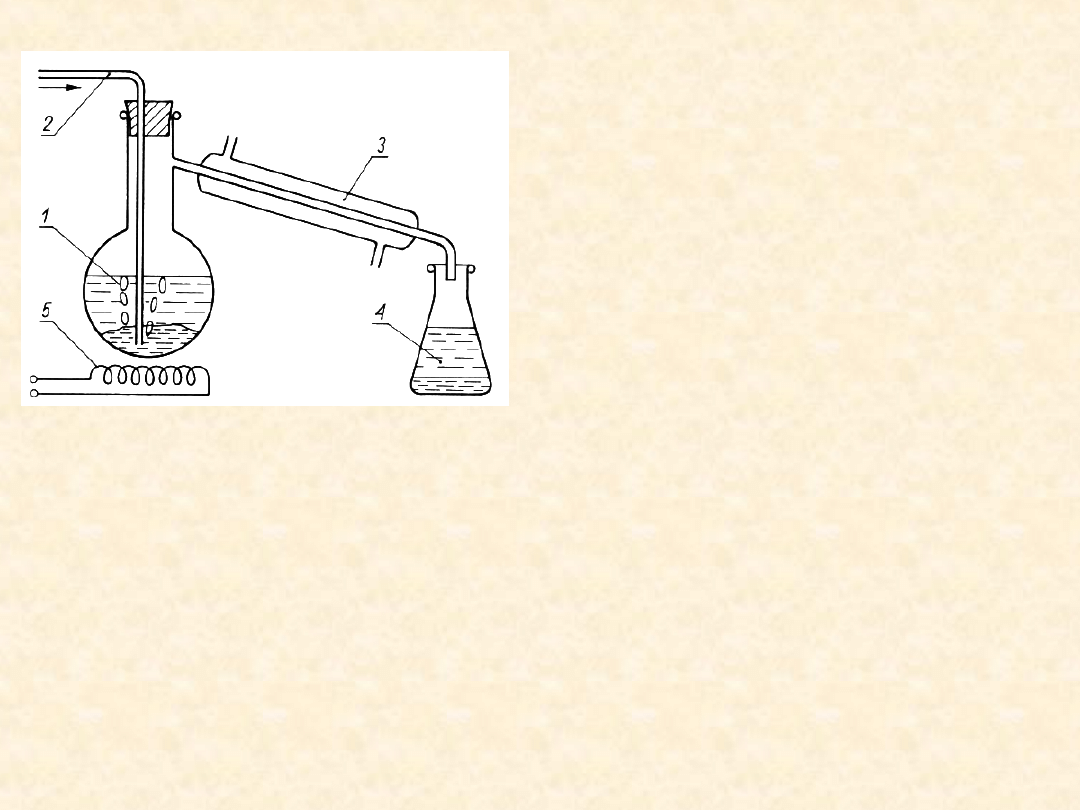
55
Destylacja z parą
wodną.
Mieszania wody i
zanieczyszczo- nej
(głównie smolistymi
produk- tami rozkładu)
substancji nie
mieszającej się
praktycznie z wodą wrze
w kolbie (1) mieszana
intensywnie
strumieniem przeg-
rzanej pary wodnej.
Układ jest
heteroazeotropem, przy
czym P
*
S
<< P
*
H2O
.
Prężność pary nad mieszaniną dwóch „czystych”
się cieczy jest równa sumie prężności par P =
P
*
H2O
+ P
*
S
> P
*
H2O
, wskutek czego T
w
< T
*
H2O.
Opuszczająca kolbę para jest całkowicie
skraplana w chłodnicy (3) i rozdziela się na
„czystą wodę” oraz „czystą substancję S” (tzn.
pozbawioną substancji smolistych). Metodę
stosuje się do wstępnego oczyszczenia substancji
S zanieczyszczonej podczas jej syntezy w wysokiej
temperaturze produktami pirolizy.

56

57
Jeżeli coś może się nie udać –
nie uda się na pewno.
Jeżeli udoskonalasz coś
dostatecznie długo – na pewno
to zepsujesz.
(wybrane prawa Murphy’ego)
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
- Slide 40
- Slide 41
- Slide 42
- Slide 43
- Slide 44
- Slide 45
- Slide 46
- Slide 47
- Slide 48
- Slide 49
- Slide 50
- Slide 51
- Slide 52
- Slide 53
- Slide 54
- Slide 55
- Slide 56
- Slide 57
Wyszukiwarka
Podobne podstrony:
12a Równowaga ciecz para w układach dwuskładnikowych (a)id 14224 ppt
12a Równowaga ciecz para w układach dwuskładnikowych (a)id 14224 ppt
13b Równowaga ciecz kryształ w układach dwuskładnikowych (b)id 15112 ppt
13a Równowaga ciecz kryształ w układach dwuskładnikowych (a)id 15105 ppt
Chemia Fizyczna - dokumenty, wyk%B3ad 8, Układy dwuskładnikowe - równowaga ciecz - para
Równowaga ciecz - para, Studia, Politechnika
Fizyczna Ćw 5 1 równowaga ciecz para
Równowaga ciecz para
Równowaga ciecz para
Równowaga ciecz para a
Równowaga ciecz para
Sprawozdanie 12 do druku, Studia, Chemia fizyczna, Laborki, 12 - Równowaga fazowa ciecz-para
emila12lab, Studia, Chemia fizyczna, Laborki, 12 - Równowaga fazowa ciecz-para
diagram fazowy KasiaMajcher, Wyznaczanie diagramu fazowego ciecz-para dla układu dwuskładnikowego
8.RÓWNOWAGI FAZOWE W UKŁADACH DWUSKŁADNIKOWYCH, Politechnika Łódzka, Technologia Żywności i Żywienie
więcej podobnych podstron