
Liczby kwantowe
1.Kwantowanie energii, główna liczba kwantowa.
2.Orbitalny moment pędu elektronu, orbitalna liczba kwantowa,
orbitalna magnetyczna liczba kwantowa.
3.Spin elektronu, spinowa liczba kwantowa, spinowa magnetyczna
liczba kwantowa.
4.Całkowity moment pędu elektronu.
5.Subtelna struktura widm liniowych.
6.Zasada Pauliego.

1.Kwantowanie energii, główna liczba kwantowa.
4
2 2
2
0
1
8
e m
h n
e
e
=-
�
kwantowanie energii
n = 1,2,3.....
n – główna liczba kwantowa
2
1
n
e :
~
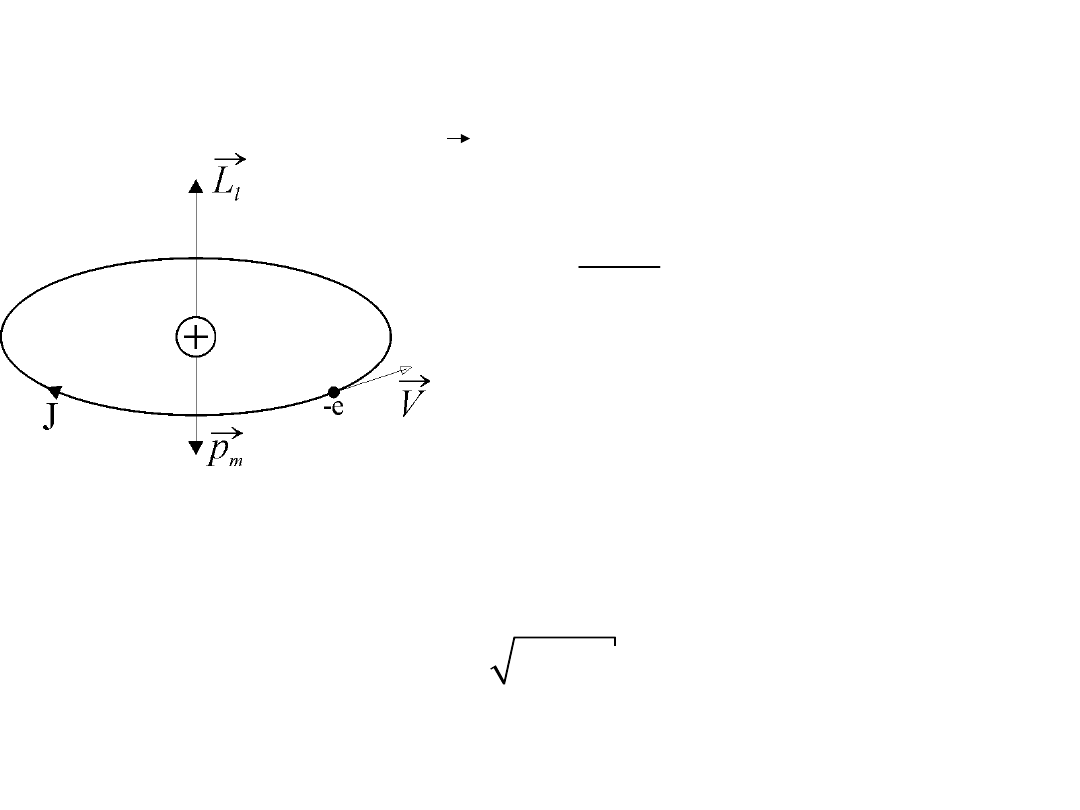
2.Orbitalny moment pędu elektronu, orbitalna liczba kwantowa,
orbitalna magnetyczna liczba kwantowa.
2
m
l
e
e
p
L
m
=
Wartości orbitalnego momentu pędu
l
L
r
są skwantowane. Wartości
l
L
związane są z liczbą kwantową
l
relacją:
l
– orbitalna liczba kwantowa
, l
= 0, 1, 2 ... (n
- 1)
p
m
– moment magnetyczny
,
( 1)
l
L
l l
=
+ h
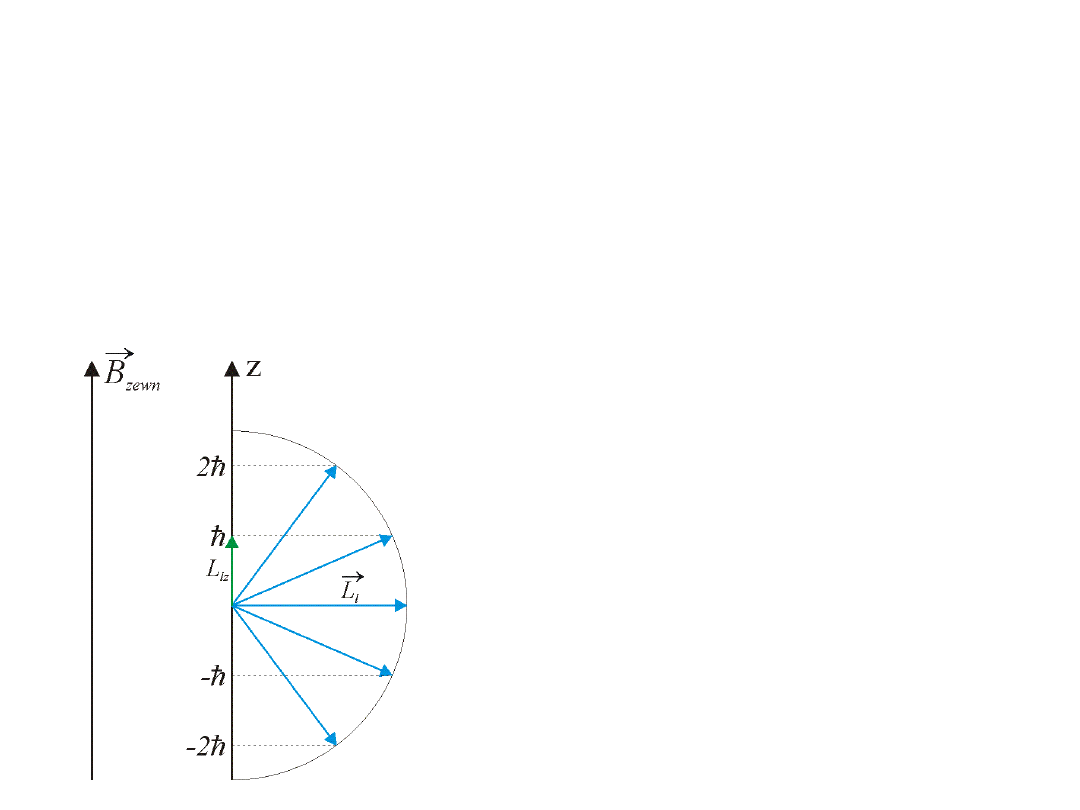
Kwantowanie przestrzenne
l
L
r
Wektor momentu pędu elektronu może mieć tylko takie kierunki w
przestrzeni, dla
l
L
r
których rzuty wektorana kierunek zewnętrznego pola magnetycznego (np. oś z)
przybierają wartości będące wielokrotnością
h
.
gdzie:
m
l
– orbitalna magnetyczna liczba
kwantowa,
m
l
= 0, 1, 2 ...
l
lz
l
L
m
= h
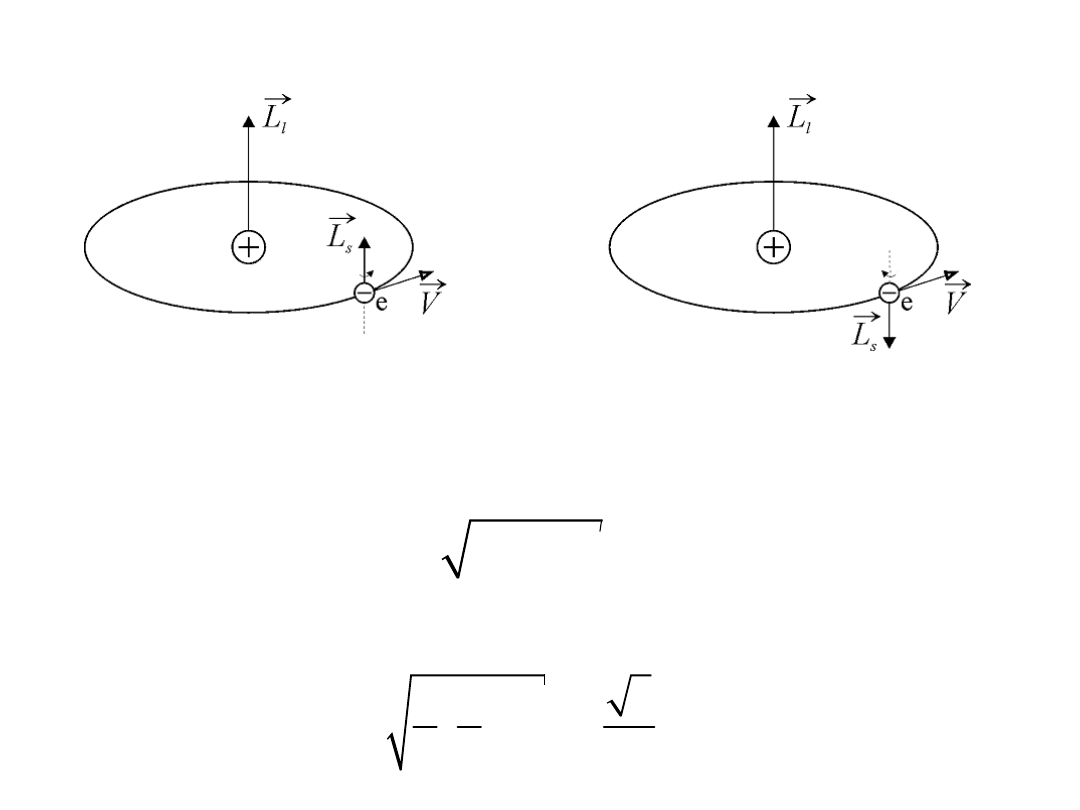
3.Spin elektronu, spinowa liczba kwantowa, spinowa magnetyczna liczba kwantowa.
s – spinowa liczba kwantowa, s = ½
stąd:
1 1
3
(
1)
2 2
2
s
L =
+
=
h
h
Elektronowi przypisuje się własny moment pędu
s
L
r
(tzw. spin) i związany z nim
magnetyczny moment własny elektronu
ms
p
r
.
Z rozważań mechaniki kwantowej wynika, że spin powinien być skwantowany
według prawa
(
1)
s
L
s s
=
+ h

Podobnie skwantowany jest rzut spinu na kierunek zewnętrznego pola
magnetycznego (np. oś z)
sz
s
L
m
= h
gdzie:
m
s
– magnetyczna liczba spinowa,
m
s
= 1/2
Dla danego zespołu wartości liczb skwantowych n,
l
, m
l
istnieją
dwie dozwolone wartości liczby m
s
( 1/2).
2
1
sz
L

4. Całkowity moment pędu elektronu.
Elektronowi przypisuje się orbitalny moment pędu
l
L
r
oraz spinowy moment pędu (spin)
s
L
r
Całkowity moment pędu elektronu
l
s
J
L L
= +
r
r
r
wartość całkowitego momentu pędu
j = l
s,
j = l
1
/
2
(
1)
J
j j
=
+ h
(*)
Wartość całkowitego momentu pędu jest skwantowana.
Całkowita moment pędu elektronu nie może przyjmować dowolnej
wartości, a jedynie wartości określone wzorem (*).

W zależności od orientacji rzutu spinu na oś z (zgodnie albo
przeciwnie do natężenia pola magnetycznego) dodatkowa
energia związana ze spinem może zwiększyć lub zmniejszyć
energię związaną z ruchem orbitalnym. Tym tłumaczy się
subtelną strukturę widm liniowych (rozszczepienie linii
widmowych).
sz
L
lz
L
sz
L
lz
L
z
J
z
J
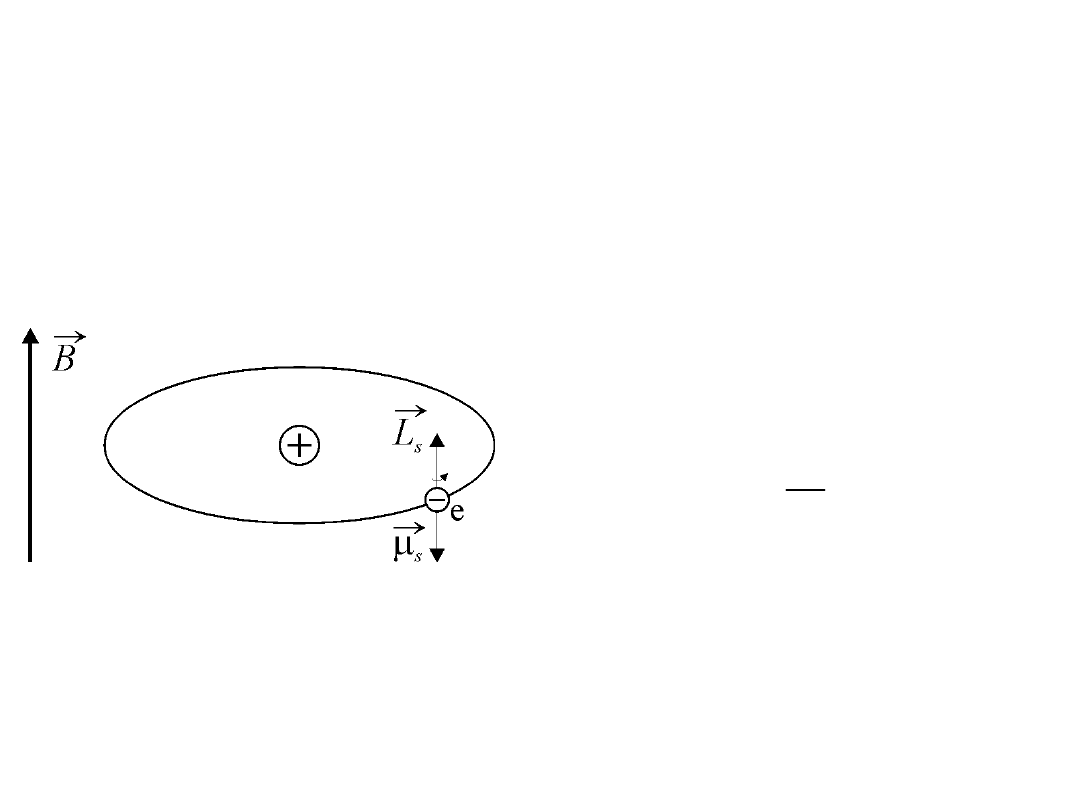
Ze spinowym momentem pędu
s
L
r
związany jest spinowy moment magnetyczny
s
m
r
Spinowy moment magnetyczny
elektronu zwrócony przeciwnie
do spinowego momentu pędu
ma wartość:
s
s
e
L
m
m =
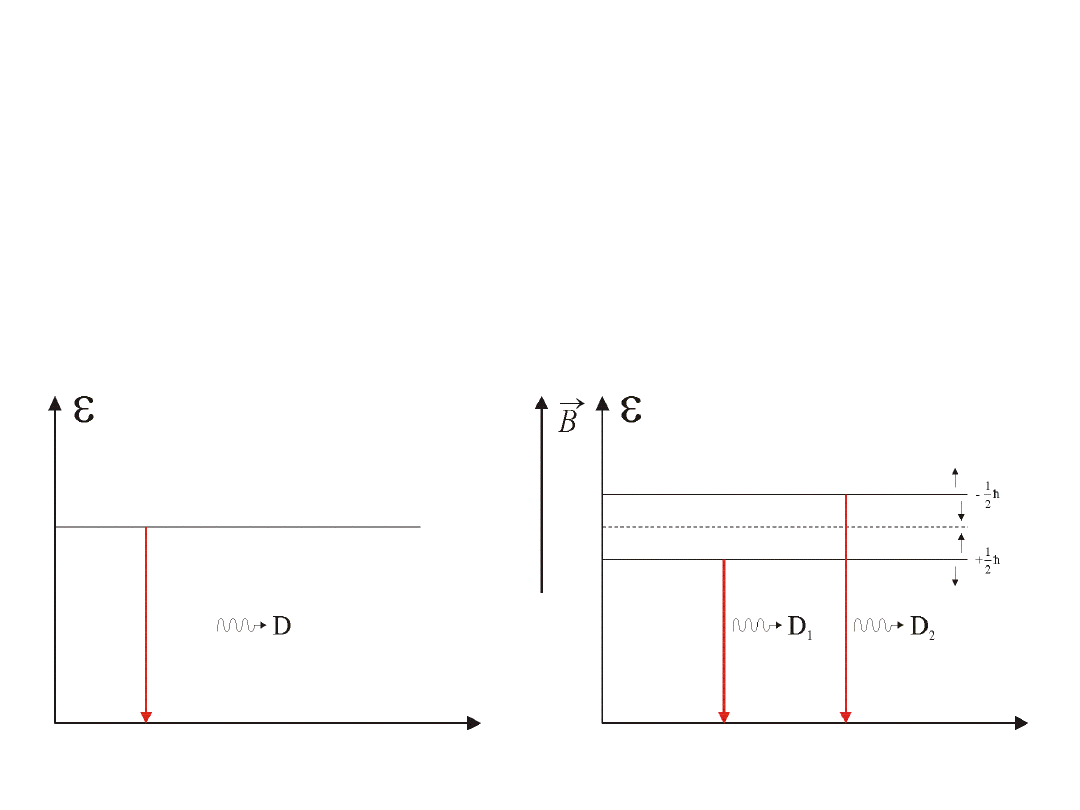
Linia widmowa D w widmie sodu składa się z dwóch linii D
1
i D
2
o długościach fal:
o
1
o
2
5890,0A
5895,9A
l
l
=
=
Liniom tym odpowiadają dwa poziomy energetyczne wzbudzonego atomu sodu.
5. Subtelna struktura widm liniowych.
poziom wzbudzony
poziom podstawowy
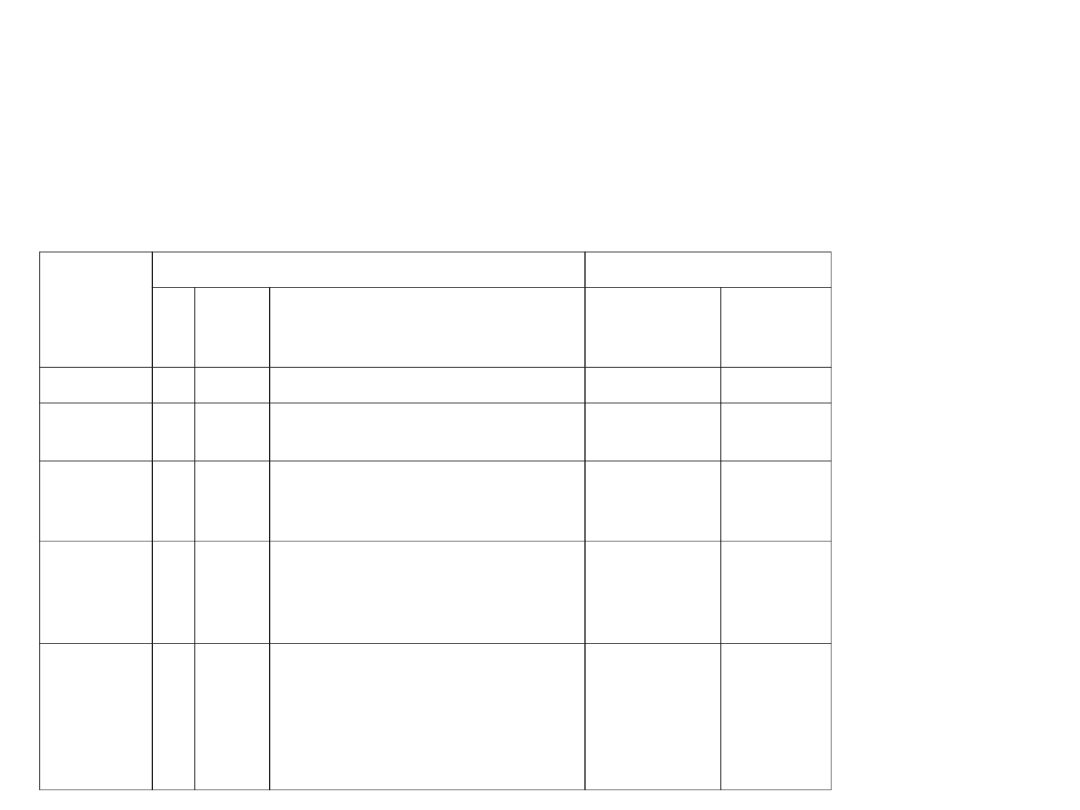
6. Zasada Pauliego
W atomie nie może być dwóch elektronów o
identycznych
wartościach czterech liczb kwantowych.
n = 1, 2, 3 ...
l = 0, 1, 2 ... (n - 1)
m
l
= 0, 1, 2 ...
l
m
s
= 1/2
Powłoka
Liczby kwantowe
Liczba stanów
n
l
m
l
w
podpowłoce
w
powłoce
K
1
0 (s)
0
2
2
L
2
0 (s)
1 (p)
0
-1, 0, +1
2
6
8
M
3
0 (s)
1 (p)
2 (d)
0
-1, 0, +1
-2, -1, 0, +1, +2
2
6
10
18
N
4
0 (s)
1 (p)
2 (d)
3 (f)
0
-1, 0, +1
-2, -1, 0, +1, +2
-3, -2, -1, 0, +1, +2, +3
2
6
10
14
32
O
5
0 (s)
1 (p)
2 (d)
3 (f)
4 (g)
0
-1, 0, +1
-2, -1, 0, +1, +2
-3, -2, -1, 0, +1, +2, +3
-4, -3, -2, -1, 0, +1, +2, +3,
+4
2
6
10
14
18
50
(x 2 bo liczba
spinowa może
przyjmować
wartości
±
1
/
2
)
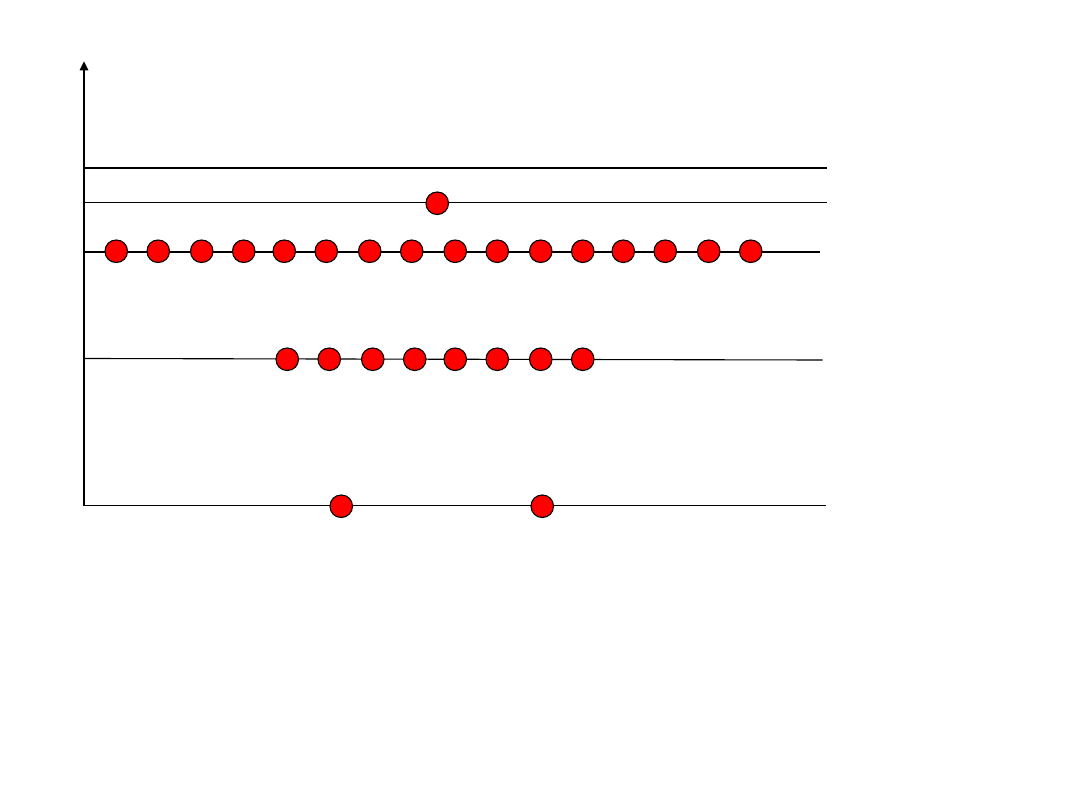
ε
n=4
n=3
n=2
n=1
2
8
18
1
Układ elektronów w atomie miedzi
29
Cu
2 + 8 + 18 + 1 = 29
Document Outline
Wyszukiwarka
Podobne podstrony:
19 Liczby kwantowe
liczby kwantowe
Liczby kwantowe, chemia(2)
Liczby kwantowe, Notatki i materiały dodatkowe, Chemia, materiały dodatkowe
Liczby kwantowe, chemia dla liceum
LICZBY KWANTOWE I PRAWA ZACHOWANIA
Liczby kwantowe chemia dla liceum
liczby kwantowe
06 Orbitale i liczby kwantowe
5) Liczby kwantowe
więcej podobnych podstron