

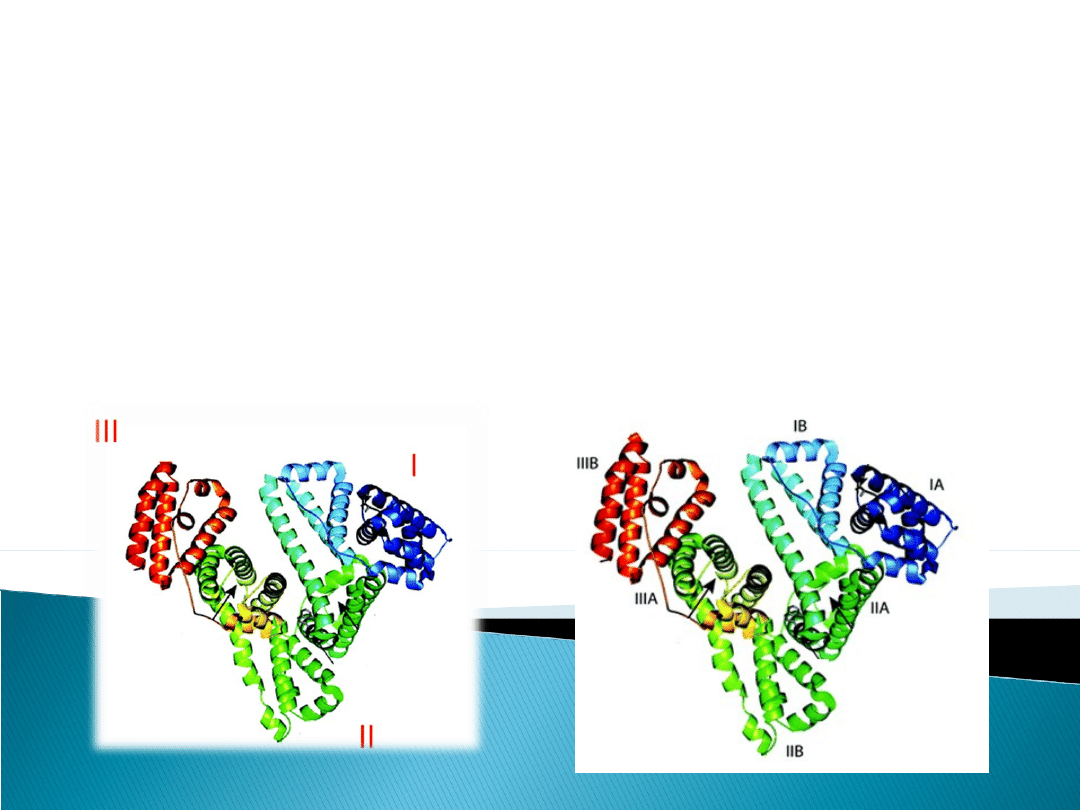
FAKT I- cząsteczka albuminy (66,5kDa = 66.500 g/mol
) jest zbudowana z pojedynczego łańcucha 585
aminokwasów. Będąc białkiem występującym w osoczu
w stężeniu aż 0,6 mM.
Dla zrozumienia biologicznej funkcji tego białka
potrzebne są informacje na temat jej struktury
trzeciorzędowej wykazującej obecność trzech
strukturalnych domen (I, II, III) z których każda złożona
jest z dwóch subdomen nazywanych A i B.

FAKT II – biologiczna funkcja albuminy
związana jest między innymi z obecnością
ujemnego ładunku (netto) na powierzchni tego
białka, ograniczającego kontakt z powierzchnią
komórek śródbłonka naczynia krwionośnego i
warunkującego ciśnienie osmotyczne
( zwane ciśnieniem onkotycznym).

FAKT III – na powierzchni trzech domen
albuminy znajdują się miejsca wiązania
drobnocząsteczkowych ligandów, takich jak:
a)
Wolne kwasy tłuszczowe
( krótko i długo łańcuchowe)
b)
Cholesterol
c)
Bilirubinę
d)
Wolny hem
e)
Leki
f)
Jony metali
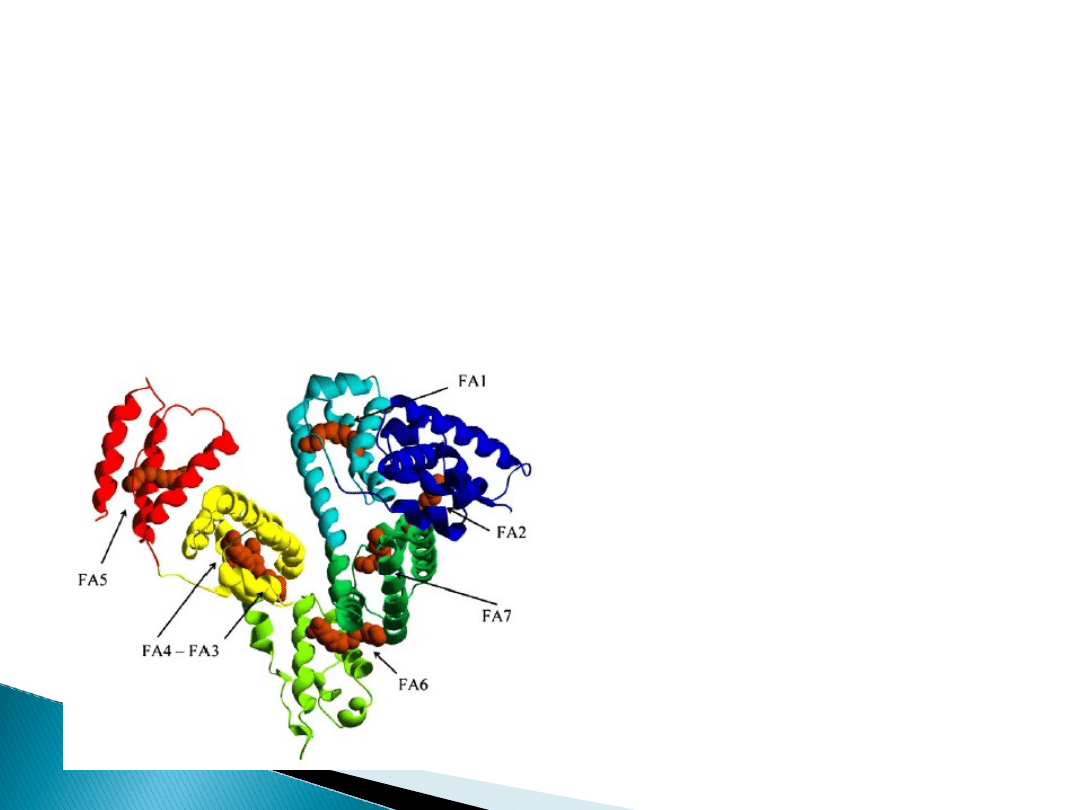
Kwasy tłuszczowe uwalniane są w procesie
lipolizy, a albumina dostarcza je do
odpowiednich komórek naszego organizmu.
Cząsteczka albuminy wykazuje aż 7
odrębnych miejsc wiążących kwasy
tłuszczowe FA1-FA7 .
FA2, FA4, FA5 mają największe powinowactwo do
długołańcuchowych kwasów tłuszczowych. FA6 i FA7
wiążą kwasy tłuszczowe wyłącznie wiązaniami
hydrofobowymi
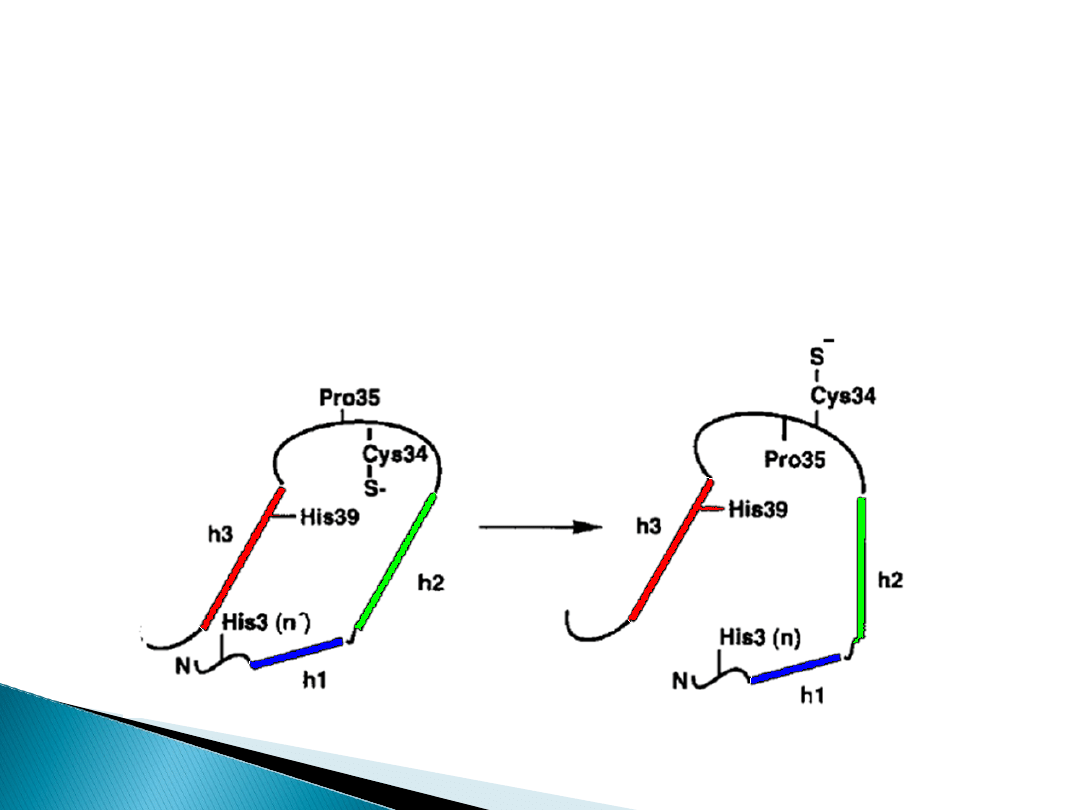
W warunkach fizjologicznych do jednej cząsteczki albuminy
wiążą się dwie cząsteczki długołańcuchowych kwasów
tłuszczowych FFA.
W stanach chorobowych, takich jak cukrzyca wszystkie
miejsca wiążące mogą ulec wysyceniu. Obecność trzech
cząsteczek FFA i więcej związanych z cząsteczką albuminy
wywołuje zmianę konformacji całej cząsteczki, zmieniając
dramatycznie strukturę N-końcowej pętli białka zawierającej
jedyną wolną resztę cysteiny występującej w formie tiolanu.
3
FFA

Znaczenie 34 cysteiny albuminy
dla biologicznej funkcji tego
białka.
Albumina ludzka zawiera 17 mostków
dwusiarczkowych (S-S) i tylko jedną resztę
wolnej cysteiny w pozycji 34. Cysteina 34
występuje w formie tiolanu ( anionu 34 S ),
co radykalnie zwiększa jej zdolność
do reagowania i neutralizacji toksycznych
cząsteczek nadtlenku wodoru (H
2
O
2
).
Cys
34
S + H
2
O
2
Cys
34
OH + H
2
O
_
_
H
+
Kwas sulfenowy
cysteiny
Reakcja powyższa dokumentuje biologiczną funkcję albuminy jako
przeciwutleniacza ( neutralizuje toksyczny nadtlenek wodoru)

Wolne kwasy tłuszczowe obecne w osoczu
diabetyków w nadmiarze, wiążąc się w swoich
miejscach wiązania indukują zmianę całej
cząsteczki albuminy przenoszoną na
subdomenę IA zawierającą cysteinę 34.
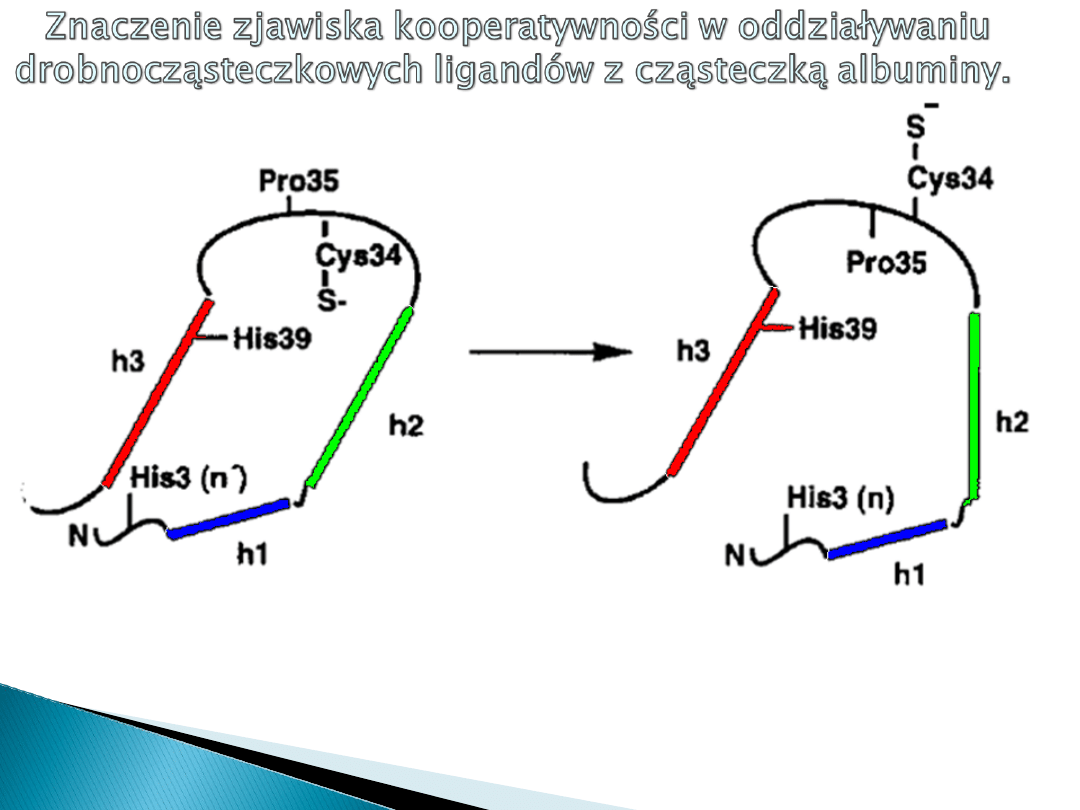
Zlokalizowana na dnie kieszonki
mieszczącej się w domenie 1A od
końca
N-aminowego
Przeniesiony na powierzchnię
cząsteczki albuminy w następstwie
interakcji albuminy z więcej niż
dwiema cząsteczkami
długołańcuchowych kwasów
tłuszczowych FFA.
3
FFA
TIOLAN CYSTEINY 34
TIOLAN CYSTEINY 34
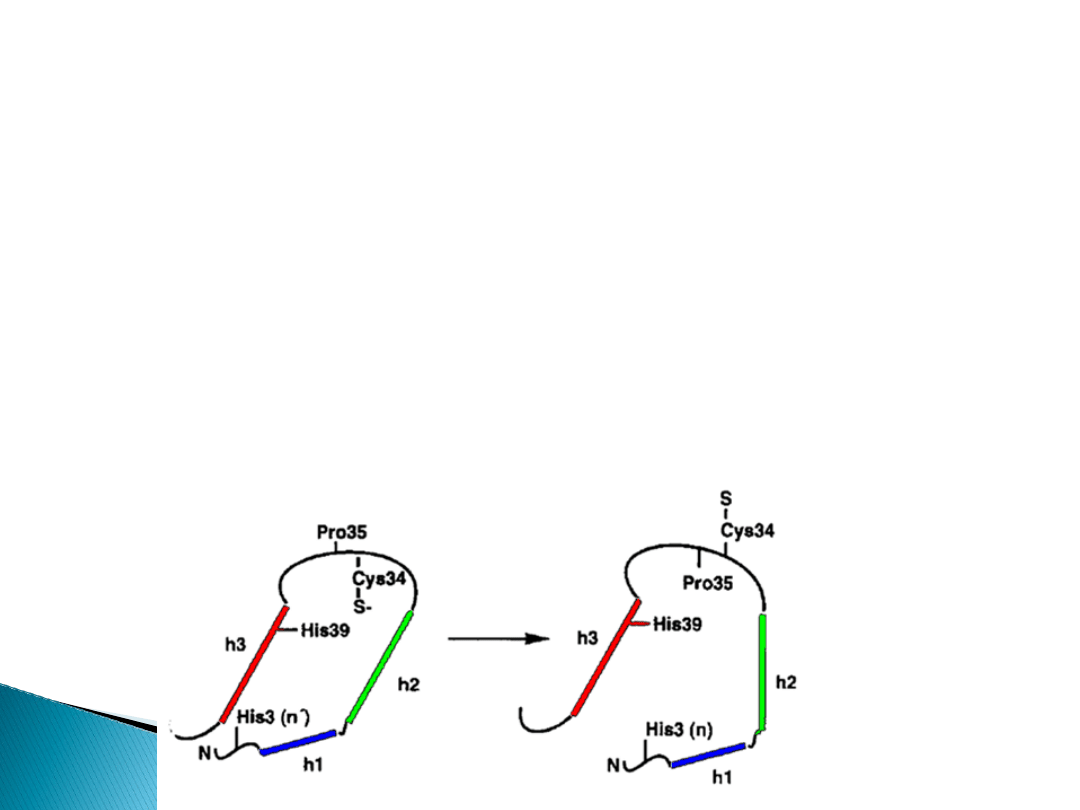
W warunkach prawidłowych ( do 2 reszt FFA związanych
z albuminą) tiolan cysteiny 34 znajduje się na dnie
kieszonki domeny IA, a więc jest odseparowany
przestrzennie (topologicznie ) od cząsteczek H
2
O
2
.
Wyeksponowanie reszty tiolanu cysteiny 34 na
powierzchnię domeny IA ułatwia kontakt z ligandem
jakim jest H
2
O
2
.
Zjawisko dodatniej interakcji pomiędzy różnymi
ligandami FFA i H
2
O
2
w przypadku albuminy nazywamy
heterotropową kooperatywnością dodatnią.
OH
3
FFA
H
2
O
2

Wysokie stężenia glukozy i FFA we krwi
diabetyków skutkują wzrostem aktywności
błonowej oksydazy NADPH (patrz wykład 1!)
oraz stężenia produktu reakcji tego enzymu –
H
2
O
2.

W osoczu ludzkim tlenek azotu (NO) znany czynnik
wazodylatacyjny ( obniża ciśnienie krwi) występuje w
stężeniu 7 µM z czego 82% to tlenek azotu związany z
grupą 34 cysteiny. Utlenienie cysteiny skutkuje brakiem
wiązania tlenku azotu, a co za tym idzie obkurczeniem
naczyń krwionośnych w tym zaopatrujących w tlen nerwy
obwodowe, co leży u podstawy mechanizmu
obwodowej
polineuropatii cukrzycowej.
Biorąc pod uwagę biologiczne
skutki wiązania nadmiaru cząsteczek kwasów tłuszczowych
do albuminy w cukrzycy, tzn aktywację utlenienia 34
cysteiny przez FFA ( kooperatywność heterotropowa
dodatnia). Finalnym efektem biologicznym, będzie
obniżenie zdolności utlenionej cząsteczki albuminy do
wiązania i dostarczania tlenku azotu do komórek
śródbłonka. Obserwujemy więc finalnie
efekt allosteryczny
ujemny
w nawiązaniu do funkcji biologicznej albuminy.

FAKT IV- w cząsteczce albuminy występują
dwa miejsca wiązania leków, nazwane od
nazwiska odkrywcy miejscem Sudlowa I i II.
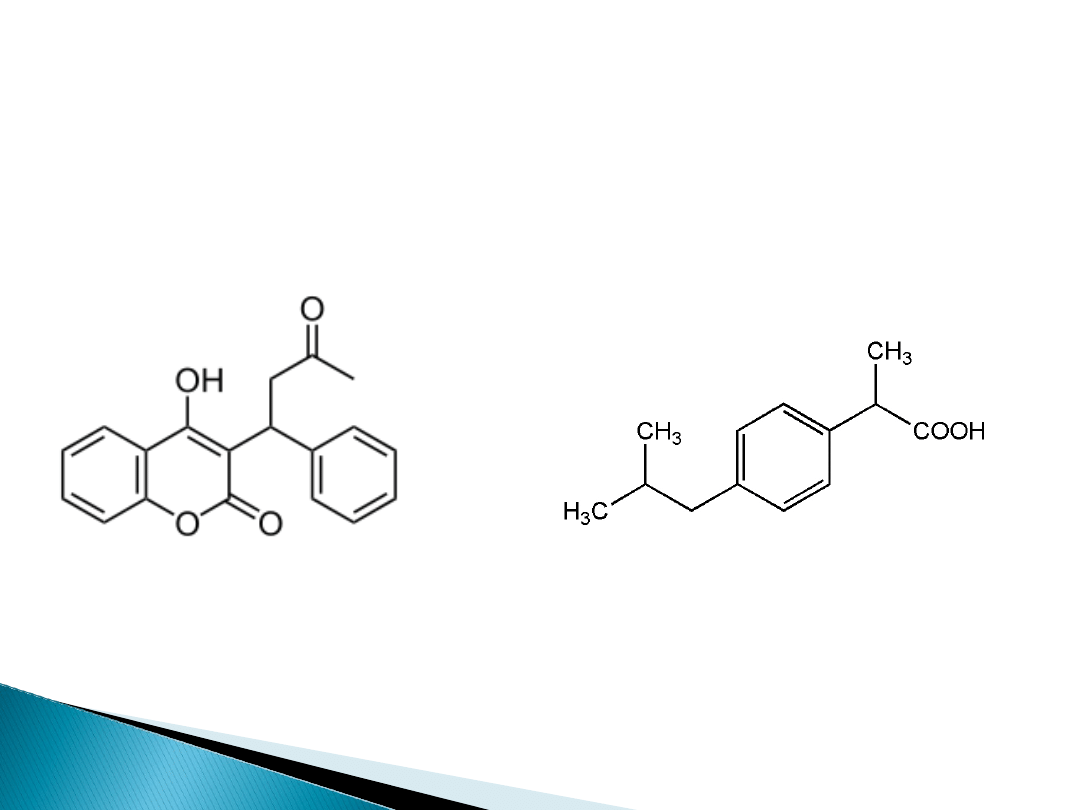
Miejsce Sudlowa I jest swoistym między
innymi dla wiązania leku
przeciwzakrzepowego warfaryny, natomiast
miejsce II wiąże ibuprofen- lek
przeciwzapalny i przeciwbólowy.
warfaryn
a
ibuprofe
n

Oba te leki wykazują kooperatywność
heterotropową negatywną w stosunku do siebie.
Jakie konsekwencje ma to zjawisko dla praktyki
lekarskiej?
Odpowiedź: Lekarz przepisujący duże ilości
ibuprofenu i warfaryny musi liczyć się z negatywnym
efektem swojego postępowania (efekt jatrogenny).
Uwolniona w wyniku negatywnej kooperatywności
warfaryna może wywołać niepożądane krwawienia.
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
Wyszukiwarka
Podobne podstrony:
albumina uzupelnienie do wykladu (1)
albumina uzupelnienie do wykladu (1)
MATERIAŁY UZUPEŁNIAJĄCE DO WYKŁADU 2012
Uzupełnienie do wykładu 1, WSZOP INŻ BHP, VI Semestr, WENTYLACJA
MATERIAŁY UZUPEŁNIAJĄCE DO WYKŁADU 2012 2
więcej podobnych podstron