
FENOLE
FENOLE

PRZYKŁADY
WAŻNIEJSZYCH
FENOLI
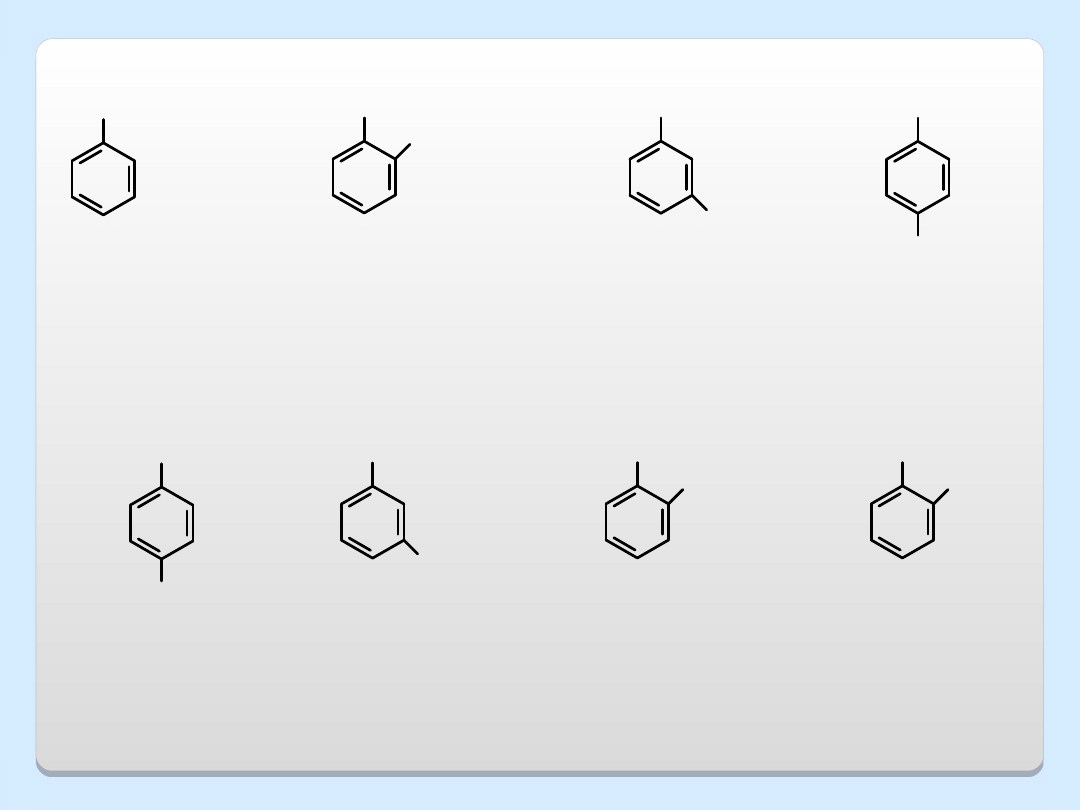
OH
OH
CH
3
OH
Cl
OH
NH
2
fenol
4-aminofenol
(p-aminofenol)
3-chlorofenol
(m-
chlorofenol)
2-metylofenol
(o-krezol)
zast. konserwacja drewna
OH
OH
OH
OH
OH
OH
COOH
OH
benzeno-1.4-diol
(hydrochinon)
zast. fotografia
benzeno-1.3-diol
(rezorcyna)
benzeno-1.2-diol
(pirokatechol)
kwas o-hydroksy-
benzoesowy
(kwas salicylowy)
zast. przemysł farmaceutyczny
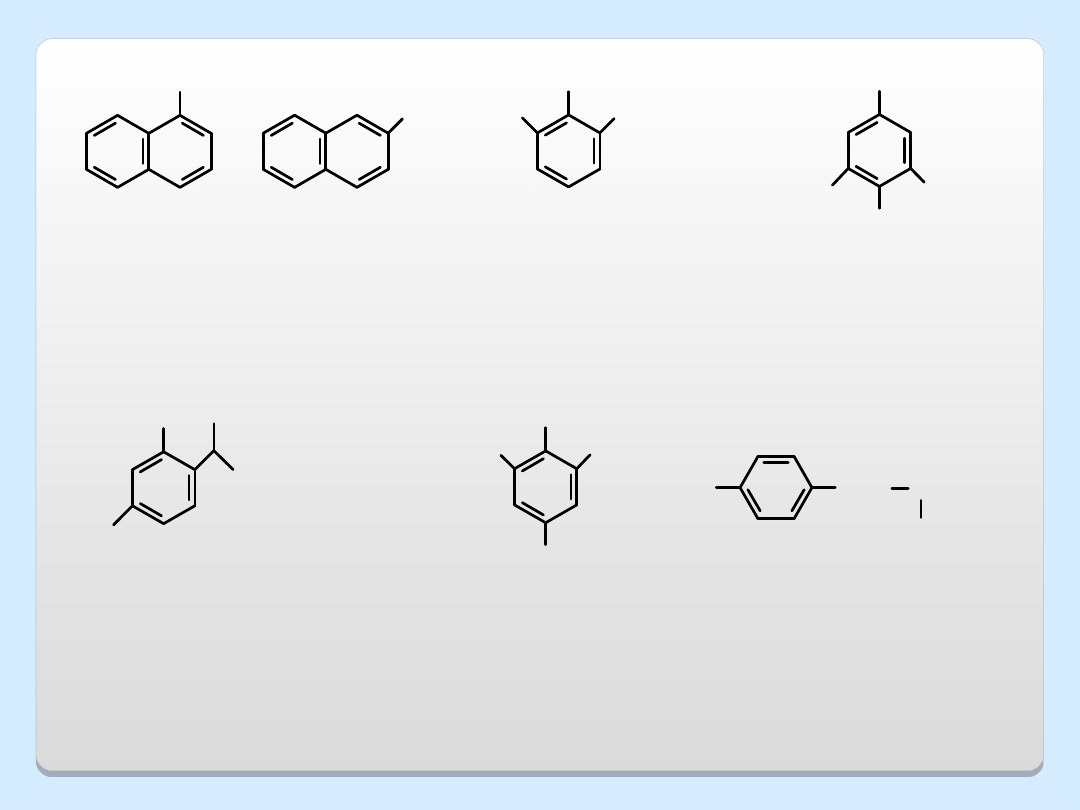
OH
OH
OH
HO
OH
COOH
OH
OH
HO
kwas 3,4,5-trihydroksy-
benzoesowy
(kwas galusowy)
zast. garbniki
1-naftol
2-naftol
benzeno-1,2,3-triol
(pirogalol)
zast. usuwanie tlenu z
mieszanin gazowych
zast. przemysł barwników
OH
OH
NO
2
NO
2
O
2
N
HO
CH
2
CHCOOH
NH
2
2,4,6-trinitrofenol
(kwas pikrynowy)
zast. materiał
wybuchowy
tyrozyna
aminokwas białkowy
2-izopropylo-5-metylofenol
(tymol)
wyst. olejek tymiankowy
zast. stomatologia
wł. bakteriobójcze i
przeciwrobacze
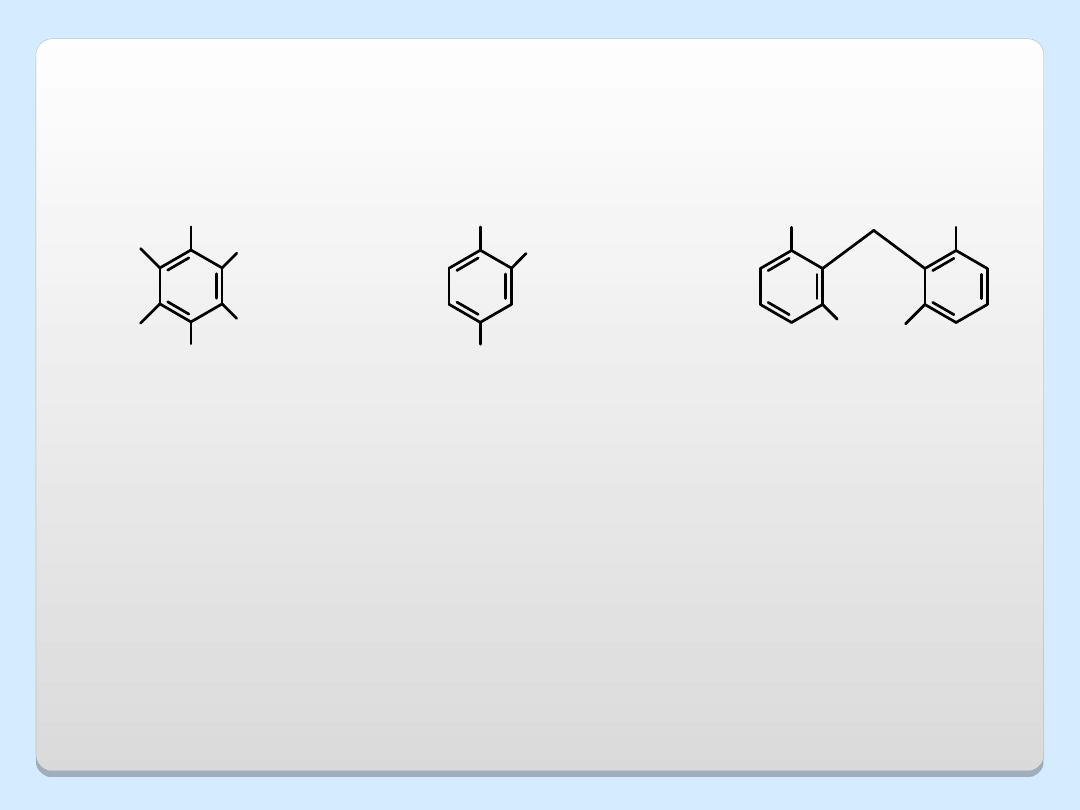
OH
Cl
Cl
Cl
Cl
Cl
O
CH
2
COOH
Cl
Cl
Cl
OH
Cl
OH
heksachlorofen
(środek
antyseptyczny)
kwas
2,4-
dichlorofenoksyoctowy
2,4-D (herbicyd)
pentachlorofenol
(środek do
konserwacji drewna)
PRZEMYSŁOWE OTRZYMYWANIE
FENOLU
CH
H
3
C
CH
3
C
H
3
C
CH
3
O
OH
OH
C O
H
3
C
H
3
C
kumen
wodoronadtlenek
kumenu
aceton
fenol
O
2
H+
H
2
O
+
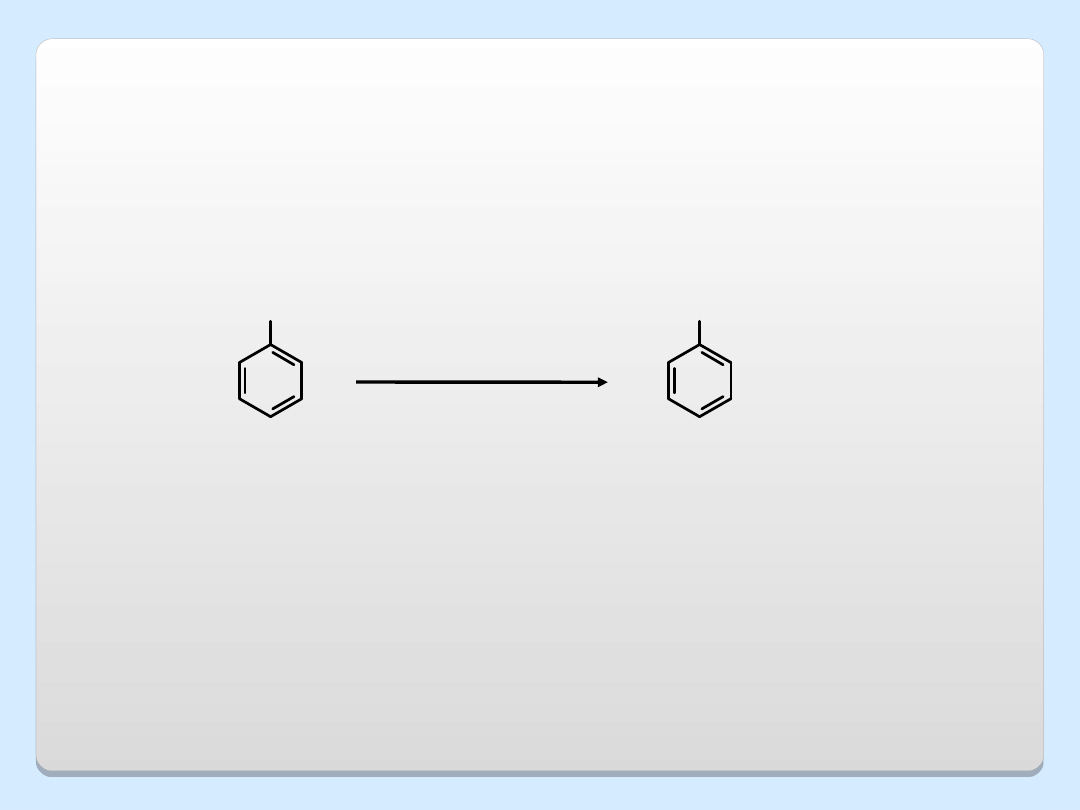
INNE METODY OTRZYMYWANIA FENOLI
OH
Cl
Na
Cl
+
1)NaOH,H
2
O
340
o
C, 150 atm
2)
H
3
O
+
fenol
chlorobenze
n
CH
3
Br
NH
2
CH
3
Br
N
2
+
HSO
4
-
CH
3
Br
OH
HNO
2
H
2
SO
4
H
3
O+
2-bromo-4-metyloanilina
2-bromo-4-metylofenol
(92%)
CH
3
CH
3
SO
3
H
CH
3
OH
SO
3
H
2
SO
4
2.H
3
O
+
1.
NaOH
300
o
C
toluen
kwas p-
toluenosulfonowy
p-metylofenol
(72%)

Właściwości fizyczne niektórych fenoli
Fenol
Temp.
topn.[
o
C]
Temp.
wrzenia [
o
C]
pK
a
Silniejszy
kwas
Słabszy
kwas
Kwas octowy
a
4,75
2,4,6-Trinitrofenol
122
―
0,60
p-Nitrofenol
115
―
7,15
o-Nitrofenol
97
―
7,17
m-Nitrofenol
45
216
8,28
p-Jodofenol
94
―
9,30
p-Bromofenol
66
238
9,35
p-Chlorofenol
43
220
9,38
Fenol
43
182
9,89
p-Metylofenol (p-
krezol)
35
202
10,17
p-Metoksyfenol
57
243
10,21
p-Aminofenol
186
―
10,46
Etanol
16,00
a
Wartości dla kwasu octowego i etanolu służą jako odnośniki
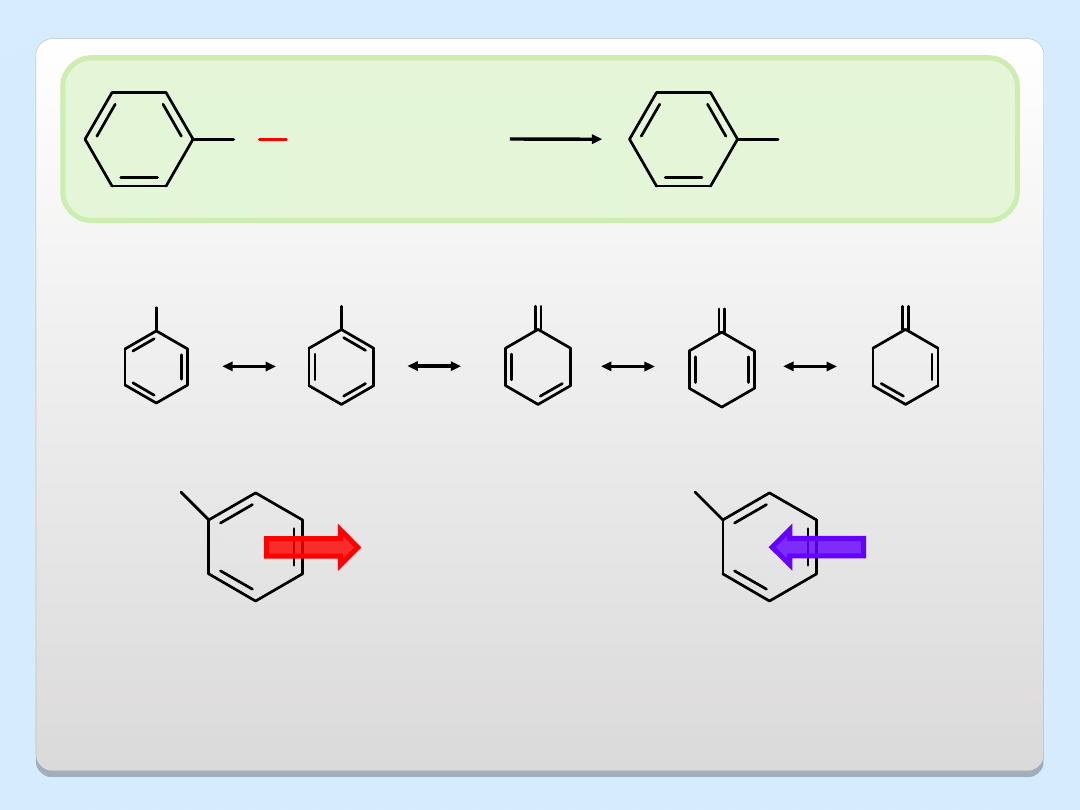
O H
NaOH
O
-
Na
+
H
2
O
+
+
O
....
.. –
O
..
.. .. –
.. ..
O
.. _
O
.. _
.. ..
O
.. ..
_ ..
O
.. .. ..
–
GEA
O
.. .. ..
–
GED
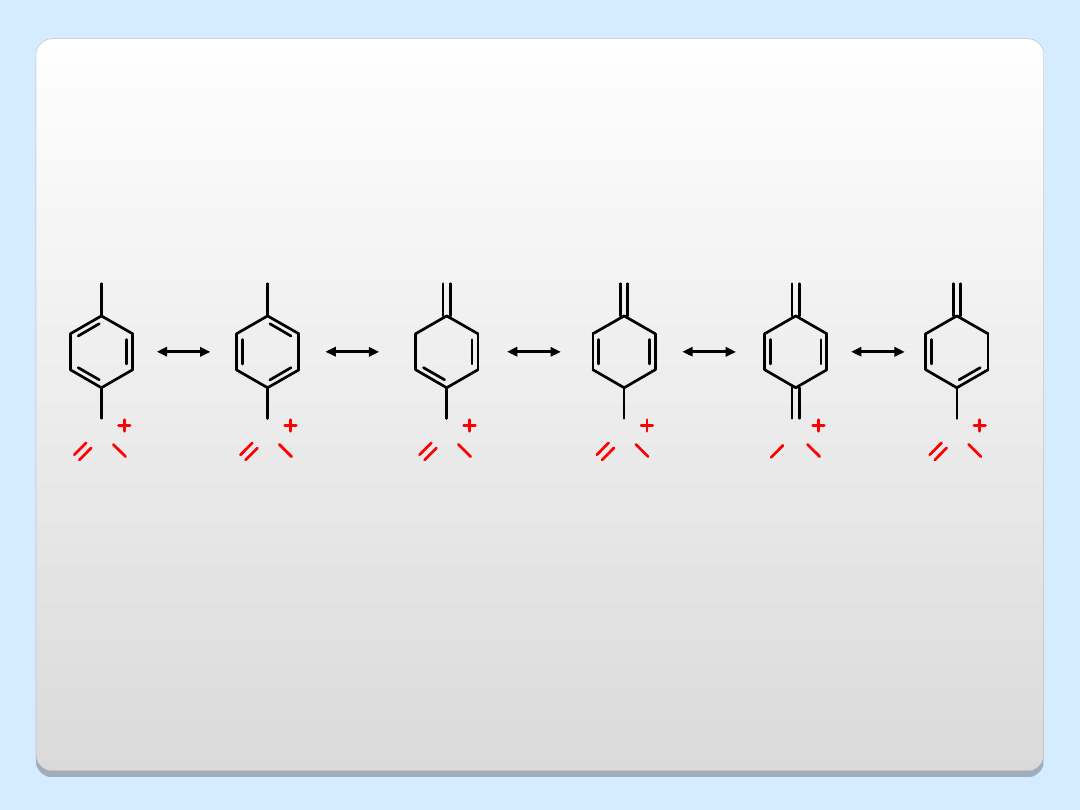
Grupy wyciągające elektrony,
grupy elektroakceptorowe (GEA)
stabilizują anion fenolanowy, co
powoduje wzrost kwasowości fenolu
Grupy oddające elektrony,
grupy elektrodonorowe (GED)
destabilizują anion fenolanowy, co
powoduje spadek kwasowości fenolu
O
N
O
O
–
–
..
.. ..
..
....
..
..
O
N
O
O
–
–
..
..
..
..
..
..
.. ..
O
N
O
O
–
..
..
.. ..
..
..
..
..–
O
N
O
O
–
..–
..
..
.. ..
..
..
..
O
N
O
O
–
–
.. ..
..
..
..
..
..
..
O
N
O
O
–
..–
..
..
..
....
..
..
Fenole ulegają podobnym reakcjom jak alkohole
•Tworzą estry – reakcja z kwasem karboksylowym z dodatkiem np.
H
2
SO
4
nie zachodzi (estryfikacja Fischera). Zachodzi natomiast reakcja z
chlorkiem kwasowym
•Tworzą etery – reakcja Williamsona zachodzi łatwiej niż w przypadku
alkoholu (fenolan powstaje łatwiej niż alkoholan)
TWORZENIE ESTRU
REAKCJA WILLIAMSONA SYNTEZY ETERÓW
OH
O
C
O
+
H
2
O
NaOH
fenol
chlorek benzoilu
benzoesan fenylu (96%)
C
Cl
O
OH
NO
2
O
CH
2
CH
2
CH
2
CH
3
NO
2
o-nitrofenol
1-bromobutan
eter butylowo-o-
nitrofenylowy (80%)
+
K
2
CO
3
aceton
CH
3
CH
2
CH
2
CH
2
Br
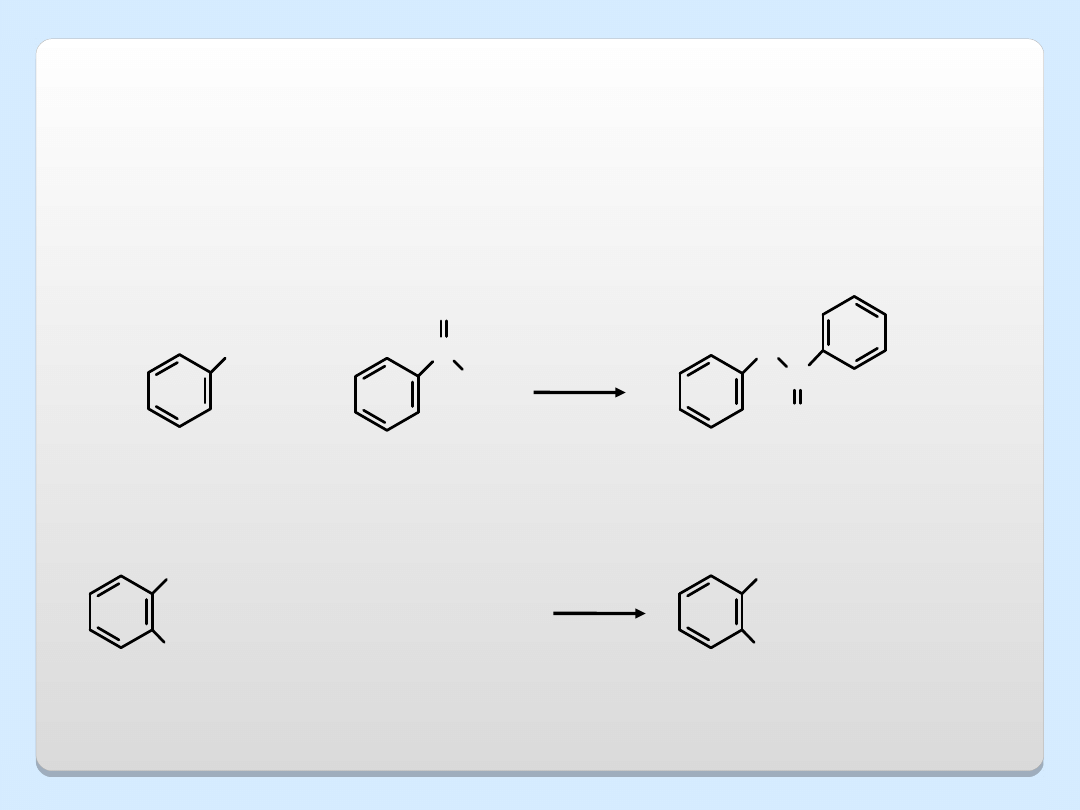
REAKCJA KARBOKSYLACJI KOLBEGO-SCHMITTA
OH
C
OH
O
(CH
3
CO)
2
O
kwas salicylowy
kwas acetylosalicylowy
(aspiryna)
O
..
.. .. –
Na
+
+
–
H
3
O+
fenolan
sodu
kwas salicylowy
O C O
O
C
H
O
O
O
H
C
O
H
O
O
C
OH
O
C
O
CH
3
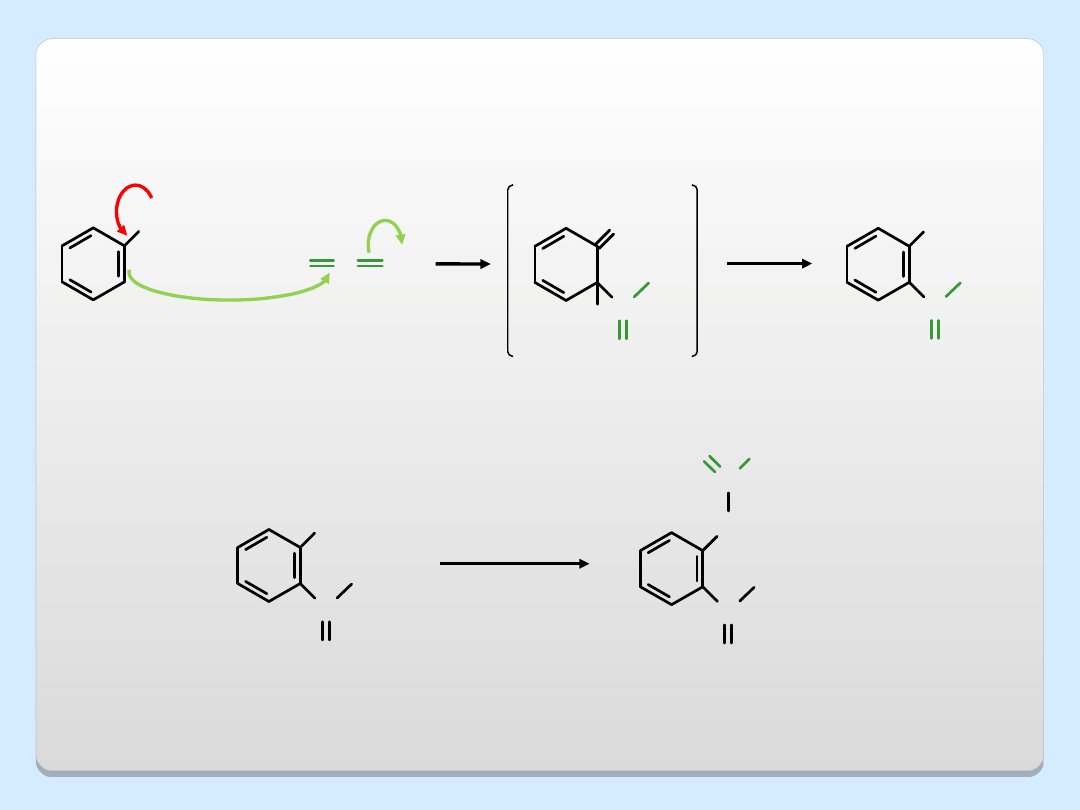
PRZEGRUPOWANIE CLAISENA
OH
O
-
Na
+
+
NaH
THF
roztwó
r
BrCH
2
CH=CH
2
fenolan
sodu
fenol
eter allilowo-fenylowy
O
CH
2
CH CH
2
eter allilowo-fenylowy
o-allilofenol
przegrupowanie Claisena
250
o
C
O
CH
2
CH
CH
2
OH
CH
2
CH CH
2
UTLENIANIE FENOLI
Utleniacze – Na
2
Cr
2
O
7
;
(KSO
3
)
2
NO – nitrozodisulfonian
potasu (sól Fremy’ego)
O
O
benzochinon
O
H
O
H
SnCl
2
, H
2
O
sól Fremy’ego
hydrochinon
OH
fenol
(KSO
3
)
2
NO
H
2
O
benzochinon (79%)
O
O
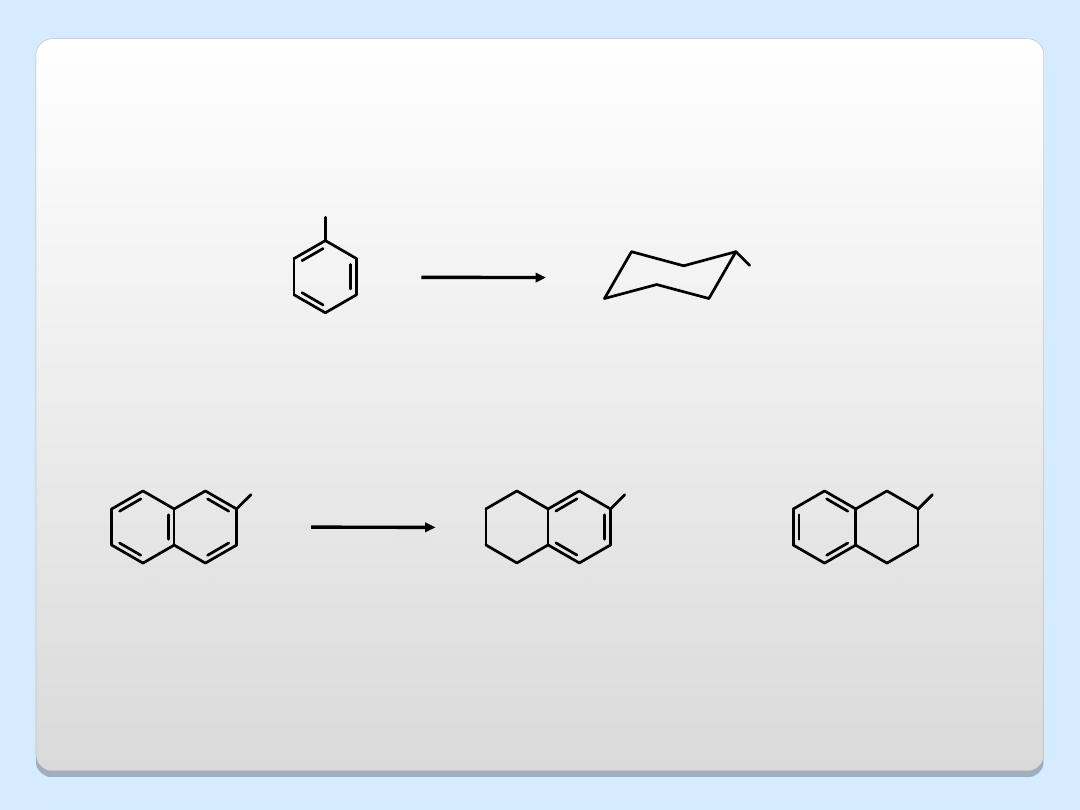
REDUKCJA FENOLI
OH
OH
H
2
, Ni
H
2
, Ni
OH
+
OH
OH
86%
7%

ETERY
ETERY
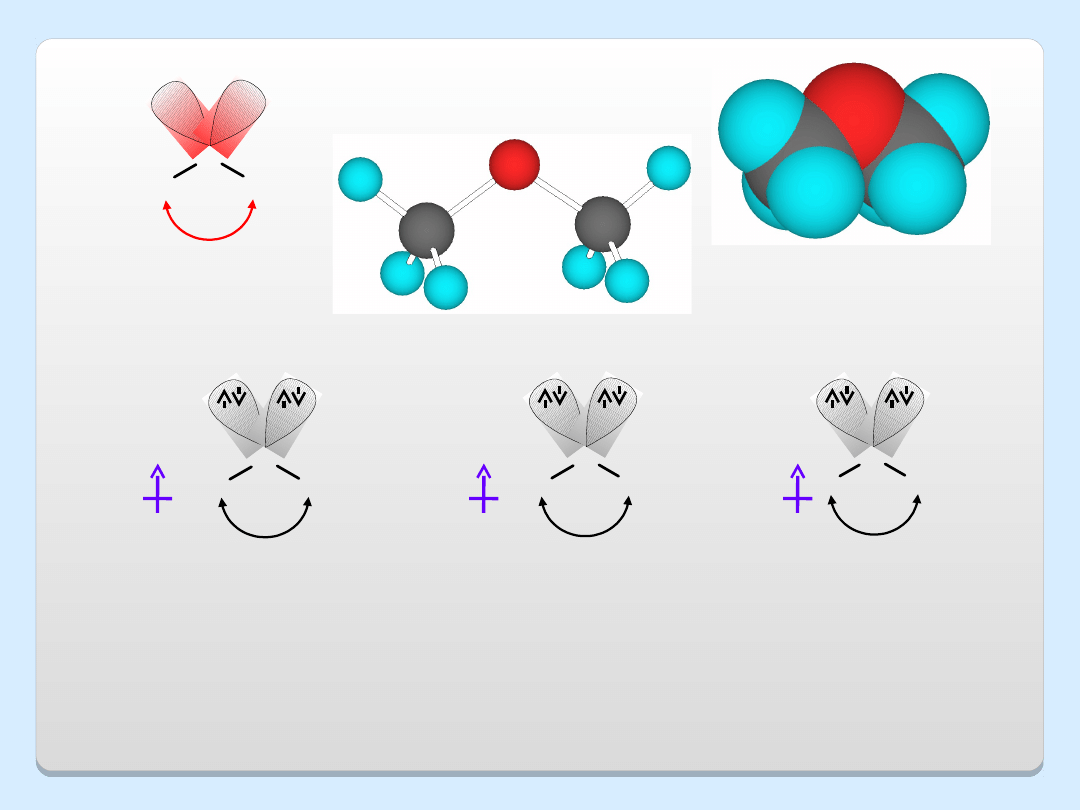
O
CH
3
H
3
C
112
o
..
..
O
CH
3
H
3
C
111,7
o
μ = 1,3 D
a)
O
H
H
3
C
108,5
o
μ = 1,7 D
b)
O
H
H
105
o
μ = 1,8 D
c)
Kształt i moment dipolowy cząsteczek: a) eteru dimetylowego,
b) metanolu, c) wody
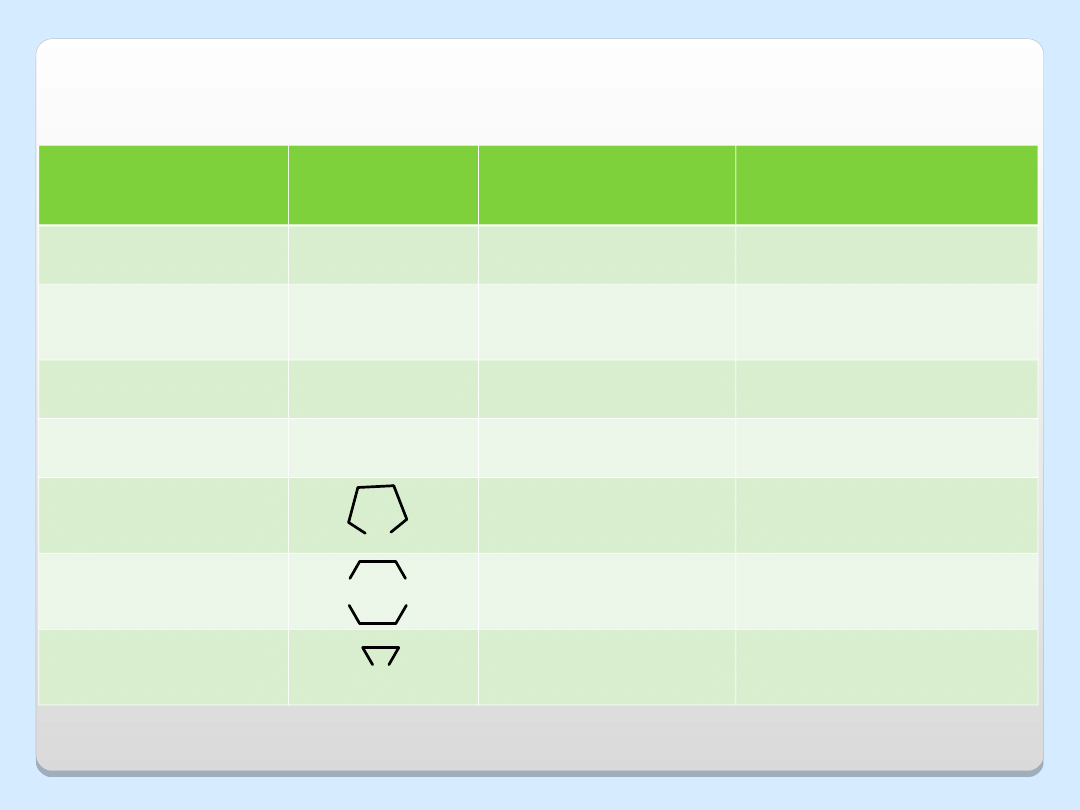
Nazwa
Wzór
Temp. wrzenia
o
C
Rozpuszczalność w
wodzie, g/100 g H
2
O
Eter dimetylowy (CH
3
)
2
O
– 24
∞
Eter etylowo-
metylowy
C
2
H
5
OCH
3
7,6
dobrze
rozpuszczalny
Eter dietylowy
(C
2
H
5
)O
34
7,5
Eter dibutylowy
(C
4
H
9
)O
142
0,05
Tetrahydrofuran
65
∞
1,4-Dioksan
101
∞
Oksiran
10,7
∞
O
O
O
O
WŁAŚCIWOŚCI FIZYCZNE ETERÓW
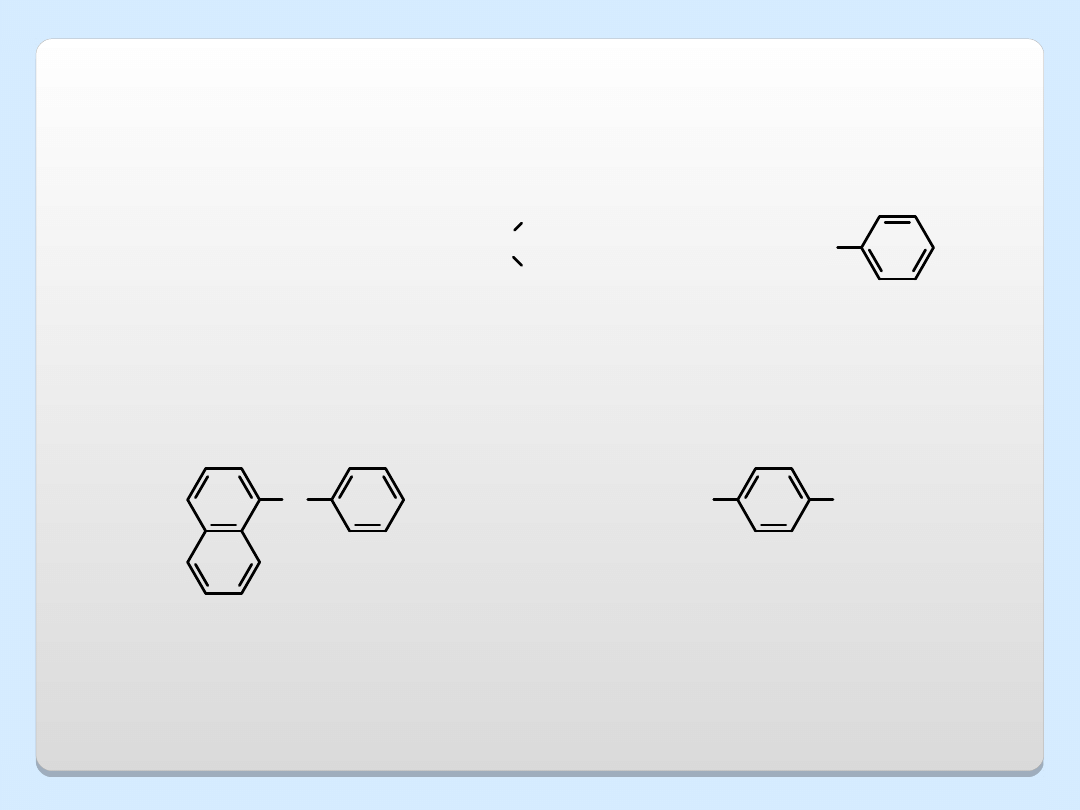
PRZYKŁADY ETERÓW
C
2
H
5
OC
2
H
5
CH
3
OCH
CH
3
CH
3
CH
3
O
eter dietylowy
eter izopropylowo-
metylowy
eter fenylowo-
metylowy
(metoksybenzen)
O
CH
3
O
CHO
eter fenylowo-1-
naftylowy
aldehyd p-
metoksybenzoesowy
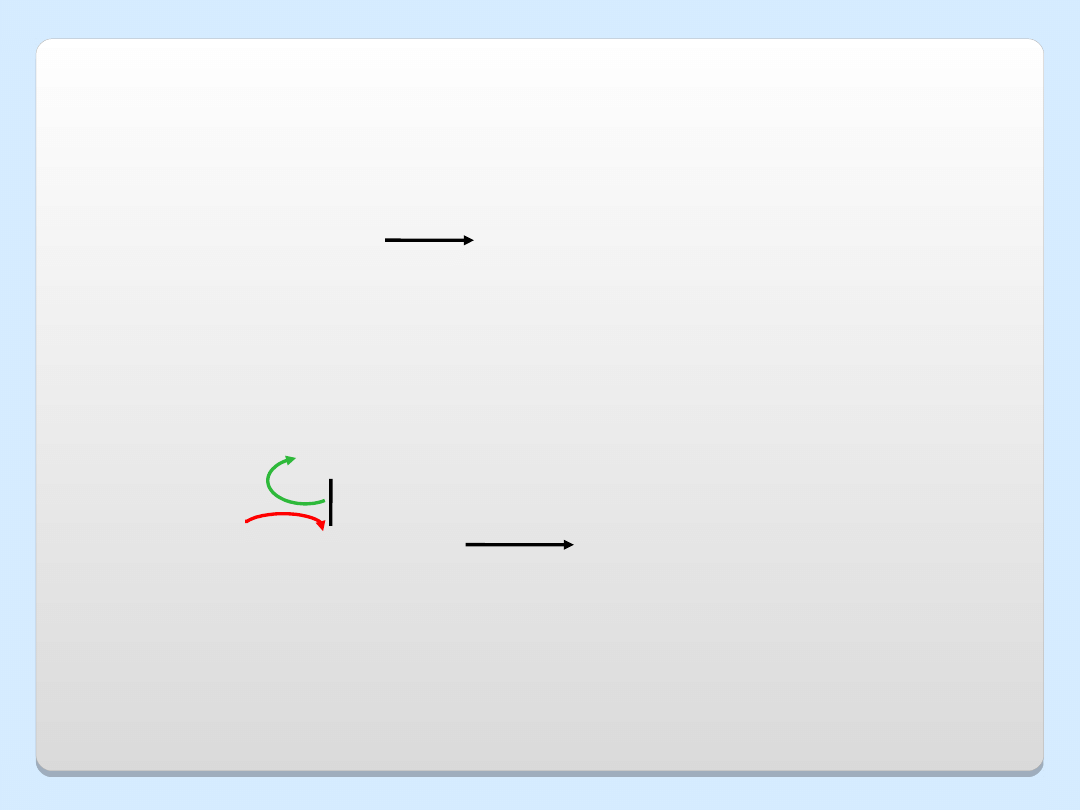
OTRZYMYWANIE ETERÓW NA SKALĘ PRZEMYSŁOWĄ
2 CH
3
CH
2
OH
CH
3
CH
2
O
CH
2
CH
3
+
H
2
O
H
2
SO
4
eter dietylowy
etanol
CH
3
CH
2
O
CH
2
CH
3
+
H
3
O
+
CH
3
CH
2
OH
+ CH
2
CH
3
+
OH
2
..
..
..
..
reakcja
S
N
2
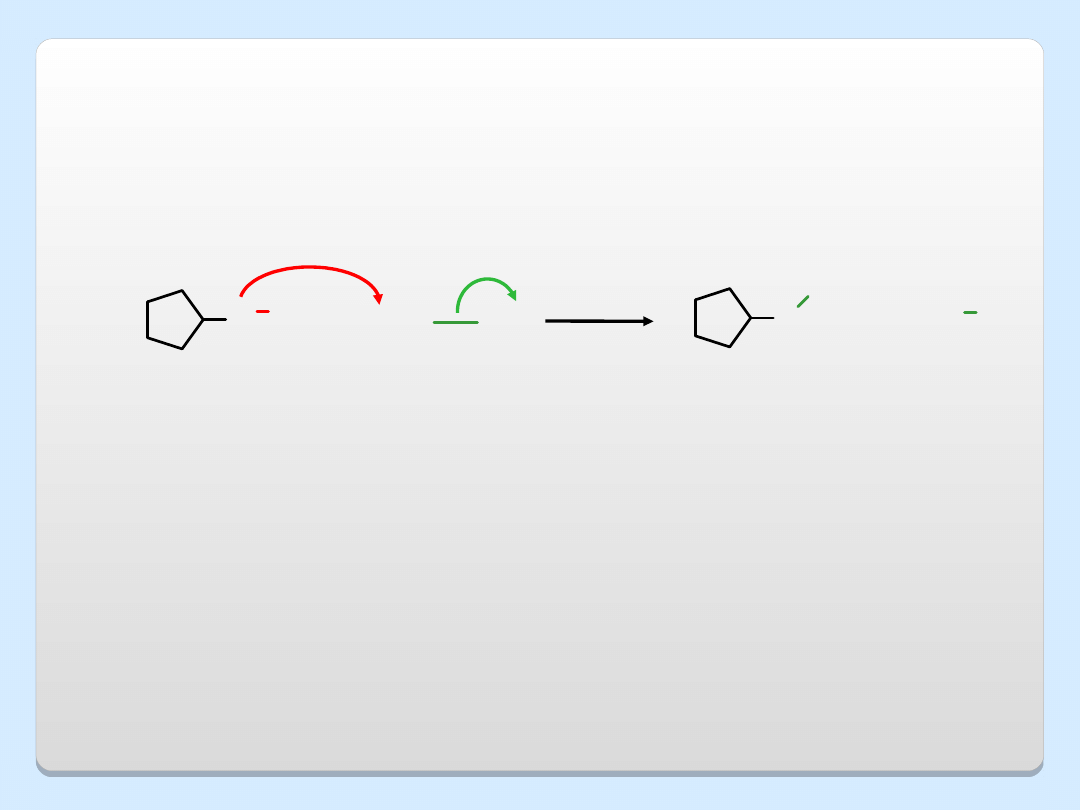
REAKCJE OTRZYMYWANIA ETERÓW
1. SYNTEZA WILLIAMSONA
Reakcja ta wymaga pierwszorzędowego halogenku alkilowego. W
przypadku halogenków drugo- i trzeciorzędowych może zachodzić
eliminacja
O
..
....
+
+
roztwór
w THF
jon
cyklopentoksylowy
eter
cyklopentylowo-
metylowy
(74%)
CH
3
I
O
CH
3
I
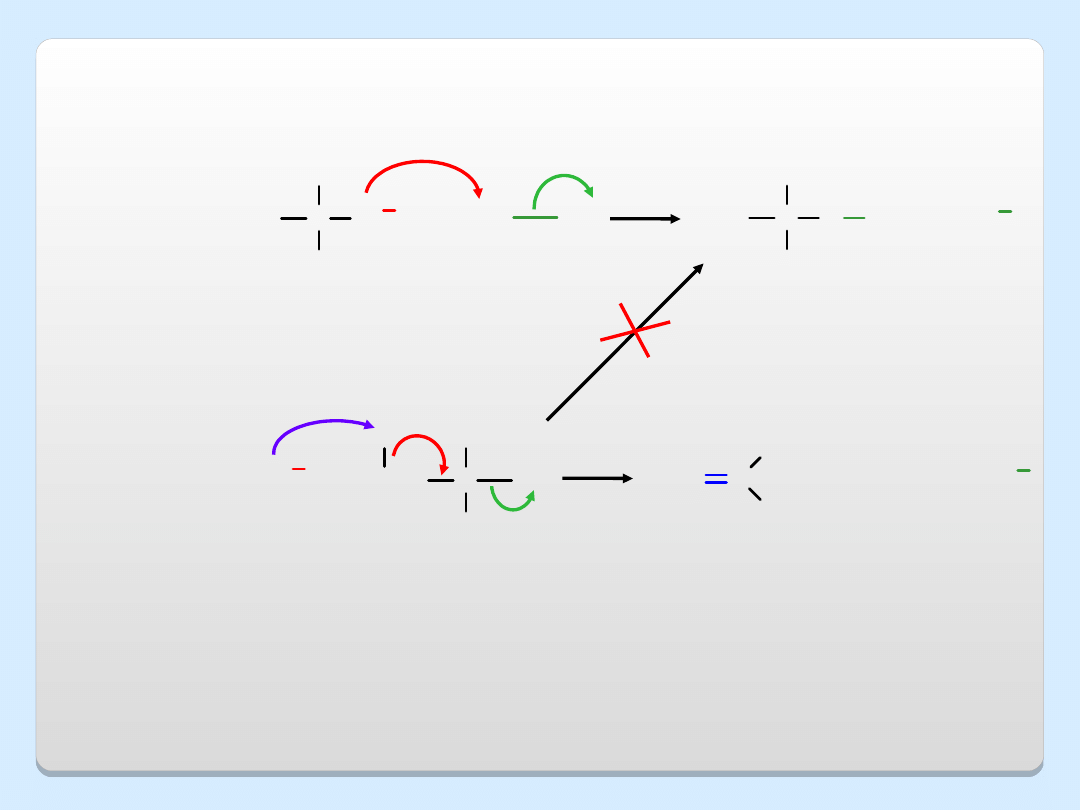
C
CH
3
CH
3
CH
3
O
....
..
+
+
eter
tert-butylowo-
metylowy
jodometan
jon
tert-butoksylowy
reakcja S
N
2
reakcja E2
+
CH
3
O
..
....
+
+
C
CH
3
CH
3
H
2
C
CH
3
O
H
jon
metoksylowy
2-chloro-2-
metylo-
propan
2-metylopropen
CH
3
I
I
C
CH
3
CH
3
CH
3
O
CH
3
C
CH
2
CH
3
CH
3
H
Cl
Cl
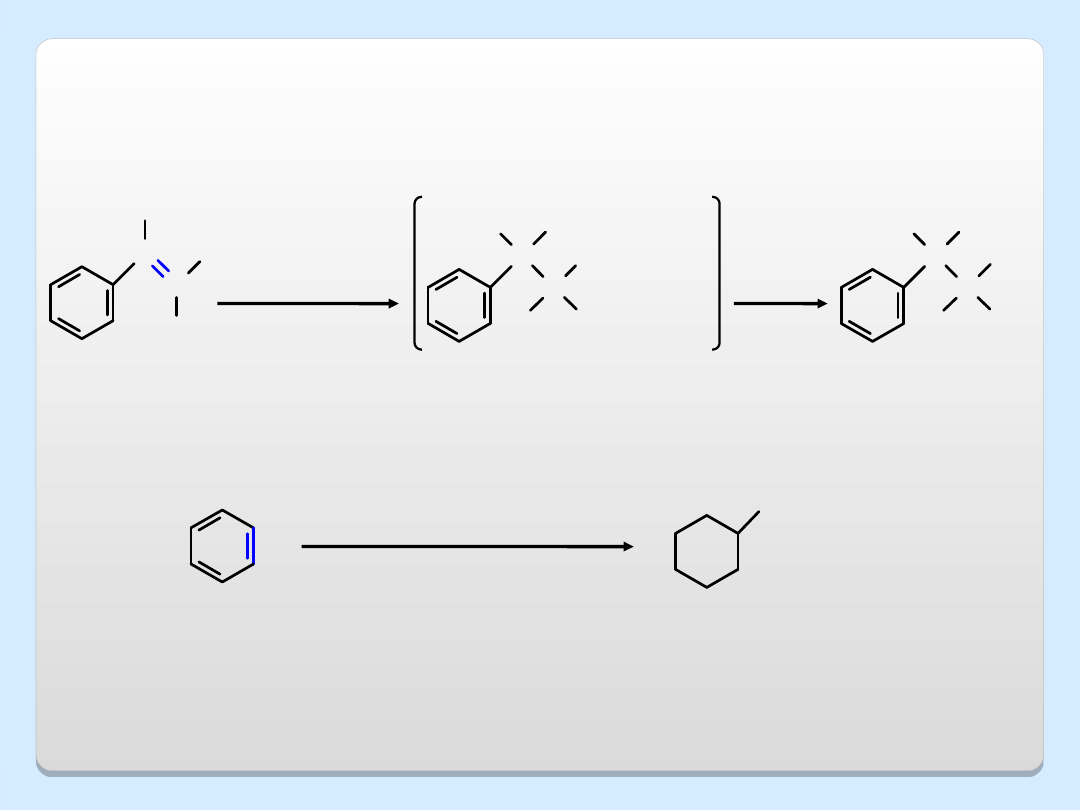
2. ALKOKSYRTĘCIOWANIE /
ODRTĘCIOWANIE
C
H
C
H
H
C
OCH
3
H
C
H
H
HgO
2
CCF
3
CH
3
OH
Hg(O
2
CCF
3
)
2
NaBH
4
styren
1-metoksy-
-1-fenyloetan
(97%)
OCH
2
CH
3
1. Hg(O
2
CCF
3
)
2
,
CH
3
CH
2
OH
2. NaBH
4
cykloheksen
eter cykloheksylowo-etylowy
(100%)
C
OCH
3
H
C
H
H
H
REAKCJE ETERÓW – ROZSZCZEPIENIE ZA
POMOCĄ HX,
GDZIE HX = HBR LUB HI
CH
3
CHCOOH
O
CH
2
CH
3
+
+
H
2
O
100
o
C
jodoetan
kwas mlekowy
kwas 2-
etoksypropionowy
HI
CH
3
CH
2
I
CH
3
CHCOOH
O
H
CH
3
CH
2
O
CHCH
3
CH
3
+
HI
, H
2
O
chłodnica
zwrotna
jodoetan
eter etylowo-
izopropylowy
alkohol izopropylowy
CH
3
CH
2
I
CH
3
CH
O
H
CH
3
O
CH
2
CH
3
HBr
, H
2
O
chłodnica
zwrotna
+
eter etylowo-
fenylowy
fenol
bromoetan
O
H
CH
3
CH
2
Br
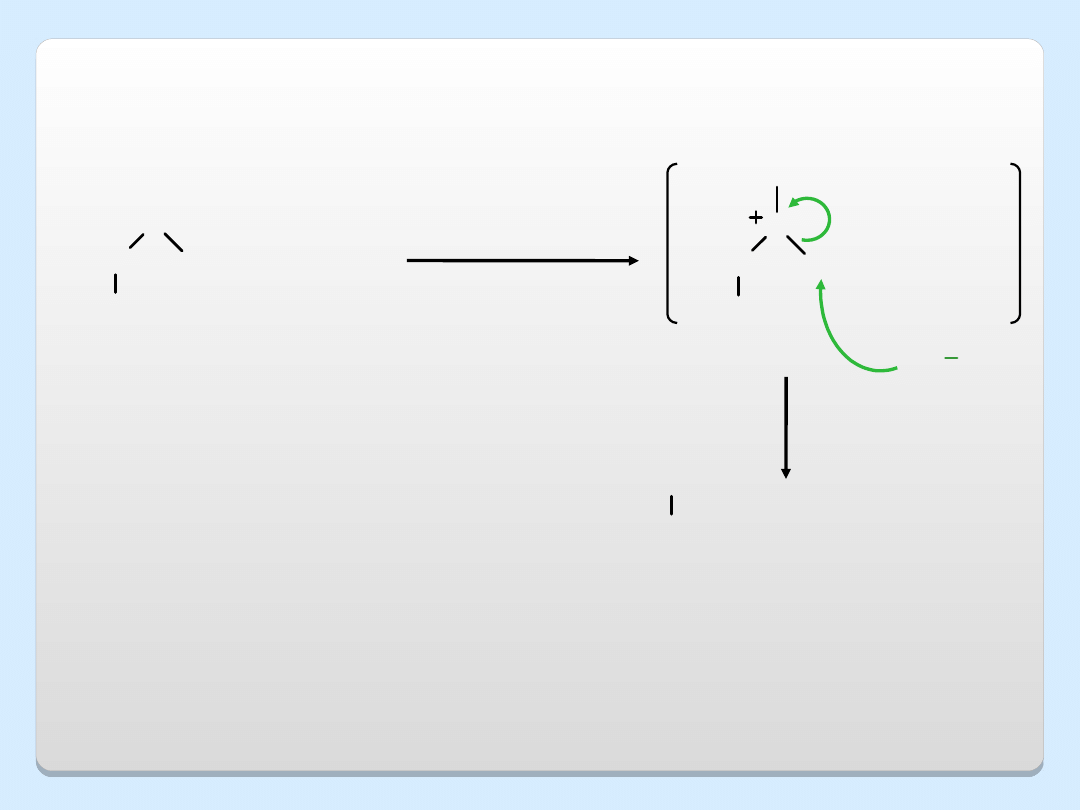
HI
, H
2
O
chłodnica
zwrotna
CH
3
CH
CH
3
O
CH
2
CH
2
CH
2
CH
3
..
..
+
eter butylowo-
izopropylowy
alkohol izopropylowy
1-jodobutan
..
..
.. ....
I
CH
3
CH
CH
3
O
CH
2
CH
2
CH
2
CH
3
H
CH
3
CH
O
H
CH
3
CH
3
CH
2
CH
2
CH
2
I
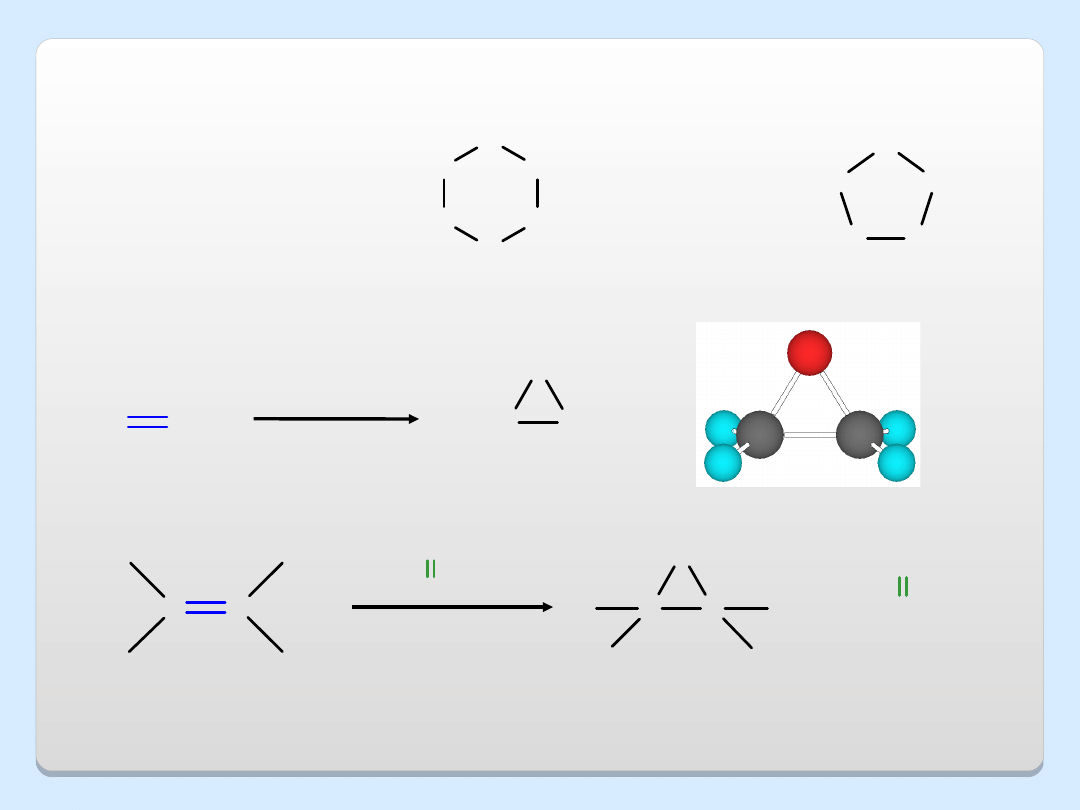
ETERY CYKLICZNE
H
2
C
H
2
C
O
CH
2
CH
2
O
C
C
H
2
C
O
CH
2
H
2
H
2
1,4-dioksan
tetrahydrofura
n
H
2
C
CH
2
H
2
C
CH
2
O
O
2
Ag
2
O, 300
o
C
etylen
tlenek etylenu
C
C
C
C
O
(nadtlenokwas)
alken
epoksyd
(oksiran)
+
RCOH
O
RCO
O
H
O
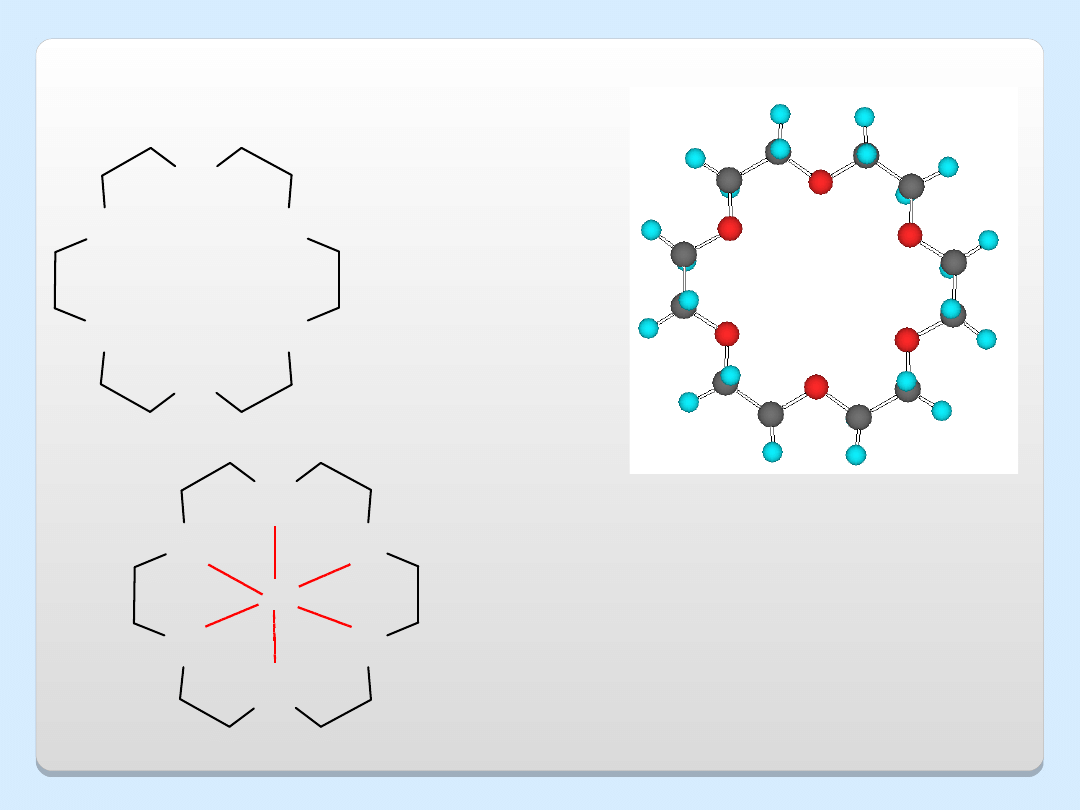
ETERY KORONOWE
O
O
O
O
O
O
O
O
O
O
O
O
K
+
..
..
..
..
..
..
..
..
..
..
..
..
MnO
4
–
eter 18-korona-6
KMnO
4
solwatowany przez 18-korona-6 (solwat
ten jest rozpuszczalny w benzenie)
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
Wyszukiwarka
Podobne podstrony:
ĆWICZENIE I FENOL, inż. BHP, VI semestr, Toksykologia przemysłowa
Eter naftowy t w @ 65
MP3, fenol katechol-krzywa-4, KRZYWA KALIBRACYJNA DLA OZNAZCZANIA STĘŻENIA FENOLU
MP3, fenol katechol-krzywa-4, KRZYWA KALIBRACYJNA DLA OZNAZCZANIA STĘŻENIA FENOLU
FENOL ppt
Eter dietylowy, Eter dietylowy C4H10O
Eter naftowy t w 5 55
Fenol
0012 Fenol
alkohole 2C+fenol EGWMFLWT4OO4Z4R6TZW2PERXAHA6C5OLROD4CBI
karta pomiarowa fenol 09, Mikrobiologia Przemysłowa, MP
Eter naftowy t w 40 60°c cz
Fenol i pochodne id 169195 Nieznany
ETER DIETYLOWY, BHP KARTA CHARAKTERYSTYKI SUBSTANCJI NIEBEZPIECZNEJ
Eter dietylowy Eter dietylowy C4H10O
Fenol cz
więcej podobnych podstron