
Metody badania surowców
Metody badania surowców
kosmetycznych
kosmetycznych
Techniki analityczne
Techniki analityczne
Surowce kosm 05 2011/12

Metody stosowane w badaniach surowców
i trwałości produktów kosmetycznych
• Metody klasyczne (wagowe, miareczkowe)
• Metody instrumentalne
• Metody mikrobiologiczne i biologiczne

Metody stosowane w badaniach surowców
i trwałości produktów kosmetycznych
Metoda wagowa
• Wytrącenie oznaczanego składnika w postaci trudno
rozpuszczalnego osadu
- odsączenie, przemycie, wysuszenie
- zważenie lub przekształcenie w inny związek o znanym,
ściśle
określonym składzie
- z masy osadu obliczenie zawartości oznaczanego składnika w
próbce
• Przykład – oznaczenie Ag w reakcji Ag
+
+ Cl
-
AgCl
(Ag – 108, Cl – 35,5)

Metody stosowane w badaniach surowców
i trwałości produktów kosmetycznych
Metoda wagowa
• Osad w analizie wagowej
- możliwie jak najtrudniej rozpuszczalny
- po wysuszeniu (lub wyprażeniu) – ściśle określony skład
chemiczny (na tej podstawie – oznaczenie zawartości
badanego składnika)
- możliwie czysty – wolny od innych substancji obecnych w
roztworze
- posiadał strukturę ułatwiającą sączenie i przemywanie
- korzystne osady o dużej masie cząsteczkowej – drobne straty
mniej
wpływają na wynik

Metody stosowane w badaniach
surowców
i trwałości produktów kosmetycznych
Metody klasyczne (miareczkowe)
• Miareczkowanie: pomiar ilości nieznanego składnika
(analitu) przez ustalenie ściśle równoważnej ilości
odpowiedniego składnika mianowanego (titranta)
(o dokładnie ustalonym stężeniu)
• Zawartość oznaczanej substancji – na podstawie
zmierzonej dokładnie objętości zużytego roztworu
mianowanego
• Dodawanie roztworu titranta małymi porcjami – „miareczkami”
z biurety do roztworu zawierającego oznaczaną substancję
- oznaczanie poszczególnych składników – metodą selektywna
dla danego składnika
- titrant powinien reagować szybko powodując zmiany
określonych jej
właściwości (np. barwy)

Metody stosowane w badaniach surowców
i trwałości produktów kosmetycznych
Metody klasyczne (miareczkowe)
• Oznaczenie zakończenia miareczkowania – także metodami
instrumentalnymi:
- zmiana różnych właściwości elektrycznych lub optycznych roztworu
podczas miareczkowania
• Doprowadzona ilość odczynnika, równoważna chemicznie ilości
składnika oznaczanego – to tzw. punkt równoważnikowy
- ustalany za pomocą wskaźnika (odpowiedniego dla danego rodzaju
oznaczenia) – zmiana barwy
• - Punkt równoważnikowy (PR) miareczkowania - w momencie, gdy pewna porcja
titranta przereaguje stechiometrycznie z odpowiednią ilością analitu
zawartego w roztworze
- Punkt końcowy (PK) miareczkowania (określony przez urządzenie lub wskaźnik
służący do oznaczania końca reakcji stechiometrycznej titranta z
analitem).
- przy dobrze dobranej metodzie oznaczania - pokrywa się z punktem
równoważnikowym ; w praktyce – prawie zawsze występuje przed nim lub po
nim: PK – PR błąd miareczkowania

Metody stosowane w badaniach surowców
i trwałości produktów kosmetycznych
Metody klasyczne (miareczkowe)
• Reakcja stosowana przy miareczkowaniu powinna:
- przebiegać ilościowo, zgodnie z określonym równaniem
- wprowadzany odczynnik (titrant) nie może wchodzić w
reakcje
z innymi substancjami występującymi w roztworze
- posiadać odpowiedni wskaźnik umożliwiający określenie
końca
miareczkowania

Reakcje miareczkowania
Ze względu na rodzaj reakcji w roztworze
• Metody oparte na łączeniu się jonów :
- alkacymetria r. zobojętniania
- alkalimetria – miareczkowanie mianowanymi roztworami
zasad
- acydymetria – miareczkowanie mianowanymi roztworami
kwasów
- precypitometria (metody wytrąceniowe), np. argentometria
trudnorozpuszczalne związki srebra
(oznaczanie chlorków AgNO
3
– wskaźnik – K
2
CrO
4
brunatnoczerwony Ag
2
CrO
4
)
• Redoksymetria
r. redoks (np. reakcja z manganianem(VII)
potasu
jako utleniaczem, wskaźnik – sam titrant)
• Komplekso(no)metria tworzenie (zwykle) barwnych związków
kompleksowych

Reakcje miareczkowania
Sposób prowadzenia miareczkowania
• Miareczkowanie bezpośrednie – reakcja bezpośrednia pomiędzy
titrantem i oznaczanym związkiem – potrzebny tylko jeden
roztwór
mianowany
• M. pośrednie – związek oznaczany reaguje z inną substancją,
a miareczkowany jest produkt tej reakcji
- przy oznaczaniu niektórych anionów wytraca się je w
postaci
osadu, odsącza osad, w którym oznacza się kation,
który był związany z tym anionem
• M. odwrotne – dodawany w nadmiarze (dokładnie odmierzona
objętość) roztwór mianowany reagujący ze związkiem
oznaczanym, odmiareczkowywany nadmiar dodanego związku –
potrzebne dwa roztwory mianowane (wykorzystywana gdy
reakcje
przebiegają powoli (niektóre reakcje redox) lub gdy
trudno dobrać
wskaźnik do miareczkowania bezpośredniego)
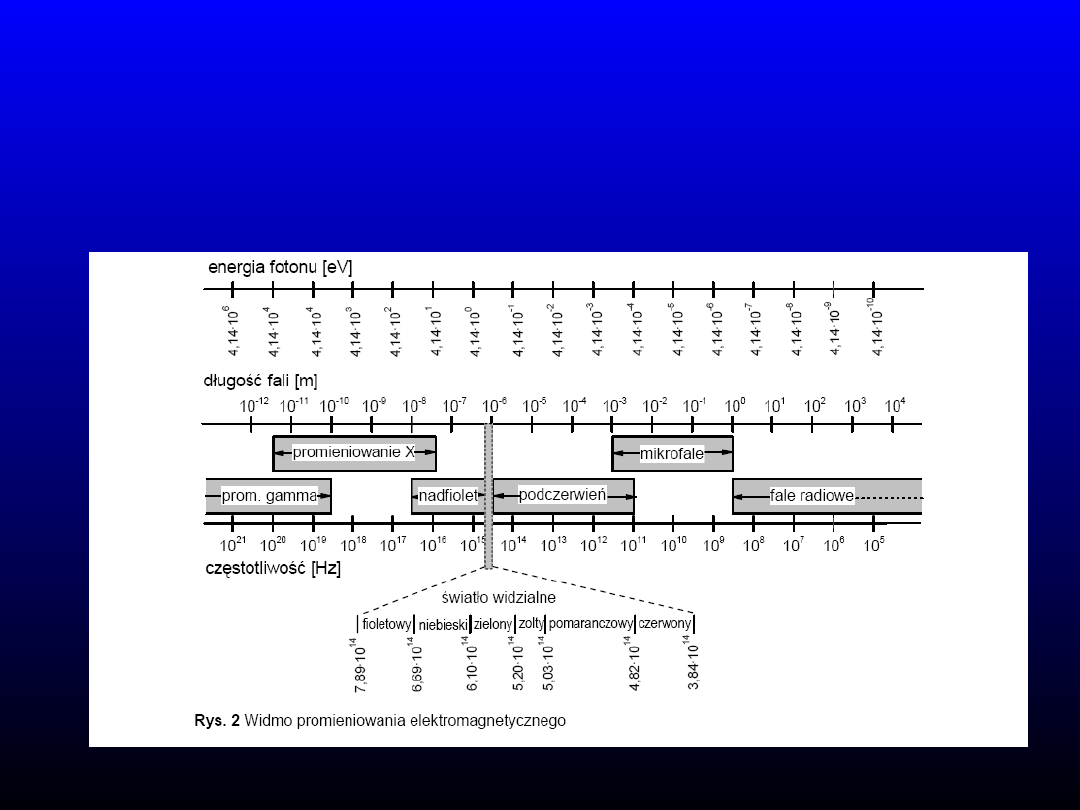
Instrumentalne techniki analityczne
Promieniowanie elektromagnetyczne – drganie
Promieniowanie elektromagnetyczne – drganie
pola elektromagnetycznego
pola elektromagnetycznego
rozchodzące się w przestrzeni, w którym składowa elektryczna i magnetyczna
rozchodzące się w przestrzeni, w którym składowa elektryczna i magnetyczna
są do siebie prostopadłe i są prostopadłe do kierunku rozchodzenia się fali
są do siebie prostopadłe i są prostopadłe do kierunku rozchodzenia się fali

Instrumentalne techniki analityczne
Orbitale molekularne
• w cząsteczce orbitale symetryczne względem osi wiązania
- (wiążące, o mniejszej energii niż energia każdego z orbitali
atomowych, zwiększenie gęstości elektronów w obszarze
nakrywania)
- * (antywiążące, o większej energii niż energia każdego z
orbitali,
zmniejszona gęstość elektronowa w obszarze
nakrywania)
• oś prostopadła do osi wiązania – typu i *
• niewiążące elektrony walencyjne

n
*
*
0
Energia
Powyższe przejścia ze względu na energię można uszeregować:
* > n * > * > n *
absorpcja UV-VIS
wzbudzenie elektronów wiązań wielokrotnych
oraz
wiązań
wzbudzenie – przejście elektronów ze stanu podstawowego do
wzbudzonego
(np.
*
)

- pasma absorpcji
- pasma absorpcji
*
*
występują w nadfiolecie
występują w nadfiolecie
próżniowym
próżniowym
-
-
*
*
i
i
n
n
*
*
- w średnim nadfiolecie
- w średnim nadfiolecie
-
-
n
n
*
*
- w bliskim UV i VIS
- w bliskim UV i VIS
- pasma przejść
- pasma przejść
n
n
*
*
- mała intensywność (
- mała intensywność (
= 10-
= 10-
1
1
·
·
10
10
3
3
)
)
- pasma przejść
- pasma przejść
*
*
- duża intensywność
- duża intensywność
(
(
= 5
= 5
·
·
10
10
2
2
-
-
1
1
·
·
10
10
5
5
)
)
Rejestrując widma w standardowym zakresie UV-VIS
Rejestrując widma w standardowym zakresie UV-VIS
(200-800 nm) obserwuje się przede wszystkim przejścia
(200-800 nm) obserwuje się przede wszystkim przejścia
*
*
i
i
n
n
*
*
Aby nastąpiła absorpcja fotonu i przeniesienie elektronu
Aby nastąpiła absorpcja fotonu i przeniesienie elektronu
z poziomu niższego na wyższy – energia fotonu
z poziomu niższego na wyższy – energia fotonu
dopasowana do różnicy poziomów
dopasowana do różnicy poziomów
E = h∙
E = h∙
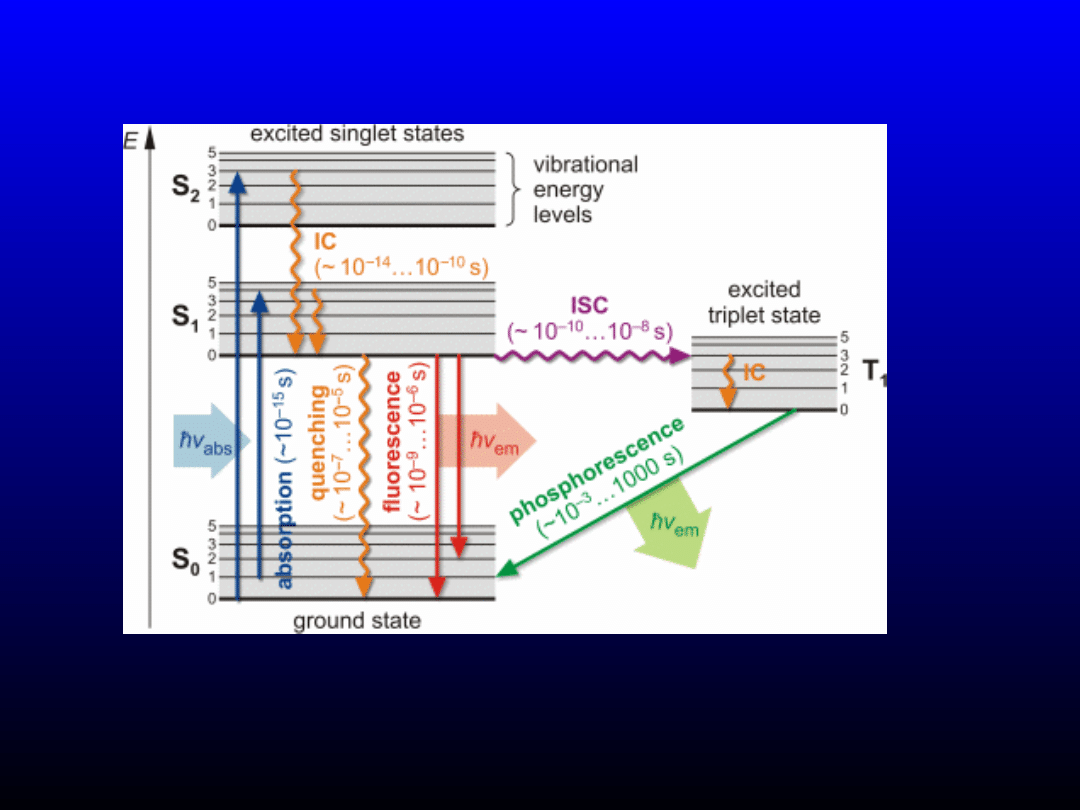
Diagram Jabłońskiego
www. uni-leipzig.de
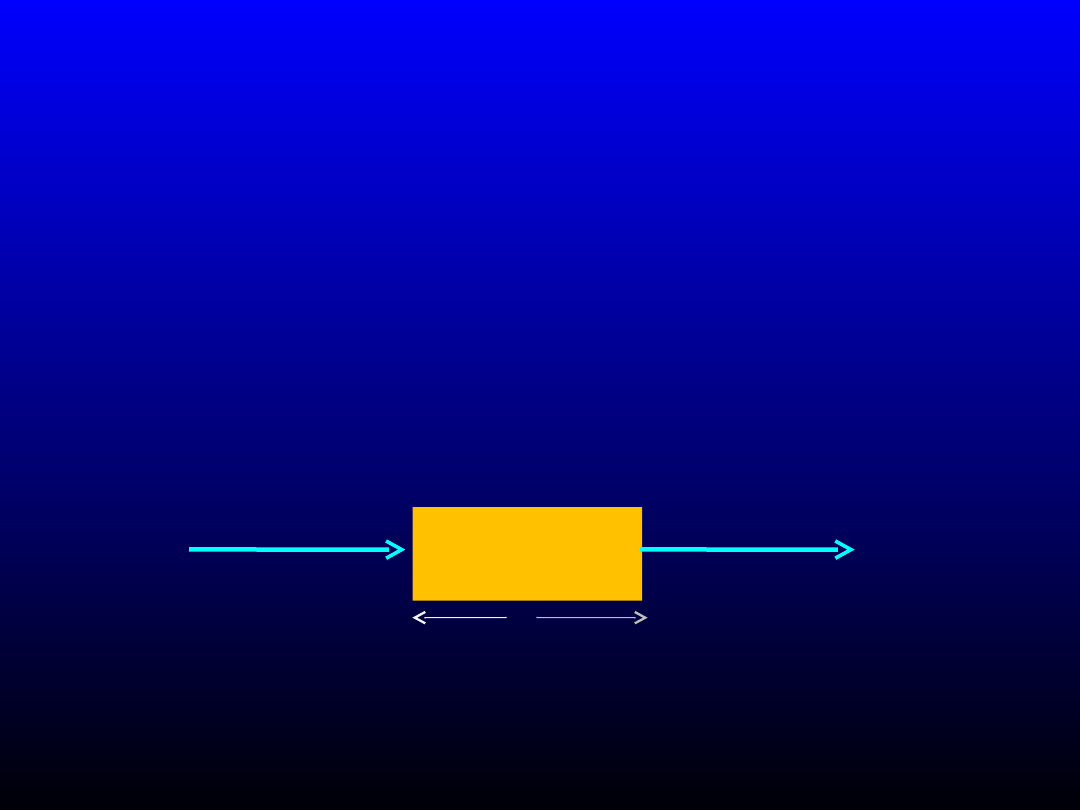
Spektroskopia absorpcyjna UV-VIS
Spektroskopia absorpcyjna UV-VIS
-
-
absorpcja promieniowania elektromagnetycznego przez
absorpcja promieniowania elektromagnetycznego przez
analizowane substancje
analizowane substancje
- umożliwia wykrycie, identyfikację lub oznaczenie badanych
- umożliwia wykrycie, identyfikację lub oznaczenie badanych
związków
związków
chemicznych
chemicznych
- natężenie padającego promieniowania zostaje zmniejszone
- natężenie padającego promieniowania zostaje zmniejszone
podczas
podczas
oddziaływania z atomami lub cząsteczkami i
oddziaływania z atomami lub cząsteczkami i
wzbudzeniu ich do
wzbudzeniu ich do
wyższych stanów energetycznych
wyższych stanów energetycznych
Instrumentalne techniki analityczne
c
Promieniowanie
padające
o natężeniu I
o
Promieniowanie
przepuszczone
o natężeniu I
t
l
Natężenie promieniowania przechodzącego maleje wykładniczo przy przechodzeniu przez próbkę
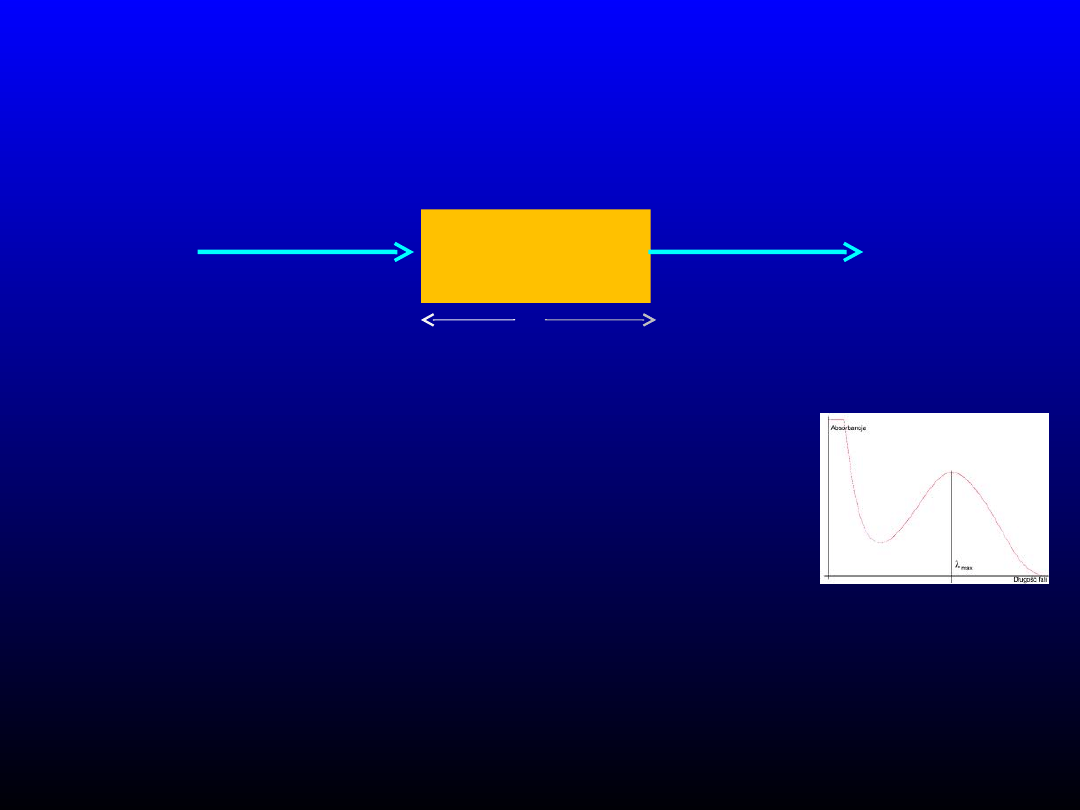
Lambert – od drogi optycznej, Beer – od stężenia
Lambert – od drogi optycznej, Beer – od stężenia
Prawo Lamberta-Beera
Prawo Lamberta-Beera
I
I
t
t
= I
= I
o
o
∙ exp (-k’∙c∙l)
∙ exp (-k’∙c∙l)
Po zlogarytmowaniu i zamianie logarytmów na dziesiętne
Po zlogarytmowaniu i zamianie logarytmów na dziesiętne
log (I
log (I
o
o
/I
/I
t
t
) = A =
) = A =
∙ c ∙ l
∙ c ∙ l
Zależność absorbancji od stężenia – liniowa
Zależność absorbancji od stężenia – liniowa
- krzywa wzorcowa – oznaczenie ilościowe, użyteczny zakres
- krzywa wzorcowa – oznaczenie ilościowe, użyteczny zakres
- budowa spektrofotometru
- budowa spektrofotometru
Instrumentalne techniki analityczne
c
Promieniowanie
padające
o natężeniu I
o
Promieniowanie
przepuszczone
o natężeniu I
t
l
Instrumentalne techniki analityczne
• Spektroskopia w podczerwieni (IR) – absorpcja
promieniowania podczerwonego przez
oscylujące cząsteczki
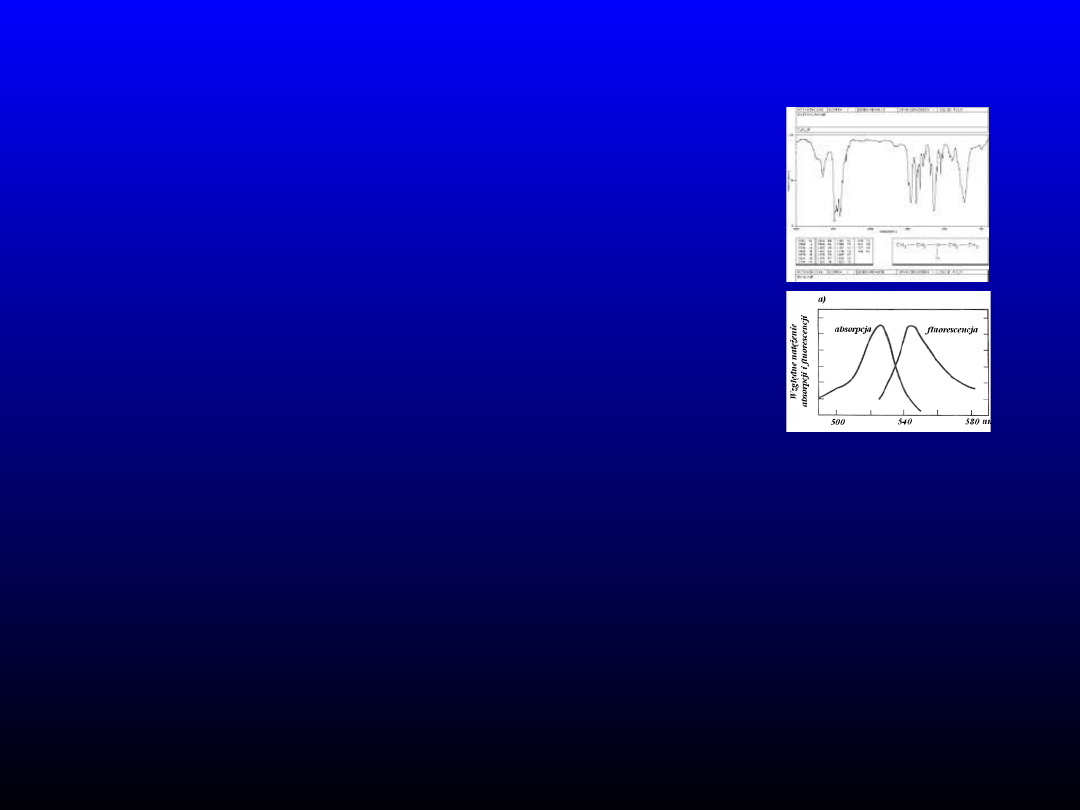
• Fluorymetria – wykorzystanie zjawiska emisji
promieniowania fluorescencyjnego przez
cząsteczki oznaczanego składnika. Intensywność
emisji proporcjonalna do stężenia składnika.
Bardzo czuła metoda. Pomiar
• Nefelometria – analiza stężenia roztworu na podstawie
pomiaru natężenie światła rozproszonego przez zawiesinę –
wykorzystanie efektu Tyndalla
• Turbidymetria – pomiar mętności zawiesin podobnie jak w przypadku
metod
spektrofotometrycznych
• Refraktometria – pomiar współczynników załamania światła badanych
roztworów wnioskowanie o stężeniu badanych substancji

Stężenie składnika mieszaniny: stosunek ilości składnika do ilości
Stężenie składnika mieszaniny: stosunek ilości składnika do ilości
mieszaniny
mieszaniny
Stężenie procentowe
Stężenie procentowe
wagowo–wagowe c
wagowo–wagowe c
pw/w
pw/w
:
:
liczba g substancji w 100 g roztworu - % (w/w) lub % (m/m) –
liczba g substancji w 100 g roztworu - % (w/w) lub % (m/m) –
stężenie dopuszczalne w chemii
stężenie dopuszczalne w chemii
Stężenie procentowe
Stężenie procentowe
objętościowo-objętościowe c
objętościowo-objętościowe c
pv/v
pv/v
: liczba cm
: liczba cm
3
3
substancji w 100 cm
substancji w 100 cm
3
3
roztworu - % (v/v)
roztworu - % (v/v)
Z uwagi na zmianę objętości
Z uwagi na zmianę objętości
roztworu w zależności od temperatury stężenie to nie powinno być
roztworu w zależności od temperatury stężenie to nie powinno być
stosowane w chemii
stosowane w chemii
Stężenie procentowe
Stężenie procentowe
wagowo–objętościowe c
wagowo–objętościowe c
pw/v
pw/v
:
:
liczba g
liczba g
substancji w 100 cm
substancji w 100 cm
3
3
roztworu - % (w/v) lub % (m/v)
roztworu - % (w/v) lub % (m/v)
Z uwagi na
Z uwagi na
zmianę objętości roztworu w zależności od temperatury stężenie to,
zmianę objętości roztworu w zależności od temperatury stężenie to,
podobnie jak powyższe, nie powinno być stosowane w chemii
podobnie jak powyższe, nie powinno być stosowane w chemii
Stężenia

Stężenie molowe
Stężenie molowe
- liczba moli substancji w 1 dm
- liczba moli substancji w 1 dm
3
3
(L)
(L)
roztworu - mol/dm
roztworu - mol/dm
3
3
(mol/L)
(mol/L)
Stężenie to stosowane jest w
układzie SI
Stężenie molalne
Stężenie molalne
- liczba moli substancji w 1 kg
- liczba moli substancji w 1 kg
rozpuszczalnika - mol/kg
rozpuszczalnika - mol/kg
Stężenie to stosowane jest w
układzie SI
Ułamek molowy
Ułamek molowy
- określa stosunek liczby moli
- określa stosunek liczby moli
składnika do sumy liczby moli wszystkich
składnika do sumy liczby moli wszystkich
składników w roztworze
składników w roztworze
Stężenie to dopuszczalne jest w
chemii
.
Stężenia

Jakie stężenie procentowe będzie miał roztwór
Jakie stężenie procentowe będzie miał roztwór
powstały po rozpuszczeniu 25 g NaCl w 100 g wody?
powstały po rozpuszczeniu 25 g NaCl w 100 g wody?
m
m
NaCl
NaCl
C [%] = x 100% =
C [%] = x 100% =
m
m
NaCl
NaCl
+ m
+ m
aq
aq
= 100% x 25 : (25 + 100) = 20%
= 100% x 25 : (25 + 100) = 20%
Stężenie procentowe (procent
Stężenie procentowe (procent
masowy)
masowy)

Ile g siarczanu sodu potrzeba do sporządzenia
Ile g siarczanu sodu potrzeba do sporządzenia
60 g
60 g
5%
5%
roztworu?
roztworu?
Dane:…
Dane:…
Na – 23, S – 32, O – 16
Na – 23, S – 32, O – 16
C
C
p(m/m)
p(m/m)
= m
= m
s
s
· 100%/m
· 100%/m
r
r
/∙ m
/∙ m
r
r
/100%
/100%
m
m
s
s
=
=
C
C
p
p
·
·
m
m
r
r
/ 100%
/ 100%
ms =
ms =
5
5
%
%
·
·
60g
60g
/ 100
/ 100
%
%
= 3g
= 3g
Stężenie procentowe
Stężenie procentowe

m
m
NaCl
NaCl
C [%] = x 100% =
C [%] = x 100% =
m
m
NaCl
NaCl
+ m
+ m
aq
aq
Ile g chlorku sodu należy wziąć aby otrzymać 125 g 10% roztworu
Ile g chlorku sodu należy wziąć aby otrzymać 125 g 10% roztworu
wodnego tego związku?
wodnego tego związku?
W jaki sposób otrzymać 150g 5% roztworu wodnego chlorku sodu?
W jaki sposób otrzymać 150g 5% roztworu wodnego chlorku sodu?
Stężenie procentowe (procent
Stężenie procentowe (procent
masowy)
masowy)

Ile g siarczanu(VI) magnezu heptahydrat potrzeba do
Ile g siarczanu(VI) magnezu heptahydrat potrzeba do
sporządzenia 150 g 5% (w/w) roztworu wodnego?
sporządzenia 150 g 5% (w/w) roztworu wodnego?
Dane:…
Dane:…
Mg – 24, S – 32, O – 16
Mg – 24, S – 32, O – 16
C
C
p(m/m)
p(m/m)
= (m
= (m
s
s
/m
/m
r
r
)
)
· 100%
· 100%
/ · m
/ · m
r
r
/100%
/100%
m
m
s
s
= C
= C
p(m/m)
p(m/m)
· m
· m
r
r
/100%
/100%
= 5%
= 5%
· 150g / 100% =
· 150g / 100% =
7,5 g
7,5 g
dotyczy związku bezwodnego, a my mamy
dotyczy związku bezwodnego, a my mamy
siedmiowodny
siedmiowodny
M
M
MgSO
MgSO
4
4
= 24 + 32 + 4
= 24 + 32 + 4
· 16 = 120 g/mol
· 16 = 120 g/mol
M
M
MgSO
MgSO
4
4
· 7H
· 7H
2
2
O
O
= 24 + 32 + 4
= 24 + 32 + 4
· 16 +
· 16 +
7 · 18
7 · 18
= 246 g/mol
= 246 g/mol
7,5 g
7,5 g
– 120 g/mol
– 120 g/mol
x g
x g
– 246 g/mol
– 246 g/mol
→ x = (7,5 · 246)/120 =
→ x = (7,5 · 246)/120 =
x = 15,375 g
x = 15,375 g
Stężenie procentowe
Stężenie procentowe

Jakie stężenie molowe będzie miał roztwór wodny NaCl
Jakie stężenie molowe będzie miał roztwór wodny NaCl
po rozpuszczeniu
po rozpuszczeniu
29,25
29,25
g tego związku w
g tego związku w
0,5 dm
0,5 dm
3
3
wody?
wody?
Wyznaczamy masę molową:
Wyznaczamy masę molową:
M
M
Na
Na
Cl
Cl
=
=
23
23
+ 35,5 =
+ 35,5 =
58,5 g/mol
58,5 g/mol
Wyznaczamy stężenie molowe:
Wyznaczamy stężenie molowe:
C
C
mol
mol
= n/V
= n/V
r
r
n = m
n = m
s
s
/M
/M
C
C
mol
mol
= m
= m
s
s
/(M
/(M
·
·
V
V
r
r
)
)
C
C
m
m
=
=
29,25
29,25
g / (
g / (
58,5 g/mol
58,5 g/mol
·
·
0,5 dm
0,5 dm
3
3
) = 1 mol/dm
) = 1 mol/dm
3
3
Stężenie molowe
Stężenie molowe

Ile g chlorku potasu potrzeba do wykonania 250 cm
Ile g chlorku potasu potrzeba do wykonania 250 cm
3
3
roztworu o stężeniu 0,5 mol/dm
roztworu o stężeniu 0,5 mol/dm
3
3
M
M
KCl
KCl
= 39 + 35,5 = 74,5 g/mol
= 39 + 35,5 = 74,5 g/mol
C
C
mol
mol
= m
= m
s
s
/(M
/(M
·
·
V
V
r
r
) / (M
) / (M
·
·
V
V
r
r
)
)
m
m
s
s
= C
= C
mol
mol
·
·
M
M
·
·
V
V
r
r
= 0,5
= 0,5
mol
mol
/
/
dm
dm
3
3
·
·
74,5 g/
74,5 g/
mol
mol
·
·
0,25
0,25
dm
dm
3
3
=
=
= 9,3125 g
= 9,3125 g
W praktyce
W praktyce
:
:
odważamy 9,31 g KCl, przenosimy do kolbki miarowej na
odważamy 9,31 g KCl, przenosimy do kolbki miarowej na
250 cm
250 cm
3
3
, rozpuszczamy w niepełnej objętości wody, po
, rozpuszczamy w niepełnej objętości wody, po
czym uzupełniamy wodą do kreski
czym uzupełniamy wodą do kreski
Stężenie molowe
Stężenie molowe

Ile g siarczanu(VI) potasu potrzeba do wykonania
Ile g siarczanu(VI) potasu potrzeba do wykonania
200 cm
200 cm
3
3
roztworu o stężeniu
roztworu o stężeniu
0,25 mol/dm
0,25 mol/dm
3
3
Dane:…
Dane:…
K – 39, S – 32, O – 16
K – 39, S – 32, O – 16
M
M
K
K
2
2
SO
SO
4
4
= 2∙39 + 32 + 4∙16 = 78 + 96 = 174 g/mol
= 2∙39 + 32 + 4∙16 = 78 + 96 = 174 g/mol
C
C
m
m
= n/V
= n/V
r
r
n = m
n = m
s
s
/M
/M
C
C
m
m
= m
= m
s
s
/(M
/(M
·
·
V
V
r
r
)
)
/
/
·
·
(M
(M
·
·
V
V
r
r
)
)
m
m
s
s
=
=
C
C
m
m
·
·
M
M
·
·
V
V
r
r
m
m
s
s
=
=
0,25 mol/dm
0,25 mol/dm
3
3
·
·
174 g/mol
174 g/mol
·
·
0,2 dm
0,2 dm
3
3
=
=
m
m
s
s
= 8,7 g
= 8,7 g
Stężenie molowe
Stężenie molowe

Ile gramów wodorotlenku sodu znajduje się w 50cm
Ile gramów wodorotlenku sodu znajduje się w 50cm
3
3
2M
2M
roztworu NaOH?
roztworu NaOH?
Do sporządzenia 150 g roztworu KOH zużyto 2,8g związku.
Do sporządzenia 150 g roztworu KOH zużyto 2,8g związku.
Jakie stężenie miał otrzymany roztwór?
Jakie stężenie miał otrzymany roztwór?
Jaką objętość będzie miał roztwór siarczanu(VI) sodu, jeżeli do
Jaką objętość będzie miał roztwór siarczanu(VI) sodu, jeżeli do
sporządzenia 2M roztworu zużyto 14,2 g bezwodnego
sporządzenia 2M roztworu zużyto 14,2 g bezwodnego
związku? Ile g związku uwodnionego (dekahydrat) potrzeba
związku? Ile g związku uwodnionego (dekahydrat) potrzeba
do sporządzenia dwukrotnie większej objętości roztworu
do sporządzenia dwukrotnie większej objętości roztworu
o takim samym stężeniu?
o takim samym stężeniu?
Stężenie molowe
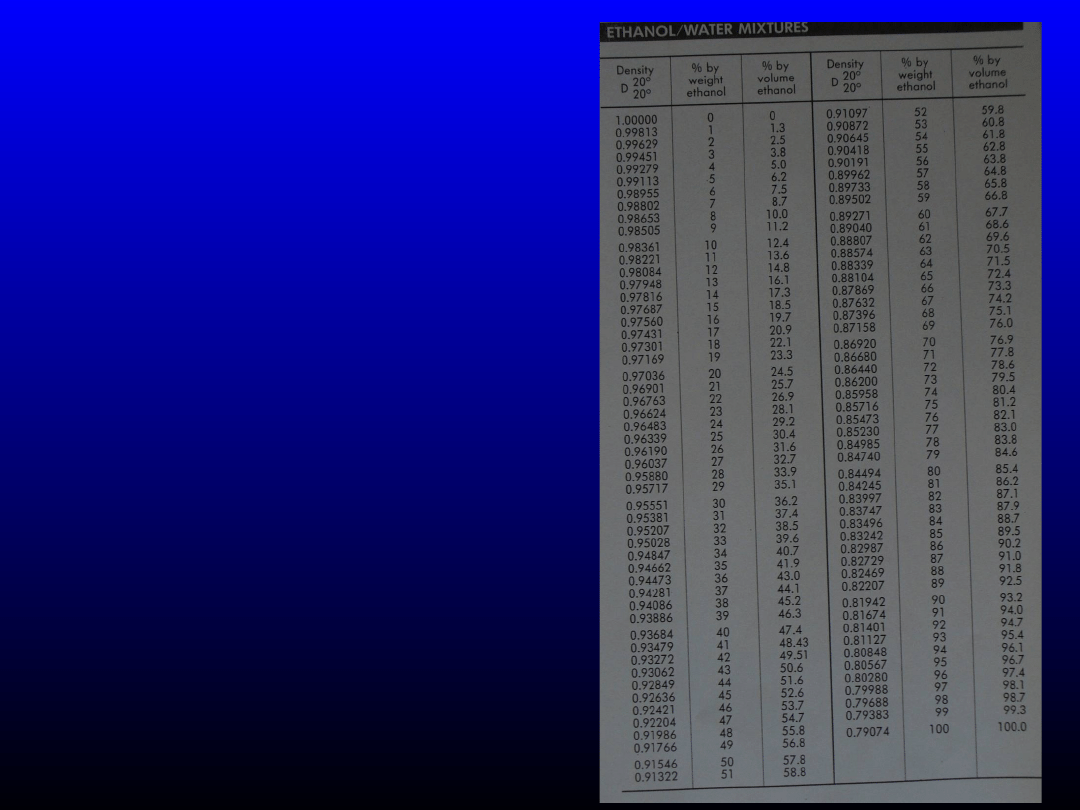
Stężenie molowe
Ile cm
3
96% (v/v) etanolu potrzeba do
sporządzenia 250 cm
3
40% (v/v) roztworu?
Korzystamy z wzoru: c
1
m
1
= c
2
m
2
Nie możemy korzystać z wzoru c
1
V
1
= c
2
V
2
, bo
alkohol w mieszaninie z wodą ulega kontrakcji,
tzn. suma objętości alkoholu i wody przed
zmieszaniem jest > niż mieszaniny
C
1
m
1
= c
2
m
2
, ponieważ m = d ∙ V, zatem
c
1
d
1
V
1
= c
2
d
2
V
2
, gdzie 1 dotyczy alkoholu 96%(v/v),
natomiast 2 - 40%(v/v)
V
1
= c
2
d
2
V
2
/c
1
d
1
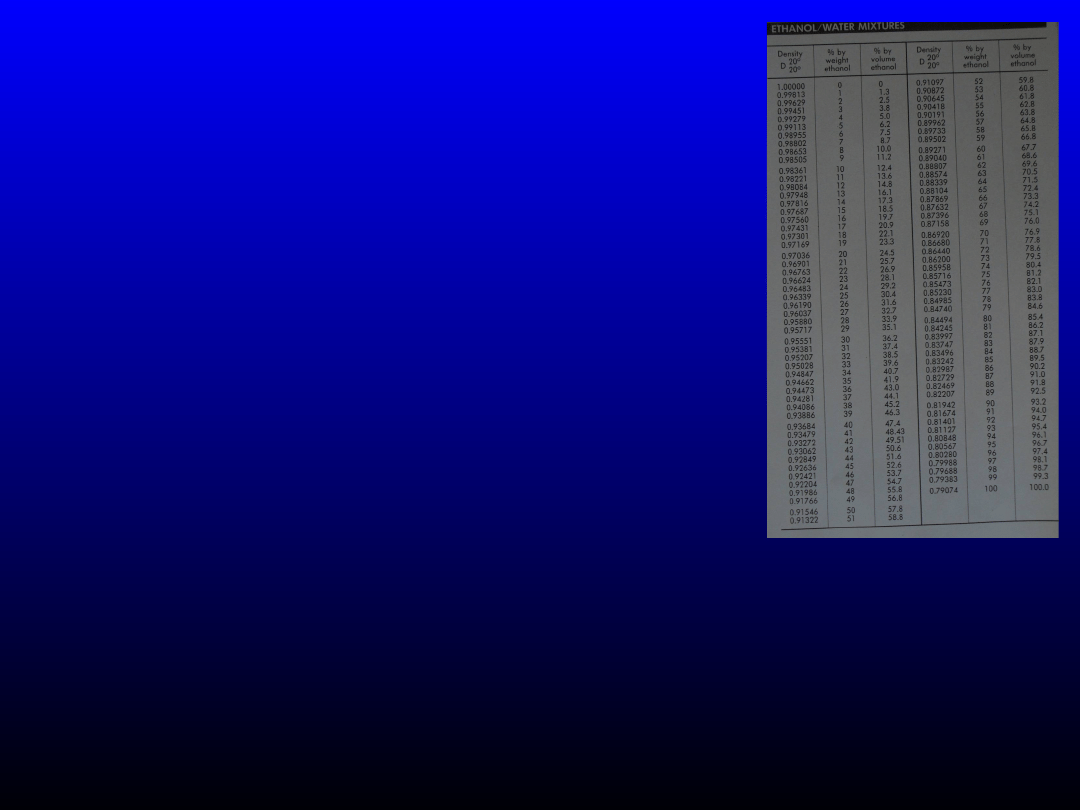
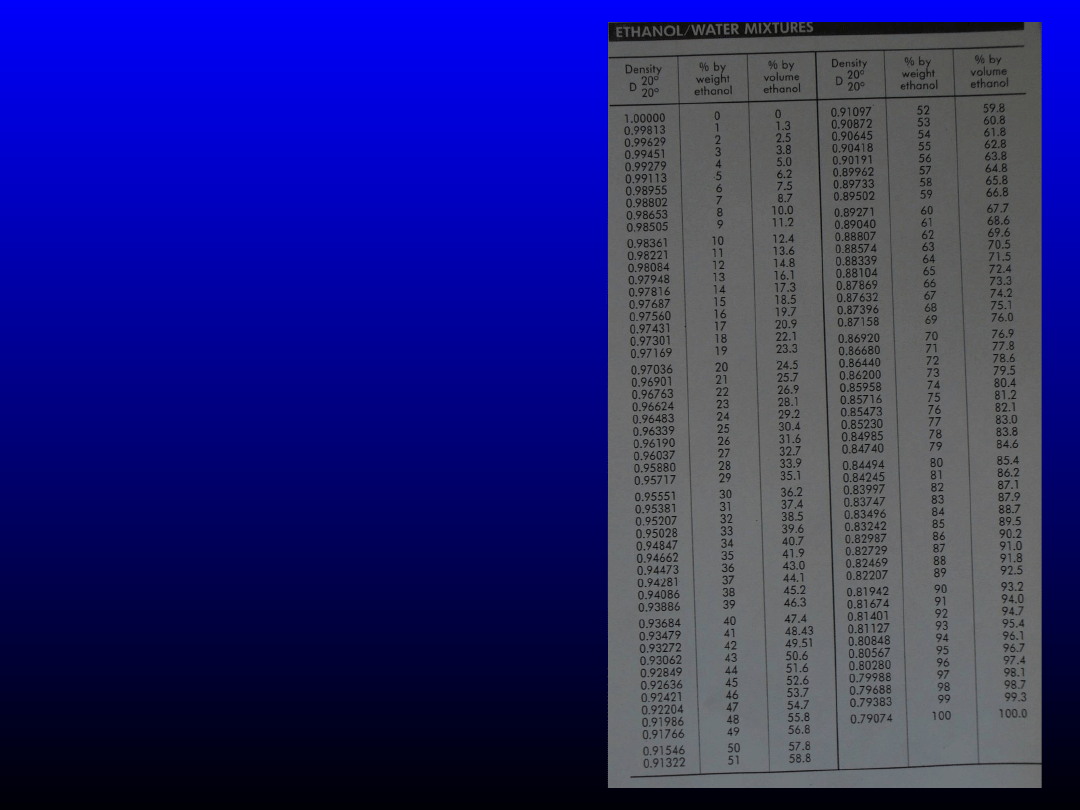
Należy pamiętać, że nie możemy wstawiać stężenia procentowego
objętościowo-objętościowego, ale tylko procentowe wagowo-wagowe.
Zatem szukamy
w tablicach, jakie stężenie (w/w) odpowiada stężeniu 96%(v/v) –
94%(w/w)
i jakie stężeniu 40%(v/v) –
33%(w/w).
Odszukujemy również gęstości
alkoholu o podanym stężeniu – odpowiednio 0,80848 i 0,95028 g/cm
3
.
Wszystkie te wartości podstawiamy do
powyższego równania
103,16
Etanol - rozcieńczanie
Etanol - rozcieńczanie
Etanol - rozcieńczanie
Etanol - rozcieńczanie
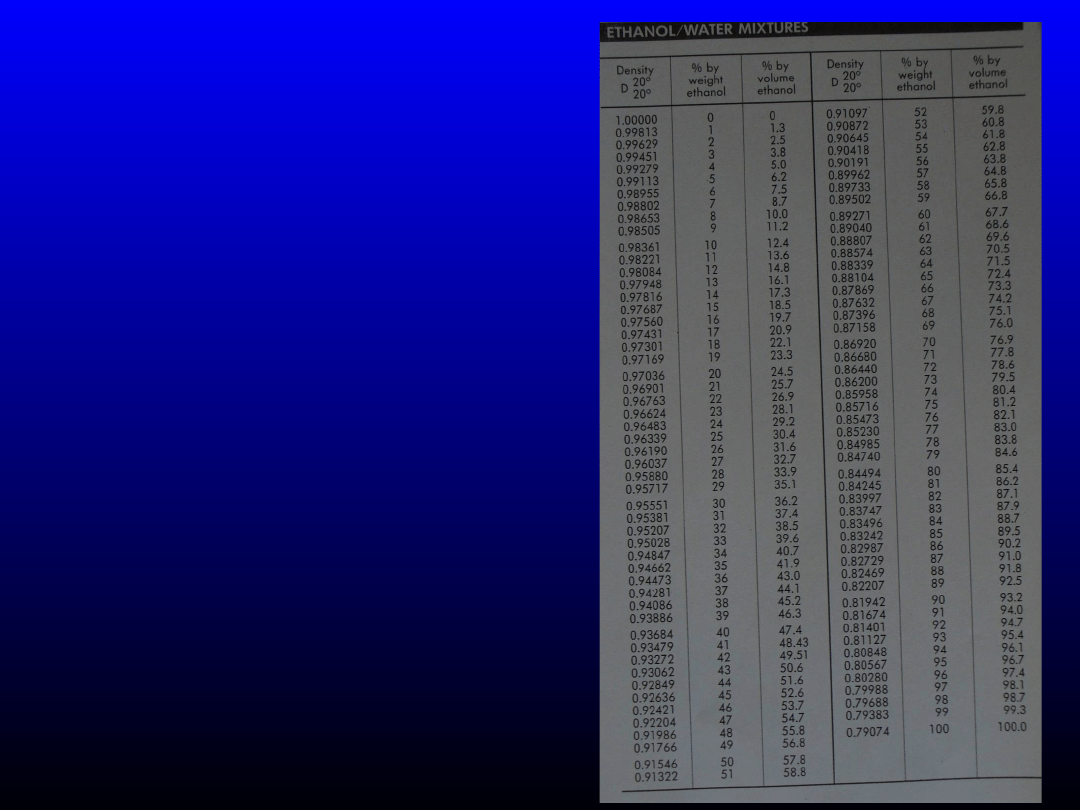
•Jaką objętość 96%
(v/v) etanolu
potrzeba do
sporządzenia 200
cm
3
50% (w/w)
roztworu?
Etanol - rozcieńczanie
Etanol - rozcieńczanie
•Jaką objętość 96%
(v/v) etanolu
potrzeba do
sporządzenia 150 g
70% (v/v) roztworu?
Etanol - rozcieńczanie
Etanol - rozcieńczanie
•Jaką masę 96%
(w/w) etanolu
potrzeba do
sporządzenia 200 g
50% (v/v) roztworu?

Dziękuję za uwagę
Dziękuję za uwagę
Ciąg dalszy zapewne nastąpi niebawem
Ciąg dalszy zapewne nastąpi niebawem
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
Wyszukiwarka
Podobne podstrony:
AaOPC 2011.05.13 wyklad, Administracja UKSW II st nst 2010-2012, II semestr
h I st II sem 2011 12
morawska - pytania z egz, Administracja UKSW II st nst 2010-2012, II semestr
pytania morawska wyklady, Administracja UKSW II st nst 2010-2012, II semestr
pytania z ochrony praw czlowieka, Administracja UKSW II st nst 2010-2012, II semestr
Wszystkie wyklady razem- Morawska, Administracja UKSW II st nst 2010-2012, II semestr
Derogacja opracowanie, Administracja UKSW II st nst 2010-2012, II semestr
WM Cw8 Spraw v14 2011.12.05
2011 12 L II AiR st I st Przetworniki i Uklady Pomiaroweid 27401
2011 12 L II AiR st I st Przetworniki i Uklady Pomiarowe
Wyklad 1- 2011-12, Studia, Pedagogika opiekuńcza i resocjalizacyjna - st. magisterskie, Pedagogika o
Zagadnienia do kolokwium UMBM st. niestacjonarne 2011-12, szkoła, PWR, Elastyczne systemy wytwórcze
plan lab Przem 2011 12 st, Elektrotechnika, Downloads
I PS- II st. 12.13-s, Praca Socjalna, I rok, II semestr
AWF -DGN FUNKCJ I PLAN FIZJO W KARDIO i PULM 2011-12 ST, Fizjoterapia, Kardiologia
Protetyka-i-ortotyka-NST-Fizjo-II-st.-II-r, ZARZĄDZENIE REKTORA nr
Historia doktryn, filozofia, s st , wykład, 2011 12
więcej podobnych podstron