Wykład 3 – REAKCJE CHEMICZNE
REAKCJE
CHEMICZNE
Równanie reakcji chemicznej i jego interpretacja na poziomie
cząsteczkowym i makroskopowym. Klasyfikacja reakcji chemicznych
według: schematu reakcji, rodzaju reagentów, efektu energetycznego,
składu fazowego reagentów, odwracalności reakcji, wymiany
elektronów.
Efekt
energetyczny
reakcji.
Zasady
obliczeń
stechiometrycznych – prawo zachowania masy, prawo stosunków
stałych.
Wykład 3 – REAKCJE CHEMICZNE
RÓWNANIE REAKCJI CHEMICZNEJ
REAKCJA CHEMICZNA to proces podczas którego
następuje zmiana składu i
właściwości materii.
Podczas reakcji chemicznej następuje zrywanie lub/i
tworzenie wiązań chemicznych.
O
2H
CO
2O
CH
2
2
2
4
SUBSTRATY
PRODUKTY
REAGENTY
PRZED reakcją
PO reakcji
Wykład 3 – REAKCJE CHEMICZNE
INTERPRETACJA (odczytanie) równania reakcji
O
2H
CO
2O
CH
2
2
2
4
●
na poziomie cząsteczkowym:
"Jedna cząsteczka metanu reaguje z dwiema cząsteczkami tlenu
dając cząsteczkę ditlenku węgla i dwie cząsteczki wody"
●
na poziomie makroskopowym:
"Jeżeli jeden mol metanu przereaguje z dwoma molami tlenu
to powstanie jeden mol ditlenku węgla i dwa mole wody"
Jeżeli do reakcji (nierównowagowej) weźmie się substraty w innych
proporcjach licznościowych niż wynika z równania chemicznego wtedy
reakcja przebiega do wyczerpania się jednego z substratów.
Przykład: Zmieszano 1 mol CH
4
i 1 mol O
2
.
Reakcja przebiegnie do wyczerpania się O
2
– pozostanie
1/2 mola CH
4
– powstanie 1/2 mola CO
2
i 1 mol H
2
O
Stopień przereagowania substratu wskazuje jaka jego część
została przemieniona w produkt
Wykład 3 – REAKCJE CHEMICZNE
●
Schemat reakcji
KLASYFIKACJA REAKCJI CHEMICZNYCH
Kryterium klasyfikacji:
H
2
+ Cl
2
= 2HCl
(synteza z
pierwiastków)
4H
2
O = H
2
O
2
+ 3H
2
+ O
2
(radioliza)
Q
γ
AgNO
3
+ NaCl = AgCl + NaNO
3
(podwójna)
2BiI
3
= 2Bi + 3I
2
(dysocjacja termiczna)
– analiza, rozkład
2AgBr = 2Ag + Br
2
(fotoliza)
– synteza
2NO
2
= N
2
O
4
(polimeryzacja)
CaO + H
2
O = Ca(OH)
2
(synteza ze
związków)
– wymiana
Fe
2
O
3
+ 2Al = Al
2
O
3
+ 2Fe
(pojedyncza)
hν
– reakcja RODNIKOWA (bardzo aktywne atomy lub grupy
atomów mające niesparowane elektrony)
Cl
2
+ H
2
= 2HCl
Wykład 3 – REAKCJE CHEMICZNE
●
Rodzaj reagentów
KLASYFIKACJA REAKCJI CHEMICZNYCH
Kryterium klasyfikacji:
– reakcja CZĄSTECZKOWA (reagują obojętne cząsteczki,
atomy))
C + O
2
= CO
2
– reakcja JONOWA (wszystkie lub niektóre reagenty są
jonami)
Zn + 2H
+
= Zn
2+
+ H
2
hν
Cl
2
Cl· + H
2
= HCl + H·
H· + Cl
2
= HCl + Cl·
itd.
Mechanizm rodnikowy reakcji łańcuchowej
Cl· + H· = HCl
Cl· + Cl· = Cl
2
H· + H· = H
2
x·
– rodnik
Reakcje kończące łańcuch
= 2Cl·
Wykład 3 – REAKCJE CHEMICZNE
●
Stan fazowy reagentów
KLASYFIKACJA REAKCJI CHEMICZNYCH
Kryterium klasyfikacji:
– reakcja HOMOGENICZNA – wszystkie substraty i produkty
znajdują się w tej samej
fazie
FAZA – jednorodna część układu oddzielona powierzchnią graniczną
(s) – faza stała
(c) – faza ciekła
(g) – faza gazowa
N
2
(g) + 3H
2
(g) ⇆ 2NH
3
(g)
reakcja homogeniczna w fazie gazowej
NH
3
·H
2
O(c) ⇆ NH
4
+
(c) + OH
–
(c)
reakcja homogeniczna w fazie ciekłej
– reakcja HETEROGENICZNA – co najmniej dwa reagenty
znajdują się w różnych
fazach
Zn(s) + 2H
+
(c) = Zn
2+
(c) + H
2
(g)
Zn(s) + S(s) =
ZnS(s)
– reakcja heterogeniczna
!
– każda faza stała jest
inna !
Wykład 3 – REAKCJE CHEMICZNE
●
Odwracalność reakcji
KLASYFIKACJA REAKCJI CHEMICZNYCH
Kryterium klasyfikacji:
– reakcja ODWRACALNA
Reakcję nazywamy odwracalną lub równowagową,
jeżeli w jej wyniku ustala się stan równowagi w którym
współistnieją produkty i substraty w określonych
proporcjach.
N
2
+ 3H
2
⇆ 2NH
3
w temp. 500
o
C i pod ciśnieniem 100 MPa
w mieszaninie reakcyjnej jest 57,5 % obj. amoniaku
– reakcja NIEODWRACALNA przebiega do wyczerpania się
co najmniej jednego z
substratów
- ditlenek węgla ulatnia się ze środowiska reakcji
CaCO
3
= CaO + CO
2
W naczyniu zamkniętym możliwa jest reakcja odwrotna:
CaO + CO
2
=
CaCO
3
W dostatecznie wysokiej temperaturze ustali się stan równowagi
– reakcja będzie odwracalna
CaO + CO
2
⇆
CaCO
3
Wykład 3 – REAKCJE CHEMICZNE
●
Wymiana elektronów
KLASYFIKACJA REAKCJI CHEMICZNYCH
Kryterium klasyfikacji:
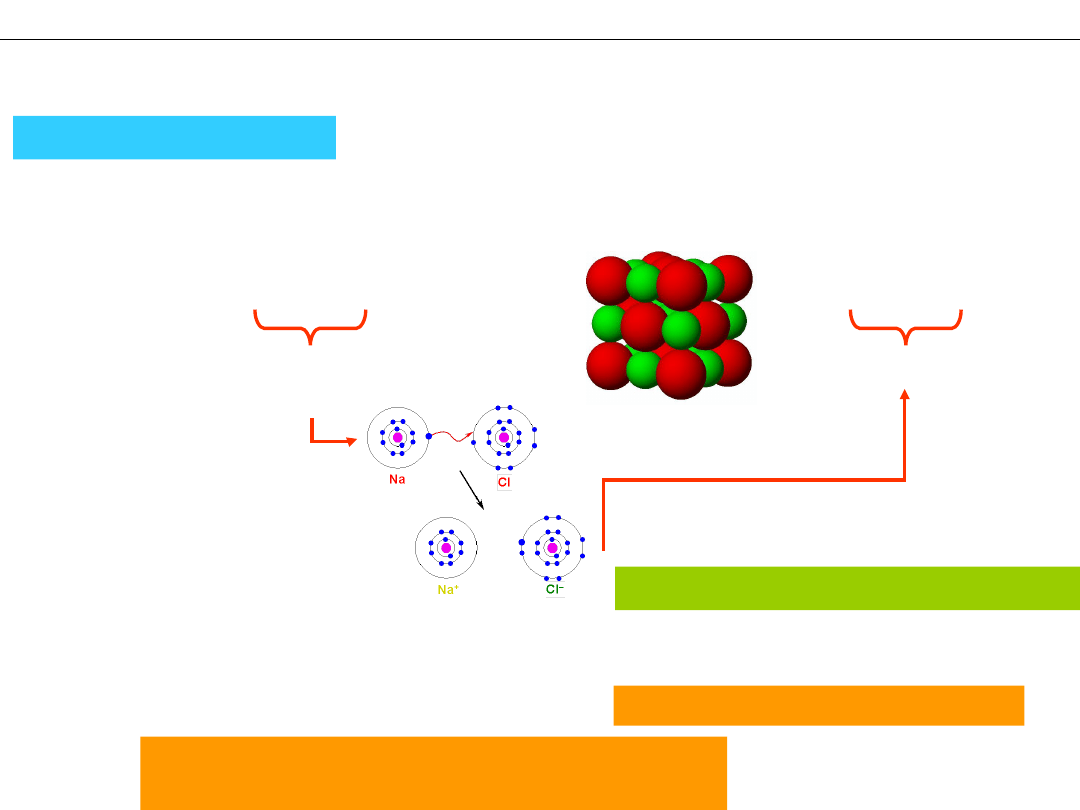
– reakcja Z WYMIANĄ ELEKTRONÓW – reakcja oksydacyjno -
redukcyjna
2Na + Cl
2
= 2NaCl →
obojętne
atomy
jony
Na
+
Cl
–
– reakcja BEZ WYMIANY ELEKTRONÓW – atomy, jony nie zmieniają
ładunków
AgNO
3
+ NaCl = AgCl +
NaNO
3
Więcej na następnym wykładzie!
→ 2Na
+
+ 2Cl
–
(Ag
+
NO
3
–
) + (Na
+
Cl
–
) = (Ag
+
Cl
–
) + (Na
+
NO
3
–
)
←reagenty mają budowę jonową

Wykład 3 – REAKCJE CHEMICZNE
●
Efekt energetyczny
KLASYFIKACJA REAKCJI CHEMICZNYCH
Kryterium klasyfikacji:
– reakcja EGZOTERMICZNA (wydzielanie
ciepła)
C + O
2
= CO
2
ΔH°= –394
kJ/mol
– reakcja ENDOTERMICZNA (pochłanianie
ciepła)
CaCO
3
= CaO + CO
2
ΔH°
= 176
kJ/mol
ΔH° - standardowa entalpia reakcji
– energia reakcji zmierzona w
warunkach standardowych, tzn. reagenty jako czyste
substancje, pod ciścieniem P
o
= 10
5
Pa i w temperaturze
298 K (lub podanej)
(–) reakcja egzotermiczna – reagujący układ traci energię (ciepło)
Wapiennik
Znak entalpii (+/–) ustala się dla reakcji:
(+) reakcja endotermiczna – reagujący układ zyskuje energię (ciepło)
(–)
(+)
Entalpie dodaje się tak, jak reakcje
Wykład 3 – REAKCJE CHEMICZNE
EFEKT ENERGETYCZNY REAKCJI
Prawo Hessa: Efekt energetyczny reakcji nie zależy od drogi po
której reakcja przebiega, a jedynie od jej stanu
początkowego i końcowego
C + O
2
=
C
O
2
Przykład: Otrzymywanie ditlenku węgla CO
2
Substraty
C
O
2
Droga 1
ΔH°(1)= –393,5 kJ/mol
Droga 2
C + ½ O
2
= CO
ΔH°(2)= –110,5 kJ/mol
CO + ½ O
2
=
CO
2
ΔH°(3)= –283 kJ/mol
CO
2
ΔH°(1)= ΔH°(2) + ΔH°(3) = (–110,5) + (–283) = –393,5 kJ/mol
Produkt
R(1)
R(2)
R(3)
R(1) = R(2) + R(3)
C + ½ O
2
=
CO
CO + ½ O
2
=
CO
2
C + CO +O
2
= CO +CO
2
+
R(2)
R(3)
R(1)
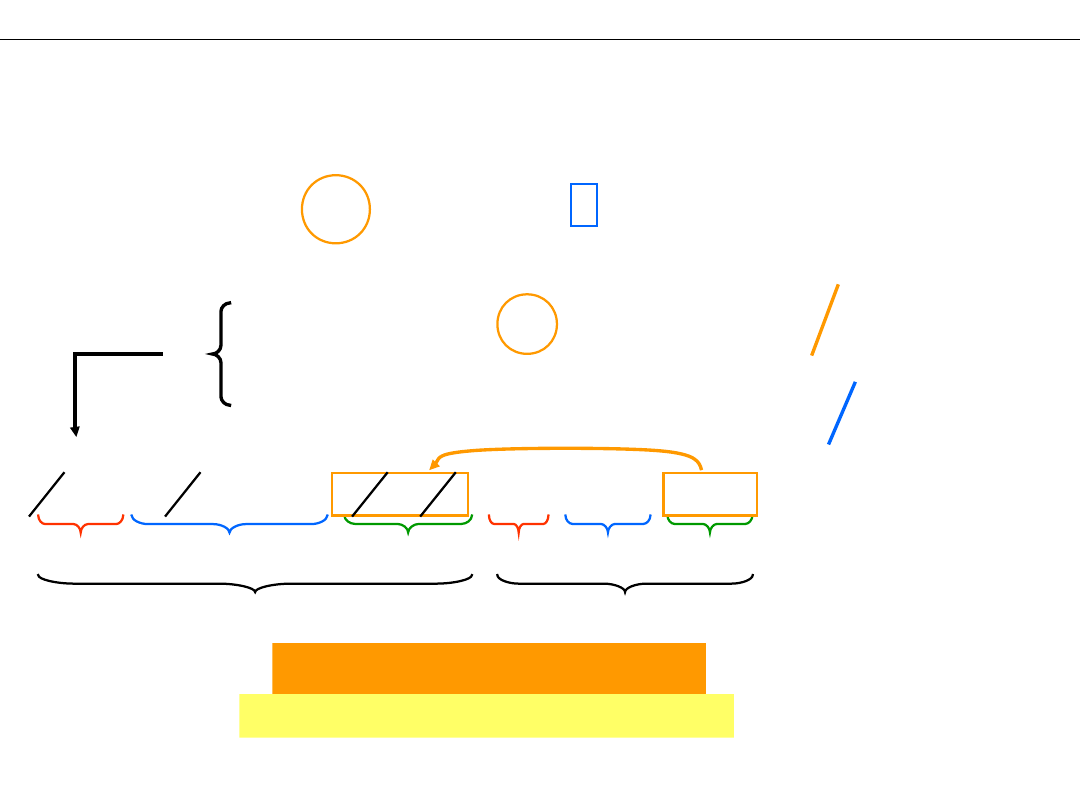
Wykład 3 – REAKCJE CHEMICZNE
Wyznaczanie entalpii reakcji na podstawie entalpii
tworzenia reagentów
C + 2H
2
=
CH
4
Zadanie: Obliczyć ΔH° reakcji spalania
metanu.
ΔH°(1)= –75 kJ/mol
H
2
+ ½ O
2
=
H
2
O
C + O
2
= CO
2
ΔH°(0)= ΔH°(2) + 2ΔH°(3) – ΔH°(1) = (–393,5) + 2(–286) – (–75) = – 890,5 kJ/mol
R(1)
R(2)
R(3)
R(0) = R(2) + 2R(3) –
R(1)
Rozwiązanie:
R(0)
Reakcję R(0) można złożyć z reakcji tworzenia reagentów z pierwiastków
ΔH°(2)= –393,5 kJ/mol
ΔH°(3)= –286 kJ/mol
C + O
2
+
2
H
2
+
2
·½O
2
– C – 2H
2
=
CO
2
+
2
H
2
O
–
CH
4
+
R(2)
2R(3)
–R(1)
R(2)
2R(3)
–R(1)
CH
4
+ 2O
2
= CO
2
+ 2H
2
O
R(0)
Entalpie dodaje się tak, jak reakcje
CH
4
+ 2O
2
= CO
2
+ 2
H
2
O
–1
x 2
Wykład 3 – REAKCJE CHEMICZNE
OBLICZENIA
STECHIOMETRYCZNE
Stechiometria – (gr. stoicheíon element) - ilościowy skład związków
chemicznych i stosunków ilościowych reagujących
substancji.
Podstawowe prawa stechiometrii:
●
Prawo zachowania masy:
Suma mas substratów jest równa sumie mas
produktów.
Przykład: Ile gramów wody powstanie w wyniku
reakcji
2,016 g wodoru z 32,00 g tlenu?
Odp. 2,016 + 32,00 = 34,02 g H
2
O
●
Prawo stosunków stałych:
Pierwiastki reagują ze sobą w stałych, ściśle
określonych stosunkach ilościowych (stechiometrycznych),
charakterystycznych dla danej reakcji.
45,0 g NO – y g H
2
O
Wykład 3 – REAKCJE CHEMICZNE
●
Obliczanie liczności lub mas reagentów na podstawie równania reakcji
Zadanie: Podczas reakcji 4NH
3
+ 5O
2
= 4NO + 6H
2
O powstało 45,0 g NO.
Ile moli tlenu przereagowało i ile powstało gramów wody? M
NO
=
30,0 g/mol
Rozwiązanie:
Proporcja wagowa:
4NH
3
+ 5O
2
= 4NO + 6H
2
O
Obliczamy liczność NO:
Z reakcji wynika proporcja:
5 moli O
2
– 4 mole
NO
45,0 g
n
NO
=
= 1,50 mol
30,0 g/mol
x moli O
2
– 1,50 mola NO
x = 1,88 mola O
2
Z reakcji wynika inna proporcja:
4NH
3
+ 5O
2
= 4NO + 6H
2
O
4 mole NO
– 6 moli
H
2
O
Jakie są masy
tych substancji?
4·30,0 = 120,0 g
NO
– 6·18,0 = 108,0
g H
2
O
y = 40,5 g H
2
O
Wykład 3 – REAKCJE CHEMICZNE
OBLICZENIA
STECHIOMETRYCZNE
●
Skład wagowy substancji
Zadanie: Obliczyć ułamki wagowe pierwiastków (skład procentowy)
NH
4
NO
3
.
Rozwiązanie:
NH
4
NO
3
1 mol związku zawiera 2 mole N
(nie
N
2
!)
1 mol związku zawiera 4 mole H
(nie
H
2
!)
1 mol związku zawiera 3 mole O
(nie
O
2
!)
Masa 1 mola NH
4
NO
3
:
2·14,0
+
4·1,0
+
3·16,0
= 80,0 g/mol
Ułamki wagowe pierwiastków:
2·14,0
80,0
w
N
=
= 0,35 → 35%
28,0
80,0
=
4·1,0
80,0
w
H
=
= 0,05 → 5%
4,0
80,0
=
3·16,0
80,0
w
O
=
= 0,60 → 60%
48,0
=
80,0
M
N
M
H
M
O
Wykład 3 – REAKCJE CHEMICZNE
●
Wyznaczanie wzoru chemicznego na podstawie składu wagowego substancji
Zadanie: Ustalić wzór boranu B
x
H
y
zawierającego wagowo 21,7%
wodoru.
M
BxHy
= 27,6 g/mol
Rozwiązanie:
B
x
H
y
W dowolnej ilości związku stosunek
x : y jest zawsze taki sam!
Pierwszy wzór związku:
W 100,0 g związku jest
21,7 g H
, a reszta to
78,3 g B.
Jakie to liczności?
1,0
g/mol
n
H
=
= 21,7
mol
21,7
g
10,8
g/mol
n
B
=
= 7,25
mol
78,3
g
B
7,25
H
21,7
- liczby atomów powinny być
całkowite!
Dzielimy obie liczby przez mniejszą z nich (czyli 7,25), co daje:
B
1
H
2,96
- Błąd analizy! – zaokrąglamy do 3
B
1
H
3
W cząsteczce może być wielokrotnie więcej atomów ( jak NO
2
i N
2
O
4
)
- sprawdzamy masę molową:
Jaki jest x : y w np. 100,0 g związku?
Dla BH
3
: 10,8 + 3·1,0 = 13,8 g/mol
Rzeczywista masa molowa
M
BxHy
= 27,6 g/mol
jest około 2 razy większa, co odpowiada wzorowi cząsteczki:
B
2
H
6
M
H
M
B
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
Wyszukiwarka
Podobne podstrony:
03 Reakcje chemiczne II, utlenianie i redukcja instrukcja
więcej podobnych podstron