
PRZEMIANY AZOTOWE

Przemiany azotowe
to przemiany, jakim podlega
azot
- czyli w jaki
sposób
azot jest usuwany z aminokwasów i przekształcany w mocznik.
Przemiany azotowe dotyczą
białek
, ponieważ te są głównym nośnikiem
azotu w organizmie. Azot jest zawarty w:
• grupach aminowych aminokwasów
• grupach amidowych glutaminy i asparaginy
• pierścieniu tryptofanu, proliny i hydroksyproliny
• grupach guanidynowych argininy.
Aminokwasy są elementem budulcowym białek.
Amoniak, pochodzący z azotu aminokwasów, jest dla ludzi potencjalnie toksyczny.
Człowiek usuwa amoniak przekształcając go w
nietoksyczny mocznik
w cyklu
mocznikowym, którego prawidłowy przebieg jest niezwykle istotny dla
utrzymania zdrowia.
Aminokwasy stanowią źródło azotu dla wielu innych niż białka związków:
nukleotydów, neurotransmitterów i grup prostetycznych.
PRZEMIANY
AZOTOWE

TURNOVER BIAŁEK - OBRÓT METABOLICZNY
Białka żywych organizmów są stale odnawiane poprzez
nieprzerwany proces degradacji i resyntezy z wolnych
aminokwasów.
• Każdego dnia organizm dorosłego człowieka degraduje 1-2% całkowitego
białka organizmu (głównie białka mięśni). 75-80% uwolnionych
aminokwasów jest wówczas ponownie wykorzystywane do syntezy białka.
Znaczenie
obrotu metabolicznego
:
•
usuwanie
nieprawidłowych
białek
•
usuwanie białek
niepotrzebnych
, które spełniły już swoje
zadanie np. przeciwciał lub enzymów wykorzystanych
przez substraty
•
regulacja stężenia poszczególnych białek; dostosowanie do
potrzeb tkanki czy narządu
•
bardzo
szybki
obrót mają
enzymy
o znaczeniu
regulacyjnym

OKRES PÓŁTRWANIA BIAŁEK
duże różnice dla poszczególnych białek
krótki
dla białek enzymatycznych (minuty, godziny,
dni)
długi
- dla białek strukturalnych (mięśni, tkanki
łącznej i tkanki nerwowej) (miesiące, lata)
decyduje o tym podatność białka na działanie proteaz
rozróżnia się
białka o szybkim obrocie i małej puli
tkankowej
oraz
powolnej przemianie i dużej puli
tkankowej
TURNOVER BIAŁEK - OBRÓT METABOLICZNY

TURNOVER BIAŁEK - OBRÓT METABOLICZNY
OBRÓT BIAŁEK WĄTROBY-
wątroba reguluje zaopatrzenie
tkanek w aminokwasy:
większość to szybko się odnawiające - około 10% całej puli
białek
wątroby; białka o wolnym obrocie - 24%
w ciągu doby wątroba odnawia 50% puli swoich białek; tj. 50g/dobę czyli
1/3 obrotu białek całego organizmu
okresy półtrwania niektórych białek
:
dekarboksylaza ornitynowa - 11 minut
syntetaza ALA - 60 minut
dehydrogenaza glutaminianowa - 6 godzin
b-glukuronidaza - 30 dni

BIAŁKA MIĘŚNI:
obrót wolniejszy niż białek wątroby;
najmniejszy obrót
aktyna
w stanach zwiększonego metabolizmu zwiększa się obrót
białek mięśni
zwiększony w stanach patologicznych: dieta bezbiałkowa
lub ubogo białkowa, głód, cukrzyca, po pobudzeniu
hormonami kory nadnerczy, w przebiegu ostrych zakażeń,
bezczynności.
TURNOVER BIAŁEK - OBRÓT METABOLICZNY

B
IAŁKA TKANKOWE
P
ULA AMINOKWASÓW
Białka pokarmowe
Azotowe substancje niebiałkowe
Porfiryny, puryny, pirymidyny, ami-
nocukry, fosfolipidy, aminy
S
YNTEZA AMINOKWASÓW
K
ATABOLIZM AMINOKWASÓW
Ł
AŃCUCHY WĘGLOWE
NH
3
G
LUKOZA
CO
2
+ H
2
O
MOCZNIK
NH
4
+
BILANS PRZEMIANY BIAŁEK I
AMINOKWASÓW

AMINOKWAS
Y
Większość mikroorganizmów i roślin wytwarza cały
podstawowy zestaw aminokwasów, wiele
organizmów wyższych, w tym ludzi, straciło zdolność
syntezy niektórych z nich (
z powodu braku
enzymów
). Istnieje więc konieczność pobierania
odpowiedniej ilości aminokwasów z pożywieniem.
Aminokwasy, które muszą być pobierane z
pożywieniem, w celu utrzymania zdrowia i
podtrzymania wzrostu, to
aminokwasy egzogenne.
Aminokwasy endogenne
z kolei to te, które organizm
sam wytwarza z dostarczanego azotu i dwutlenku
węgla.
Aminokwasy endogenne syntetyzowane są w dość
prostych reakcjach, natomiast szlaki powstawania
aminokwasów egzogennych są bardziej
skomplikowane.

Aminokwasy niezbędne (egzogenne):
•
histydyna (His)(±)
•
arginina (Arg) (±)
•
izoleucyna (Ile)
•
leucyna (Leu)
•
lizyna (Lys)
•
metionina (Met)
•
fenyloalanina (Phe)
•
treonina (Thr)
•
tryptofan (Trp)
•
walina (Val)
AMINOKWASY

Aminokwasy nie niezbędne (endogenne):
AMINOKWASY
•
alanina (Ala)
• asparagina (Asn)
• kwas asparaginowy (Asp)
• cysteina (Cys)
• glutamina (Gln)
• kwas glutaminowy (Glu)
• glicyna (Gly)
• prolina (Pro)
• seryna (ser)
• tyrozyna (Tyr)
aminokwasy
————
—
—
————
———
————
—
—
—
—
—
—
—
mocznik
(produkt rozpadu aminokwasów)
aminy biogenne
wytwarzanie energii, katabolizm
synteza białek, anabolizm
AMINOKWASY

BILANS
AZOTOWY
Bilans azotowy
–
jest to różnica między całkowitym
azotem spożytym, a całkowitym azotem wydalonym w
kale, moczu, pocie, złuszczonym nabłonku.
• bilans azotowy zrównoważony
- czyli ilość azotu
przyswojonego i wydalonego są równe.
Dorosły, zdrowy, prawidłowo odżywiający się człowiek –
bilans azotowy zerowy
(wyrównany), jest w stanie
równowagi azotowej.

BILANS AZOTOWY
•
bilans azotowy dodatni
– więcej azotu zostaje
przyswojonego niż wydalonego. W okresie ciąży, karmienia,
wzrostu i dojrzewania, w czasie rekonwalescencji po
przebytych chorobach.
•
bilans azotowy ujemny
– jest wynikiem choroby
(zaawansowana choroba nowotworowa, stan po operacji),
świadczy o postępującym ubytku białka z organizmu. Więcej
białek ulega degradacji niż jest syntetyzowanych. Dzieje się
tak w okresie głodu, na diecie bezbiałkowej, przy niedostatku
białka w diecie lub niewłaściwym jego składzie, w chorobach
wyniszczających, w wieku starczym (upośledzone wchłanianie,
rozpad białka, upośledzone jego wykorzystanie).
Niedobór choćby jednego aminokwasu może być
przyczyną ujemnego bilansu.

Pożywienie ubogie
w węglowodany i tłuszcze
może spowodować zachwianie
równowagi azotowej nawet wtedy, gdy pokrycie zapotrzebowania białkowego jest
wystarczające.
Niedostarczenie odpowiedniej ilości
węglowodanów i tłuszczów w diecie
wymaga znaczniejszej ilości białka, którego aminokwasy stają się surowcem
energetycznym.
Przebieg procesów metabolicznych zależy od najmniejszej ilości
niezbędnego czynnika pokarmowego
wykorzystanie białka zależy od
najmniejszej ilości aminokwasu niezbędnego obecnego w spożywanym białku.
Minimum białkowe
(zabezpiecza pokrycie strat azotu)
=
0.5 g/kg/dobę
Norma żywieniowa 0,9-1,0 g/kg/dobę
3:2 stosunek białek zwierzęcych do roślinnych
BILANS AZOTOWY

Zaobserwowano, że karmienie zwierząt pewnymi
aminokwasami prowadzi u tych zwierząt do
zwiększonej
glukoneogenezy
i akumulacji glikogenu w wątrobie, a
karmienie innymi, nasila proces
ketogenezy
.
Istnieje też grupa aminokwasów, która indukuje
oba
procesy
.
Te obserwacje stały się podstawą podziału aminokwasów
na:
•
glukogenne
•
ketogenne
•
glutoketogenne
AMINOKWASY GLUKOGENNE I KETOGENNE

• Aminokwasy glukogenne
– szkielety węglowodorowe przekształcają się do:
-
pirogronianu
- -ketoglutaranu
- bursztynylo-CoA
- szczawiooctanu
Synteza glukozy z tych aminokwasów jest możliwa dzięki temu, że produkty cyklu
kwasu cytrynowego i pirogronian ulegają przekształceniu w
fosfoenolopirogronian, a ten w glukozę.
•
Aminokwasy ketogenne
– są degradowane do:
-
acetylo-CoA
- acetoacetylo-CoA
Z nich powstają ciała ketonowe lub kwasy tłuszczowe.
AMINOKWASY GLUKOGENNE I KETOGENNE

AMINOKWASY
GLUKOKETOGENNE
•
Aminokwasy glukoketogenne
– szkielety
węglowodorowe rozpadają się na dwa fragmenty:
-
jeden jest substratem w gukoneogenezie
- drugi fragment jest ciałem ketonowym
(
acetooctan
) lub substratem w procesie
ketogenezy (
acetylo~S-CoA
)

AMINOKWASY GLUKOGENNE I KETOGENNE
•
Aminokwasy glukogenne (są substartami w
glukoneogenezie):
Alanina
Walina
Seryna
Arginina
Cysteina
Glutaminian
Glicyna
Glutamina
Treonina
Histydyna
Asparagina
Prolina
Asparaginian
Metionina
•
Aminokwasy ketogenne:
Leucyna
Lizyna
•
Aminokwasy glukoketogenne:
Izoleucyna
Fenyloalanina
Tryptofan
Tyrozyna
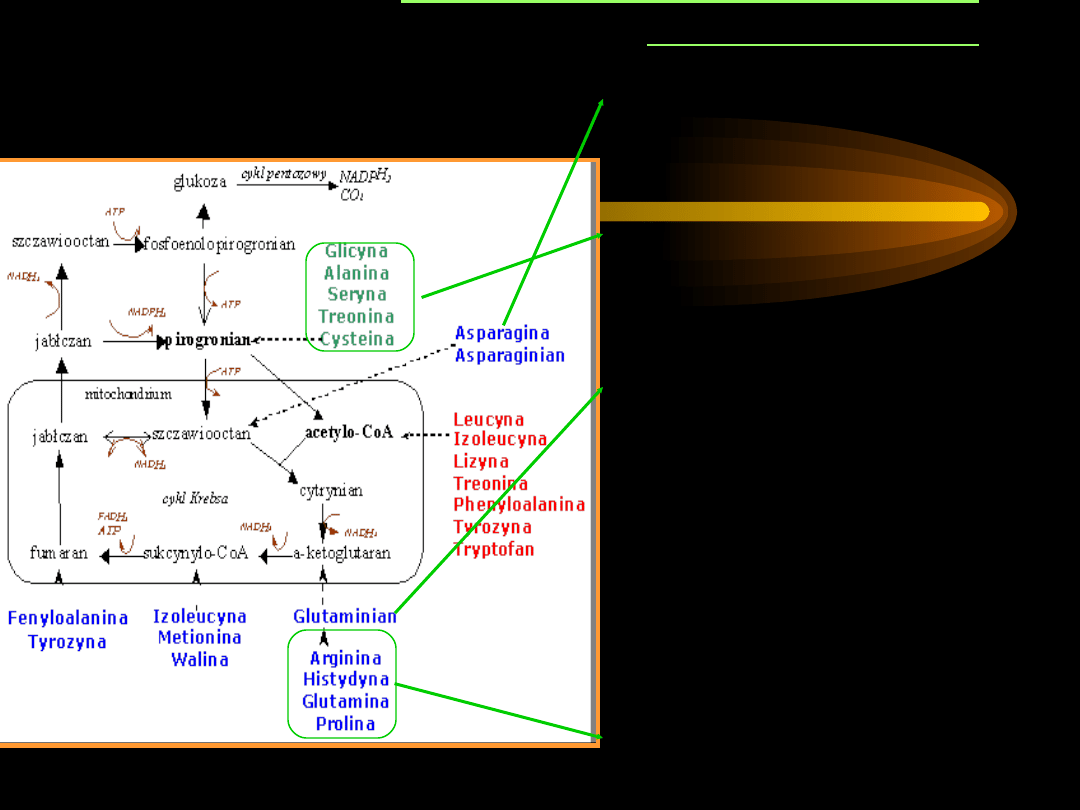
PRZEMIANY AMINOKWASÓW
GLUKOGENNYCH
Asp
– w wyniku transaminacji
przekazuje grupę aminową na
ketokwas, stając się
szczawiooctanem.
Gly, Ala, Ser, Cys, Hyp
– w
wyniku transaminacji powstaje
pirogronian
, ten ulega
dekarboksylacji do
szczawiooctanu.
Gln
– pod działaniem
dehydrogenazy glutaminianowej
lub aminotransferazy ulega
przemianie w
-ketoglutaran
.
Wiele aminokwasów
glukogennych przekształca się
do substratów glukoneogenezy
poprzez inne aminokwasy:
Ala
Trp i Hyp
Gln
Arg, His, Glu, Pro,
Ornityna
Ser
Gly
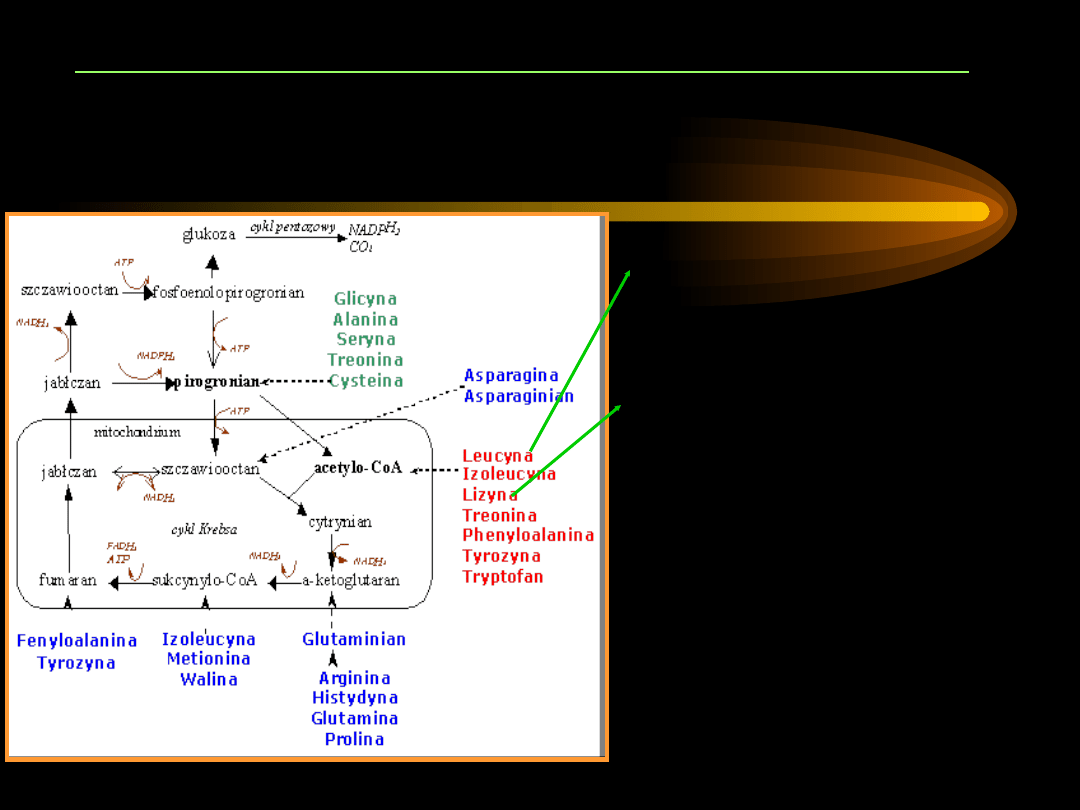
PRZEMIANY AMINOKWASÓW KETOGENNYCH
Leu
– ulega
transaminacji,
przekształca się w
acetooctan
.
Lys
– nie podlega
transaminacji,
przekształca się w
acetoacetylo~S-CoA
,
który może być
traktowany jako
aktywna postać
acetooctanu
.
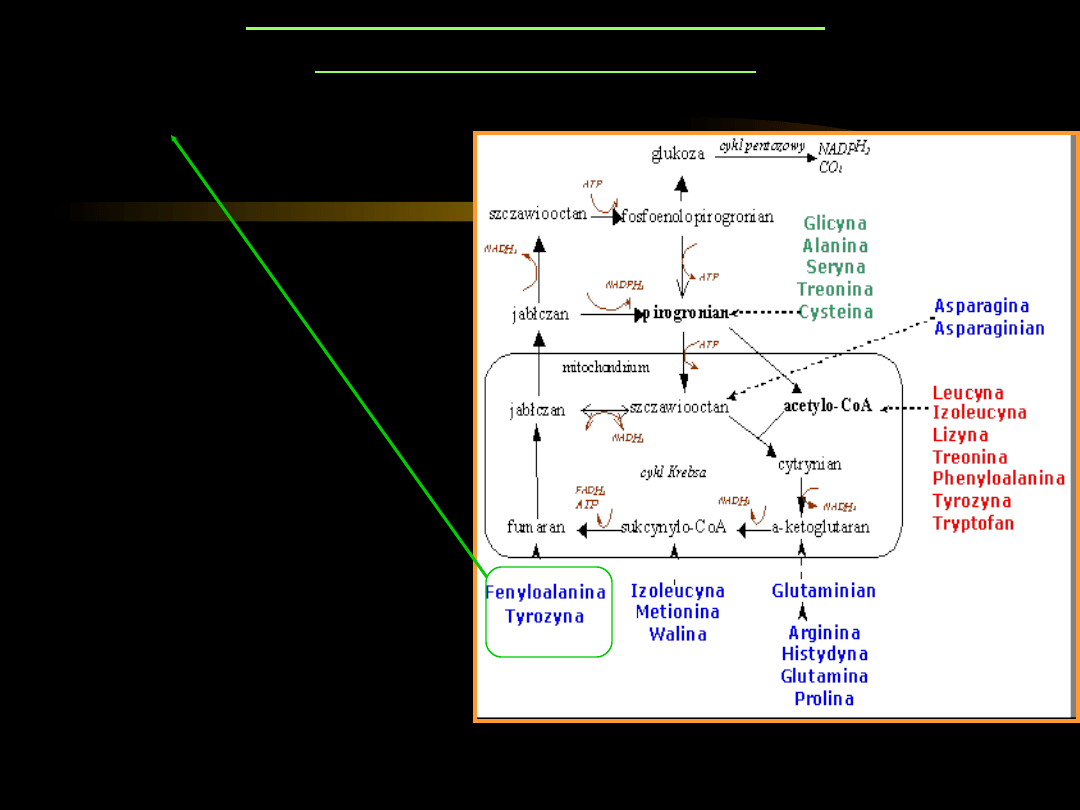
PRZEMIANY AMINOKWASÓW
GLUKOKETOGENNYCH
Phe
i
Tyr
– ulegają
przemianom w wyniku
wielu reakcji z udziałem
kilku enzymów do
acetooctanu
i
fumaranu
.
Wrodzony niedobór tych
enzymów jest przyczyną
chorób metabolicznych:
•
fenyloketourii
(hydroksylaza
fenyloalaninowa;
zaburzenia funkcji układu
nerwowego)
•
tyrozynemii
•
alkaptonurii

PRZEMIANY AMINOKWASÓW
Aminokwasy będące w nadmiarze są degradowane, a
nie magazynowane.
Źródłem wolnych aminokwasów jest:
–
rozpad białek pokarmowych
–
rozpad białek komórkowych
–
rozpad białek pozakomórkowych
–
biosynteza aminokwasów

TRAWIENIE BIAŁEK I AMINOKWASÓW
Rozpad białek zachodzi na drodze
proteolizy
przy udziale
enzymów
proteolitycznych, które hydrolizują wiązania peptydowe
.
Hydroliza
to dodanie cząsteczki wody do wiązania
peptydowego.
Każdemu rozpadowi wiązania peptydowego towarzyszy
odtworzenie
wolnej grupy aminowej jednego aminokwasu i wolnej grupy
karboksylowej drugiego aminokwasu.
PPROTEOLIZA
+
H
3
N————C—C—N—C————C
O
—
—
—
—
—
—
—
H
H
H
R
n
R
n+1
O
O
-
O
— —
—
H
2
O
proteaza
+
H
3
N————C—C + H
3
N
+
—C————C
R
n
—
—
—
—
R
n+1
H
H
— —
— —
O
—
—
O
O
substrat białkowy
dwa produkty proteolizy

PPROTEOLIZA
Enzymy katalizujące proces proteolizy to:
•
proteazy
•
proteinazy
•
peptydazy
Łańcuch białkowy zawiera jeden
aminokwas N-końcowy i jeden aminokwas
C-końcowy.
Egzopeptydazy
- odłączają od białka
pojedyncze końcowe aminokwasy.
-
aminopeptydazy
-
karboksypeptydazy
Endopeptydazy
– przecinają wewnętrzne wiązania w peptydach,
tworząc krótsze peptydy. Aminopeptydazy i karboksypeptydazy
usuwają wówczas odpowiednio aminokwasy z C- i N- końców.

TRAWIENIE BIAŁEK W PRZEWODZIE
POKARMOWYM
Żołądek
– błona śluzowa wydziela sok żołądkowy
(przejrzysty płyn, lekko żółty, pH 1,0, zawierający HCl,
H
2
O, mucynę, sole i enzymy trawienne).
Trawienie białek jest główną funkcją żołądka
.
•
Kwas solny
- białka ulegają denaturacji (utrata struktury
trzeciorzędowej poprzez rozerwanie wiązań wodorowych).
•
Pepsyna
, endopeptydaza (zymogen-pepsynogen):
– rozkłada zdenaturowane białka do peptonów (dużych
polipeptydów)
- rozkłada wiązania peptydowe w obrębie głównej
struktury polipeptydowej
- hydrolizuje wiązania utworzone przez aminokwasy
aromatyczne (tyrozynę) lub dikarboksylowe (glutaminian)

Zawartość żołądka przedostaje się do światła
dwunastnicy
:
-
sok trzustkowy i żółć
(pH zasadowe) – środowisko
niezbędne dla działania enzymów soku trzustkowego i
jelitowego; zahamowana aktywność pepsyny.
Dwunastnica
– sok trzustkowy (wodnisty, nielepki płyn, pH
7,5-8,0. Zawiera liczne enzymy wydzielane jako zymogeny:
•
trypsyna
– wiązania peptydowe utworzone przez
aminokwasy zasadowe
•
chymotrypsyna
– wiązania utworzone przez aminokwasy
pozbawione ładunku elektrycznego (aromatyczne)
•
elastaza
– wiązania utworzone przez małe aminokwasy
Enzymy te są
endopeptydazami
, działają na białka i peptydy,
rozkładając je do polipeptydów i dipeptydów.
•
karboksypeptydaza
– uwalnia aminokwasy od C-końca
TRAWIENIE BIAŁEK W PRZEWODZIE
POKARMOWYM

Jelito cienkie
– sok jelitowy, wydzielany przez gruczoły
dwunastnicze i jelitowe zawiera:
•
karboksypeptydazę A
•
karboksypeptydazę B
•
aminopeptydazę
•
dipeptydazę
Końcowym produktem trawienia białek są wolne
aminokwasy.
TRAWIENIE BIAŁEK W PRZEWODZIE POKARMOWYM
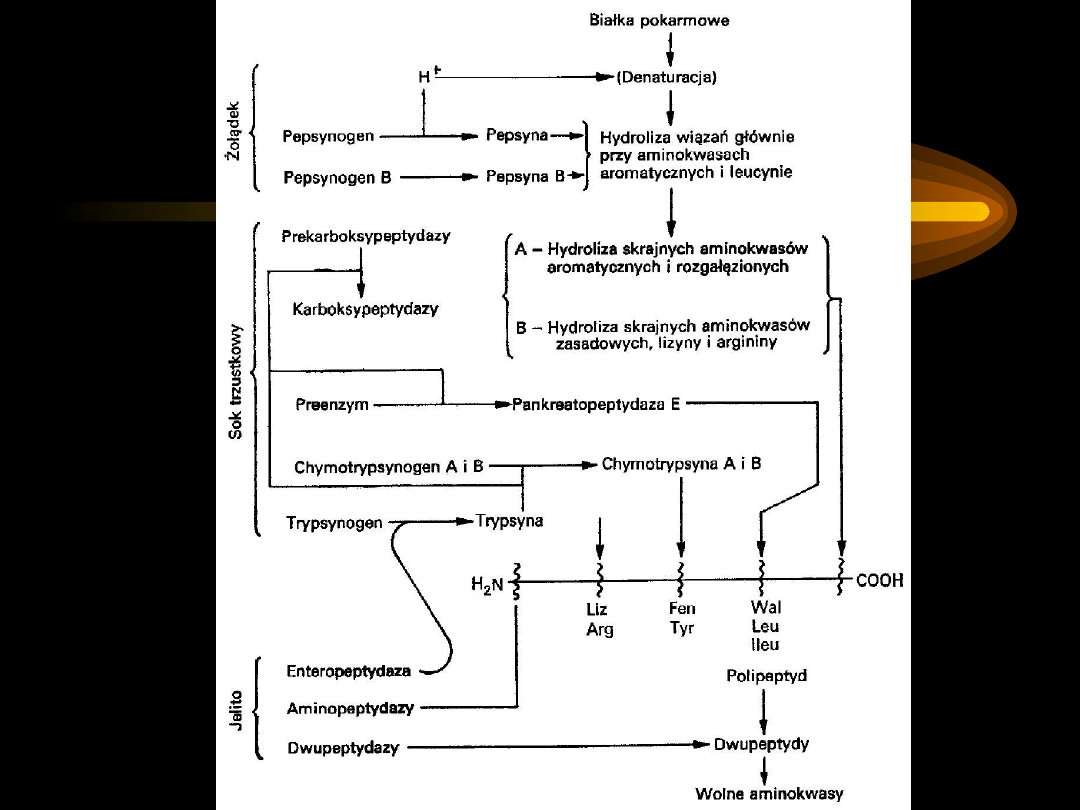
Skutkiem działania enzymów jest rozłożenie
składników pokarmowych do postaci, w której
mogą być wchłaniane i przyswajane.
TRAWIENIE BIAŁEK W PRZEWODZIE POKARMOWYM
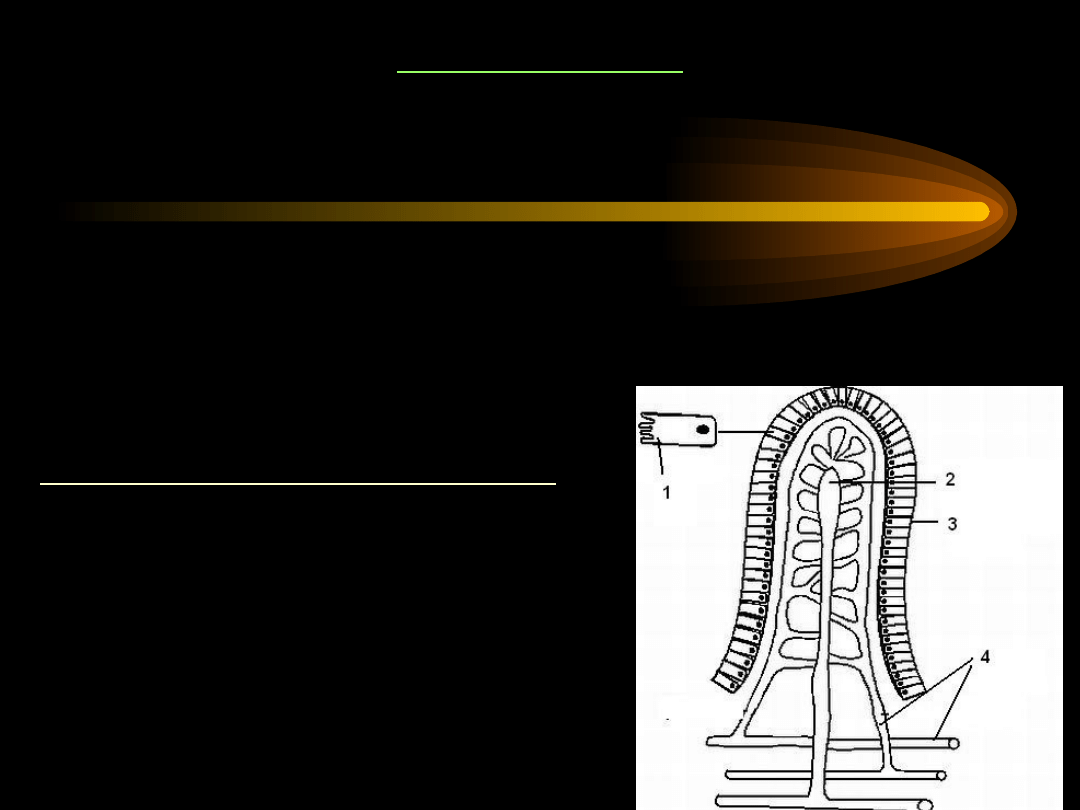
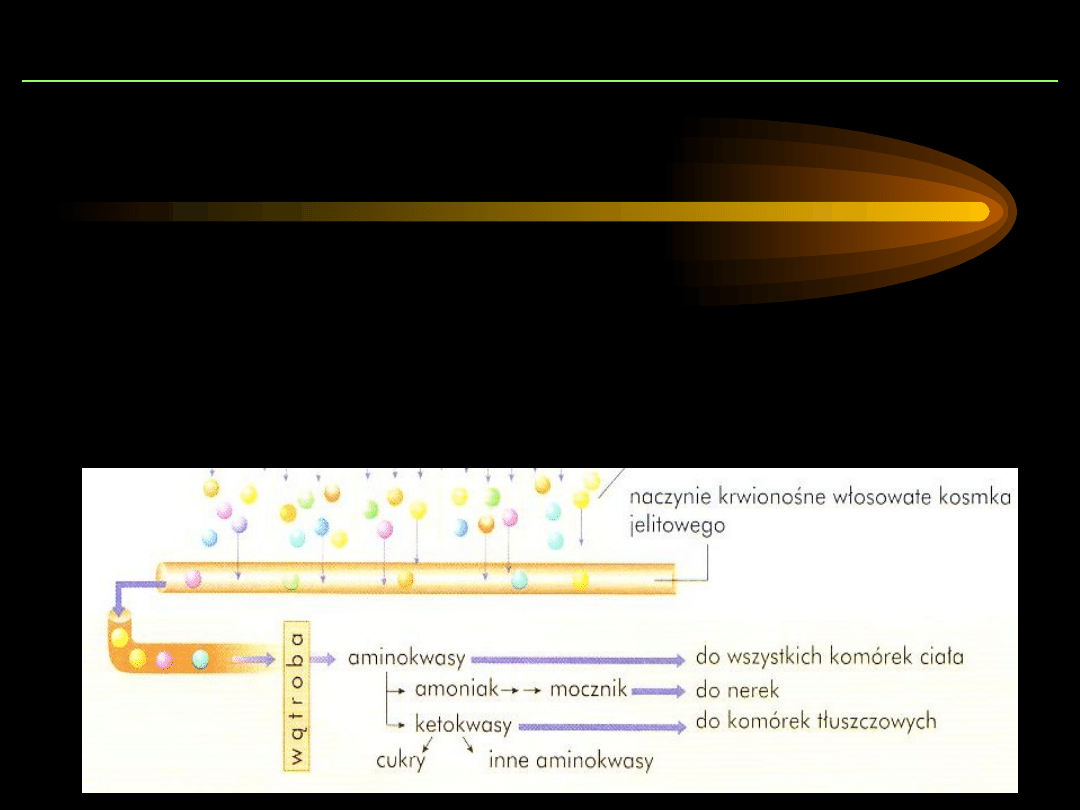
WCHŁANIANIE
Wchłanianie aminokwasów z przewodu pokarmowego
polega na ich transporcie do krążenia wrotnego lub
naczyń limfatycznych.
Wolne aminokwasy, jako rozpuszczalne w wodzie,
są wchłaniane przez nabłonek jelitowy i z krwią
żyły wrotnej dostają się do wątroby.
Jelito cienkie jest głównym narządem
trawiennym i wchłaniającym.
1 – mikrokosmki
2 – naczynie limfatyczne
3 – komórki nabłonkowe
4 – naczynia krwionośne

PRZEMIANY AMINOKWASÓW
Aminokwasy będące w nadmiarze są degradowane, a
nie magazynowane.
Źródłem wolnych aminokwasów jest:
–
rozpad białek pokarmowych
–
rozpad białek komórkowych
–
rozpad białek pozakomórkowych
–
biosynteza aminokwasów

ROZPAD BIAŁEK WEWNĄTRZKOMÓRKOWYCH
Wewnątrzkomórkowe białka
są degradowane przez
wewnątrzkomórkowe proteazy w dwóch
głównych szlakach:
•
białka pozakomórkowe, związane z błoną oraz długo
żyjące białka wewnątrzkomórkowe są degradowane
w lizosomach bez udziału ATP
•
białka wewnątrzkomórkowe, nieprawidłowe, krótko
żyjące wymagają do degradacji ATP i ubikwityny

Białka przeznaczone do degradacji są znakowane
ubikwityną.
Ubikwityna
to małe białko (8,5kDa) występujące we
wszystkich komórkach eukariotycznych.
Aminokwasem C-końcowym jest glicyna.
Jej grupa karboksylowa wytwarza wiązanie peptydowe z
grupą -aminową reszty lizyny białka przeznaczonego
do degradacji.
ROZPAD BIAŁEK WEWNĄTRZKOMÓRKOWYCH

To, czy białko zostanie zdegradowane przez ubikwitynę
zależy od rodzaju aminokwasu obecnego na jego N-
końcu
:
•
metionina i seryna opóźniają
•
arginina i kwas asparaginowy przyspieszają degradację.
Cząsteczka białka wiąże kilka cząsteczek ubikwityny.
Ubikwityna wyznacza wiele wewnątrzkomórkowych białek
do degradacji – jest znacznikiem.
Nieprawidłowe funkcjonowanie lub jej brak jest powodem
wielu chorób: stanów zapalnych, nowotworów, choroby
Alzheimera.
ROZPAD BIAŁEK WEWNĄTRZKOMÓRKOWYCH
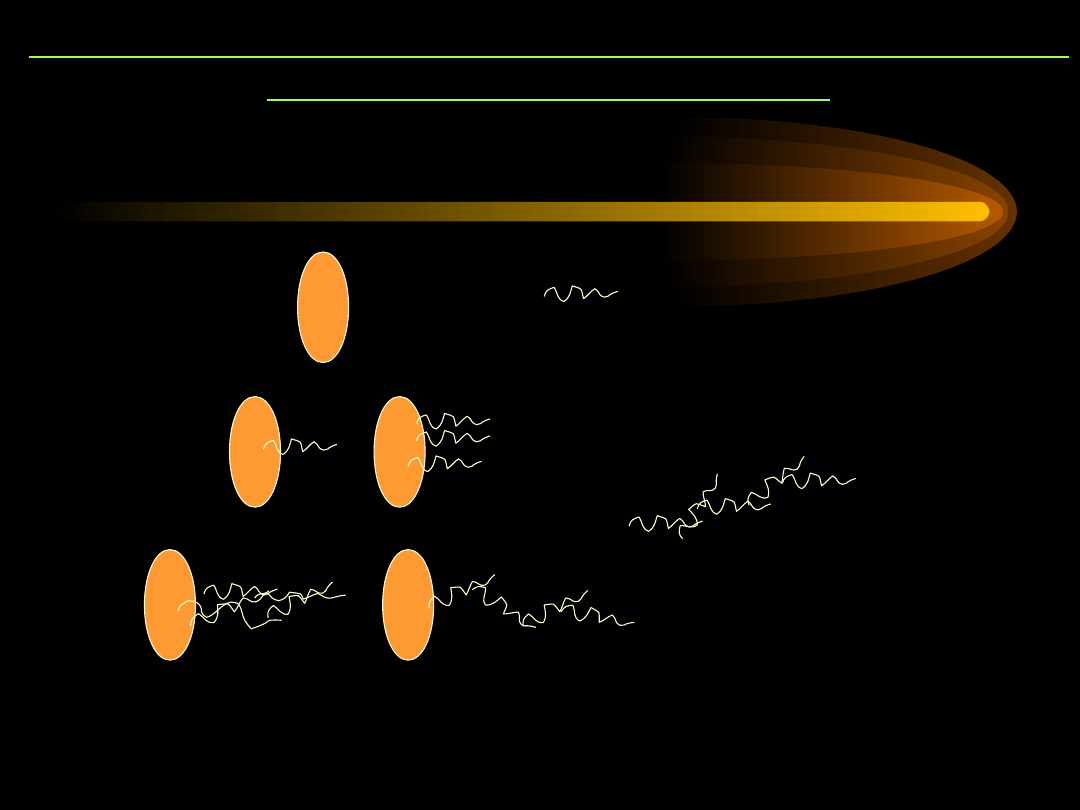
Wiązanie substratu białkowego przeznaczonego do
proteolizy przez ubikwitynę
Białko
(substrat)
ubikwityna
A
monoubikwityn
acja
B
poliubikwitynacja

•
Różne białka degradowane są z różną prędkością.
Okres półtrwania białek waha się od kilku minut do
kilku dni a nawet tygodni.
•
Szybkość rozkładu białek zależy od stanu
fizjologicznego narządu, np.w mięśniu macicy będącej
w stanie „spoczynku” proteoliza jest powolna, a w
okresie poporodowej inwolucji bardzo szybka.
•
Degradacja białek mięśni szkieletowych zwiększa się
podczas głodu

LOSY GRUPY AMINOWEJ
Wolne aminokwasy, pochodzące z białek pożywienia lub z
degradacji białek endogennych są metabolizowane w
identyczny sposób i rozkładane w wątrobie.
Ich -aminowy azot jest usuwany przez
:
•
transaminację
– przekazanie grupy aminowej na
akceptor (ketokwas)
•
deaminację oksydacyjną
– odłączenie grupy aminowej
w postaci amoniaku
- Azot aminokwasowy zostaje przekształcony w
mocznik.
-
Szkielet węglowy ulega przemianie w:
•
ciała ketonowe (z aminokwasów ketogennych)
•
glukozę (z aminokwasów glukogennych)

Transaminacja
–
grupa -aminowa zostaje przeniesiona na
jeden z trzech -ketokwasów
:
•
szczawiooctan
•
pirogronian
-ketoglutaran
Reakcje katalizują
aminotransferazy
: alaninowa,
asparaginianowa, glutaminianowa
Dawcami grup aminowych są prawie wszystkie aminokwasy
oprócz tych, które nie posiadają grupy aminowej.
Aminokwas pozbawiony grupy aminowej staje się ketokwasem.
Ketokwas, który przyjął grupę aminową, staje się
aminokwasem.
W każdej reakcji transaminacji powstaje nowy aminokwas i nowy
ketokwas
. Znaczenie transaminacji:
powstające produkty ułatwiają przemianę azotu.
LOSY GRUPY AMINOWEJ

Deaminacja
– odłączenie grupy aminowej od
aminokwasu w postaci amoniaku (NH
3
)
Deaminacja oksydacyjna
– odłączenie grupy
aminowej i utlenienie węgla do grupy ketonowej.
C
C
C
H-C-H H-
C-H
H-C-H
H-C-H H-
C-H
H-C-H
H-C-NH
3
C=NH
C=O
C
C
C
LOSY GRUPY AMINOWEJ
-
-
-
-
—
—
—
—
—
—
O
-
O
-
O
O
glutaminian
-
-
-
-
dehydrogenaza
glutaminianowa
glutiminian
—
—
—
—
—
—
O
O
O
-
O
-
H
2
O
H
2
O
-
-
-
-
O
-
O
-
—
—
O
O
—
—
—
—
+NH
3
-ketoglutaran
(NADP
+
)
NAD
+
(NADPH
+
+H
+
)
NADH+H
+
Znaczenie: oddzielenie azotu od glutaminianu i wbudowanie go do mocznika.

Amoniak powstaje w procesach
:
•
deaminacji aminokwasów
•
deaminacji zasad purynowych i pirymidynowych
Nawet znikome ilości amoniaku są
toksyczne dla ośrodkowego układu
nerwowego.
W warunkach prawidłowych wątroba szybko usuwa
amoniak z krwi żyły wrotnej. Przy upośledzonej
funkcji wątroby, stężenie amoniaku we krwi
obwodowej jest tak wysokie, że dochodzi do
zatrucia: drgawki, bełkotliwa mowa, upośledzenie
ostrości widzenia, śpiączka i zgon.
LOSY GRUPY AMINOWEJ

DETOKSYKACJA AMONIAKU
Amoniak musi podlegać detoksykacji
na drodze różnych procesów:
•
człowiek i większość kręgowców lądowych
przekształca amoniak i wydala go w postaci
mocznika
•
ptaki i gady lądowe w postaci kwasu
moczowego
•
wiele zwierząt wodnych wydala amoniak
bezpośrednio do środowiska

DETOKSYKACJA AMONIAKU
Jedną z dróg detoksykacji amoniaku jest
synteza glutaminy
:
część amoniaku jest wiązana przez grupę karboksylową kwasu
glutaminowego z wytworzeniem glutaminy. Reakcja
prowadzona
jest przez występującą w nerkach
syntetazę glutaminy
, przy
udziale ATP. Glutamina dostarcza grup aminowych do syntezy
puryn i
pirymidyn.
C
C
CH
2
CH
2
CH
2
CH
2
H-C-NH
3+
H-C-NH
3+
C
C
-
-
-
-
——
—
—
——
O
-
O
O
O
-
+NH
3
ATP
ADP+Pi
syntetaza
glutaminy
—
—— —
——
O
-
O
O
NH
2
-
-
-
-
glutaminian
glutamina

Głównym mechanizmem usuwania amoniaku jest:
• tworzenie glutaminy – w mózgu
• tworzenie mocznika – w wątrobie
Głównym szlakiem wydalania azotu u ludzi jest
mocznik
syntetyzowany w wątrobie, uwalniany
do krwi i wydalany przez nerki.
Mocznik stanowi 80-90% uwalnianego azotu.
Proces przekształcania toksycznego amoniaku w
nietoksyczny mocznik nosi nazwę cyklu
mocznikowego
(lub ornitynowego lub małego
cyklu Krebsa)
DETOKSYKACJA AMONIAKU

CYKL MOCZNIKOWY
•
Mocznik tworzy się z NH
3
, CO
2
i asparaginianu
w
mitochondriach i cytosolu wątroby.
•
Proces wymaga 3 moli ATP i udziału 5 enzymów
•
W syntezie uczestniczy 6 aminokwasów:
-
asparaginian, arginina, ornityna, cytrulina i argininobursztynian
są nośnikami atomów, z których ostatecznie powstaje mocznik
-
jeden aminokwas działa jako aktywator enzymu
Arginina i asparaginian to aminokwasy białkowe, pozostałe trzy w
białkach nie występują.
Tworzenie mocznika jest procesem cyklicznym.
Ornityna jest regenerowana, nie ma zysków i start aminokwasów.
Zużywa się jon amonowy, CO
2
, ATP i asparaginian.
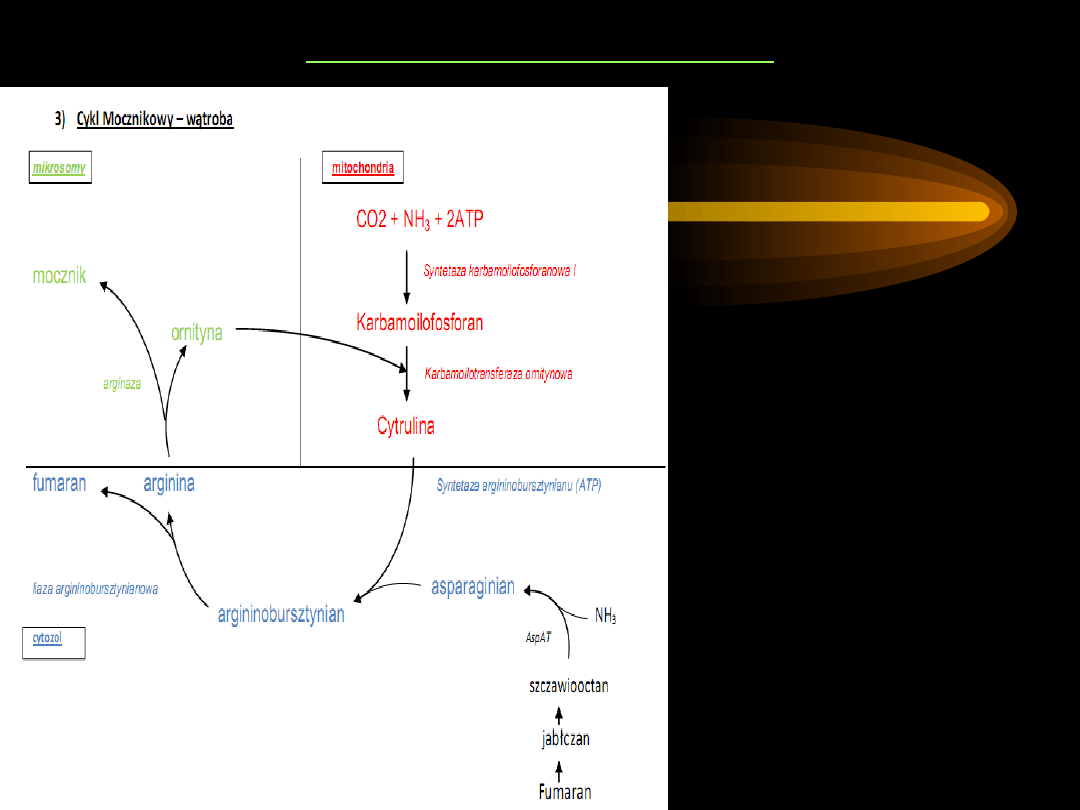
CYKL MOCZNIKOWY
1. Cykl mocznikowy
rozpoczyna się od syntezy
karbamoilofosforanu
z
CO
2
i
NH
3
. Reakcja
katalizowana jest przez
enzym:
syntetazę
karbomoilofosforanową
, a
niezbędnym kofaktorem do
tej reakcji jest N-
acetyloglutaminian.
W reakcji tej zużywane są
dwie cząsteczki ATP.
Karbamoilofosforan jest
związkiem bogatym w
energię.
2. Pod wpływem
karbamoilotransferazy L-
ornitynowej
grupa
karbamoilowa jest
przenoszona na ornitynę z
wytworzeniem
cytruliny
.
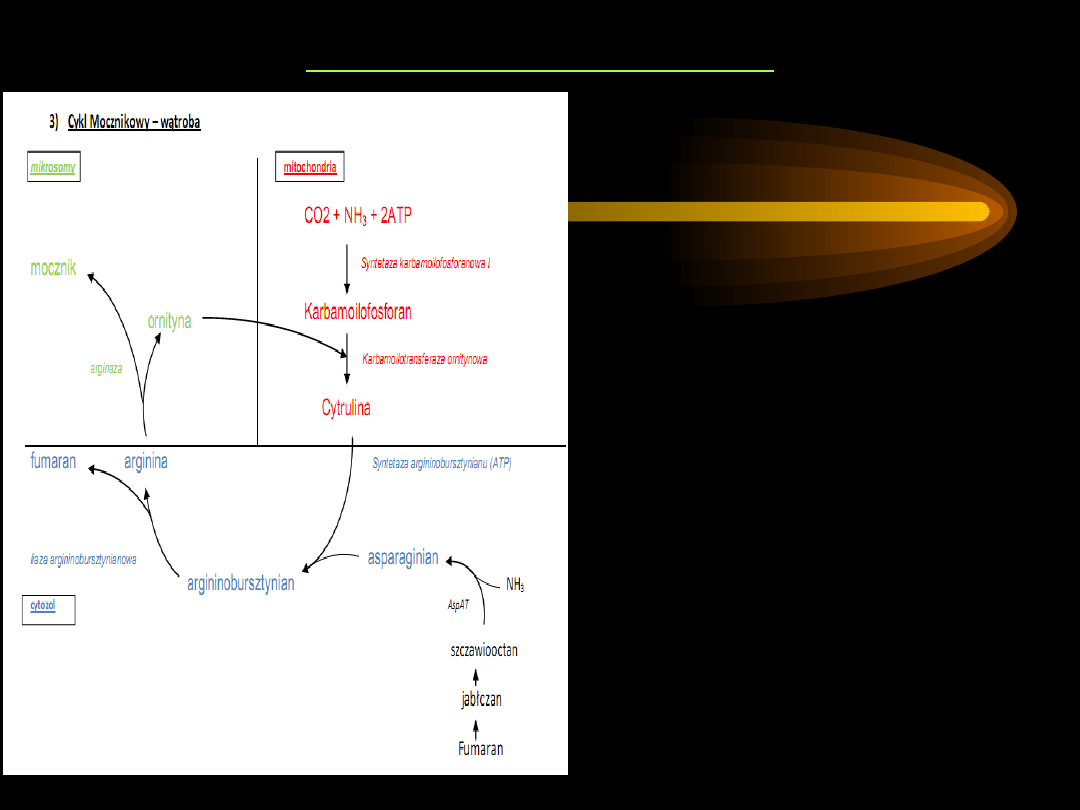
CYKL MOCZNIKOWY
3.
3.
Cytrulina
przenika do cytozolu.
Następnie pod wpływem
syntetazy
arginiobursztynianowej
asparaginian i cytrulina tworzą
arginiobursztynian
.
W reakcji tej zużywana jest
cząsteczka ATP.
4. Rozszczepienie
arginiobursztynianu do
argininy
i
fumaranu
. Katalizuje tę reakcję
liaza argininonbursztynianowa.
5. Hydrolityczne rozszczepienie
grupy guanidynowej argininy
przez
arginazę
na
mocznik
i
ornitynę
.
Uwolniona ornityna wchodzi w
reakcję z kolejną cząsteczką
karbamoilofsforanu.

•
Bilans cyklu mocznikowego:
2 NH
3
+ CO
2
+ asparaginian + 3ATP mocznik + fumaran +
2ADP + 2Pi + AMP + Ppi
Cząsteczka mocznika posiada dwa atomy azotu – jeden
pochodzi z amoniaku, drugi z asparaginianu.
Regulacja cyklu mocznikowego zachodzi na drodze:
-
aktywacji allosterycznej – aktywatorem allosterycznym
syntetazy karbamoilofosforanowej I jest N-
acetyloglutaminian
-
indukcji substratowej – pobudzanie biosyntezy enzymów
przez wzrost stężenia substratów
-
odtwarzania ornityny.
CYKL MOCZNIKOWY

•
Ponieważ
cykl mocznikowy przekształca toksyczny amoniak w
nietoksyczny mocznik
, wszelkie zaburzenia syntezy mocznika
powodują zatrucie amoniakiem, w wyniku jego akumulacji w
tkankach i płynach ustrojowych.
•
Stężenie mocznika w surowicy krwi jest ważnym parametrem
biochemicznym w diagnostyce chorób nerek (>300-400mg/dl
upośledzona funkcja nerek).
- Znanych jest 5 hiperamonemii - objawy są podobne, wymioty w
wieku niemowlęcym, nerwowość, opóźniony rozwój umysłowy;
-
hiperamonemia typu I - niedobór syntetazy karbamoilofosforanowej
-
cytrulinemia – znaczne ilości cytruliny w moczu
-
acyduria argininobursztynianowa – łamliwe rosnące kępami włosy,
zgon w dzieciństwie
CYKL MOCZNIKOWY

AMINOKWASY ŹRÓDŁEM ZWIĄZKÓW
BIOLOGICZNIE CZYNNYCH
Aminokwasy
są
prekursorami
wielu
związków
biologicznie czynnych, takich jak:
•
aktywne fragmenty jednowęglowe,
•
barwniki porfirynowe (hem),
•
zasady purynowe i pirymidynowe,
•
hormony i neuroprzekaźniki,
•
karnityna,
•
kreatyna,
•
melaniny,
•
aminy i poliaminy.

AMINY BIOGENNE
W wyniku
dekarboksylacji niektórych aminokwasów
powstają związki biologicznie czynne, które noszą nazwę
amin biogennych
.
Aminy biogenne dzielimy na:
• alifatyczne (monoaminy i poliaminy)
• katecholowe (fenolowe: noradrenalina, adrenalina i
dopamina)
• heterocykliczne (imidazolowe: histamina oraz indolowe:
serotonina)

•
Serotonina:
- powstaje w wyniku hydroksylacji tryptofanu i jego
dekarboksylacji
- jest przekaźnikiem w centralnym układzie
nerwowym
- kurczy mięśnie gładkie naczyń tętniczych i
drobnych oskrzeli, zwęża naczynia krwionośne
- obficie gromadzi się w płytkach krwi
- w rakowiaku (srebrzak- guz chromochłonny
jelita) -zwiększone wytwarzanie serotoniny:
zamiast 1%, 60% tryptofanu zamienia się w
serotoninę
AMINY BIOGENNE

•
Histamina:
- hormon tkankowy
- pobudza sekrecję HCl przez nabłonek śluzówki
żołądka
- rozszerza naczynia włosowate i zwiększa ich
przepuszczalność, wpływa na ciśnienie krwi
- jest produktem dekarboksylacji histydyny
- uwalnia się w dużych ilościach w tkankach objętych
urazem lub stanem zapalnym
- odgrywa główną rolę w reakcjach alergicznych
- uwolnienie histaminy doprowadza do wstrząsu
anafilaktycznego, astmy, pokrzywki, kataru
siennego
AMINY BIOGENNE

•
GABA – kwas -aminomasłowy:
- główny neuroprzekaźnik hamujący w układzie
nerwowym
- odpowiada za zmniejszenie pobudliwości i
zwiotczenie mięśni
- zablokowanie jego działania spowoduje
zespół niespokojnych nóg, a znaczny brak
doprowadzi do konwulsji, a nawet śmierci
AMINY BIOGENNE

•
Adrenalina i noradrenalina
-
powstają w gruczołach
dokrewnych, ich prekursorem jest tyrozyna.
•
Adrenalina:
-
pełni rolę w mechanizmie powstania stresu, w błyskawicznej reakcji
człowieka na zagrożenie (przyspieszone bicie serca, wzrost ciśnienia
krwi, rozszerzenie oskrzeli i źrenic, co ułatwia przyspieszone
oddychanie)
- hamuje perystaltykę jelit, wydzielanie soków trawiennych i śliny
- reguluje poziom glukozy we krwi przez nasilenie rozpadu glikogenu w
wątrobie do glukozy
- wyrzut adrenaliny do krwi jest mechanizmem uruchamianym w
hipogligemii
- podana dożylnie działa szybko i krótko – reanimacja!! Ma wtedy
pobudzić kurczliwość mięśnia sercowego, poprawić skuteczność
defibrylacji elektrycznej
- stosowana we wstrząsie anafilaktycznym i napadach astmy
AMINY BIOGENNE

•
Noradrenalina:
-
silny wzrost ciśnienia tętniczego
- działa podobnie do adrenaliny, ale po zastosowaniu dużych
dawek
- stosowana w stanach nadciśnienia tętniczego
•
Tyramina:
-
występuje w pokarmach pochodzenia roślinnego i zwierzęcego,
serach twardych, czekoladzie, mięsie czerwonym, śledziach
- osoby uczulone na tyraminę po spożyciu pokarmów mogą
cierpieć na migreny – ból wywołany jest gwałtownym skokiem
ciśnienia tętniczego
- kumuluje się u osób z defektem enzymu rozkładającego
tyraminę, może wystąpić kołatanie serca, zapaść i śmierć
AMINY BIOGENNE
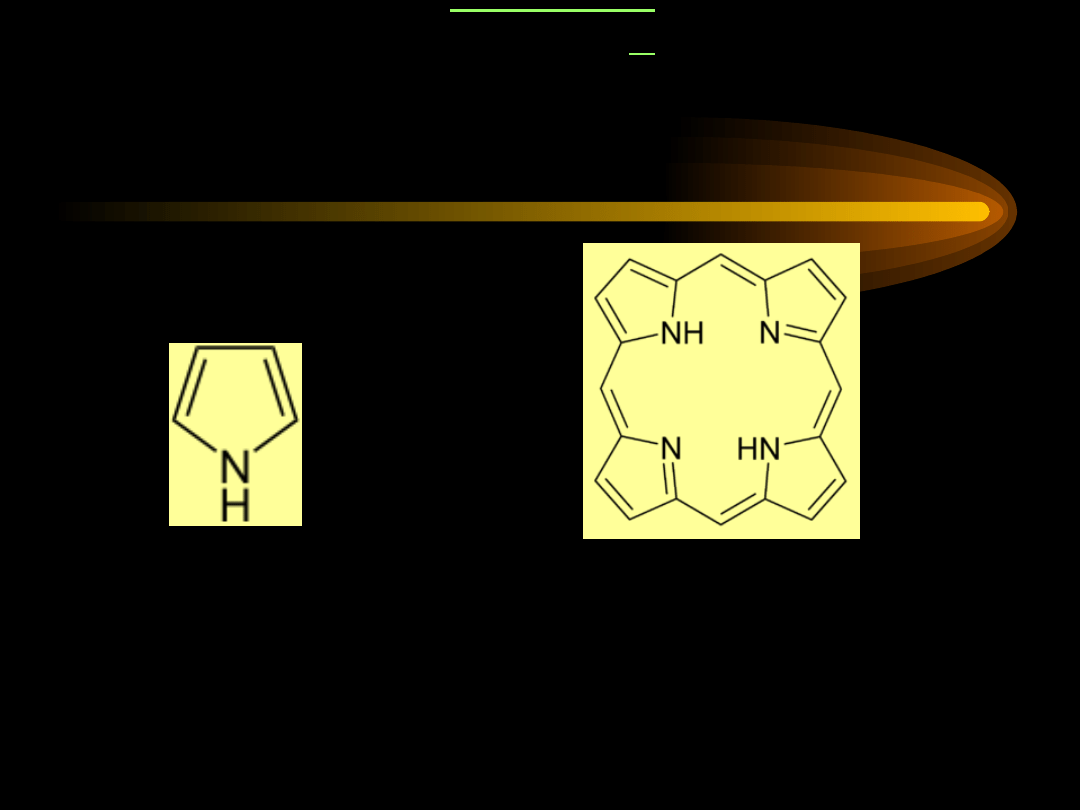
PORFIRYN
Y
•
Porfiryny to związki heterocykliczne, zawierające
cztery pierścienie pirolowe: A, B, C i D.
•
Pentagonalny pierścień pirolowy posiada cztery
atomy węgla oraz atom azotu
•
Porfiryny występują w całym świecie żywym
•
Biologicznie czynne porfiryny zawierają jon metalu
związany przez azot: Mg, Fe, Zn, Ni, Co, Cu, Sr.
pierścień
pirolowy
układ porfirynowy

HEM
•
W organizmach zwierzęcych najobficiej występującą
porfiryną jest
hem
•
Stanowi on grupę prostetyczną białek zwanych
hemoproteinami
•
Do hemoprotein należą:
-
białka transportowe: hemoglobina, mioglobina
-
białka enzymatyczne: cytochromy, katalaza,
peroksydaza
-
cytochrom (roślinny barwnik porfirynowy)
•
Hemoproteiny biorą udział w transporcie tlenu,
transporcie elektronów, metabolizmie leków
•
Hem
jest barwnikiem pirolowym, zawierającym jon
Fe
2+
lub Fe
3+
związany kowalencyjnie z dwoma
atomami azotu w pierścieniach pirolowych
•
Hem nadaje białku i krwi czerwony kolor
•
Głównym miejscem biosyntezy hemu są
wewnątrzszpikowe, prekursorowe krwinki czerwone
syntetyzujące hemoglobinę oraz wątroba,
syntetyzująca enzymy zawierające hem
•
Początkowa reakcja i trzy ostatnie etapy biosyntezy
hemu zachodzą w mitochondriach, a etapy
pośrednie w cytozolu.
HEM
•
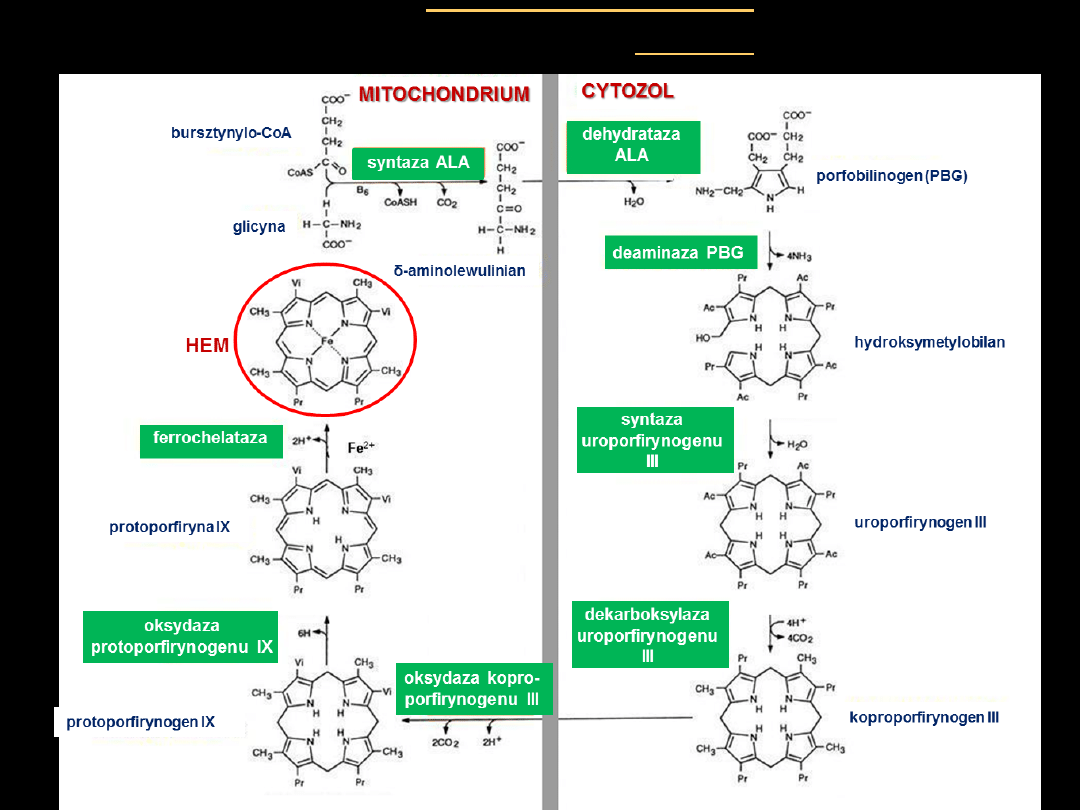
Wszystkie atomy węgla i azotu zawarte w porfirynach pochodzą z
glicyny i bursztynylo~S-CoA
•
Kondensacja
4 cząsteczek porfobilinogenu
prowadzi do powstania
uroporfirynogenu III
.
•
Kolejne reakcje prowadzą do przekształcenia
uroporfirynogenu III
w
protoporfirynę IX
.
•
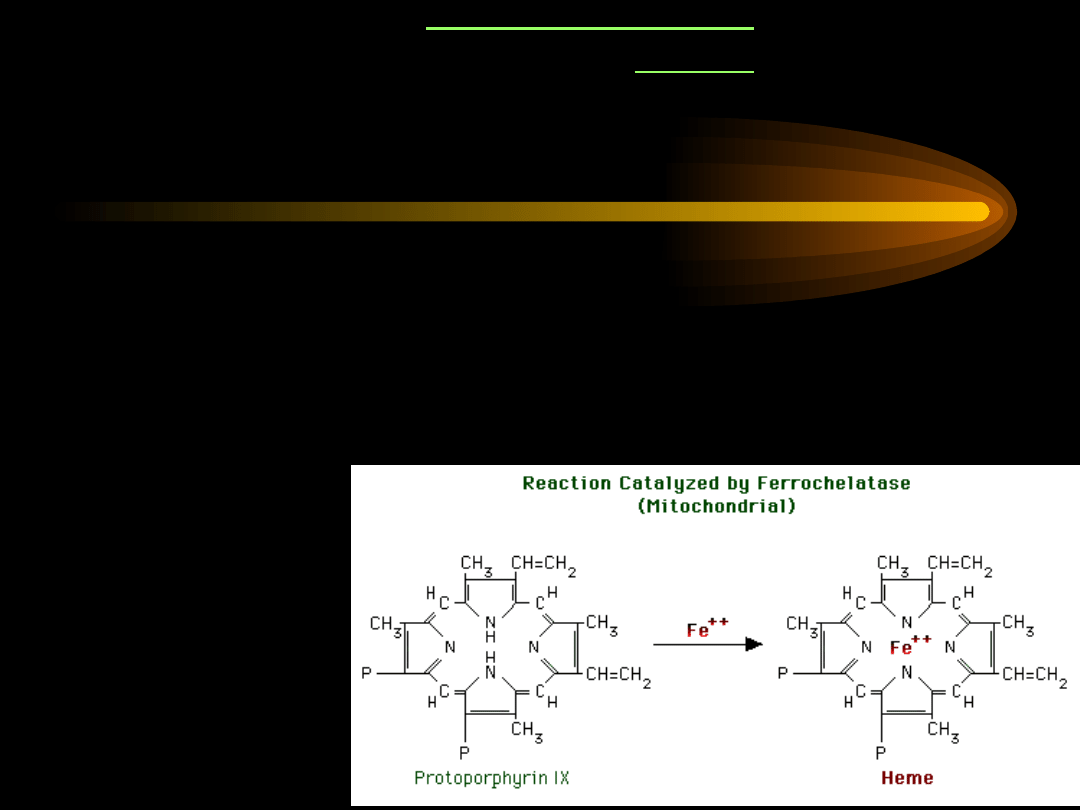
Ostatni etap biosyntezy hemu to wprowadzenie do
protoporfiryny
IX
jonu Fe
2+
przez
ferrochelatazę
.
ZARYS SYNTEZY
HEMU
ZARYS SYNTEZY
HEMU

PORFIRIE
•
Porfirie – spowodowane przez zaburzenia w biosyntezie
porfiryn
•
Wynikają z wrodzonych, czasem z nabytych defektów
działania enzymów biosyntezy hemu
•
Dochodzi do akumulacji i zwiększonego wydalania
metabolitów pośrednich
•
Wyróżnia się dwa główne typy porfirii:
- porfiria erytropoetyczna – defekt metabolizmu porfiryn w
komórkach erytroidalnych
- porfiria wątrobowa – defekt metabolizmu porfiryn w
wątrobie
•
Skutkiem porfirii jest niedobór hemu.
•
Porfirie to zaburzenia na tle neuropsychicznym,
nadwrażliwość skóry na światło (aktywność nocna, wilkołaki).

•
Krwinka czerwona żyje około 120 dni, po czym
rozpada się w układzie siateczkowo-śródbłonkowym
wątroby, śledziony i szpiku kostnego.
•
Z
hemoglobiny
pochodzi około
85% hemu
przeznaczonego do degradacji.
•
Część białkowa hemoglobiny może być ponownie
wykorzystana jako taka lub w formie składowych
aminokwasów.
•
Część porfirynowa hemu pozbawiona żelaza jest
degradowana.
KATABOLIZM
HEMU

•
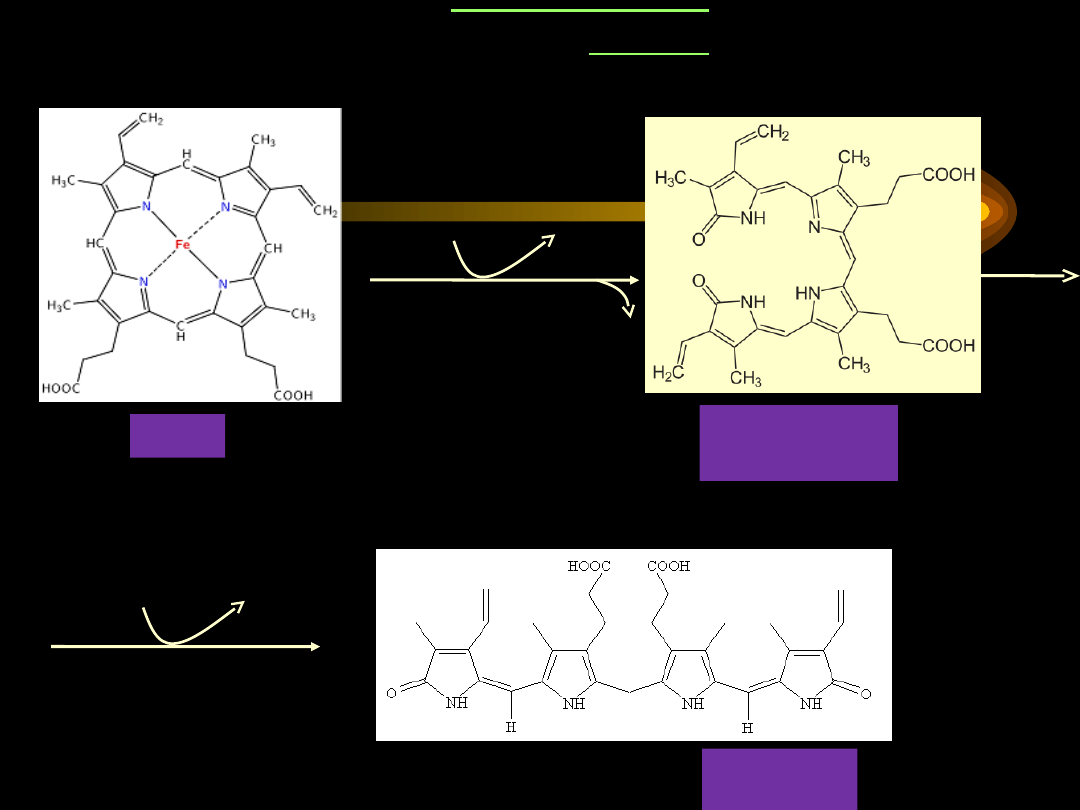
Katabolizm hemu
zachodzi dzięki obecności złożonego układu
enzymatycznego –
oksygenazy hemowej
. Enzym ten
doprowadza do uwolnienia
Fe
3+
, CO
oraz zielonego barwnika –
biliwerdyny
.
•
Biliwerdyna drogą redukcji przekształca się w czerwono-
pomarańczową
bilirubinę
. Bilirubina i jej pochodne to barwniki
żołciowe.
•
Bilirubina jest słabo rozpuszczalna w wodzie, musi być
transportowana do wątroby w postaci związanej z albuminą.
•
Metabolizm bilirubiny zachodzi w wątrobie i polega na
sprzęganiu
z:
- kwasem glukuronowym
- tauryną
- glicyną
- kwasem siarkowym
Sprzęganie zwiększa rozpuszczalność bilirubiny.
KATABOLIZM
HEMU
KATABOLIZM
HEMU
hem
biliwerdyn
a
bilirubin
a
2 O
2
+
NADP
H
CO +
H
2
O
+
NADP
+
oksygenaza
hemowa
reduktaza
biliwerdyny
NADPH + H
+
NADP
+
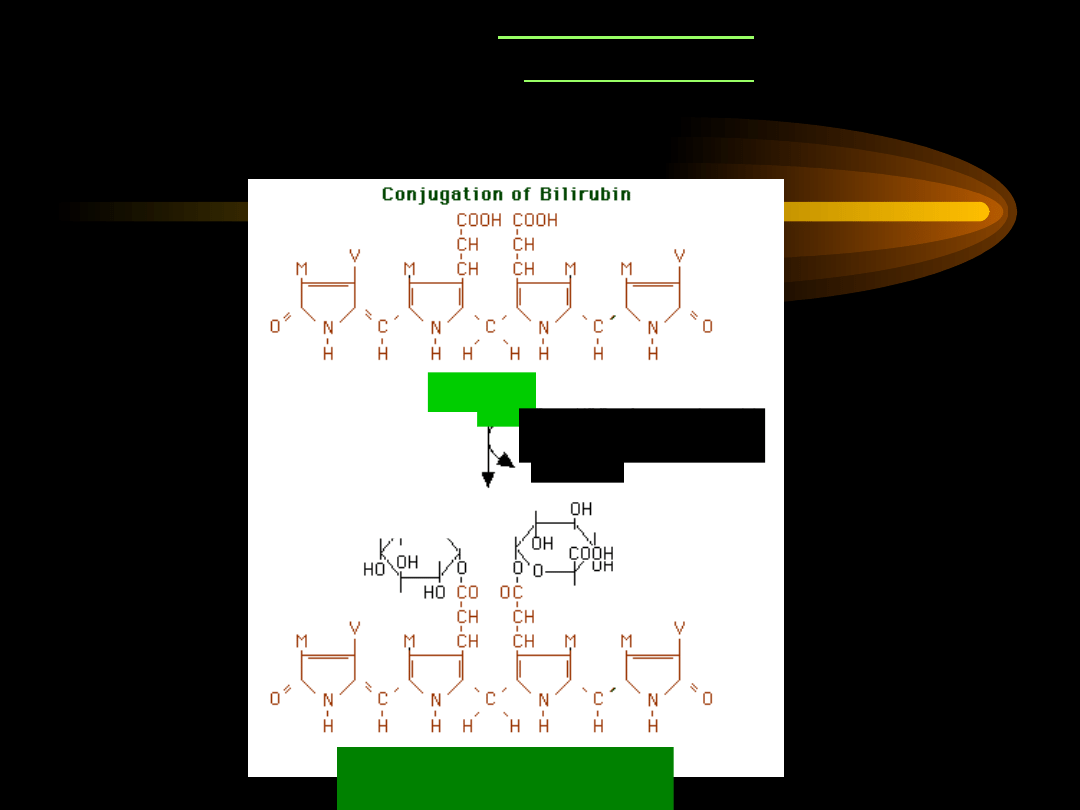
SPRZĘGANIE
BILIRUBINY
diglukuronid bilirubiny
(dobrze rozpuszczalny w
wodzie)
bilirubin
a
2 kwas UDP-
glukuronowy
2 UDP
transferaza
UDP-
glukuronianowa
(
2 oddzielne
etapy)

PRZEKSZTAŁCANIE BILIRUBINY W JELICIE
•
Diglukuronid bilirubiny
jest hydrolizowany w jelicie przez
β-glukuronidazę
i
redukowany
przez
bakterie
do
bezbarwnego urobilinogenu.
•
Część urobilinogenu przenika z jelita do krwi i jest wydalana
przez nerki, przekształcając się w
żółtą urobilinę
(barwnik
moczu).
•
Większość urobilinogenu jest utleniana przez bakterie
jelitowe do
brązowej sterkobiliny
(barwnik kału).
•
Bilirubina jest usuwana z organizmu drogą jelitową.
•
Nadmierny rozpad bilirubuny i zaburzenia jej usuwania
prowadzą do żółtaczki.

ŻÓŁTACZK
A
Żółtaczka
to wzrost stężenia bilirubiny w osoczu, prowadzący do jej
odkładania się w tkankach.
•
Objawami są żółcenie się białkówek oczu oraz skóry.
•
Wyróżniamy kilka typów żółtaczek:
-
Żółtaczka hemolityczna
– wynikająca ze wzmożonego rozpadu krwinek
czerwonych;
-
Żółtaczka zastoinowa
(obstrukcyjna) – jest następstwem zamknięcia odpływu
żółci z wątroby na skutek przeszkody mechanicznej (kamień w drogach
żółciowych, guz nowotworowy);
-
Żółtaczka miąższowa
– jest skutkiem uszkodzenia komórek wątrobowych
przez czynnik zakaźny toksyczny;
-
Żółtaczka noworodków
(objaw fizjologiczny) – wynikająca ze wzmożonego
rozpadu krwinek, będących nośnikami hemoglobiny płodowej oraz niskiej
aktywności transferazy UDP-glukuronianowej.

HEMOGLOBINA
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
- Slide 40
- Slide 41
- Slide 42
- Slide 43
- Slide 44
- Slide 45
- Slide 46
- Slide 47
- Slide 48
- Slide 49
- Slide 50
- Slide 51
- Slide 52
- Slide 53
- Slide 54
- Slide 55
- Slide 56
- Slide 57
- Slide 58
- Slide 59
- Slide 60
- Slide 61
- Slide 62
- Slide 63
- Slide 64
- Slide 65
- Slide 66
- Slide 67
- Slide 68
- Slide 69
Wyszukiwarka
Podobne podstrony:
V przemiana azotowa
produkty przemiany azotowej mocznik, kreatyna, kwas moczowy
Kolokwium VI. Przemiana azotowa 2013, Biochemia
PRZEMIANY ZWĄZKÓW AZOTOWYCH, Biochemia
8 Przemiany związków azotowych w czasie przechowywania obornika
Udział mikroorganizmów w przemianach związków azotowych w środowisku
Zagrozenia zwiazane z przemieszczaniem sie ludzi
RM 16
11b Azotowanie i nawęglanie (PPTminimizer)id 13076 ppt
3 Przemiany fazowe w stopach żelazaPrzemiana martenzytycznaSem2010
RM 4 praktyczne
przemiennik 1
Przemienienie Jezusa
Przemiany aminokwasów w biologicznie ważne, wyspecjalizowane produkty
więcej podobnych podstron