
1
18
1s
1
H
Wodór
2
13 14
15
16 17
2
He
Hel
2s
3
Li
Lit
4
Be
Beryl
2p
5
B
Bor
6
C
Węgiel
7
N
Azot
8
O
Tlen
9
F
Fluor
10
Ne
Neon
3s
11
Na
Sód
12
Mg
Magnez
3
4
5
6
7
8
9
10
11
12
3p
13
Al
Glin
14
Si
Krzem
15
P
Fosfor
16
S
Siarka
17
Cl
Chlor
18
Ar
Argon
4s
19
K
Potas
20
Ca
Wapń
3d
21
Sc
Skand
22
Ti
Tytan
23
V
Wanad
24
Cr
Chrom
25
Mn
Mangan
26
Fe
Żelazo
27
Co
Kobalt
28
Ni
Nikiel
29
Cu
Miedź
30
Zn
Cynk
4p
31
Ga
Gal
32
Ge
German
33
As
Arsen
34
Se
Selen
35
Br
Brom
36
Kr
Krypton
5s
37
Rb
Rubid
38
Sr
Stront
4d
39
Y
Itr
40
Zr
Cyrkon
41
Nb
Niob
42
Mo
Molibden
43
Tc
Technet
44
Ru
Ruten
45
Rh
Rod
46
Pd
Pallad
47
Ag
Srebro
48
Cd
Kadm
5p
49
In
Ind
50
Sn
Cyna
51
Sb
Antymon
52
Te
Tellur
53
I
Jod
54
Xe
Ksenon
6s
55
Cs
Cez
56
Ba
Bar
5d
*
72
Hf
Hafn
73
Ta
Tantal
74
W
Wolfram
75
Re
Ren
76
Os
Osm
77
Ir
Iryd
78
Pt
Platyna
79
Au
Złoto
80
Hg
Rtęć
6p
81
Tl
Tal
82
Pb
Ołów
83
Bi
Bizmut
84
Po
Polon
85
At
Astat
86
Rn
Radon
7s
87
Fr
Frans
88
Ra
Rad
6d
**
104
Rf
Rutherford
105
Db
Dubn
106
Sg
Seaborg
107
Bh
Bohr
108
Hs
Has
109
Mt
Meitner
110
Uun
111
Uuu
112
Uub
*
Lantanowce
4f
57
La
Lantan
58
Ce
Cer
59
Pr
Prazeodym
60
Nd
Neodym
61
Pm
Promet
62
Sm
Samar
63
Eu
Europ
64
Gd
Gadolin
65
Tb
Terb
66
Dy
Dyspoz
67
Ho
Holm
68
Er
Erb
69
Tm
Tul
70
Yb
Iterb
71
Lu
Lutet
**
Aktynowce
5f
89
Ac
Aktyn
90
Th
Tor
91
Pa
Protaktyn
92
U
Uran
93
Np
Neptun
94
Pu
Pluton
95
Am
Ameryk
96
Cm
Kiur
97
Bk
Bekerel
98
Cf
Kaliforn
99
Es
Einstein
100
Fm
Ferm
101
Md
Mendelew
102
No
Nobel
103
Lr
Lorens
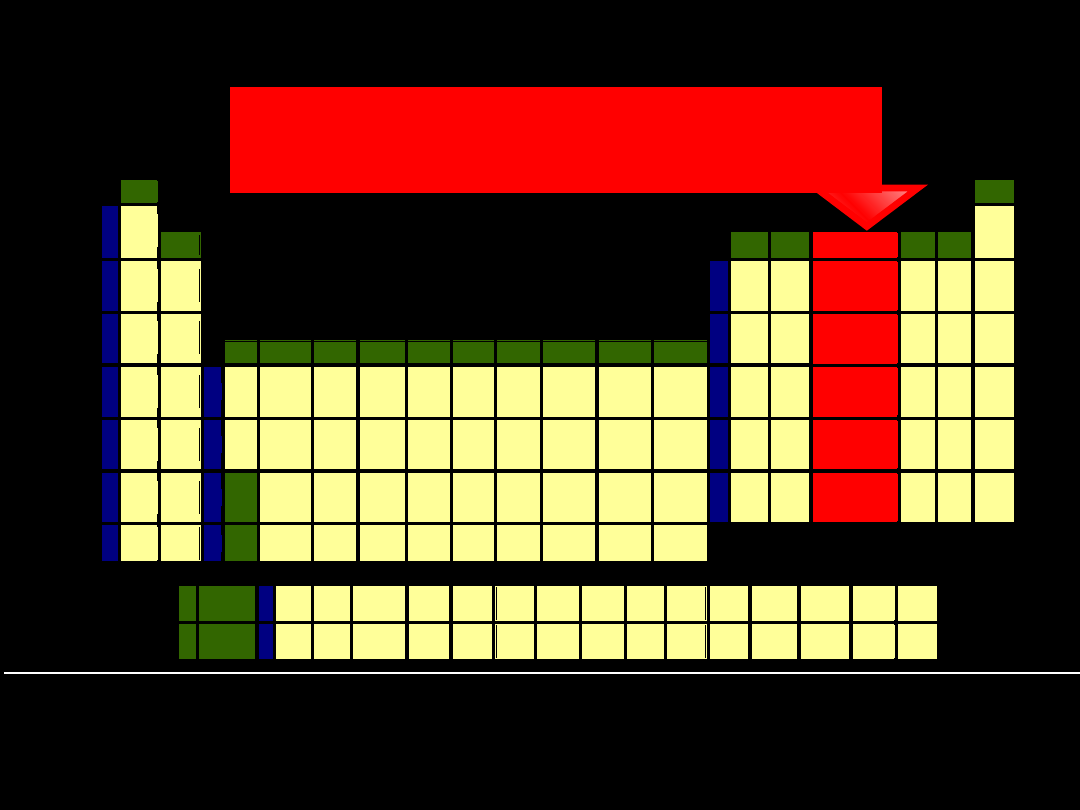
15 grupa układu okresowego -
azotowce

Pierwiastek
LIT
SÓD
POTA
S
RUBID CEZ
FRAN
S
Li
Na
K
Rb
Cs
Fr
Konfiguracja
elektronów
walencyjnych
2s
1
3s
1
4s
1
5s
1
6s
1
7s
1
Liczba atomowa
Masa atomowa
Promień
atomowy
[pm]
Elektroujemność
(Pauling)

Azot (N)
Fosfor (P)
Arsen (As)
Antymon
(Sb)
Bizmut
(Bi)
Azot (N)
Fosfor (P)
Arsen (As)
Antymon
(Sb)
Bizmut
(Bi)
N
P
As
Sb
Bi

Pierwiastek
Azot
N
Fosf
or
P
Arse
n
As
Antymo
n
Sb
Bizmu
t
Bi
niemetale
charakter
pośredni
metal
Konfiguracja
elektronowa
2s
2
p
3
3s
2
p
3
4s
2
p
3
5s
2
p
3
6s
2
p
3
Liczba
atomowa
Masa atomowa
Promień
atomowy
[pm]
Elektroujemno
ść
(Pauling)
Energia
jonizacji
[kJ·mol
-1
]
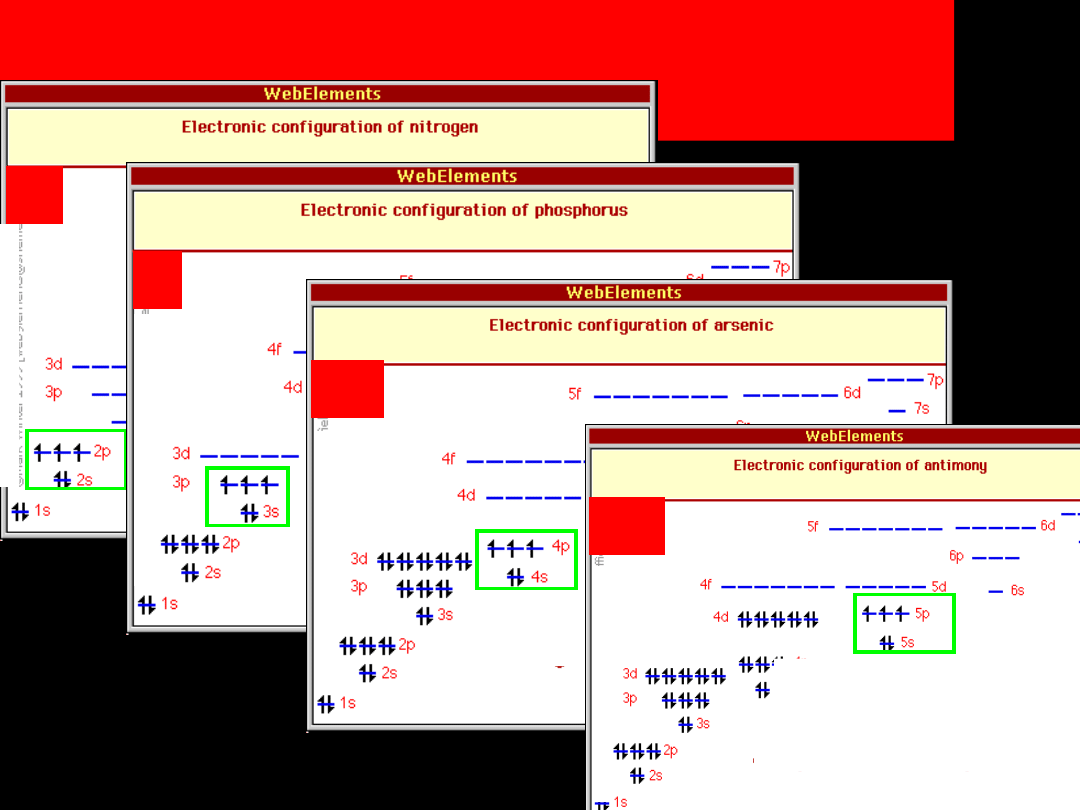
Konfiguracje elektronowe
azotowców
Sb
N
P
As

azot (N)
fosfor (P)
arsen (As)
antymon (Sb)
bizmut (Bi)
w szeregu tym w miarę wzrostu
liczby
atomowej
stwierdza
się
stopniowe:
zmniejszanie elektroujemności
zmniejszanie energii jonizacji
wzrost promienia atomowego
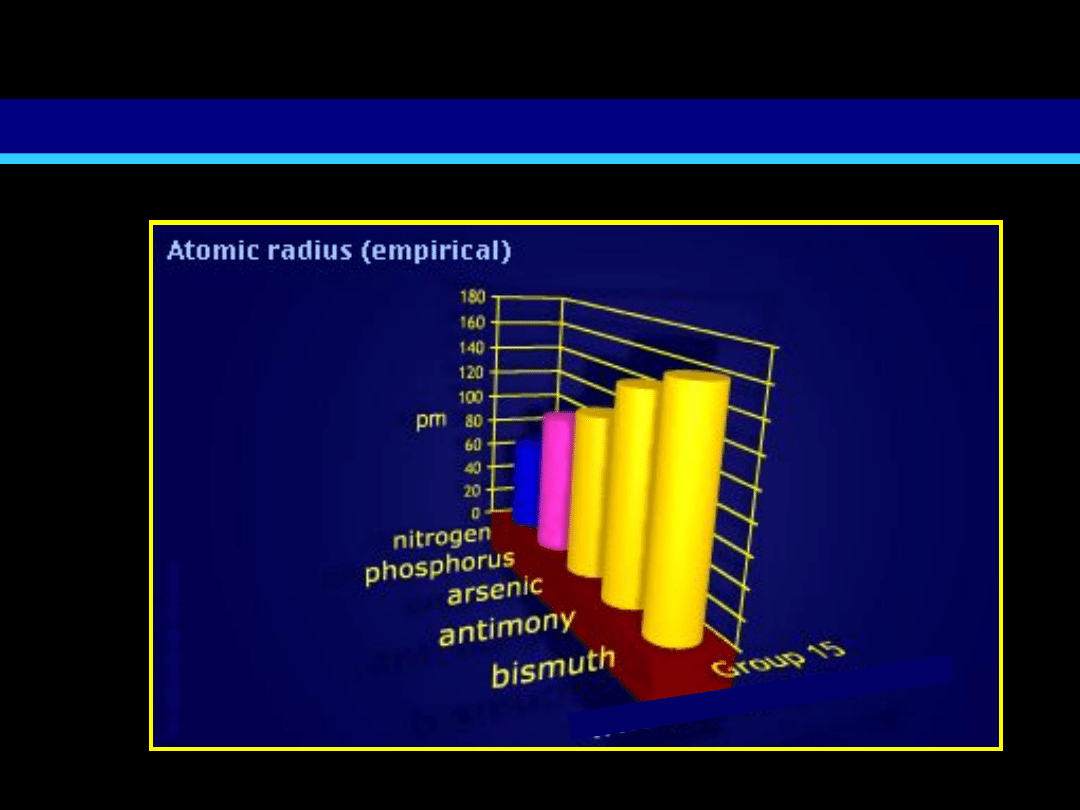
Zmiana promienia atomowego w obrębie grupy azotowców
Zmiana promienia atomowego w obrębie grupy azotowców
N
Bi
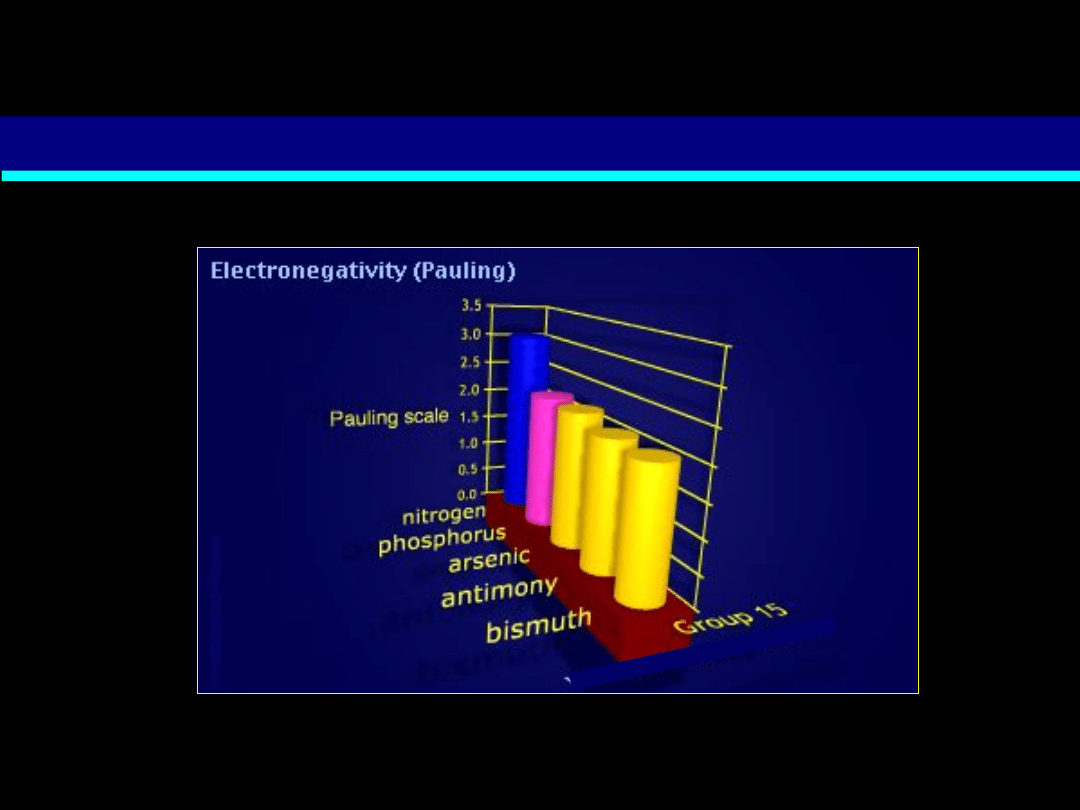
Zmiana elektroujemności w obrębie grupy azotowców
Zmiana elektroujemności w obrębie grupy azotowców
Zmiana elektroujemności w obrębie grupy azotowców
Zmiana elektroujemności w obrębie grupy azotowców
N
Bi
Bi

Pierwiastek
Azot
N
Fosfor
P
Arse
n
As
Antymo
n
Sb
Bizmut
Bi
Zawartość w
zewnętrznych
warstwach
Ziemi
2x10
-
3
%
1,1x10
-1
%
1,1x10
-
6
%
2x10
-5
%
8x10
-7
%
Zawartość w
atmosferze
Ziemi
75%
w.
78%
ob.
-
-
-
-
Zawartość w
organizmie
człowieka
3%
1%
-
-
-
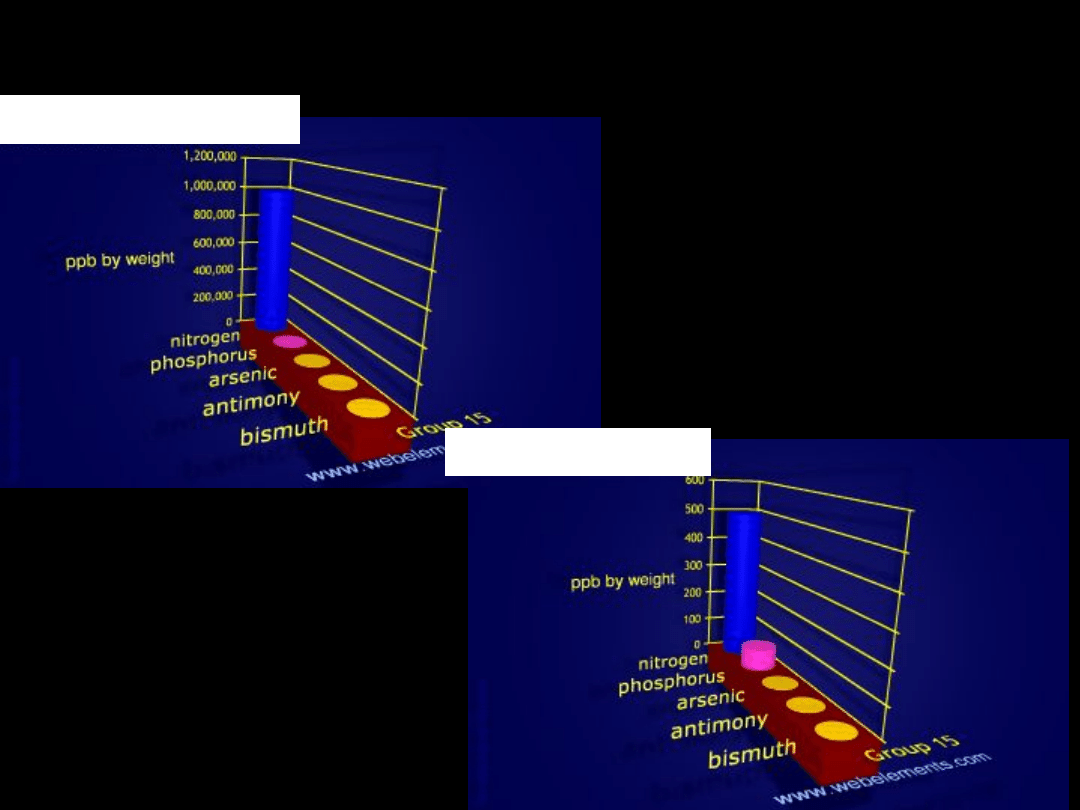
Występowanie azotowców
we wszechświecie
N
N
w morzach
N
N
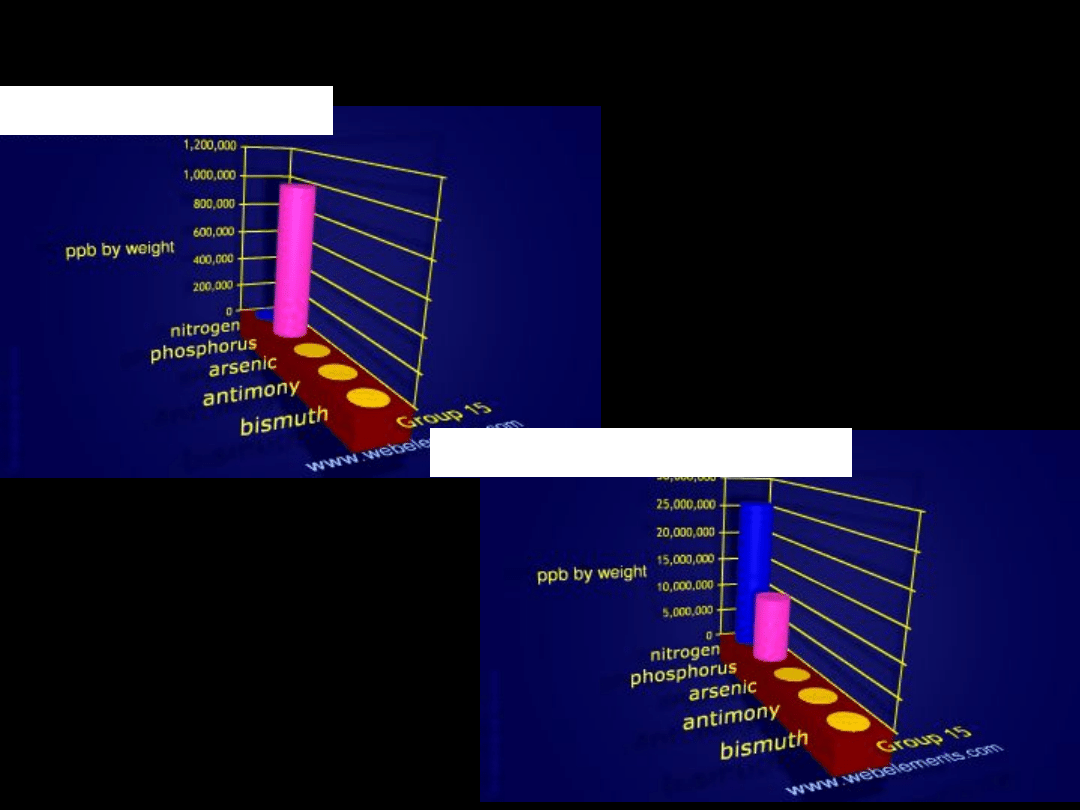
w skorupie ziemskiej
w organizmie człowieka
P
P
P
P
N
N
Występowanie azotowców

Azot
Fosfor
Arsen
Antymon Bizmut
Symbol
chemiczny
N
P
As
Sb
Bi
ALOTROPIA W STANIE STAŁYM
odmiana ,
trwała,
romboedrycz
na
P fioletowy
(
lub P
czerwony
)
As szary
metalicz
ny
Sb szary
metaliczny
Bi
metaliczn
y
odmiana
metastabilna,
regularna,
rozpuszczana
w CS
2
P biały,
barwa
żółtawa
As żółty
Sb żółty
odmiana ,
metastabilna,
bezpostaciow
a
P czarny,
bezpostacio
wy
Sb czarny
odmiany inne
N
2
heksagon
35K
N
2
regularny
Sb
wybuchowy
odmiana
alotropowa
zwana
„metaliczną”
brak
nietrwała
trwała
trwała
trwała i
jedyna
N
P
As
Sb
Bi
Trwałość stopnia
utlenienia +3
zwiększa się od N
3+
do Bi
3+
Charakter M
2
O
3
kwasowy
amfoteryczn
y
zasado
wy
Kwasowość
H
3
MO
3
(HMO
2
)
zmniejsza się od N do Bi
Własności
redukujące
stopnia
utlenienia +3
zmniejszają się od N do Bi
Trwałość stopnia
utlenienia +5
zmniejsza się od N do Bi
Kwasowość M
2
O
5
trwałość i moc kwasów, odpowiadających
M
2
O
5
zmniejsza się ze wzrostem liczby
atomowej
Sole
odpowiadające
M
2
O
5
i kwasom:
orto H
3
MO
4
piro H
4
M
2
O
7
meta HMO
3
sześciohydroksy
HM(OH)
6
meta orto
piro
meta
orto
piro
meta
orto
piro
meta
sześciohydro
ksy
meta
Kationy M
3+
——
——
——
Sb
3+
Bi
3+
Kationy MO
+
——
——
——
SbO
+
BiO
+

N
P
As
Sb
Bi
Trwałość
MH
3
trwałość
maleje
od
NH
3
do
BiH
3
Własności
redukujące
MH
3
wszystkie są reduktorami
moc redukcyjna
rośnie
od
NH
3
do
BiH
3
Działanie
chloru
bezpośred
nio nie
działa
zapala się i powstaje
MCl
3
MCl
3
kowalencyj
ny
(wybuchow
y)
kowalencyjny
częściowo jonowe
jonowy
Działanie
siarki
nie działa
działa powoli na
zimno; gwałtownie
na gorąco; daje:
P
4
S
3
, P
4
S
7
, P
4
S
10
na gorąco
daje
As
4
S
10
na gorąco
daje
Sb
2
S
3
na gorąco
daje
Bi
2
S
2
Działanie
metali
z
niektórymi
metalami
reaguje
bezpośredni
o
większość metali
daje fosforki
z litowcami i
berylowcami
szybka
reakcja
dająca
arsenki
z litowcami i
berylowcami
szybka reakcja
dająca
antymonki
tworzy
stopy
Działanie
kwasu
solnego
nie działa
w 200
0
C, pod
ciśnieniem
PH
3
nie działa bez dostępu powietrza
przy dostępie powietrza –
MCl
3
Działanie
H
2
SO
4
nie działa
na gorąco -
SO
2
i
H
2
S
rozcieńczony kwas nie działa
stężony na gorąco redukuje się do SO
2
z
utworzeniem
H
3
AsO
4
i M
2
(SO
4
)
3
Działanie
HNO
3
nie działa
utlenienie –
H
3
PO
4
utlenienie na gorąco
H
3
MO
4
reaguje
łatwo
-
Bi(NO
3
)
3
N

w stanie wolnym:
w stanie związanym:
główny składnik atmosfery otaczającej kulę ziemską
78,1% objętościowych = 75,5% wagowych
w atmosferze śladowe ilości amoniaku
w litosferze:
— głównie NaNO
3
- saletra chilijska

na skalę przemysłową:
frakcjonowana destylacja skroplonego
powietrza
O
H
2
N
NO
NH
2
2
temp
2
4
.
O
H
2
N
NO
NH
2
2
temp
2
4
.
2
temp
3
N
3
Na
2
NaN
2
.
2
temp
3
N
3
Na
2
NaN
2
.
próżnia
próżnia
do celów laboratoryjnych:

w temperaturze
pokojowej gaz o
cząsteczkach
dwuatomowych
N
2
:NN:
skroplony po raz
pierwszy w 1883 r.
przez K.
Olszewskiego
i Z. Wróblewskiego
bezbarwny
bezwonny
azot ciekły i
stały jest
bezbarwny

azot występuje na wszystkich
stopniach utlenienia od
-3
do
+5
-3
-2
-1
0 +1 +2 +3 +4 +5
NH
3
N
2
H
4
NH
2
O
H
N
2
N
2
O
NO N
2
O
3
NO
2
N
2
O
5
w temperaturze pokojowej jest
bardzo mało aktywny - duża
energia wiązania w N
2
N
2
= 2N - 941 kJ

w
podwyższonej
temperaturze
znacznie łatwiej wchodzi w reakcje
chemiczne:
łączy się z niektórymi metalami tworząc azotki:
łączy się z niektórymi metalami tworząc azotki:
Mg + N
2
= Mg
3
N
2
Mg
3
N
2
+ 6H
2
O = 3Mg(OH)
2
+ 2NH
3
wchodzi w reakcje z wodorem:
N
2
+ 3H
2
2NH
3
z tlenem:
N
2
+ O
2
2NO
z węglikiem wapnia:
N
2
+ CaC
2
C + CaCN
2
- cyjanamid
wapnia

azot ulega aktywacji pod wpływem
wyładowań atmosferycznych i reaguje
wówczas bezpośrednio z:
siarką
jodem
fosforem
i licznymi metalami
—
jest surowcem wyjściowym do
otrzymywania
amoniaku, kwasu azotowego,
cyjanamidu wapnia
— do otrzymywania nawozów sztucznych
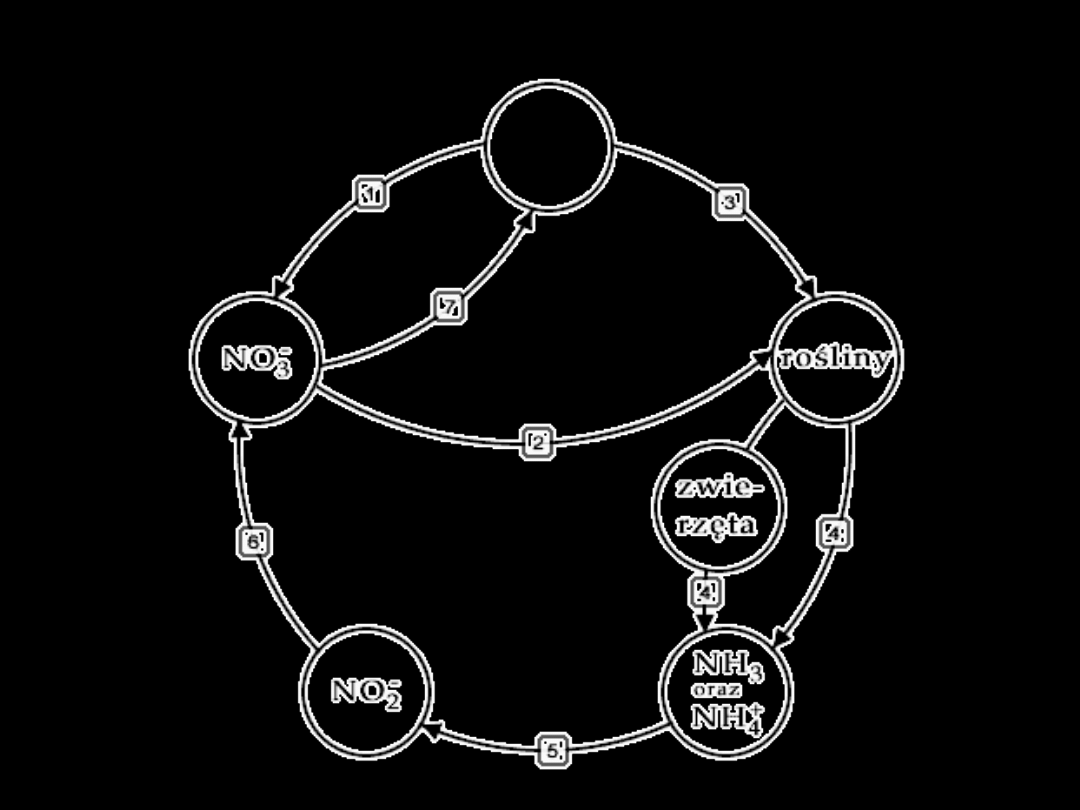
OBIEG AZOTU W PRZYRODZIE
azot
N
2

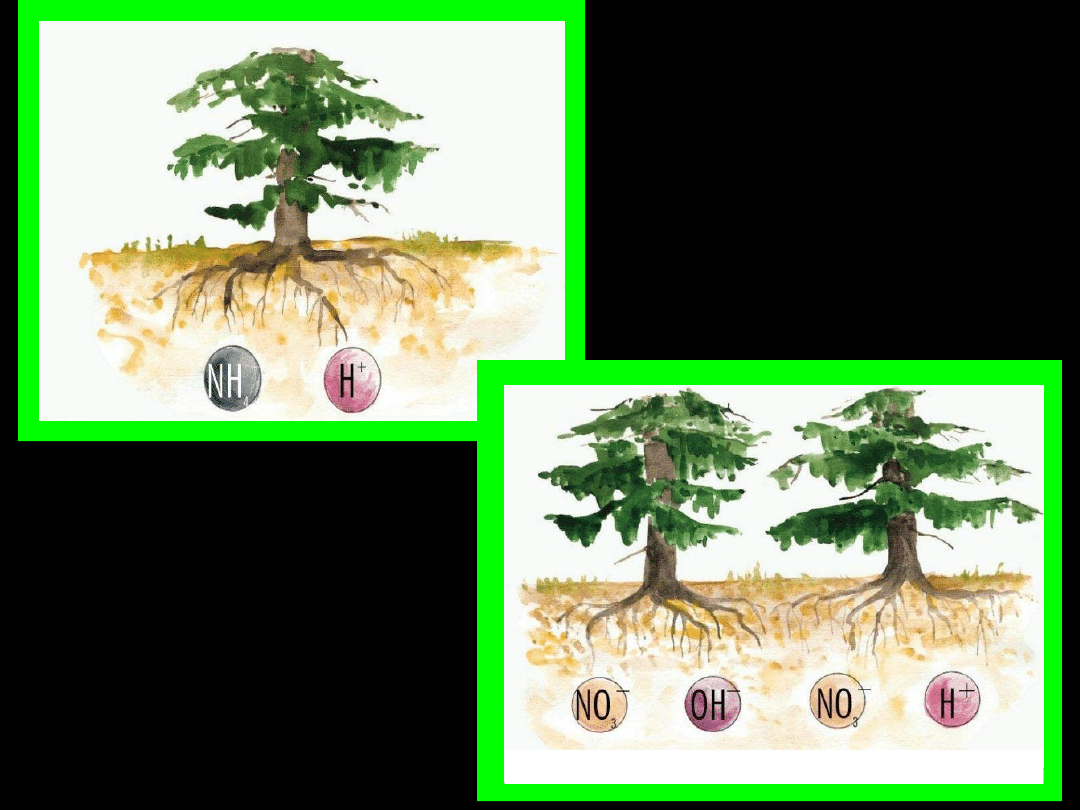
ZAKWASZANIE
GLEBY

w wyniku reakcji azotu z
metalami i niemetalami
w wysokiej
temperaturze:
3
2
2
2
2
3
2
NH
2
N
H
3
BN
2
N
B
2
N
Mg
N
Mg
3
3
2
2
2
2
3
2
NH
2
N
H
3
BN
2
N
B
2
N
Mg
N
Mg
3

własności azotków zmieniają się w okresach i grupach
Na
3
N
Mg
3
N
2
AIN
Si
3
N
4
P
3
N
5
S
4
N
4
Cl
3
N
właściwości
zasadowe
właściwości
amfoteryczne
właściwości
kwasowe
azotki I i II grupy —
substancje krystaliczne,stosunkowo
aktywne,
azotki III grupy —
substancje stałe, polimeryzujące w
wyższych
temperaturach wykazują wysokie
temperatury
topnienia; są dielektrykami lub
półprzewodnikami
3
2
3
NH
HClO
3
O
H
3
N
Cl
azotki fluorowoców —
połączenia endotermiczne o
charakterze
kwasowym i budowie
kowalencyjnej
azotki metali przejściowych —
charakteryzują się
zróżnicowanym
składem
chemicznym:
MN albo M
2
N
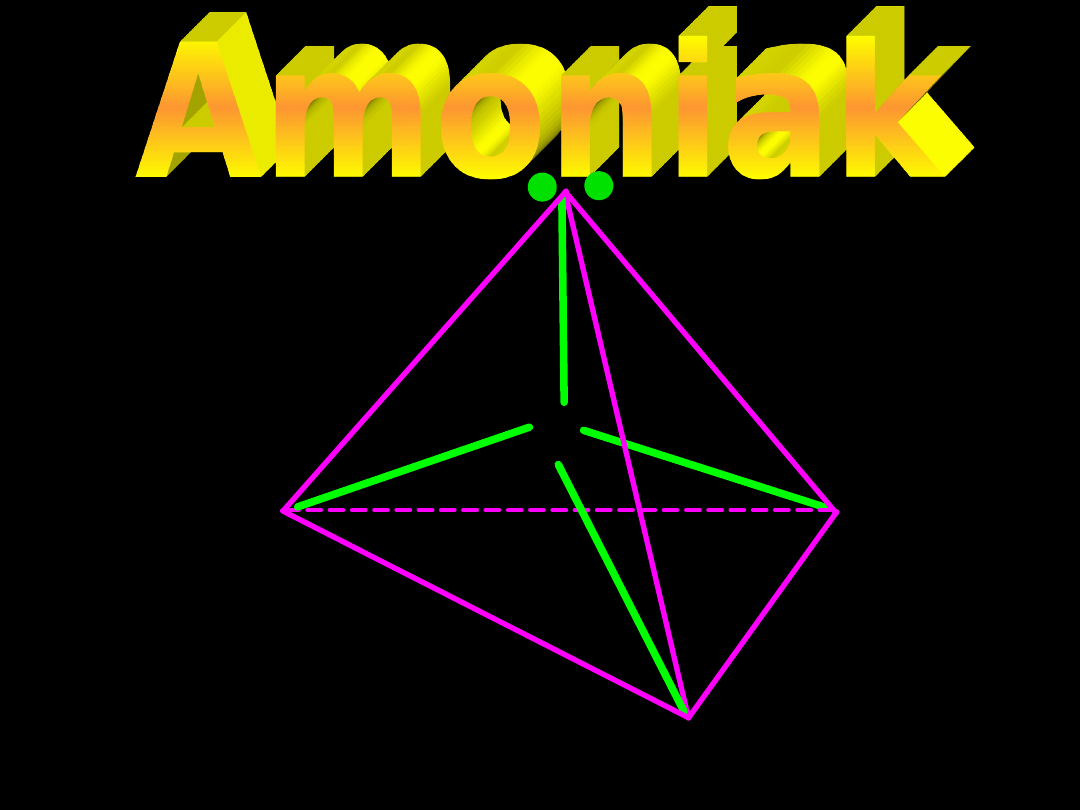
N
Struktura przestrzenna cząsteczki NH
3

na skalę
przemysłową
Q
NH
2
H
3
N
3
Fe
2
2
Q
NH
2
H
3
N
3
Fe
2
2
O
H
NH
2
CaCO
O
H
5
CaCN
2
3
3
2
2
P, tem.

dla potrzeb
laboratoryjnych
3
2
2
2
4
NH
2
O
H
2
CaCl
OH
Ca
Cl
NH
2
)
(
3
2
2
2
4
NH
2
O
H
2
CaCl
OH
Ca
Cl
NH
2
)
(
O
H
ZnO
Na
4
NH
Zn
4
NaNO
NaOH
7
2
2
2
3
3
O
H
ZnO
Na
4
NH
Zn
4
NaNO
NaOH
7
2
2
2
3
3
3
2
2
2
3
NH
2
OH
Mg
2
O
H
6
N
Mg
)
(
3
2
2
2
3
NH
2
OH
Mg
2
O
H
6
N
Mg
)
(
800
0
C

w temperaturze pokojowej — gaz:
w temperaturze pokojowej — gaz:
—
bezbarwny
—
o charakterystycznym zapachu
drażniącym
błony śluzowe
—
bardzo dobrze rozpuszczalny w
wodzie
—
łatwo ulega skropleniu na ciecz
bezbarwną, silnie łamiącą światło
ciekły amoniak:
ciekły amoniak:
—
ciecz o stosunkowo dużej
względnej
przenikalności elektrycznej

związek azotu na
–3
stopniu utlenienia
w obecności tlenu ulega utlenieniu:
O
H
2
H
N
2
O
NH
4
2
4
2
2
3
O
H
2
H
N
2
O
NH
4
2
4
2
2
3
2
2
2
3
N
O
H
3
O
3
NH
4
2
2
2
3
N
O
H
3
O
3
NH
4
2
Pt
2
3
H
6
NO
4
O
5
NH
4
2
Pt
2
3
H
6
NO
4
O
5
NH
4

posiada właściwości redukujące:
O
H
3
N
Cu
3
NH
2
CuO
3
2
2
3
2
3
2
N
HCl
6
NH
2
Cl
3
3
3
2
NCl
HCl
3
NH
Cl
3
reaguje z kwasami:
]
HCl
NH
[
Cl
NH
HCl
NH
3
4
3
3
4
3
3
NO
NH
HNO
NH

w ciekłym NH
3
rozpuszczają się, bez reakcji
chemicznej, metale alkaliczne i metale
ziem alkalicznych
2
2
3
H
NH
2
Na
2
NH
2
Na
2
amoniak jest doskonale rozpuszczalny
w wodzie
roztwór
amoniaku
w
wodzie,
zwany
roztworem wodorotlenku amonowego (lub
wodą amoniakalną) zawiera cząsteczki NH
3
i NH
4
OH oraz jony NH
4
+
i OH
-
wodorotlenek amonowy jest
słabą zasadą:
OH
NH
OH
NH
O
H
NH
4
4
2
3

— amoniak jest surowcem wyjściowym
do
otrzymywania:
- kwasu azotowego
- soli amonowych
— do produkcji sztucznego lodu

ze względu na porównywalne promienie
jonowe, pod względem:
—
postaci krystalicznej
—
objętości molowej
—
barwy
przypominają sole potasu i rubidu
są rozpuszczalne w wodzie i całkowicie
zdysocjowane
roztwory ich są słabo kwaśne:
Cl
NH
Cl
NH
4
4
O
H
NH
O
H
NH
3
3
2
4

białą solą
o gorzkawosłonawym smaku
znajduje zastosowanie w suchych
ogniwach i jako
topnik przy lutowaniu i spawaniu
(g)
3(g)
.
temp
(s)
4
HCl
H
N
l
C
NH
NH
4
Cl
jest:
NH
4
Cl
jest:
(NH
4
)
2
SO
4
jest ważnym nawozem
(NH
4
)
2
SO
4
jest ważnym nawozem
NH
4
NO
3
jest ważnym nawozem
NH
4
NO
3
jest ważnym nawozem
3(g)
3(g)
.
temp
3(s)
4
HNO
H
N
NO
NH

HYDRAZYNA —N
2
H
4
HYDRAZYNA —N
2
H
4
związek azotu na
-2
stopniu utlenienia
bezwodna
hydrazyna
jest
dymiącą
cieczą
bezbarwną cieczą, bardzo trwałą
w powietrzu pali się z wydzieleniem dużej ilości ciepła:
O
H
2
N
O
H
N
2
2
2
4
2

tworzy dwa szeregi soli hydrazyny, które są:
— ulegają łatwo hydrolizie, słabiej rozpuszczalne
5
2
H
N
2
6
2
H
N
— trwałe w wodzie, dobrze rozpuszczalne
niekiedy wykazuje również właściwości kwasowe
jest stosunkowo silnym środkiem redukującym:
atomy wodoru w hydrazynie mogą być
zastąpione atomami metalu
2
2
4
2
N
HI
4
I
2
H
N
ulega dysocjacji w roztworach wodnych
posiada słabe właściwości zasadowe —
zasada dwufunkcyjna
:
OH
H
N
O
H
H
N
5
2
2
4
2
OH
H
N
O
H
H
N
6
2
2
5
2

HYDROKSYLOAMINA —NH
2
OH
HYDROKSYLOAMINA —NH
2
OH
związek azotu na
-1
stopniu utlenienia
jest zasadą słabszą niż NH
3
OH
OH
NH
O
H
OH
NH
3
2
2
w roztworze wodnym lub w postaci swych
soli [NH
3
OH]Cl lub [NH
3
OH]SO
4
jest
stosowana jako
reduktor
:
O
H
4
KI
2
N
KOH
2
I
OH
NH
2
2
2
2

O
2H
SO
)
(NH
)
(SO
2Fe
SO
H
3
FeSO
4
OH
NH
2
4
2
4
3
4
2
4
2
2
2
może być również utleniaczem
łatwo ulega rozkładowi podczas ogrzewania
O
H
3
N
NH
OH
NH
3
2
2
3
2

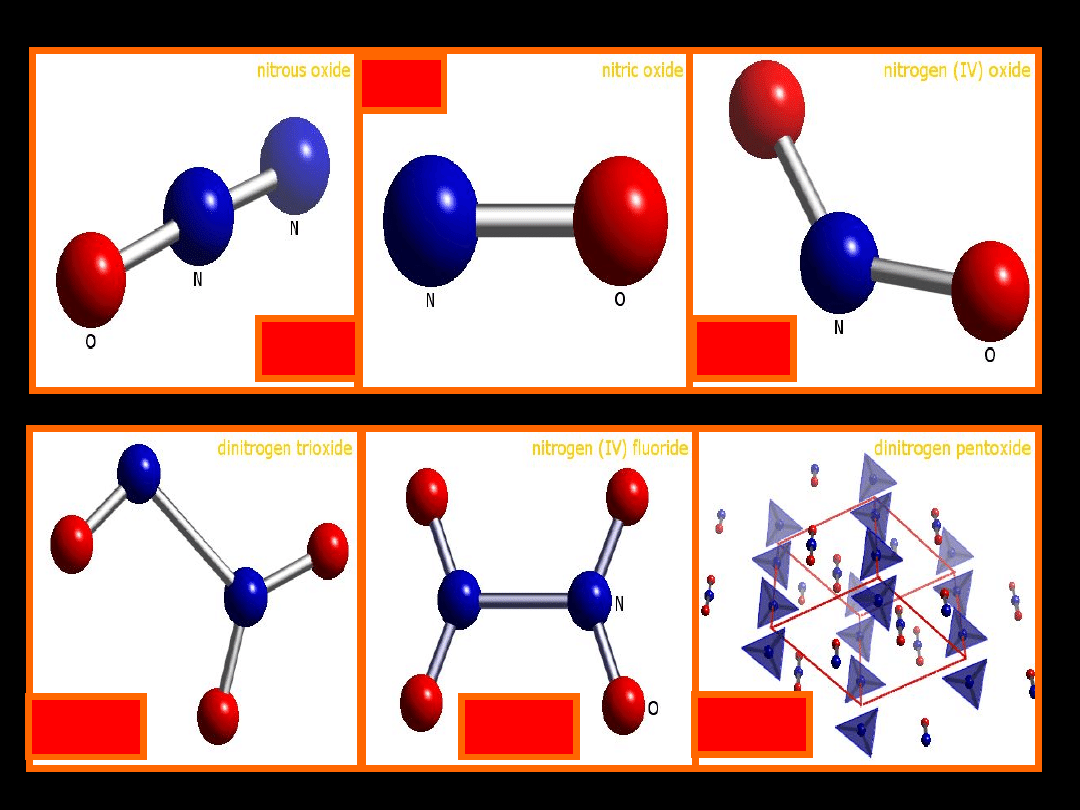
TLENKI I TLENOWE KWASY
AZOTU
wzór
stopień
utlenieni
a
nazwa
kwas odpowiadający
tlenkowi
N
2
O
+1
podtlenek azotu
tlenek azotu(I)
H
2
N
2
O
2
– kwas
azotowy (I)
NO
+2
tlenek azotu
tlenek azotu(II)
N
2
O
3
+3
tritlenek azotu
tlenek azotu(III)
HNO
2
–
kwas
azotowy(III)
NO
2
+4
ditlenek azotu
tlenek azotu(IV)
HNO
2
+ HNO
3
N
2
O
4
+4
tetratlenek
diazotu
tlenek azotu(IV)
HNO
2
+ HNO
3
N
2
O
5
+5
pentatlenek
diazotu
tlenek azotu(V)
HNO
3
–
kwas
azotowy(V)
N
2
O
3
N
2
O
4
N
2
O
5
N
2
O
NO
NO
2
N
2
O
3
i kwas azotowy (III)
N
2
O
3
i kwas azotowy (III)
Właściwości
3
2
O
N
gaz o
pomarańczowym
zabarwieniu
nietrwały w temperaturze pokojowej:
w niskiej temperaturze ciało stałe
jest bezwodnikiem kwasu azotowego (III):
2
3
2
NO
NO
O
N
2
3
2
NO
NO
O
N
2
2
3
2
HNO
2
O
H
O
N
2
2
3
2
HNO
2
O
H
O
N
Właściwości kwasu azotowego(III)
kwas azotowy (III) jest kwasem
nietrwałym, występującym tylko w
postaci rozcieńczonych roztworów
wraz ze wzrostem stężenia ulega rozkładowi:
wraz ze wzrostem stężenia ulega rozkładowi:
NO
2
O
H
HNO
HNO
3
2
3
2
NO
2
O
H
HNO
HNO
3
2
3
2
sole kwasu azotowego (III) otrzymuje się:
PbO
NaNO
Pb
NaNO
2
3
PbO
NaNO
Pb
NaNO
2
3

kwas azotowy (III) i jego sole wykazują
właściwości amfoteryczne:
H
NO
HNO
NO
OH
2
2
H
NO
HNO
NO
OH
2
2
O
H
3
Mn
2
NO
5
H
6
NO
5
MnO
2
2
2
3
2
4
O
H
3
Mn
2
NO
5
H
6
NO
5
MnO
2
2
2
3
2
4
O
H
2
NO
2
I
2
H
4
I
4
NO
2
2
2
2
O
H
2
NO
2
I
2
H
4
I
4
NO
2
2
2
2
mogą być reduktorami:
mogą być reduktorami:
mogą być utleniaczami:
mogą być utleniaczami:
kwas azotowy (III) i jego sole ulegają
reakcji dysproporcjonowania:
NO
2
O
H
HNO
HNO
3
2
3
2
NO
2
O
H
HNO
HNO
3
2
3
2
N
2
O
5
i kwas azotowy (V)
N
2
O
5
i kwas azotowy (V)
Właściwości
5
2
O
N
łatwo ulega rozkładowi
ciało stałe,
bezbarwne
z wodą łączy się energicznie tworząc kwas azotowy (V)
rozpuszcza się w stężonym kwasie siarkowym:
w roztworze bezwodnego HNO
3
ulega
całkowicie dysocjacji:
3
2
5
2
NO
NO
O
N
3
2
5
2
NO
NO
O
N
O
H
HSO
3
NO
2
SO
H
3
O
N
3
4
2
4
2
5
2
O
H
HSO
3
NO
2
SO
H
3
O
N
3
4
2
4
2
5
2
kation nitroniowy

Kwas azotowy(V)
Kwas azotowy(V)
działanie na saletry kwasem siarkowym:
1
3
4
4
2
3
HNO
NaHSO
SO
H
NaNO
3
4
4
2
3
HNO
NaHSO
SO
H
NaNO
b
katalityczne spalanie amoniaku do NO
metodą Oswalda:
c
pochłanianie mieszaniny NO
2
i N
2
O
4
w
wodzie
w obecności powietrza:
2
3
2
4
2
HNO
HNO
O
H
O
N
2
3
2
4
2
HNO
HNO
O
H
O
N
4
2
2
2
O
N
NO
2
O
NO
2
4
2
2
2
O
N
NO
2
O
NO
2
O
H
6
NO
4
O
5
NH
4
2
2
3
O
H
6
NO
4
O
5
NH
4
2
2
3
kat.
metoda amoniakalna:
2
a
otrzymywanie amoniaku metodą Habera i Boscha:
3
2
2
NH
2
N
H
3
3
2
2
NH
2
N
H
3

NO
O
H
HNO
HNO
2
3
2
3
2
NO
O
H
HNO
HNO
2
3
2
3
2
Powstający kwas azotowy (III) jest trwały
jedynie w rozcieńczonych roztworach i w
miarę
zagęszczania
roztworu
ulega
rozkładowi:
NO ulega ponownemu utlenieniu:
W ten sposób uzyskany kwas nie przekracza
60%.
4
2
2
2
O
N
NO
O
NO
2
4
2
2
2
O
N
NO
O
NO
2
Właściwości kwasu azotowego(V)
bezwodny kwas jest bezbarwną cieczą
100% kwas ulega reakcji autojonizacji:
100% kwas ulega powolnemu rozkładowi:
kwas azotowy (V) miesza się z wodą w
każdym stosunku
rozkład przyśpiesza światło
O
H
NO
NO
HNO
2
2
3
2
3
O
H
NO
NO
HNO
2
2
3
2
3
2
2
2
3
O
O
H
2
NO
4
HNO
4
2
2
2
3
O
O
H
2
NO
4
HNO
4
h

w obecności stężonych mocniejszych od
niego kwasów (np.chlorowego (VII) lub
siarkowego (VI) zachowuje się jak akceptor
protonów -
właściwości zasadowe
w rozcieńczonych roztworach wodnych oraz w
obecności słabszych od siebie kwasów HNO
3
jest
donorem
protonów
-
właściwości
kwasowe
O
H
ClO
2
NO
HCl
2
HNO
3
4
2
3
O
H
ClO
2
NO
HCl
2
HNO
3
4
2
3
O
H
HSO
2
NO
SO
H
2
HNO
3
4
2
4
2
3
O
H
HSO
2
NO
SO
H
2
HNO
3
4
2
4
2
3
3
3
2
3
NO
O
H
O
H
HNO
3
3
2
3
NO
O
H
O
H
HNO

HNO
3
wykazuje silne
właściwości utleniające:
złoto i platynowce ulegają jednak dopiero
działaniu
wody królewskiej
(stężony HNO
3
+
stężony HCl — 1 : 3)
O
4H
2NO
)
3Cu(NO
HNO
.
roz
8
Cu
3
2
2
3
3
O
4H
2NO
)
3Cu(NO
HNO
.
roz
8
Cu
3
2
2
3
3
NOCl
Cl
O
H
2
HNO
HCl
3
2
2
3
NOCl
Cl
O
H
2
HNO
HCl
3
2
2
3
cynk
i
glin
redukują
w
roztworach
alkalicznych kwas azotowy i jego sole do
wolnego azotu lub amoniaku
3
2
4
2
3
NH
]
4[Zn(OH)
O
H
6
OH
7
NO
Zn
4
3
2
4
2
3
NH
]
4[Zn(OH)
O
H
6
OH
7
NO
Zn
4

kwas azotowy (V) działa
pasywująco
na
niektóre metale (żelazo, nikiel, glin)
na związki organiczne HNO
3
działa:
—
—
utleniająco
utleniająco
—
—
estryfikująco
estryfikująco
—
—
nitrująco
nitrująco

azotany
litowców
podczas
ogrzewania tracą tlen i
przechodzą w azotyny
2
2
3
O
KNO
2
KNO
2
2
2
3
O
KNO
2
KNO
2
produktem rozkładu większości
azotanów są
jednak tlenki metali
2
2
2
3
O
NO
NO
BaO
)
NO
(
Ba
2
2
2
3
O
NO
NO
BaO
)
NO
(
Ba
lub nawet wolny metal, jeżeli tlenek jest nietrwały
2
2
3
O
NO
2
Ag
2
AgNO
2
2
2
3
O
NO
2
Ag
2
AgNO
2
sole kwasu -
azotany
są bez wyjątku
dobrze rozpuszczalne w wodzie:
wykazują działanie utleniające

—
do wytwarzania azotanów
—
do nitrowania związków organicznych
—
wiele azotanów (np. nitrogliceryna)
i związków
nitrowych stanowią materiały
wybuchowe
(trójnitrotoluen)
O
H
HSO
NO
SO
H
HNO
2
4
2
4
2
3


Henning Brand —odkrywa fosfor
Henning Brand —odkrywa fosfor

0,11% w skorupie ziemskiej
—
13 miejsce
w litosferze w postaci
soli kwasu fosforowego
w biosferze
—
stanowi 1%
masy organizmu człowieka
Ca
3
(PO
4
)
2
— fosforyt
3Ca
3
(PO
4
)
2
.
Ca(F,Cl)
2
—
apatyt
—w białkach
— we krwi
— w substancji nerwowej i mózgowej
— w żółtku i mleku
— w kościach i zębach
3Ca
3
(PO
4
)
2
.
CaCO
3
.
H
2
O
— apatyt węglanowy
3Ca
3
(PO
4
)
2
.
Ca(OH)
2
—
apatyt hydroksylowy

4
3
2
2
4
3
P
CO
10
CaSiO
6
C
10
SiO
6
)
PO
(
Ca
2
1400
o
C
fosfor
biały
w stanie stałym
występuje w kilku
odmianach alotropowych
Fosfor
czerwony
(krystaliczny)
Fosfor
czerwony
(krystaliczny)
Fosfor
czerwony
(polimer
bezpostaciowy
)
Fosfor
czerwony
(polimer
bezpostaciowy
)
Fosfor biały
(dwie
odmiany)
Fosfor biały
(dwie
odmiany)
Fosfor ciekły
(tetraedry P
4
)
Fosfor ciekły
(tetraedry P
4
)
Fosfor
czarny
(metaliczny
)
Fosfor
czarny
(metaliczny
)
Fosfor
szkarłatny
(czerwony bardzo
drobnoziarnisty)
Fosfor
szkarłatny
(czerwony bardzo
drobnoziarnisty)
Fosfor
Hittorfa
(fioletowy
bezpostaciowy
polimer
)
Fosfor
Hittorfa
(fioletowy
bezpostaciowy
polimer
)
Fosfor brązowy
(trwały poniżej-
100
o
C )
Fosfor brązowy
(trwały poniżej-
100
o
C )
ogrzewanie
w
260
0
C
(katalizator I lub
S)
ALOTROPIA
FOSFORU
ALOTROPIA
FOSFORU
Pary P
4
480
0
C
ogrzewanie
ok.500-600
0
C
z Pb
ogrzewanie
w 200
0
C
pod
ciśnieniem
gotowanie
z PBr
3
-regularny
-
heksagonaln
y
ogrzewa
nie
ok45
0
C
Pary P
2
Zestalenie w
temperaturze ciekłego
azotu

tworzy sieć regularną zbudowaną z tetraedrów P
4
2
4
P
P
2
4
P
P
na świetle i pod wpływem promieni
rentgenowskich przechodzi w fosfor
czerwony
nierozpuszczalny w wodzie i alkoholu
rozpuszcza się w CS
2
, ciekłym NH
3
i SO
2

na powietrzu dymi i zapala się -
przechowywany jest pod wodą
Q
O
P
O
5
P
4
5
2
2
Q
O
P
O
5
P
4
5
2
2
ulega utlenianiu na powierzchni, czemu
towarzyszy
chemiluminescencja
objawiająca się świeceniem
pary fosforu rozkładają parę wodną:
reaguje gwałtownie z chlorowcami
2
4
3
2
4
H
10
PO
H
4
O
H
16
P
2
4
3
2
4
H
10
PO
H
4
O
H
16
P
w podwyższonej temp. w metalami tworzy fosforki

rozpuszcza się w gorącym ługu:
z roztworów wydziela metale szlachetne:
jest odmianą nietrwałą
2
2
3
2
4
PO
KH
3
PH
O
H
3
KOH
3
P
2
2
3
2
4
PO
KH
3
PH
O
H
3
KOH
3
P
4
2
4
3
2
4
4
SO
H
10
PO
H
4
Cu
10
O
H
16
Cu
SO
10
P
4
2
4
3
2
4
4
SO
H
10
PO
H
4
Cu
10
O
H
16
Cu
SO
10
P
jest
silnie trujący!!!
powoduje bolesne oparzenia

jest mieszaniną
zawierającą fosfor fioletowy jako główny składnik
proszek barwy
ciemnoczerwonej
nierozpuszczalny w CS
2
nietoksyczny
znacznie mniej reaktywny niż fosfor biały
zapala się w powietrzu dopiero powyżej 400
0
C
z chlorowcami reaguje dopiero w
podwyższonej temperaturze
nie wydziela metali z roztworów

— barwa szara,
połysk
metaliczny
— ma
właściwości
półprzewodniko
we
— pod
zwiększonym
ciśnieniem
staje się
nadprzewodniki
em
— przewodzi
prąd
elektryczny
— niepalny
— ma
największą
gęstość ze
wszystkich
odmian
Struktura przestrzenna fosforu czarnego


P
2
O
3
(P
4
O
6
) i P
2
O
5
(P
4
O
10
)
bezwodniki kwasowe
3
3
O
H
5
2
4
O
H
2
O
H
3
2
PO
H
2
O
P
H
HPO
2
O
P
2
2
2
kwas
pirofosforowy(III)
kwas
metafosforowy(III)
kwas
ortofosforowy(III)
H
3
PO
3
- słaby kwas o silnych właściwościach
redukcyjnych
H
3
PO
3
- kwas nietrwały
H
2
Ag
2
HPO
Ag
2
HPO
2
4
2
3
3
4
3
.
temp
3
3
PH
PO
H
3
PO
H
4

4
3
O
H
7
2
4
O
H
3
O
H
5
2
PO
H
2
O
P
H
HPO
2
O
P
2
2
2
kwas
pirofosforowy(V)
kwas
metafosforowy(V)
kwas
ortofosforowy(V)
4
3
4
4
2
2
4
3
PO
H
2
CaSO
3
SO
H
3
)
PO
(
Ca
2
4
3
2
4
H
10
PO
H
4
O
H
16
P
H
3
PO
4
:
substancja krystaliczna topniejąca w
temp.42
o
C na syropowatą ciecz
bardzo dobrze
rozpuszczalny
w wodzie
kwas średniej mocy, trwały

dysocjuje trójstopniowo:
4
2
4
3
PO
H
H
PO
H
2
4
4
2
HPO
H
PO
H
3
4
2
4
PO
H
HPO
tworzy fosforany I-, II- i III-rzędowe
fosforany I-rzędowe są rozpuszczalne w wodzie
spośród fosforanów II i III rzędowych
w wodzie rozpuszczają się tylko
fosforany metali alkalicznych

P
RECYPITAT:
4
4
4
2
2
4
3
CaHPO
2
CaSO
2
SO
H
)
PO
(
Ca
S
UPERFOSFAT PODWÓJNY:
2
4
2
4
3
2
4
3
)
PO
H
(
Ca
3
PO
H
4
)
PO
(
Ca
S
UPERFOSFAT:
2
4
2
4
4
2
2
4
3
)
PO
H
(
Ca
CaSO
2
SO
H
2
)
PO
(
Ca
NAWOZY AZOTOWE
zawierają przyswajany przez rośliny azot
amonowe
(NH
4
)
2
SO
4
NH
4
Cl
amonowo
–
azotowe
NH
4
NO
3
NH
4
NO
3
+
(NH
4
)
2
SO
4
amidowe
azotniak —
CaCN
2
— cyjanamid
wapnia
CaCN
2
+2H
2
OCaO+CO(NH
2
)
2
mocznik —
CO(NH
2
)
2
+ H
2
O
CO
2
+2NH
3
azotanowe
— saletra chilijska
NaNO
3
— saletra indyjska
KNO
3
— saletra amonowa
NH
4
NO
3
— saletra norweska
Ca(NO
3
)
2
3
9
3
O
P
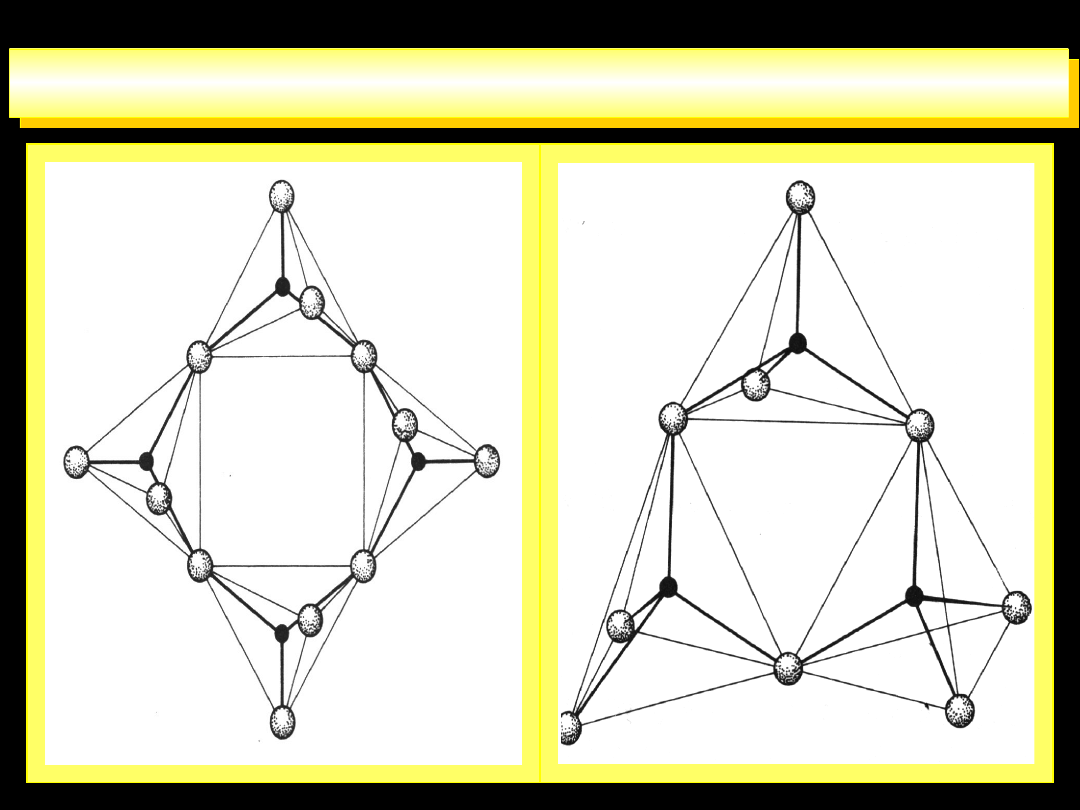
STRUKTURY PRZESTRZENNE JONÓW
STRUKTURY PRZESTRZENNE JONÓW
4
12
4
O
P
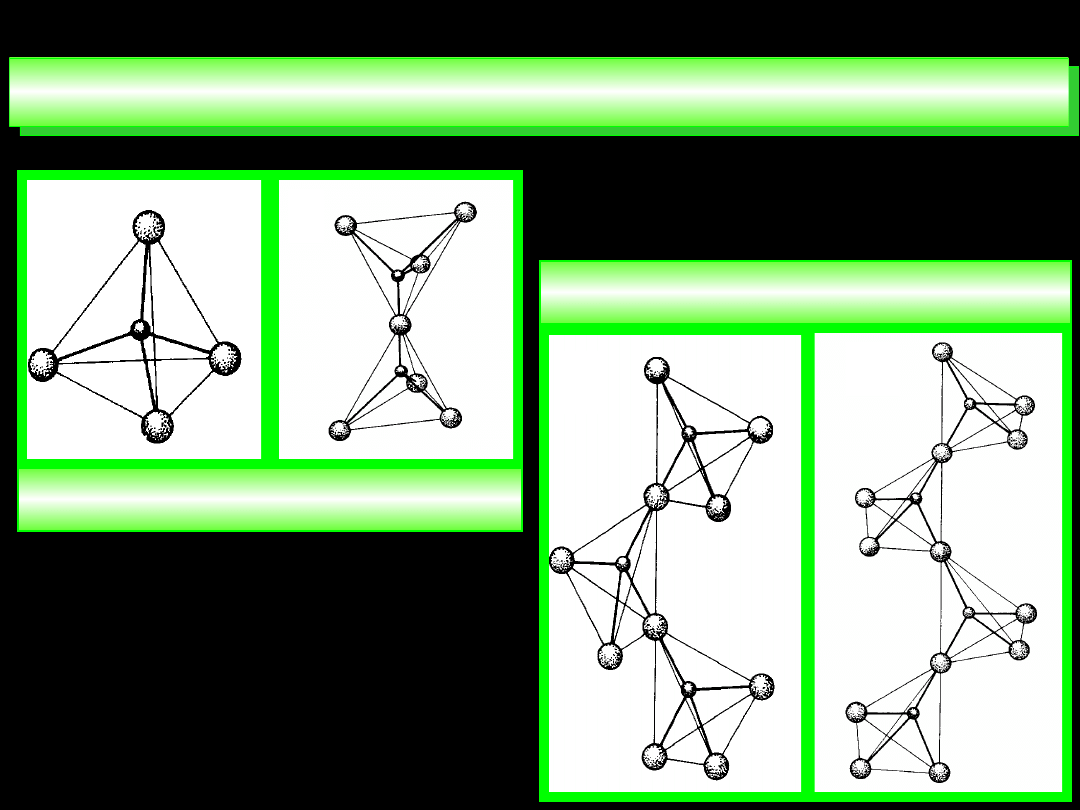
STRUKTURY PRZESTRZENNE JONÓW
STRUKTURY PRZESTRZENNE JONÓW
3
4
PO
4
7
2
O
P
5
10
2
O
P
6
13
2
O
P






Większość rud siarczkowych metali
ciężkich
zawiera zanieczyszczenia siarczkami
arsenu, antymonu i bizmutu
A
RSEN
A
NTYMON
B
IZMUT
w skorupie
ziemskiej:
5·10
-4
%
w skorupie
ziemskiej:
5·10
-5
%
w skorupie
ziemskiej:
5·10
-5
%
w stanie wolnym:
sporadycznie
w związkach
chemicznych:
siarczkach
Sb
2
S
3
tlenkach
Sb
2
O
3
w związkach
chemicznych:
siarczkach
Bi
2
S
3
tlenkach
Bi
2
O
3
w związkach
chemicznych:
siarczkach
arsenkach
arsenosiarczkach
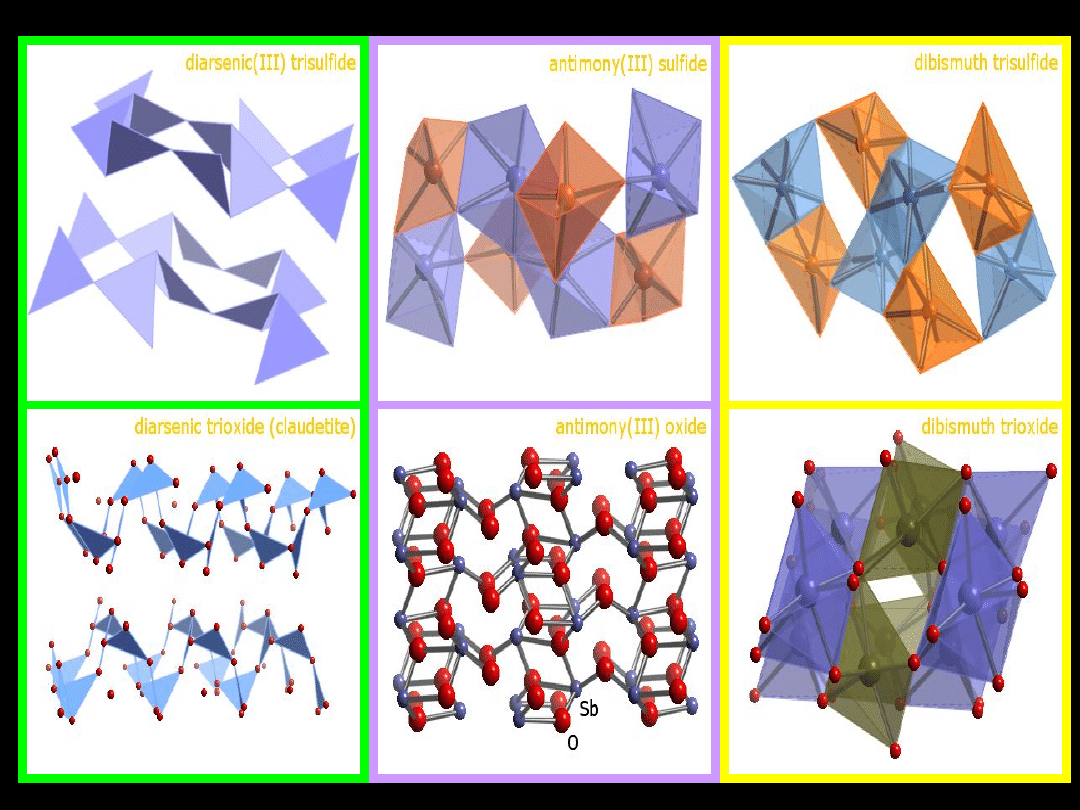
As
2
O
3
Sb
2
O
3
Bi
2
O
3
As
2
S
3
Sb
2
S
3
Bi
2
S
3

ARSEN
FeAsS = FeS+As
As
4
O
6
+6C = 4As + 6CO
ANTYMO
N
Sb
2
O
3
+ 5O
2
= Sb
2
O
4
+ 3SO
2
Sb
2
O
4
+ 4C = 2Sb + 4CO
BIZMUT
Bi
2
O
3
+ 5O
2
= Bi
2
O
4
+ 3SO
2
Bi
2
O
4
+ 4C = 2Bi + 4CO
Bi
2
S
2
+ 3Fe = 2Bi + 3FeS

Arsen, antymon i bizmut są izomorficzne i
występują w odmianie
metalicznej o podobnej strukturze warstwowej
jak fosfor czarny
Arsen i antymon mogą występować również w
odmianach
barwy żółtej
Od typowych metali różnią się:
kruchością
niskim przewodnictwem
elektrolitycznym
Wykazują połysk metaliczny
Barwa:
arsen – szary
antymon – srebrzystobiały
bizmut – różowobiały

ogrzewane w powietrzu spalają się dając
tlenki
łączą się łatwo z fluorowcami
zapalają się w chlorze
stężony kwas azotowy utlenia:
—
As do kwasu arsenowego
—
Sb do Sb
2
O
3
—
Bi przechodzi w Bi(NO
3
)
3
ulegają działaniu stężonego kwasu
siarkowego

Z
ASTOSOWANIE
ARSEN
Bardzo ograniczone zastosowanie:
dodatek drobnej ilości wolnego
arsenu
do ołowiu ułatwia odlewanie
śrutu
Antymon i bizmut:
wchodzą w skład wielu stopów użytkowych
ANTYMO
N
stopu czcionkowego
stopów łożyskowych
BIZMUT
łatwotopliwych stopów

Otrzymywanie:
działanie kwasami na arsenki metali
lub stopy
antymonu lub bizmutu
Mg
3
Sb
2
+ 6HCl = 3MgCl
2
+ 2SbH
3
Własności:
gazy o nieprzyjemnym zapachu
toksyczne
w czasie ogrzewania ulegają rozkładowi
posiadają właściwości redukujące

Trójhalogenki - YX
3
charakteryzują się bardzo mała trwałością
trójhalogenek arsenu (III) hydrolizuje z
wytworzeniem kwasu arsenu (III)
AsCl
3
+ H
2
O As(OH)Cl
2
+ HCl
As(OH)Cl
2
+ H
2
O As(OH)
2
Cl + HCl
As(OH)
2
Cl + H
2
O As(OH)
3
+ HCl
produktami hydrolizy trójhalogenków antymonu
i bizmutu są nierozpuszczalne sole
SbCl
3
+ H
2
O SbOCl + 2HCl
chlorek
antymonylu
BiCl
3
+ H
2
O BiOCl + 2HCl
chlorek
bizmutylu

Tritlenki — X
2
O
3
występują w postaci
cząsteczek
podwójnych X
4
O
6
Otrzymywanie – spalanie pierwiastków
As
2
O
3
- arszenik - związek o charakterze amfoterycznym
3
3
2
3
2
AsO
H
2
O
H
3
O
As
2
2
3
2
HAsO
2
O
H
3
O
As
3
2
3
AsO
H
H
)
OH
(
As
OH
)
OH
(
As
)
OH
(
As
2
3

O
H
)
OH
(
SbO
)
OH
(
Sb
2
3
OH
SbO
)
OH
(
SbO
jon
antymonylowy
H
SbO
)
OH
(
SbO
2
jon
metaantymoninowy
Pięciotlenki
3As + 5HNO
3
+ 2H
2
O = 3H
3
AsO
4
+ 5NO
6Sb +10HNO
3
+ xH
2
O = 3Sb
2
O
5
.
xH
2
O + 1-NO + 5H
2
O
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 27
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 40
- Slide 41
- Slide 42
- Slide 43
- Slide 44
- Slide 45
- Slide 46
- Slide 47
- Slide 48
- Slide 49
- Slide 50
- Slide 51
- Slide 52
- Slide 53
- Slide 54
- Slide 55
- Slide 56
- Slide 57
- Slide 58
- Slide 59
- Slide 60
- Slide 61
- Slide 62
- Slide 63
- Slide 64
- Slide 65
- Slide 66
- Slide 67
- Slide 68
- Slide 69
- Slide 70
- Slide 71
- Slide 72
- Slide 73
- Slide 77
- Slide 78
- Slide 79
- Slide 80
- Slide 81
- Slide 82
- Slide 83
- Slide 84
- Slide 85
- Slide 86
- Slide 87
- Slide 88
- Slide 89
- Slide 90
- Slide 91
- Slide 92
- Slide 93
- Slide 94
- Slide 95
- Slide 96
- Slide 97
- Slide 98
Wyszukiwarka
Podobne podstrony:
23 wykad 13 gr[1] borowce[F]2006
21 wykładów, MIKRO15, Wyk˙ad 15.
wyk%c5%82ad 7 15 12 12
15 wykad ukad okresowy[F]2006
Pytania z Patofizjologii zebrane do 12 wИеcznie wersja 0 01 DODANE TESTY z wyjШЖ, wykИadвwek i egza
WYKLADY, GR W5, WYK˙AD V
Semestr 2, Wykład 15, WYK˙AD XV
WYKLADY, GR W13, WYK˙AD XIV ( II SEMESTR )
Semestr 2, Wykład 15, WYK˙AD XV
WYKLADY, GR W13, WYK˙AD XIV ( II SEMESTR )
9 wykad Ukady dyspersyjne [F] 2006
10 wykad Statyka kinetyka chemiczna[F 2006]
12 wykad roztwory buforowe [F]2006
WYKLADY, GR W17, WYK˙AD
WYKLADY, GR W4, WYK˙AD IV
WYKLADY, GR W1, WYK˙AD I
więcej podobnych podstron