
Nowotwory - część
ogólna
Barbara Górnicka
Katedra i Zakład Anatomii
Patologicznej
Akademii Medycznej

Diagnostyka nowotworów
• Diagnostyka histopatologiczna
• Diagnostyka cytologiczna
(złuszczeniowa, aspiracyjna)
• Immunocyto(histo)chemia
• Metody cytogenetyczne i
molekularne
• Biomarkery nowotworowe

Diagnostyka
histopatologiczna
Ma fundamentalne znaczenie w
klinicznej medycynie
• W odniesieniu do nowotworów odpowiada na
pytania:
*Czy badania zmiana jest nowotworem?
*Czy jest to nowotwór złośliwy, czy łagodny?
*Czy jest to neoplasia śródnabłonkowa, czy postać inwazyjna?
*Czy jest to rak wczesny czy zaawansowany?
*Jaki jest typ histologiczny nowotworu?
*Jaki jest stopień histologicznej złośliwości guza – G?
*Jaki jest stopień zaawansowania klinicznego – S?

Diagnostyka
histopatologiczna
Badaniu podlegają:
• Wycięte w całości zmiany (wraz z
marginesami tkanek zdrowych)
• Większe wycinki – biopsje
• Bardzo drobne wycinki – oligobiopsje
(wycinki z gastroskopii, bronchoskopii,
biopsje gruboigłowe)
Materiał pobrany do badania powinien
pochodzić z właściwego miejsca, być
odpowiedniej wielkości i natychmiast po
pobraniu zostać prawidłowo utrwalony

Diagnostyka
histopatologiczna
Rutynowe procedury
histopatologiczne
• Utrwalanie – 10% roztwór formaliny
• Niekiedy materiał mrożony
• Przeprowadzanie i zatapianie – około 2-3
dni
• Barwienie HE
• Badanie śródoperacyjne – materiał
mrożony

Diagnostyka cytologiczna
Dzieli się na dwie
podstawowe grupy:
• Cytologia złuszczeniowa
(exfoliatywna)
• Cytologia aspiracyjna (BAC)

BAC – warunki
wykonywania
• Ambulatoryjnie – narządy
powierzchowne (tarczyca, ślinianka,
sutek, zmiany położone podskórnie)
• W warunkach szpitalnych – narządy
głębokie (wątroba, trzustka, nerka
itp.)

BAC - wskazania
• Zmiana ogniskowa dobrze
uwidoczniająca się metodami
obrazowania
• Zmiany rozlane – znacznie rzadziej i
tylko w odniesieniu do niektórych
narządów np. podejrzenie zapalenia
tarczycy

Zmiana ogniskowa
• Dostępna palpacyjnie – praktycznie
odstąpiono od takiego wykonywania
biopsji
• Uwidoczniona metodami
wizualizacyjnymi (USG, TK)

BAC - przeciwwskazania
• Bezwzględne - brak zgody chorego
lub możliwości technicznych
wykonania biopsji
• Względne
-brak współpracy chorego
-zaburzenia układu krzepnięcia?
-niektóre jednostki chorobowe (torbiele
bąblowcowe, pheochromocytoma,
naczyniaki)

Rodzaje igieł stosowanych
do BAC
• 27-22 gauge (0,4-0,7mm)
• 22-23 (0,7-0,6mm) zmiany włókniste,
twarde np.. Sutek, trzustka
• 24-25 (0,4-0,5mm) zmiany miękkie,
miąższowe
• 27 (0,3mm) wyjątkowo delikatne
okolice np. gałka oczna, dzieci

Powikłania
• Śmiertelność 1:15000
• Krwawienie
• Sepsa
• Żółciowe zapalenie otrzewnej
• Ostre zapalenie trzustki
• odma

Techniki histologiczne
• Utrwalanie: 70-90% alkohol (HE, Pap)
Cytofix
suszenie (MGG, Wright)
• Barwieniua specjalne:
p.a.S+alcjan śluz
Błękit pruski żelazo
Ziel-Nelsen mikroorganizmy
• Metody immunohistochemiczne: CK,
vimentyna, S-100, LCA, Desmina,
FVIII,chromogranina itd..

Zmiany po wkłuciu
• Krwiaki
• Zawały
• Pseudoinwazja torebki
• Zmiany naprawcze mogące
sugerować złośliwość

BAC – bardzo wygodna dla:
*pacjenta – prawie bezbolesna
*lekarza – szybki wynik
*podatnika – tania
Nie zastępuje badania
histopatologicznego

Immunohistochemia
• 1941r Albert Coons – pierwsze próby
oznakowania bezpośredniego
przeciwciał fluoresceiną
• Polega na ocenie obecności
antygenów za pomocą przeciwciał
przeciwko różnym białkom jądra,
cytoplazmy i powierzchni komórki
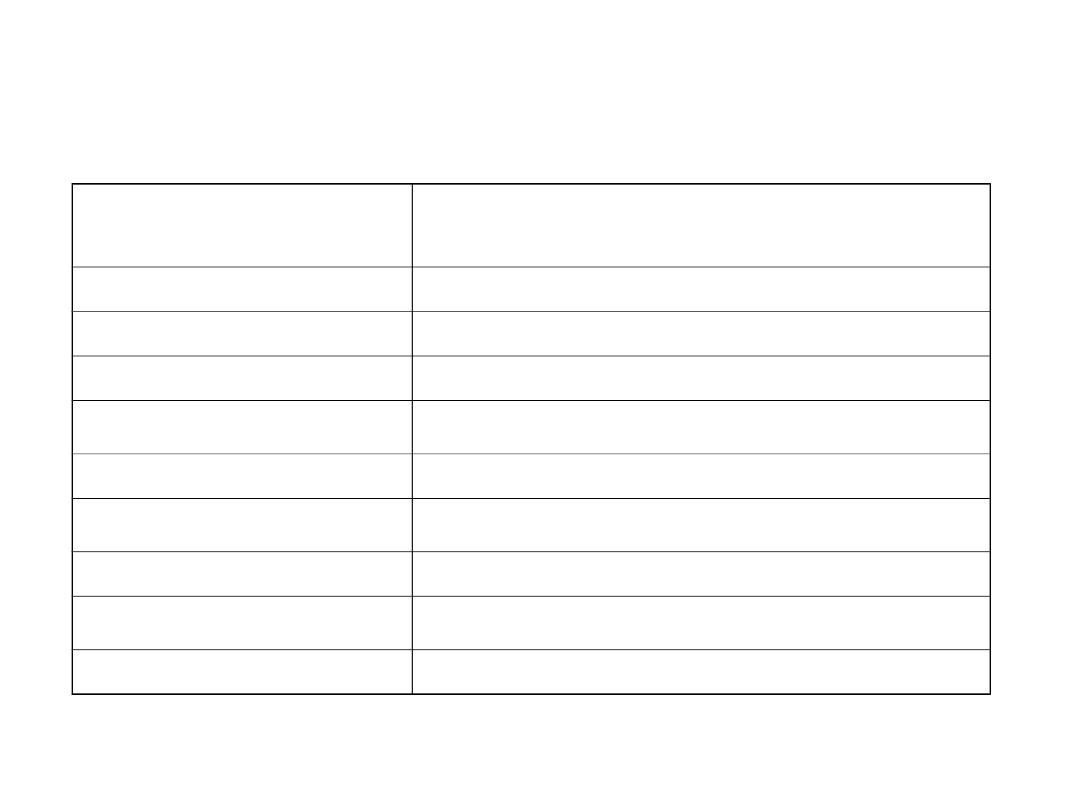
Immunohistochemia
Ocena kierunku różnicowania
Kierunek
różnicowania
Markery
Nabłonkowy
Keratyny, EMA, PSA
Limfoidalny
LCA
Melanocytarny
HMB45, MelanA, S100
Mięśniowy
Desmina, aktyna
Glejowy
GFAP, S100
Neuroendokrynny
ChromograninaA, synaptophysina, insulina
Naczyniowy
CD34, CD31, FVIII
Histiocytarny
CD68
Antygeny płodowe
AFP, CEA
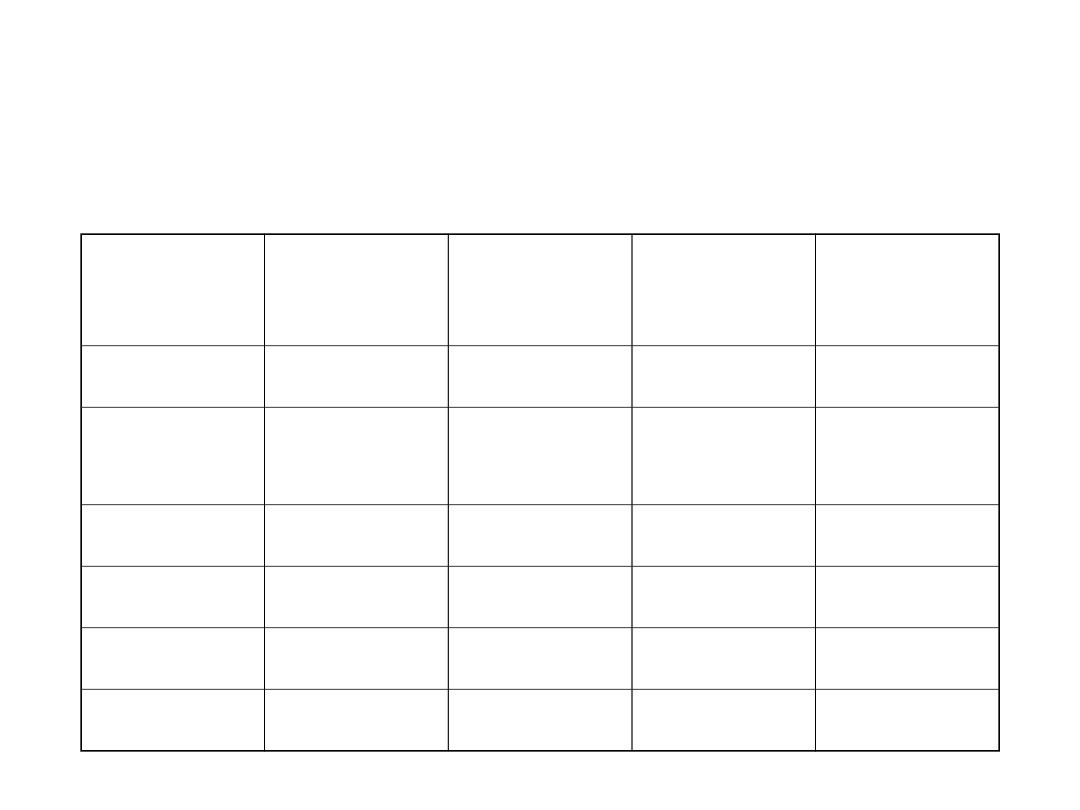
Immunohistochemia
Ocena kierunku różnicowania
Marker Rak
Chłoni
ak
Mięsak Czerni
ak
CK
+
-
-/+
-/+
Vimenty
na
-/+
+
+
+
LCA
-
+
-
-
HMB45
-/+
-
-
+
S100
-/+
-
-
+
EMA
+
-/+
-/+
-

Immunohistochemia
• Diagnostyka różnicowa nowotworów
drobnookrągłokomórkowych wieku
dziecięcego
• Ustalenie punktu wyjścia przerzutu
• Immunofenotypowanie białaczek i
chłoniaków
• Ocena obecności markerów
biologicznych o znaczeniu
prognostycznym lub predykcyjnym

Metody cytogenetyczne i
molekularne
• Wykrywanie dziedzicznych predyspozycji
do rozwoju nowotworów złośliwych
• Diagnostyka niektórych nowotworów
poprzez wykrywanie specyficznych mutacji
• Wykrywanie nielicznych komórek
pozostałych po leczeniu białaczek lub
chłoniaków (PCR)
• Ocena rokowania w niektórych chorobach
nowotworowych

Biomarkery
nowotworowe
Szereg białek cytoplazmatycznych,
białek powierzchni komórek, hormonów
i enzymów można wykryć metodami
biochemicznymi w surowicy chorych (i
w innych płynach ustrojowych) – są to
tzw. biomarkery nowotworowe
Markery wspomagają rozpoznanie,
ale nie mają znaczenia
rozstrzygającego

Biomarkery
nowotworowe
Służą do:
• Wykrywania niektórych nowotworów w
grupach wysokiego ryzyka (PSA)
• Monitorowania wyników leczenia
operacyjnego (CEA, betahCG)
• Klasyfikacji i monitorowania białaczek
(TdT)
• Ocenie rokowania
• Ocenie stopnia zaawansowania choroby

Biomarkery nowotworowe
• CEA
– rak jelita grubego, wątroby, trzustki,
żołądka, płuca, piersi
• AFP
– Yolc sack tumor, Ca hepatocellulare
• Beta hCG
– chorioncarcinoma
• NSE
– rak drobnokomórkowy płuca
• PSA
– rak prostaty
• Kalcytonina
– rak rdzeniasty tarczycy
• Katecholaminy
– pheochromocytoma
• Immunoglobuliny
– szpiczak mnogi
• CA15-3
– rak piersi
• CA19-9
– raki przewodowe
• CA125
– rak jajnika
• TdT
– białaczki

Zespoły
paraneoplazmatyczne
• Są to zespoły objawów klinicznych,
które nie są związane ani z
umiejscowieniem nowotworu ani z
obecnością przerzutów ani z
wydzielaniem hormonów typowych dla
tkanki z której nowotwór się wywodzi
• Występują u około 10% chorych z
nowotworem złośliwym

Przyczyny występowania
zespołów
paraneoplazmatycznych
Ektopowe wydzielanie peptydów lub
nietypowych hormonów:
• Zespół Cushinga
(ACTH) – rak płuca, trzustki, mięsaki
• Hipoglikemia
(insulina) - rak wątroby, mięsaki
• Hiperkalcemia
(peptyd podobny do parathormonu,
TNF alfa, IL-1, TGF alfa) – raki płuca, sutka, nerki,
jajnika
• Policytemia
(erytropoetyna) – rak nerki, rak wątroby
• Zespół rakowiaka
(serotonina, bradykinina) – rak
trzustki, rak żołądka

Przyczyny występowania
zespołów
paraneoplazmatycznych
Działanie przeciwciał przeciwko
komórkom nowotworowym
• Zespół nefrytyczny
• Dermatomyositis
– rak płuca, piersi
• Acanthosis nigricans
– rak płuca, żołądka
• Myasthenia
– rak płuca
• Neuropatie obwodowe
Działanie czynników
aktywujących krzepnięcie
• Zakrzepica żylna (objaw Trousseau)
– liczne
• Zakrzepowe niebakteryjne zapalenia wsierdzia
–
zaawansowane
• DIC
– rak prostaty, niektóre białaczki

Wyniszczenie nowotworowe
– Cachexia neoplasmatica
• Spadek wagi ciała, utrata łaknienia, osłabienie,
niedokrwistość
• Metabolizm jest zwiększony i dochodzi do utraty
tkanki tłuszczowej i mięśniowej
• Jest najprawdopodobniej wynikiem działania
cytokin zwłaszcza TNF alfa (IFN gamma, IL-1). Są
one produkowane głównie przez makrofagi i
monocyty, ale także przez komórki nowotworowe
• Zmniejszenie aktywności lipazy lipoproteinowej,
zahamowanie syntezy syntazy kwasów
tłuszczowych

Molekularno-genetyczne podstawy
choroby nowotworowej
Zmiany zachodzą głównie w obrębie 4
klas genów:
• Protoonkogenów
czyli genów
stymulujących wzrost
• Genów supresorowych
transformacji
nowotworowej – antyonkogenów czyli
genów hamujących wzrost
• Genów kontrolujących apoptozę
• Genów regulujących naprawę
uszkodzonego DNA

Onkogeny
• W prawidłowych komórkach znajdują się geny
zwane
protoonkogenami
, które są
odpowiedzialne za procesy wzrostu i
różnicowania komórek oraz pośredniczą w
przekazywaniu sygnałów międzykomórkowych
zwłaszcza w czasie embriogenezy i procesów
gojenia (onc).
• Szereg mechanizmów może prowadzić do
aktywacji protoonkogenów, czyli do zmiany ich
struktury (w następstwie czego będą kodowane
nieprawidłowe białka) lub do zaburzeń ich
ekspresji. Stają się wówczas
onkogenami
(c-onc).

Mechanizmy aktywacji
protoonkogenów
• Mutacje punktowe.
Najlepiej znana jest mutacja genu
ras. 10-20% wszystkich nowotworów ma taką
mutację. 90% raków trzustki.
• Translokacje chromosomowe
. Mogą spowodować
przeniesienie protoonkogenu w sąsiedztwo
promotora lub sekwencji wzmacniającej, co powoduje
nadekspresję protoonkogenu. Typowy przykład to
chłoniak Burkitta t(8;14)(q24;q32) – przeniesienie c-
myc w sąsiedztwo genu dla łańcuchów ciężkich
immunoglobulin, co powoduje ciągłą stymulację i
nadekspresję c-myc. Translokacja może również
spowodować mutację protoonkogenu lub fuzję dwóch
genów przez co powstaje hybryda będąca nowym
onkogenem np. chromosom Philadelphia występujący
w przewlekłej białaczce szpikowej

Mechanizmy aktywacji
protoonkogenów
• Amplifikacja genów.
Jest to
zwielokrotnienie liczby kopii prawidłowego
protoonkogenu, co skutkuje zwiększoną
ilością białka. Np. amplifikacja erb-B2 w
rakach piersi
• Inne: rekombinacja, delecja, rearanżacja
• Poddanie protoonkogenu kontroli silnego
promotora lub sekwencji wzmacniającej

Onkoproteiny
Produkty białkowe onkogenów
• Czynniki wzrostu i ich receptory
• Białka przekaźnikowe
• Czynniki transkrypcyjne
• Czynniki regulujące cykl komórkowy
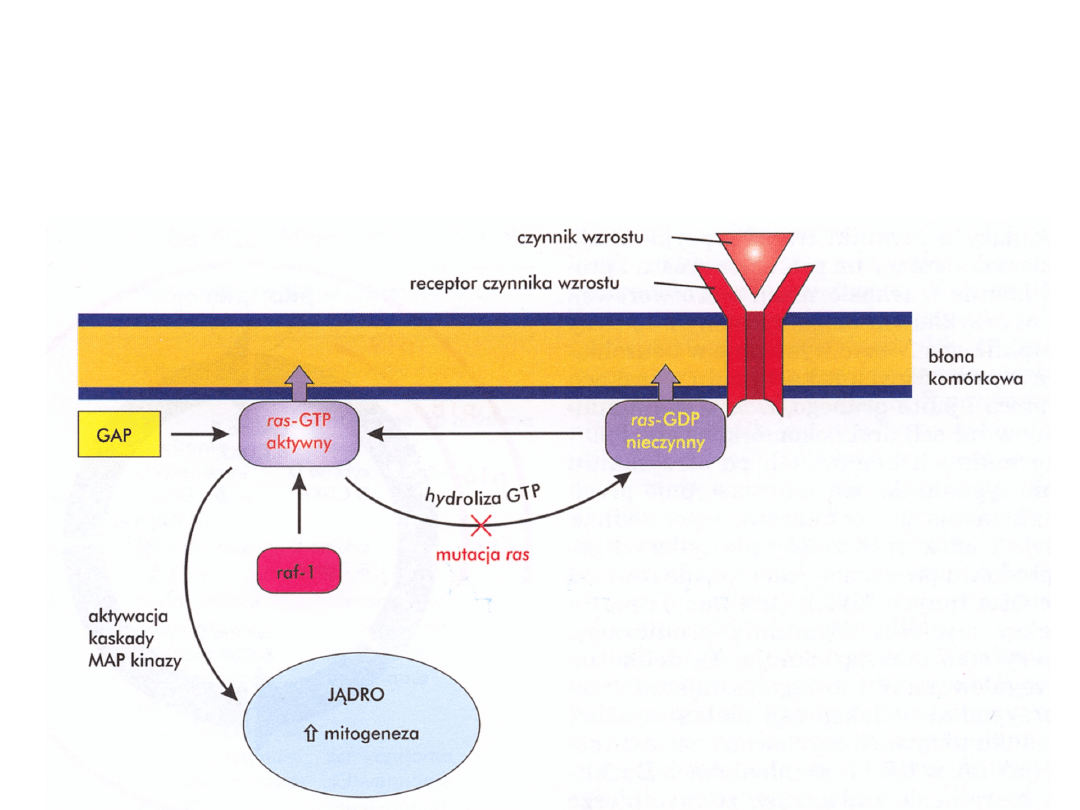
Uproszczony schemat
przekazywania sygnału do
proliferacji

Czynniki wzrostu i ich
receptory
• FGF, EGF, TGF-alfa, PDGF, IGF. Czynniki wzrostu
łączą się ze swoistymi receptorami (FGFR,
EGFR,TGFR, PDGFR) w błonie komórkowej i
zapoczątkowują przekazywanie sygnałów
dotyczących wzrostu, różnicowania i proliferacji
komórki.
• Mutacje powodują permanentną aktywację
receptorów dla czynników wzrostu; amplifikacje
uwrażliwiają receptory na bardzo niewielką
podprogową ilość tych czynników; rearanżacje
powodują powstanie genu, który koduje domeny
wewnątrzkomórkowe receptora, która jest
permanentnie aktywowana
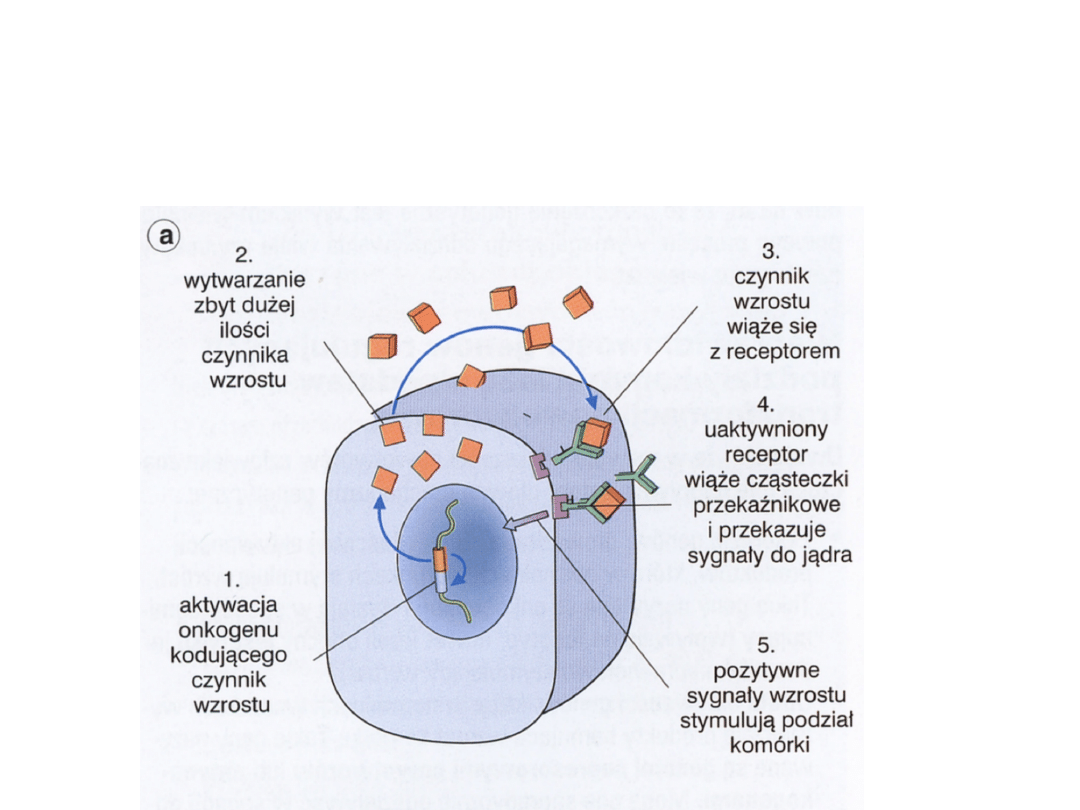
Aktywacja onkogenu kodującego
czynniki wzrostu
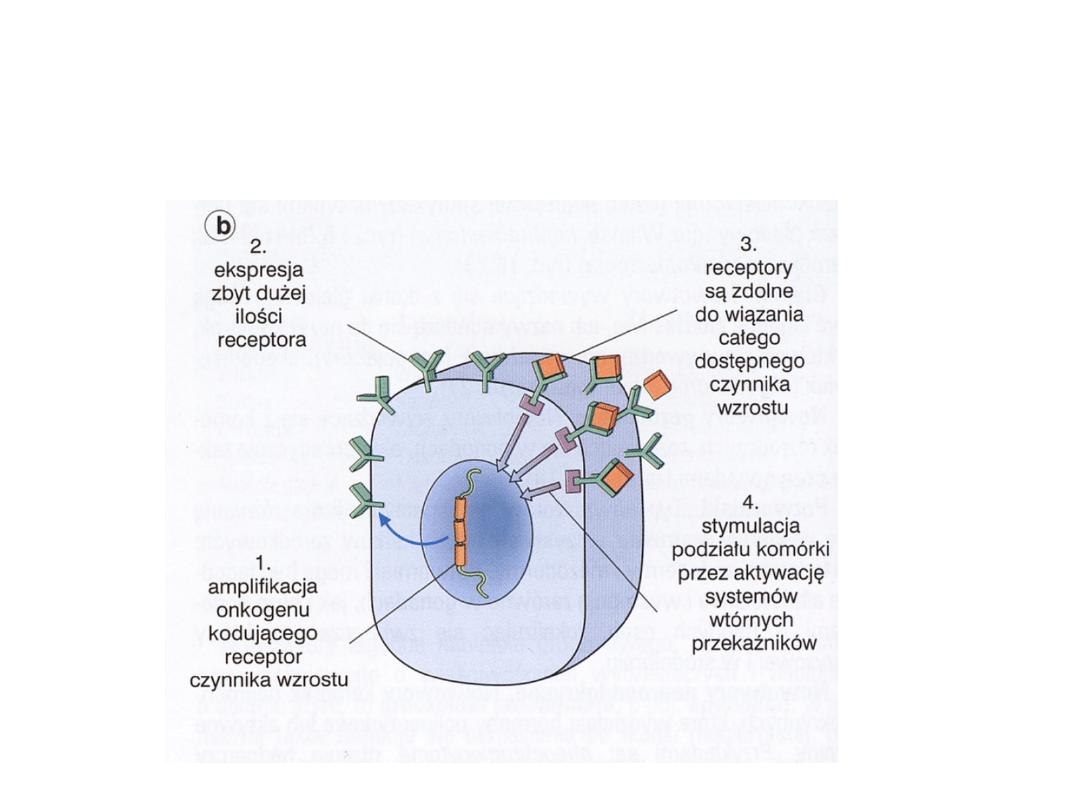
Aktywacja onkogenu kodującego
receptory dla czynników wzrostu

Czynniki wzrostu i ich
receptory
Czynniki wzrostu
• PDGF – sis – nadekspresja – astrocytoma,
osteosarcoma
• FGF – hst-1 – nadekspresja – rak żołądka
• FGF – int-2 – amplifikacja – rak sutka
Receptory
• EGFR – erb-B1 – nadekspresja – rak płuca, pęcherza
moczowego
• EGFR – erb-B2 – amplifikacja – rak sutka, jajnika,
żołądka
• GDNFR – ret – mutacja – MEN2A i 2B
• GDNFR – ret – rearanżacja – rak brodawkowaty tarczycy
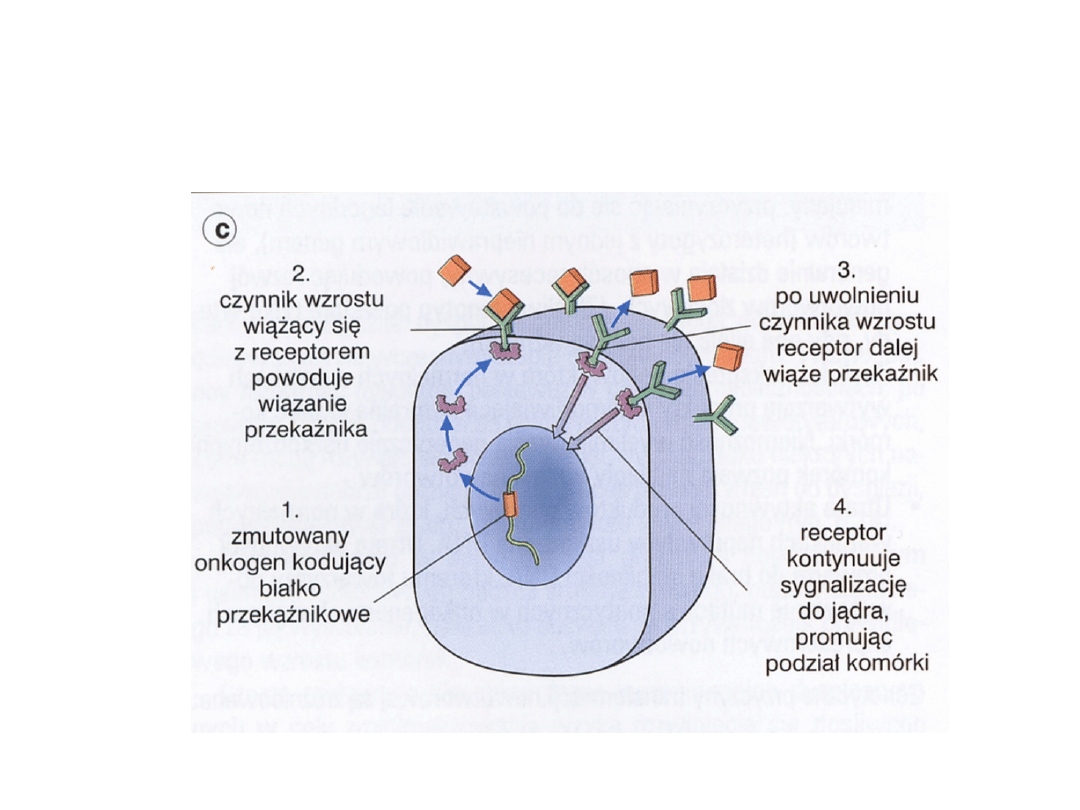
Aktywacja onkogenu kodującego
białka przekaźnikowe

Onkoproteiny i ich związek z
nowotworzeniem
Białka przekaźnikowe
• Kinazy tyrozynowe: src – mutacja - mięsaki
abl – translokacja – PBSz,
OBL
• Białka wiążące GTP: ras – mutacja – raki, mięsaki
• Kinazy serynowo-tyrozynowe – mas – mutacja-
białaczki
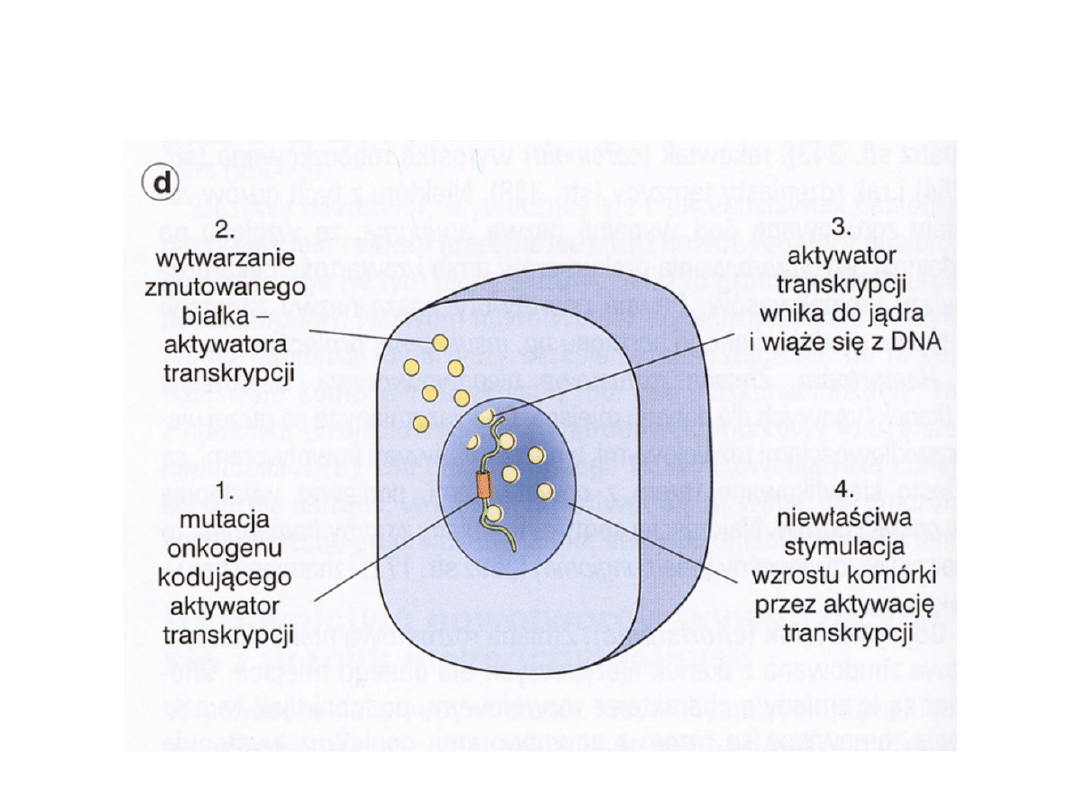
Aktywacja onkogenu kodującego
aktywatory transkrypcji

Onkoproteiny i ich związek z
nowotworzeniem
Aktywatory transkrypcji
• myc – translokacja – chłoniak
Burkitta
• N-myc – amplifikacja –
neuroblastoma
• L-myc – amplifikacja – rak
drobnokomórkowy płuca
• myb – mutacja – białaczki

Onkoproteiny i ich związek z
nowotworzeniem
Czynniki regulujące cykl
komórkowy
• Cykliny – cyklina D – *amplifikacja
rak sutka, wątroby, przełyku
*translokacja –
chłoniak grudkowy
• Kinazy cyklinozależna – CDK4 – mutacja,
amplifikacja – glejak, mięsak, czerniak

Molekularno-genetyczne podstawy
choroby nowotworowej
Zmiany zachodzą głównie w obrębie 4
klas genów:
• Protoonkogenów
czyli genów
stymulujących wzrost
• Genów supresorowych
transformacji
nowotworowej – antyonkogenów czyli
genów hamujących wzrost
• Genów kontrolujących apoptozę
• Genów regulujących naprawę
uszkodzonego DNA

Geny supresorowe
• Białka kodowane przez geny
supresorowe hamują proliferację
komórek
• Mutacje tych genów, zarówno
somatyczne jak i wrodzone, są
związane z licznymi nowotworami

Geny supresorowe
Rb – retinoblastoma, osteosarcoma
p53 – zespół Li Fraumeni, większość
nowotworów
BRCA-1 i BRCA-2 – rak sutka, rak jajnika
WT-1 – guz Wilmsa
NF-1 i NF-2 – neurofibromatosis, schwannoma,
meningioma
E-kadheryna – rak żołądka, rak piersi
RTGF-beta – rak jelita grubego
VHL – zespół von Hippel-Lindau
APC – gruczolakowatość jelita grubego

Gen Rb (retinoblastoma)
• Koduje on białko pRb, które odgrywa
kluczową rolę w kontroli cyklu komórkowego;
w postaci aktywnej uniemożliwia przejście z
fazy G1 do S oraz uniemożliwia replikację
przez wiązanie się z czynnikami
transkrypcyjnymi z grupy E2F
• Był pierwszym poznanym genem
supresorowym
• Umiejscowiony jest na chromosomie 13q14

Gen Rb (retinoblastoma)
•
W przypadkach dziedzicznych we wszystkich
komórkach organizmu brakuje jednego allelu Rb
wskutek delecji lub mutacji punktowej. Jeśli w jednym
z retinoblastów dojdzie do mutacji drugiego allela
nastąpi utrata heterozygotyczności; obydwa allele są
inaktywowane i rozwija się nowotwór. Rozwój
nowotworu wymaga więc wystąpienia dwóch mutacji
(hipoteza Knudsona)
•
Siatkówczaki dziedziczne występują w młodszym
wieku, są najczęściej obustronne i wieloogniskowe.
Dzieci te mają również większe ryzyko zachorowania
na osteosarcoma i inne mięsaki tkanek miękkich
•
W przypadkach sporadycznych mutacje somatyczne
muszą wystąpić w obu allelach genu Rb w jednym
retinoblaście

p53
Gdy dojdzie do uszkodzenia
DNA w normalnej komórce,
p53 stymulując aktywację
transkrypcji odpowiednich
genów, zatrzymuje ją w fazie
G1 i kieruje komórkę na drogę
naprawy DNA, a jeżeli ta się
nie uda, na drogę apoptozy.

p53
• Białko p53 uniemożliwia wejście w cykl komórkowy
komórkom z uszkodzonym DNA
• Uszkodzenie DNA powoduje aktywację p53 i wzrost ilości
jego produktu białkowego (nie ulega degradacji), który
wiąże się z DNA i powoduje uruchomienie transkrypcji
różnych genów, które biorą udział w naprawie DNA lub
apoptozie i syntetyzowanie odpowiednich białek
p21/WAF
– hamuje tworzenie kompleksów cyklina/CDK,
co uniemożliwia fosforylację pRb i nie pozwala na wejście
komórki w fazę S
GADD45
(growth arrest and DNA damage) – białko to
bierze udział w zahamowaniu cyklu w fazie G1, a
jednocześnie w naprawie DNA
Bax
– białko kodowane przez bax wiąże i unieczynnia
bcl-2, które jest białkiem hamującym apoptozę

Gen p53
•
Zlokalizowany na chromosomie 17p13
•
Najczęściej występująca zmiana genetyczna w
nowotworach (w ponad połowie nowotworów
człowieka)
•
Zespół Li Fraumeni – dziedziczna mutacja w jednym
allelu każdej komórki organizmu
•
Druga mutacja (zgodnie z hipotezą Knudsona)
wywołuje utratę heterozygotyczności w locus genu
p53
•
Zespół Li Fraumeni – różne nowotwory (mięsaki, rak
sutka, guzy mózgu, białaczki, raki kory nadnercza);
liczne nowotwory u jednego chorego; młody wiek
zachorowania na nowotwory (25x większe ryzyko
wystąpienia nowotworu złośliwego do 50 rż)

BRCA-1 i BRCA-2
• Umiejscowiony na chromosomie
17q21(BRCA-1) i 13q12 (BRCA-2).
Przypuszcza się, że mogą być one
zaangażowane w naprawę DNA i regulację
transkrypcji
• Mutacje te występują niezwykle rzadko w
sporadycznych rakach piersi
• W 80% raków występujących rodzinnie (5-
10%) stwierdza się mutacje tych genów

BRCA-1 i BRCA-2
• Dla nosicieli mutacji w BRCA-1 ryzyko
wystąpienia raka piersi wynosi 70% w wieku
80lat oraz dodatkowo występuje zwiększone
ryzyko wystąpienia raka jajnika i jelita
grubego
• Dla nosicieli mutacji BRCA-2 ryzyko
wystąpienia raka piersi wynosi ponad 60%
w wieku 70 lat (10 lat wcześniej niż w
mutacjach BRCA-1) oraz dodatkowo istnieje
zwiększone ryzyko wystąpienia raka jajnika i
pęcherza moczowego u kobiet, a raka piersi
i gruczołu krokowego u mężczyzn.

Gen APC
(adenomatoums polyposis coli)
• Białko APC występuje w cytoplazmie, gdzie pełni
rolę negatywnego regulatora funkcji przekaźnikowej
beta-kateniny. Inaktywacja APC podnosi poziom
beta-kateniny w cytoplazmie, która przemieszcza
się do jądra stymulując proliferację komórki
• Obniżona adhezyjność komórkowa w nowotworach
może być związana z zaburzeniami wiązania beta-
kateniny z cytoplazmatyczną domeną E-kadheryny
• Mutacje genu APC w polipowatości gruczolakowej
rodzinnej jelita grubego (szereg dodatkowych
mutacji doprowadza do powstania raka w niektórych
polipach) oraz w czerniakach

NF-1 i NF-2
• Białko kodowane przez NF-1 (neurofibromina)
aktywuje GTP-azę i powoduje przejście ras w
postać nieaktywną. Gdy NF-1 jest zmutowany – ras
pozostaje permanentnie w postaci aktywowanej
• Zmutowany jeden allel – neurofibromatosa typu I
oraz zwiększone ryzyko guza Wilmsa,
rhabdomyosarcoma, PBSz, meningioma,
pheochromocytoma
• Białko kodowane przez NF-2 (merlina) wiąże się z
aktyną i białkiem CD44. Mutacje zaburzają
przekazywanie sygnałów na granicy macierz
komórkowa/komórka
• Mutacje – neurofibromatosa typu II oraz zwiększone
ryzyko oponiaków, wyściółczaków, glejaków

Molekularno-genetyczne podstawy
choroby nowotworowej
Zmiany zachodzą głównie w obrębie 4
klas genów:
• Protoonkogenów
czyli genów
stymulujących wzrost
• Genów supresorowych
transformacji
nowotworowej – antyonkogenów czyli
genów hamujących wzrost
• Genów kontrolujących apoptozę
• Genów regulujących naprawę
uszkodzonego DNA

Geny regulujące apoptozę
• Geny hamujące apoptozę – bcl-2, bcl-xL
• Geny proapoptotyczne – bax, bcl-xS,
bad
• Zahamowanie apoptozy może ułatwić
transformację nowotworową, gdyż
wydłuża okres życia komórek, przez co
zwiększa się liczebność populacji
komórek narażonych na działanie
czynników mutagennych
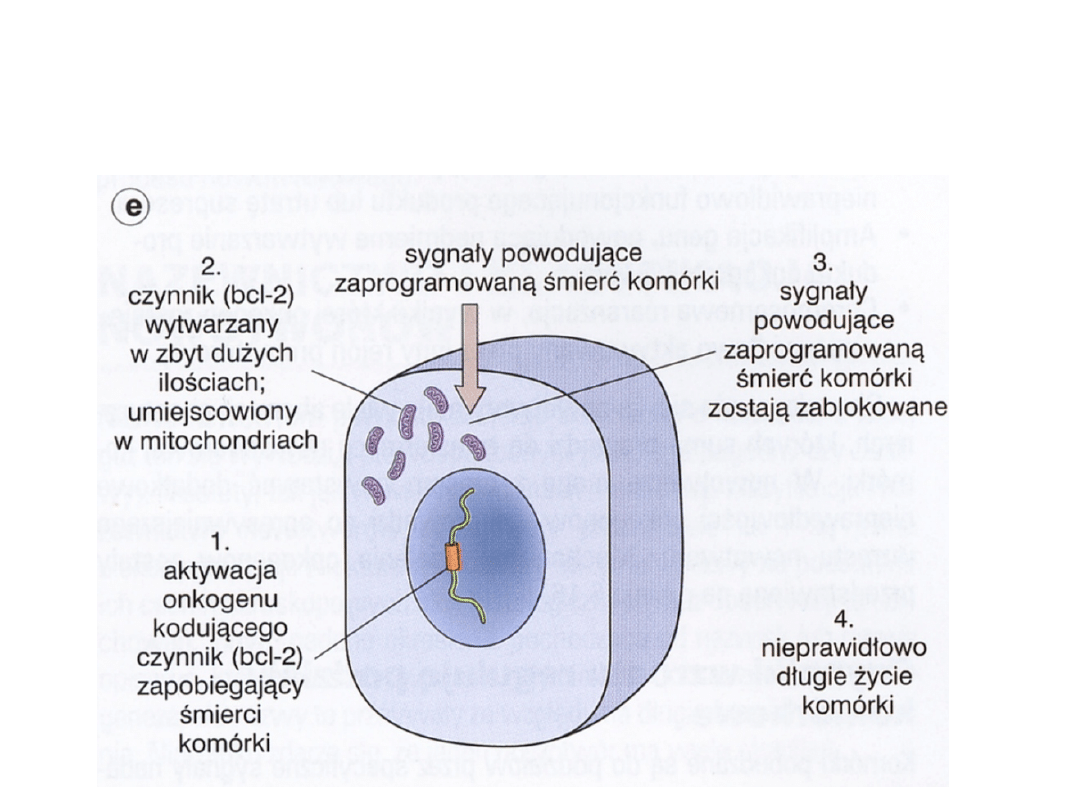
Aktywacja onkogenu
regulującego apoptozę

Molekularno-genetyczne podstawy
choroby nowotworowej
Zmiany zachodzą głównie w obrębie 4
klas genów:
• Protoonkogenów
czyli genów
stymulujących wzrost
• Genów supresorowych
transformacji
nowotworowej – antyonkogenów czyli
genów hamujących wzrost
• Genów kontrolujących apoptozę
• Genów regulujących naprawę
uszkodzonego DNA

Geny regulujące naprawę
DNA
• Komórki organizmu w ciągu całego życia
narażone są na działanie czynników
mutagennych – uszkodzenia DNA są częste i
naturalne
• Istnieją mechanizmy odpowiedzialne za
naprawę tych błędów
• Geny naprawcze błędnie sparowanych zasad
(mismach repair genes) czyli geny mutatory.
Dziedziczą się one jak geny supresorowe, lecz
ich produkty białkowe nie mają
bezpośredniego wpływu na proces proliferacji
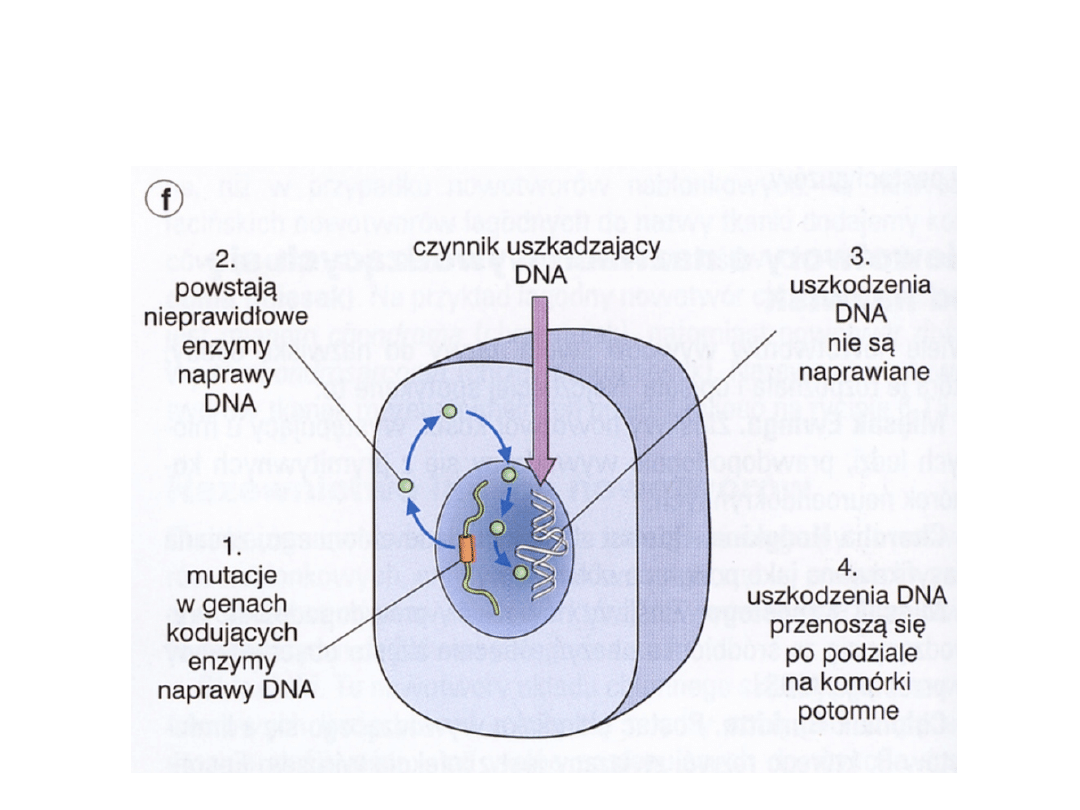
Aktywacja genów kontrolujących
naprawę DNA

Geny regulujące naprawę
DNA
• Mutacje w tych genach – gromadzenie w
komórkach błędów replikacyjnych w różnych
genach (supresorowych, protoonkogenach)
• Może to prowadzić do transformacji
nowotworowej i występowania rodzinnie
uwarunkowanych zespołów predyspozycji do
niektórych nowotworów np. zespół Lyncha
czyli HNPCC (hereditary non polyposis colon
cancer), ataxia teleangiectatica, xeroderma
pigmentosum itp

Telomery i telomeraza
• Telomery znajdują się na końcach
chromosomu i ulegają skróceniu przy
każdym podziale mitotycznym. Gdy
zostaną skrócone poza pewną granicę
komórka przestaje się dzielić i obumiera.
• Telomeraza zapobiega skracaniu telomerów
• W wielu nowotworach stwierdza się
obecność telomerazy lub innych
mechanizmów wydłużających telomery, co
umożliwia nieustanną proliferację komórek.

Dziękuję za uwagę
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
- Slide 40
- Slide 41
- Slide 42
- Slide 43
- Slide 44
- Slide 45
- Slide 46
- Slide 47
- Slide 48
- Slide 49
- Slide 50
- Slide 51
- Slide 52
- Slide 53
- Slide 54
- Slide 55
- Slide 56
- Slide 57
- Slide 58
- Slide 59
- Slide 60
- Slide 61
- Slide 62
- Slide 63
Wyszukiwarka
Podobne podstrony:
NOWOTWORY CZ. III, IV rok Lekarski CM UMK, Patomorfologia, patomorfologia, ćwiczenia, semestr zimowy
NOWOTWORY CZ. I, IV rok Lekarski CM UMK, Patomorfologia, patomorfologia, ćwiczenia, semestr zimowy,
Nowotwory cz 1
NOWOTWORY CZ. I (2), IV rok Lekarski CM UMK, Patomorfologia, patomorfologia, ćwiczenia, semestr zimo
NOWOTWORY CZ.II, IV rok Lekarski CM UMK, Patomorfologia, patomorfologia, ćwiczenia, semestr zimowy,
NOWOTWORY CZ IV
Wyleczenie ze wszystkich nowotworów cz 1
Wyleczenie ze wszystkich nowotworów cz 3
Nowotwory gruczolu sutkowego u psow i kotow cz I
Nowotwory gruczolow dokrewnych wyklad cz 2
Nowotwory narządu ruchu cz IV
Nowotwory nabłonkowe cz III
Nowotwory tkanki podskórnej cz I
Nowotwory narządu ruchu i psów i jkotów kostniakomięsaki cz I
nowotwory komórek tucznych u psów cz 1
Biol kom cz 1
więcej podobnych podstron