
IZOMERIA

.
Izomeria jest to zjawisko istnienia związków chemicznych o
identycznym wzorze sumarycznym lecz różnej strukturze
cząsteczek.
Związki o takim samym wzorze cząsteczkowym, ale różnej
budowie nazywamy związkami izomerycznymi, albo po
prostu izomerami.
Związki spełniające ten warunek, różnią się właściwościami
chemicznymi i fizycznymi z wyjątkiem masy molowej.
Rodzaje izomerii:
Izomeria strukturalna
Izomeria
przestrzenna
(konstytucyjna):
(stereoizomeria):
izomeria łańcuchowa izomeria geometryczna
(cis-trans)
izomeria podstawienia (położenia) izomeria optyczna
izomeria funkcyjna (metameria)
tautomeria

.
Izomeria łańcuchowa – polegająca na odmiennej
konstytucji łańcucha,
CH3
CH3-CH2-CH2-CH3
CH3-CH-CH3
np. butan
i
izobutan (2-
metylopropan)
CH3-CH2-CH2-CH2-CH3
pentan
CH3-CH-CH2-CH3
2-metylobutan
CH3
CH3
CH3 –C-CH3
2,2-dimetylopropan
CH3

.
Liczby izomerów niektórych alkenów:
liczba izomerów
METAN-
CH
4
1
ETAN-
C
2
H
6
CH
3
-CH
3
1
PROPAN-
C
3
H
8
CH
3
-CH
2
-CH
3
1
BUTAN-
C
4
H
10
CH
3
-(CH
2
)
2
-CH
3
2
PENTAN-
C
5
H
12
CH
3
-(CH
2
)
3
-CH
3
3
HEKSAN-
C
6
H
14
CH
3
-(CH
2
)
4
-CH
3
5
HEPTAN-
C
7
H
16
CH
3
-(CH
2
)
5
-CH
3
9
OKTAN-
C
8
H
18
CH
3
-(CH
2
)
6
-CH
3
18
NONAN-
C
9
H
20
CH
3
-(CH
2
)
7
-CH
3
35
DEKAN-
C
10
H
22
CH
3
-(CH
2
)
8
-CH
3
75
.
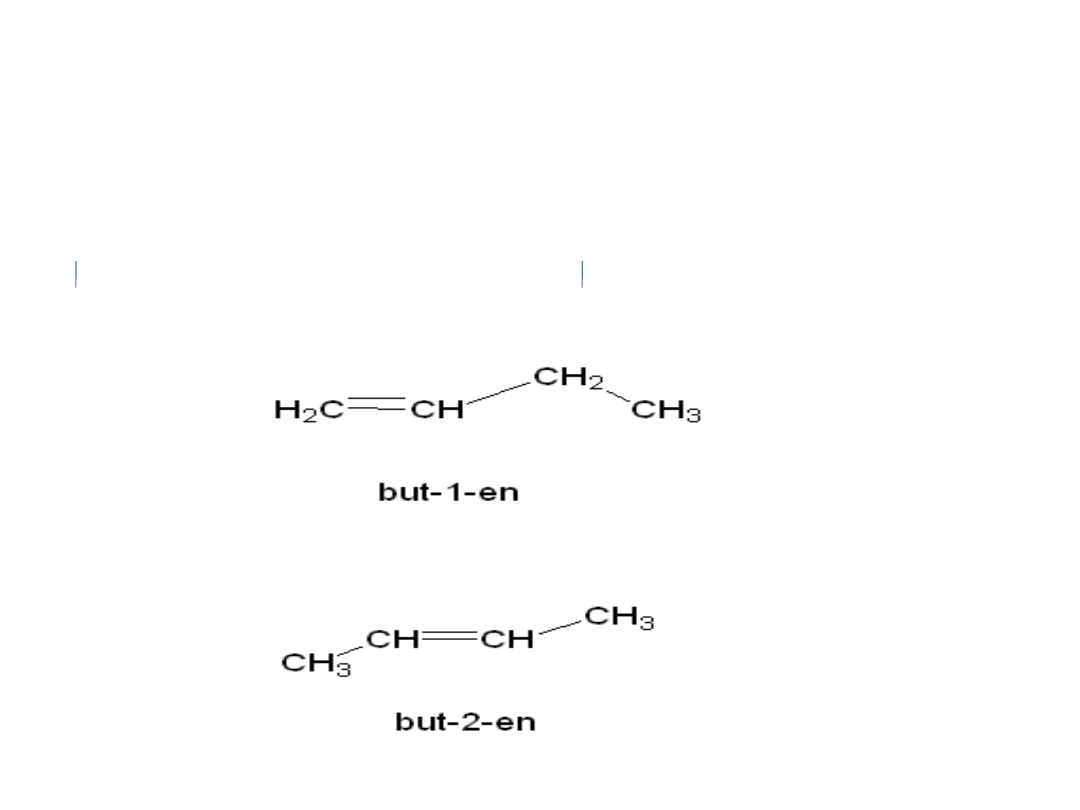
Izomeria podstawienia – polegająca na różnej
pozycji zajmowanej przez podstawnik (grupę
funkcyjną lub atom inny niż wodór) lub wiązanie
wielokrotne.
CH2-CH2-CH2-CH3
CH3-CH-CH2-CH3
Cl
Cl
np. 1-chlorobutan i
2-chlorobutan
• 1-buten
• 2-buten

.
Izomery podstawienia spotykamy często w związkach
alifatycznych jak i aromatycznych.
W związkach cyklicznych, izomeria ta występuje dopiero przy
dwóch podstawnikach, lub w przypadku niehomogennego
pierścienia (pierścień zbudowany z różnych pierwiastków -
heterocykle). Generalnie izomeria podstawienia występuje
tam gdzie możliwe jest jednoznaczne określenie miejsca
podstawienia.
.
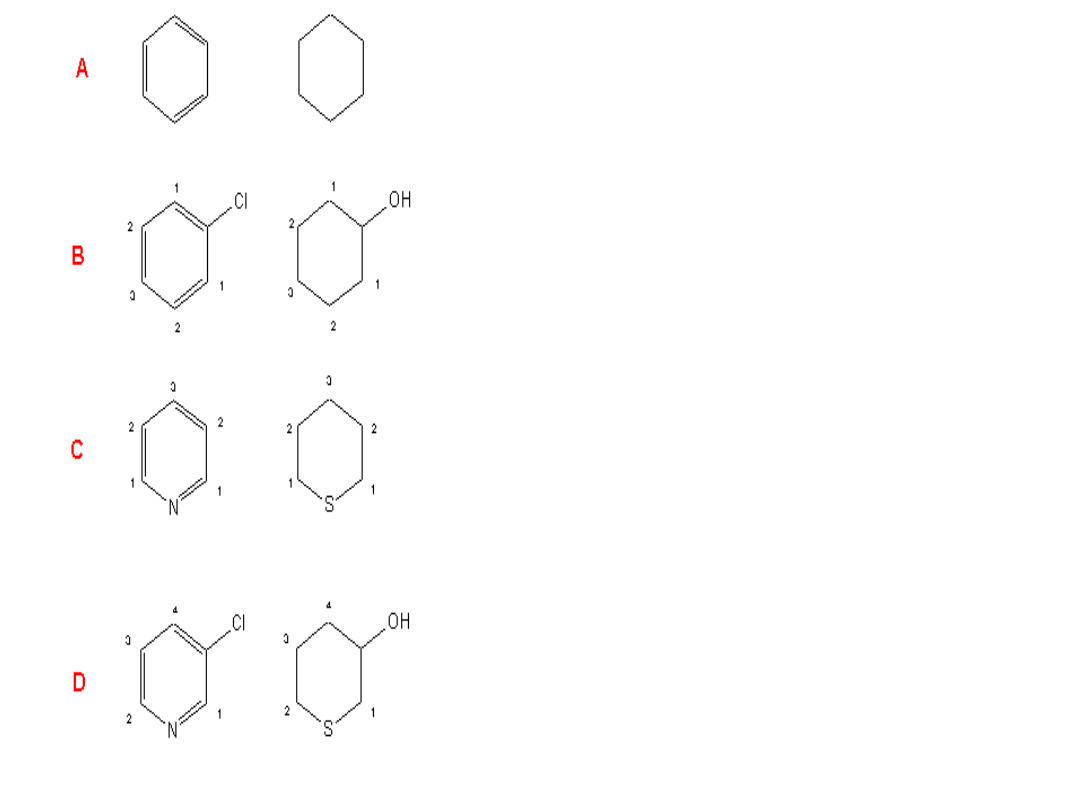
Przykład związków A (benzen i cykloheksan) to
przykład związków na tyle symetrycznych, że każda
pozycja podstawienia (każdy atom węgla
pierścienia) jest równocenna. Nie mogą zatem
istnieć tu izomery jednopodstawione.
Związki B są też symetryczne, lecz podstawnik tę
symetrie zakłóca. Następny podstawnik może zająć
pozycje 1,2 lub 3. Mogą zatem istnieć trzy
dwupodstawione izomery.
W przypadku C jest podobnie. Zakłócenie idealnej
symetrii cząsteczki z przypadku A powoduje
powstanie trzech różniących się miejsc
podstawienia w przypadku dwupodstawionych
izomerów.
Istnienie dwóch, niesymetrycznych podstawników
(atom hetero i podstawnik) na tyle psuje symetrię
cząsteczki, że każdy nowy podstawnik może zostać
przyłączony do jednego z czterech różnych miejsc.
Zwiększyła się liczba możliwych izomerów (z trzech do
czterech).
.
Izomeria funkcyjna (metameria) – spowodowana
obecnością różnych grup funkcyjnych , np. aldehyd i keton
O
O
H3C - CH2 - C
H3C – C – CH3
H
Aldehyd propionowy Aceton
CH3 – CH2 – CH2 – NH2
CH3 – CH2 – NH
CH3
lub np. propyloamina
i
N-metylo-
etyloamina
.
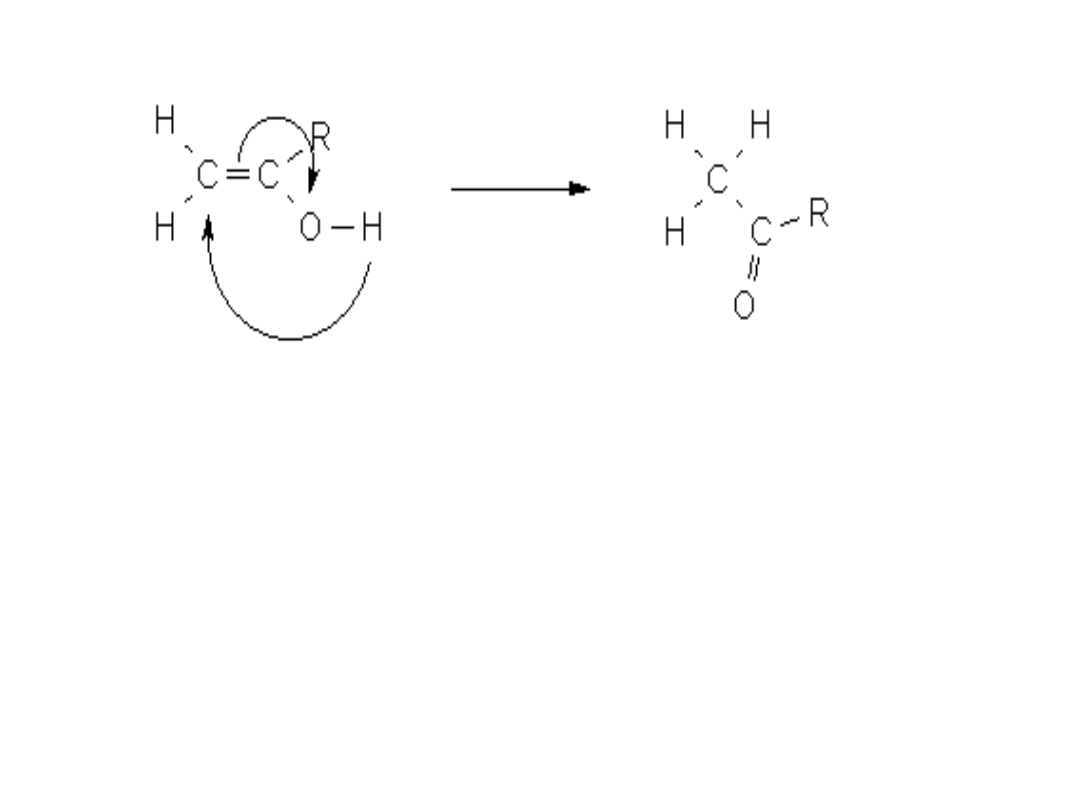
Tautomeria – zjawisko wzajemnego przemieszczania się
protonu i wiązania podwójnego w obrębie tego samego
związku. np. tautomeria keto-enolowa kwasu pirogronowego.
H O
OH
H – C – C – COOH ↔ H – C C - COOH
H
H
Keton
enol
dwie formy kwasu pirogronowego
Tautomeria amino-iminowa występuje w zasadach pirymidynowych –
związkach heterocyklicznych mających ważne znaczenie biologiczne.
NH2 NH
HN
HN
↔
O
cytozyna HO
N
N
Forma aminowa
forma iminowa
.
‘

.
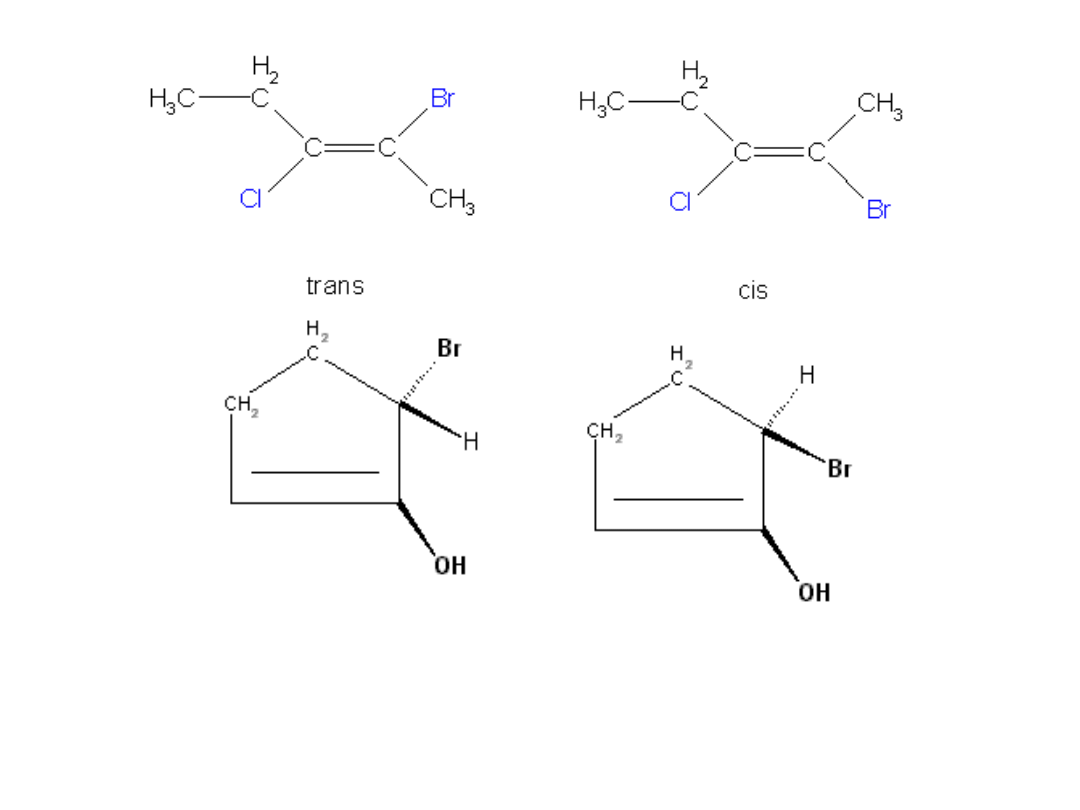
Izomeria geometryczna
jest następstwem występowania wiązania
podwójnego którego sztywność wyklucza obrót wokół niego.
Izomery geometryczne charakteryzują się identyczną strukturą co jest
przyczyną różnych właściwości fizykochemicznych. Atomy węgla
połączone wiązaniem podwójnym wraz ze związanymi z nimi
bezpośrednio podstawnikami leżą w jednej płaszczyźnie.
Izomer cis zawiera jednakowe podstawniki po jednej stronie płaszczyzny,
zaś izomer trans po przeciwnych.
Zadanie
Jednym z leków przeciwnowotworowych jest związek o wzorze
PtCl2(NH2)2, nazywany potocznie cisplatyną. Związek ten ma płaską
kwadratową budowę z atomem platyny w środku kwadratu.
Napisz wzory izomerów tego związku różniących się położeniem
podstawników.
Izomer cis (mniejsze odległości między identycznymi podstawnikami) został
nazwany cisplatyną.
Drugi nie ma właściwości leczniczych.
Przykład ten uczy, że drobne na pozór różnice w budowie cząsteczek
decyduję o ich właściwościach.
.

.
Izomeria optyczna
Jest to rodzaj stereoizomerii spowodowany chiralną budową cząsteczki.
Chiralność jest to nieidentyczność z własnym odbiciem w
płaskim zwierciadle. Cząsteczka jest chiralna, gdy posiada co
najmniej jedno centrum chiralności (warunek konieczny, ale nie
wystarczający). (
buty-chiralne)
Warunkiem koniecznym i wystarczającym do wystąpienia izomerii
optycznej związków chemicznych jest obecność centrum chiralności w
cząsteczce.
Najczęściej centrum chiralności stanowi asymetryczny atom węgla czyli
atom związany z czterema różnymi podstawnikami. Asymetryczne mogą
być także atomy innych pierwiastków, jak: Si, N, P, As, S. Aktywność
optyczną mogą wykazywać także cząsteczki chiralne, nie zawierające
asymetrycznego atomu (tzw. chiralność cząsteczkowa).
Związki chemiczne, których cząsteczki stanowią odbicie lustrzane
noszą nazwę enancjomerów. Budowę przestrzenną izomerów tego
typu przedstawia się wzorami przestrzennymi lub wzorami Fischera.
COOH
COOH
(D) H OH
HO H (L)
CH3
CH3
Odmiany enancjomeryczne kwasu mlekowego (wzory Fischera).

.
Wszystkie związki o cząsteczkach chiralnych wykazują czynność optyczną (aktywność optyczną) –
cechę polegającą na skręcaniu płaszczyzny polaryzacji światła przechodzącego przez tę substancję.
Każdy z enancjomerów skręca płaszczyznę polaryzacji w przeciwnym kierunku, ale o taki sam kąt.
Oprócz skręcalności optycznej, enancjomery różnią się szybkością reakcji ze
związkami optycznie czynnymi. Inne właściwości chemiczne i fizyczne są
identyczne. (ręce, rękawiczki, szklanka)
c
c
c
c
a
b b a a b
b a
a
b b a b a
a b
d
d
d
d
I
II
III
IV
Ponieważ cząsteczka może mieć tylko jeden obraz lustrzany, zatem wśród
czterech izomerów istnieją dwie pary enancjomeryczne (I i II oraz III i IV),
natomiast pary I – III, I – IV, II – III nie stanowią odbić lustrzanych (nie są
enancjomerami) i różnią się właściwościami chemicznymi i fizycznymi podobnie
jak izomery konstytucyjne. Stereoizomery nie będące enancjomerami noszą
nazwę diastereoizomerów.
.
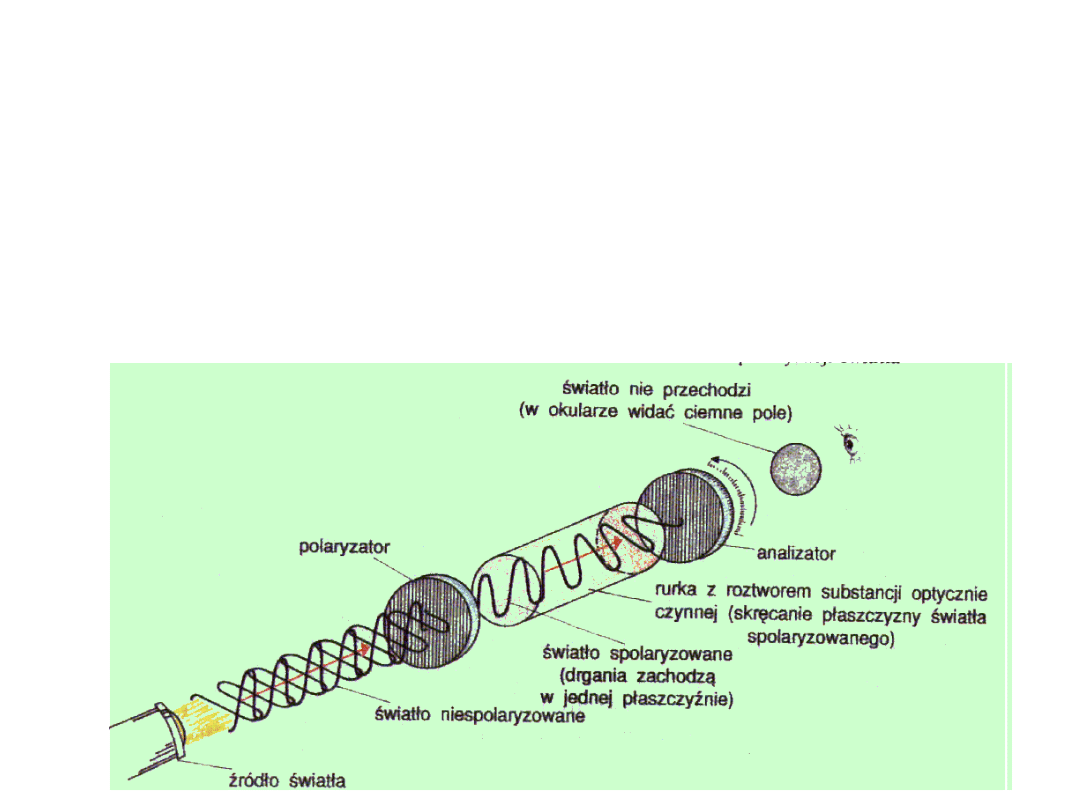
Polarymetr jest przyrządem służącym do badania czynności
optycznej i pomiaru kąta skręcenia płaszczyzny polaryzacji
przez
roztwór
badanej
substancji.
Pomiary
polarymetryczne umożliwiają identyfikację substancji oraz
określenie ich stężenia w roztworze (zastosowanie m.in. w
przemyśle cukrowniczym).
Dla danej temperatury i długości fali wielkość kąta
zależy od
rodzaju
substancji
oraz
liczby cząsteczek
znajdujących się na drodze wiązki światła
podczas jej przechodzenia przez rurkę polarymetryczną. Zdolność danej
substancji do wykazywania czynności optycznej określa tzw.
skręcalność
właściwa

.
Określ, które z poniższych cząsteczek
są chiralne. Oznacz w nich gwiazdką
asymetryczny atom węgla:
a) 2-chloropentan,
b) 1-chloropentan,
c) 1-chloro-2-metylobutan,
d) 3-bromo-3-chloropentan.
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
Wyszukiwarka
Podobne podstrony:
BT izomeria (wykład I)
Chemia wykłady, koło II sem v.3.0 - do nauki, Izomeria optyczna
Chemia wykłady, koło II sem v.3.0, Izomeria optyczna
Chemia wykłady, koło II sem v.3.01, Izomeria optyczna
Chemia wykłady, koło II sem v.3.0 długopis, Izomeria optyczna
wykład 2 z chemii izomeria
Chemia wykłady, koło II sem v.2.0, Izomeria optyczna
Wykład 13 Chemia Organiczna, izomeria, oddziaływania międzycząsteczkowe, kwasy i zasady 5fantastic p
Napęd Elektryczny wykład
wykład5
więcej podobnych podstron