
Powiązanie przemiany
węglowodanowej z przemianą
tłuszczową w normie i patologii
.
Dr Ewa Cieślar-Marczak
Katedra i Zakład Biochemii
Lekarskiej
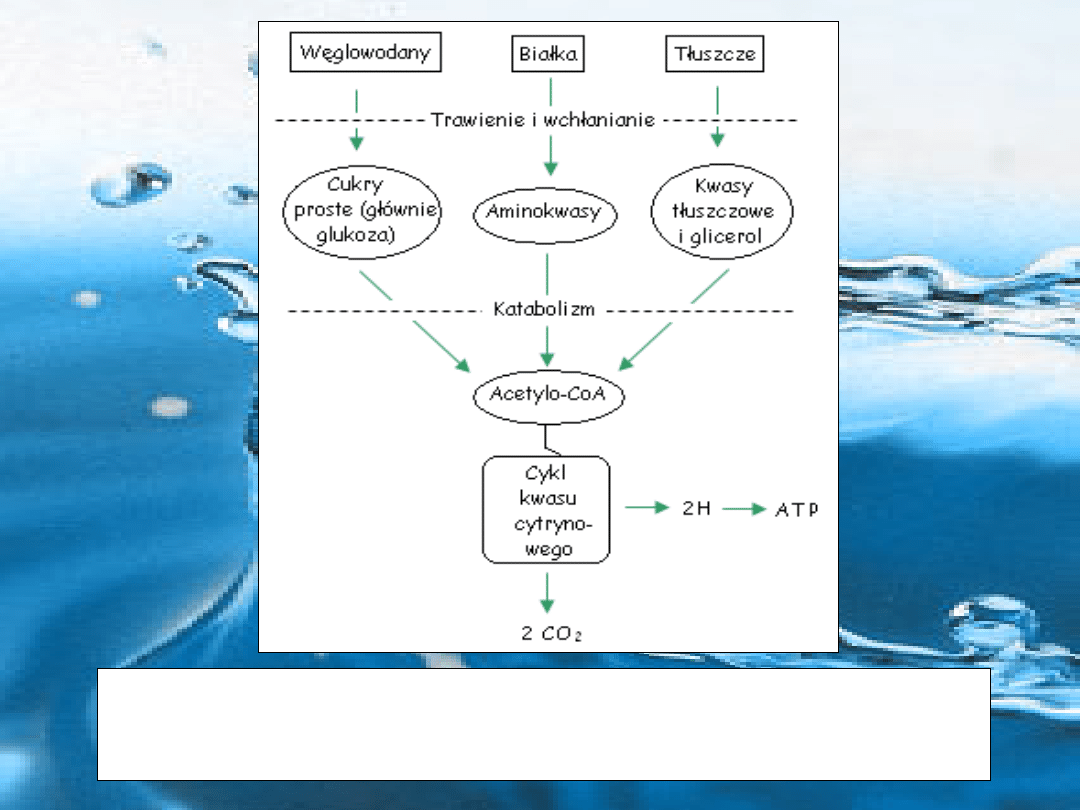
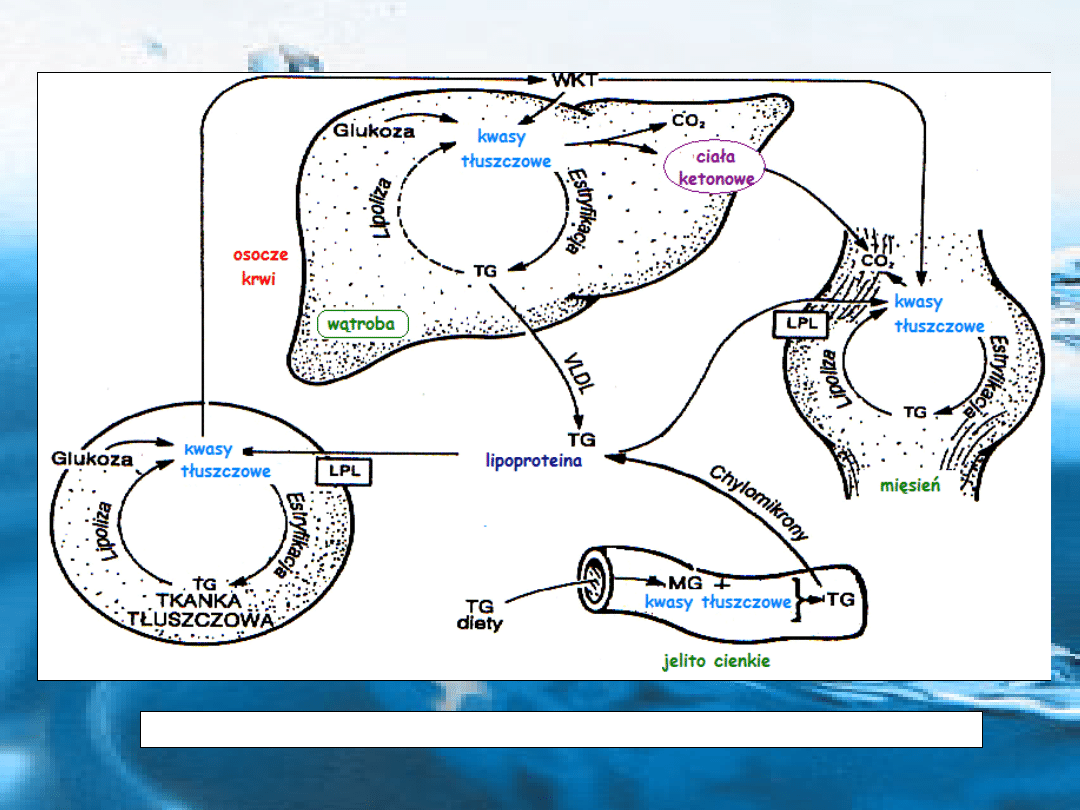
Rys. Schemat katabolizmu węglowodanów, białek i tłuszczów pokarmowych.
Szlaki katabolityczne tych związków prowadzą do wytworzenia acetylo-CoA, który
następnie jest utleniany w cyklu kwasu cytrynowego. Końcowym efektem tych
przemian jest wytworzenie ATP w procesie fosforylacji oksydacyjnej.

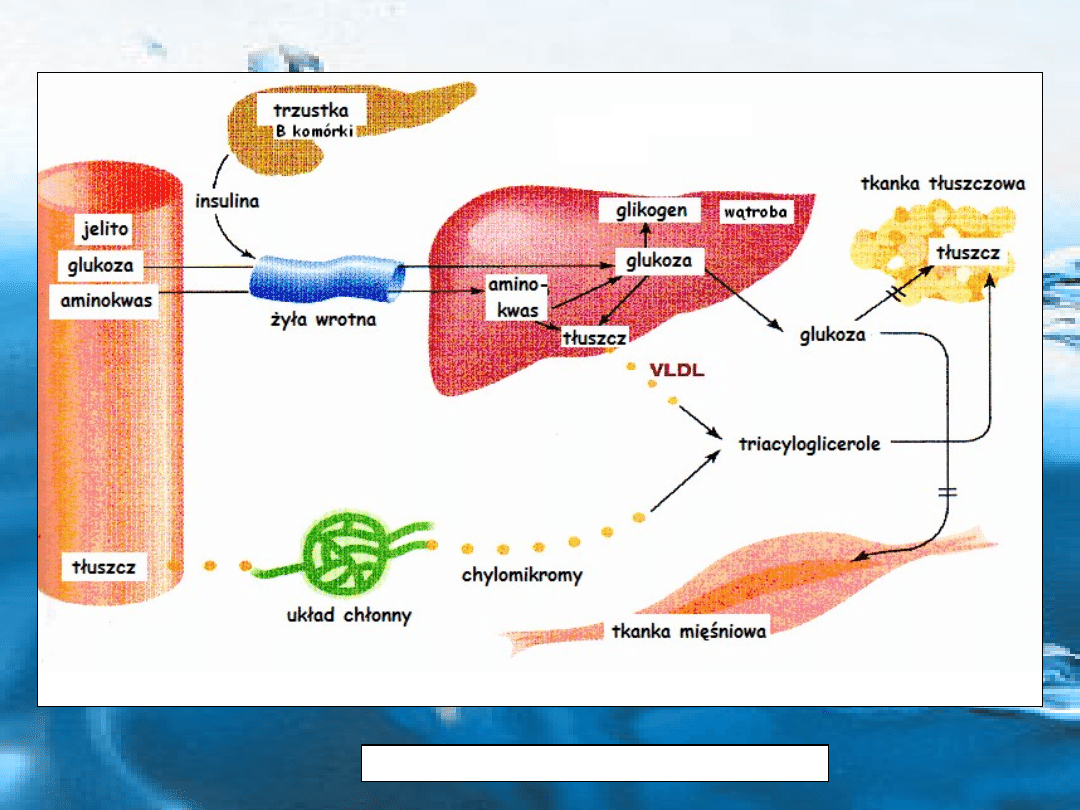
Integracja metabolizmu węglowodanów tłuszczów i białek na poziomie tkanki
i narządu poprzez krążącą krew.
Aminokwasy
( powstające w procesie trawienia białek
pokarmowych) i
glukoza
(w wyniku trawienia węglowodanów) są
wchłaniane z jelita do krwi żyły wrotnej wątroby.
Podstawową funkcją metaboliczną wątroby jest
regulowanie stężenia większości metabolitów we
krwi – głównie glukozy i aminokwasów
W przypadku glukozy odbywa się to przez wychwytywanie nadmiaru glukozy i
przekształcenie jej w glikogen (glikogenogeneza) lub w tłuszcz (lipogeneza).
Między posiłkami w celu uzupełnienia stężenia glukozy we krwi, wątroba
uwalnia ją ze zmagazynowanego glikogenu (glikogenoliza) lub wraz z nerką
przekształca metabolity niecukrowe: mleczan, glicerol i aminokwasy w glukozę
(glukoneogeneza)
Glukoza
musi być dostarczana, jako źródło energii głównie
dla układu nerwowego i erytrocytów (Poniżej krytycznego
stężenia glukozy we krwi następuje zaburzenie czynności
mózgu, w przypadku ciężkiej hipoglikemii może wystąpić
śpiączka i zgon)
Glukoza w tkance tłuszczowej stanowi
źródło 3-fosfoglicerolu → acylogliceroli
Glukoza odgrywa rolę w utrzymaniu odpowiedniego
stężenia związków pośrednich cyklu Krebsa w wielu
tkankach
Pomimo pokrycia energetycznego organizmu przez
tłuszcze, zawsze istnieje podstawowe zapotrzebowanie
na glukozę
Glukoza jest jedynym źródłem energii dla mięśni szkieletowych w
warunkach beztlenowych
Glukoza powstaje z niektórych aminokwasów, propionianu i glicerolu, a ten po
hydrolizie acylogliceroli tkanki tłuszczowej. Przetwarzany jest w glukozę drogą
glukoneogenezy w wątrobie i w nerkach.

* Zwiększenie metabolizmu
glukozy zmniejsza uwalnianie
wolnych kwasów tłuszczowych
* Gdy zużycie glukozy przez tkankę
tłuszczową ulega zwiększeniu, zmniejsza
się wypływ z niej wolnych kwasów
tłuszczowych
* Gdy zużycie glukozy jest duże to
większość pobranej glukozy jest utleniana
do CO
2
i przekształcana
w kwasy
tłuszczowe
* Gdy zużycie glukozy zmniejsza się to : - większość jej
jest przekształcana w 3-fosfoglicerol wykorzystany do
estryfikacji z acylo-CoA, proces ten pomaga
zminimalizować wpływ wolnych kwasów tłuszczowych z
tkanki tłuszczowej
Glukoza w tkance tłuszczowej może wchodzić w wiele szlaków
metabolicznych: - Utleniana do CO
2
przez cykl Krebsa,
- Utleniana w szlaku
pentozofosforanowym, -
Przekształcana w długołańcuchowe kwasy tłuszczowe,
- Wytwarzanie acyloglicerolu poprzez 3-fosfoglicero
l
,
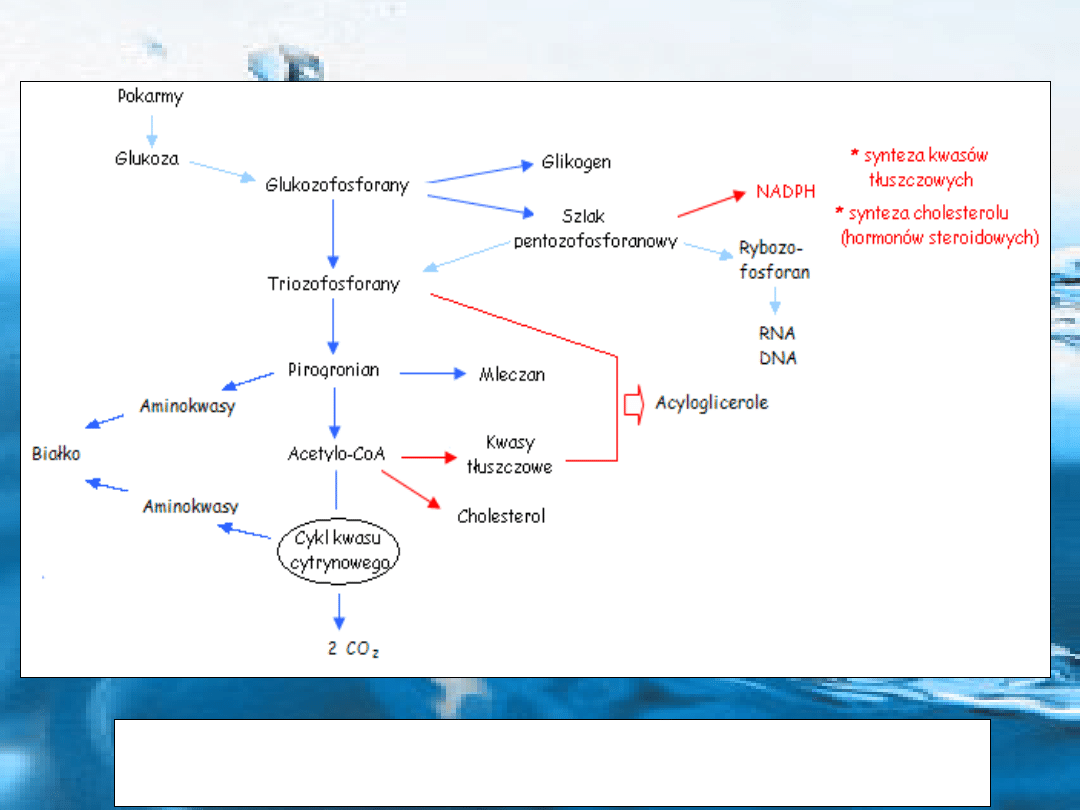
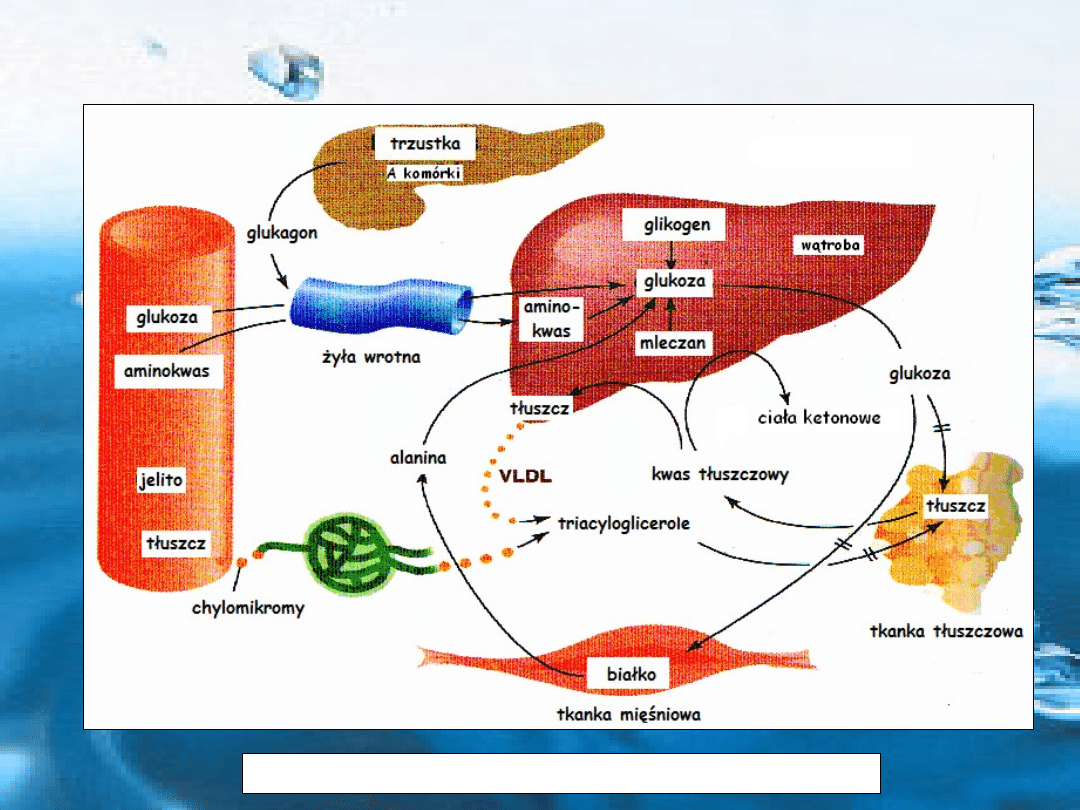
Rys. Ogólny schemat metabolizmu węglowodanów i jego główne produkty
końcowe, na czerwono pokazane połączenie metabolizmu węglowodanów z
metabolizmem tłuszczów

Insulina
– hormon peptydowy o działaniu
ogólnoustrojowym Odgrywa zasadniczą rolę w
regulowaniu stężenia glukozy we krwi.
Wytwarzana jest przez komórki β wysp
Langerhansa w trzustce.
Hormony regulujące przemianę
węglowodanów
Insulina krystaliczna
Wraz ze wzrostem poziomu insuliny we krwi następuje przyspieszenie transportu
glukozy do wnętrza komórek. Ale co ciekawe, insulina nasila transport tego cukru
przede wszystkim w mięśniach nie pracujących i w tkance tłuszczowej, bowiem w
przypadku wytężonej pracy mięśniowej glukoza ma zdolność wnikania do przestrzeni
wewnątrzkomórkowych praktycznie bez obecności insuliny.
Insulina w znaczący sposób oddziałuje na gospodarkę węglowodanowa także
wewnątrz samych komórek. Hormon ten między innymi wzmaga aktywność
enzymów odpowiedzialnych za proces spalania glukozy, w efekcie czego aż 50%
wchłoniętego cukru przekształcane jest w energię. Jednocześnie insulina powoduje
wzrost aktywności enzymu - syntazy glikogenowej, w konsekwencji czego dochodzi
do nasilonej zamiany glukozy w glikogen mięśniowy i wątrobowy.

Insulina pobudza lipogenezę w tkance tłuszczowej dostarczając:
1. Acetylo CoA i NADPH niezbędnych do syntezy kwasów tłuszcowych,
2. Wpływa na aktywnośc karboksylazy Acetylo CoA ,
3. Dostarcza glicerolu niezbędnego do syntezy trójglicerydów.
W niedoborze insuliny aktywność tych enzymów jest obniżona, przez co spada
nasilenie lipogenezy
Inną przyczyną obniżonej lipogenezy, przy niedoborze insuliny są WKT
uwalniane w dużych ilościach przez kilka hormonów normalnie blokowanych
przez insulinę
Wzrost stężenia WKT jest przyczyną hamowania ich własnej syntezy na
zasadzie sprzężenia zwrotnego (poprzez hamowanie karboksylazy acetylo CoA)
Insulina wpływa na powstawanie VLDL i LDL. U chorych z niekontrolowaną cukrzycą
wzrasta stężenie tych frakcji, a w związku z tym wzrasta stężenie cholesterolu. Jest to
przyczyną przyspieszonego rozwoju miażdżycy u chorych na cukrzycę.
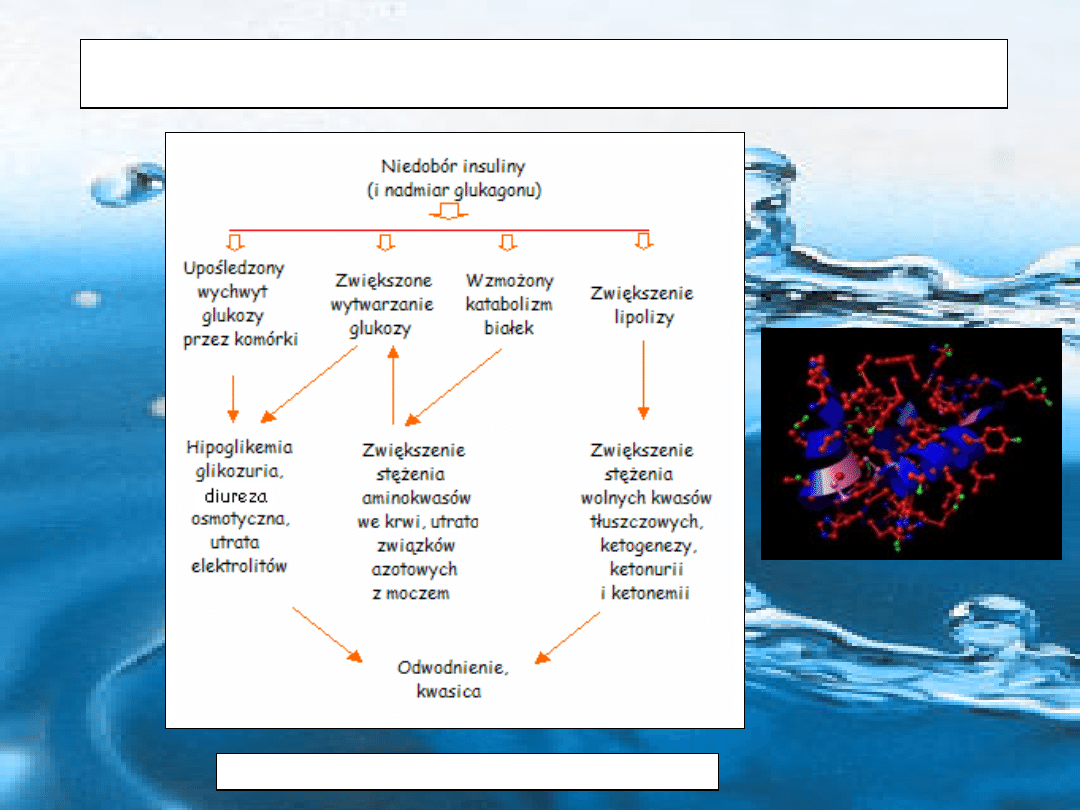
Rys. Patofizjologia niedoboru insuliny.
Rolę i znaczenie insuliny w przemianie węglowodanowej, tłuszczowej i
białkowej można najlepiej ocenić w stanach jej niedoboru u człowieka

Hormon ten ma znaczenie w gospodarce węglowodanowej
ponieważ: *
wykazuje działanie antagonistycznie w stosunku do insuliny,
które przede wszystkim objawia się zwiększeniem stężenia
glukozy we krwi i jednocześnie zmniejsza poziom glikogenu w
wątrobie. * aktywuje enzym
rozszczepiający glikogen (fosforylazę glikogenową wątroby).
*
pobudza też lipolizę i glukoneogenezę
* jego wydzielanie jest pobudzane przez hipoglikemię.
Inne hormony zwiększające stężenie glukozy we krwi
(działające antagonistycznie do insuliny) :
- hormon wzrostu,
- hormon kortykotropowy
(ACTH), -
glikokortykosteroidy,
- adrenalina,
- hormony tarczycy
Hormony regulujące przemianę
węglowodanów cd.
Glukagon
- jest polipeptydowym hormonem
wytwarzanym przez komórki A (α) wysp
trzustkowych.

Wysokie stężenie glukozy –
hiperglikemia
,
powyżej normy (5,5mmol/l-100mg%) wpływa na
funkcjonowanie nerek
Glukoza jest nieustannie przesączana w kłębuszkach nerkowych. Gdy
stężenie glukozy jest podwyższone przesącz kłębuszkowy może
zawierać jej więcej, niż zdąży ulec zwrotnemu wchłonięciu w kanalikach;
nadmiar przechodzi do moczu i powodując glikozurię. Glikozuria często
bywa objawem cukrzycy.
Przyczyną hipoglikemii jest m.in.: upośledzenie utleniania kwasów
tłuszczowych
*
Niedobór karnityny (okresowa hipoglikemia powoduje zmniejszoną
glukoneogenezę i ketogenezę przy równoczesnym zwiększeniu stężenia WKT
w osoczu → nagromadzenie lipidów i osłabienie mięśni)
*
Dziedziczny niedobór palmitoilotransferazy karnitynowej I (wątroba) →
zmniejszenie utleniania WKT i ketogeneza
*
Dziedziczne defekty enzymów β oksydacji – hipoglikemia bez ketozy,
śpiączka i stłuszczenie wątroby
Kliniczne znaczenie zaburzenia stężenia
glukozy
Niebezpieczeństwo
hipoglikemii
–
niskie stężenie glukozy poniżej
45mg%

Hipoglikemia
może występować w czasie ciąży i u
noworodków. W czasie ciąży wzrasta spożycie glukozy
przez dziecko i dlatego istnieje ryzyko hipoglikemii.
Wcześniaki o małej wadze urodzeniowej podatne są na
hipoglikemię, gdyż mając mało tkanki tłuszczowej
dostarczają mniej paliwa energetycznego takiego jak
wolne kwasy tłuszczowe lub ciała ketonowe. Uwalniana
jest mniejsza ilość glicerolu z tkanki tłuszczowej, co
skutkuje wolniejszą glukoneogenezą.
Do najczęstszych objawów
hipoglikemii
należą:
* bladość skóry,
* szybkie pocenie się
* drżenie rąk i nagłe uczucie osłabienia
* silne uczucie głodu,
* kołatanie serca
* pogorszenie procesu widzenia,
rozdrażnienie, * zachowania
agresywne,
* bóle głowy
* zasłabniecie z utratą przytomności
Kliniczne znaczenie zaburzenia stężenia
glukozy

Przy zbyt intensywnym utlenianiu kwasów tłuszczowych wytwarzane w
mitochondriach wątroby są
ciała ketonowe
( acetooctan, 3-hydroksymaślan i
aceton).
Ciała ketonowe
są ważnym paliwem energetycznym w tkankach
pozawątrobowych. Większe niż normalnie ilości ciał ketonowych we krwi nazywa
się ketonemią (hiperketonemią), w moczu ketonurią . Ogólnie ten stan
nazywany jest ketozą.
*
Zarówno kwas acetooctowy, jak i 3-
hydroksymasłowy są umiarkowanie silnymi
kwasami i są normalnie buforowane, jeżeli
znajdują się we krwi lub innych tkankach.
*
Jednak ciągłe ich wydalanie w większych
ilościach prowadzi do pewniej utraty
buforującego kationu (pomimo wytwarzania
amoniaku w nerce), co stopniowo wyczerpuje
rezerwę alkaliczna, powodując kwasicę
ketonową. Może to być zgubne przy
niekontrolowanej cukrzycy.
*
Najprostsza postać ketozy występuje w
głodzeniu, na skutek wyczerpania się
dostępnych zapasów węglowodanów,
związanego z mobilizacją wolnych kwasów
tłuszczowych.
Kliniczne znaczenie zaburzenia stężenia
glukozy
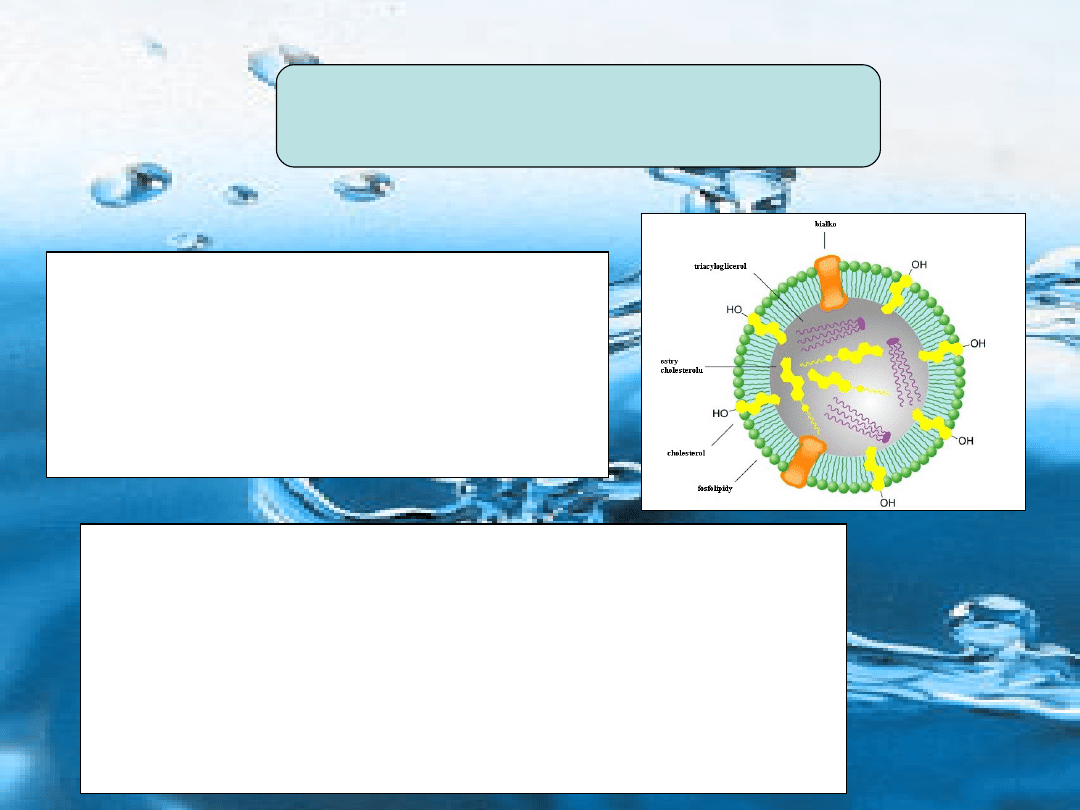
Z Lipidów reprezentowanych głównie przez
triacyloglicerole, po strawieniu powstają
monoacyloglicerole i kwasy tłuszczowe.
W komórkach jelitowych zachodzi resynteza
lipidów, które po połączeniu z białkiem są
wydzielone w formie lipoprotein, znanych jako
chylomikrony
, początkowo do układu chłonnego, a
następnie do krwiobiegu.
Triacyloglicerole chylomikromów
w odróżnieniu od glukozy i
aminokwasów nie są wychwytywane przez wątrobę.
Metabolizowane są przez tkanki pozawątrobowe przy udziale lipazy
lipoproteinowej, która hydrolizuje triacyloglicerol, uwalniając kwasy
tłuszczowe – wbudowane do lipidów tkankowych lub utleniane jako
żródło energii.
Innym ważnym żródłem długołańcuchowych kwasów tłuszczowych
jest synteza (lipogeneza) z węglowodanów głównie w tkance
tłuszczowej i w wątrobie
.
Metabolizm lipidów dotyczy głównie
kwasów tłuszczowych i cholesterolu

Triacyloglicerole
tkanki tłuszczowej to
główna rezerwa energetyczna w
organizmie.
W wyniku ich hydrolizy (lipolizy) kwasy
tłuszczowe są uwalniane do krwiobiegu
jako wolne kwasy tłuszczowe.
Wychwytywane są przez większość
tkanek (oprócz mózgu i erytrocytów) i
estryfikowane do triacylogliceroli (TG)
lub utleniane, jako główne źródło
energetyczne do CO
2
i H
2
O.
W wątrobie zachodzą 2 dodatkowe
szlaki :
1) nadwyżka triacyloglicerolu (po
lipogenezie i podaży wolnych kwasów
tłuszczowych) jest wydzielana do
krwioobiegu w postaci lipoprotein o
bardzo małej gęstości (VLDL);
2) częściowe utlenianie wolnych
kwasów tłuszczowych pozwala
wytwarzać ciała ketonowe (ketogeneza);
ciała ketonowe są transportowane do
tkanek pozawątrobowych – tam ważne
źródło energii
Rys. Transport i losy głównych substratów i metabolitów lipidowych

Stan odżywienia reguluje
lipogenezę
.
Anaboliczna faza odżywiania dotyczy zmagazynowania nadmiaru
węglowodanów w postaci tłuszczu w okresach niedoboru
energetycznego: głodzenie czy hibernacja
Proces
lipogenezy
dotyczy przekształcenia w
tłuszcz nadmiaru glukozy i związków
przemiany pośredniej : pirogronianu,
mleczanu i acetylo-CoA
Stan odżywienia organizmu jest
głównym czynnikiem
kontrolującym szybkość
lipogenezy.
Szybkość ta jest większa u
organizmów z dietą bogatszą w
węglowodany.
Zmniejsza się gdy ograniczone
zostaje dostarczanie
energetycznego pokarmu, przy
diecie bogato tłuszczowej i
niedoborze insuliny, np. w
cukrzycy.
Wszystkie te stany są związane ze
zwiększanym stężeniem wolnych
kwasów tłuszczowych w osoczu.
z
Wzmacnia przez to skutki wynikające ze
wzmożonego pobierania glukozy,
zwiększające wytwarzanie kwasów
tłuszczowych i acylogliceroli
* ↑ aktywności enzymów
dehydrogenazy pirogronianowej,
karboksylazy acetylo-CoA,
acylotransferazy glicerolo-3-
fosforanowej
Insulina
-hamuje uwalnianie WKT z tkanki tłuszczowej →
następstwem jest ↓ stężenia WKT w osoczu,
-
↑ lipogenezę i syntezę acyloglicerolu, nasila
utlenianie glukozy do CO
2
w cyklu
pentozofosforanowym,
- działa pobudzająco na pobieranie glukozy przez
komórki tkanki tłuszczowej (GLUT-4)
Hormony regulujące przemianę
tłuszczu:
Glukagon
Działanie glukagonu jest
przeciwstawne do działania insuliny
- aktywuje
glikogenolizę w wątrobie,
- aktywuje
lipolizę,
- hormon
najsilniej pobudzający
glukoneogenezę,
- ma działanie ketogenne,
Glukagon
jako silny hormon lipolityczny
-
podwyższa stężenie cAMP w adipocytach
tym samym aktywuje lipazę uwalniając
kwasy tłuszczowe, które są przekształcane
w związki ketonowe (acetooctan, ß-
hydroksymaślan)
Ważny aspekt przemiany u chorych na
cukrzycę, ponieważ stężenie glukagonu w
osoczu krwi jest zawsze podwyższone w
stanach niedoboru insuliny
Na sekrecję glukagonu wpływa wiele substancji: aminokwasy, kwasy tłuszczowe, związki
ketonowe, hormony przewodu pokarmowego oraz neuroprzekaźniki.

•Komórki B trzustki całkowicie zniszczone w procesie autoimmunologicznym
Hiperglikemia, hiperlipoproteinemia
(↑ chylomikronów i VLDL)
Hiperglikemia wynika z niezdolności
wniknięcia osoczowej glukozy do tkanek
insulinozależnych i przyspieszenia
glukoneogenezy w wątrobie z aminokwasów
pochodzących z białek mięśni , również
zahamowania jest glikogenogeneza
Kwasica ketonowa
Kwasica ketonowa to ↑ lipolizy w
adipocytach i przyspieszenie β-oksydacji
kwasów tłuszczowych w wątrobie
Hiperchylomikronemia to wynik ↓
aktywności lipazy lipoproteinowej w
naczyniach tkanki tłuszczowej (enzym
aktywowany przez insulinę)
Zaburzona przemiana
węglowodanów, lipidów i białek
Cukrzyca typu I - typ insulinozależny
Rys. cukrzyca typu I – typ insulinozależny

Na znaczną
hiperglikemię
wskazują
takie objawy, jak:
* nadmierne pragnienie,
* oddawanie dużych ilości moczu i
glikozuria,
* utrata apetytu,
* chudnięcie,
* osłabienie,
* senność,
* nudności, wymioty, bóle brzucha i
głowy,
* uczucie pieczenia w jamie ustnej,
* przyspieszenie tętna,
* zaróżowienie skóry
Głównym objawem cukrzycy jest
hiperglikemia
.
Jest ona spowodowana:
1) upośledzonym napływem glukozy do
komórek, 2) upośledzonym zużytkowaniem
(utylizacją) glukozy przez inne tkanki i
3) wzmożonym
wytwarzaniem glukozy w wątrobie (w procesie
zwanym glukoneogenezą)

i
Pojawia się najczęściej w średnim wieku u osób otyłych
Główne objawy:
• Hiperglikemia
↑
stężenie glukozy →
↑
stężenia insuliny (hiperinsulinizm)
• Glikemię zwiększa nasilona synteza glukozy z aminokwasów i kwasów
tłuszczowych w wątrobie (glukoneogeneza) →
↑
produkcji wątrobowej glukozy
*
Glukoza w wątrobie przekształca się w glicerol i razem z
WKT syntezowane są TG i VLDL → uwalniane w nadmiarze
do krwi obwodowej
*
WKT uwalniane po nasilonej lipolizie z tkanki tłuszczowej są
substratem do produkcji w wątrobie lipoprotein VLDL. Są one
przyczyną hiperlipidemii (hipertriglicerydemii)
↑
poziomu glukagonu sprzyja uwalnianiu WKT z tkanki tłuszczowej → nadprodukcja VLDL;
↑
poziomu cholesterolu (zwiększenie stężenia LDL powstających z VLDL)
Cukrzyca typu II – typ insulinoniezależny

*
Patologicznym zmianom ulega katabolizm VLDL → zaburzenia składu lipoprotein
*
Powstaja małe, gęste LDL (typu B LDL ) w wyniku aktywności lipazy wątrobowej
*
Powstają bogate w TG HDL
*
Wzrost syntezy VLDL stymulowany jest przez hiperglikemię i hiperinsulinizm
*
Wzrasta poziom (TNF- α) i białka rezystyny
uszkadzają one funkcję receptora insuliny i spadek receptorów insuliny
(
insulinooporność
)
insulinooporność prowadzi do wzmożonej glukoneogenezy przy jednoczesnym
niewykorzystaniu glukozy w tkankach obwodowych
Upośledzenie sekrecji insuliny
Obniżona tolerancja glukozy
Cukrzyca typu II
Cukrzyca typu II – typ insulinoniezależny – cd
.
Cukrzyca typu II – typ insulinoniezależny

Zmniejszenie aktywności enzymów glikolizy:
↓ fosfofruktokinazy
↓ kinazy pirogronianowej
Spadek przemiany cyklu pentozowego, głównie :
↓ aktywności dehydrogenazy 6-fosfoglukonianowej → niedobór
NADPH (potrzebnego do syntezy kwasów tłuszczowych i steroidów)
niedobór rybozo 5-fosforanu
Spowolnienie glikogenogenezy
↓ aktywności syntazy glikogenowej → ↑ degradacji glikogenu w
wątrobie i mięśniach → zmniejszenie zasobów glikogenu w tych
tkankach
Niedobór insuliny w cukrzycy
↑ aktywności enzymów glukoneogenezy : karboksylazy
pirogronianowej, karboksykinazy fosfoenolopirogronianowej, fruktozo-
1,6 bisfosfatazy
Biochemiczne parametry w cukrzycy

Dziękuję za uwagę
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
Wyszukiwarka
Podobne podstrony:
Biochemia wykład 13 Metabolizm węglowodanów
Metabolizm węglowodanów
1 białka, węglowodany, tłuszcze
pros 11 Metabolizm kw tłuszczowe, aminokwasy
Dietetyka Węglowodany i tłuszcze AHE Pielęgniarstwo
Dietetyka, Węglowodany i tłuszcze AHE Pielęgniarstwo
regulacja metabolizmu weglowodanow
analityka zab weglowodanowo tłuszczowe 4
ROZWÓJ PSYCHORUCHOWY DZIECKA w normie i patologii(1), KAMI
Biochemia 10 Metabolizm kwasow tluszczowychK
Metabolizm węglowodanów
Metabolizm kwasów tłuszczowych
15 BIOCHEMIA Metabolizm weglowodorow
Metabolizm węglowodanów
białka węglowodany tłuszcze mikor i markoelementy
(K) węglowodany i tluszcze
metabolizm weglowodanow
więcej podobnych podstron