
CHEMIA
SiMR
Dr hab. inż. Wanda Ziemkowska
Email: ziemk@ch.pw.edu.pl
Tel.: 22 234 7316
Typy reakcji chemicznych:
Reakcje analizy czyli rozkładu
A = B + C
2HgO = 2Hg + O
2
ogrzewanie
2H
2
O = 2H
2
+ O
2
elektroliza
2NaCl = 2 Na + Cl
2
elektroliza stopionej soli
Reakcje syntezy czyli łączenia
A + B = AB
4Fe + 3O
2
= 2Fe
2
O
3
spalanie w tlenie
C + O
2
= CO
2
2Cu + S = Cu
2
S spalanie w siarce
Reakcje wymiany
C + AB = CB + A AB + CD = AD + CB
Fe + 2HNO
3
= Fe(NO
3
)
2
+ H
2
ZnO + H
2
SO
4
= ZnSO
4
+ H
2
O
Podstawowe prawa chemiczne:
Prawo zachowania masy
Prawo stałości składu związków chemicznych
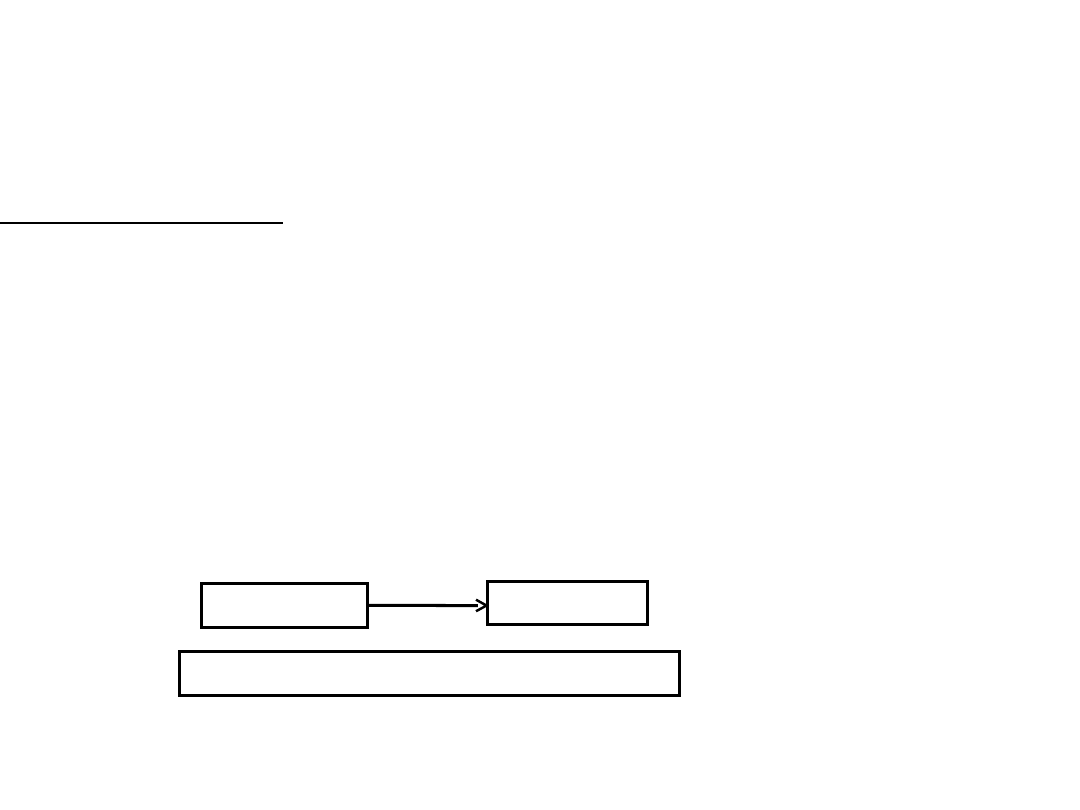
Prawo zachowania masy – Łomonosow i Lavoisier, 18 wiek
W układzie zamkniętym ogólna masa produktów powstających w dowolnej
reakcji chemicznej jest równa masie substratów wziętych do reakcji.
Masa układu zamkniętego, w którym przebiegają reakcje chemiczne, pozostaje stała.
Prawo sformułowano na podstawie doświadczeń, w których ogrzewano metale
z powietrzem w zamkniętych naczyniach szklanych. Ważono substancje wyjściowe
i substancje powstałe po reakcji wraz z powietrzem.
Prawo zachowania masy jest podstawą wprowadzenia równań chemicznych.
Substraty
Produkty
R e a g e n t y

Prawo stałości składu związków chemicznych
, Proust, 1799 r
Stosunek masowy pierwiastków w każdym związku chemicznym jest zawsze stały,
charakterystyczny dla danego związku i nie zależy od sposobu powstawania
tego związku.
Inne sformułowanie tego prawa:
Prawo stosunków stałych
W procesie tworzenia się związków chemicznych pierwiastki łączą się między
sobą zawsze w ściśle określonych stosunkach masowych.
Przykład: dwa pierwiastki – tlen i wodór – występują w każdej próbce wody
zawsze w stosunku wagowym 8:1. Oznacza to, że 8 g tlenu łączy się z 1 g wodoru
i tworzy się 9 g wody.
W przeciwieństwie do związków chemicznych, mieszaniny mają różny skład.
Mieszaniny mogą być utworzone z pierwiastków, związków chemicznych lub
z pierwiastków i związków. Można je rozdzielić za pomocą prostych metod
fizycznych:
Masa molowa – masa 1 mola materii wyrażona w g/mol. Liczbowo równa jest
wartości masy atomowej lub cząsteczkowej.
Np. masa atomowa żelaza Fe = 55,845, masa molowa żelaza 55,845 g/mol,
w przybliżeniu 56 g/mol
Masa cząsteczkowa dwutlenku węgla CO
2
: 12,0107 + 2•15,9994 = 44,0095,
masa molowa 44,0095 g/mol, w przybliżeniu 44 g/mol
W 1 molu znajduje się 6,022·10
23
(liczba Avogadra) atomów lub cząsteczek
substancji.
Wartościowość – liczba wiązań, które tworzy dany atom związany w cząsteczce.
W stanie niezwiązanym wartościowość pierwiastka wynosi zero.
Pojęcie wartościowości służy do ustalania wzorów sumarycznych i strukturalnych
związków chemicznych.
Podstawowe obliczenia chemiczne
Zadanie 1. Obliczyć ile moli znajduje się w 10,00 g CO
2
.
M
CO2
= 44.01 g/mol
1 mol CO
2
- 44,01 g CO
2
x moli - 10,00 g CO
2
1 mol · 10,00 g
x = ------------------------------- = 0,227 mol
44,01 g
Odpowiedź: w 10,00 g CO
2
znajduje się 0,227 mola.
Zadanie 2. Obliczyć ile cząsteczek znajduje się w 10,00 g CO
2
.
1 mol - 6,02·10
23
cząsteczek
0,227 mol - x cząsteczek
0,227 mol · 6,02·10
23
cząsteczek
x = ------------------------------------------------- = 1,37·10
23
cząsteczek
1 mol
Odpowiedź: W 10,00 g CO
2
znajduje się 1,37·10
23
cząsteczek.

Zadanie 3. Obliczyć procentową zawartość boru w minerale boraksie o wzorze
Na
2
B
4
O
7
·10H
2
O.
M
Na2B4O7·10H2O
= 2 · 22,99 + 4 · 10,81 + 7 · 16,00 + 10(2 · 1,01 + 16,00) = 381,37 g/mol
M
B
= 10,81 g/mol
381,37 g - 100%
4 • 10,81 g - x%
4 • 10,81 g · 100%
x = ------------------------- = 11,34%
381,37 g
Odpowiedź: Procentowa zawartość boru w boraksie wynosi 11,34%.

Zadanie 4. W wyniku reakcji H
2
S z SO
2
otrzymuje się S i H
2
O. Ile g siarki można
otrzymać z 5 g H
2
S zakładając, że ilość SO
2
jest wystarczająca do przereagowania
całej ilości H
2
S.
2 H
2
S
(g))
+ SO
2(g)
3 S
(s)
+ 2 H
2
O
(c)
M
H2S
= 2 · 1,0 + 32,1 = 34,1 g/mol
M
S
= 32,1 g/mol
Z 2 moli H
2
S powstają 3 mole siarki
68,2 g H
2
S - 96,3 g S
5 g - x g S
5 g · 96,3 g
x = ------------------- = 7,1 g
68,2 g
Odpowiedź: Z 5,0 g H
2
S można otrzymać 7,1 g S.

Zadanie 5. Ile gramów sodu należy użyć w reakcji z kwasem solnym HCl
aby otrzymać 20,0 g chlorku sodu NaCl.
2 Na + 2 HCl 2 NaCl + H
2
M
Na
= 23,0 g/mol M
NaCl
= 23,0 + 35,5 = 58,5 g/mol
Z 2 moli Na powstają 2 mole NaCl.
46,0 g Na - 117,0 g NaCl
x Na - 20,0 g NaCl
46.0 g · 20,0 g
x = ---------------------- = 7,9 g Na
117,0 g
Odpowiedź: Należy użyć 7,9 g sodu.

Zadanie 6. Chlorek pewnego pierwiastka 13 grupy układu okresowego zawiera
79,68% chloru. Obliczyć masę molową tego pierwiastka i wskazać jaki
to pierwiastek.
Wzór ogólny: Me
III
Cl
3
Zakładamy, że w 100 g związku znajduje się 79,68 g Cl i 20,32 g nieznanego
pierwiastka. Obliczamy ile moli Cl znajduje się w 79,68 g Cl.
M
Cl
= 35,5 g/mol
35,5 g Cl - 1 mol
79,68 g Cl - x moli
79,68 g · 1 mol
x = -------------------- = 2,24 mola Cl
35,5 g
Z treści zadania wiadomo, że na 3 mole Cl przypada 1 mol nieznanego pierwiastka.
Obliczamy ile moli nieznanego pierwiastka znajduje się w założonych 100 g
związku M
III
Cl
3
.
3 mole Cl - 1 mol nieznanego pierwiastka
2,24 mole Cl - x moli nieznanego pierwiastka
2,24 mol · 1 mol
x = -------------------------- = 0,75 mola nieznanego pierwiastka
3 mol

20,32 g nieznanego pierwiastka - 0,75 mola nieznanego pierwiastka
x g - 1 mol
20,32 g · 1 mol
x = ------------------------- = 27,09 g
0,75 mol
Masa molowa nieznanego pierwiastka wynosi 27,09 g/mol. Sprawdzamy w układzie
okresowym pierwiastków, który pierwiastek 13 grupy ma masę atomową
najbliższą tej wartości. Jest to glin M
Al
= 26,98 u.
Odpowiedź: wzór związku AlCl
3
.

Zadania
1.W próbce siarczku chromu Cr
2
S
3
znajduje się 8 g siarki. Ile g chromu
znajduje się w tej próbce.
2. Z 5 ton rudy pirytowej zawierającej siarczek żelaza FeS
2
otrzymano
850 kg żelaza. Obliczyć zawartość FeS
2
w procentach wagowych w tej rudzie.
3. Obliczyć skład procentowy (% wag.) dwuhydrokso węglanoglinianu sodu
NaAl(OH)
2
CO
3
.
4. Obliczyć procentową zawartość tytanu (% wag.) w minerale ilmenicie FeTiO
3
.
5. Do następującej reakcji 3 Na
2
O + 2 H
3
PO
4
2 Na
3
PO
4
+ 3 H
2
O
Użyto 10 g roztworu kwasu H
3
PO
4
, w którym kwas stanowi 50% wag.
Ile g Na
2
O trzeba do całkowitego przereagowania kwasu.
6. Reakcja spalania glinu w chlorze przebiega według następującego równania
2 Al
metal
+ 3 Cl
2
2 AlCl
3
Ile g Al trzeba użyć aby po spaleniu w atmosferze chloru otrzymać 20 g AlCl
3
.

7. Bromek pewnego pierwiastka 2 grupy układu okresowego zawiera
86,80% bromu. Obliczyć masę molową tego pierwiastka i wskazać jaki
to pierwiastek. Odp. magnez.
8. Ile gramów tlenku fosforu(V) P
2
O
5
należy wziąć do reakcji aby w reakcji
z wodą otrzymać 8,0 g kwasu ortofosforowego H
3
PO
4
?
Odp. 5,80 g
9. Ile gramów tlenku sodu Na
2
O należy wziąć do reakcji z tlenkiem siarki(IV)
SO
2
aby otrzymać 10,0 gramów siarczanu(IV) sodu Na
2
SO
3
?
Odp. 4,92 g
10. Wyprowadzić uproszczony wzór związku o składzie:
52,14% wag. Zn, 9,58% C, 38,28% O
Odp. ZnCO
3
11. Ile moli tlenu oraz wodoru zużyje się do wytworzenia 5,41 g wody.
Odp. 0,3 mola wodoru i 0.15 mola tlenu.

Zalecany zbiór zadań:
Alfred Śliwa, Obliczenia Chemiczne zbiór zadań z chemii nieorganicznej
i analitycznej wraz z podstawami teoretycznymi. PWN.
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
Wyszukiwarka
Podobne podstrony:
wykładKonta bilansowe i zasady ich funkcjonowania (Eko nomia's conflicted copy 2012 06 14)
Kopia spr12 (ja VAIO s conflicted copy 2012 05 02)
Projekt (qwer s conflicted copy 2012 06 02)
W11 Starzenie komórkowe (asus Komputer's conflicted copy 2012 05 26)
W10 Oddzialywania komórek miedzy soba (asus Komputer's conflicted copy 2012 05 26)
Prawo cywilne ćw.8 2012-02-20, Prawo Cywilne
SUMKOSZTYwynikrachunkowość wynik finansowy (Eko nomia's conflicted copy 2012 06 12)
W8 Cykl komórkowy (asus Komputer's conflicted copy 2012 05 26)
W3 Struktura jadra (asus Komputer's conflicted copy 2012 05 23)
W9 Uszkodzenia białek i DNA (asus Komputer's conflicted copy 2012 05 26)
więcej podobnych podstron