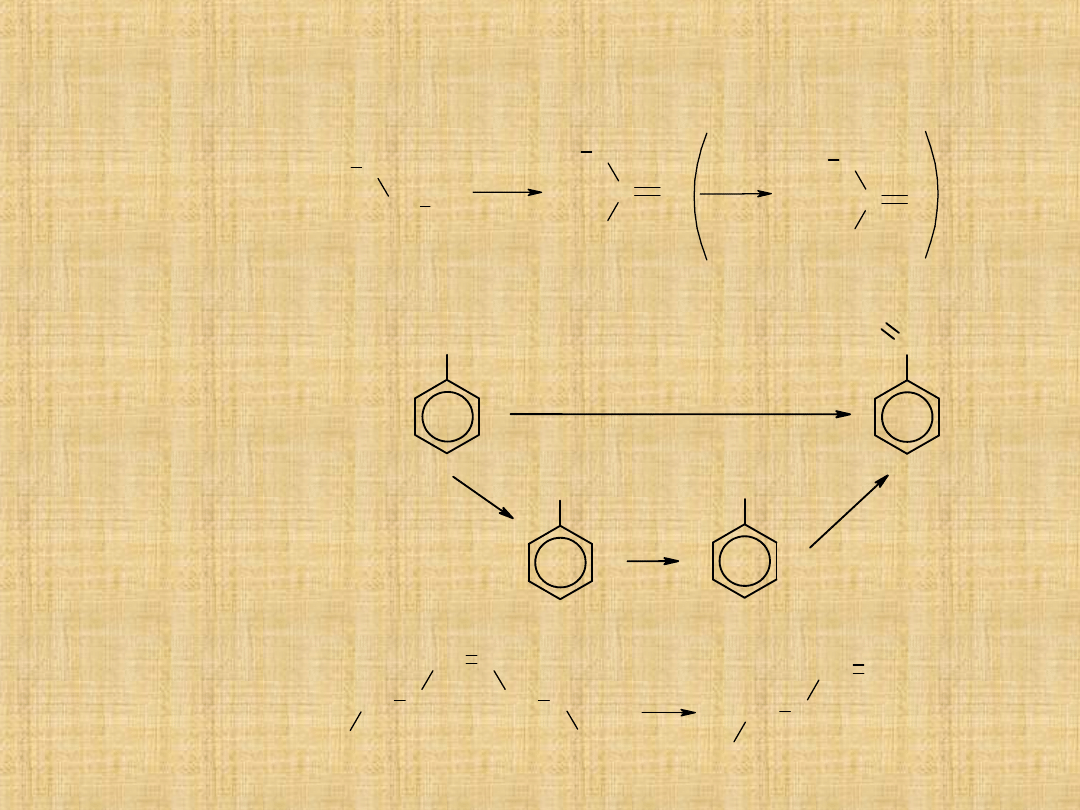
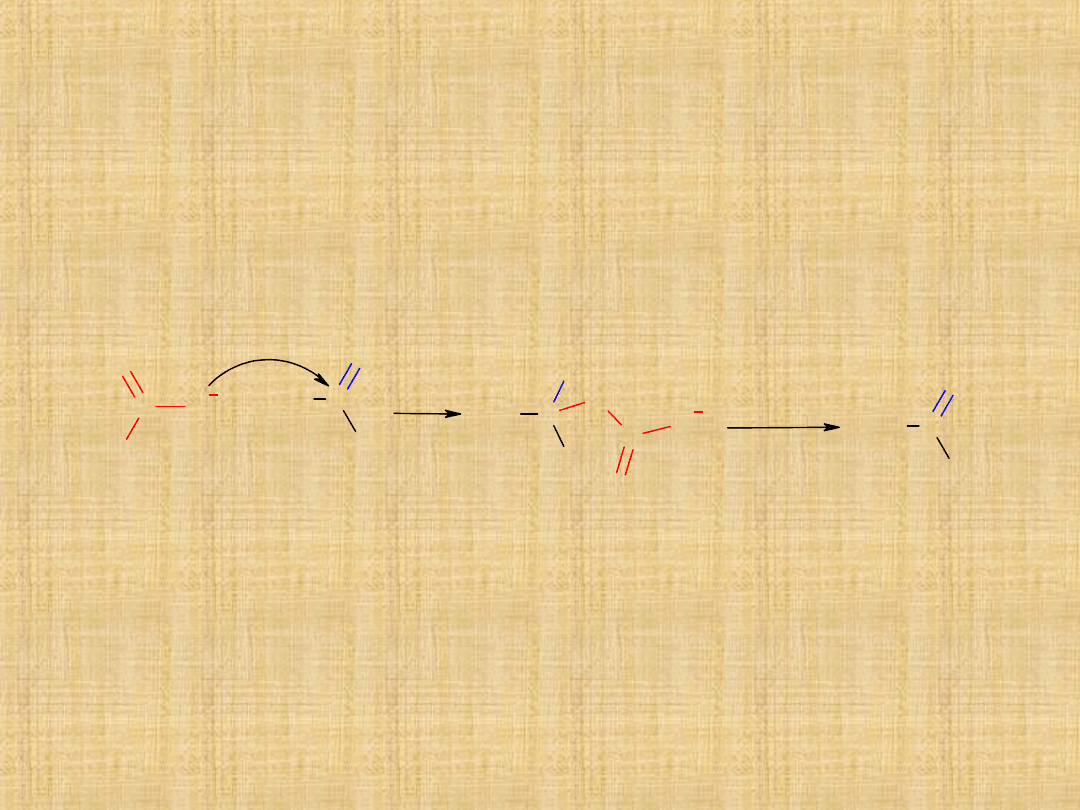
-Selektywne
utlenianie
1°alkoholi
( łagodne
utleniacze)
-Selektywne utlenianie
metylowych
pochodnych benzenu
lub przez hydrolizę
dichlorometylobenzenu
CH CH
CH
2
CH
2
CH
2
CH
3
CH
2
CH
3
O
3
CH O
CH
2
CH
2
CH
3
-w procesie ozonolizy
CH
3
CH
2
Cl
CHCl
2
Cl
2
h
CH
O
H
2
O
CrO
3
h
Cl
2
CH
3
CH
2
C
O
H
CH
3
CH
2
CH
2
OH
CH
3
CH
2
C
O
OH
[O]
[O]
Metody otrzymywania aldehydów
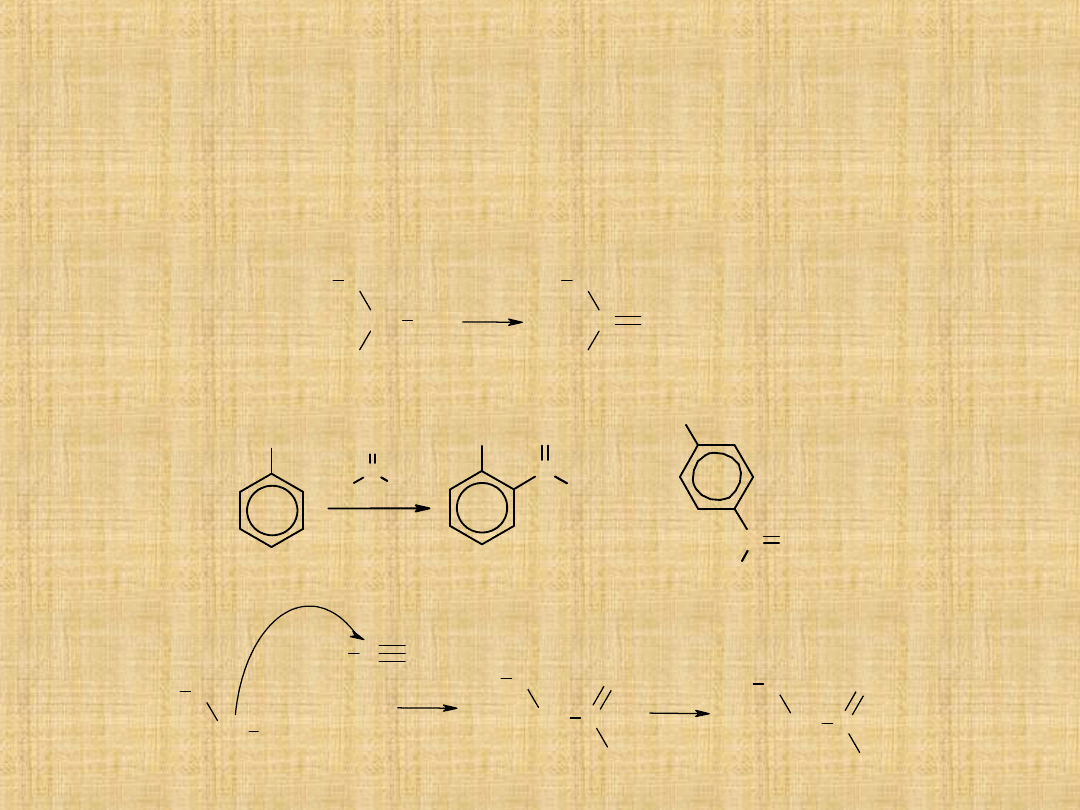
Otrzymywanie ketonów
Utlenianie alkoholi 2°-rzędowych
Drugorzędowe alkohole utleniają się na ketony za pomocą mieszaniny
K
2
Cr
2
O
7
i rozcieńczonego kwasu siarkowego lub za pomocą CrO
3
.
CH
3
CH
2
C
O
CH
3
CH
3
CH
2
CH OH
CH
3
[O]
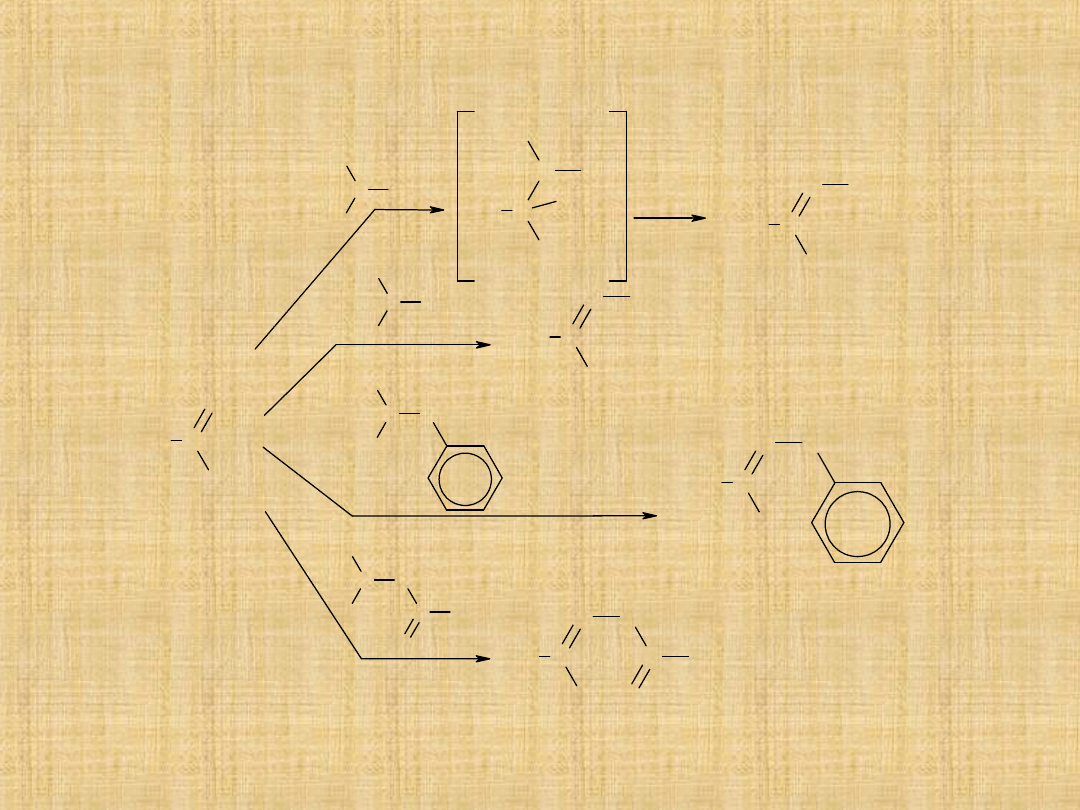
Acylowanie metodą Friedla -Craftsa
W reakcji odczynnika Grignarda z nitrylami
CH
3
C
CH
3
C
O
CH
3
C
Cl
CH
3
C
O
C
CH
3
C O
C
H
3
AlCl
3
+
CH
3
CH
2
CH
2
MgBr
CH
3
C
N
CH
3
NH
C
CH
3
CH
2
CH
2
CH
3
O
C
CH
3
CH
2
CH
2
+
H
2
O
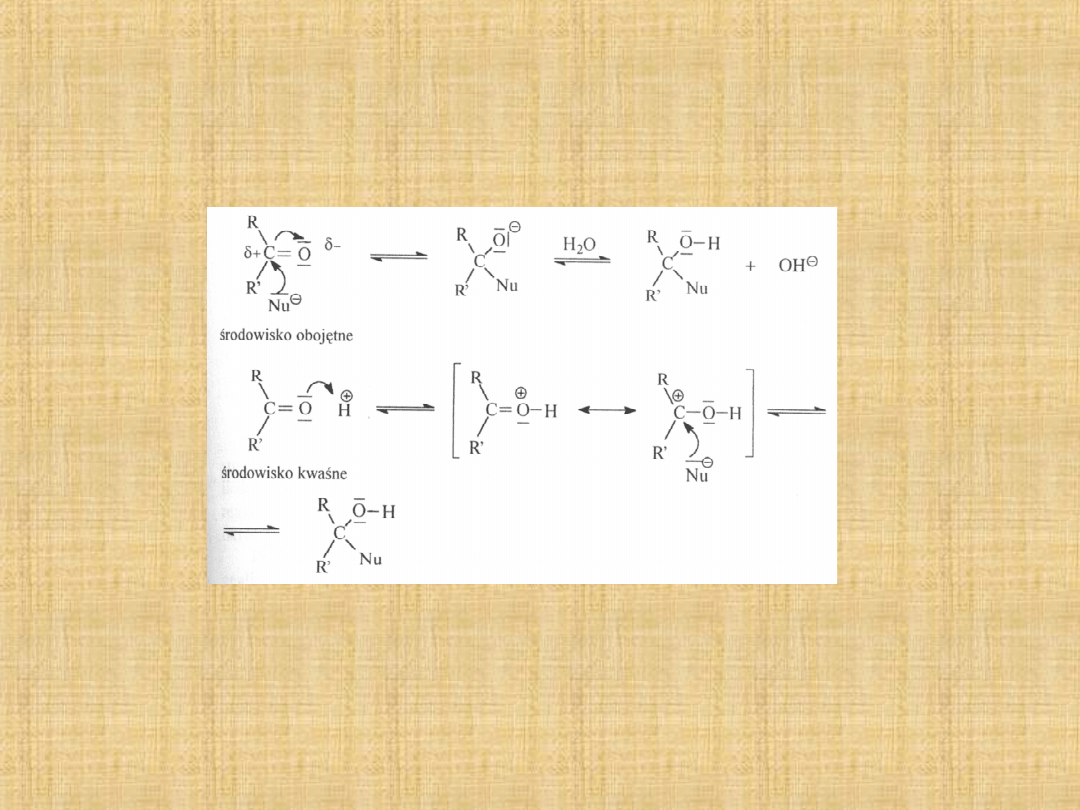
Addycja nukleofilowa do grupy
karbonylowej
Najważniejszą reakcją grupy karbonylowej jest reakcja addycji
nukleofilowej.
Reakcje zachodzą zwykle samoczynnie, choć w niektórych
przypadkach przyspiesza się ich przebieg zakwaszając
środowisko reakcji. W wyniku tworzy się ładunek dodatni na
atomie węgla grupy karbonylowej,łatwiejszy jest atak nukleofila.
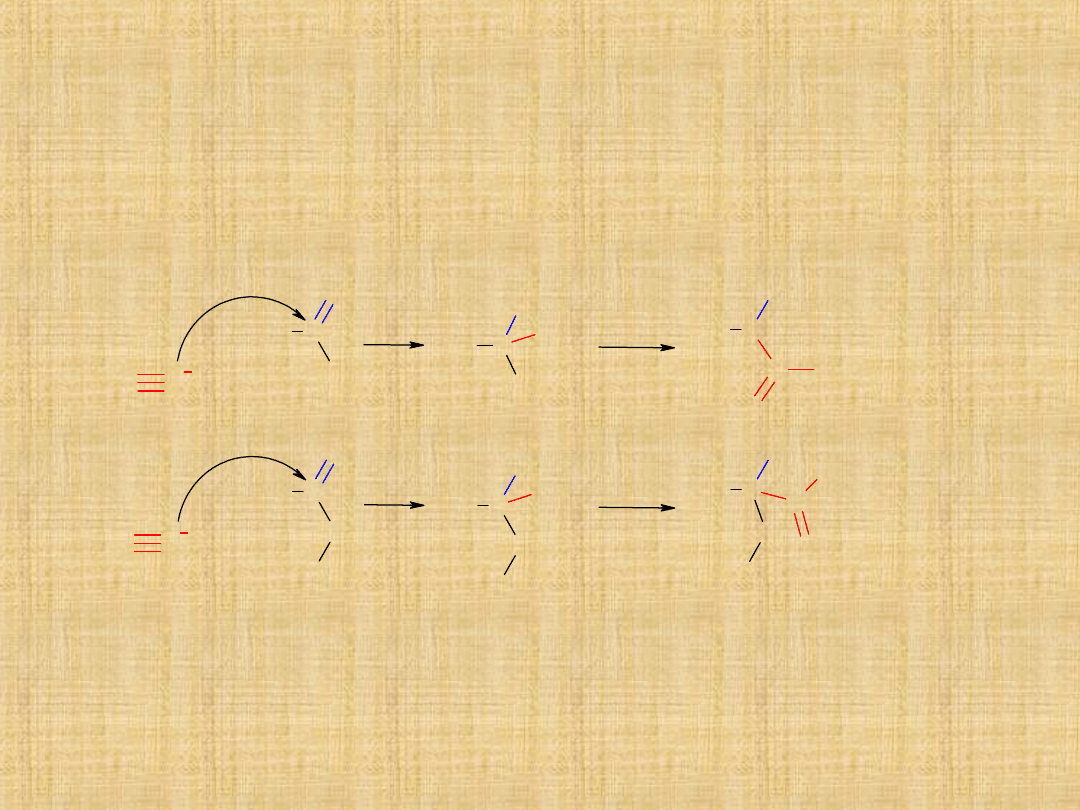
Addycja cyjanowodoru
Reakcję tworzenia cyjanohydryn przeprowadza się w
obecności kwasu nieorganicznego dodawanego do mieszaniny
związku karbonylowego i wodnego roztworu NaCN. Łatwo
ulegają hydrolizie do -hydroksykwasów.
N
C
CH
3
C
H
O
H
OH
C
CH
3
CN
OH
CH
CH
3
O
OH
C
+
H
2
O/H
+
H
+
N
C
CH
3
C
CH
2
O
CH
3
OH
C
CH
3
CN
CH
2
CH
3
OH
C
CH
3
O
OH
C
CH
2
CH
3
+
H
2
O/H
+
H
+
Addycja wodorosiarczanu(IV) sodu
Reakcja przyłączenia ma głównie znaczenie w syntezie w procesach
wyodrębnienia i oczyszczania związków karbonylowych.
Addukty związków karbonylowych a wodorosiarczanem (IV) są
krystaliczne. Łatwo można je wyodrębnić ze środowiska reakcji.Ponownie
w związki karbonylowe przekształcamy je za pomocą kwasu lub zasady.
S
O
O
O
H
CH
3
C
H
O
H
OH
C
CH
3
S
O
O
O
+
H
+
CH
3
C
H
O
H
+
lub OH
–
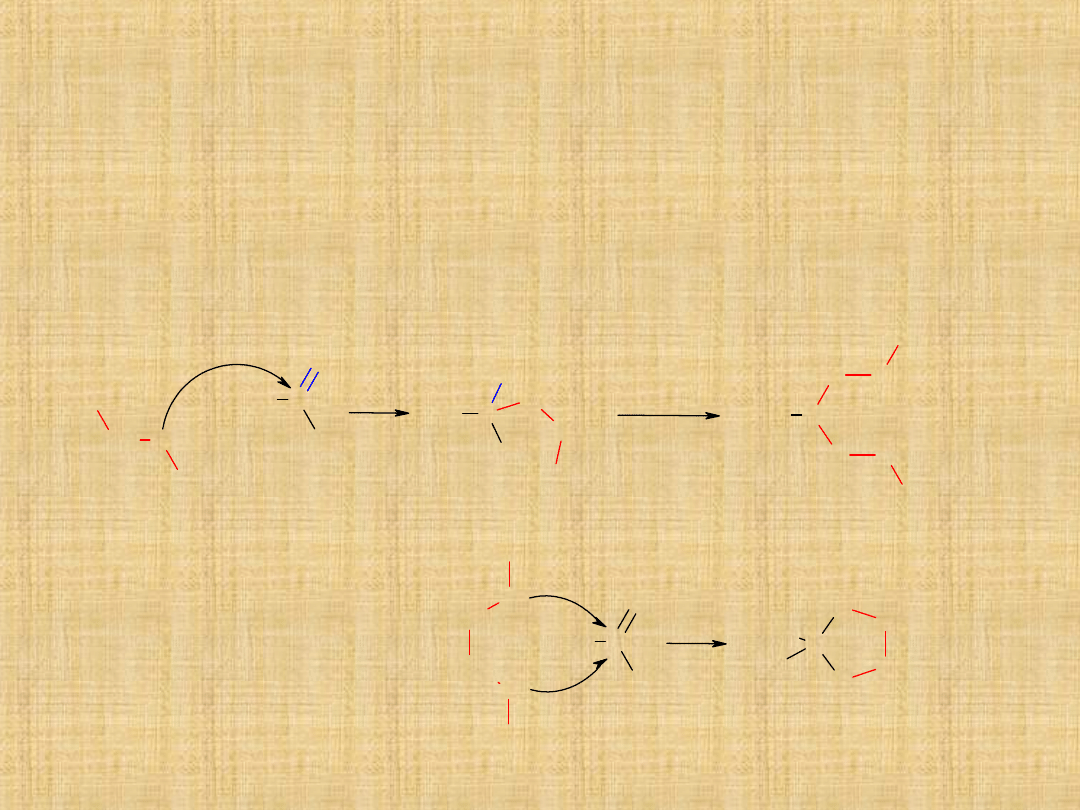
Hemiacetale i acetale
Produktem przyłączenia alkoholu do grupy aldehydowej jest
hemiacetal
(półacetal). Reakcja biegnie bez udziału katalizatora.
W obecności kwasu hemiacetal może przeragować z drugą
cząsteczką alkoholu tworząc
acetal.
CH
2
O
CH
3
H
CH
3
C
H
O
H
OH
C
CH
3
O
CH
2
CH
3
CH
3
CH
3
CH
2
O
CH
CH
3
O
CH
2
+
C
2
H
5
OH/H
+
– H
2
O
O
CH
2
CH
2
H
O
H
CH
3
C
CH
3
O
CH
3
CH
3
C
CH
2
CH
2
O
O
+
H
+
Ketony reagują trudniej,
mogą przyłączać łatwo
glikole, tworząc cykliczne
ketale
.
NH
N
H
H
NH
N
CH
3
C
CH
3
fenylohydrazyna
fenylohydrazon
NH
2
N
H
H
NH
2
N
CH
3
C
CH
3
hydrazyna
hydrazon
hydroksyloamina
OH
N
H
H
CH
3
C
CH
3
O
OH
N
H
CH
3
C
CH
3
OH
OH
N
CH
3
C
CH
3
oksym
Addycja pochodnych amoniaku
NH
2
NH
N
H
H
C
O
NH
2
NH
N
C
O
CH
3
C
CH
3
semikarbazyd
semikarbazon
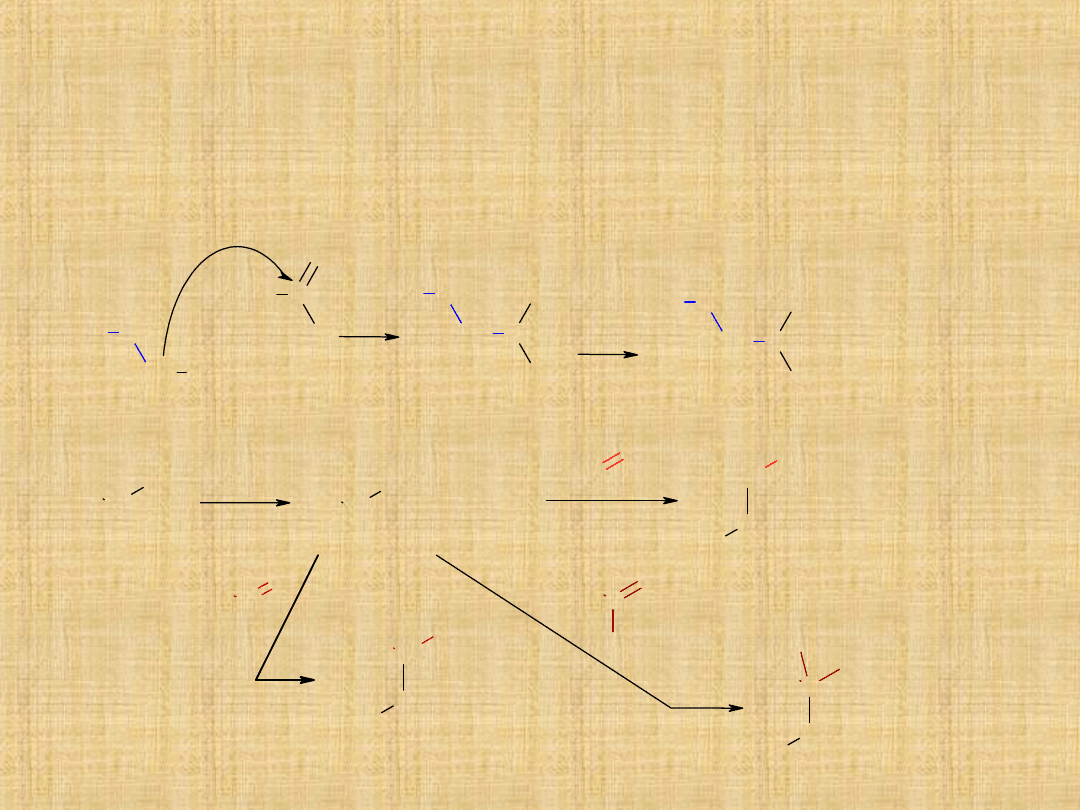
Addycja związków Grignarda
CH
3
CH
2
Cl
CH
3
CH
2
MgCl
Mg/eter
C
H
2
O
CH
2
OH
CH
2
CH
3
CH
3
CH
O
CH
3
CH
OH
CH
2
CH
3
CH
3
C
O
CH
3
CH
3
C
OH
CH
2
CH
3
CH
3
Reakcja ma również charakter addycji nukleofilowej,w jej
wyniku można otrzymać alkohole o różnej rzędowości.
CH
3
CH
2
CH
2
MgBr
CH
3
C
H
O
CH
3
OMgBr
CH
CH
3
CH
2
CH
2
CH
3
OH
CH
CH
3
CH
2
CH
2
Mg(OH)Br
+
H
2
O
+
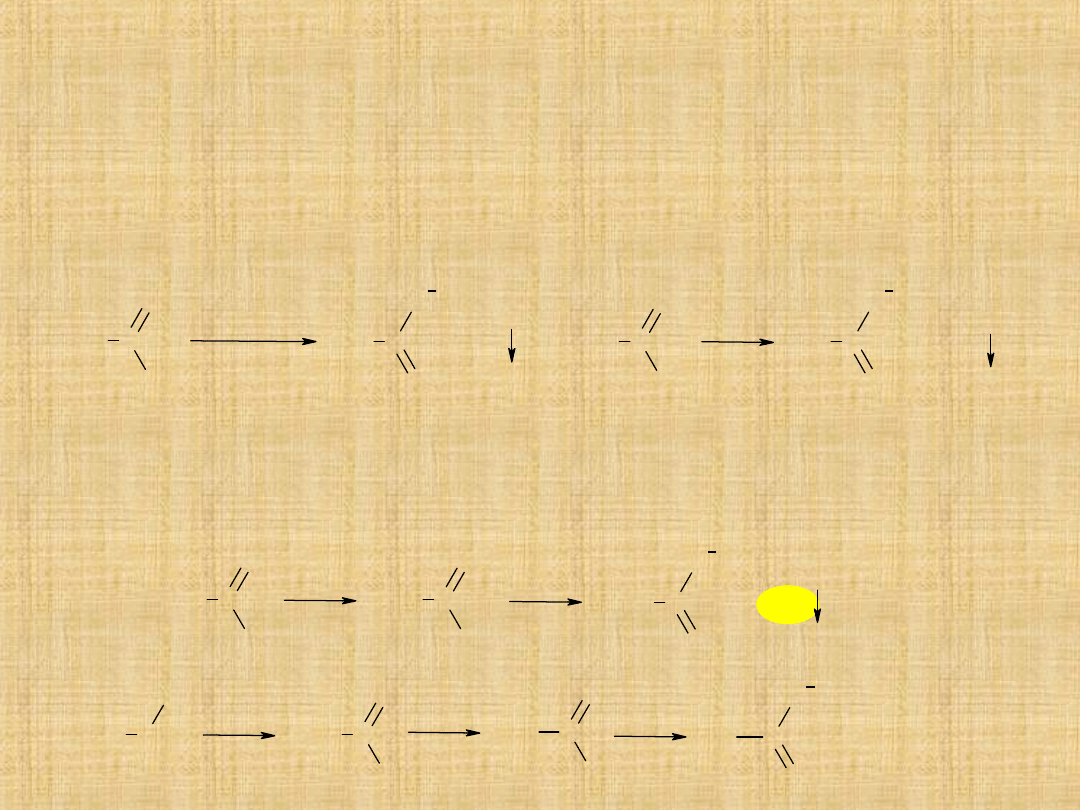
Utlenianie
Aldehydy łatwo ulegają utlenieniu do kwasów karboksylowych.
Czynnikiem utleniającym mogą być nadmanganian potasu,
dwuchromian potasu,
a nawet tak łagodne reagenty jak odczynnik:
Tollensa (Ag(NH
3
)
2
+
)
czy
Fehlinga (Cu
2+
)
Ketony są odporne na utlenienie. Wyjątek stanowią
metyloketony,które łatwo można utlenić jonami OX
–
X=Cl,Br,J.
Produktami reakcji są kwas karboksylowy krótszy o jeden atom
węgla od substratu oraz haloform.(CHX
3
).
CH
3
C
H
O
CH
3
O
C
O
Ag
[Ag(NH
3
)
2
]
+
+
OH
–
CH
3
C
H
O
CH
3
O
C
O
Cu
2
O
Cu
2+
+
OH
–
CH
3
C
C I
3
O
CH
3
O
C
O
CHI
3
CH
3
CH
3
C
O
I
2
+
OH
–
OH
–
CH
3
C
H
O
H
O
C
O
CHCl
3
CH
3
CH
2
OH
Cl
2
CCl
3
C
H
O
Cl
2
+
OH
–
OH
–

Redukcja związków karbonylowych
Redukcję związkow karbonylowych do alkoholi można
przeprowadzić różnymi sposobami,wodorem w obecności
katalizatora lub też wodorkami metali.
Najczęściej stosowanymi wodorkami metali są, NaBH
4
lub LiAlH
4
.
Reakcja Canizarro
Aldehydy nie zawierające -atomów wodoru pod działaniem
stężonego,około 50% wodnego roztworu NaOH w temperaturze pokojowej
ulegają dysproponacji(międzycząsteczkowemu utlenianiu –redukcji)dając
alkohole i kwasy np.;
2H-CHO CH
3
OH + HCOONa
2Ar-CHO ArCH
2
OH + Ar COONa
CH
3
CH
2
C
O
H
CH
3
CH
2
CH
2
OH
[H]
CH
3
CH
2
C
O
CH
3
CH
3
CH
2
CH OH
CH
3
[H]
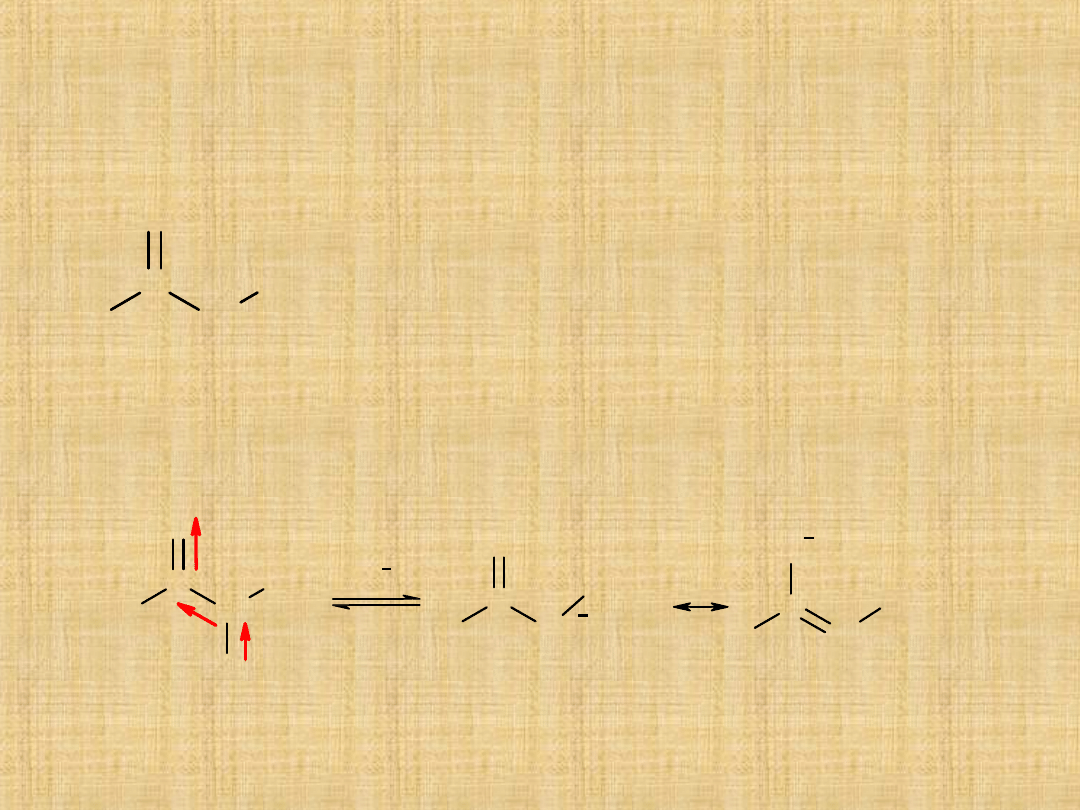
Kwasowość atomów wodoru
Elektrododatni charakter atomu węgla(1)
grupy karbonylowej powoduje polaryzację
wiązania łączącego atom węgla (1) z atomem
węgla (2) wskutek tego atom węgla (2)
uzyskuje pewien deficyt elektronów i staje się
nieznacznie naładowany dodatnio. Następuje
osłabienie wiązania co jest przyczyna łatwego
oderwania od atomu węgla C(2) wodoru w
postaci protonu.
Reakcja zachodzi już pod wpływem
rozcieńczonego roztworu NaOH.
H
CH
2
C
O
CH
3
H
CH
C
O
CH
3
H
H
CH
C
O
CH
3
H
CH
C
O
CH
3
OH
H
+
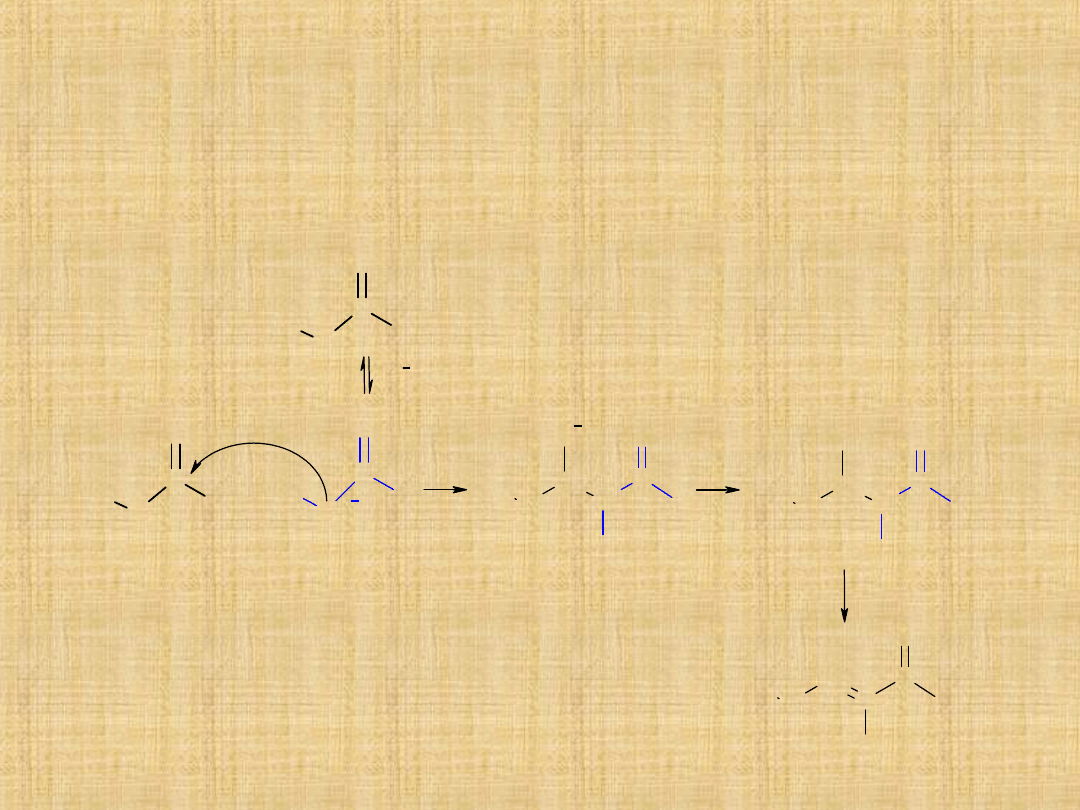
H
CH
2
C
O
CH
3
OH
H
CH
C
O
CH
3
H
CH
2
C
O
CH
3
CH
3
C
CH
CH
CH
2
CH
3
H
O
O
H
+
CH
3
C
CH
CH
CH
2
CH
3
H
OH
O
+
Kondensacja aldolowa
Pod wpływem rozcieńczonej zasady dwie cząsteczki aldehydu
albo ketonu posiadające atomy wodoru przy węglu mogą łączyć
się, w wyniku czego tworzy się -hydroksyaldehyd albo -
hydroksyketon.
Reakcja ta nosi nazwę kondensacji aldolowej.
Produkt powstaje w wyniku addycji jednej
cząsteczki aldehydu do drugiej cząsteczki tego
samego związku w taki sposób, że atom węgla
pierwszej cząsteczki przyłącza się do atomu węgla
grupy karbonylowej drugiej cząsteczki. Dalej
może nastąpić odwodnienie z utworzeniem
wiązania podwójnego
CH
3
C
C
CH
CH
2
CH
3
H
O
T
C
CH
3
H
O
C
CH
3
H
O
C
CH
3
H
O
CH
3
C
CH
3
O
C
CH
2
H
O
CH
CH
3
OH
CH
3
C
CH
2
O
CH
CH
3
OH
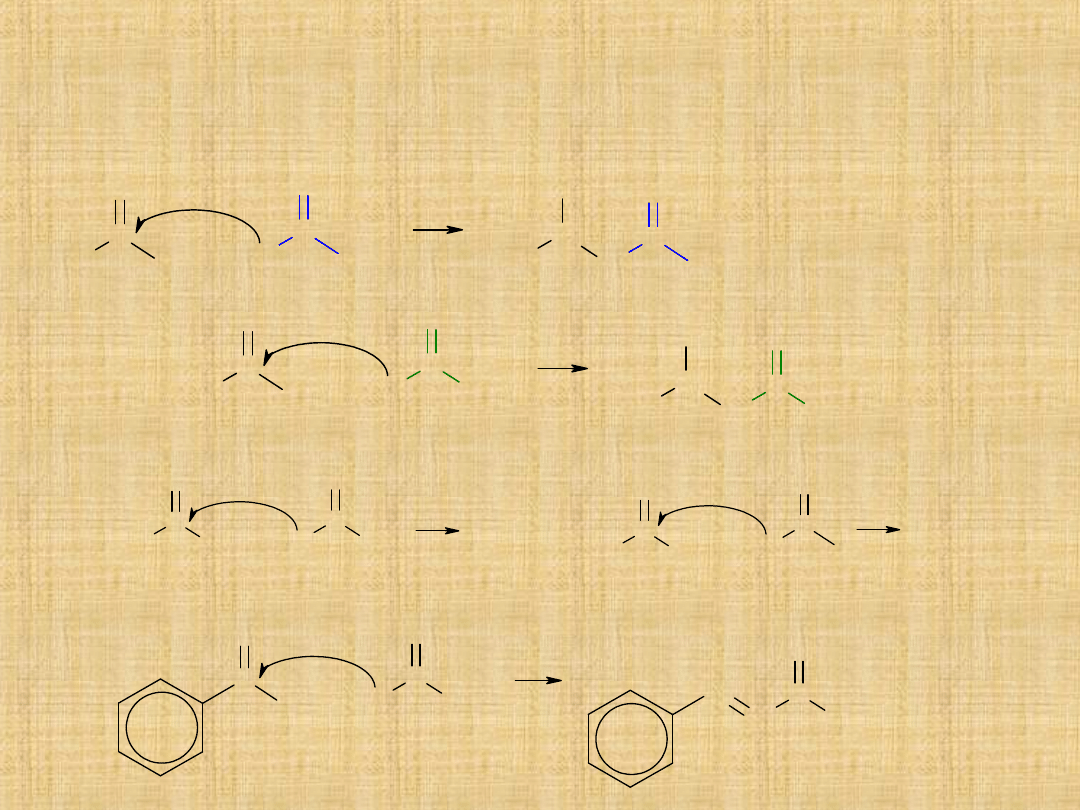
Kondensacja aldolowa
Podobnie reagują ketony, ale znacznie trudniej. Jeżeli w mieszaninie
reakcyjnej występuje aldehyd i keton mogą zachodzić dwie reakcje
konkurencyjne.
Reakcje, w których atakowana jest grupa karbonylowa ketonów,
praktycznie nie zachodzą.
CH
3
C
CH
3
O
C
CH
3
H
O
CH
3
C
CH
3
O
CH
3
C
CH
3
O
X
X
Jeśli aldehyd nie posiada atomów wodoru przy węglu , reakcja biegnie w
jednym kierunku.
CH
3
C
CH
3
O
CH
3
C
CH
O
CH
C
H
O
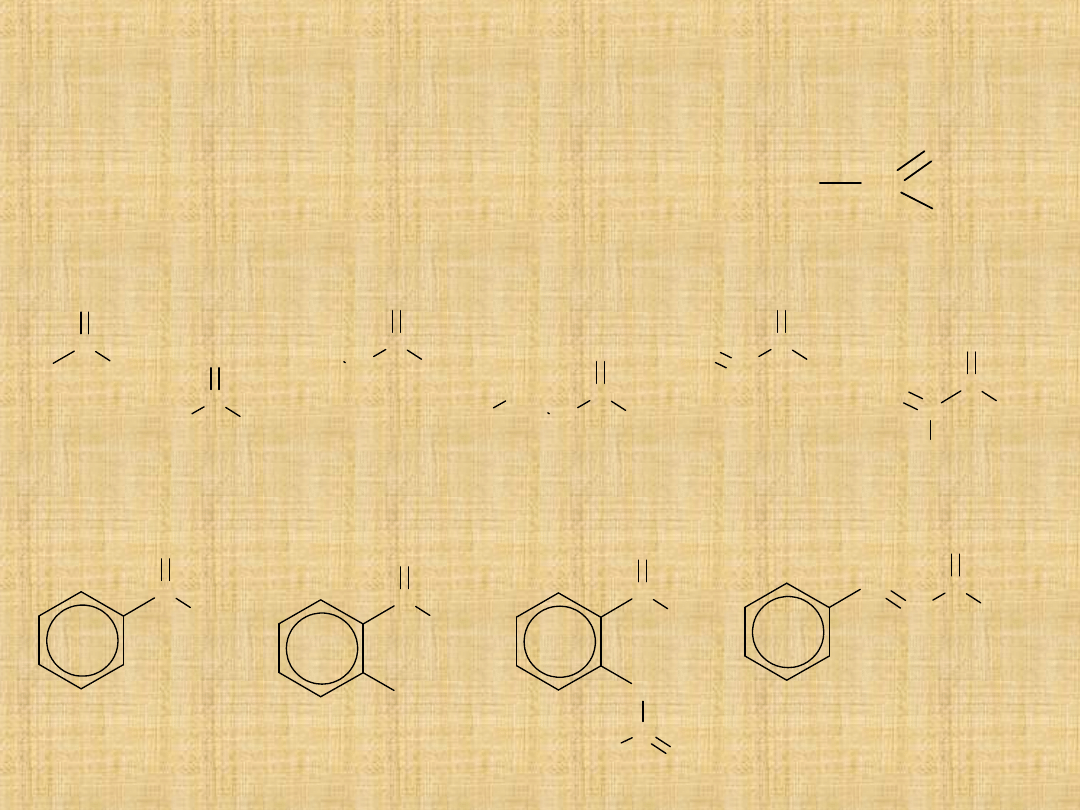
OH
C
H
O
OH
C
CH
3
O
CH
3
OH
C
CH
2
O
CH
2
CH
3
OH
C
CH
2
O
CH
2
OH
C
CH
O
CH
3
CH
2
OH
C
C
O
OH
C
O
OH
C
O
OH
O
C
CH
3
O
OH
C
O
OH
C
CH
O
CH
mrówkowy
propionowy
akrylowy
metakrylowy
salicylowy
acetylosalicylowy
benzoesowy
masłowy
octowy
cynamonowy
Kwasy karboksylowe
Największą kwasowość spośród związków organicznych
wykazują kwasy karboksylowe.
Związki te zawierają w cząsteczce grupę karboksylową –
COOH,
połączoną albo z grupą alkilową R (RCOOH)
albo grupą arylową Ar (ArCOOH).
C
O
OH

Nazewnictwo
Tworzenie nazw polega na dodaniu do nazwy węglowodoru końcówki
–owy
i słowa kwas. Szeroko stosowane są też tradycyjne nazwy
zwyczajowe tych związków.
HCOOH
kwas metanowy (mrówkowy)
CH
3
COOH
kwas etanowy (octowy)
CH
3
CH
2
COOH
kwas propanowy (propionowy)
CH
3
CH
2
CH
2
COOH
kwas butanowy (masłowy)
CH
3
CH
2
CH
2
CH
2
COOH
kwas pentanowy (walerianowy)
Miejsce przyłączenia podstawnika do łańcucha podstawowego wskazuje się w
nazwie liczbą odpowiadającą kolejnemu numerowi węgla w łańcuchu. Za atom
C-1 uważa się atom węgla grupy karboksylowej.
W nazewnictwie zwyczajowym kolejne atomy węgla sąsiadujące z węglem
grupy karboksylowej oznacza się kolejnymi literami greckimi (α, β, γ itd.).
Atom węgla α w nazwie zwyczajowej odpowiada atomowi C-2 w nazwie
systematycznej.
C
C
C
C
C
C
O
OH
C
6
5
4
3
2
1
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
Wyszukiwarka
Podobne podstrony:
aldehydy i ketony addycja nukleofilowa
aldehydy i ketony
Aldehydy i ketony
Aldehydy i ketony
Aldehydy, ketony, kwasy, ALDEHYDY
Aldehydy, ketony i kwasy - test 2, 1p
ISE powtorka z chemii, ISE aldehydy i ketony, P 5
aldehydy i ketony zadania
13 Aldehydy i ketony kondensacja aldolowa
(3wysł) polifenole, aldehydy, ketony,kwasy,mydła 2010 11(1)
Aldehydy i ketony
6 aldehydy,ketony
Aldehydy i ketonywisła
Aldehydy i ketony
aldehydy, ketony, hemiacetale
Aldehydy i ketony 2 id 54913 Nieznany
więcej podobnych podstron