
Metabolizm aminokwasów

Przemiany białek
Białka są jedynym źródłem azotu pokarmowego.
Ilość białka u człowieka dorosłego - 10 do 14 kg.
Wymiana białek w ciągu doby – około 300g.
Białko pobierane z pożywienia
jest przekształcane w
swoiste białko ustrojowe.
Dzienne zapotrzebowanie na
białko: 0.8 g/kg masy ciała.

Rola białek:
•Budowa i odbudowa zużytych tkanek
•Podstawowy składnik krwi, limfy, mleka, enzymów
•Składnik przeciwciał
•Działanie buforujące
•Regulacja ciśnienia krwi

OKRES PÓŁTRWANIA BIAŁEK
duże różnice dla poszczególnych białek
krótki
dla białek enzymatycznych (minuty,
godziny,
dni)
długi
- dla białek strukturalnych (mięśni,
tkanki
łącznej i tkanki nerwowej) (miesiące, lata)
decyduje o tym podatność białka na działanie
proteaz
rozróżnia się
białka o szybkim obrocie i małej
puli
tkankowej
oraz
powolnej przemianie i
dużej puli
tkankowej

Okresy półtrwania niektórych białek:
dekarboksylaza ornitynowa - 11 minut
syntetaza ALA - 60 minut
dehydrogenaza glutaminianowa - 6 godzin
beta-glukuronidaza - 30 dni
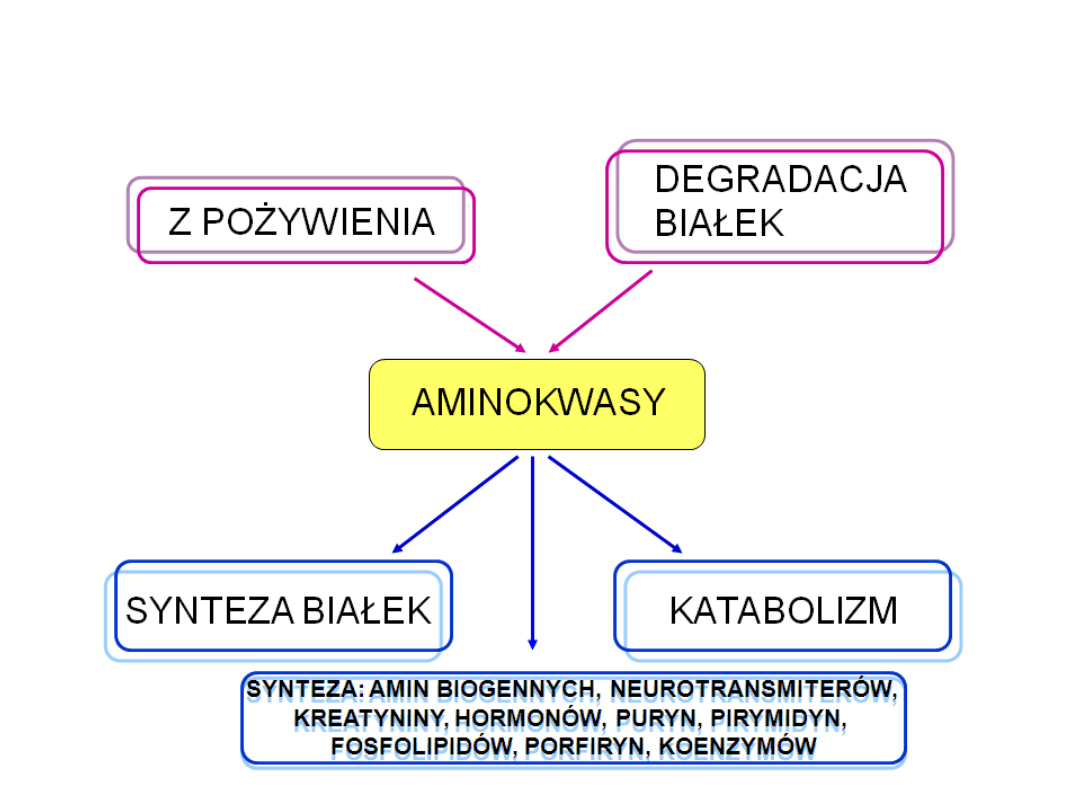
Schemat przemiany białek w organizmie

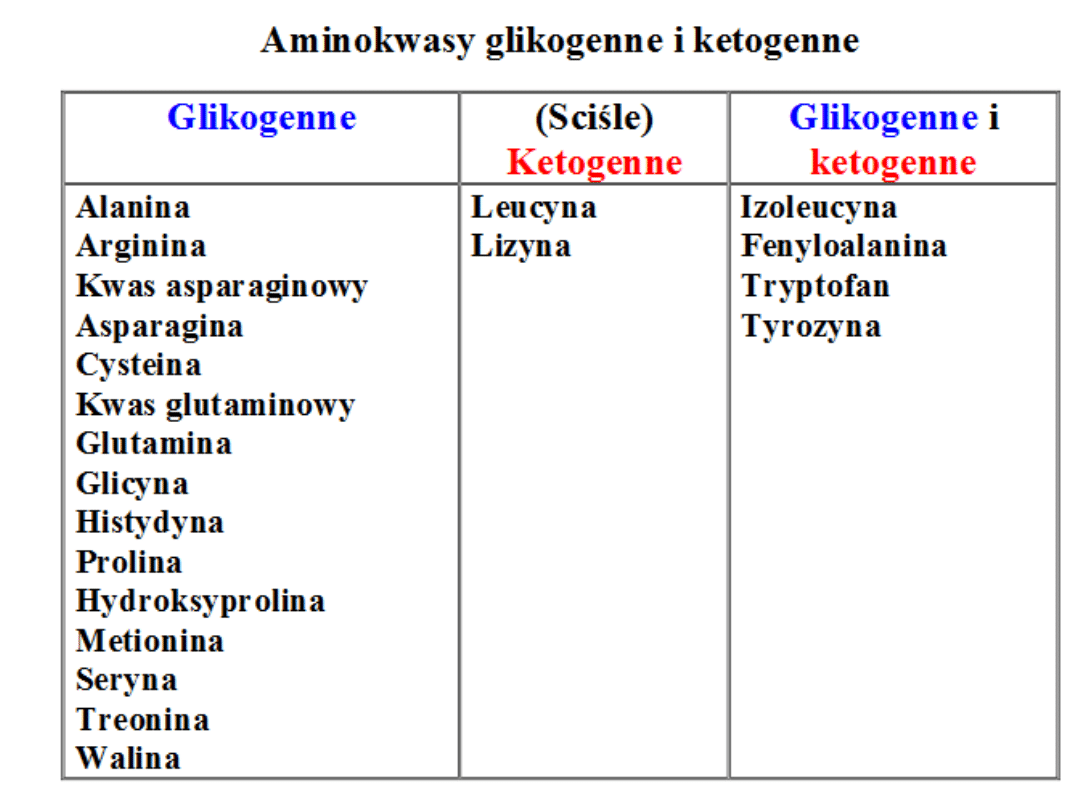
Podział aminokwasów ze względu na:
1. możliwość syntezy w ustroju (niezbędne i
nie niezbędne)
2. produkt powstały w wyniku katabolizmu
(glukogenne, ketogenne, gluko- i ketogenne)

Wartość biologiczna białek
•
Pełnowartościowe
(mięso, soja)
•
Częściowo niepełnowartościowe
(zawierają
wszystkie
aminokwasy niezbędne, ale przynajmniej jeden
w
ilości niewystarczającej (mąka, kasze)
•
Niepełnowartościowe
(kolagen, żelatyna - brak
tryptofanu, brak lizyny w kukurydzy)

Trawienie białek

W jelicie cienkim
Trypsynogen trypsyna
enterokinaza
Chymotrypsynogen chymotrypsyna
trypsyna
Trypsyna i chymotrypsyna – rozkład białek do peptydów.
Aminopeptydazy, dipeptydazy, karboxypeptydazy –
rozkład do aminokwasów.

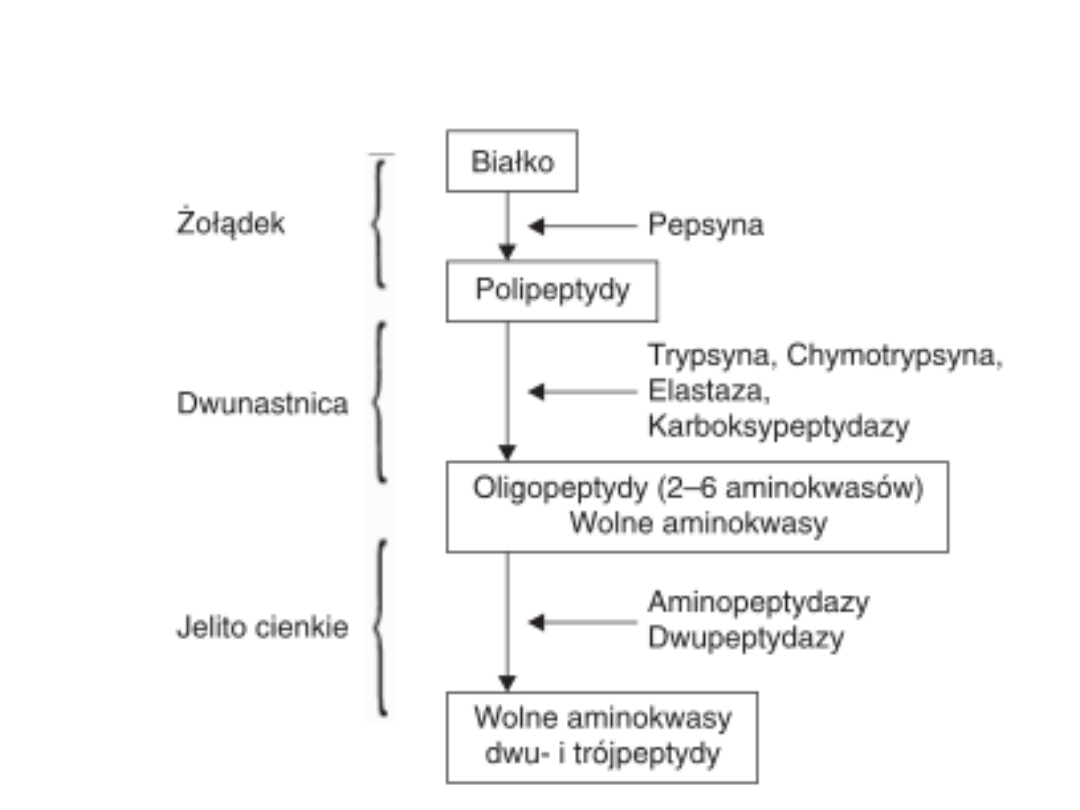
Trawienie białek

Wchłanianie aminokwasów

Bilans azotowy

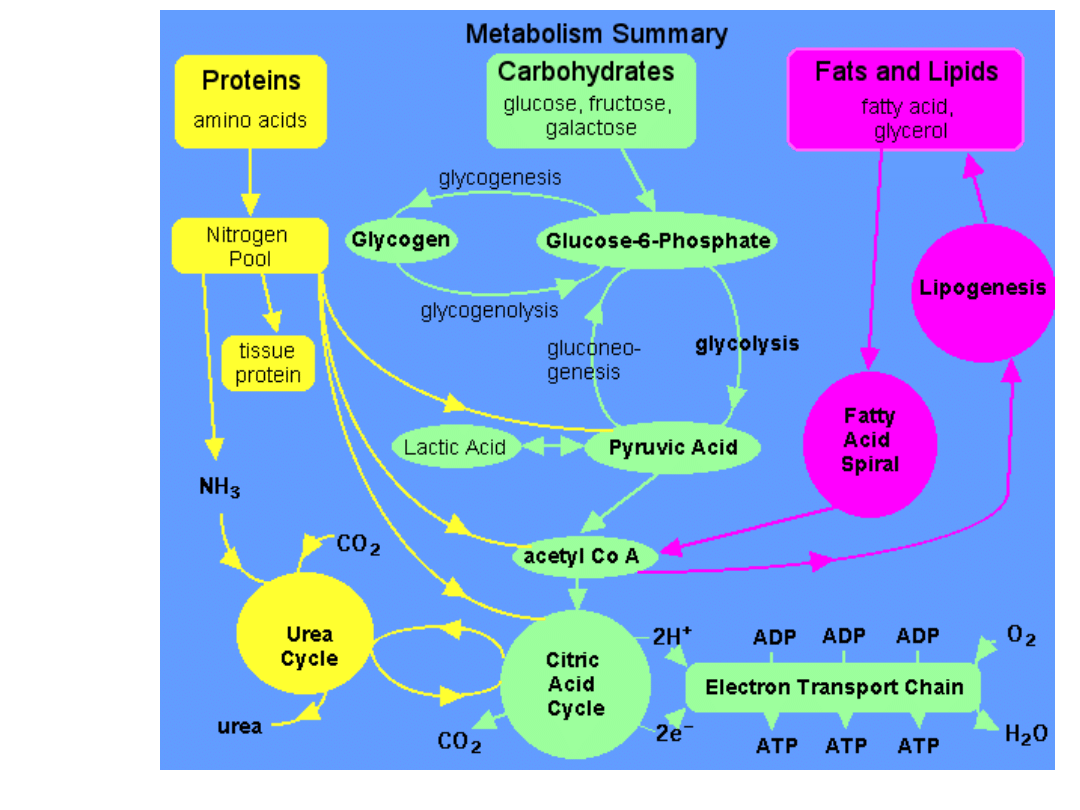
Metabolizm aminokwasów
1. źródło energii
2. do budowy endogennych białek
3. do budowy związków zawierających azot
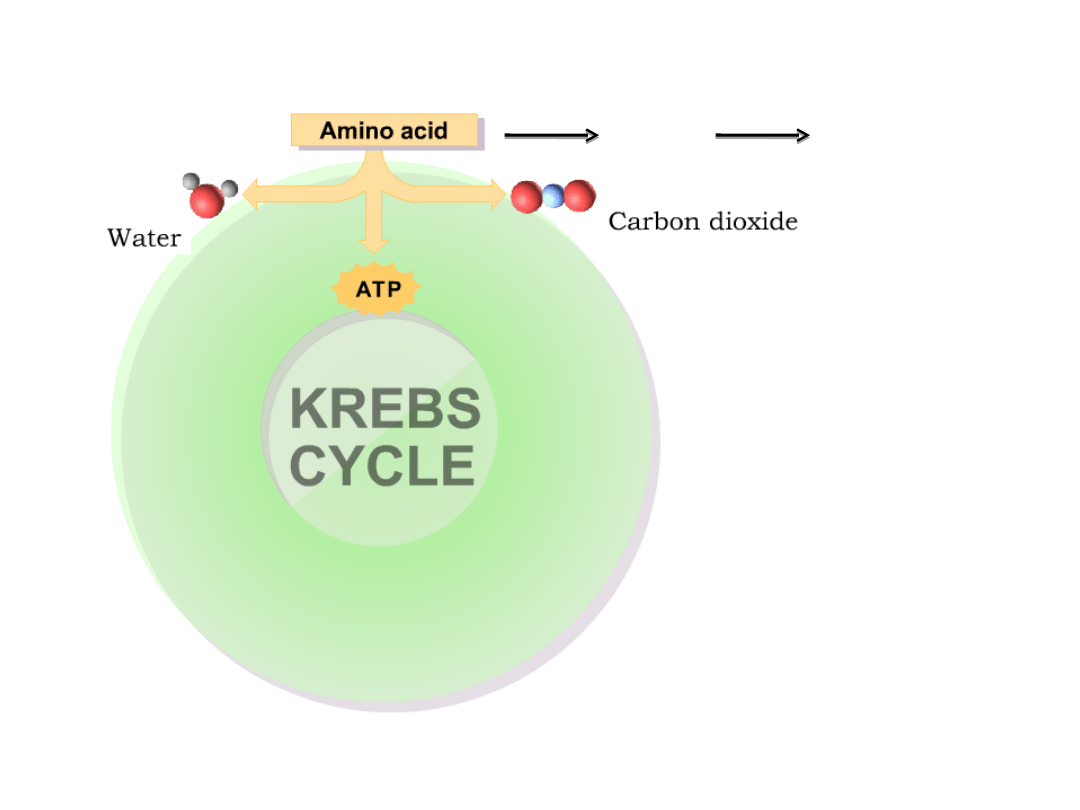
1. Aminokwasy jako źródło energii
NH
4
+
mocznik
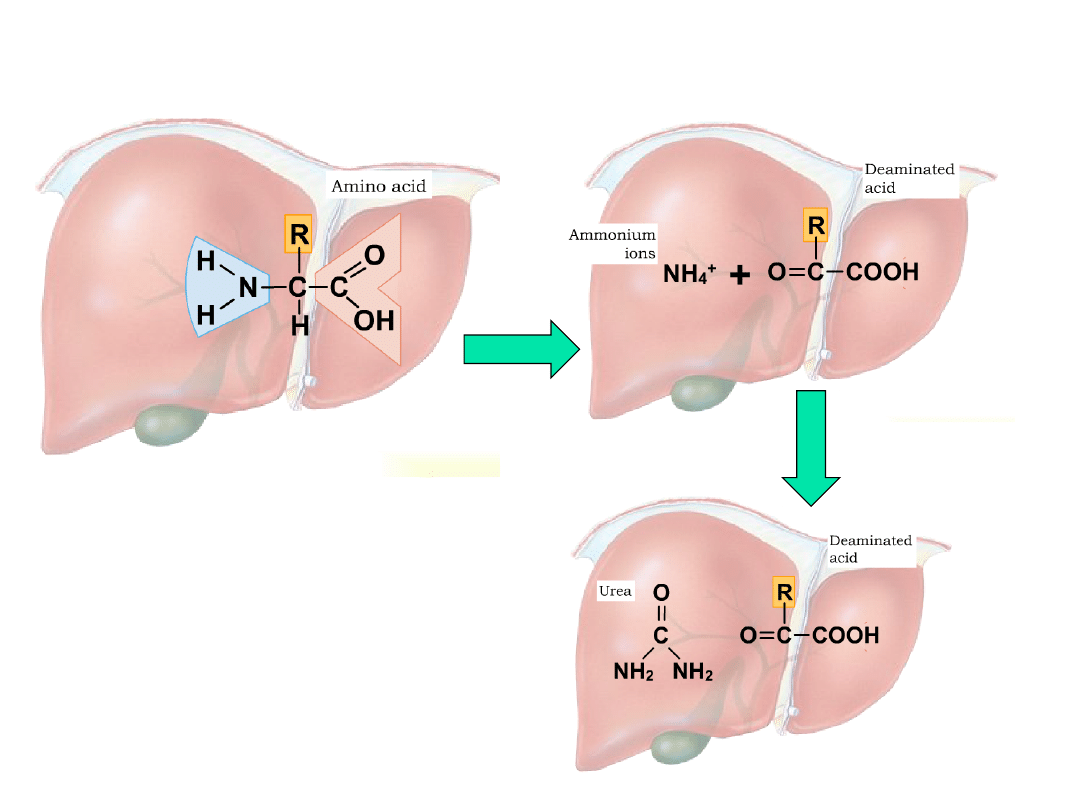
Zanim AA zostaną utlenione muszą stracić grupę
aminową

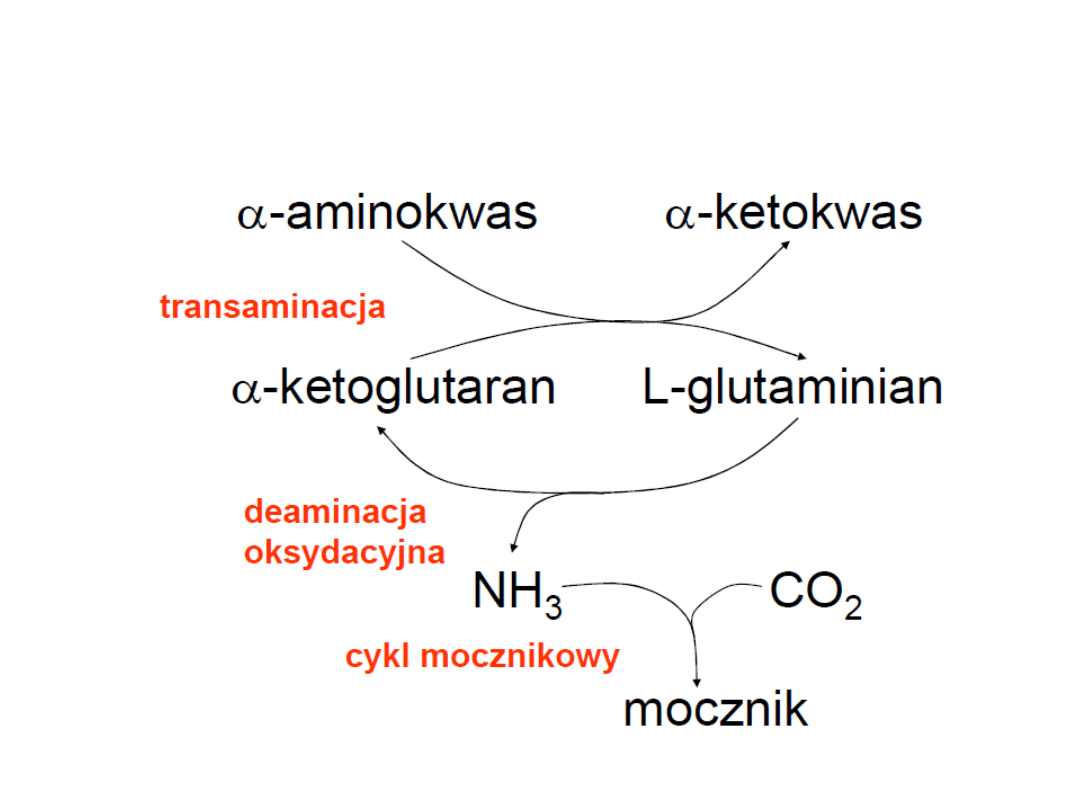
Usuwanie grupy aminowej z aminokwasów:
Główna droga
1.Transaminacja –
aminotransferazy
2. Oksydacyjna deaminacja glutaminianu –
dehydrogenaza glutaminianowa
Poboczna droga dla 4 AA
Przez
oksydazę L-aminokwasową
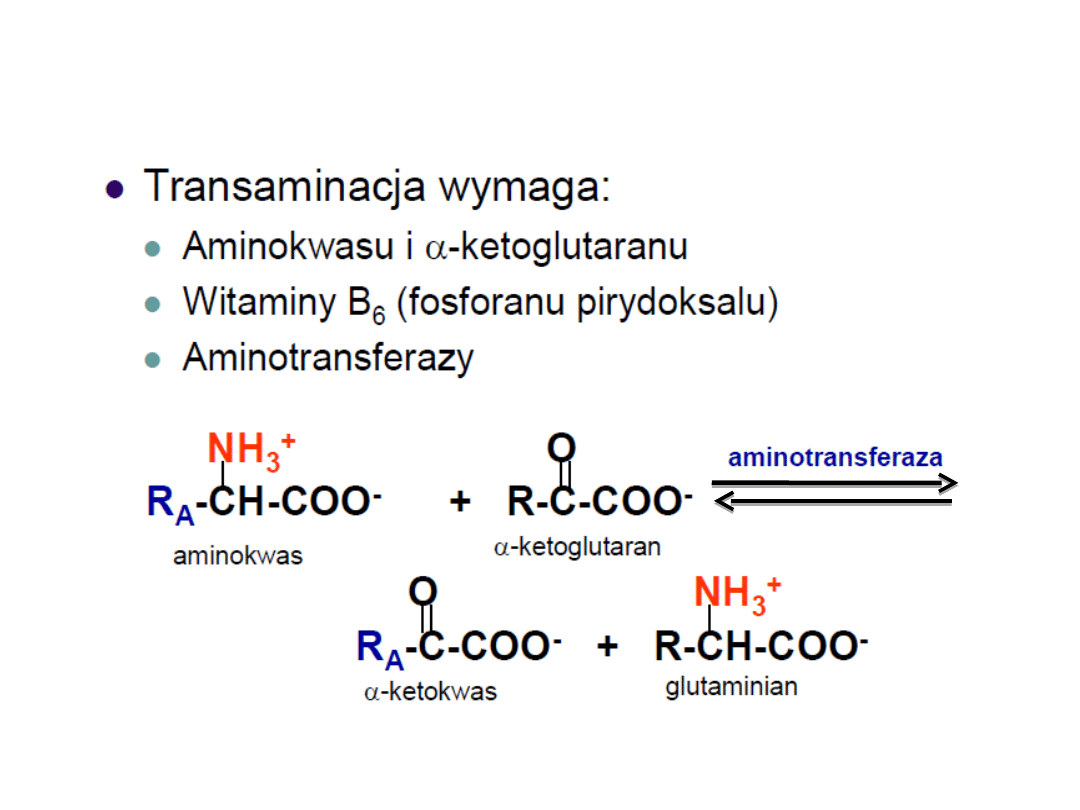
1. Transaminacja
COO
-
HC ─ NH
3
+
CH
3
COO
-
C = O
CH
2
CH
2
COO
-
+
COO
-
C = O
CH
3
COO
-
HC ─NH
3
+
CH
2
CH
2
COO
-
+
aminotrasferaza
alaninowa
Transaminacja alaniny
Transaminacji nie ulegają:
lizyna
treonina
prolina
hydroksyprolina
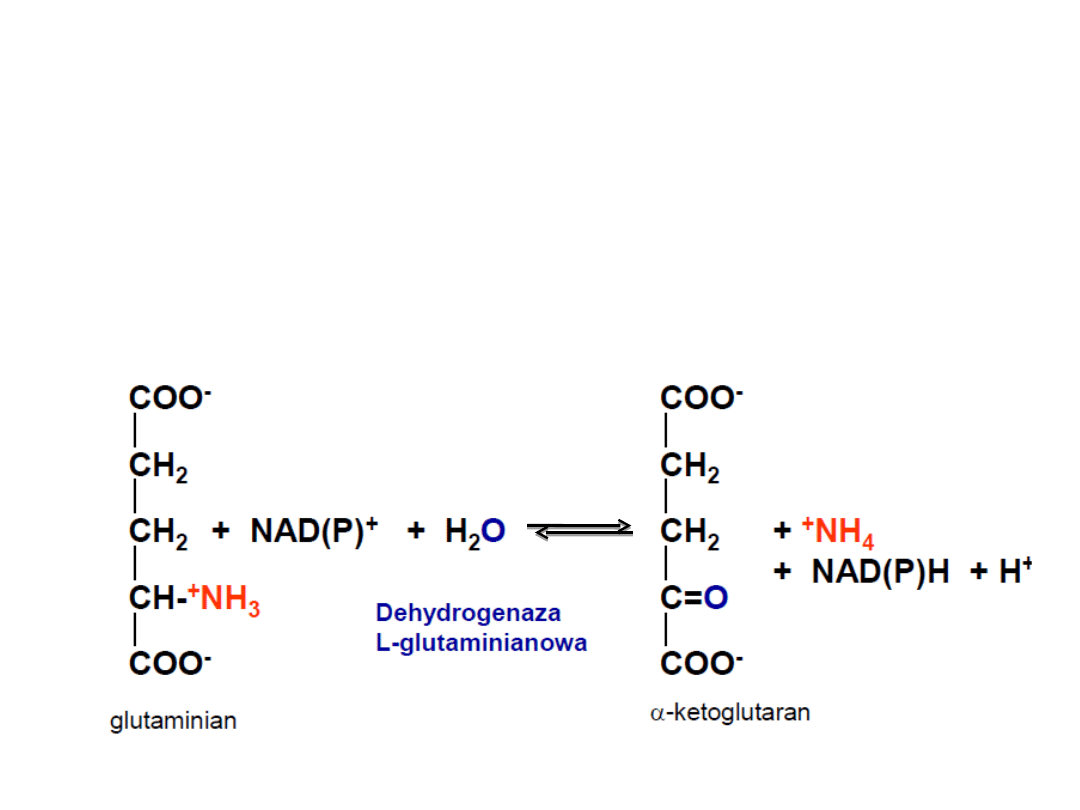
2. Oksydacyjna deaminacja glutaminianu
Utlenianie glutaminianu przez dehydrogenazę
glutaminianową .
Akceptorami wodorów są NAD
+
lub NADP
+
.
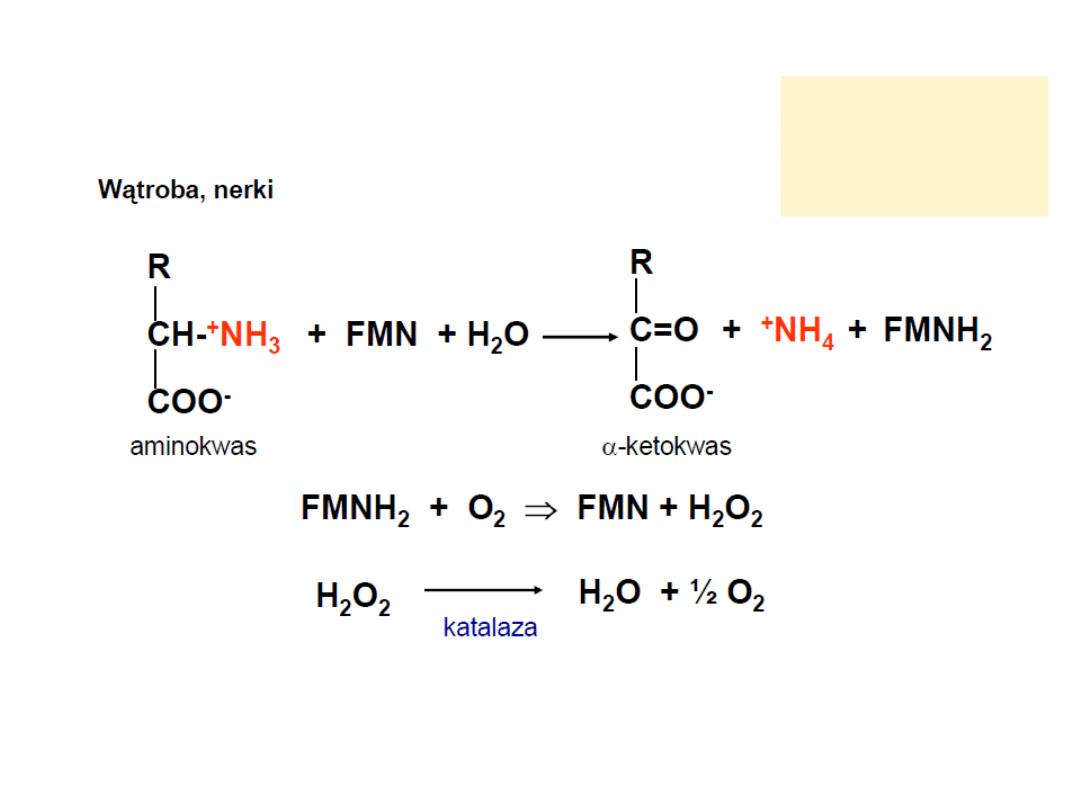
Poboczna droga - oksydaza L-aminokwasowa
lizyna
treonina
prolina
hydroksyprolina
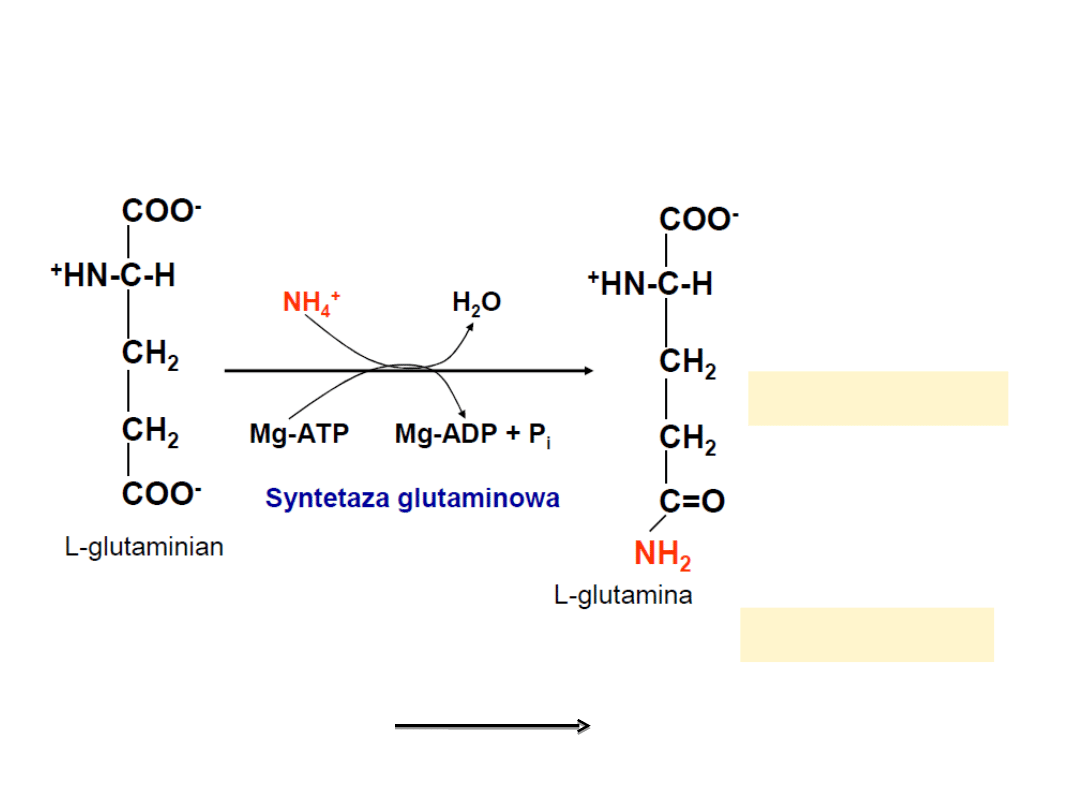
Mechanizm transportu amoniaku
Los NH
4
+
- Przekształacanie glutaminianu w glutaminę
W tkankach
glutamina + H
2
O glutaminian + NH
4
+
W wątrobie
glutaminaza
Przepływ azotu w katabolizmie aminokwasów
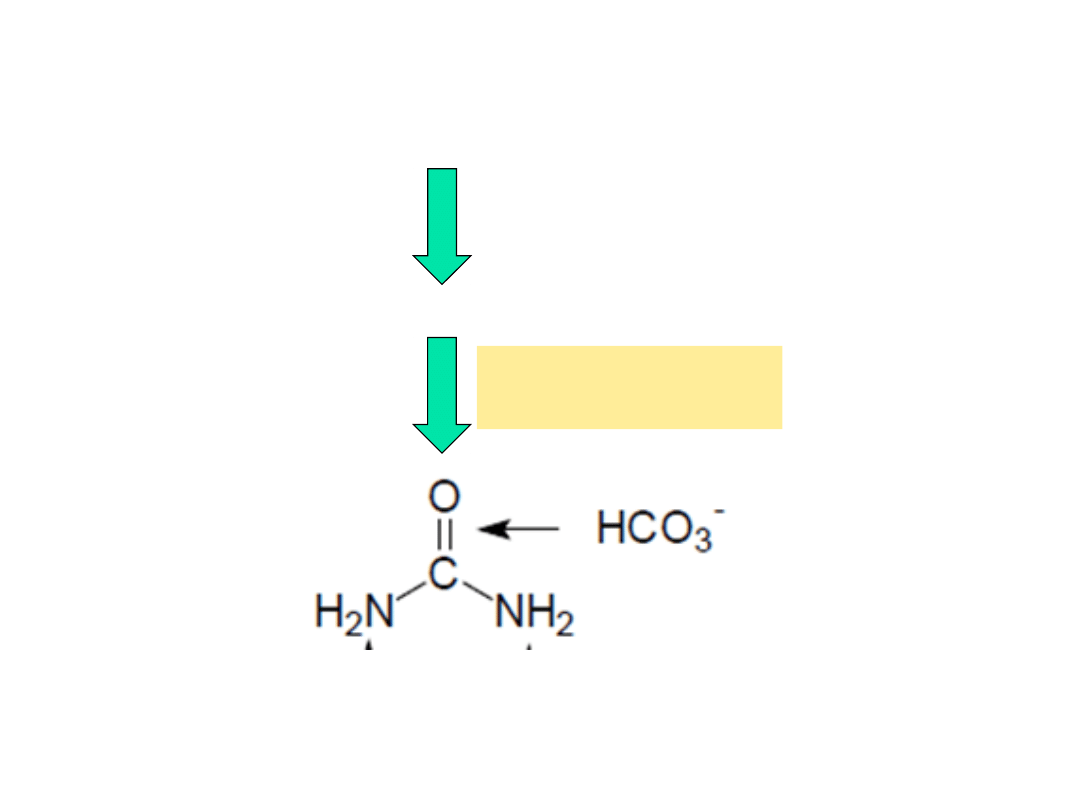
grupy aminowe (-NH
2
) aminokwasów
NH
4
+
Usuwanie azotu z organizmu
w wątrobie
cykl mocznikowy
mocznik
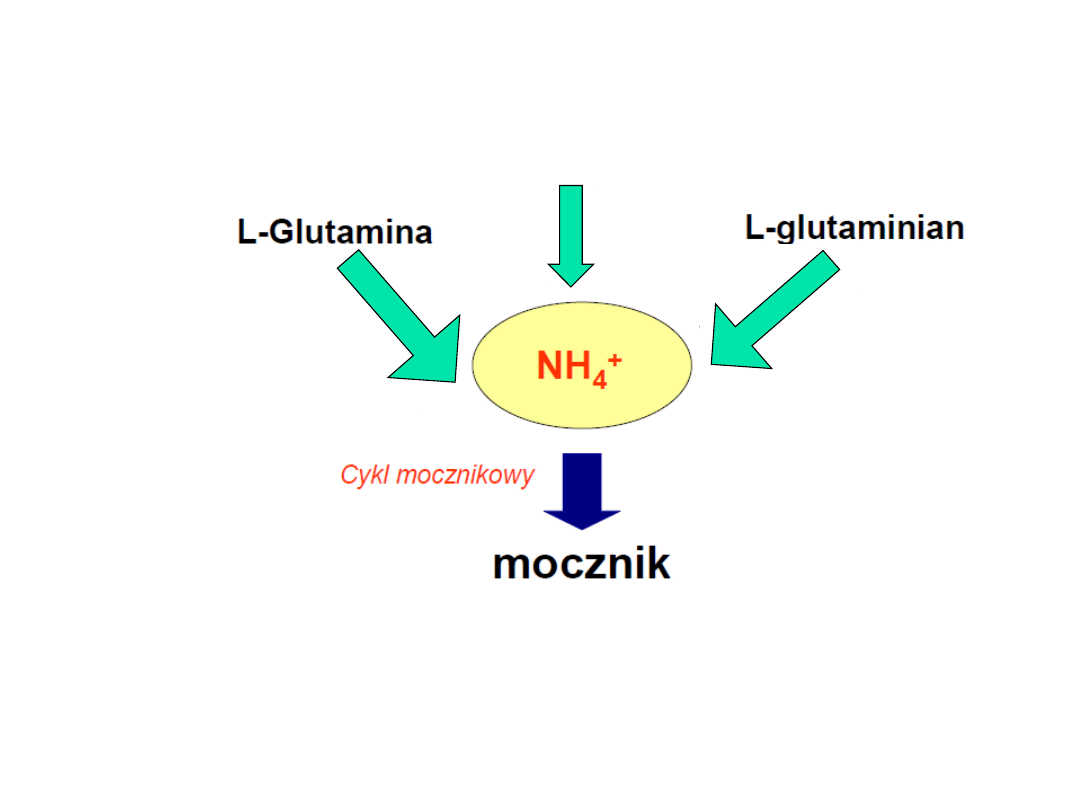
Jony NH
4
+
do cyklu
mocznikowego
Cykl purynowy
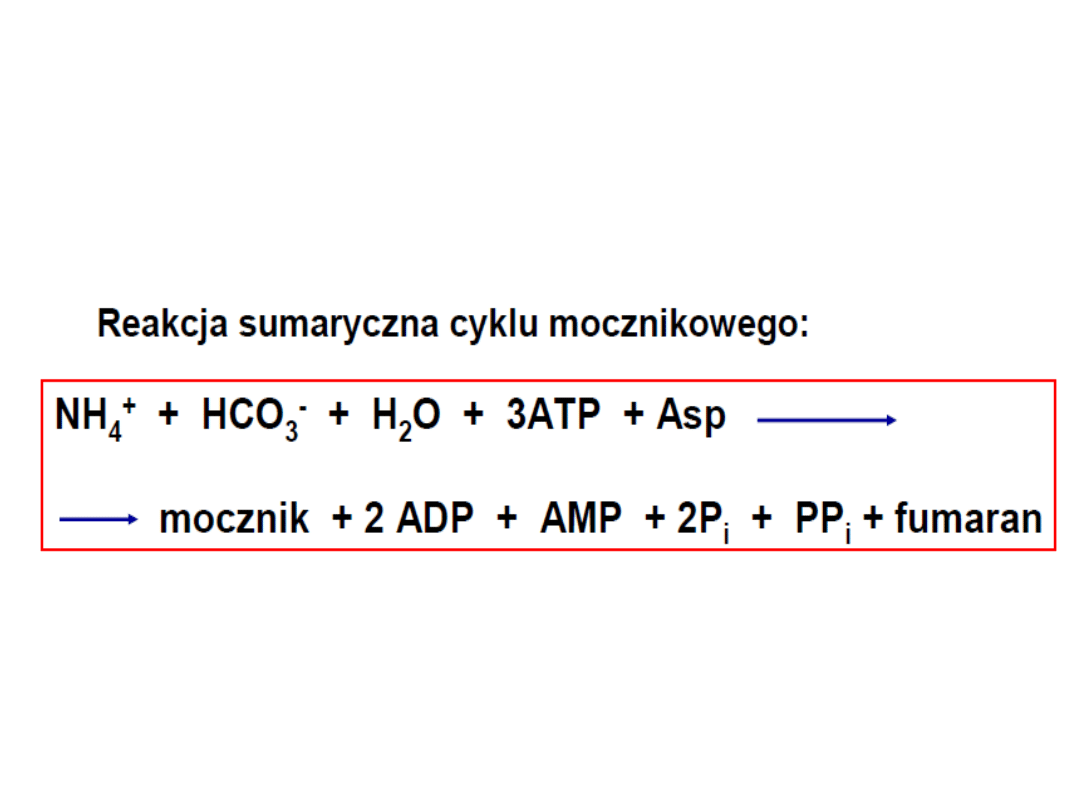
Przekształcenie silnie toksycznego amoniaku w mocznik
(w wątrobie).
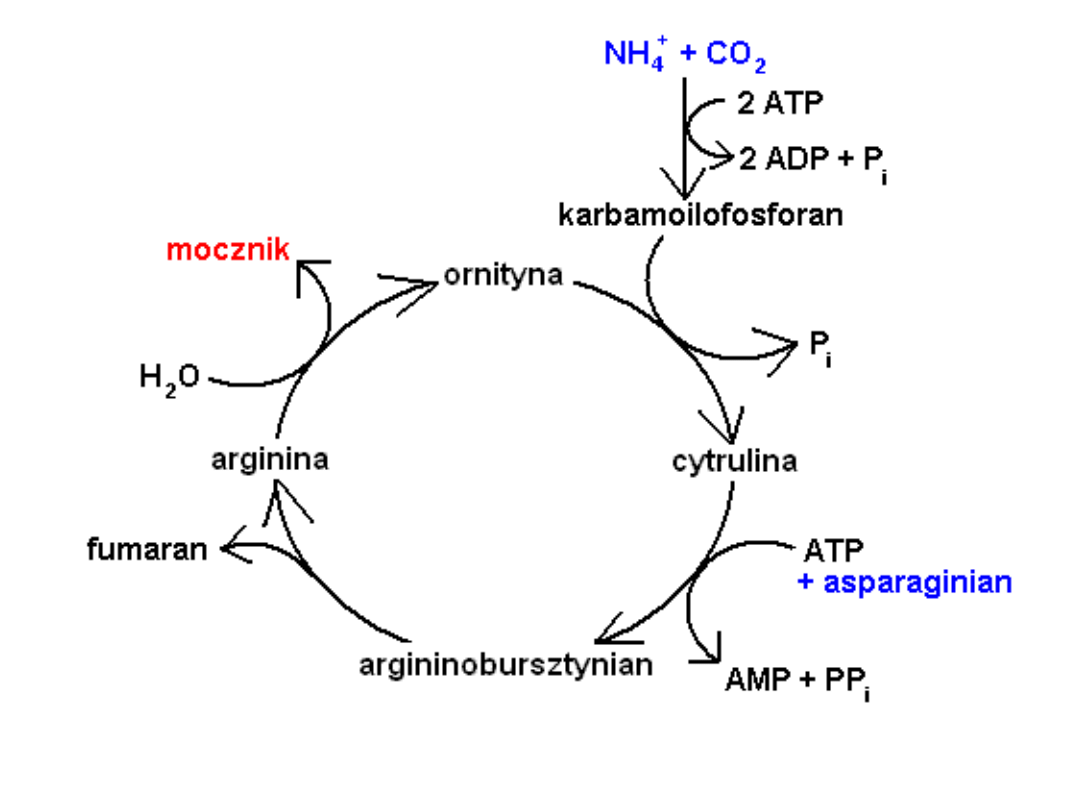
Cykl mocznikowy
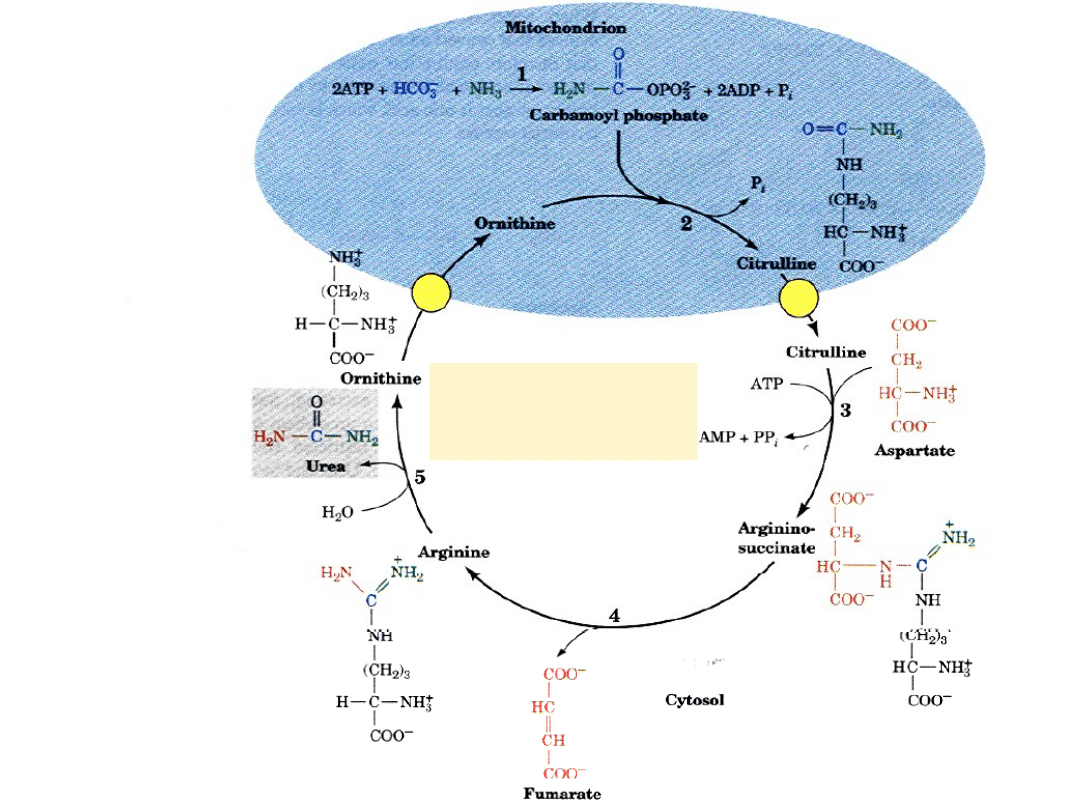
mitochondrium
cytoplazma
cykl
mocznikowy
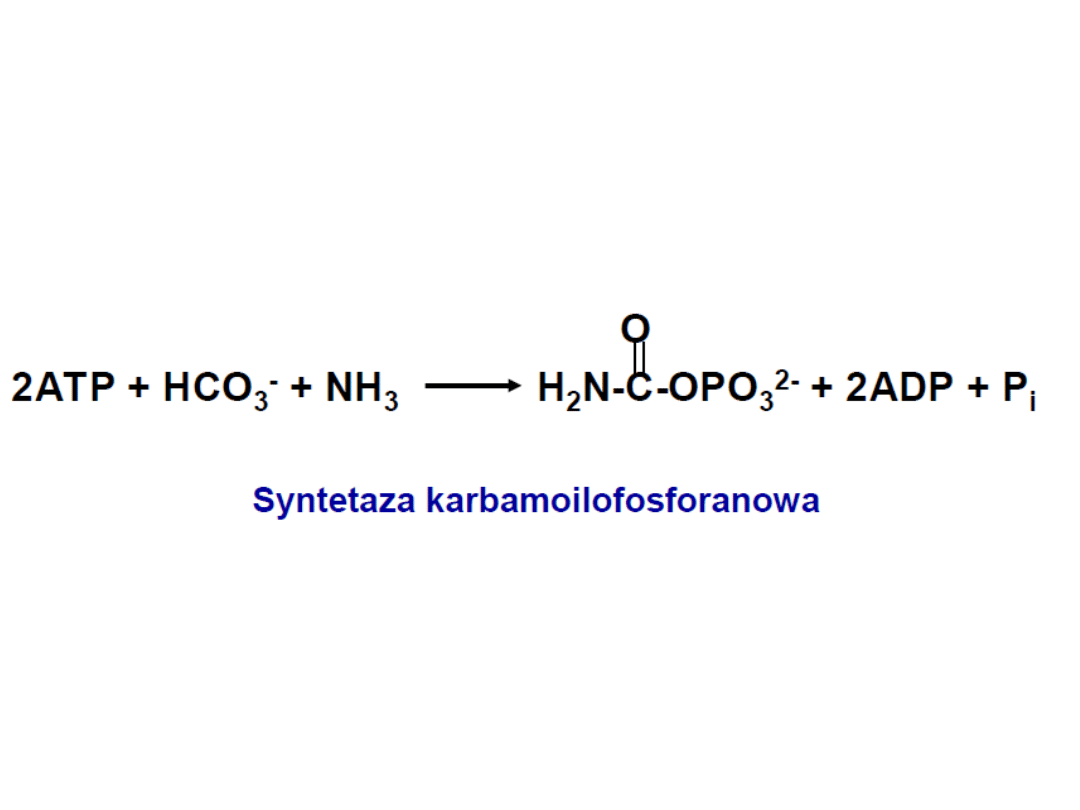
I-szy etap: powstawanie karbamoilofosforanu
Cykl mocznikowy
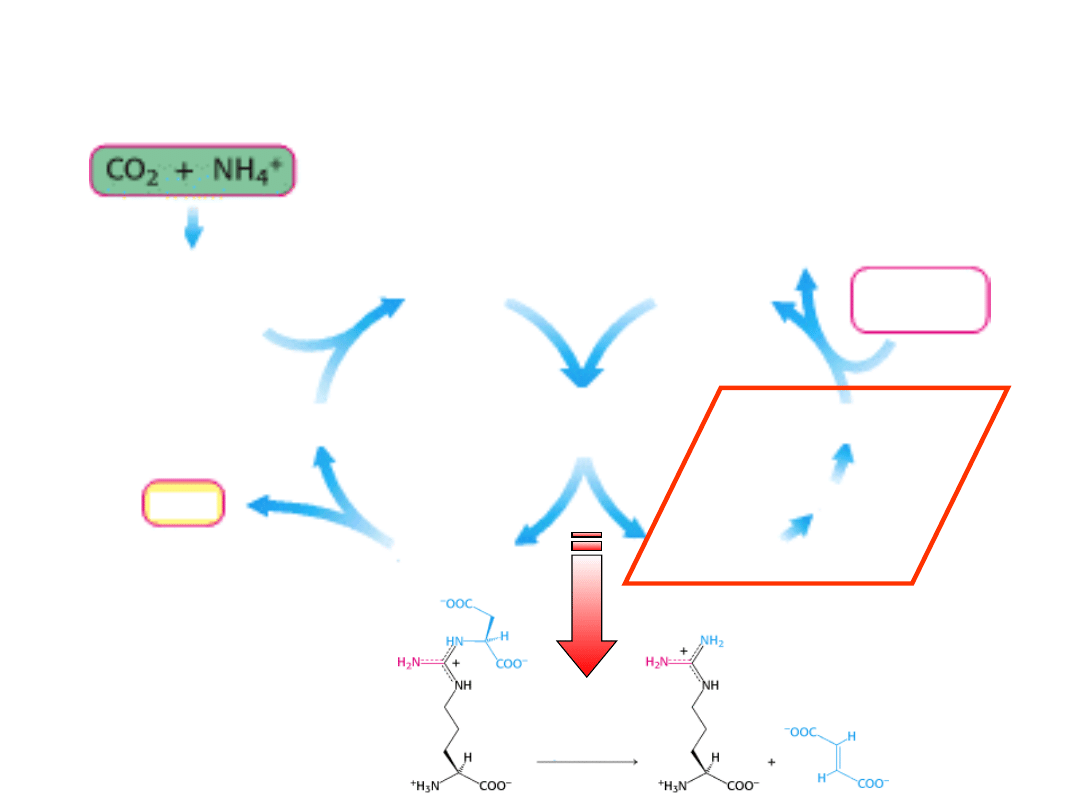
Liaza arginino-
bursztynianowa
Szczawiooctan
Szczawiooctan
Jabłczan
Jabłczan
Fumaran
Fumaran
Asparaginian
Asparaginian
-ketokwas
-ketokwas
amino
amino
kwas
kwas
Karbamoilofosforan
Karbamoilofosforan
Ornityna
Ornityna
mocznik
mocznik
Cytrulina
Cytrulina
Arginino-
Arginino-
bursztynian
bursztynian
Arginina
Arginina
CK
CK
Powiązanie cyklu mocznikowego z cyklem
Krebsa
Fumaran łączy cykl mocznikowy z cyklem Krebsa:
fumaran jabłczan szczawiooctan
Szczawiooctan może ulec:
• transaminacji do asparaginianu i wrócić do
cyklu
mocznikowego
• kondensacji z acetylo-CoA dając cytrynian
ATP
• przekształceniu w glukozę w czasie
glukoneogenezy
• przekształceniu w pirogronian

Regulacja cyklu mocznikowego
Zmiany w pożywieniu
Poziom enzymów cyklu mocznikowego rośnie:
• w diecie bogatej w białka
• w głodzie
Enzym regulatorowy -
syntetaza karbamoilofosforanowa
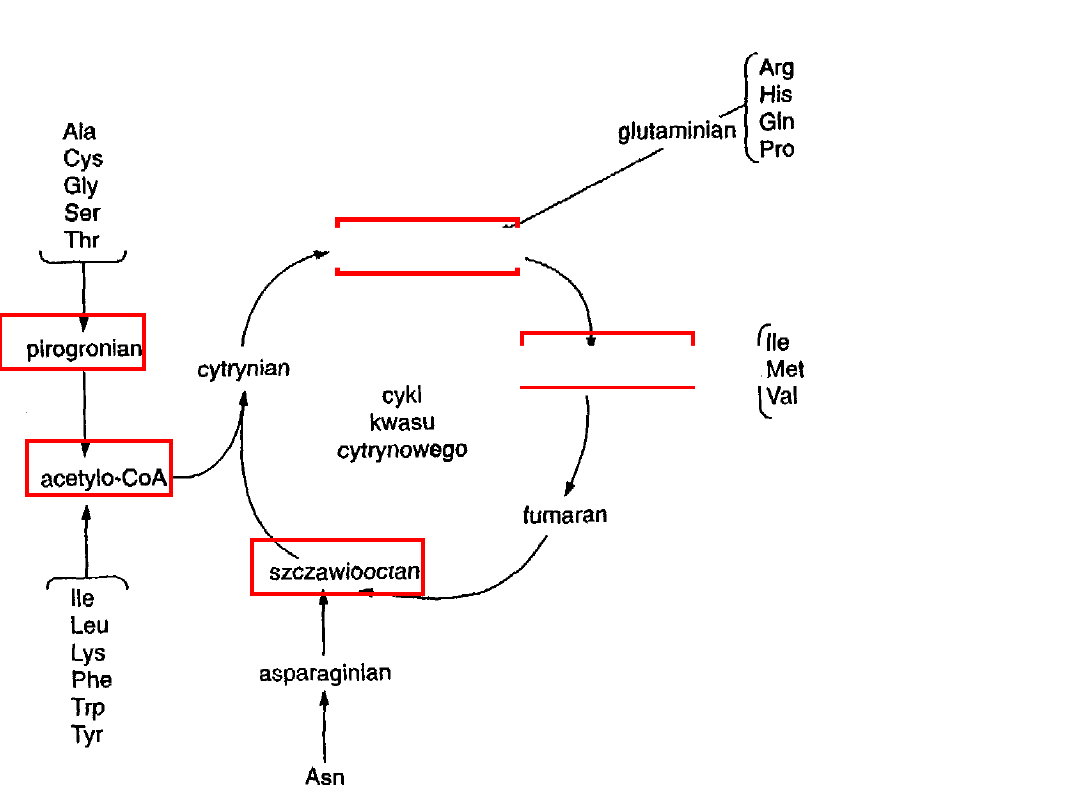
20 szkieletów AA wchodzi w 5 związków:
pirogronian AA gluko- i ketogenne
α-ketoglutaran
bursztynylo-CoA
szczawiooctan
acetylo-CoA
AA glukogenne
AA ketogenne
Losy szkieletów węglowych aminokwasów
37
Losy szkieletów węglowych
aminokwasów
ketoglutaran
bursztynylo-CoA

Najważniejsze
źródło amoniaku
w
organizmie
Polega na
cyklicznych przemianach AMP
Zachodzi w mitochondriach mięśni
szkieletowych
W wyniku pracy mięśnia, energia z
ATP jest zużywana - powstaje ADP i
fosforan nieorganiczny
Dla przebiegu cyklu niezbędny jest
asparaginian, a uwalnia się fumaran.
Cykl purynowy
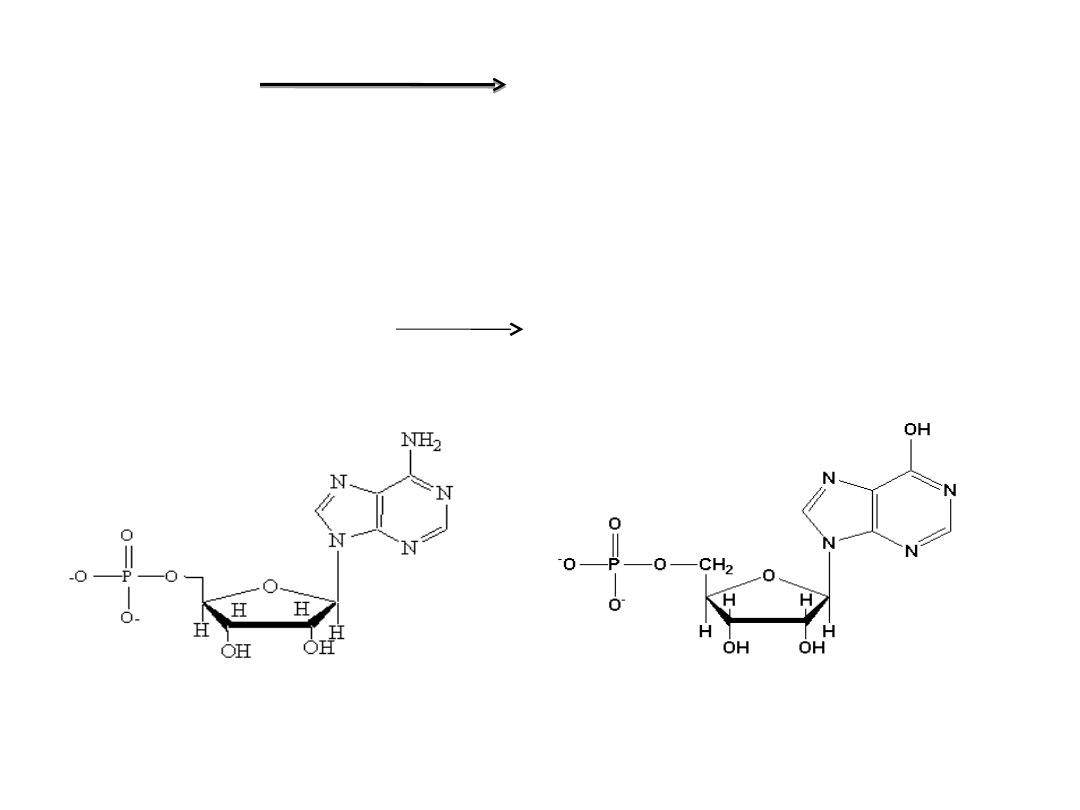
AMP + H
2
O → IMP + NH
4
+
Syntetaza
asparaginian + IMP + GTP → adenylobursztynian +
GDP + P
i
Adenylobursztynian → AMP + fumaran
AMP deaminaza
liaza
AMP
IMP
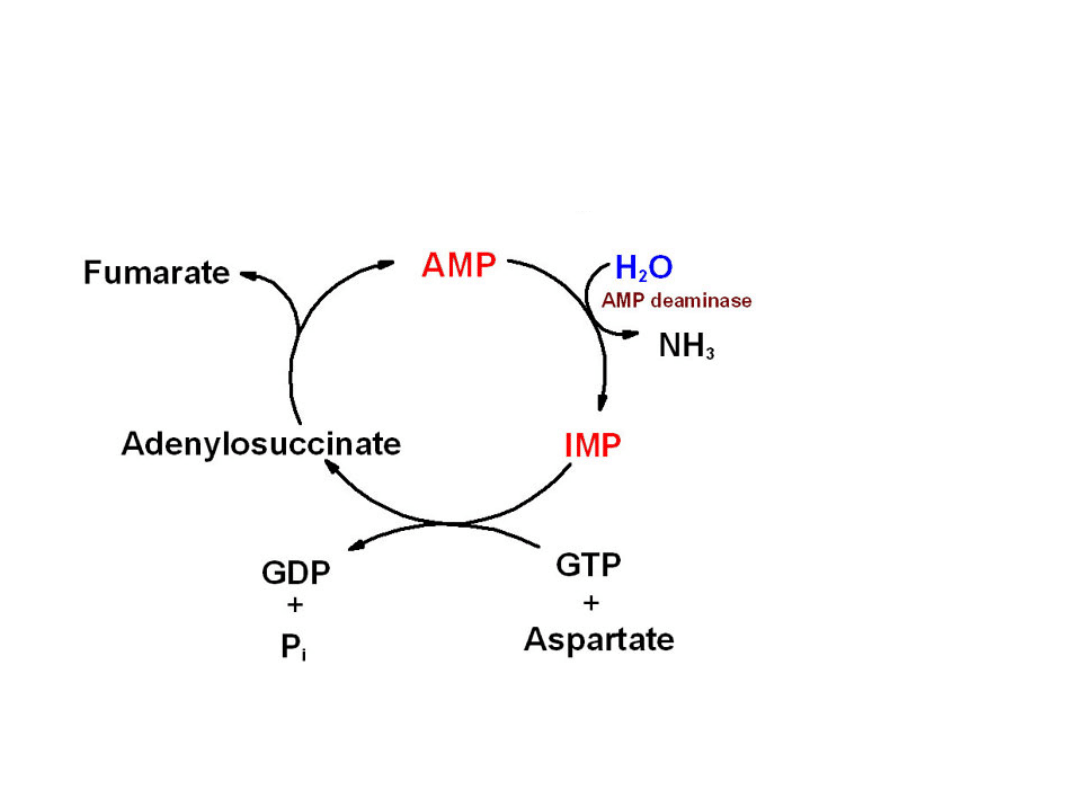
Cykl purynowy

Funkcje cyklu purynowego
1.
Utrzymanie właściwego zasobu tkankowej
puli nukleotydów adenylowych
Wzajemny stosunek nukleotydów
adenylowych zależy od aktywności
kinazy
adenylowej (miokinazy),
katalizującej
reakcję:
2 ADP ↔ ATP +
AMP
Stan równowagi powyższej reakcji zależy
od aktywności deaminazy AMP, która
przesuwa równowagę reakcji
miokinazowej w kierunku tworzenia ATP.
Jest to szczególnie ważne w czasie
intensywnej pracy mięśnia.
2.
Odtwarzanie AMP
3.
Produkcja fumaranu
4.
Wytwarzanie
amoniaku

Biosynteza aminokwasów
Rośliny i mikroorganizmy generalnie syntetyzują
wszystkie aminokwasy – zwierzęta nie.
Grupy aminowe w aminokwasach pochodzą z
glutaminianu dzięki transaminacji.
Typowa synteza aminokwasu to wykorzystanie
ketokwasu np. z cyklu Krebsa i transaminacji.

Pirogronian
Alanina
Valina
Leucyna
3-fosfoglicerynian
Seryna
Glicyna
Cysteina
Fosfoenolopirogronian
Fenyloalanina
Tyrozyna
tryptofan
Asparaginian
Asparagina
Metionina
Treonina
Izoleucyna
Lizyna
PRPP
(fosforybozylopirofosforan)
Histydyna
α-Ketoglutaran
Glutaminian
glutamina’
Prolina
Arginina
Lizyna
Biosynteza aminokwasów
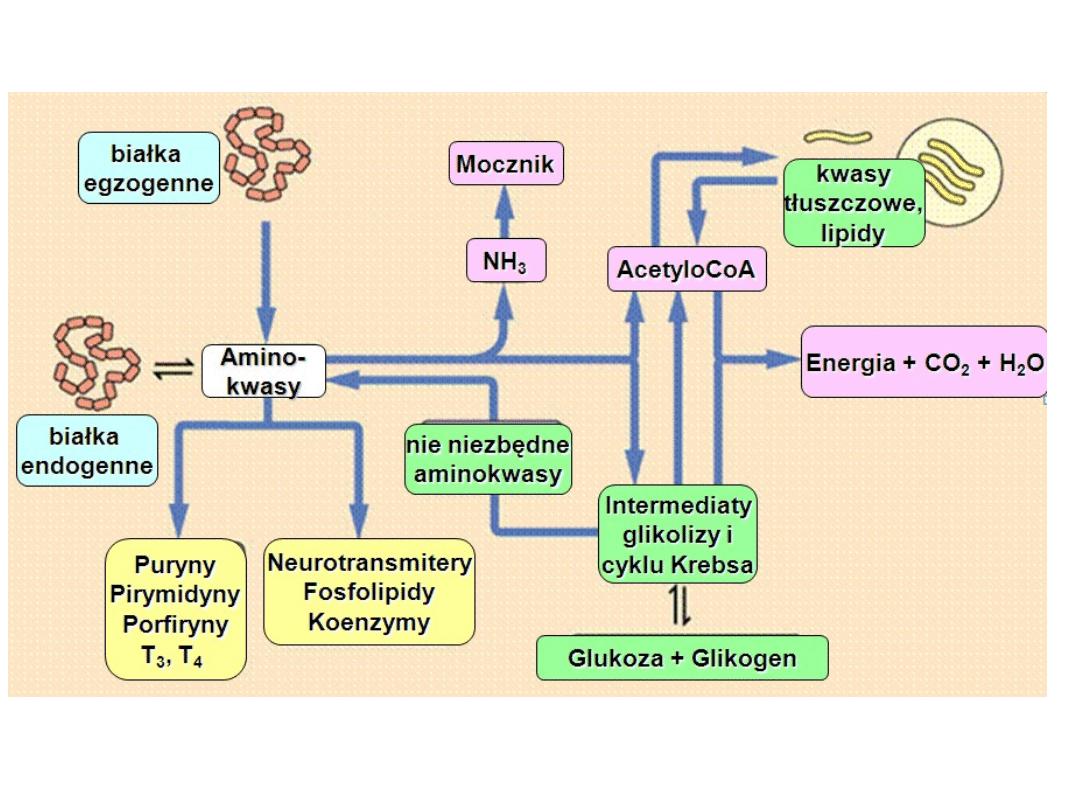
Przemiany białek
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
- Slide 40
- Slide 41
- Slide 42
- Slide 43
- Slide 44
- Slide 45
Wyszukiwarka
Podobne podstrony:
Metabolizm aminokwasów
BIOCHEMIA Metabolizm aminokwasów i białek
Odpowiedzi kolokwium metabolizm aminokwasتw
Metabolizm aminokwasów częśc Moreli
19 METABOLIZM AMINOKWASOWid 18214
Biochemia 11 Metabolizm aminokwasówK
Metabolizm aminokwasów
Metabolizm aminokwasow, Biochemia, Pomoce;)
metabolizm aminokwasów, niezbędnik rolnika 2 lepszy, biochemia, biochemia22
metabolizm aminokwasów i białek, Biologia, Biochemia
metabolizm aminokwasów
METABOLIZM AMINOKWASOW, Ratownicto Medyczne, BIOCHEMIA
Metabolizm aminokwas w2009
Metabolizm aminokwasów
POPRAWKA metabolizm aminokwasów
więcej podobnych podstron