Rodzaje wiązań
Magdalena Michalik
MSiB, gr 3
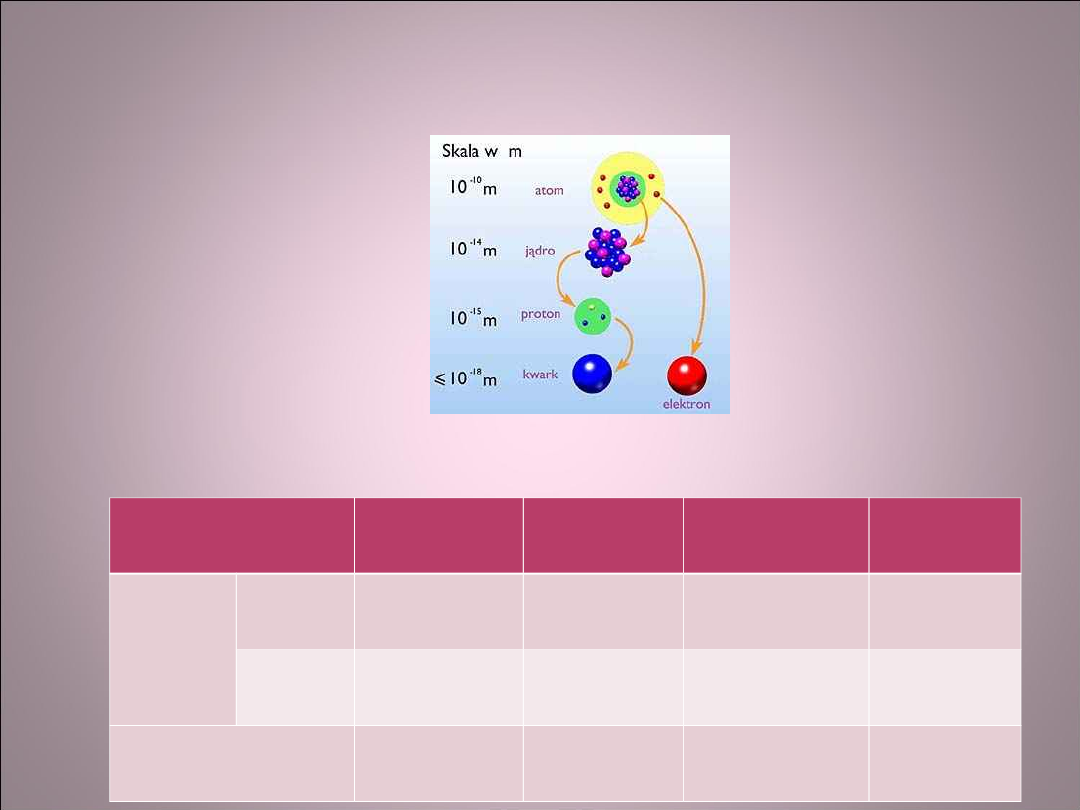
Cząstki budujące atom
Wielkość cząstek
Właściwości cząstek
Cząstka
Masa, g
Masa, u
Ładunek,
C
Symbol
Nukleo
ny
proton 1,6726*10
-
24
1,00728
+1,602*10
-
19
p
neutro
n
1,6749*10
-
24
1,00867
0
n
elektron
0,91096*1
0
-27
1/1836
-1,602*10
-19
e

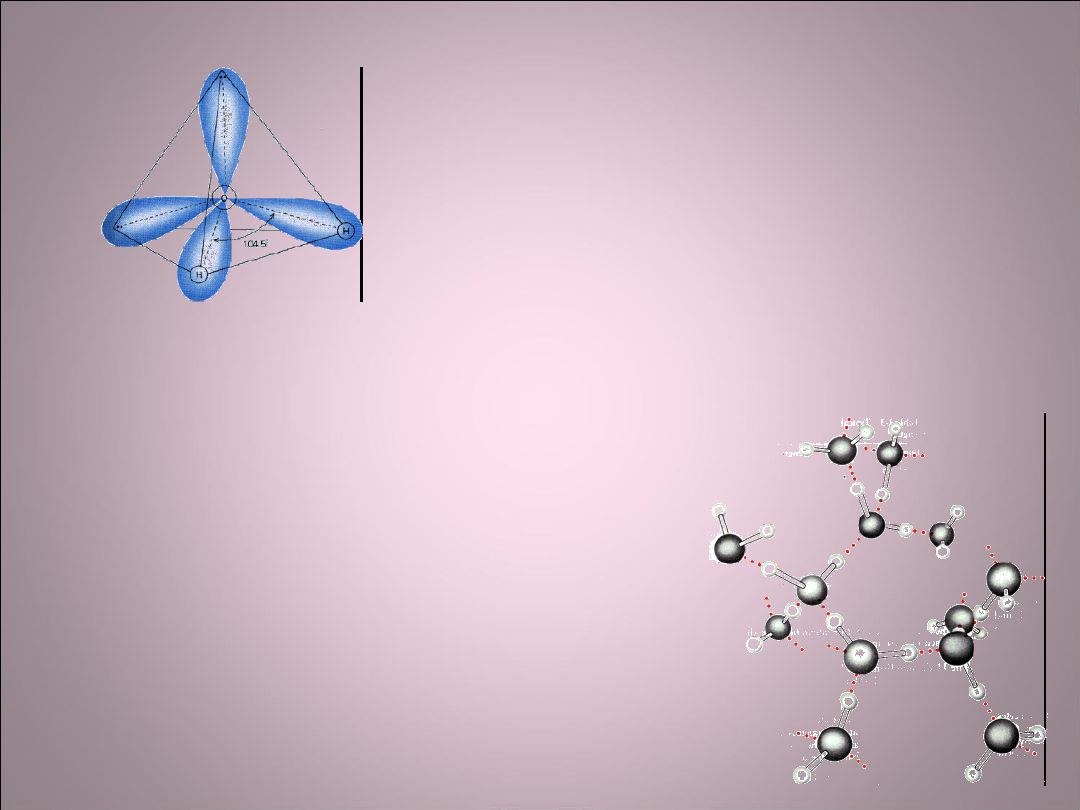
Elektronowa struktura
atomów
• Elektrony o ujemnym ładunku otaczają
dodatnio naładowane jądra.
• Jądro zawiera prawie całą masę atomu,
lecz w porównaniu do całego atomu jest bardzo
małe.
• Elektrony poruszają się jedynie po ściśle
określonych orbitach atomowych zwanych
dozwolonymi lub stacjonarnymi.
• Elektrony znajdujące się na orbicie najbardziej
oddalonej od jądra nazywamy elektronami
walencyjnymi.

Wiązania chemiczne
• Wiązania chemiczne są wynikiem
oddziaływania atomów ze sobą.
• Rodzaj wiązania pomiędzy atomami
zależy od struktury atomu. Jest to
związane z różnym sposobem
uzyskiwania stabilnej elektronowej
konfiguracji zewnętrznej powłoki.
• Atomy dążą do uzyskiwania
konfiguracji gazu szlachetnego.

Rodzaje wiązań pierwotnych
• Wyróżniamy wiązania:
– jonowe
– kowalencyjne (atomowe)
– kowalencyjne spolaryzowane
– koordynacyjne
– metaliczne
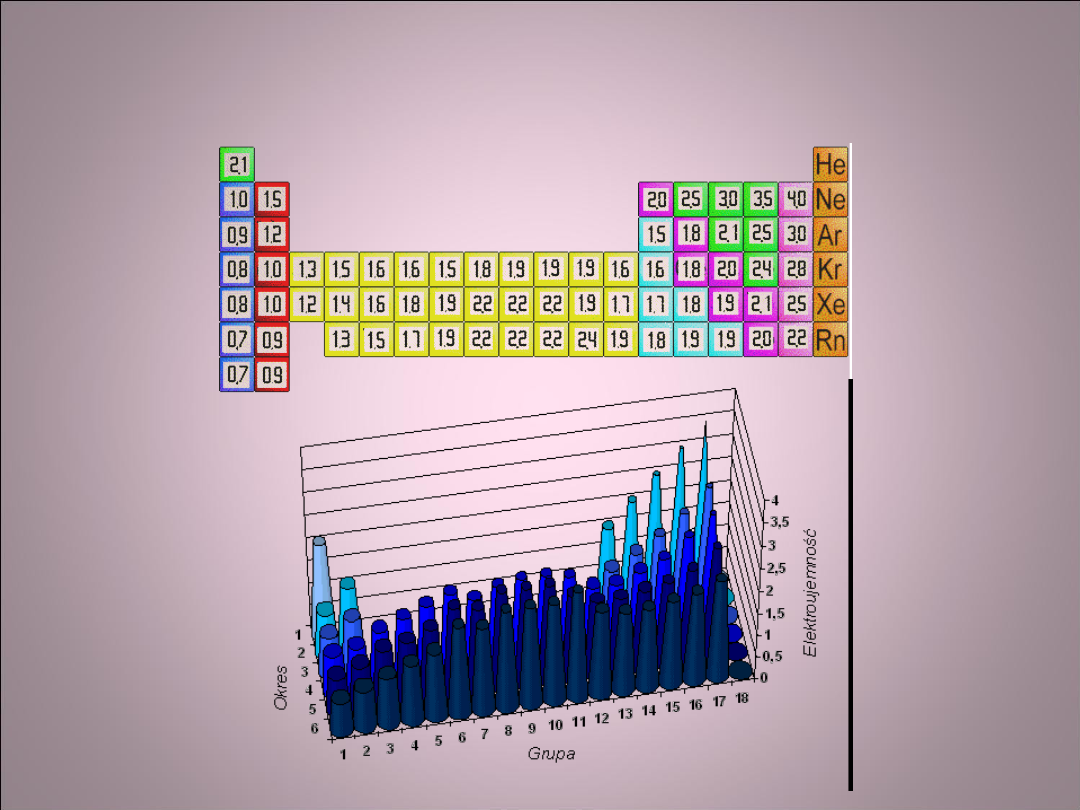
Skala elektroujemności
Paulinga
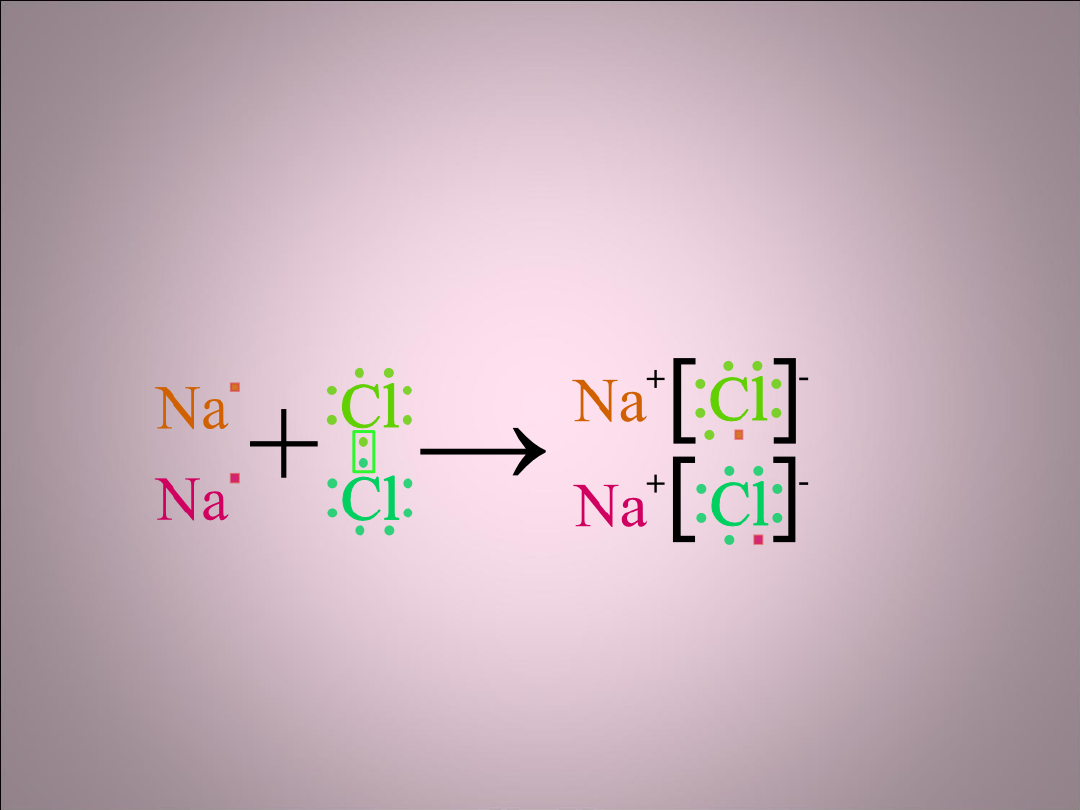
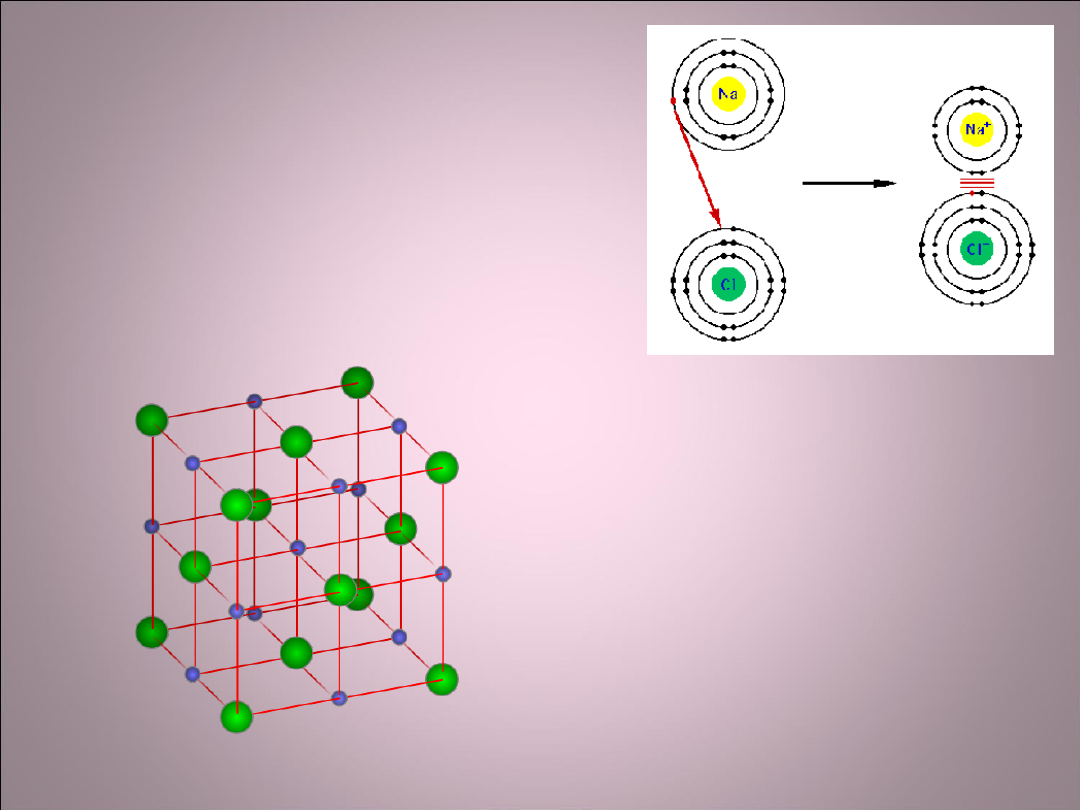
Wiązanie jonowe
• To elektrostatyczne przyciąganie między
jonami o przeciwnych znakach, np. Na
+
Cl
-
w
NaCl. Atomy tworzące wiązanie jonowe
muszą się bardzo różnić elektroujemnością.
Dzięki temu, że elektron przechodzi z
zewnętrznej powłoki Na do Cl powstają
trwalsze
struktury elektronowe- każdy z atomów ma
całkowicie zapełnioną zewnętrzną powłokę.
• Między powstałymi jonami występują
siły elektrostatycznego przyciągania. Kation Na
+
przyciąga anion Cl- ze wszystkich kierunków
z taką samą siłą. Bezkierunkowy charakter
wiązań jonowych powoduje tworzenie się
struktur krystalicznych.
•
Poszczególne jony dążą do
tego, aby w ich bezpośrednim
sąsiedztwie była możliwie
największa liczba jonów
przeciwnych.
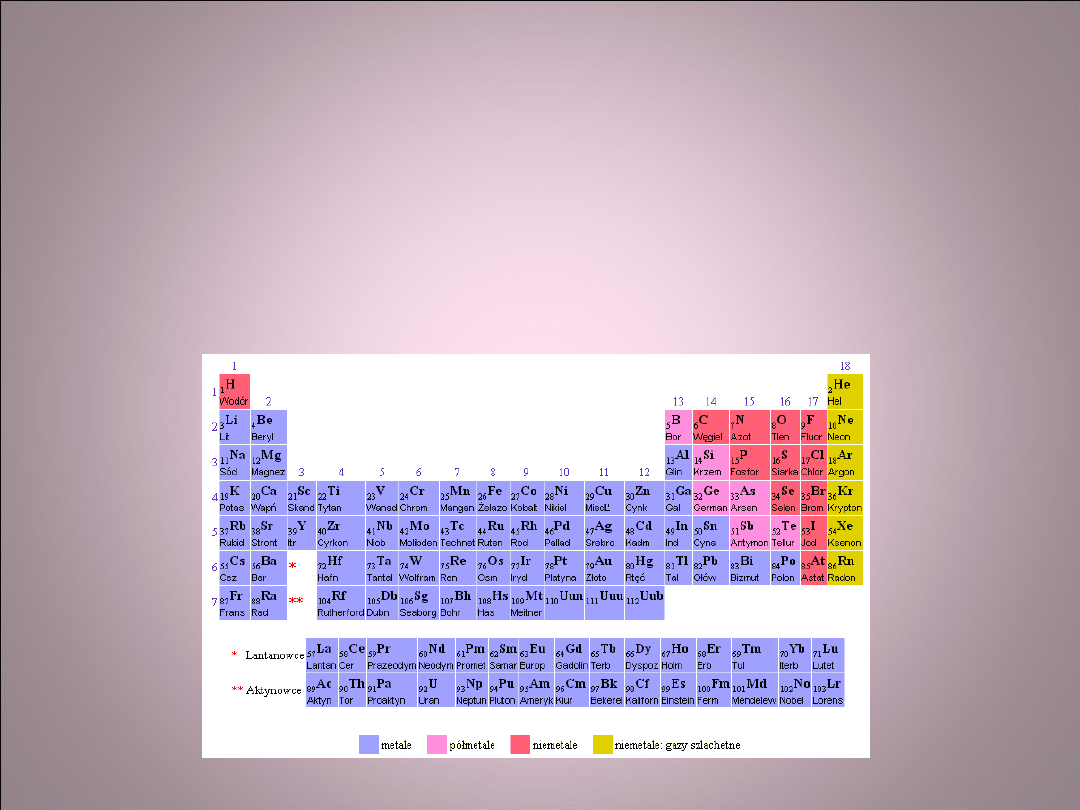
• Wiązanie jonowe występuje zawsze
pomiędzy atomami pierwiastków
metalicznych i niemetalicznych. Jest to
związane z właściwościami tych
pierwiastków. Atomy metali łatwo oddają
elektrony, natomiast atomy niemetali łatwo
je przejmują.
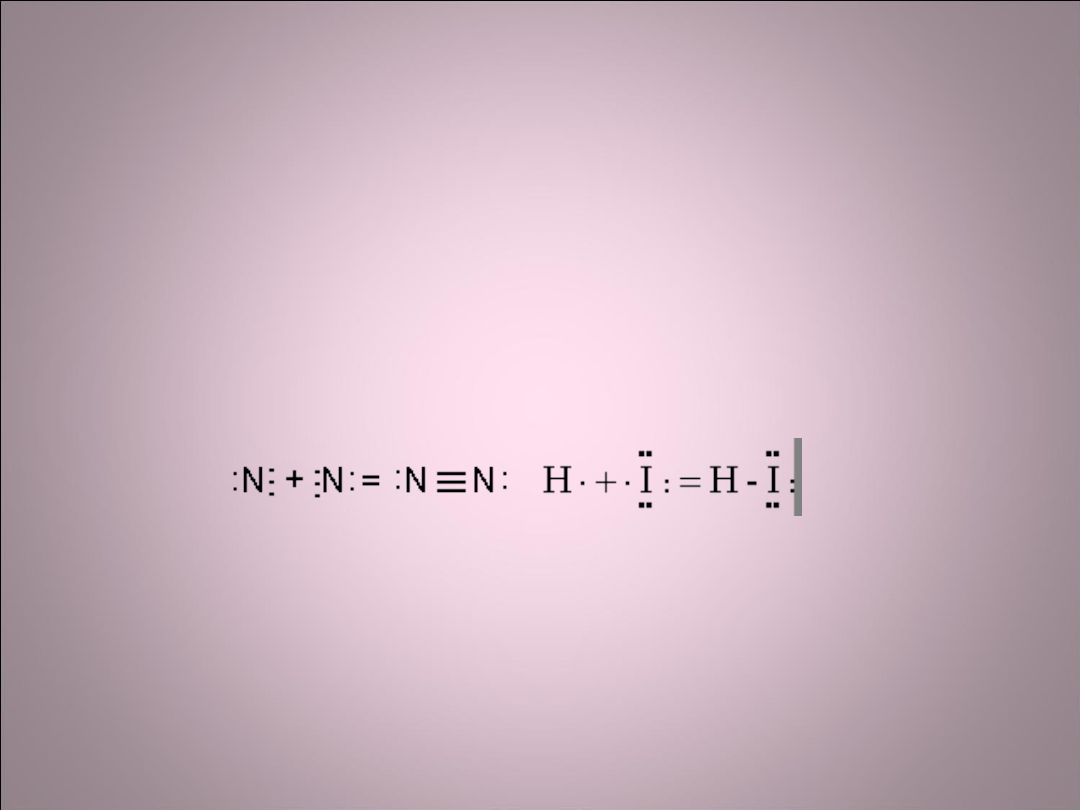
Wiązanie kowalencyjne
(atomowe)
• Powstaje wtedy, gdy dwa atomy mające
niesparowane elektrony stworzą z tych
elektronów wspólną parę elektronową.
Atomy tworzące wiązanie kowalencyjne
muszą mieć podobną, lub taką samą
elektroujemność, np. H-H.
• Uwspólnianie elektronów ma na celu
uzyskanie konfiguracji gazu
szlachetnego, ponieważ jest ona
najtrwalsza.
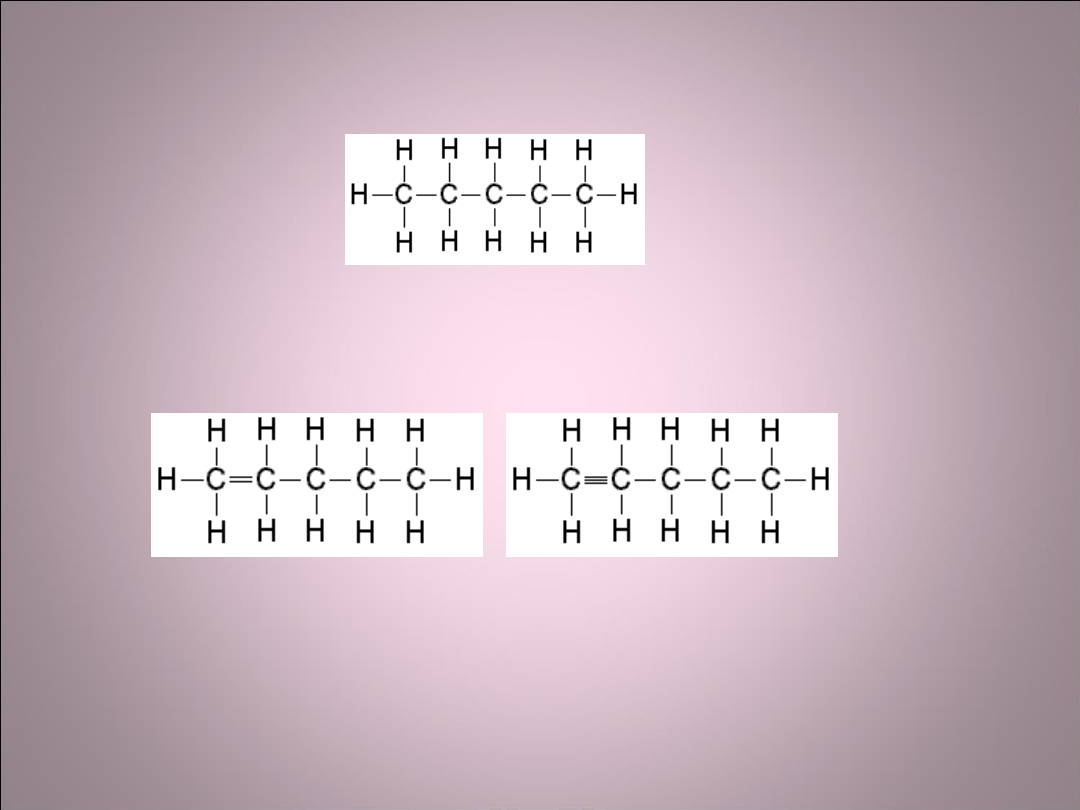
• Związki węgla, w których występują pojedyncze
wiązania między atomami węgla to związki
nasycone.
• Związki węgla, w których występują wiązania
podwójne lub potrójne to związki nienasycone.
• Związki nienasycone mogą podlegać reakcjom
chemicznym, w wyniku których nowe atomy
wchodzą do cząsteczki, np.C
2
H
4
może tworzyć
polietylen.
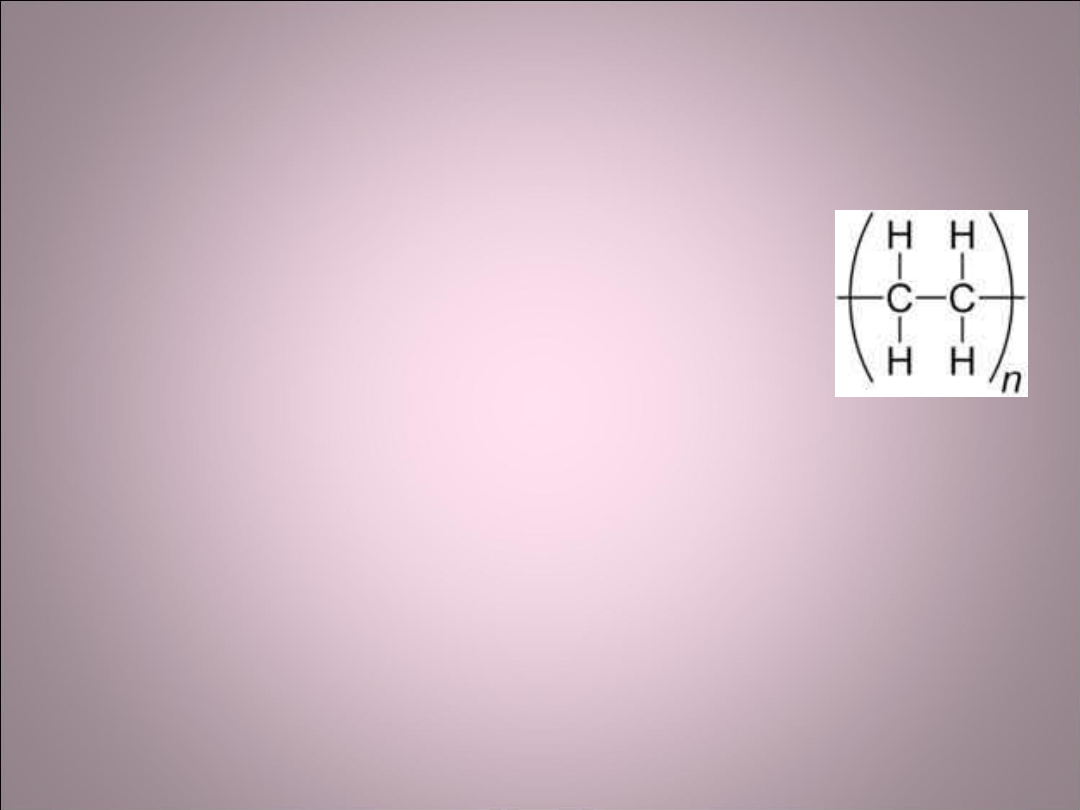
• W polietylenie w cząsteczkach polimerycznych
występują mocne wiązania kowalencyjne. Między
sąsiednimi cząsteczkami natomiast słabe wiązania
wtórne. Powodują one, że polimery mają małą
sztywność i wytrzymałość oraz niską temperaturę
topnienia.
• Czyste wiązania kowalencyjne występują
w diamencie, krzemie i germanie. W krzemianach
to dominujący tym wiązań. Występują także
w metalach wysokotopliwych (np. wolfram, molibden,
tantal).
Wiązania te są bardzo mocne, gdyż do ich zerwania
potrzeba bardzo dużo energii, stąd wysokie
temperatury topnienia powyższych pierwiastków.
• Wiązania kowalencyjne wykazują kierunkowość.
Działają w kierunku równoległym do linii łączącej środki
atomów.
Polietylen
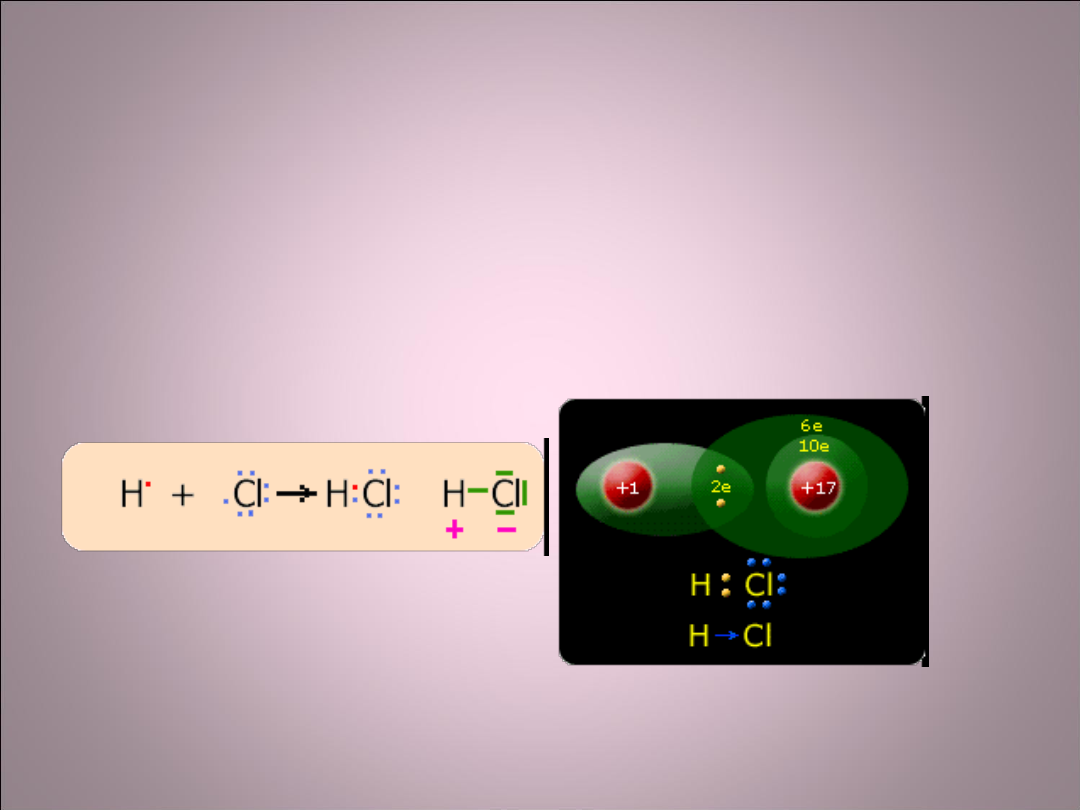
Wiązanie kowalencyjne
spolaryzowane
• Powstaje wtedy, gdy dwa atomy mające
niesparowane elektrony stworzą z tych
elektronów wspólną parę elektronową.
Para ta przesunięta jest w stronę bardziej
elektroujemnego atomu.
Mechanizm powstawania
wiązania kowalencyjnego
spolaryzowanego w cząsteczce
chlorowodoru.
H- 2,1
Cl- 3,0
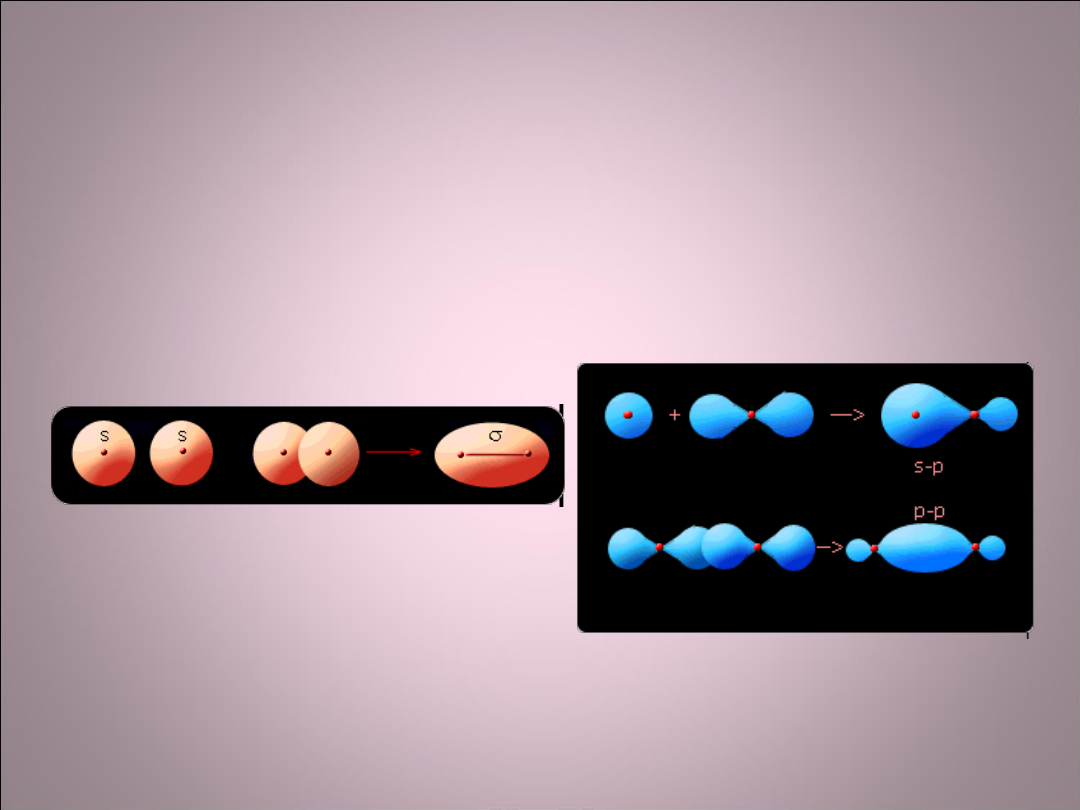
Wiązanie σ
• Wiązania kowalencyjne, koordynacyjne i kowalencyjne
spolaryzowane istnieją dzięki przenikaniu się orbitali.
• Wiązania typu σ powstają na skutek czołowego
przenikania się orbitali.
• Cząstki mające wiązania σ
Mają możliwość obrotu atomu
wokół osi wiązania
Powstawanie wiązania s w
cząsteczce H
2
(s-s)
Powstawanie wiązania s (s-p i p-p)
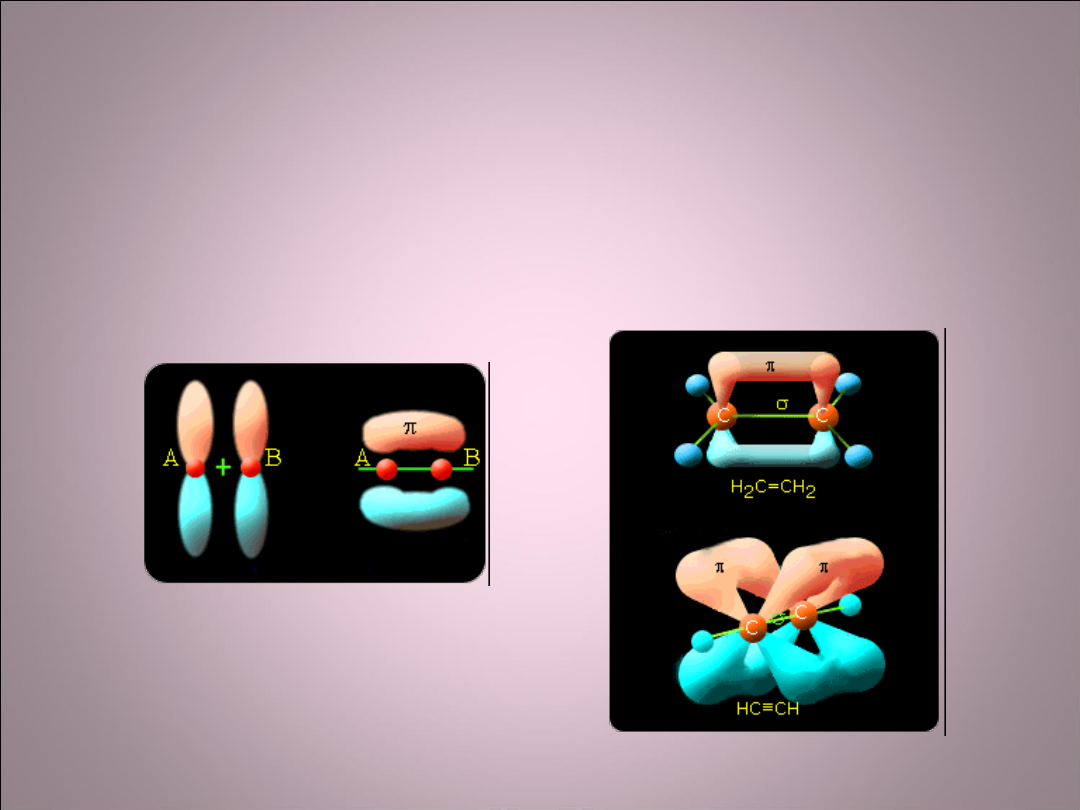
Wiązanie π
• Wiązania π tworzą się miedzy orbitalami p. Podczas
tworzenia tego wiązania orbitale p pochodzące od
dwóch różnych atomów, ustawiają się równolegle
do siebie i następuje tzw. Przenikanie boczne.
• Wiązanie π nie pozwala
w cząsteczce na swobodny obrót
atomów wokół osi wiązania.
Wiązania s i p w cząsteczkach etylenu i
acetylenu

Wiązanie metaliczne
• Podczas resublimacji i skraplania metali słabo związane z
jądrem atomu elektrony walencyjne oddzielają się od
atomu. Powstają elektrony swobodne.
• W kryształach metali węzły sieci
krystalicznej są obsadzone przez kationy,
natomiast elektrony poruszają się podobnie jak
cząsteczki w stanie gazowym. Elektrony tworzą
chmurę elektronową.
• Elektrony oraz kationy utrzymują się w obrębie kryształu
dzięki wzajemnym siłą przyciągania.
• Siła wiązania metalicznego zależy od energii przyciągania
pomiędzy kationami i elektronami oraz energii odpychania
między samymi kationami i samymi elektronami.
• Dzięki występowaniu chmury elektronowej metale dobrze
przewodzą prąd elektryczny.
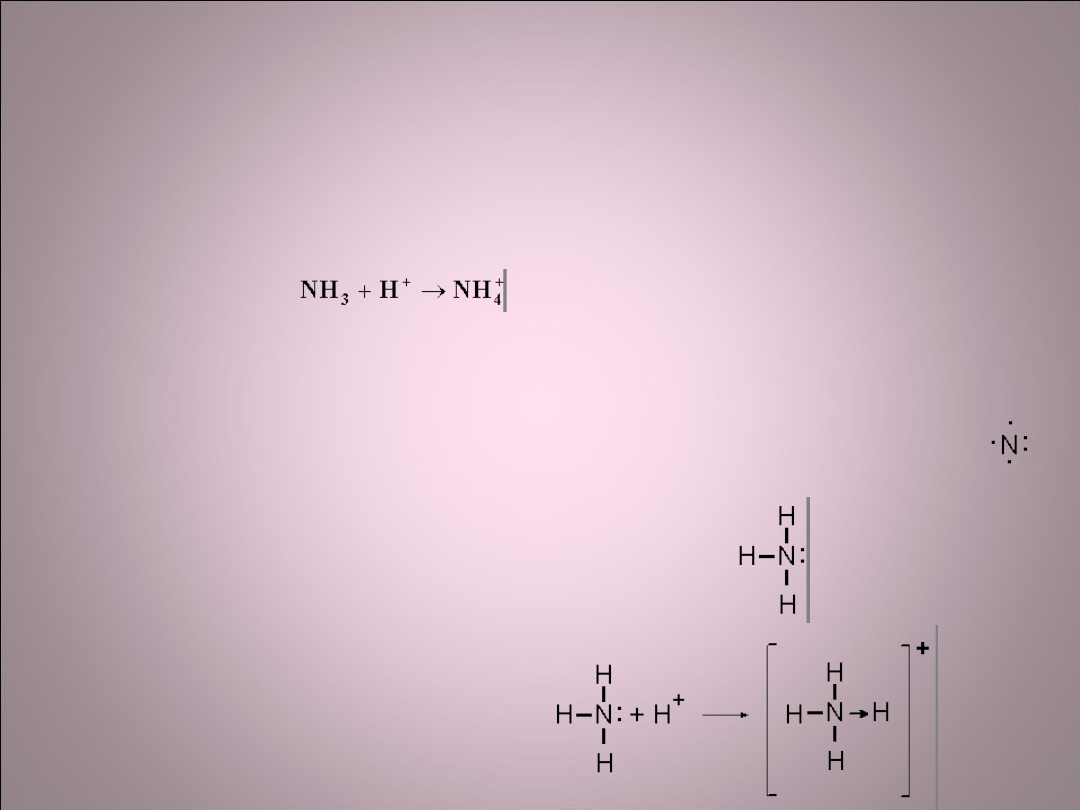
Wiązanie koordynacyjne
• Jest to odmiana wiązania atomowego, w którym wiążącą parę
elektronów dostarcza jeden z atomów.
• Przykład:
Reakcja tworzenia się jonu amonowego z amoniaku i jonu
wodorowego przebiega z utworzeniem wiązania
koordynacyjnego polegającego na tym, że wiążąca czwarty
atom wodoru para elektronowa pochodzi od azotu. Amoniak
zawiera azot posiadający pięć elektronów walencyjnych 2s
2
p
3
.
Przy pomocy trzech elektronów wiąże kowalentnie trzy atomy
wodoru na cząsteczkę zachowując wolną parę elektronową.
W reakcji z protonem azot wytwarza czwarte
wiązanie za pomocą dwóch elektronów stanowiących
do tej pory wolną parę elektronową.

Oddziaływania
międzycząsteczkowe (wiązania
wtórne)
• To inne niż wiązania chemiczne siły
wiążące atomy i cząsteczki.
• Rozróżniamy oddziaływania:
– Siły van der Waalsa
– Wiązania wodorowe
– Oddziaływania między dipolami
chwilowymi

Siły van der Waalsa
• To słabe oddziaływania międzycząsteczkowe
powstające na skutek oddziaływania
elektrostatycznego pomiędzy różnoimiennymi
ładunkami pochodzącymi z ich asymetrycznego
rozkładu.
• Działają tylko na małych odległościach. Im
cząsteczki są bliżej położone, tym występują
między nimi większe siły van der Waalsa.
• Niepolarne cząsteczki węglowodorów silnie
rozgałęzionych przyciągają się słabiej niż
cząsteczki węglowodorów liniowych. Dlatego
tłuszcze nienasycone są ciekłe, a nasycone stałe.
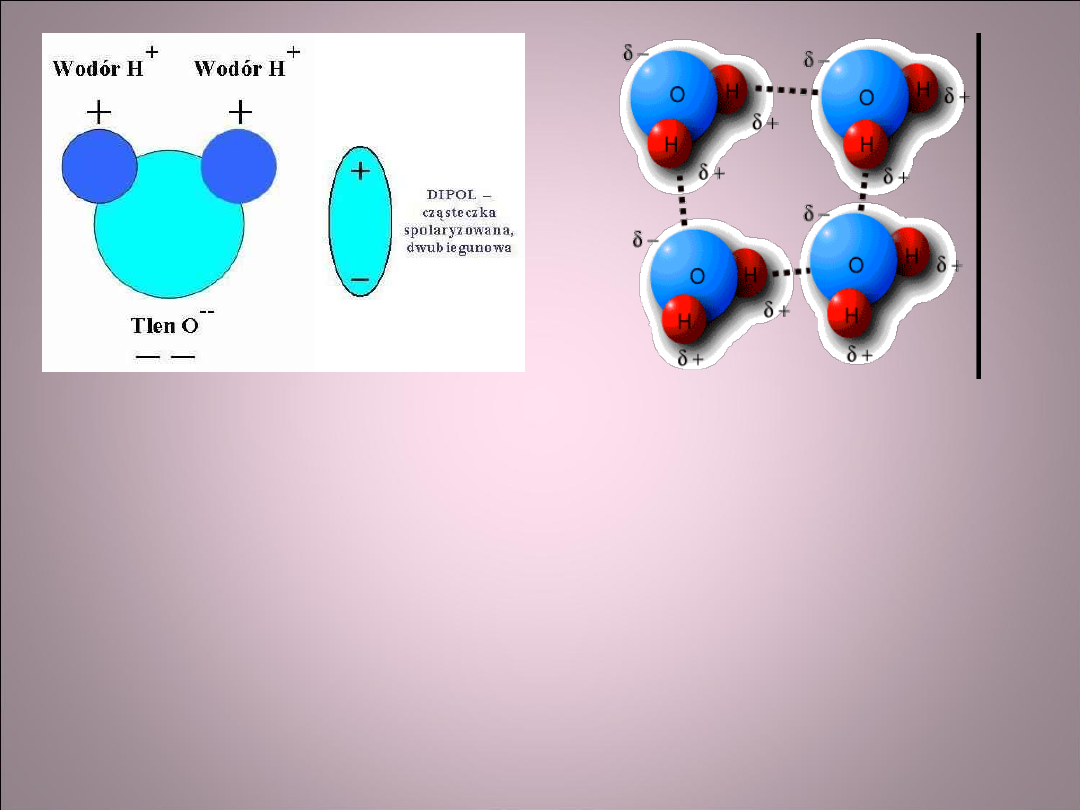
• Atomy lub cząsteczki z asymetrią rozkładu
ładunków to dipole elektryczne.
• Wyróżniamy wiązania między dipolami
chwilowymi i wiązania między dipolami
trwałymi.
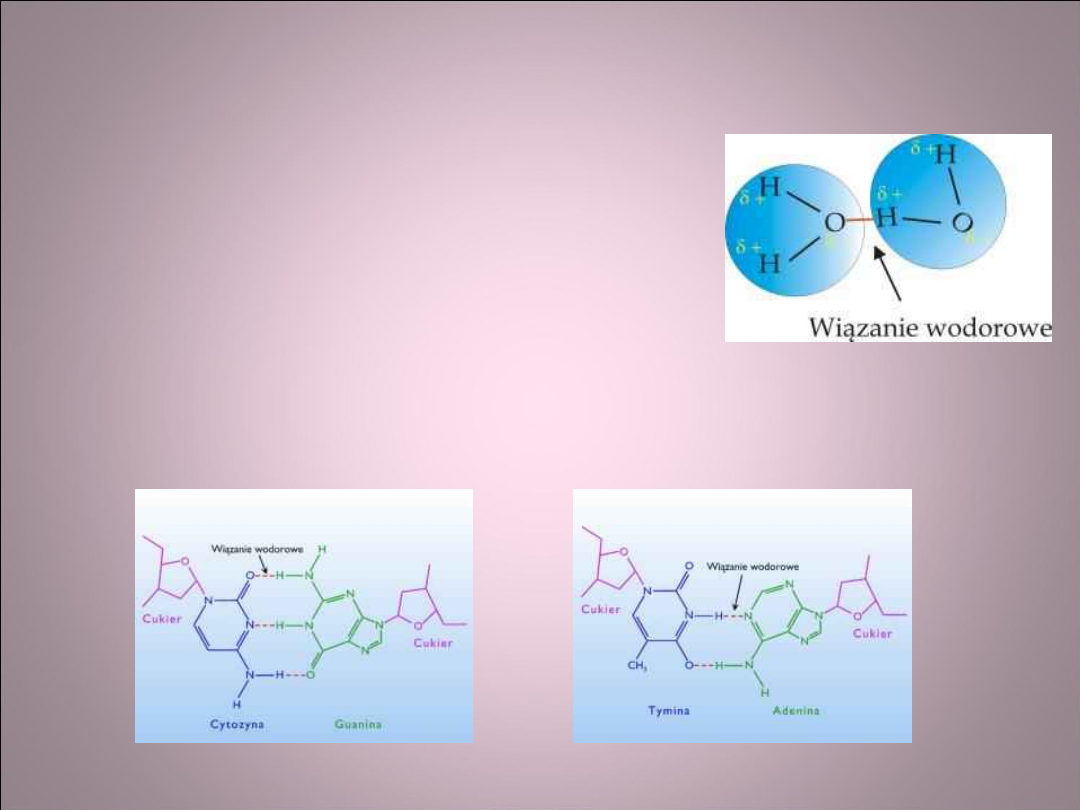
Wiązanie wodorowe
• Są to wiązania między dipolami trwałymi
• Wiązanie wodorowe występuje pomiędzy
kowalentnie związanym atomem wodoru,
a elektroujemnymi atomami sąsiedniej cząsteczki.
• Przykładem są mostki wodorowe występujące
pomiędzy atomami wody. Para elektronów przesunięta jest w
kierunku tlenu
• Wiązania wodorowe mają duże znaczenie w budowie materii
organicznej. Dwa łańcuchy DNA połączone są mostkami
wodorowymi.

Wpływ występowania wiązania
wodorowego na właściwości
związku
• W wodorkach niemetali, w których nie występują
wiązania wodorowe (grupa IV i VIII) temperatura
wrzenia i topnienia rośnie wraz ze wzrostem
masy cząsteczkowej
• Wodorki pierwiastków grup V, VI, VII zachowują
się inaczej. Dla substancji o małej masie
molowej: H
2
O, HF, NH
3
występują bardzo wysokie
temperatury topnienia i wrzenia w porównaniu z
ich cięższymi analogami. Jest to związane z
dodatkową energią potrzebną do rozerwania
wiązań wodorowych podczas uwalniania
cząsteczek w czasie zmiany stanu skupienia.
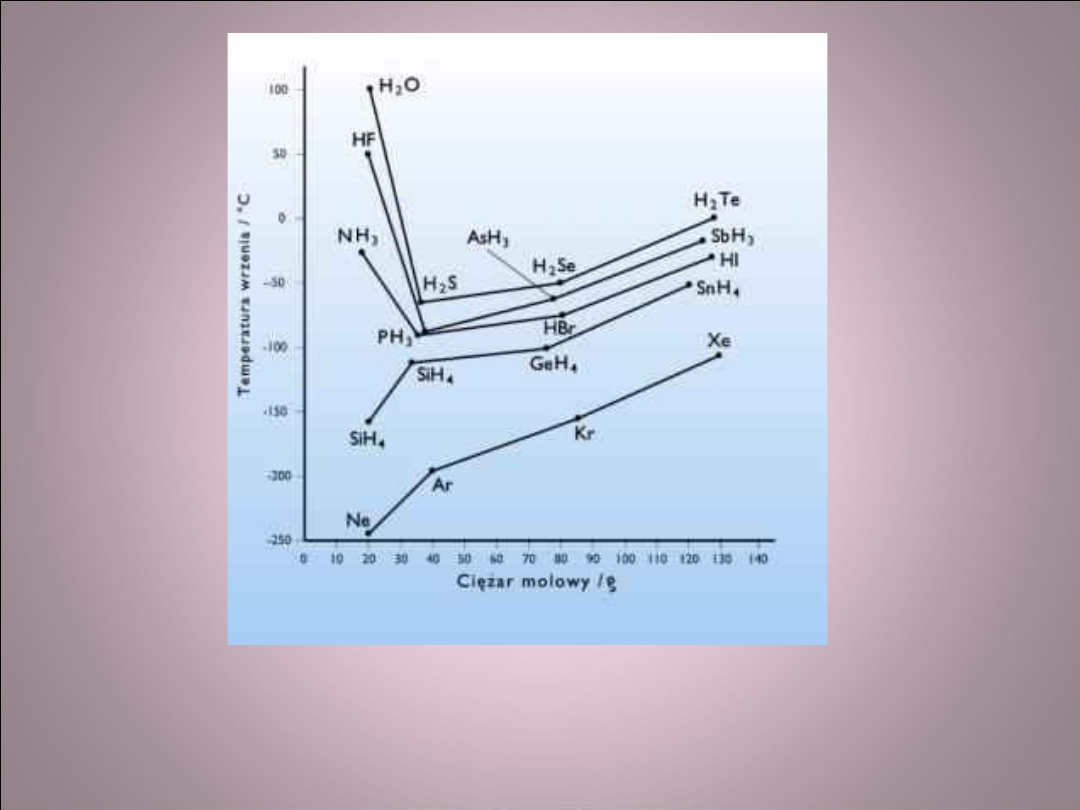
Temperatura wrzenia wybranych
wodorków i gazów szlachetnych
Porównaj:
H
2
O i H
2
S
HF i HCl
NH
3
i PH
3

Wiązania między dipolami
chwilowymi
• Atomy są chwilowymi dipolami, ponieważ
elektrony są w ciągłym ruchu i w danej
chwili środek ładunku dodatniego jądra nie
pokrywa się ze środkiem ładunku
ujemnego elektronów.
• Powstawanie chwilowych dipoli prowadzi
do powstawania sił przyciągania między
nimi. Tego typu siły powodują skraplanie
się gazów szlachetnych.
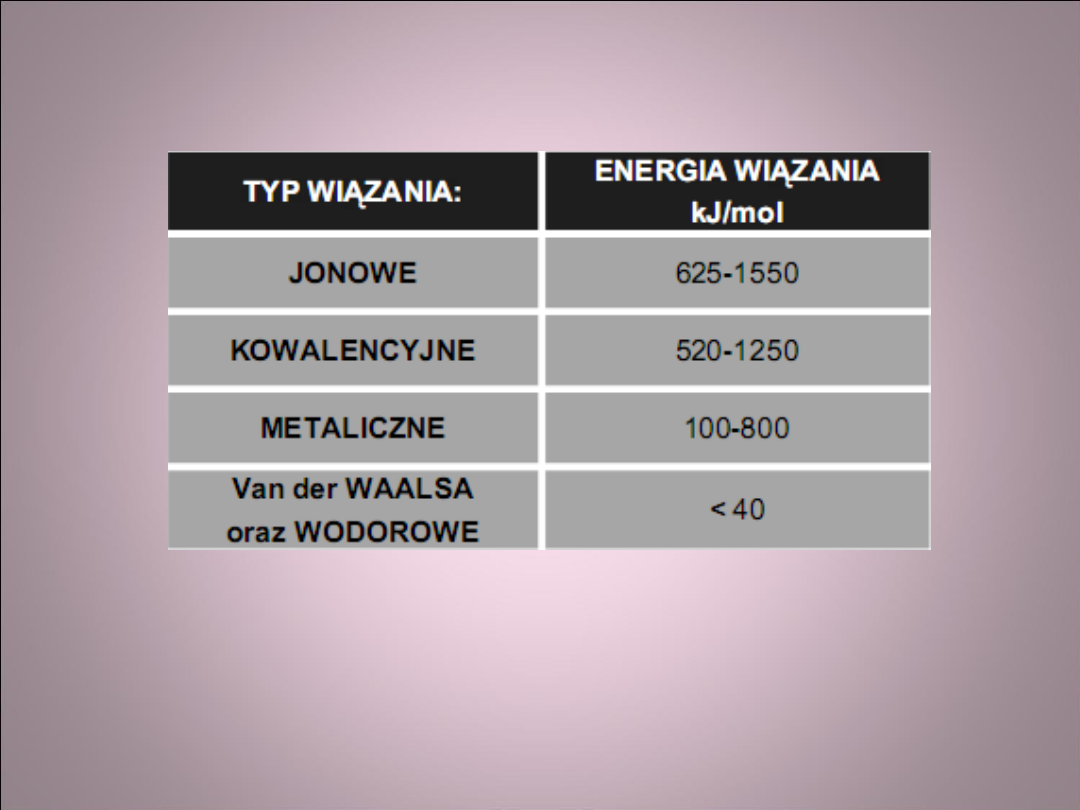
Energia wiązań
Bodowa cząsteczki a
właściwości fizykochemiczne
związku
• Materiały, dla których energia wiązania między atomami
jest duża charakteryzują się dużą wytrzymałością i
wysoką temperaturą topnienia.
• Typy wiązań występujących w materiałach inżynierskich:
W materiałach ceramicznych występują wiązania kowalencyjne
spolaryzowane.
Kowalencyjne
Metaliczne
Wtórne
Jonow
e
Ceramika i
szkło
Polimery
Półprzewodniki
Metale

• Wiązania między atomami wywierają duży wpływ
na zdolność materiałów do odkształceń trwałych
(plastycznych). Metale charakteryzują się dużą
plastycznością, gdyż przemieszczanie się w nich
poszczególnych części kryształu względem siebie
odbywa się bez większych zaburzeń struktury
krystalicznej.
• Plastyczność materiałów o wiązaniach jonowych
jest mniejsza niż metali. Na przykład przy
przemieszczaniu jednej części kryształu względem
drugiej powstaje bardzo wysokoenergetyczna
konfiguracja, gdy kationy znajdą się nad kationami,
a aniony nad anionami.
• Przemieszczanie się poszczególnych części
kryształu względem siebie w kryształach o
wiązaniach kowalencyjnych powoduje zrywanie
istniejących wiązań i powstawanie nowych. Ze
względu na kierunkowość wiązań kowalencyjnych
materiały z tymi wiązaniami są zawsze kruche
(mało plastyczne).

• Materiały o wiązaniach jonowych mają
małą przewodność elektryczną, gdyż
ładunki elektryczne są w nich przenoszone
dzięki przemieszczaniu się jonów, które ze
względu na wielkość nie przemieszczają
się tak łatwo jak jony tworzące chmurę
elektronową w metalach.
• Materiały o wiązaniach kowalencyjnych
także cechuje mała przewodność
elektryczna, ponieważ by elektrony mogły
się w nich przemieszczać i przenosić
ładunki elektryczne, muszą zostać
zerwane wiązania kowalencyjne, do czego
niezbędna jest wysoka temperatura lub
bardzo wysokie napięcie.

Literatura
• http://oen.dydaktyka.agh.edu.pl/dydaktyka/che
mia/a_e_chemia/index_start.htm
• Marek Blicharski „Wstęp do inżynierii
materiałowej” Wydawnictwa Naukowo-
Techniczne, 2001 r.
• Stanisława Hejwowska „Vademecum Matura
2009” Operon, 2008 r.
• http://www.chemia.dami.pl/wyzsza/rozdzial_V/wi
azania3.htm
• http://commons.wikimedia.org/wiki/File:NaCl-
Obtenci%C3%B3n-2.svg
• http://lc.brooklyn.cuny.edu/smarttutor/core3_21/
nature.html
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
Wyszukiwarka
Podobne podstrony:
Odlewnictwo2, Wi˙zanie mi˙dzycz˙steczkowe
Odlewnictwo1, Wi˙zanie mi˙dzycz˙steczkowe
Mechanika 2, Wi˙zanie mi˙dzycz˙steczkowe
Odlewnictwo3, Wi˙zanie mi˙dzycz˙steczkowe
Melodramat, NIE ZA˙WIECI DLA NIEJ S˙O˙CE
06, WNIOSKI1, Pr˙dko˙˙ d˙wi˙ku wyznaczona w tym ˙wiczeniu za pomoc˙ fali stoj˙cej
Laboratorium energoelektroniki, Zestaw pytań, 1. Om˙wi˙ proces za˙˙czania tyrystora. Od czego zale˙y
WSP, CZYNNIK ZA AMANIA WI DOC
Rozp w sprawie określenia rodzajów materiałów stanowiących państwowy zasób geodezyjny i kartograficz
WSP, CZYNNIK ZA AMANIA WI
2018 04 18 Będzie skarga do KRRiT za mówienie o transseksualiście Rafalali w rodzaju męskim To de
RAMPY ZA I WYŁADUNKOWE, DOKUMENTACJA DYSTRYBUCYJNA, RODZAJE RAMP 2
WSP, CZYNNIK ZA AMANIA WI
WSP, CZYNNIK ZA AMANIA WI
Z jednostkami za pan brat
RODZAJE WYSIŁKU FIZYCZNEGO
więcej podobnych podstron