CHEMIA
CHEMIA
ORGANICZNA
ORGANICZNA
Dr Jolanta Piekut
POCHODNE
WĘGLOWODORÓW
H
H
COOH
COOH
OH
OH

Grupa związków organicznych w których atomy wodoru w
cząsteczkach węglowodorów zastąpione są atomami lub grupami
atomów innych pierwiastków nazywamy pochodnymi węglowodorów.
Cząsteczki tych połączeń zbudowane są
z grupy węglowodorowej (alkilowej lub arylowej)
oraz podstawnika, zwanego grupą funkcyjną.
Grupa funkcyjna - jest to atom lub grupa atomów, które w połączeniu
z grupą węglowodorową tworzą cząsteczkę pochodnej
węglowodorowej i nadają danej grupie połączeń charakterystyczne
właściwości.
Obecność jednej grupy funkcyjnej zalicza dany związek do
jednofunkcyjnych pochodnych węglowodorów.
Grupa
Grupa
funkcyjna
funkcyjna
Nazwa grupy funkcyjnej
Nazwa grupy funkcyjnej
(Z)
(Z)
Nazwa pochodnych
Nazwa pochodnych
-F, -Cl, -Br, -I
Fluorowce (halogenki)
Fluorowcopochodne węglowodorów
-OH
Hydroksylowa
Jeżeli jest połączona z grupą alkilową -
alkohole
Jeżeli jest połączona z grupą arylową -
fenole
Aldehydowa
Aldehydy
Ketonowa
Ketony
Karboksylowa
Kwasy karboksylowe
-NH
2
Aminowa
Aminy
-NO
2
Nitrowa
Związki nitrowe

CHLOROWCOPOCHODNE
Chlorowcopochodne mogą być pochodnymi alkilowymi i
aromatycznymi.
Symbol chlorowcopochodnych - RX (X = F, Cl, Br, I).
Nazewnictwo
Grupa funkcyjna Z = -X (-F, -Cl, -Br, -I) w połączeniach tworzy związki
typu
R-X, Ar-X - halogeno(chlorowco) -pochodne
Nazwy systematyczne tworzy się przez dodanie przed nazwę
węglowodoru:
liczb oznaczających położenie chlorowca
liczebnika określającego liczbę atomów chlorowca
nazw: fluoro-, chloro-, bromo-, jodo-.
Nazwy potoczne: halogenek + nazwa grupy alkilowej lub arylowej:
CH
3
-Cl
chlorometan, chlorek metylu
Cl-CH
2
-CH
2
-Cl
1,2-dichloroetan, chlorek etylenu
CHCl
2
-CH
3
1,1-dichloroetan
dla węglowodorów aromatycznych

Właściwości fizyczne
Z powodu większej masy cząsteczkowej halogenoalkany mają
znacznie wyższe temperatury wrzenia niż alkany o tej samej liczbie
atomów węgla w cząsteczce. Przy określonej grupie alkilowej
temperatura wrzenia wzrasta ze wzrostem masy atomowej halogenu,
w związku z czym temperatura wrzenia fluorku jest najniższa, a
jodku najwyższa.
Halogenki alkilów mimo swej polarności nie rozpuszczają się
w wodzie, prawdopodobnie dlatego, że nie mogą tworzyć wiązań
wodorowych. Rozpuszczają się one natomiast w typowych
rozpuszczalnikach organicznych. Chlorowcopochodne są dobrymi
rozpuszczalnikami. Wprowadzenie chlorowca do łańcucha
węglowodorowego obniża palność.
Jodo-, bromo- i polichloropochodne alkanów mają większą gęstość
niż woda.

Otrzymywanie
Chlorowcopochodne można otrzymać w wyniku bezpośredniego
chlorowcowania i innymi metodami. Metoda bezpośredniego
chlorowcowania została opisana podczas prezentacji reakcji
weglowodorów. Z innych metod należy wymienić:
przyłączanie chlorowcowodorów HX i chlorowców
wymiana grupy hydroksylowej OH
chlorek etylu H
2
C=CH
2
+ HCl --> H
2
CCl-CH
3
1,2-dichloroetan H
2
C=CH
2
+ Cl
2
--> H
2
CCl-CH
2
Cl
wymiana grupy hydroksylowej OH w alkoholach
R-OH --> R-X (z udziałem HX
lub PX
3
)

Przykłady:
otrzymywanie bromku n-propylu
(czynnikiem bromującym jest stęż.HBr lub NaBr + H
2
SO
4
)
CH
3
CH
2
CH
2
OH --> CH
3
CH
2
CH
2
Br
otrzymywanie 1-bromo-1-fenyloetanu (czynnikiem bromującym jest
PBr
3
)
C
6
H
5
CH(OH) -CH
3
--> C
6
H
5
CH(Br) -CH
3
Fluoropochodne otrzymuje się działając F
2
rozcieńczonym N
2
albo
fluorkami metali AgF, SbF
3
, CoF
2
Przykład - otrzymywanie freonów
CHCl
3
--> HCClF
2
+ HCCl
2
F + CHF
3

Właściwości chemiczne
Pochodne halogenowe szeregu alifatycznego charakteryzują
się dużą aktywnością chemiczną i służą do otrzymywania
innych pochodnych.
Substytucja nukleofilowa S
N
W wyniku reakcji substytucji nukleofilowej S
N
otrzymujemy:
alkohole
aminy
nitryle a dalej kwasy karboksylowe
tiole (merkaptany)
sulfidy (tioestry)

Przykłady:
Otrzymywanie alkoholi
R-X + HOH --> R-OH + HX
R-X + OH
-
--> R-OH + X
-
Otrzymywanie amin
R-X + NH
3
--> R-NH
2
R-X + R'-NH
2
--> R'-NH-R
R-X + R'-NH-R" --> R'-NRR"
Otrzymywanie nitryli
R-X + CN
-
--> R-CN + X
-
R-CN + H
2
O --> R-COOH + NH
3
Otrzymywanie tioli
R-X + SH- --> R-SH + X
-
R-SH --> utlenianie R-SO
3
H (kwas sulfonowy)
Otrzymywanie tioestrów
R-X + -SR' --> R-SR'
Dehydrohalogenacja
Jest to reakcja eliminacji i polega ona na równoczesnym oderwaniu atomu
halogenu od atomu węgla oraz atomu wodoru od sąsiedniego atomu węgla:
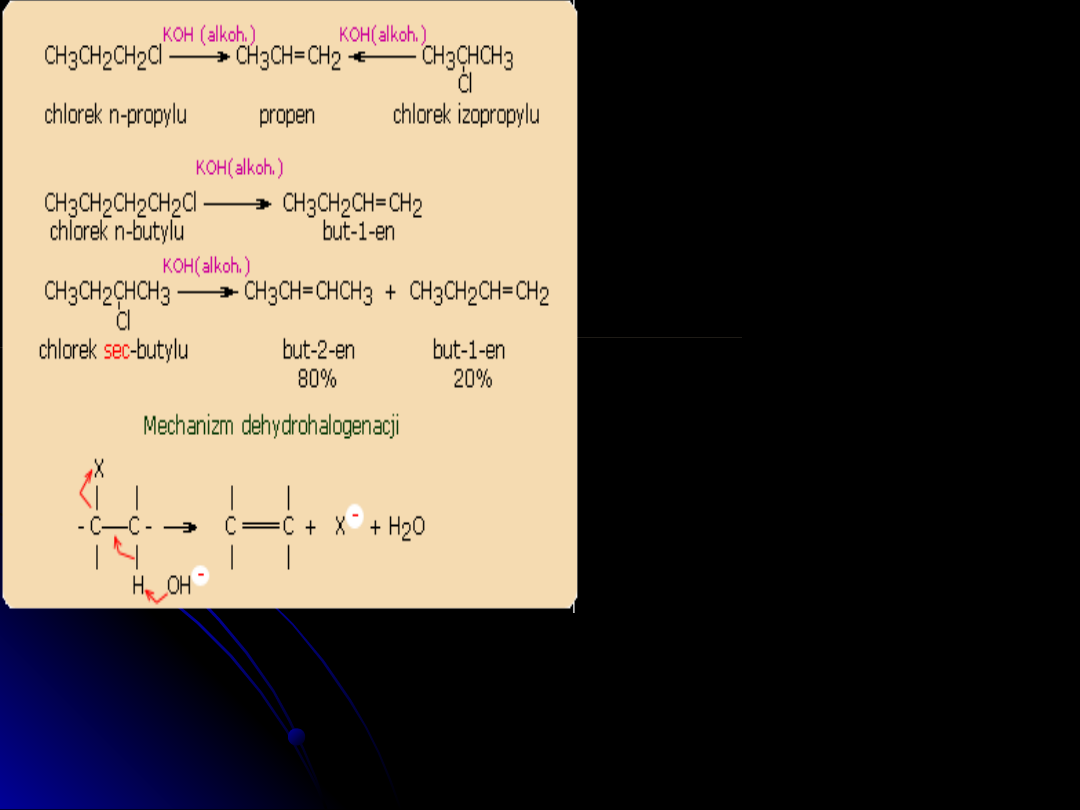
Reakcja przebiega z udziałem
mocnej zasady (KOH w alkoholu) i
podwyższonej temperaturze.
W niektórych przypadkach reakcja
ta prowadzi do powstania jednego
alkenu, w innych natomiast do
powstania mieszaniny. Przykładem
są prezentowane reakcje
chemiczne chlorku n-butylu i
chlorku sec-butylu. W przypadkach,
w których mogą powstać oba
alkeny, głównym produktem jest
but-2-en, co jest zgodne z ogólnym
mechanizmem reakcji.
Udowodniono, że
uprzywilejowanym produktem jest
alken, który ma większą liczbę grup
alkilowych przy atomach węgla
połączonych wiązaniem
podwójnym.
R
2
C=CR
2
> R
2
C=CHR > R
2
C=CH
2
> RCH=CHR > RCH=CH
2

Zastosowanie
Chorowcopochodne są związkami chemicznymi, które znajdują zastosowanie
jako półprodukty do otrzymywania ważnych związków chemicznych.
Jednym z takich związków chemicznych jest związek Grignarda.
Związek Grignarda ma ogólny wzór RMgX i nazwę halogenek
alkilomagnezowy.
Jest to jeden z najbardziej użytecznych i uniwersalnych odczynników znanych
chemikom organikom. Charakteryzuje się dużą reaktywnością. Reaguje m.in.
z wodą, dwutlenkiem węgla i tlenem, oraz większością związków
organicznych.
Wiązanie węgiel - magnez jest wiązaniem kowalencyjnym, lecz silnie
polarnym, gdyż atom węgla przyciąga elektrony należące do
elektrododatniego atomu magnezu, natomiast wiązanie magnez - halogen
jest w zasadzie jonowe. Ten charakter wiązania nadaje związkowi Grignarda
dużą reaktywność.
CH
3
CH
2
Br + Mg ---> CH
3
CH
2
MgBr
Reakcja otrzymywania odczynnika Grignarda przebiega w środowisku
suchego eteru dietylowego. Reakcja zachodzi dosyć energicznie.
Z innych związków metaloorganicznych o podobnych właściwościach należy
wymienić związki z metalami: litu, potasu, sodu, cynku, rtęci, ołowiu, talu, itd.
Każdy rodzaj związku metaloorganicznego wykazuje charakterystyczne
właściwości i od nich zależy jego zastosowanie.

Reakcja Friedla-Craftsa
Ponadto chlorowcopochodne wykorzystywane są do produkcji alkilobenzenów
w reakcji Friedla-Craftsa
R-X + ArH + AlCl
3
--> Ar-R

Innymi ważniejszymi chlorowcopochodnymi znajdującymi
zastosowanie praktyczne są:
Chloroform (trichlorometan - CHCl
3
) - znany jako środek używany
podczas narkozy. Obecnie do tego celu stosowany coraz rzadziej. Jest
to substancja słabo rozpuszczalna w wodzie ale jest dobrym
rozpuszczalnikiem żywic, tłuszczów i innych substancji. Stąd jego
zastosowanie jako rozpuszczalnika. Chloroform pod wpływem
wilgoci, powietrza i światła rozpada się na silnie trujący fosgen i
chlorowodór.
Tetrachlorometan (czterochlorek węgla - CCl
4
) - stosuje się jako
rozpuszczalnik do tłuszczów, olejów, żywic i wosków. Jego zaletą jest
to, że jest on substancją niepalną. Jako substancja działa toksycznie i
odurzająco, stąd coraz to mniejsze jego zastosowanie.
Chlorek winylu (chloroeten - CH
2
=CHCl) - ulega polimeryzacji, stąd
jego zastosowanie do produkcji tworzywa sztucznego o nazwie
polichlorek winylu (PCV).
Freony (CCl
2
F
2
, CCl
3
F) - są to bezbarwne gazy, łatwo poddające się
skropleniu, niepalne i odporne termicznie oraz chemicznie. Były
szeroko stosowane jako środek chłodniczy i wypełniacz pojemników
dla różnego rodzaju kosmetyków. Przypuszcza się, że uwalniany do
atmosfery jest jednym z czynników niszczących warstwę ozonową,
stąd ograniczenie jego stosowania.

Związki organiczne z grupą funkcyjną -OH i -OR (alkohole i
etery)
Związki organiczne zawierające grupę funkcyjną Z = -OH można
podzielić na trzy zasadnicze typy:
alkohole
fenole
etery.
ALKOHOLE
Grupa funkcyjna -OH
grupa hydroksylowa w połączeniach tworzy związki typu:
alkanole o wzorze ogólnym C
n
H
2n+1
OH (alkohole)
alkandiole o wzorze ogólnym C
n
H
2n
(OH)
2
alkantriole o wzorze ogólnym C
n
H
2n-1
(OH)
3
Hybrydyzacja atomów tlenu - sp
3
.
FENOLE
Fenole są to związki organiczne powstałe przez wprowadzenie do
pierścienia aromatycznego w miejsce wodoru grupy (grup) -OH.
Wzór ogólny – ArOH
ETERY
Etery są to związki organiczne pochodne alkoholi, fenoli o wzorze
ogólnym
R'-O-R, R-O-Ar, Ar-O-Ar (etery)
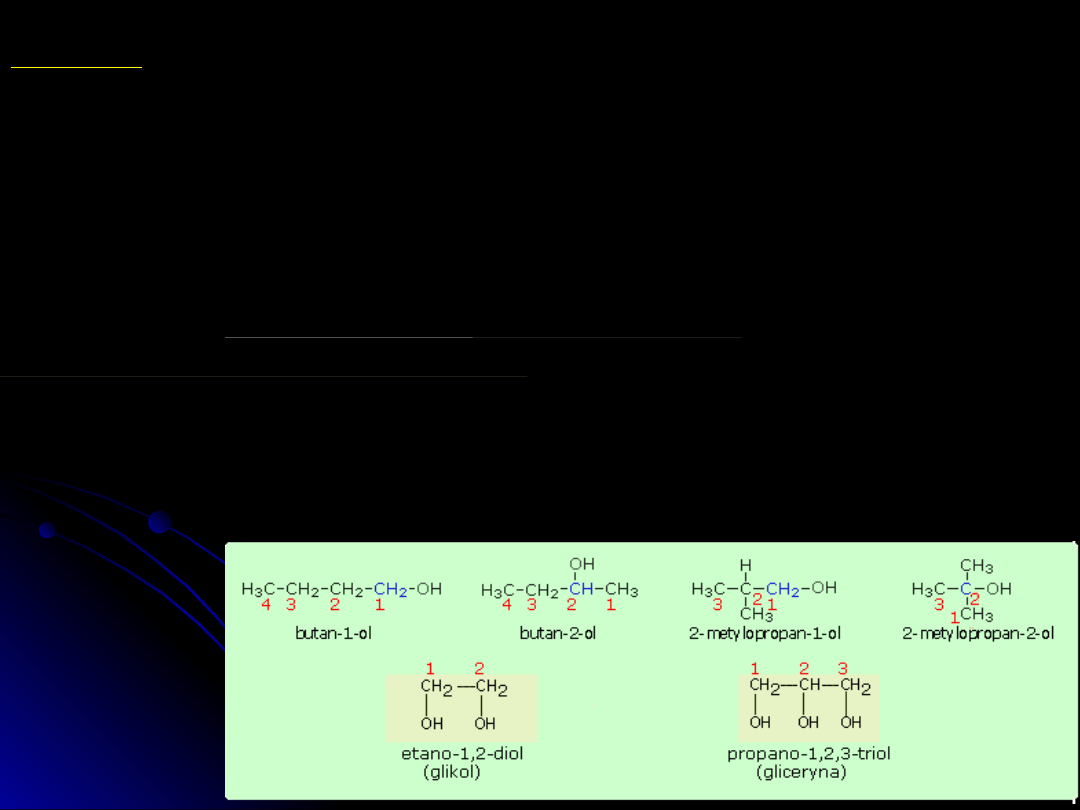
NAZEWNICTWO
Alkohole
W użyciu mają zastosowanie nazwy zwyczajowe i systematyczne.
nazewnictwo zwyczajowe (dotyczy prostszych alkoholi). Składają się one z
nazwy grupy alkilowej, poprzedzonej słowem alkohol.
nazewnictwo systemowe w którym:
- jako strukturę podstawową wybiera się najdłuższy łańcuch węglowy.
- struktura podstawowa ma nazwę w zależności od ilości atomów węgla,
etanol,
propanol,....; nazwę tworzy się przez dodanie końcówki
-ol
- określamy cyfrą położenie grupy -OH
- położenie każdej z pozostałych grup przyłączonych do łańcucha
podstawowego
określa się również odpowiednią cyfrą, np. 2-metylobutan-1-ol
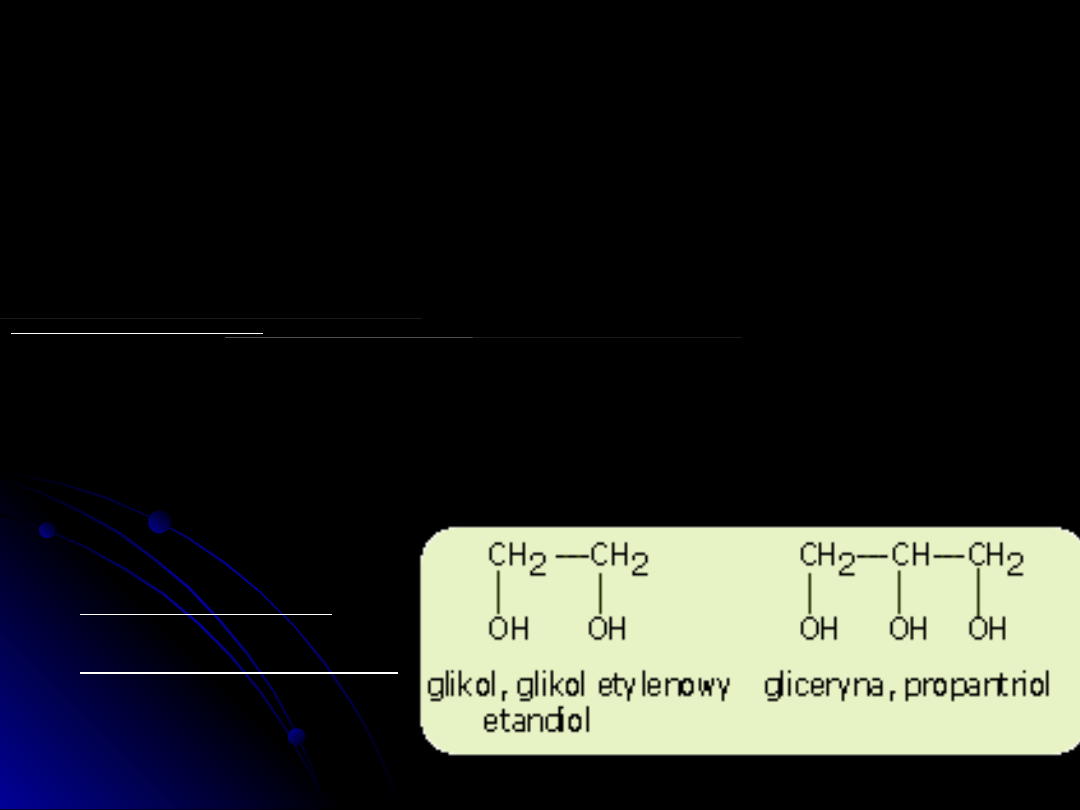
- alkohole zawierające w cząsteczce dwie grupy wodorotlenowe nazywane są
ogólnie
diolami (dawniej glikolami)
- alkohole zawierające w cząsteczce trzy grupy wodorotlenowe nazywane są
glicerynami
Alkohole propan-1-ol i propan-2-ol są przykładem występowania izomerii
łańcuchowej wśród alkoholi.
Grupa węglowodorowa -R w cząsteczce alkoholu może pochodzić również od
węglowodorów nienasyconych i wówczas otrzymuje się alkohole nienasycone,
np.
prop-2-en-1-ol CH
2
=CH-CH
2
-OH
Przykłady alkoholi:
metanol, alkohol metylowy CH
3
-OH
etanol, alkohol etylowy C
2
H
5
-OH
propan-1-ol, alkohol propylowy CH
3
-CH
2
-CH
2
-OH
Przykłady alkoholi
wielowodorotlenowych:
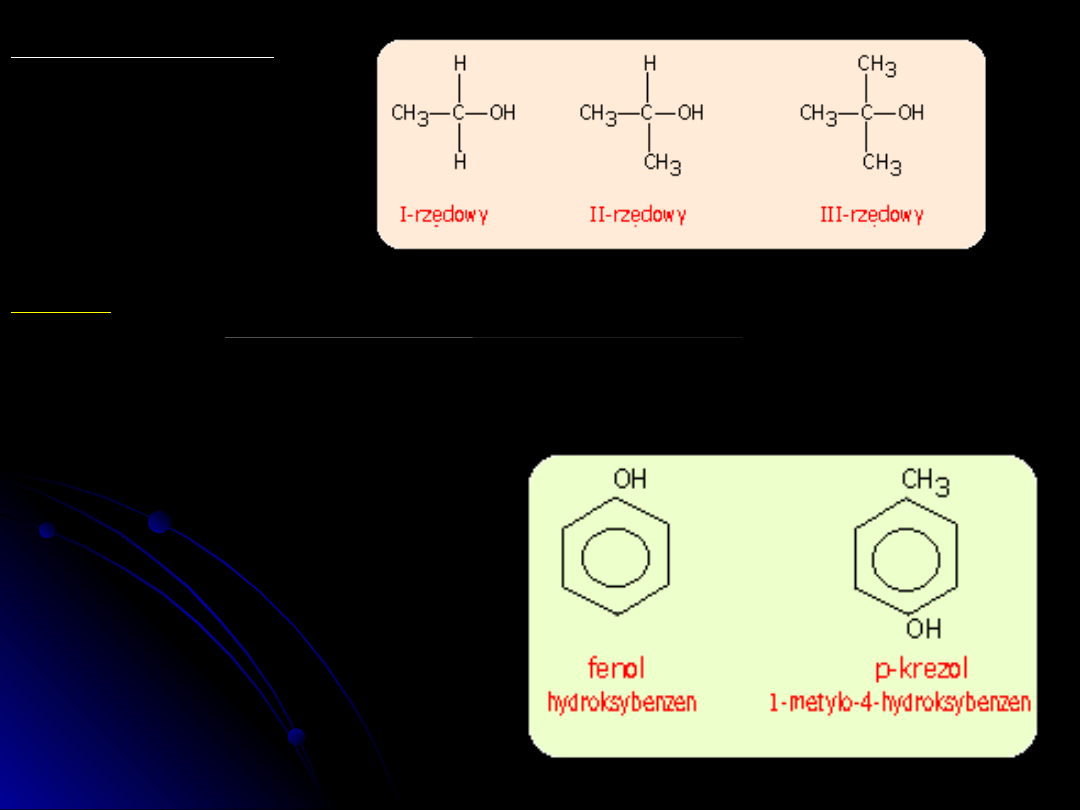
Rzędowość alkoholi
Alkohole klasyfikuje się
według rzędowości
węgla
Fenole Ar-OH
Fenole są związkami o ogólnym wzorze
Ar-OH, w którym Ar oznacza fenyl,
naftyl.....
Fenole różnią się od alkoholi tym, że
grupa -OH związana jest bezpośrednio
z pierścieniem aromatycznym.
Nazwy fenoli tworzy się na ogół od
nazwy najprostszego przedstawiciela,
a mianowicie fenolu.
Metylofenole mają specyficzną nazwę
krezole.

Alkoh
ol
e
Nazewnictwo
R
OH
R
H
alkan
alkan
ol
CH
3
CH
2
CH
2
CH
3
CH
3
CH
2
CH
2
CH
2
OH
CH
3
CH
2
CH CH
3
OH
butan
butan-1-
ol
butan-2-
ol
Alkohol
alkilowy
Alkohol
butylowy
Nazewnictwo
Alkoh
ol
e
CH
3
CH
2
CH
2
CH
2
OH
CH
3
CH
2
CH CH
3
OH
CH
3
C CH
3
OH
CH
3
CH
3
CH CH
2
CH
2
OH
CH
3
Alkohol tert-
butylowy
Alkohol sec-
butylowy
Alkohol izopentylowy
CH
2
C CH CH
3
CH
3
OH
Cl
Cl
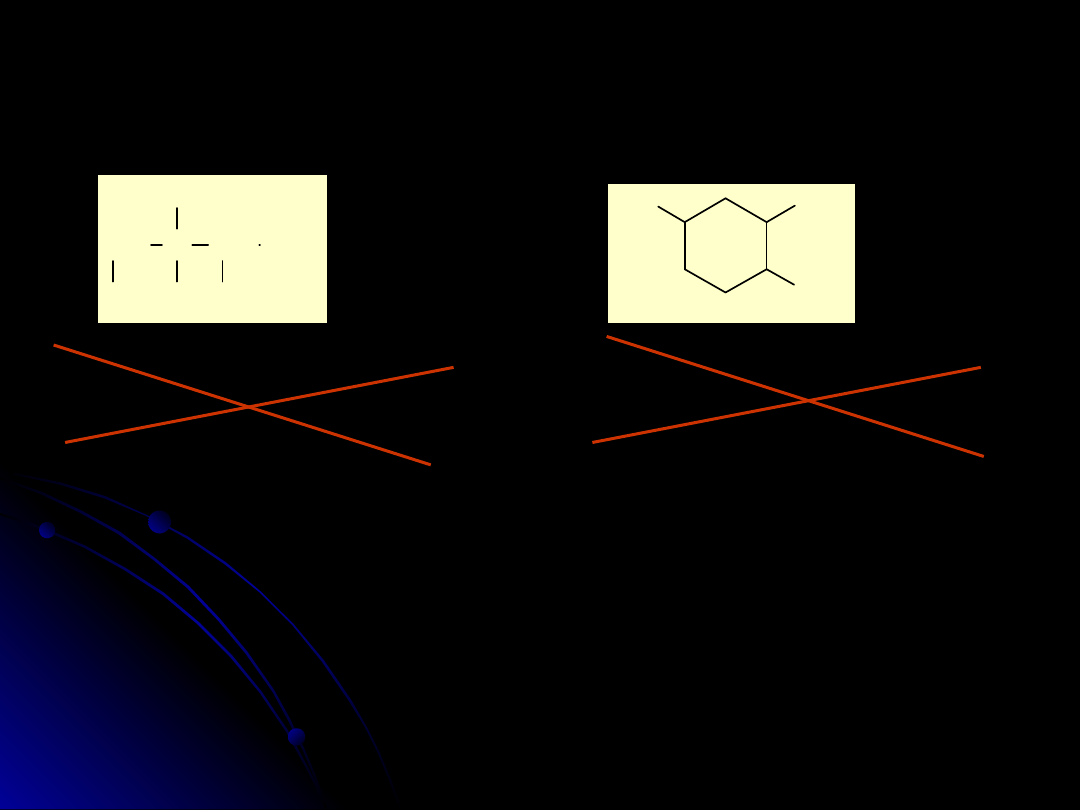
1,2-dichloro-2-metylobutan-3-ol
3,4-dichloro-3-metylobutan-2-ol
O
H
Br
CH
3
2-bromo-1-metylocykloheksan-4-ol
3-bromo-4-metylocykloheksanol
Alkoh
ol
e
Nazewnictwo
Alkoh
ol
e
Nazewnictwo
OH
OH
OH
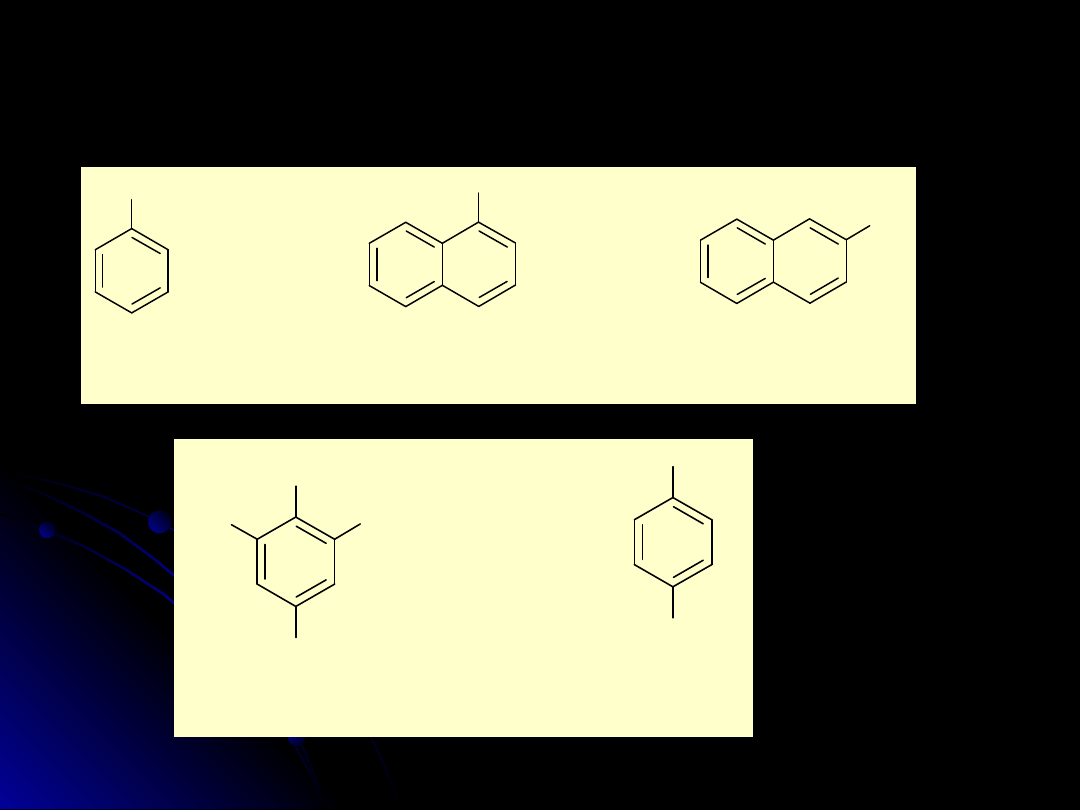
benzenol
fenol
naftalen-1-ol
-naftol
nafalen-2-ol
-nafol
OH
NO
2
NO
2
O
2
N
OH
OH
kwas pikrynowy
hydrochinon

Niektóre grupy w nomenklaturze podstawnikowej nigdy nie są
traktowane jako grupy funkcyjne, nazywamy je grupami podrzędnymi.
W nazwie związku ich obecność wskazywana jest wyłącznie w formie
przedrostka:
Niektóre grupy charakterystyczne (podrzędne) wskazywane w
nomenklaturze podstawnikowej wyłącznie przedrostkami
Grupa
Przedrostek
-Br
bromo-
-N
3
azydo-
-Cl
chloro-
-NO
nitrozo-
-F
fluoro-
-NO
2
nitro-
-I
jodo-
-O-R
alkoksy- (alkiloksy-)
-S-R
alkilosulfanylo-
Alkoh
ol
e
Nazewnictwo
Alkoh
ol
e
Nazewnictwo
Chociaż znanych jest wiele związków wielofunkcynych, to w nazwie
nigdy nie mogą pojawić się dwie grupy funkcyjne w formie przyrostka.
Wsród grup głównych ustalono pewną kolejność pierwszeństwa
(ważność). Tylko grupa o największym pierwszeństwie może być
pokazana w nazwie w formie przyrostka. Pozostałe grupy w
nazwie związku występują w formie przedrostka.
Grupy
główne
wg
pierwszeństwa
kwasy karboksylowe -COOH
bezwodniki kwasowe
estry
halogenki kwasowe
amidy
nitryle
aldehydy i ketony
alkohole i fenole
-ol (hydroksy-)
tiole
aminy
iminy
Nazewnictwo
Alkoh
ol
e
CH
3
CH
2
CH CH
2
C
O
CH
3
OH
OH
COOH
OH
Br
HO
3
S
OH
Br
C
H
3
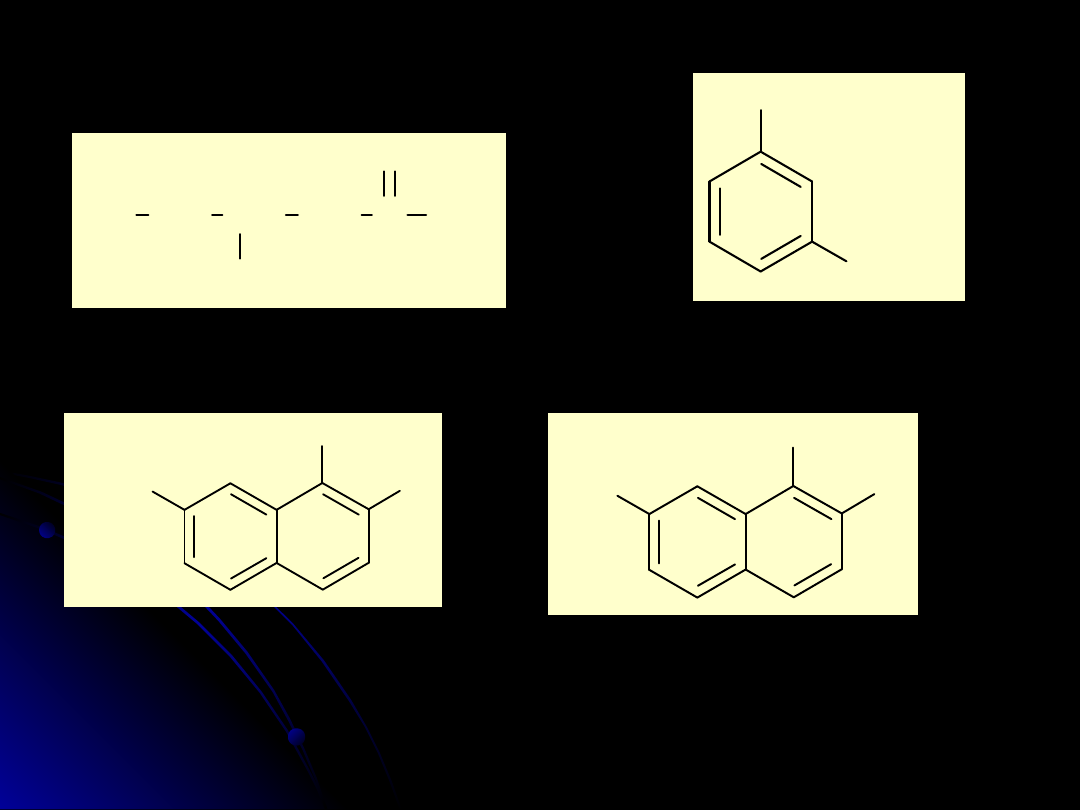
4-hydroksyheksan-2-on
Kwas 3-hydroksybenzoesowy
2-bromo-7-metylonaftalen-1-ol
2-bromo-7-metylo-1-naftol
Kwas 7-bromo-8-
hydroksynaftaleno-2-
sulfonowy
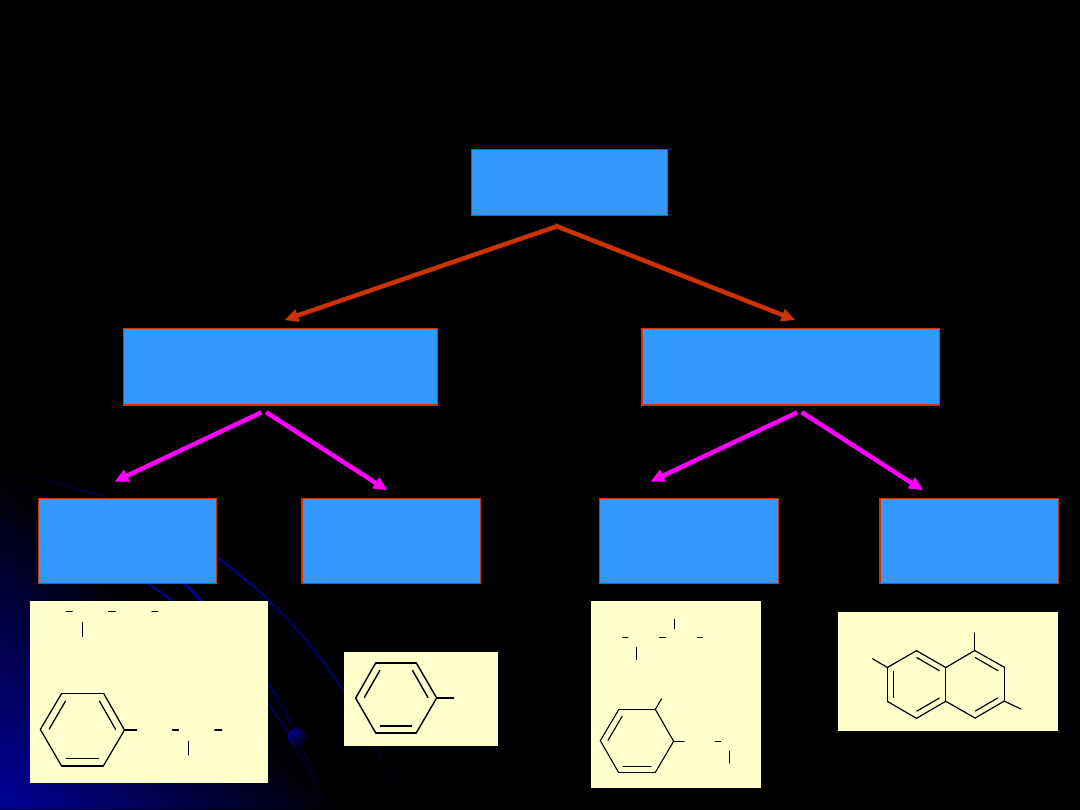
Alkohole
podział
Alkohole
monowodorotlenowe
wielowodorotlenowe
alifatyczne
(nasycone)
alifatyczne
(nasycone)
aromatyczne
(fenole)
aromatyczne
(fenole)
CH
3
CH
CH
2
CH
3
OH
CH
2
CH
CH
3
OH
OH
CH
3
CH CH
CH
3
OH
OH
CH
2
CH
2
OH
OH
.
OH
OH
O
H
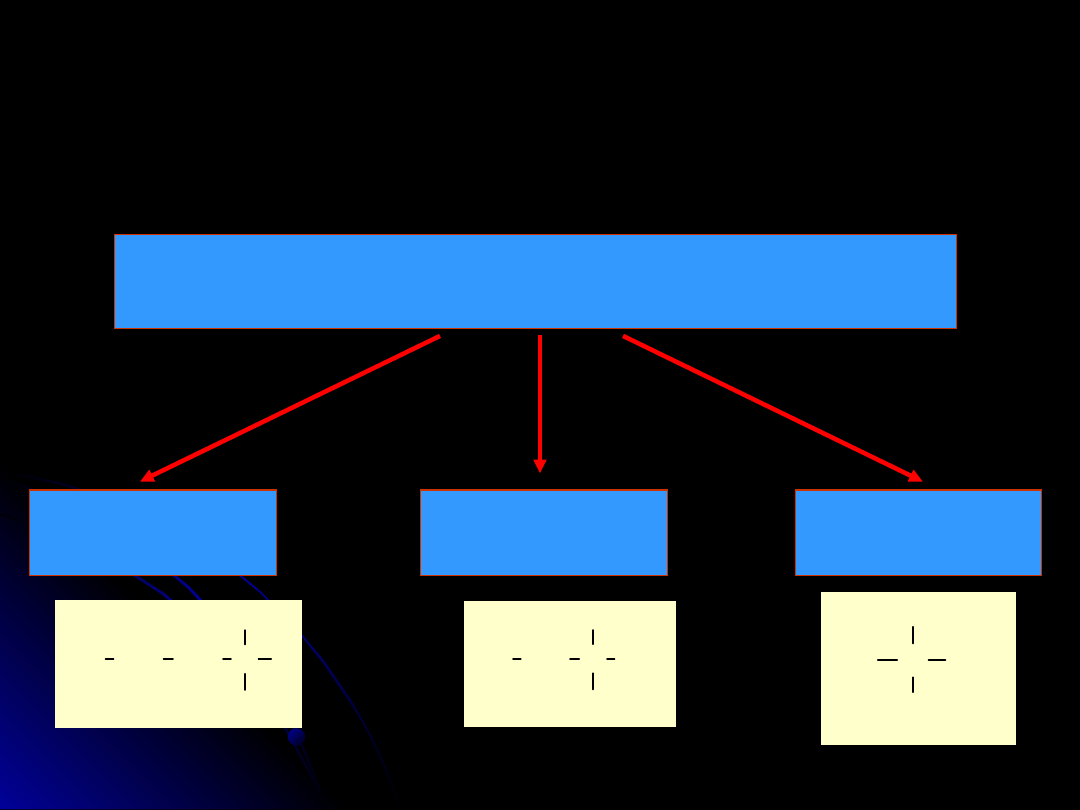
Alkohole
podział
Alkohole alifatyczne
Pierwszorzędowe
1
o
Drugorzędowe
2
o
Trzeciorzędowe
3
o
CH
3
CH
2
CH
2
C
OH
H
H
CH
3
CH
2
C
CH
3
OH
H
CH
3
C
CH
3
OH
CH
3

Etery
Nazwy systematyczne wyprowadza się z nazw alkanów, w których
jeden lub więcej atomów wodoru zastąpiono grupami -OR (grupa
alkoksylowa) lub -OAr (grupa aryloksylowa). Nazwę eteru tworzy się
również i w ten sposób, że po słowie eter podaje się w kolejności
alfabetycznej nazwy dwóch grup, które są przyłączone do atomu
tlenu.
Przykłady:
eter dimetylowy, metoksymetan CH
3
-O-CH
3
eter etylometylowy, metoksyetan CH
3
-O-C
2
H
5

Etery – właściwości fizyczne
R
1
O
R
2
Pomiędzy cząsteczkami eterów nie tworzą się wiązania wodorowe,
dlatego posiadają stosunkowo niskie temperatury wrzenia.
Również dość słabo rozpuszczają się w wodzie

WŁAŚCIWOŚCI FIZYCZNE
Alkohole
Alkohole jednowodorotlenowe o małych masach cząsteczkowych są
bezbarwnymi cieczami. Alkohole zawierające więcej niż 12 atomów C w
cząsteczce w temp. pokoj. są ciałami stałymi. Alkohole o małej liczbie
atomów węgla w cząsteczce są dobrze rozp. w wodzie. Temp. wrzenia
poszczególnych alkoholi w szeregu homologicznym rośnie ze wzrostem
łańcucha węglowego. Ze wzrostem łańcucha węglowego maleje ich
rozp. w wodzie.
Fenole
Najprostsze fenole są cieczami lub ciałami stałymi o niskich
temperaturach topnienia. Stosunkowo wysokie temperatury wrzenia
fenoli spowodowane są występowaniem między cząsteczkowych wiązań
wodorowych. Fenol jest nieco rozpuszczalny w wodzie a większość
pozostałych fenoli zasadniczo nie rozpuszcza się w wodzie.
Fenole są bezbarwne, chyba że ich cząsteczki zawierają jakąś grupę
nadającą zabarwienie.

Etery
Cząsteczki eterów wykazują mały średni moment dipolowy i dlatego
ta słaba polarność nie wpływa w widoczny sposób na temperatury
wrzenia eterów, które są mniej więcej takie same jak temperatury
wrzenia alkanów o porównywalnych masach cząsteczkowych i
znacznie niższe niż temperatury wrzenia izomerycznych alkoholi.
Rozpuszczalność eterów w wodzie jest porównywalna z
rozpuszczalnością alkoholi, np. zarówno eter dietylowy, jak i alkohol
n-butylowy rozpuszcza się w stosunku ok. 8 g na 100 g wody.
Etery stosowane są jako rozpuszczalniki. Nie tworzą wiązań
wodorowych i dlatego mają stosunkowo niskie temperatury wrzenia.
eter dimetylowy CH
3
-O-CH
3
temp. wrzenia -24°C
eter etylometylowy CH
3
-O-C
2
H
5
temp. wrzenia 6,4°C
eter dietylowy C
2
H
5
-O-C
2
H
5
temp. wrzenia 34°C
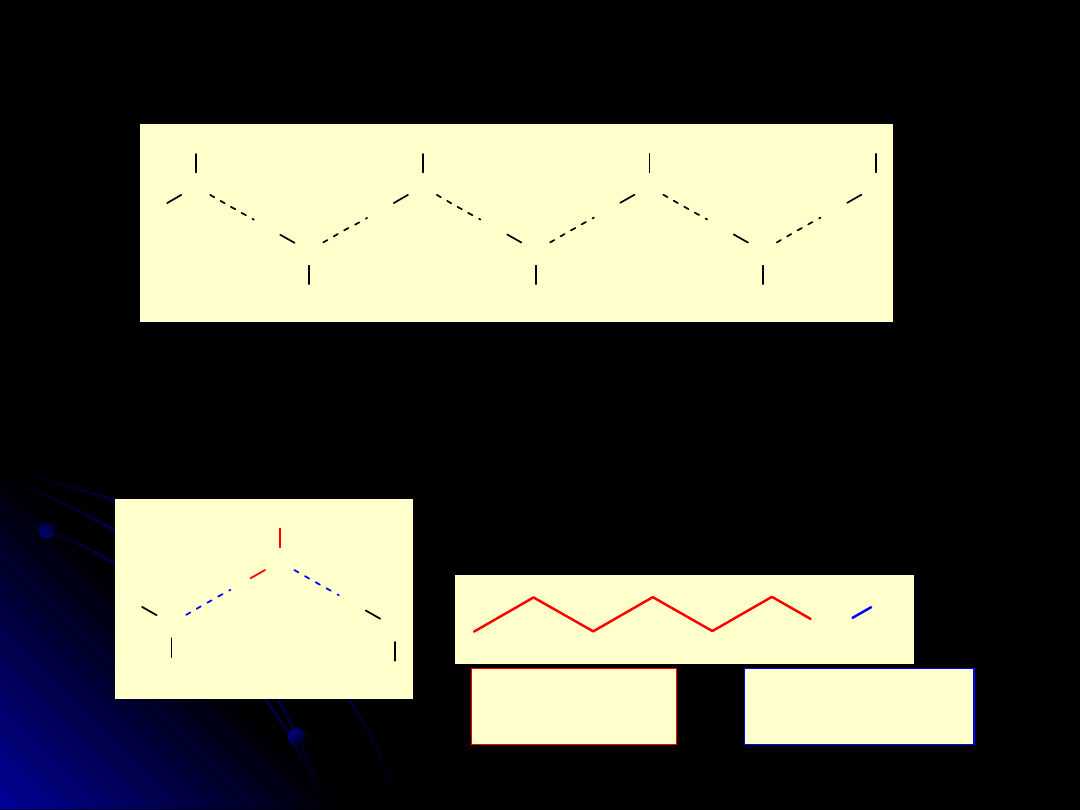
Alkohole
R
O
H
R
O
H
R
O
H
R
O
H
R
O
H
R
O
H
R
O
H
Właściwości fizyczne
Tworzenie wiązań wodorowych pomiędzy cząsteczkami alkoholu
powoduje, że mają one wysoką temperaturę wrzenia
H
O
H
R
O
H
H
O
H
Tworzenie wiązań wodorowych pomiędzy
wodą a alkoholem powoduje, że alkohole
zawierające
do
4
atomów
węgla
doskonale rozpuszczają się w wodzie
O
H
Część
hydrofobowa
Część
hydrofilowa
Otrzymywanie
Alkohole
Otrzymuje się je w wyniku
hydrolizy chlorowcopochodnych
przyłączenia wody do alkenów
fermentacji
redukcji aldehydów i ketonów
syntezy Grignarda
Przykłady:
Hydroliza chlorowcopochodnych
R-X + HOH --> ROH + HX

Addycja wody do alkenów
Reakcja addycji wody przebiega z udziałem octanu rtęciowego Hg(OAc)
2
a
orientacja addycji zgodna jest z regułą Markownikowa. Sama reakcja
nazywana jest reakcją hydroksyrtęciowania
CH
2
=CH
2
+ HOH --> CH
3
-CH
2
OH
Reakcja hydroksyrtęciowania polega na elektrofilowej addycji do podwójnego
wiązania węgiel-węgiel, gdzie czynnikiem elektrofilowym jest jon rtęciowy.
Fermentacja
Fermentacja jest to najstarsza synteza chemiczna stosowana przez człowieka.
Fermentacji podlegają cukry znajdujące się w owocach, zbożu i ziemniakach
za pomocą drożdży. Produktem fermentacji jest głównie alkohol etylowy.
C
6
H
12
O
6
--> 2C
2
H
5
OH + 2CO
2
Drożdże, które uczestniczą w procesie fermentacji, wytwarzają enzym, zwany
zymazą, która działa jako katalizator przemiany. Podczas produkcji piwa
zboże, np. jęczmień lub owies, przemienia się w "słód" przez moczenie w
wodzie w celu umożliwienia kiełkowania. W wyniku kiełkowania wytwarza się
enzym, zwany diastazą, który katalizuje przemianę skrobi w cukier. Następnie
przez fermentację otrzymuje się alkohol etylowy. Piwo zawiera niewielką ilość
alkoholu (3 - 6%), osiągając swój charakterystyczny smak dzięki dodatkowi
chmielu. Wina są zwykle nieco mocniejsze (10 - 14% alkoholu). Maksymalna
zawartość alkoholu osiągana przez destylację zwykła wynosi 95%
objętościowych. Pozostałą zawartość wody (5% obj.) można usunąć za
pomocą chemicznych środków odwadniających (CaCl
2
).
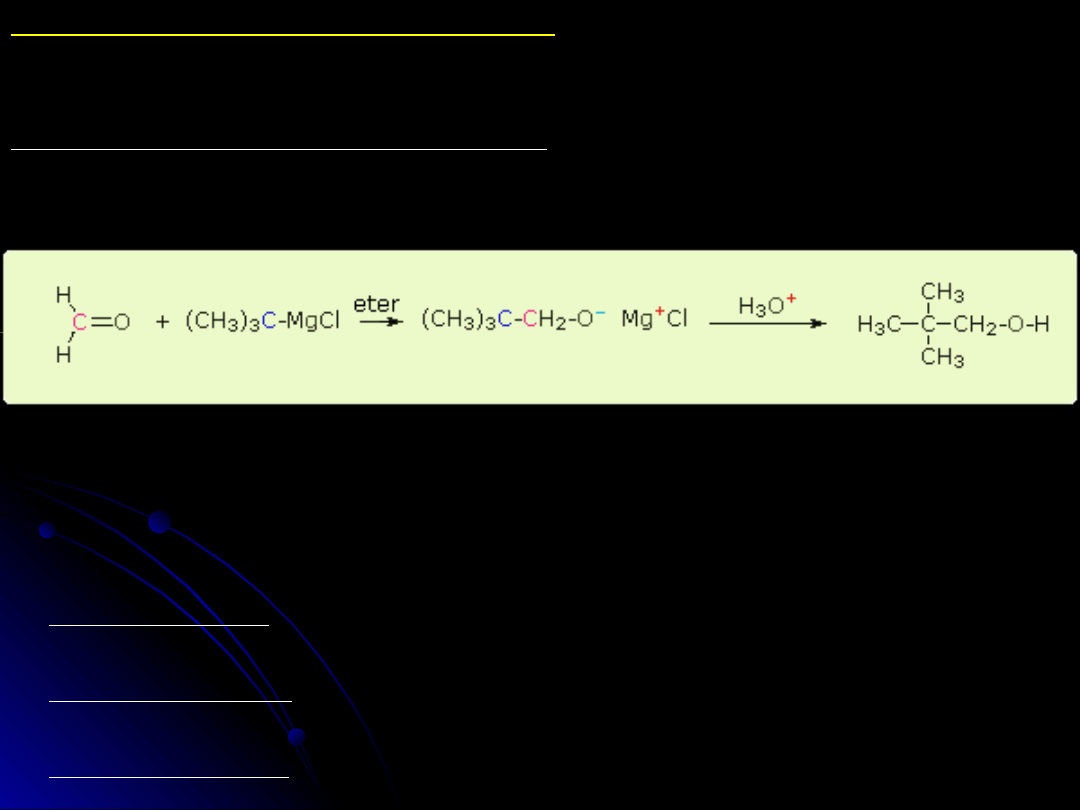
REDUKCJA ALDEHYDÓW I KETONÓW
RCHO + H
2
--> R-CH
2
-OH
(CH
3
)
2
C=O + H
2
--> (CH
3
)
2
CH-OH
Synteza alkoholi metodą Grignarda
Otrzymywanie związku Grignarda (środowisko bezwodnego eteru)
RX + Mg --> RMgX
Przebieg reakcji z udziałem związku Grignarda.
Rodzaj alkoholu powstającego w syntezie metodą Grignarda zależy od typu
użytego związku karbonylowego:
z formaldehydu HCHO, powstają alkohole I-rzędowe
z RCHO - alkohole II-go rzędowe
z R
2
CO - alkohole III-cio rzędowe
z formaldehydu
HCHO + RMgX --> R-CH
2
-OMgX dalej + H
2
O --> R-CH
2
OH
z aldehydu RCHO
RCHO + R'MgX --> RR'CH-OMgX dalej + H
2
O --> RR'CH-OH
z ketonu RR'C=O
RR'C=O + R"MgX --> RR'R"C-OH
Fenole
Hydroksypochodne aromatyczne otrzymuje się z kwasów
sulfonowych w reakcji stapiania z NaOH lub KOH
C
6
H
5
SO
3
H + NaOH --> C
6
H
5
SO
3
Na + H
2
O
C
6
H
5
SO
3
Na + NaOH --> C
6
H
5
OH + Na
2
SO
3
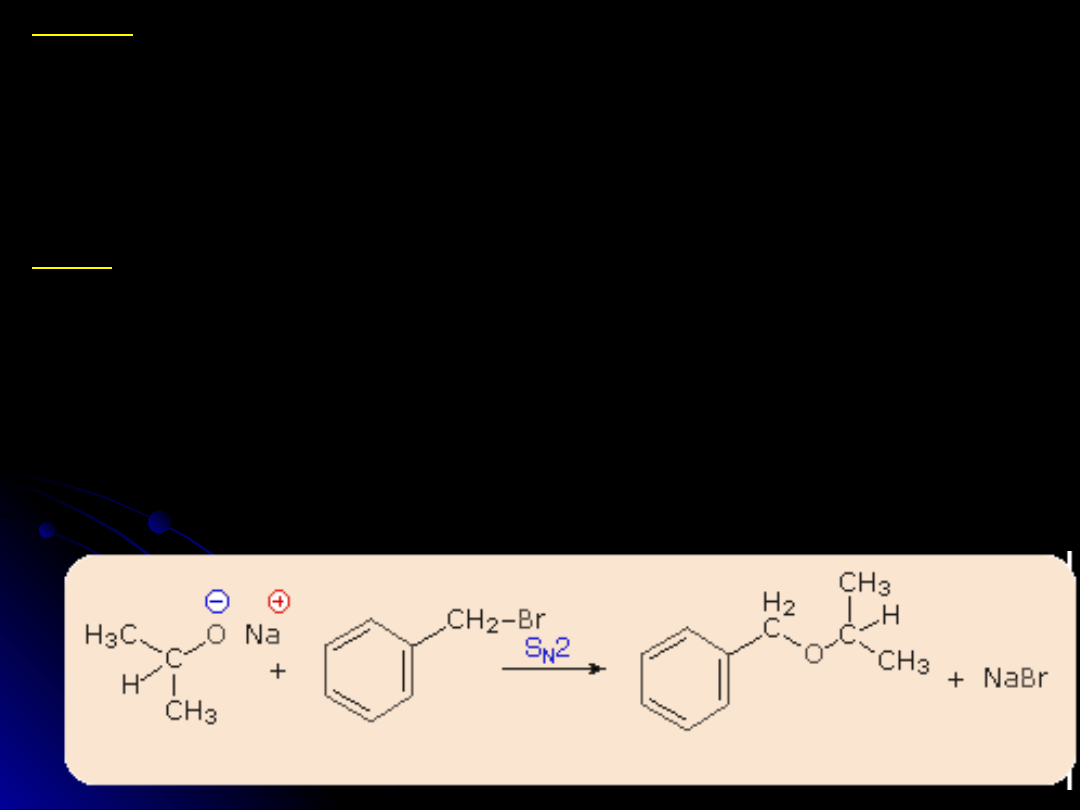
Etery
Etery dwu alkilowe otrzymuje się przez odwodnienie alkoholi w
silnie kwaśnym środowisku
2ROH --> R-O-R + H
2
O
Inna metoda polega na reakcji alkoholanów lub fenolanów z
halogenowęglowodorami
RBr + R-O--Na
+
--> R-O-R + NaBr

Właściwości chemiczne
Alkohole
O właściwościach chemicznych alkoholi decyduje obecność grupy
hydroksylowej w cząsteczce. Reakcje alkoholi mogą polegać na
rozerwaniu jednego z dwóch wiązań: wiązania C-OH z
odszczepieniem grupy -OH, albo wiązania O-H z oderwaniem atomu
H.
Każda z tych przemian może polegać na reakcji substytucji, w której
następuje wymiana grupy -OH lub atomu wodoru na inną grupę, albo
na reakcji eliminacji,
w wyniku której zostaje utworzone wiązanie podwójne.
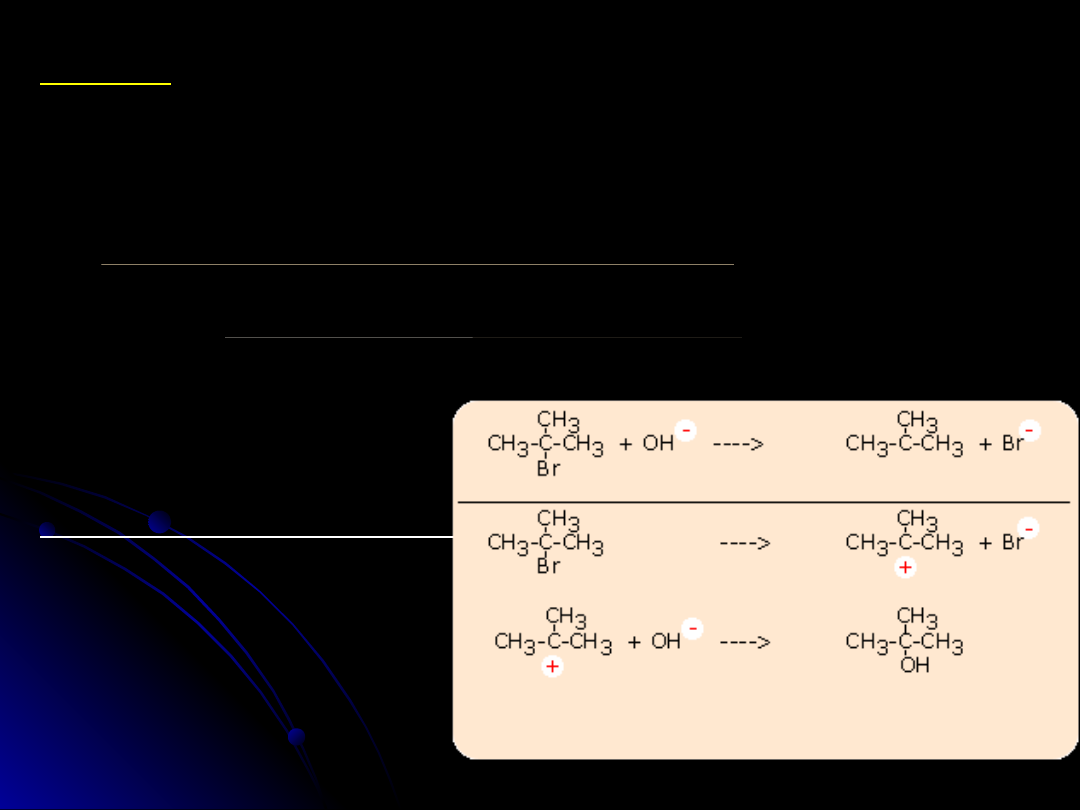
Reakcja z halogenowodorami
R-OH + HX --> RX + H
2
O
CH
3
CH
2
CH
2
CH
2
-OH + H
Br
(48%)
<===>
CH
3
CH
2
CH
2
CH
2
-OH
2
(+)
Br
(-)
---->
CH
3
CH
2
CH
2
CH
2
-
Br
+ H
2
O
S
N
2
(CH
3
)
3
C-OH + H
Cl
(37%)
<===>
(CH
3
)
3
C-OH
2
(+)
Cl
(-)
<===>
(CH
3
)
3
C
(+)
Cl
(-)
+H
2
O --->
(CH
3
)
3
C-
Cl
+H
2
O
S
N
1
Reakcja z trójhalogenkami fosforu
R-OH + PX
3
--> RX + H
3
PO
4
(PX
3
= PBr
3
, PI
3
)
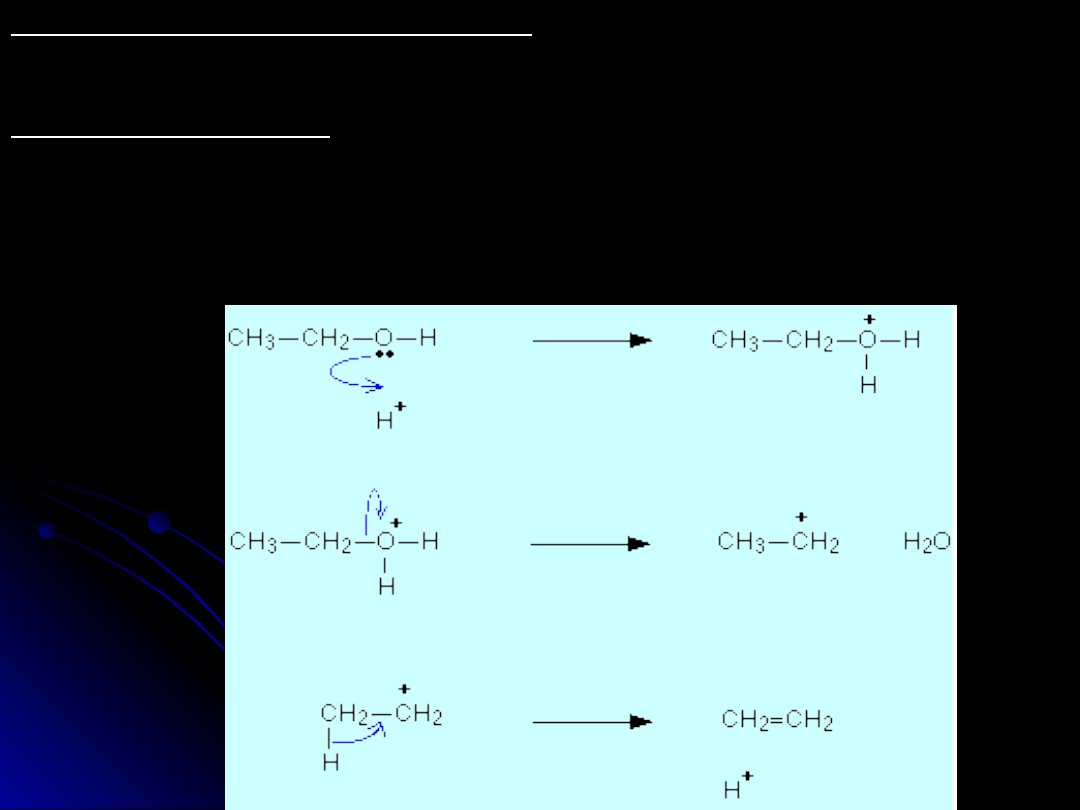
Reakcja dehydratacji
Rekcja dehydratacji przebiega w środowisku kwasowym np. H
2
SO
4
. Przebieg i
mechanizm reakcji był już opisany w punkcie opisującym otrzymywanie
alkenów.
CH
3
-CH
2
OH --> CH
2
=CH
2
+ H
2
O
Reakcje alkoholi z metalami aktywnymi
Metalami aktywnymi są: Na, K, Al
2CH
3
-CH
2
OH + 2Na --> 2CH
3
-CH
2
ONa + H
2
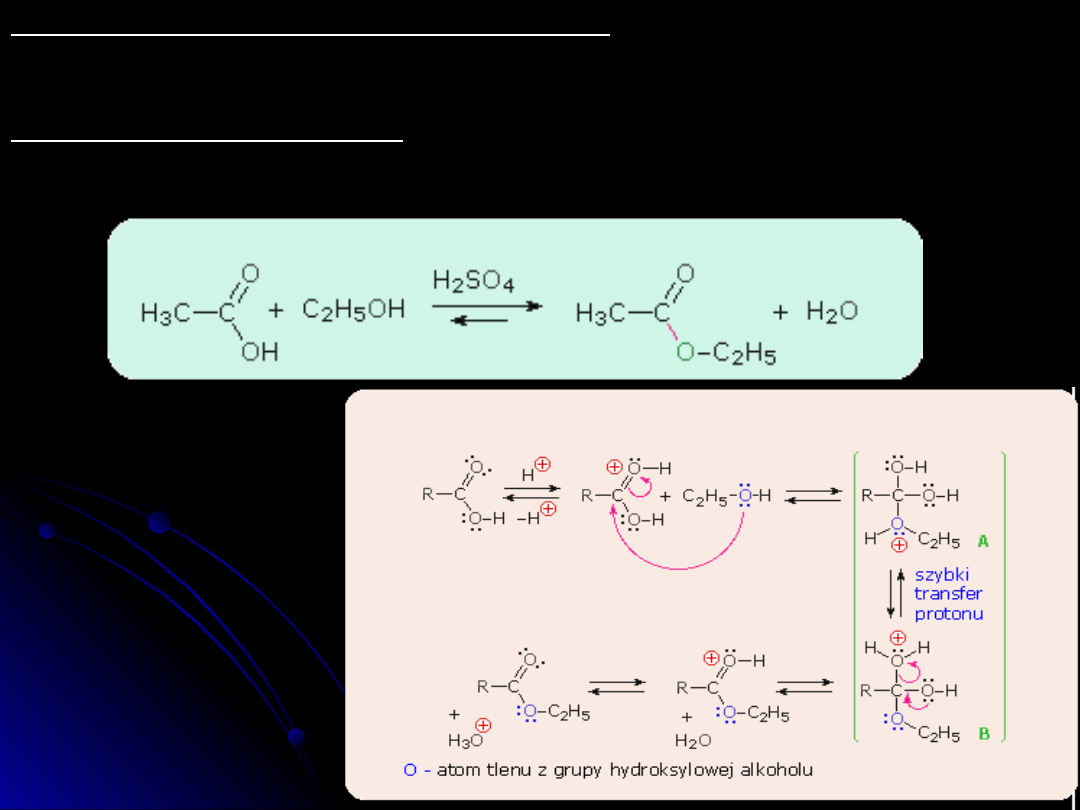
Reakcja tworzenia estrów
Reakcja tworzenia estrów przebiega w środowisku kwasowym np.H
2
SO
4
CH
3
-CH
2
OH + CH
3
COOH --> CH
3
COOC
2
H
5
+ H
2
O
Mechanizm reakcji
Estrami są:
tłuszcze
substancje zapachowe
woski
inne
Estry o miłym zapachu wykorzystywane są w przemyśle kosmetycznym i
spożywczym (aromaty spożywcze). Zapach kwiatów i owoców to zapach
estrów. Szczególną grupę estrów stanowią tłuszcze.
Fenole
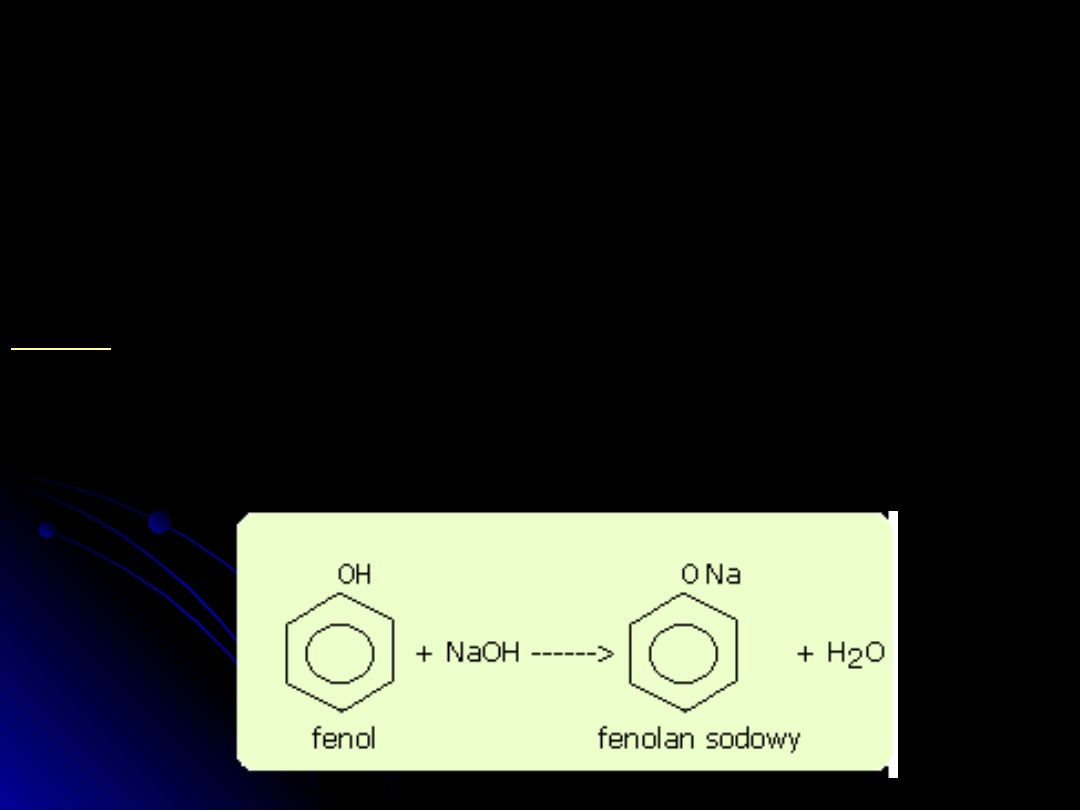
Najbardziej charakterystyczną właściwością chemiczną fenoli jest ich
kwasowość i zdolność tworzenia soli.
ArOH + H
2
O <=> ArO
-
+ H
3
O
+
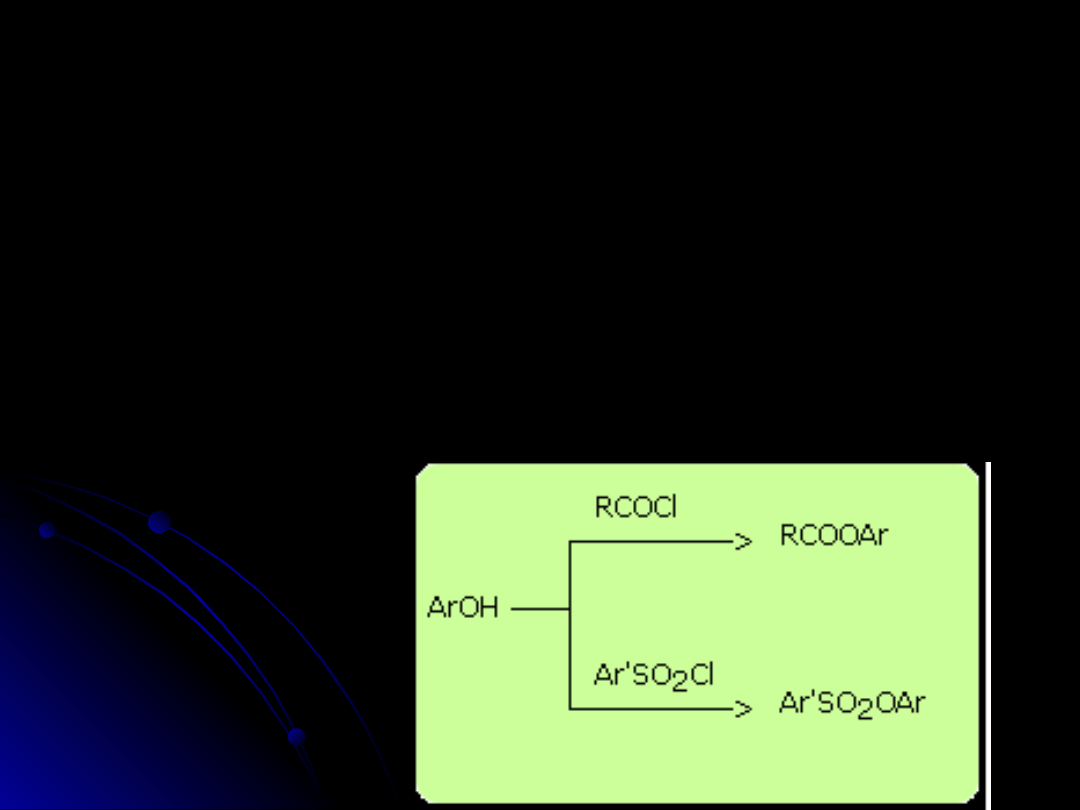
Oprócz kwasowości, fenole charakteryzują się dużą reaktywnością
pierścienia w reakcjach substytucji elektrofilowej.
Fenole ulegają nie tylko reakcjom podstawienia elektrofilowego, typowym
dla większości związków aromatycznych, lecz także wielu innym reakcjom,
które możliwe są tylko dzięki niezwykłej reaktywności pierścienia. Do tych
reakcji zaliczamy:
reakcja tworzenia eterów - synteza Williamsona
ArO
-
+ RX ----> ArOR + X
-
reakcja tworzenia estrów
Substytucja w pierścieniu
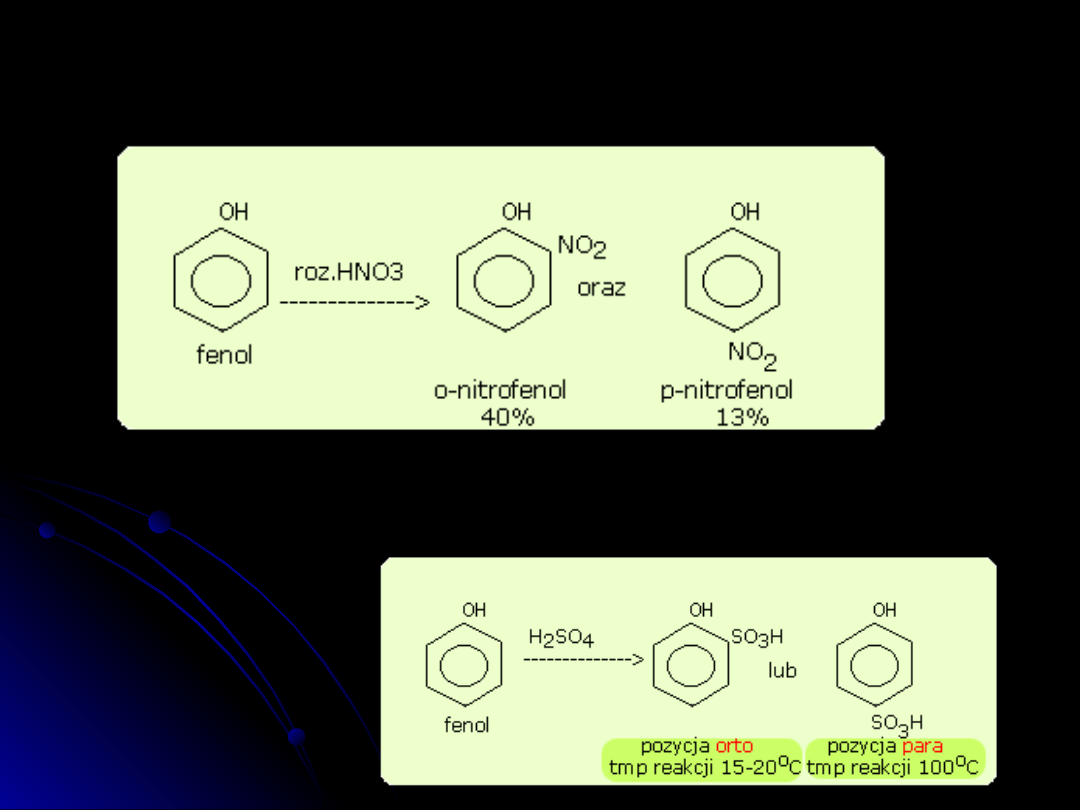
Przykładami reakcji substytucji elektrofilowej są następujące reakcje
chemiczne.
reakcja nitrowania
W wyniku działania stężonego kwasu azotowego na fenol powstaje
2,4,6-trinitrofenol (kwas pikrynowy)
reakcja sulfonowania
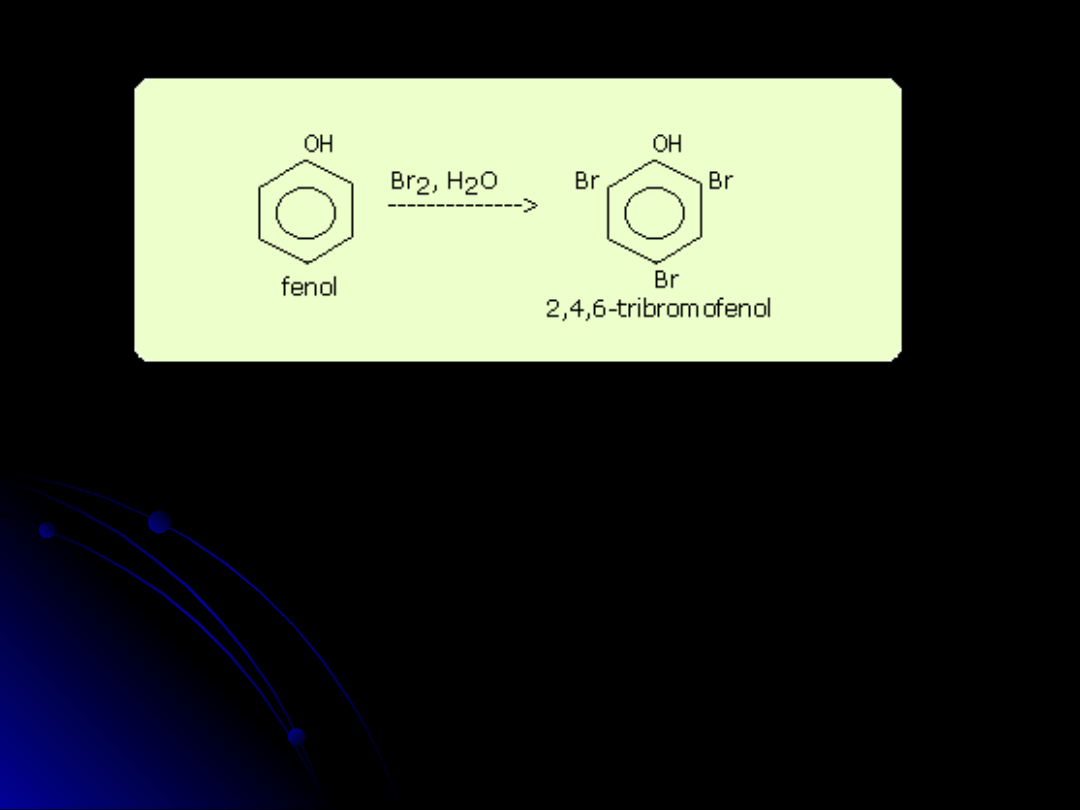
reakcja halogenowania
Bromowanie w obecności CS
2
i w temperaturze 0°C daje produkt
o nazwie p-bromofenol.
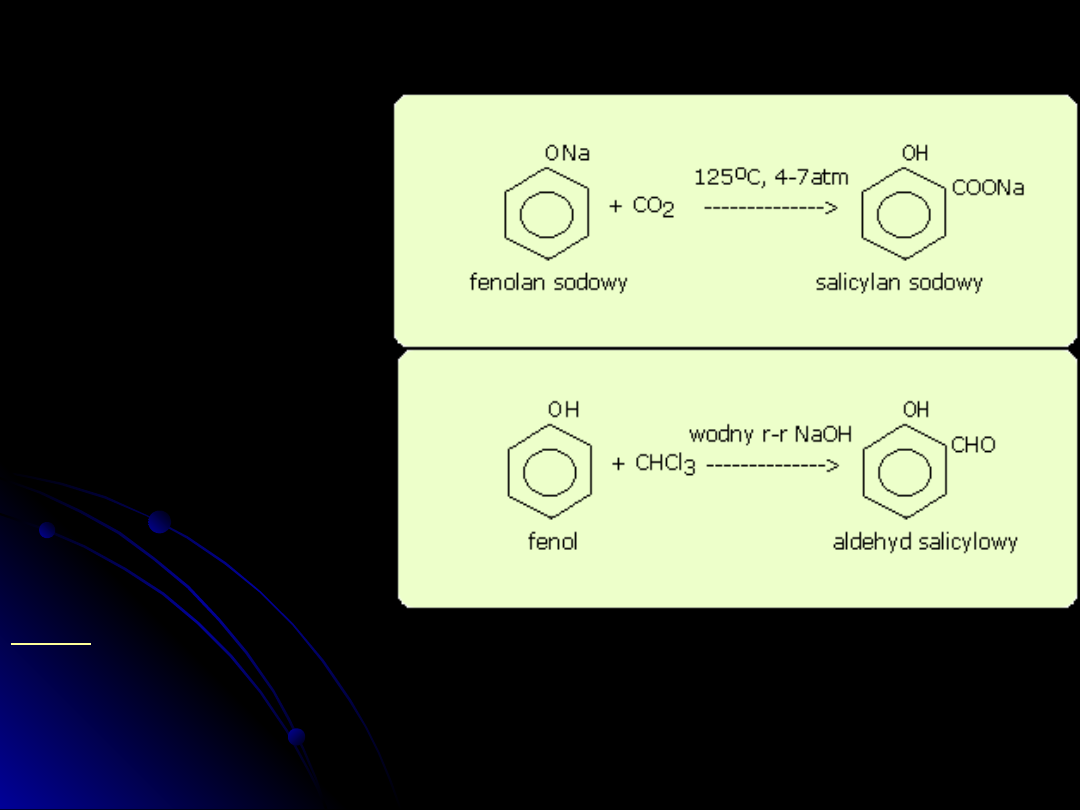
tworzenie aldehydów
- reakcja Reimera-
Tiemanna
alkilowananie metodą Friedla-
Craftsa
acylowanie metodą Friedla-
Craftsa
karboksylowanie
Etery
Wiązanie eterowe jest wiązaniem trwałym, trudno ulega działaniom
czynników chemicznych. Rozerwanie wiązania eterowego powoduje działanie
jodowodoru HI
R-O-R + HI --> R-I + ROH

Najważniejszymi alkoholami mającymi praktyczne zastosowanie są:
metanol, etanol a z alkoholi aromatycznych fenol.
Metanol
jest bezbarwną cieczą, bardzo dobrze rozpuszczalną w wodzie. Na
powietrzu pali się niebieskawym płomieniem. Metanol (spirytus drzewny) jest
śmiertelną trucizną. Niektórzy ludzie mogą pamiętać metanol jako truciznę,
która oślepiła lub zabiła wielu ludzi. Metanol ma następujące zastosowanie:
służy jako rozpuszczalnik farb i lakierów oraz paliwo
używa się go do produkcji tworzyw sztucznych, leków, barwników,
włókien
syntetycznych
stosowany w przemyśle chemicznym m.in. do wytwarzania aldehydu
mrówkowego (formalina), estrów, metyloamin, chlorku metylu
Etanol
jest bezbarwną, łatwo palną cieczą. Rozpuszcza się w wodzie,
benzenie i benzynie. Większość etanolu stosuje się do wyrobu różnego
rodzaju napoi alkoholowych. Przyjmowany w niewielkich ilościach obniża próg
wrażliwości narządów zmysłu. Jest szkodliwy dla zdrowia. Nadmierne picie
napojów alkoholowych powoduje różnego rodzaju uszkodzenia tkanek oraz
doprowadzenie do alkoholizmu, tj. nałogowego zatruwania się i całkowitego
uzależnienia od alkoholu. Dobrą ilustracją działania alkoholu na organizm
człowieka, może być praktyczny pokaz działania alkoholu na białko kurze.

Białko kurze poddane działaniu alkoholu etylowego ulega ścinaniu
czyli zachowuje się podobnie jak białko kurze rzucone na rozgrzaną
patelnię. Jest to proces nieodwracalny w wyniku którego struktura
białka ulega zniszczeniu.
W organizmie uszkodzeniu ulega: serce, wątroba, przewód
pokarmowy i układ nerwowy.
Fenol
jest silnie toksyczny. Głownie jest wykorzystywany jako
półprodukt do wyrobu tworzyw sztucznych.

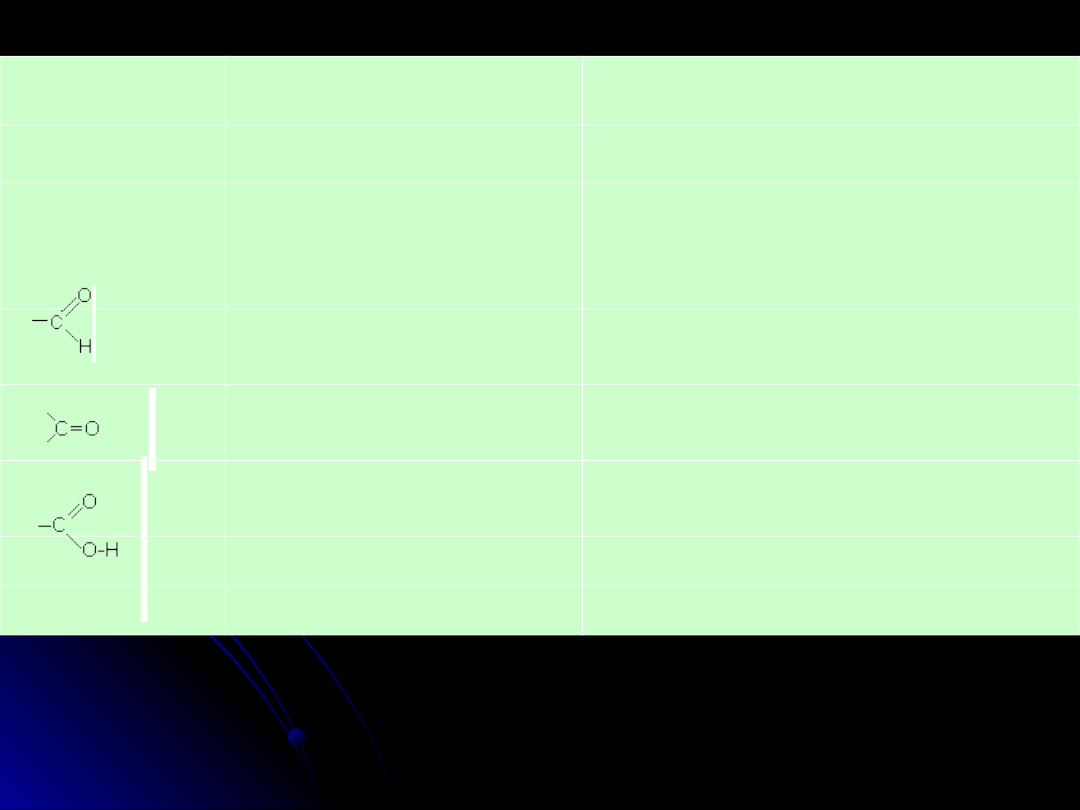
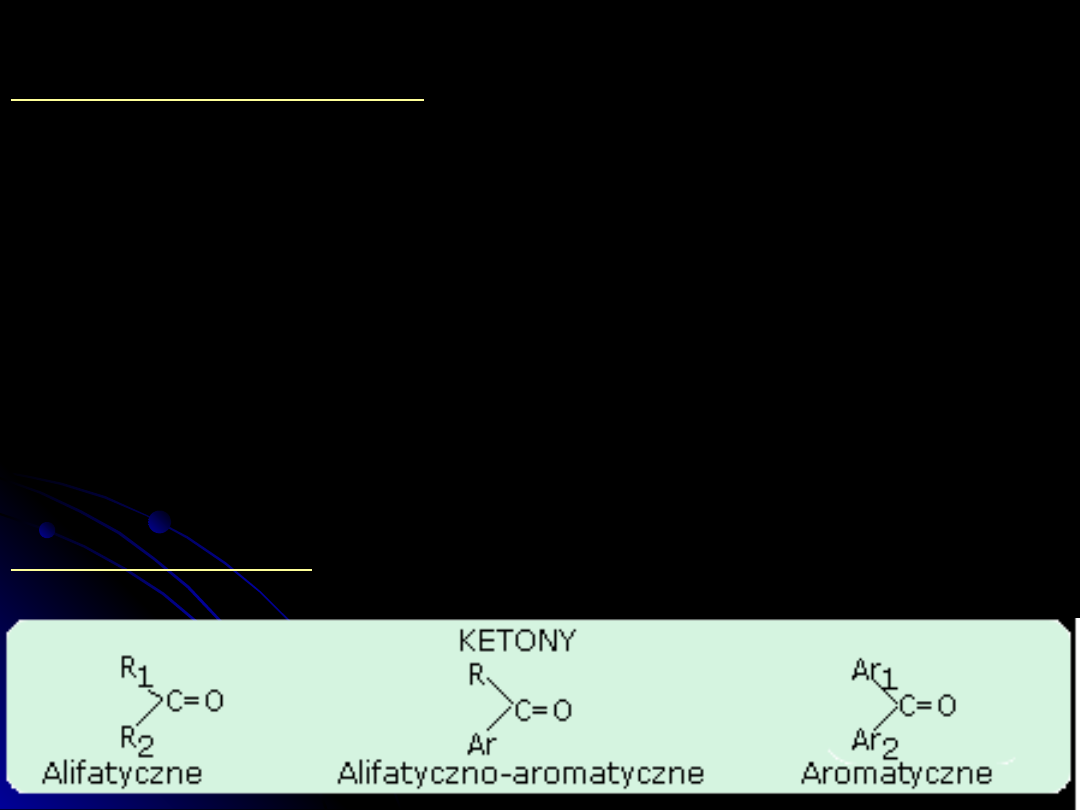
Wśród związków organicznych zawierających grupę karbonylową =C=O
można wyróżnić 3 zasadnicze typy:
aldehydy, ketony i kwasy karboksylowe
.
Aldehydami
nazywamy pochodne węglowodorów zawierające w
cząsteczce grupę aldehydową -CHO, natomiast
ketonami
nazywamy
pochodne węglowodorów zawierające w cząsteczce grupę ketonową
=C=O.
Symbol aldehydów - RCHO, ketonów - RCOR
1
Hybrydyzacja atomów grupy karbonylowej: C sp
2
i O sp.
Podstawowe wiązanie w grupie karbonylowej - σ i π
NAZEWNICTWO
Nazwy zwyczajowe aldehydów
pochodzą od nazw zwyczajowych
odpowiednich kwasów karboksylowych, w których słowo "kwas" zastąpiono
słowem "aldehyd", np. aldehyd mrówkowy.
W nazwach systematycznych nazwy wyprowadzamy od nazwy węglowodoru
dodając końcówkę
-al
Przykłady:
metanal, aldehyd mrókowy
HCHO
etanal, aldehyd octowy
CH
3
-CHO
aldehyd benzoesowy (aromatyczny)
C
6
H
5
-CHO
Nazewnictwo ketonów
Ketony mogą być: alifatyczne, alifatyczno-aromatyczne i aromatyczne.
Zasady nazewnictwa ketonów są podobne do tych które były opisywane przy
aldehydach.
Nazwę ketonu tworzy się przez dodanie końcówki
-on
do nazwy
węglowodoru.
Przykłady:
propanon, aceton
butan-2-on, keton etylo-metylowy
C
2
H
5
COCH
3
acetofenon (aromatyczny)
C
6
H
5
COCH
3

Właściwości fizyczne
Właściwości fizyczne aldehydów i ketonów zależne są od liczby atomów
węgla w cząsteczce:
Aldehydy
Stan skupienia
C1 - występuje w stanie gazowym
> C2 - występują w stanie ciekłym
Charakterystyczny zapach
C1 - C3 - mają nieprzyjemny zapach
C4 - C7 - mają odrażającą woń
> C8 - mają przyjemny zapach
Ketony
1. Są cieczami
2. Są lotniejsze niż odpowiadające im alkohole
3. Rozpuszczają się w wodzie i w rozpuszczalnikach organicznych w
tym samym stopniu co alkohole
4. Są dobrymi rozpuszczalnikami organicznymi
5. Mają małą zdolność do krystalizacji
Otrzymywanie
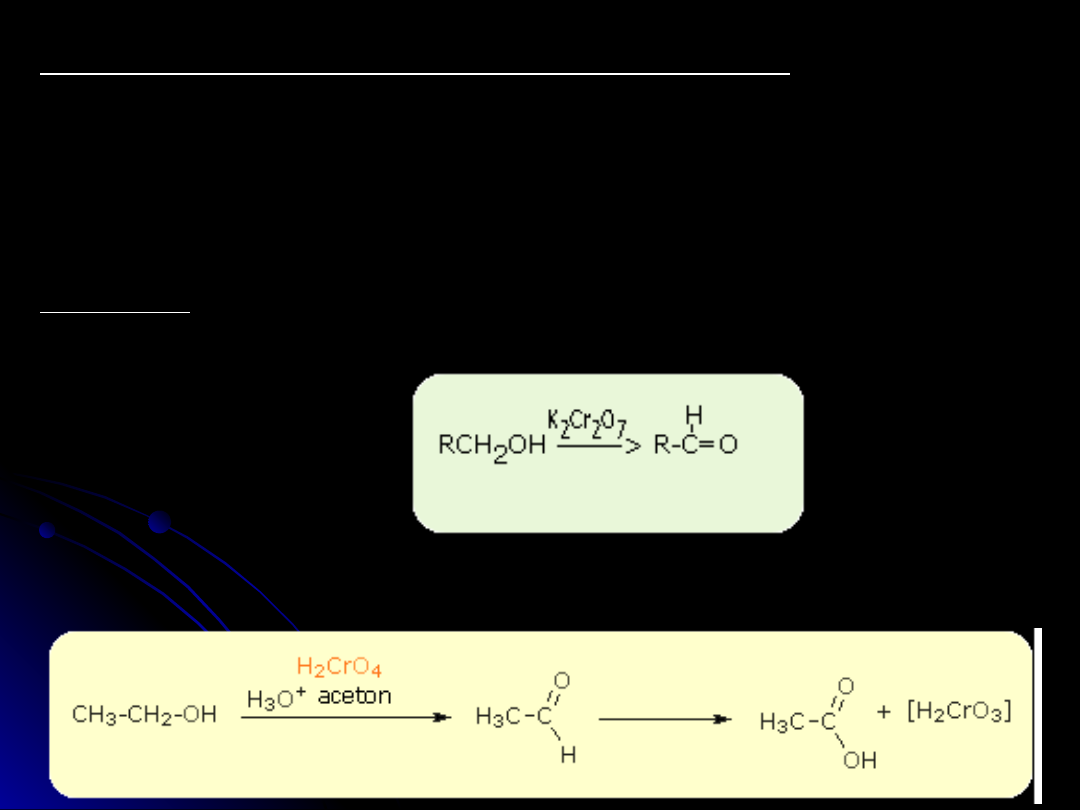
Aldehydy otrzymuje się następującymi metodami
utlenianie alkoholi I-szo rzędowych w obecności K
2
Cr
2
O
7
utlenianie metylowych pochodnych benzenu
redukcja chlorków kwasowych
synteza Reimera-Tlemanna (otrzymywanie fenolo-aldehydów)
Przykłady
Utlenianie alkoholi I-szo rzędowych
RCH
2
OH --> RCHO
Pogłębione utlenianie alkoholi I-szo rzędowych daje nam produkt
końcowy - kwas karboksylowy
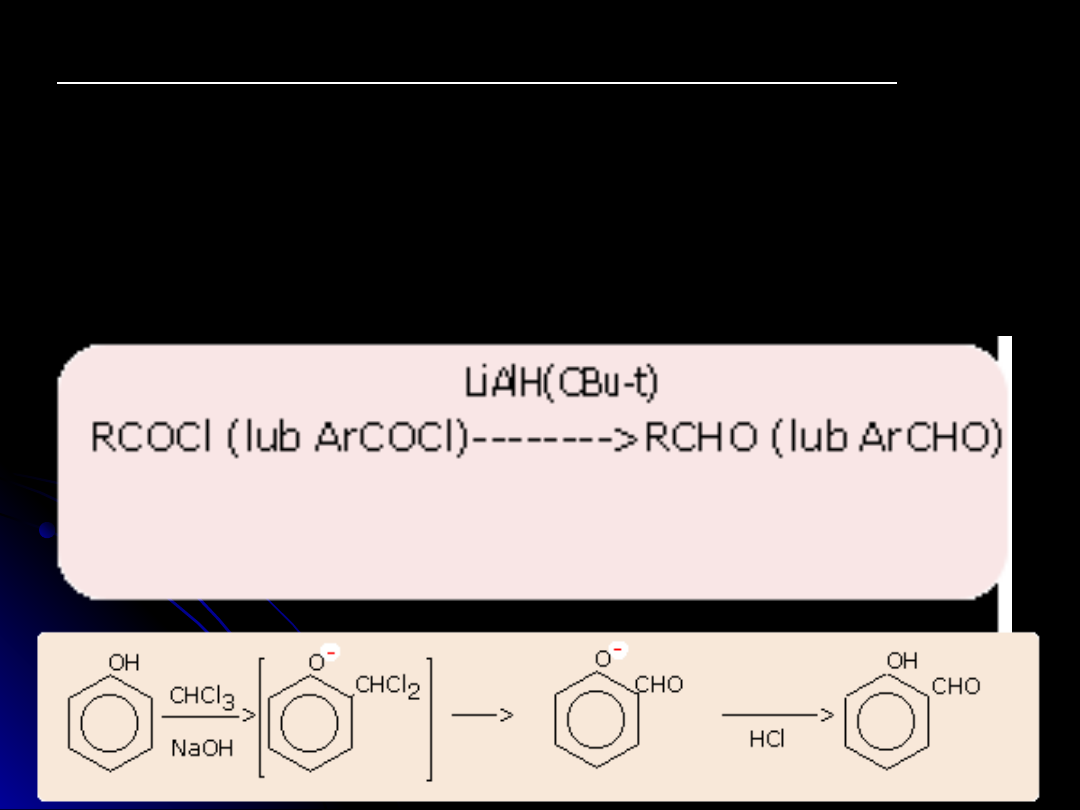
Synteza Reimera-Tiemanna (otrzymywanie fenolo-aldehydów)
W wyniku działania chloroformu i wodnego roztworu wodorotlenku
na fenol grupa aldehydowa -CHO zostaje wprowadzona do
pierścienia aromatycznego, na ogół w położenie -orto do grupy
-OH.
C
6
H
5
OH + (CHCl
3
, NaOH) --> HOC
6
H
4
CHO
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
- Slide 40
- Slide 41
- Slide 42
- Slide 43
- Slide 44
- Slide 45
- Slide 46
- Slide 47
- Slide 48
- Slide 49
- Slide 50
- Slide 51
- Slide 52
Wyszukiwarka
Podobne podstrony:
3 ch org związki funkcyjne
Ch org cd Zwiazki wielofunkcy Nieznany
zcho ch org errata
W4 ch org 2011 12
kolokwium 4, organiczna, ch.org kolo
MOJE ch org 5
kolokwium 2, organiczna, ch.org kolo
Ch org c d Weglowodany, aminokwasy id 1102
egzamin 23.06.2008, organiczna, ch.org kolo
kolokwia zaliczeniowe 2001-2008, organiczna, ch.org kolo
kolokwium 1, organiczna, ch.org kolo
pytania ch org 11 i 12
egzamin 02.02.2009, organiczna, ch.org kolo
kolokwium 2, organiczna, ch.org kolo
kolokwium 1 27.03.2008 rozwiązania, organiczna, ch.org kolo
więcej podobnych podstron