
Węglowodory
Podział
ze względu na budowę czyli sposób połączenia wzajemnego
atomów węgla:
• węglowodory łańcuchowe (alifatyczne)
• węglowodory pierścieniowe (cykliczne)
w zależności od rodzaju wiązań:
• węglowodory nasycone (alkany, cykloalkany)
• węglowodory nienasycone (alkeny, alkiny, cykloalkeny)
• węglowodory aromatyczne (areny)

Reguły IUPAC nazewnictwa nasyconych
węglowodorów alifatycznych
• Wybiera się najdłuższy łańcuch węglowy i określa go nazwą
węglowodoru. Łańcuchy węglowe rozgałęzień traktuje się jako
podstawniki, nadając im nazwy odpowiadające rodnikom
utworzonym z węglowodorów o identycznej ilości atomów
węgla.
• Numeruje się atomy węgla najdłuższego łańcucha tak, by suma
liczb określających położenie podstawników przy danych
atomach węgla była jak najmniejsza.
• Jeżeli przy tym samym atomie węgla znajdują się dwa
identyczne podstawniki, to wymienia się w nazwie lokant tej
pozycji dla każdego podstawnika.
• Dla podstawników posiadających łańcuch rozgałęziony wybiera
się najdłuższy łańcuch węglowy i numeruje go, rozpoczynając
od atomu węgla związanego z łańcuchem głównym.

• Jeżeli przy łańcuchu głównym znajduje się kilka
identycznych podstawników to krotność ich występowania
określa się przedrostkami: di-, tri-, tetra-, penta-, jeżeli te
podstawniki są nierozgałęzione. Dla rozgałęzionych
identycznych grup alkilowych (podstawionych w ten sam
sposób) stosuje się przedrostki bis, tris, tetrakis bez kresek
łącznikowych.
• Przy wymienianiu nazw podstawników stosuje się porządek
alfabetyczny bez uwzględniania przedrostków krotności dla
podstawników nierozgałęzionych, natomiast z
uwzględnieniem tych przedrostków dla podstawników
rozgałęzionych.
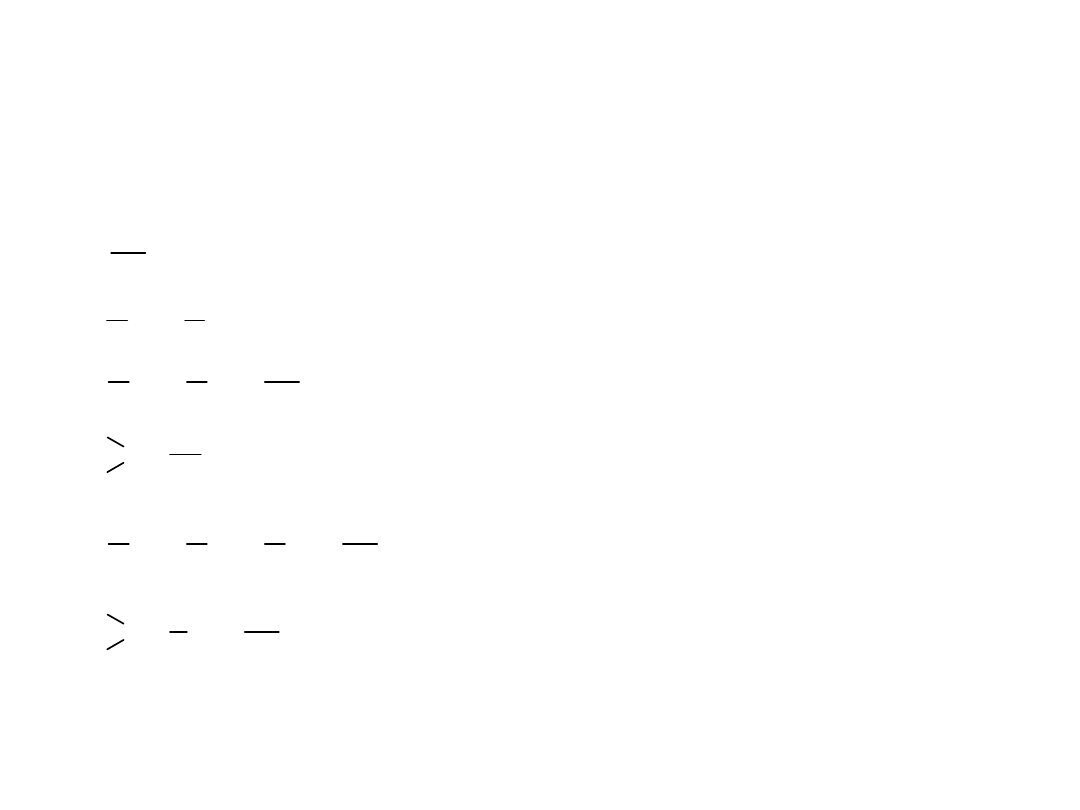
Nazewnictwo najprostszych grup alkilowych
CH
3
CH
3
CH
2
CH
3
CH
2
CH
2
CH
3
CH
2
CH
2
CH
2
CH
CH
3
CH
3
CH CH
2
CH
3
CH
3
metyl
etyl
propyl
butyl
izopropyl
izobutyl
pierwszorzędowy.
drugorzędowy.
pierwszorzędowy
pierwszorzędowy
pierwszorzędowy
pierwszorzędowy.
.
.
.
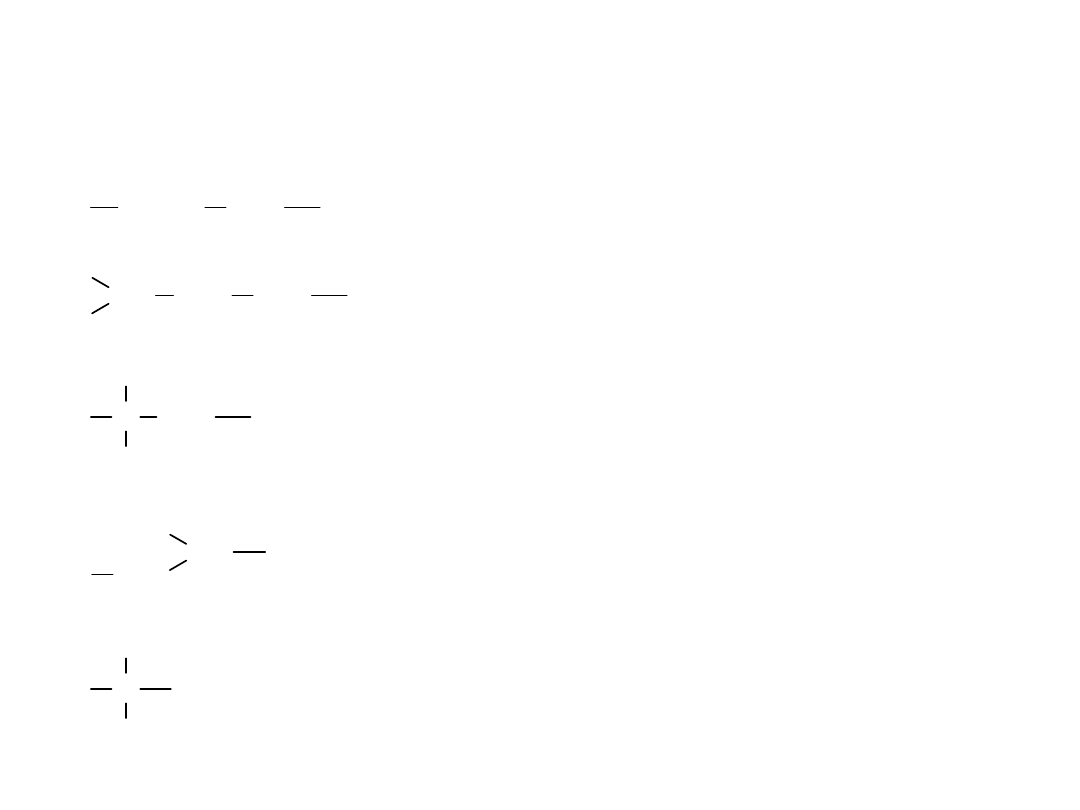
CH
3
(CH
2
)
3
CH
2
CH CH
2
CH
3
CH
3
CH
2
CH
3
C
CH
3
CH
3
CH
2
CH
CH
3
CH
2
CH
3
CH
3
C
CH
3
CH
3
pentyl
izopentyl
neopentyl
II-rzêd.-butyl
III-rzêd.-butyl
(sec-butyl)
(tert-butyl)
trzeciorzędowy.
pierwszorzędowy.
pierwszorzędowy.
pierwszorzędowy
drugorzędowy
.
.

Metody otrzymywania alkanów
1.
Redukcja (uwodornienie) odpowiednich alkenów lub
alkinów
2.
Z halogenoalkanów:
a.
przez redukcję wodorem
b. poprzez związki Grignarda
R CH CH R
1
H
2
R CH
2
CH
2
R
1
R C C R
1
2H
2
R CH
2
CH
2
R
1
R X
H
2
(Pt)
R H
R X
Mg
R Mg X
R Mg X
H
2
O
R H
Mg(OH)X
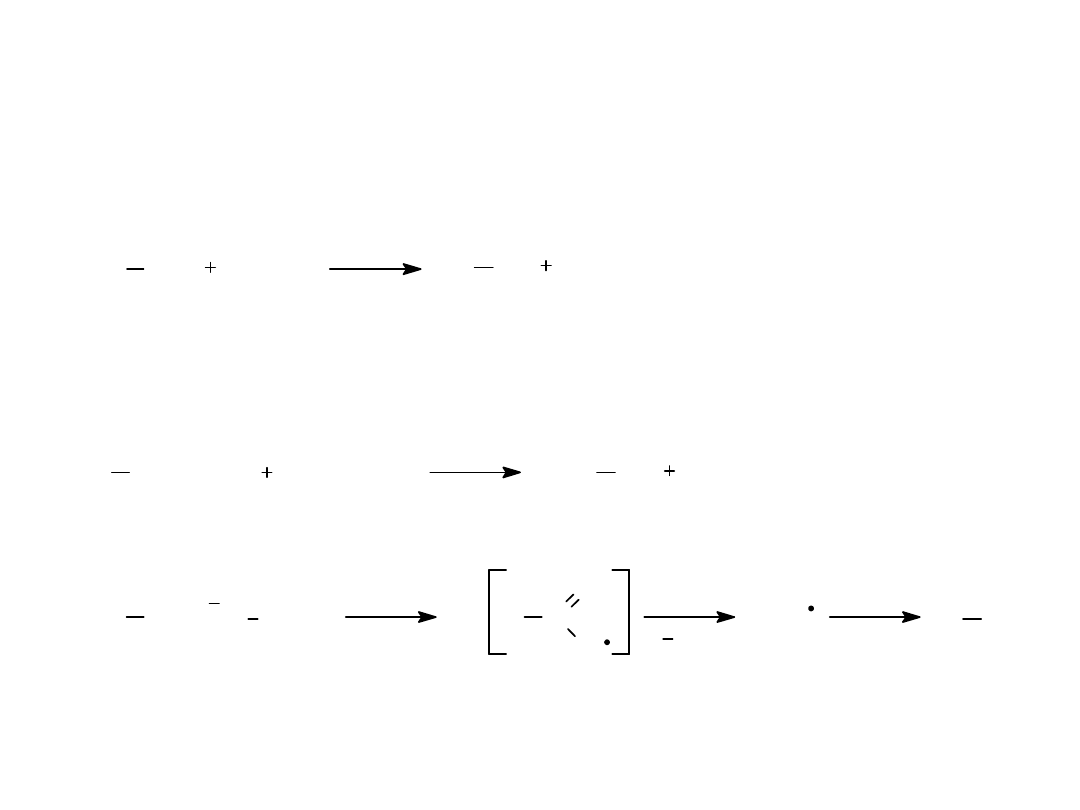
c.
w reakcji Würtza
3. Z kwasów organicznych na dwóch drogach:
a. piroliza (rozkład termiczny) soli kwasów organicznych wobec
zasad:
b. elektroliza wodnych roztworów soli kwasów organicznych:
R X
Na
R R
NaX
2
2
2
R COONa
NaOH
ogrzew.
R H
Na
2
CO
3
R COO
2 e
2
2
R C
O
O
CO
2
2 R
R R
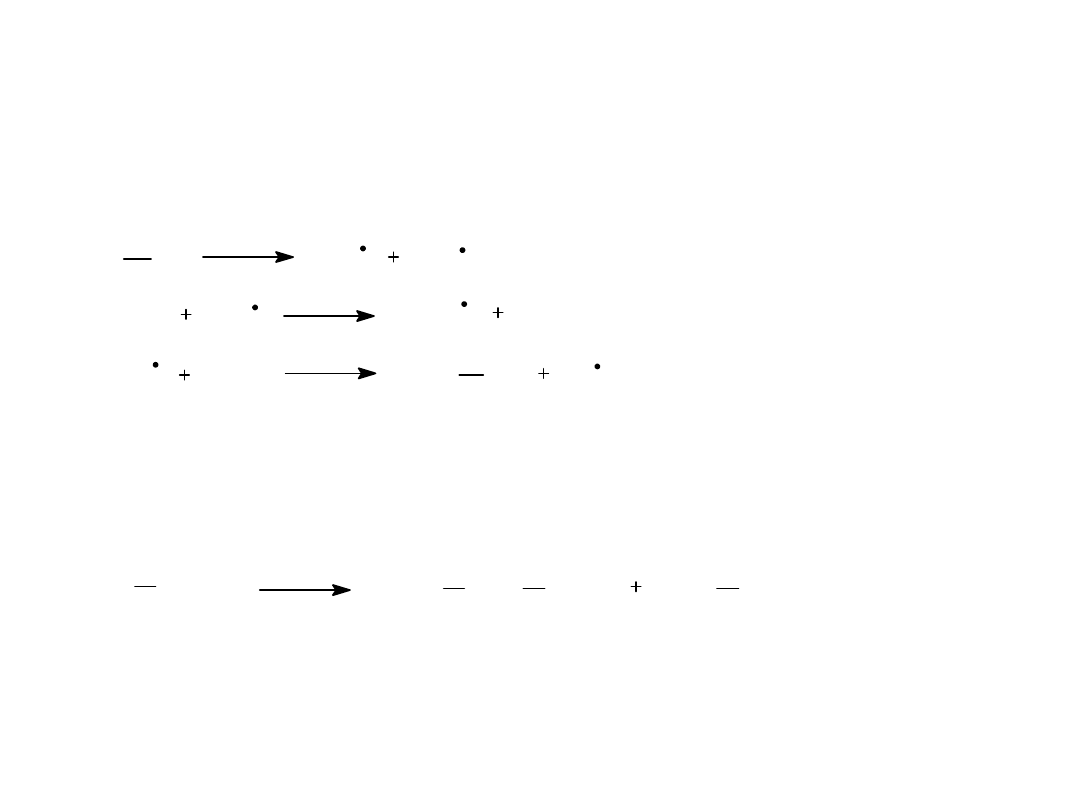
Właściwości chemiczne alkanów
• Reakcje chlorowania
• Nitrowanie alkanów
Cl Cl
Cl
Cl
CH
4
Cl
CH
3
HCl
CH
3
Cl
2
CH
3
Cl
Cl
światło
CH
3
CH
3
HNO
3
450
O
C
CH
3
CH
2
NO
2
CH
3
NO
2
73%
27%

• Utlenianie alkanów
• Piroliza
CH
3
CH
2
CH
3
600
O
C
CH
3
CH CH
2
H
2
CH
2
CH
2
CH
4
CH
4
O
2
CO
2
H
2
O
2
2
O
2
C
CH
4
2 H
2
O
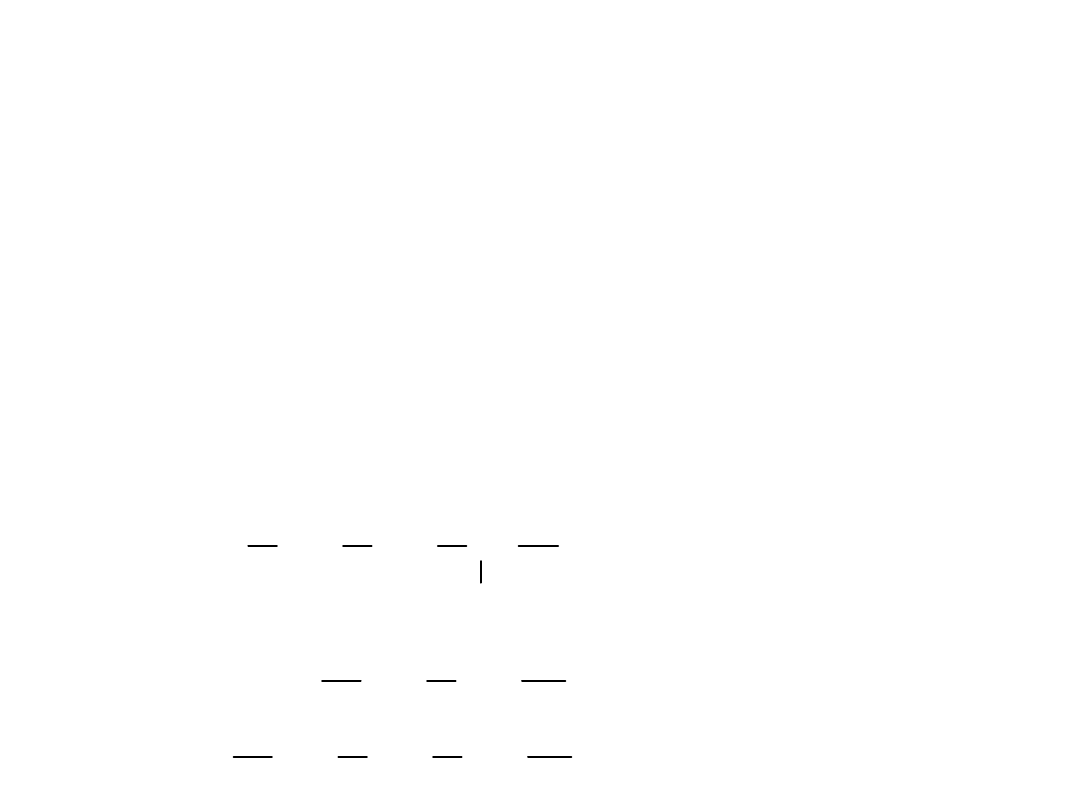
Alkilowanie
Reakcja alkilowania polega na wprowadzeniu do cząsteczki
związku organicznego ugrupowania alkilowego na miejsce
atomu wodoru. Alkilowaniu mogą ulegać związki nienasycone i
aromatyczne. W reakcji tej tworzy się wiązanie C – C pomiędzy
atomem węgla substratu a atomem węgla wprowadzanego
ugrupowania alkilowego. Reakcje takie określamy jako C-
alkilowanie.
Atom wodoru można zastąpić grupą alkilową w takich
ugrupowaniach jak : OH, NH
2
, SH (O-alkilowanie, N- i S-
alkilowanie)
Grupy alkilowe:
CH
3
CH
2
CH
2
CH
CH
3
1-metylobutyl.
CH
2
CH
2
etylen
CH
2
CH
2
CH
2
trimetylen
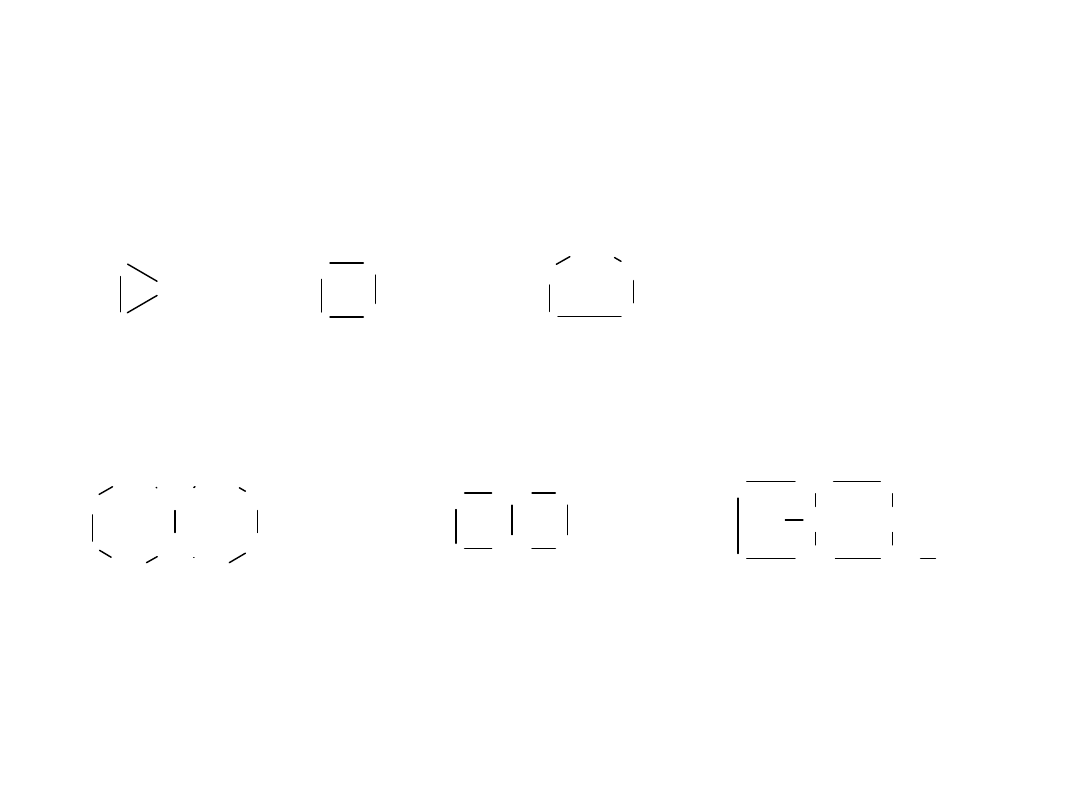
Cykloalkany
CH
2
CH
2
CH
2
CH
2
CH
2
CH
2
CH
2
CH
2
CH
2
CH
2
CH
2
CH
2
cyklopropan cyklobutan cyklopentan
CH
2
CH
2
CH
2
CH
CH
CH
2
CH
2
CH
2
CH
2
CH
2
CH
2
CH
2
CH
CH
CH
2
CH
2
CH
2
CH
2
CH
CH
CH
CH
CH
2
CH
2
CH
3
CH
2
CH
3
bicyklo[4,4,0]dekan bicyklo[2,2,0]heksan 2-etylo-8-metylobicyklo[3,2,1]
oktan
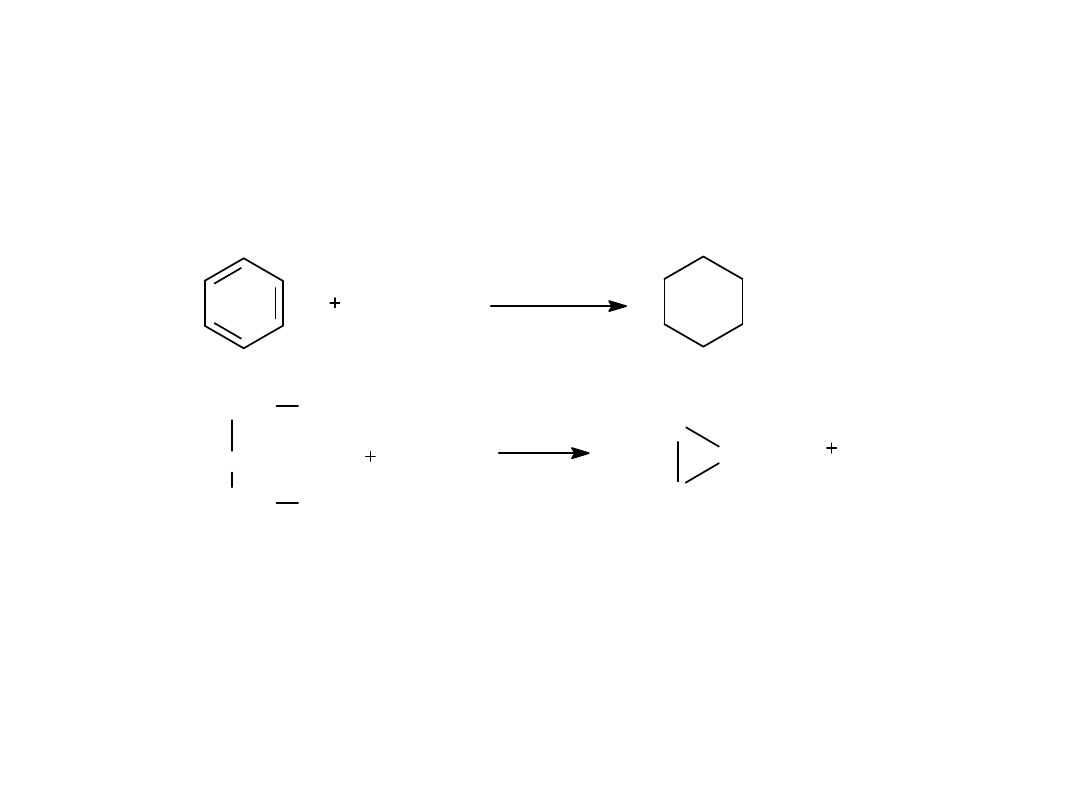
Metody otrzymywania cykloalkanów
3 H
2
Ni, 200
O
C
CH
2
Br
CH
2
CH
2
Br
Zn
CH
2
CH
2
CH
2
ZnBr
2
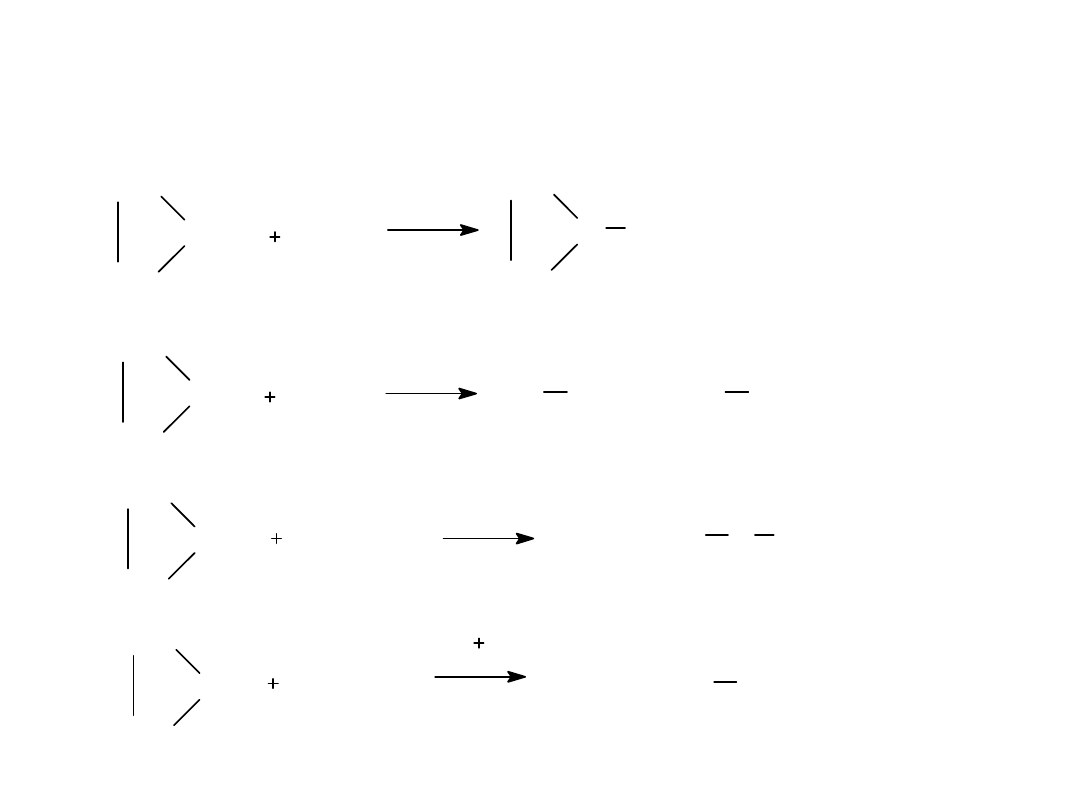
CH
2
CH
2
CH
2
Cl
2
światło
CH
2
CH
2
CH Cl
CH
2
CH
2
CH
2
Br
2
AlBr
3
Br CH
2
CH
2
CH
2
Br
CH
2
CH
2
CH
2
H
2
SO
4
CH
3
CH
2
CH
2
O SO
3
H
jedyny węglowodór nasycony rozp.
w stęż. kw.siarkowym !
CH
2
CH
2
CH
2
H
2
O
H
CH
3
CH
2
CH
2
OH

Alkeny
CH
2
=CH
2
eten
CH
3
-CH
2
-CH=CH
2
but-1-en
CH
3
-CH=CH-CH
3
but-2-en
CH
2
=CH- etenyl (winyl)
CH
2
=CH-CH
2
- prop-2-enyl (allil)
CH
3
- CH=CH-CH
2
- but-2-enyl
-CH=CH- etenylen (winylen)
-CH
2
-CH=CH- propenylen
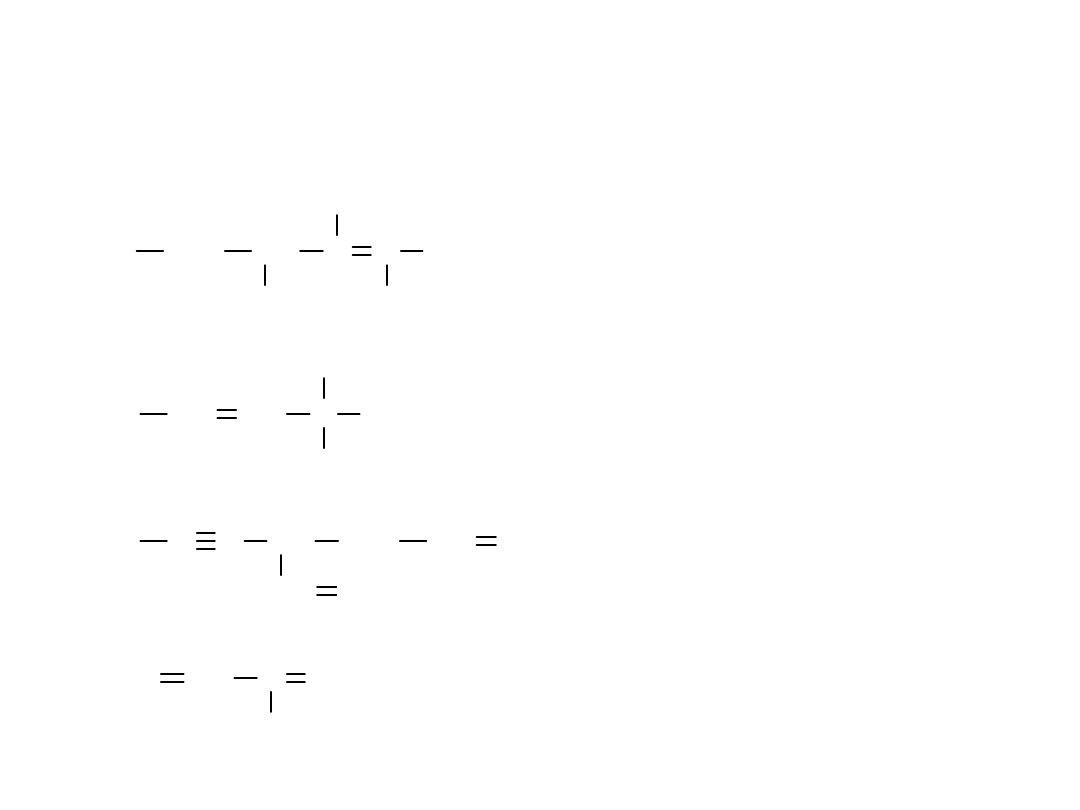
CH
3
CH
2
CH
C
2
H
5
C C
CH
3
CH
3
CH
3
4-etylo-2,3-dimetylo-heks-2-en.
CH
3
CH CH C
Cl
CH
3
CH
3
4-chloro-4-metyl-pent-2-en
CH
3
C C CH
CH
CH
2
CH
2
CH CH
2
4-winylo-hept-1-en-5-yn
CH
2
CH C
CH
3
CH
2
2-metylo-buta-1,3-dien (izopren)
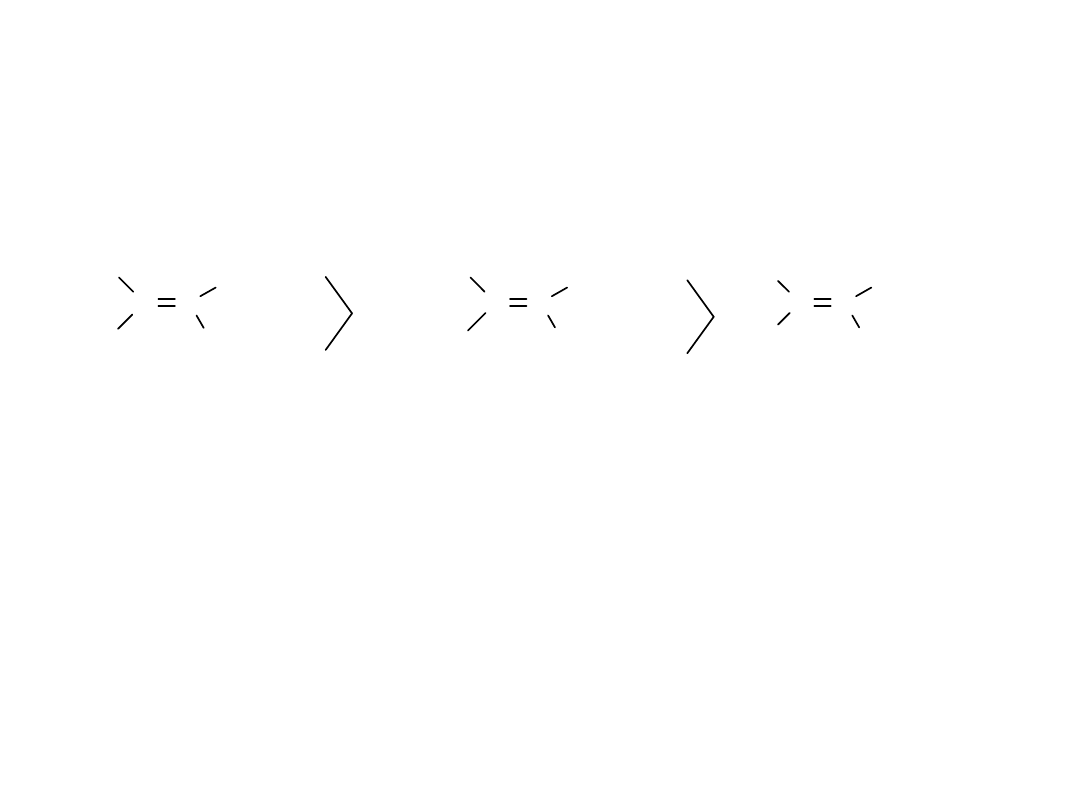
Alken jest tym trwalszy, im więcej grup alkilowych
znajduje się przy wiązaniu podwójnym
C C
CH
3
CH
3
CH
3
CH
3
C C
CH
3
H
CH
3
CH
3
CH
2
C C
CH
2
CH
2
CH
3
H
H
H
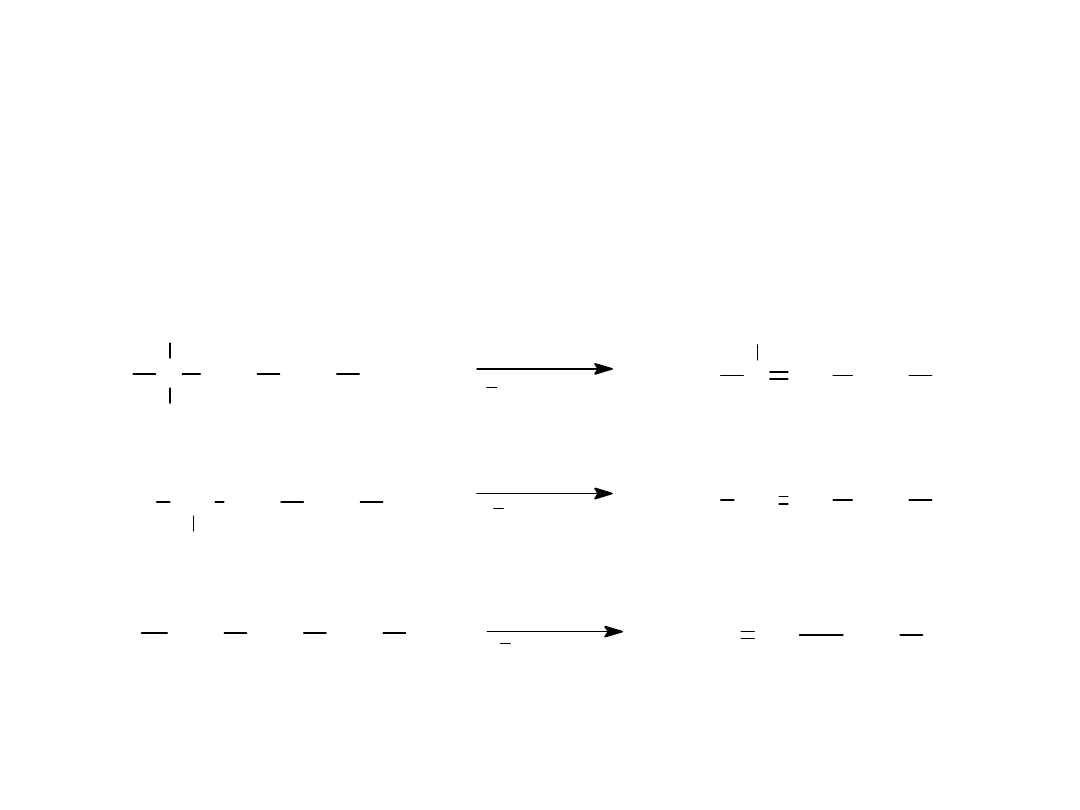
Metody otrzymywania
1.
z fluorowcopochodnych
CH
3
C
CH
3
CH CH
2
CH
3
NaOH/EtOH
CH
3
C
CH
3
Cl
CH
2
CH
2
CH
3
CH
3
CH
Cl
CH
2
CH
2
CH
3
NaOH/EtOH
CH
3
CH CH CH
2
CH
3
Cl CH
2
CH
2
CH
2
CH
3
NaOH/EtOH
CH
2
CH
CH
2
CH
3
HCl
HCl
HCl
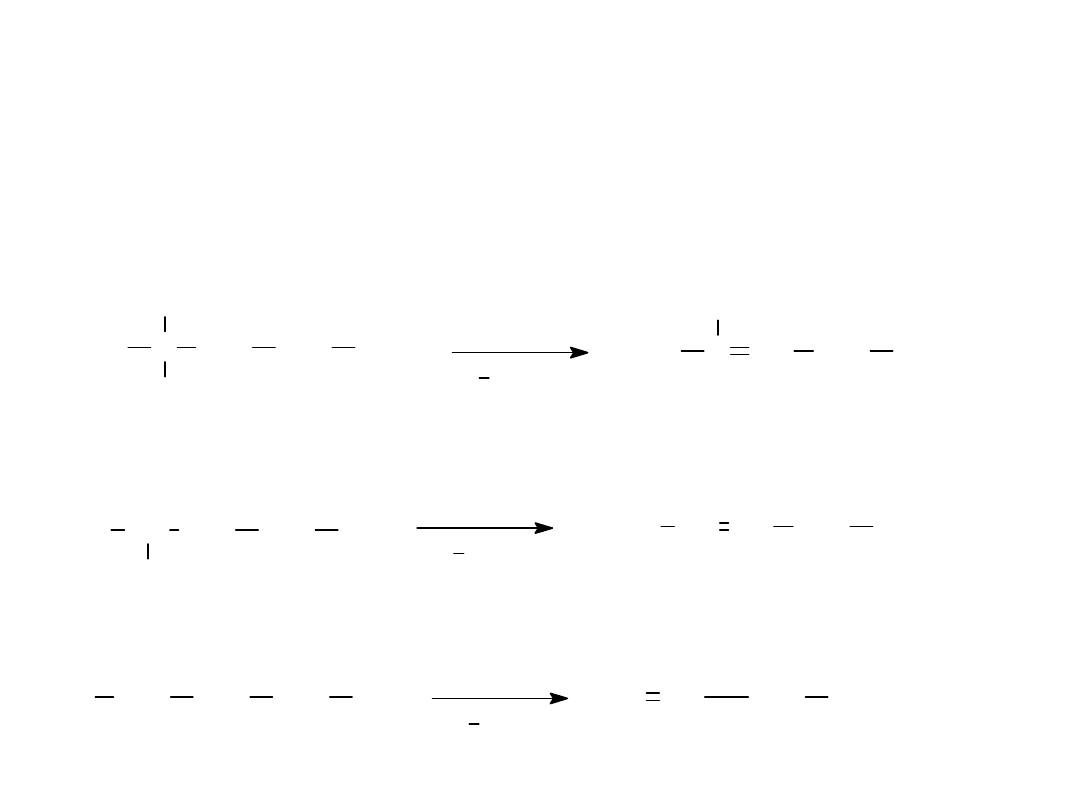
• 2. z alkoholi
CH
3
C
CH
3
OH
CH
2
CH
2
CH
3
H
2
SO
4
Al
2
O
3
P
2
O
5
H
2
O
CH
3
C
CH
3
CH CH
2
CH
3
HO CH
2
CH
2
CH
2
CH
3
CH
3
CH
OH
CH
2
CH
2
CH
3
H
2
O
H
2
SO
4
Al
2
O
3
P
2
O
5
CH
2
CH
CH
2
CH
3
CH
3
CH CH CH
2
CH
3
H
2
SO
4
Al
2
O
3
P
2
O
5
H
2
O
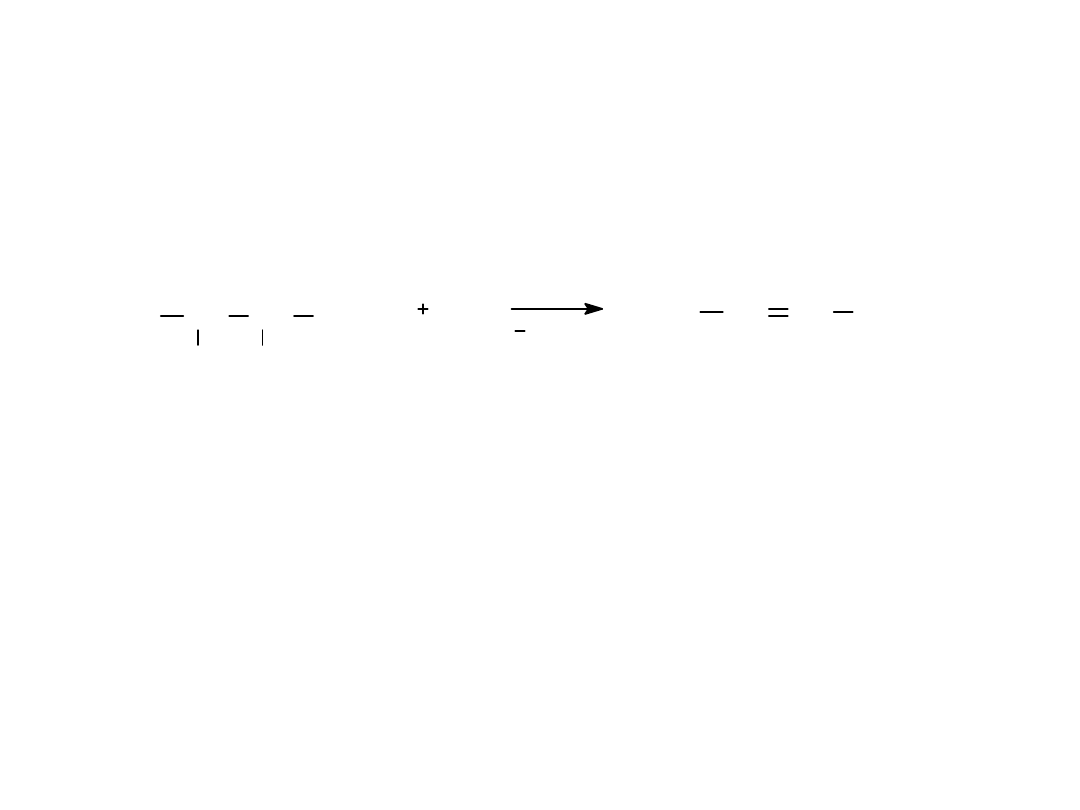
• 3. z difluorowcopochodnych wicinalnych
CH
3
CH CH
Cl
Cl
CH
3
Zn
ZnCl
2
CH
3
CH CH CH
3
Właściwości
1.Reakcje addycji elektrofilowej
CH
3
CH CH
2
Br
2
CH
3
CH CH
2
Br
Br
-
CH
3
CH CH
2
Br
Br
CH
3
CH CH
2
HBr
CH
3
CH CH
3
CH
3
CH CH
3
Br
Br
-
CH
3
CH
2
CH
2
Br
HBr
CH
3
CH CH
2
ROOR
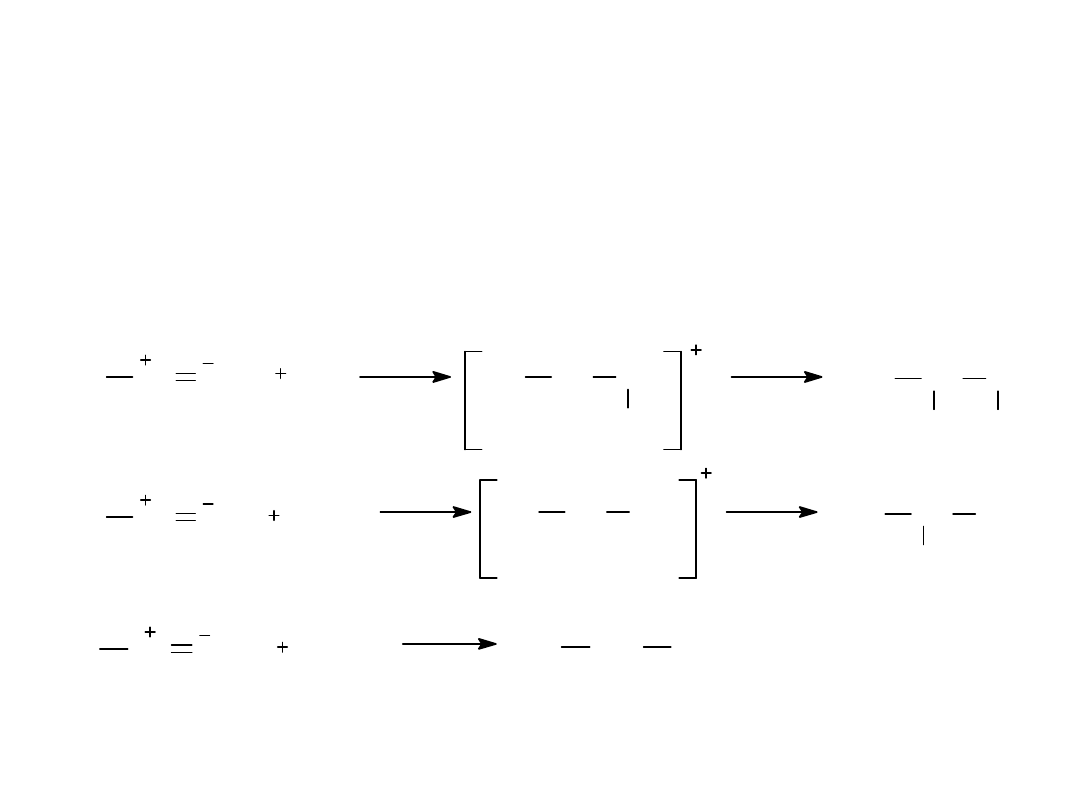
Tworzenie halogenohydryn
C C
X
2
H
2
O
C C
OH
X
X = Br, Cl
C C
H
CH
3
OH H
CH
3
Cl
H
2
O
C C
H
CH
3
H
CH
3
Cl
2
(HOCl)
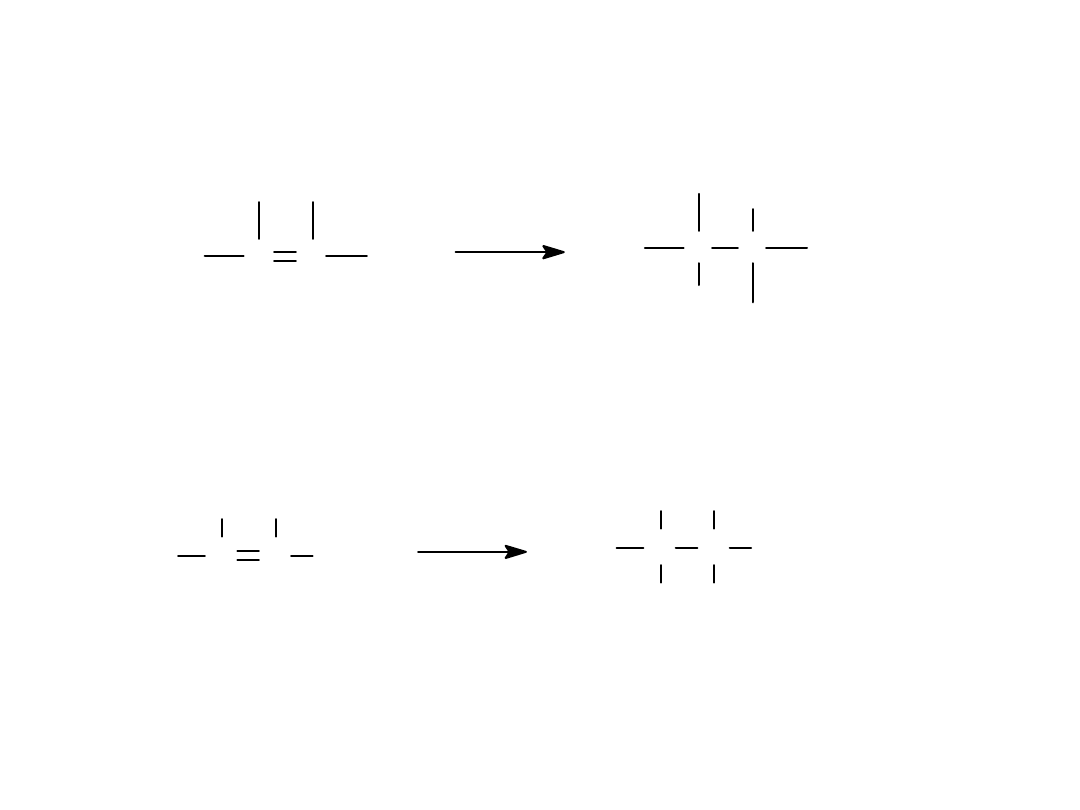
C C
H
C C
H
X
C C
X H
CH
2
CH CH
3
CH
3
CH CH
3
CH
2
CH
2
CH
3
Br
Br
CH
3
CH CH
3
Br
CH
2
CH
2
CH
3
Br
CH
3
C
CH
3
CH
3
H C
CH
3
CH
3
H C
CH
3
H
H C
H
H
>
>
>
2. reakcje utleniania
CH
3
CH
2
CH CHCH
3
KMnO
4
CH
3
CH
2
CH
OH
CH CH
3
OH
H
+
CH
3
CH
2
C
O
OH
CH
3
C
O
OH
CH
3
CH
2
CH C CH
3
CH
3
CH
3
CH
2
CH
OH
C
CH
3
OH
CH
3
KMnO
4
H
+
CH
3
CH
2
C
O
OH
CH
3
C CH
3
O
Reakcje ozonolizy
CH
3
CH
2
CH CHCH
3
O
3
CH
3
CH
2
O
CH
O
CH
O
CH
3
Zn, H
2
O
H
+
CH
3
CH
2
C
O
H
C
O
H
CH
3
C
O
CH
3
CH
3
CH
3
CH
2
C
O
H
H
+
Zn, H
2
O
O
CH
O
C
O
CH
3
CH
3
CH
3
CH
2
O
3
CH
3
CH
2
CH C
CH
3
CH
3

Dieny
układ skumulowany
CH
2
C CH
2
propadien
układ sprzężony
CH
2
CH CH CH
2
buta-1,3-dien
układ izolowany
CH
2
CH CH
2
CH
2
CH CH
2
heksa-1,5-dien
Otrzymywanie
CH
2
CH
CH
2
Br
Br
Br
alk.KOH
CH
2
C
Br
Br
CH
2
Zn
HBr
ZnBr
2
CH
2
C
CH
2
2 CH
3
CH
2
OH
Al
2
O
3
600
0
C
CH
2
CH CH CH
2
CH
2
CH CH CH
2
CH CH CH
2
CH
3
Br
H
CH CH CH
2
CH
3
CH CH
CH
3
CH
2
Br
CH CH CH
2
CH
3
Br
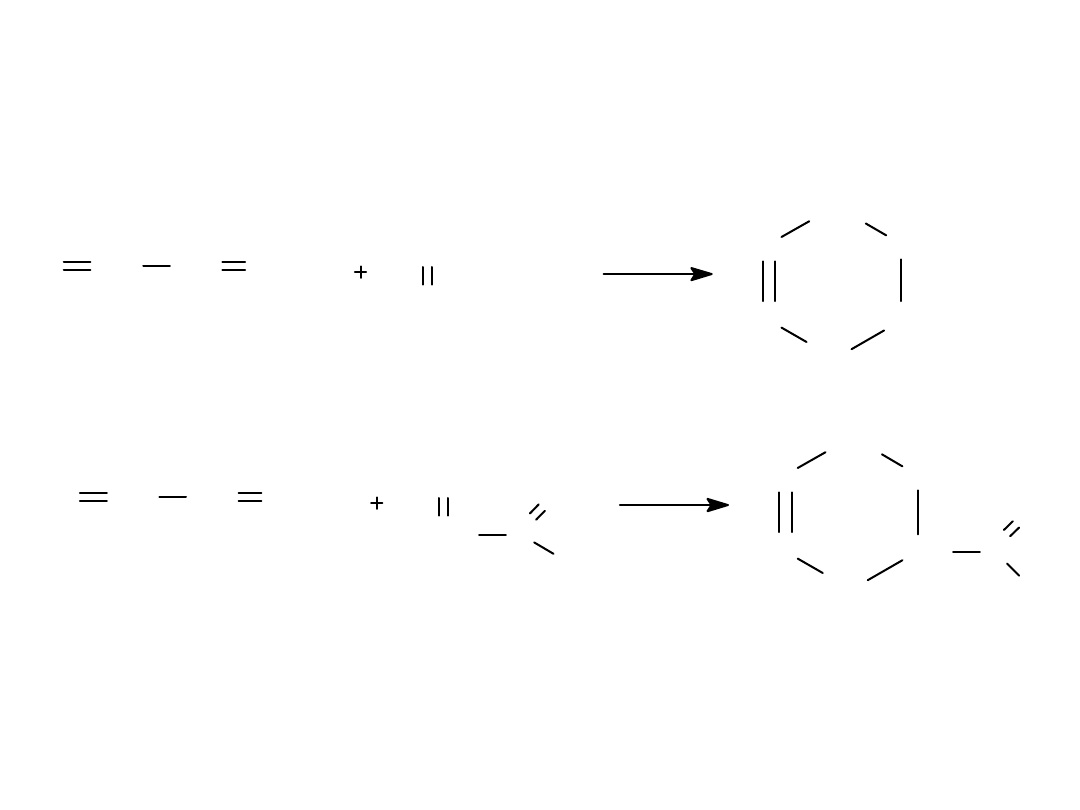
Reakcja Dielsa-Aldera
CH
2
CH CH CH
2
CH
2
CH C
O
H
CH
CH
CH
2
CH
CH
2
CH
2
C
O
H
CH
CH
CH
2
CH
2
CH
2
CH
2
CH
2
CH
2
CH
2
CH CH CH
2
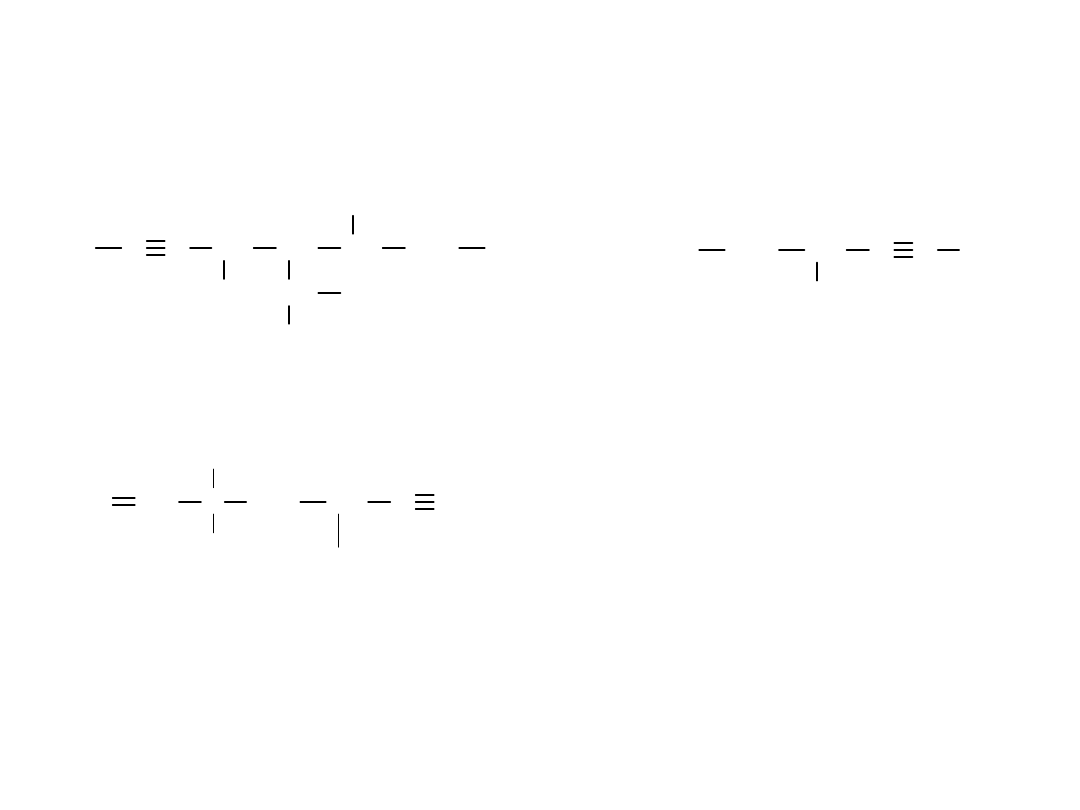
ALKINY
CH
3
C C CH
CH
3
CH
CH CH
3
CH
3
CH
CH
3
CH
2
CH
3
CH
3
CH
2
CH
CH
3
C C CH
3
5-izopropylo-4,6-dimetylo-okt-2-yn
1
2
3
4
5
6
7
8
1
2
3
4
5
6
4-metylo-heks-2-yn
CH
2
CH C
CH
3
CH
3
CH
2
CH C CH
C
2
H
5
5-etylo-3,3-dimetylo-hept-1-en-6-yn
1
2
3
4
5
6
7
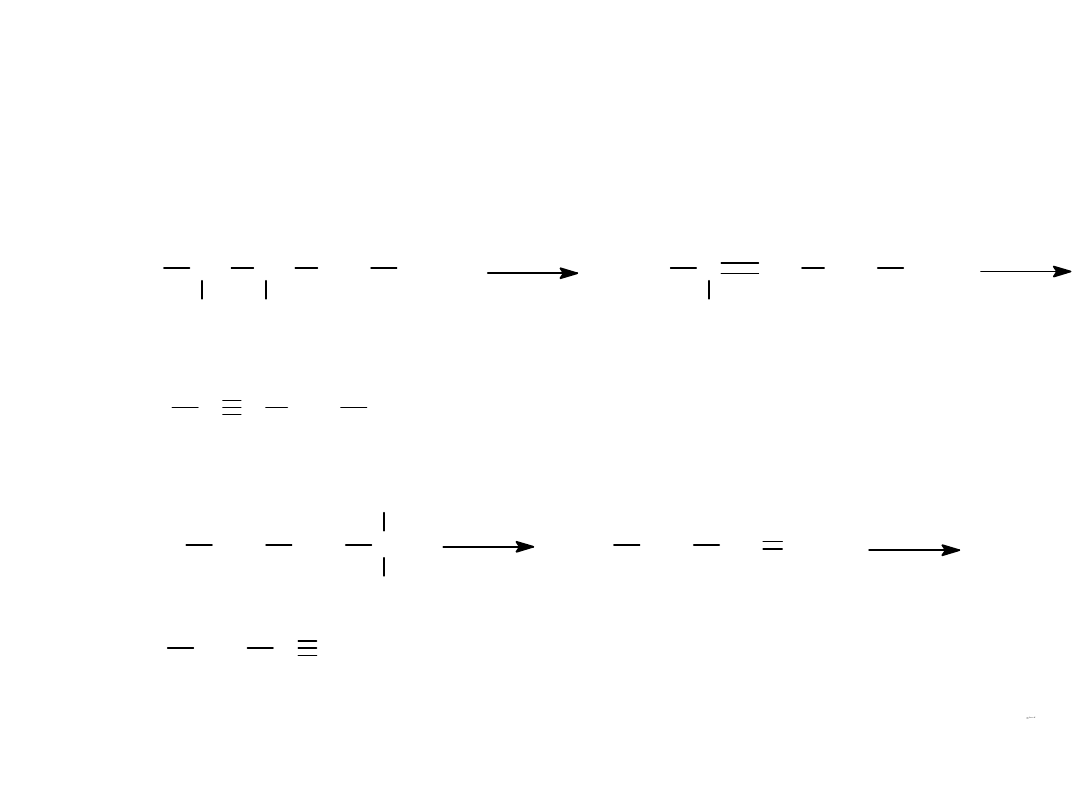
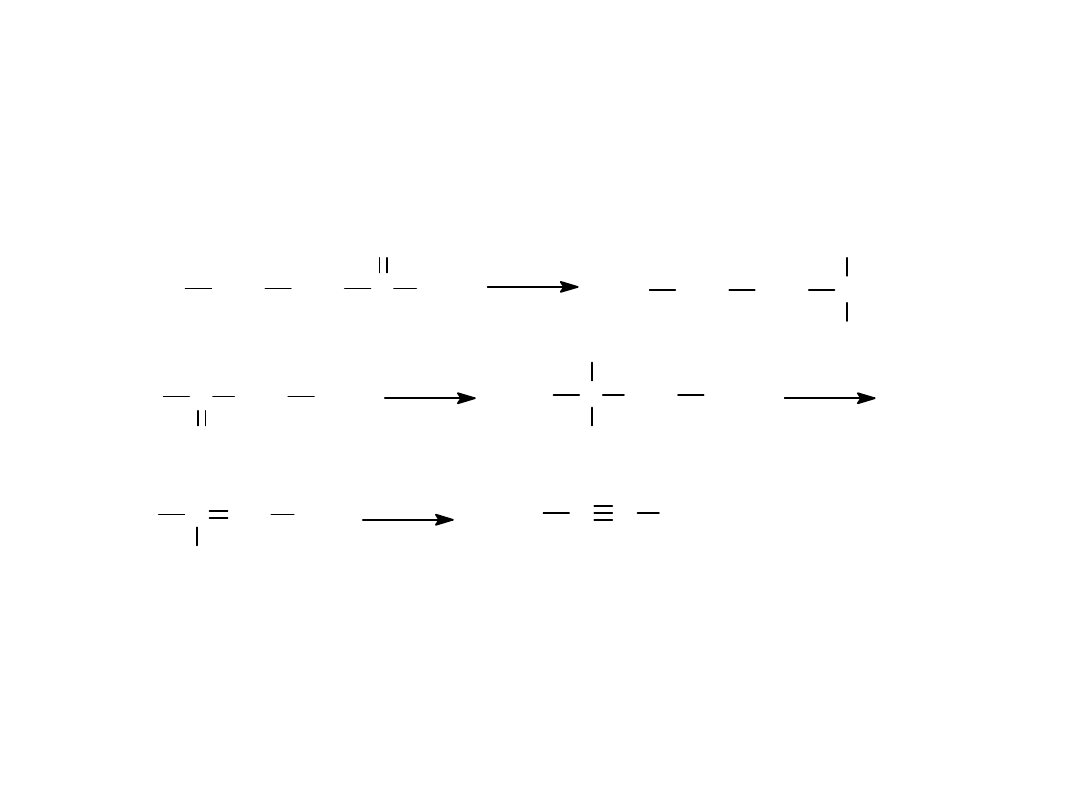
METODY OTRZYMYWANIA
1.
Z WICINALNYCH DIFLUOROWCOPOCHODNYCH
2.
Z GEMINALNYCH DIFLUOROWCOPOCHODNYCH
CH
3
CH CH
Br
Br
CH
2
CH
3
alk.KOH CH
3
C
CH
Br
CH
2
CH
3
alk.KOH
CH
3
C C CH
2
CH
3
C H
3
CH
2
C H
2
C H
B r
B r
al k.KO H C H
3
C H
2
CH C HBr al k.K OH
CH 3
CH2
C C H
CH
3
CH
2
CH
2
CH
Br
Br
alk.KOH CH
3
CH
2
CH CHBr alk.KOH
CH
3
CH
2
C CH
CH
3
CH
2
CH
2
C
O
H
PBr
3
PBr
5
CH
3
CH
2
CH
2
CH
Br
Br
CH
3
C
O
CH
2
CH
3
PBr
3
PBr
5
CH
3
C CH
2
CH
3
Br
Br
alk.KOH
CH
3
C CH
Br
CH
3
alk.KOH CH
3
C C CH
3
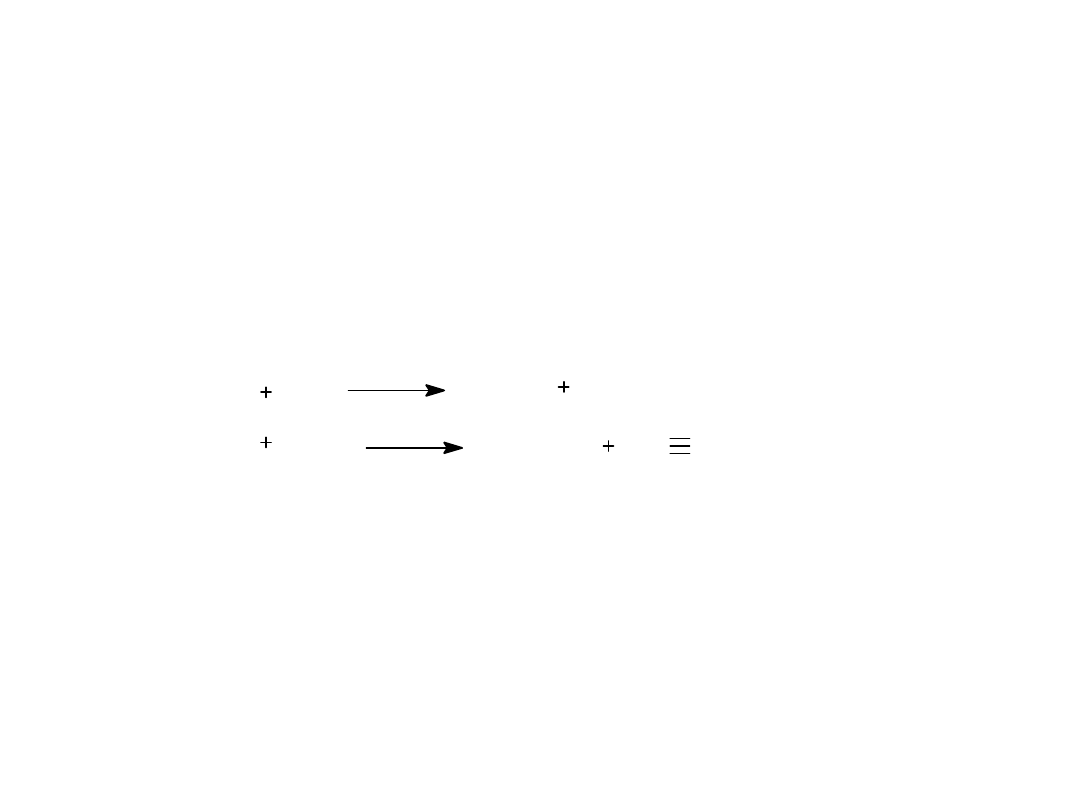
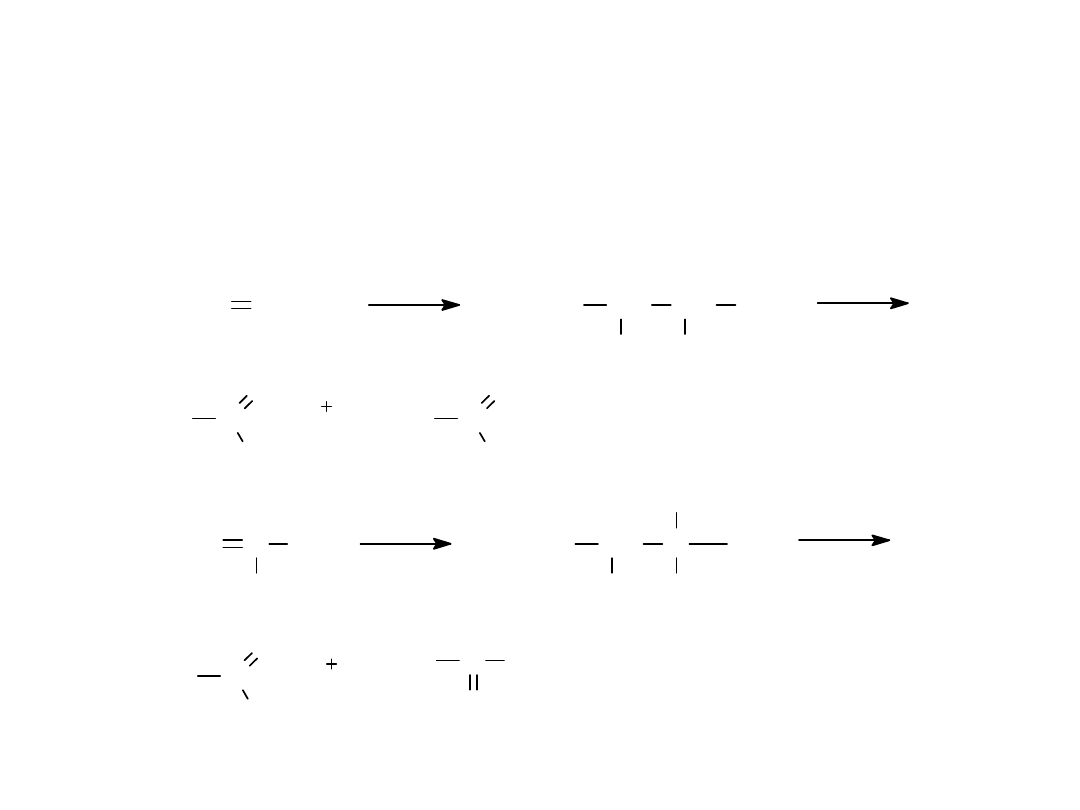
3.METODA PRZEMYSŁOWA OTRZYMYWANIA ACETYLENU
CaO
3C
CaC
2
CO
CaC
2
H
2
O
Ca(OH)
2
HC CH
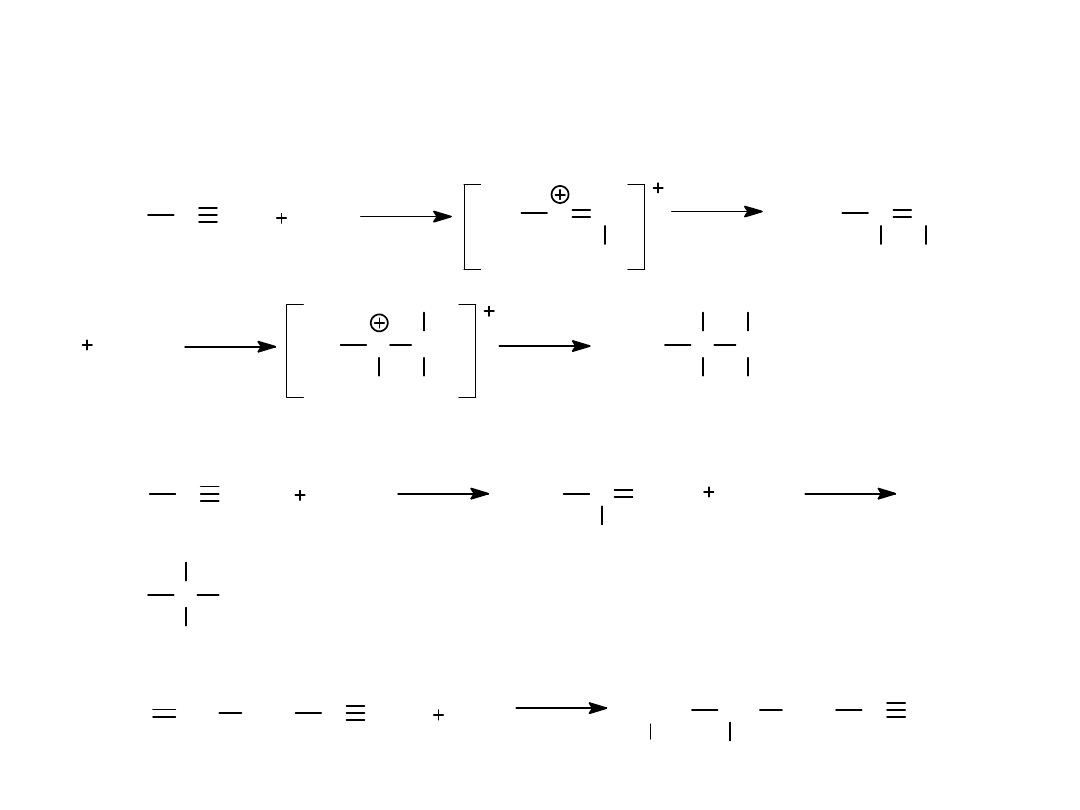
WŁAŚCIWOŚCI ALKINÓW
1. REAKCJE ADDYCJI ELEKTROFILOWEJ
CH
3
C CH
Cl
2
CH
3
C CH
Cl
CH
3
C CH
Cl
Cl
Cl
2
CH
3
C CH
Cl Cl
Cl
CH
3
C CH
Cl Cl
Cl
Cl
CH
3
C CH
HCl
CH
3
C CH
2
Cl
HCl
CH
3
C
Cl
Cl
CH
3
CH
2
CH CH
2
C CH
Cl
2
CH CH
2
C CH
CH
2
Cl
Cl
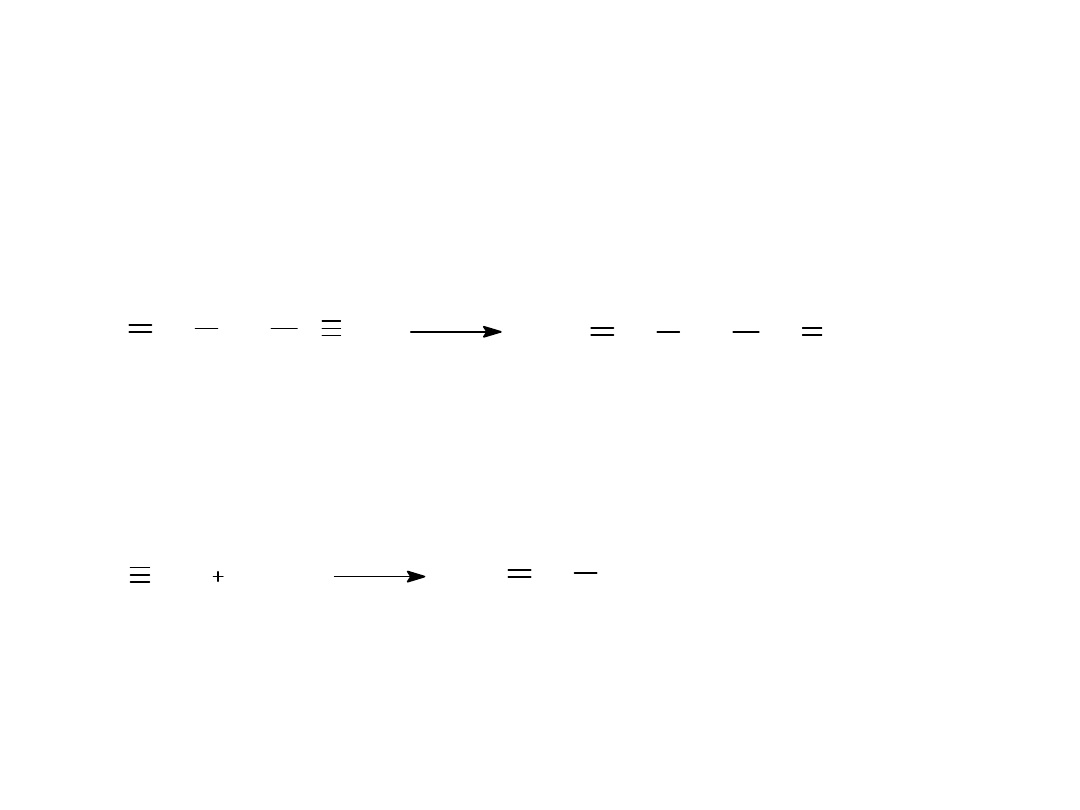
2.REDUKCJA
3.REAKCJE ADDYCJI NUKLEOFILOWEJ
CH
2
CH CH
2
C CH
kat.Lindlara
CH
2
CH CH
2
CH CH
2
CH CH
HCN
CH
2
CH CN
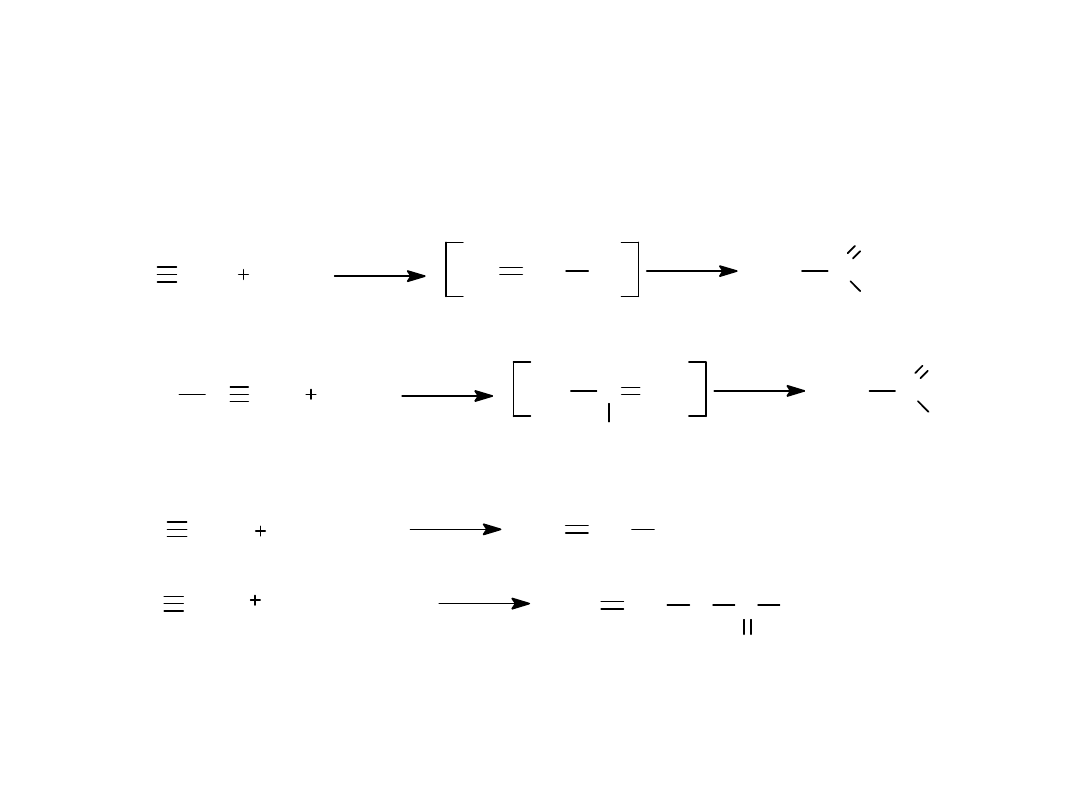
CH CH
H
2
O
CH
2
CH OH
HgSO
4
H
2
SO
4
CH
3
C
O
H
CH
3
C CH
CH
3
C
O
CH
3
H
2
SO
4
HgSO
4
H
2
O
CH
3
C
OH
CH
2
CH CH
CH
3
OH
CH
2
CH OCH
3
CH CH
CH
3
COOH
CH
2
CH O C CH
3
O
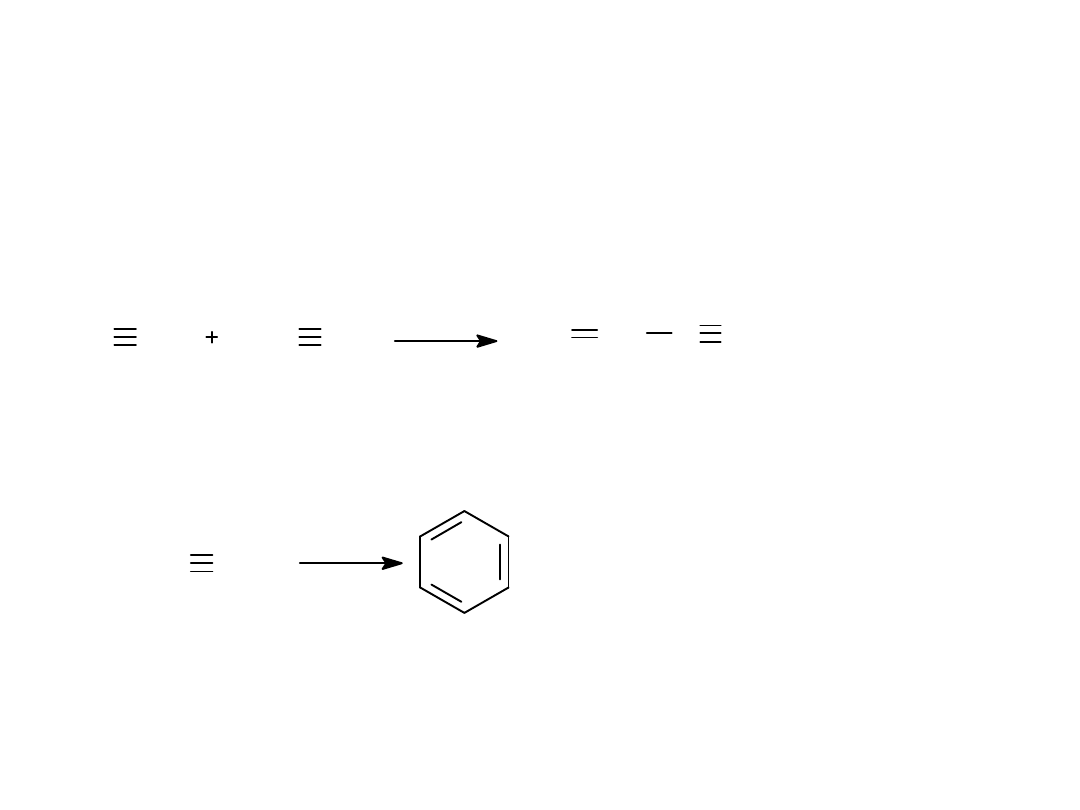
4. REAKCJA DIMERYZACJI ACETYLENU
5.REAKCJA TRIMERYZACJI ACETYLENU
CH CH
CH CH
CuCl
2
NH
4
Cl CH
2
CH C CH .
CH CH
3
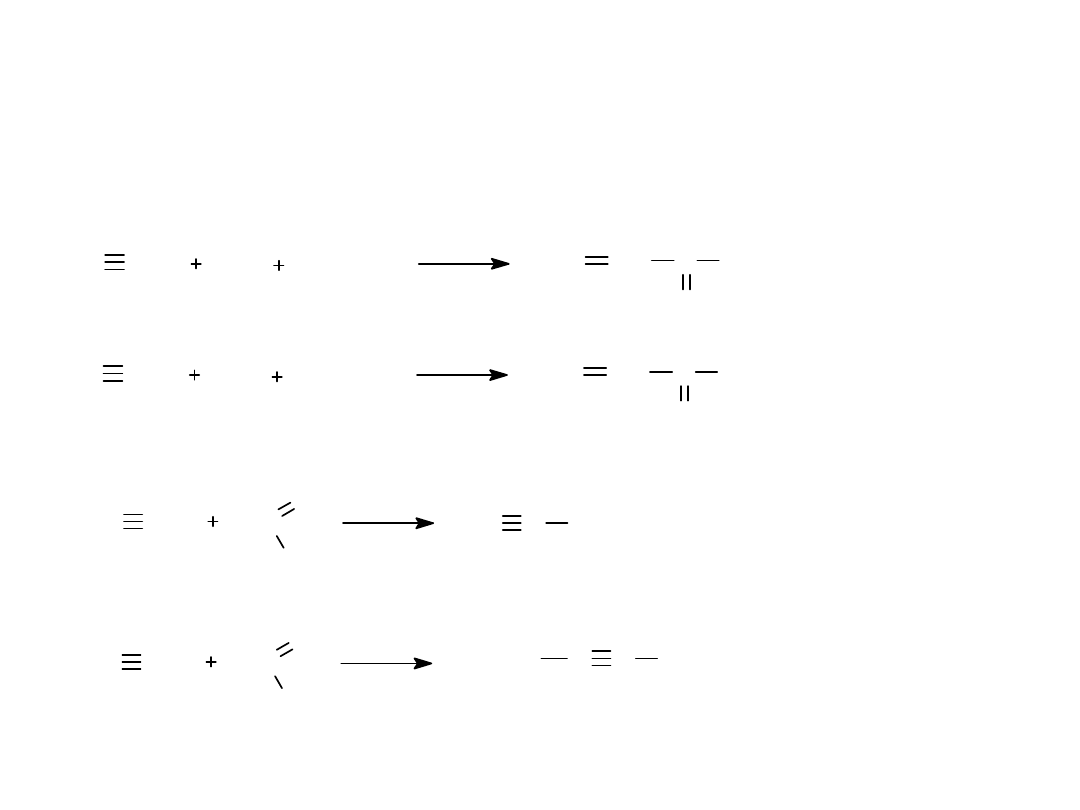
6.REAKCJE Z TLENKIEM WĘGLA
7.REAKCJE PODSTAWIENIA
CH CH
CO
CH
3
OH
Ni(CO)
4
CH
2
CH C
O
OCH
3
CH
2
CH C
O
OH
Ni(CO)
4
CO
CH CH
H
2
O
HC CH
HC
O
H
HC C CH
2
OH
C C CH
2
OH
HOCH
2
HC
O
H
HC CH
2
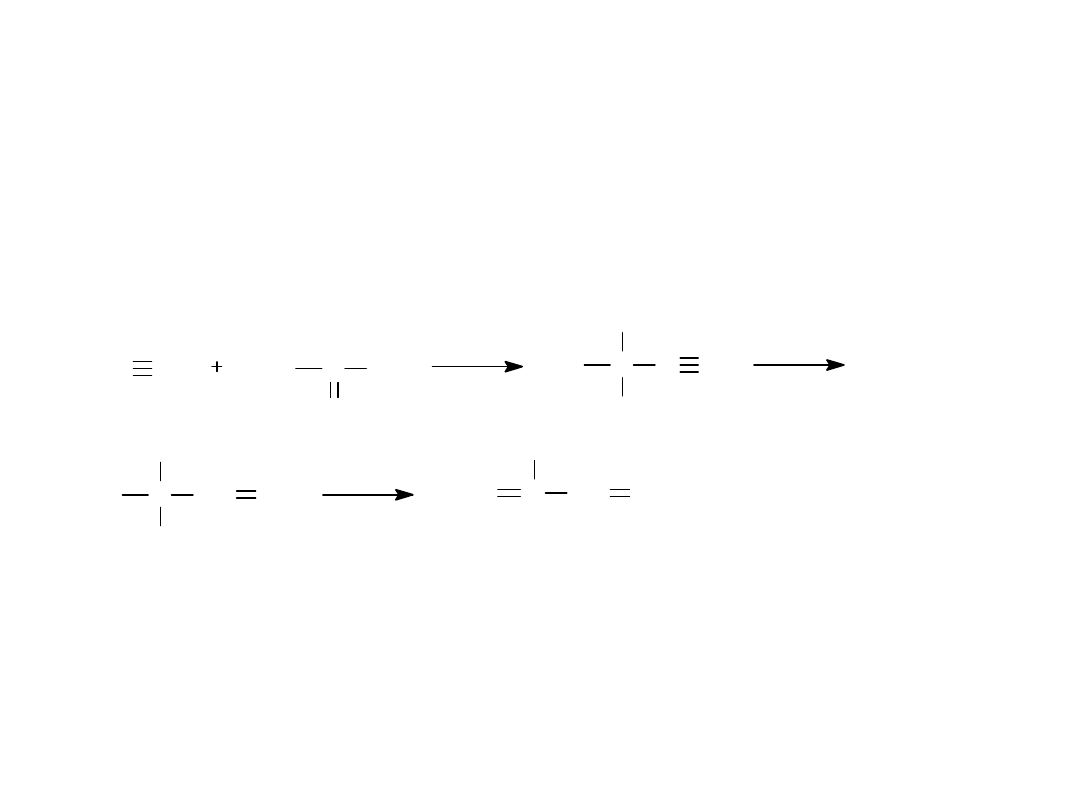
• SYNTEZA IZOPRENU
HC CH
CH
3
C
O
CH
3
OH
-
C C
CH
3
OH
CH
3
CH H
2
/Pd
CH
2
C
CH
3
CH CH
2
C
CH
3
OH
CH
CH
3
CH
2
Al
2
O
3
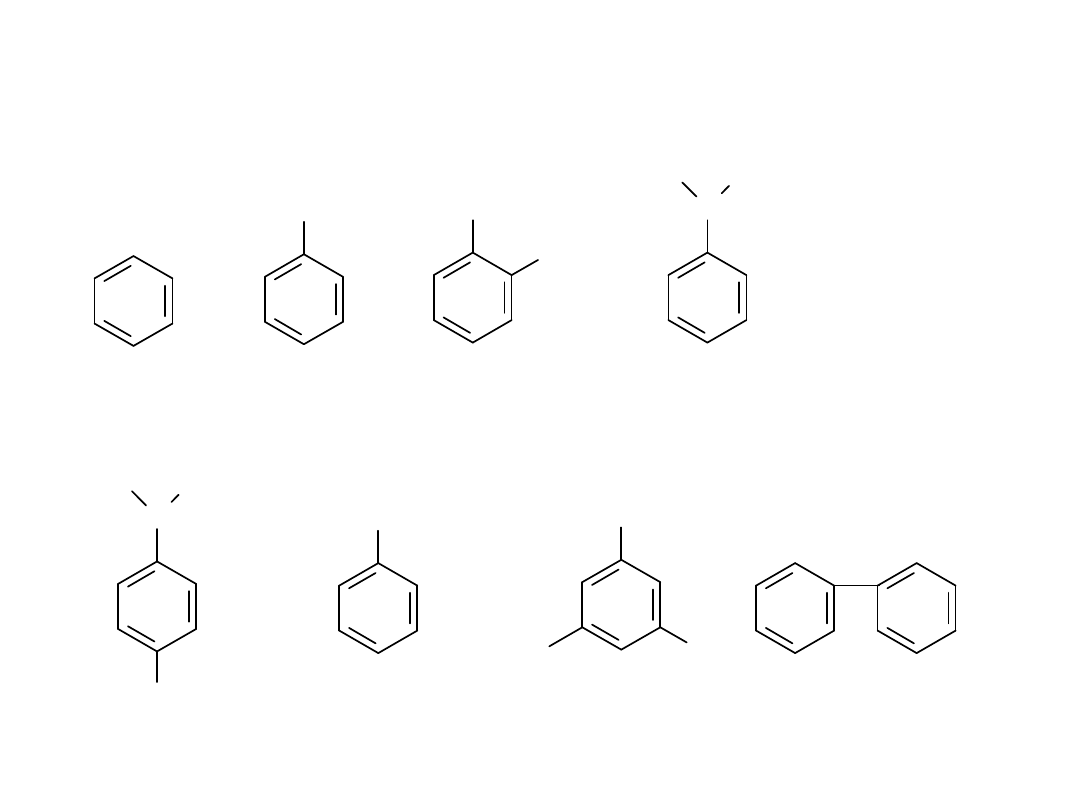
ARENY
CH
3
CH
3
CH
3
benzen toluen o-ksylen
(1,2-dimetylobenzen)
CH
CH
3
CH
3
CH
CH
3
CH
3
CH
3
CH=CH
2
p-cymen styren
CH
3
CH
3
CH
3
mezytylen bifenyl
kumen
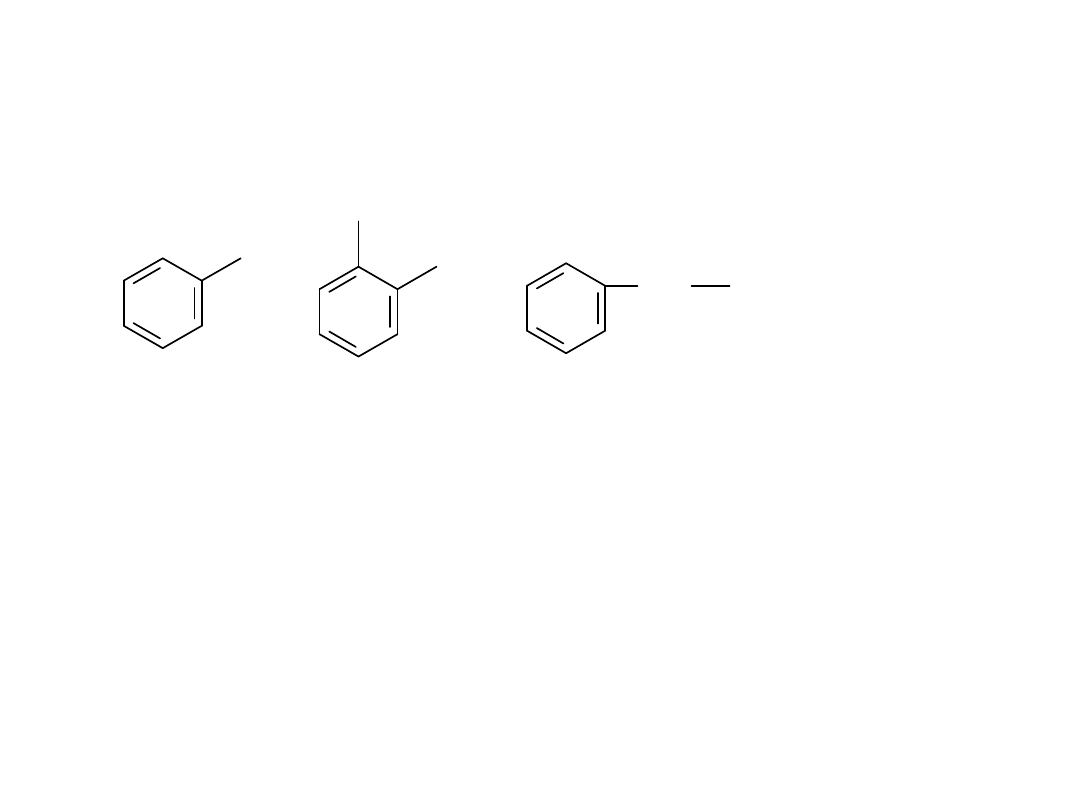
CH
2
CH
3
fenyl o-tolil benzyl
ksylen - rodnik ksylilowy
mezytylen - rodnik mezytylowy
kumen - rodnik kumenylowy
1
2
3
4
5
6
7
8
9
10
1
2
3
4
5
6
7
8
9
10
11
12
13
14
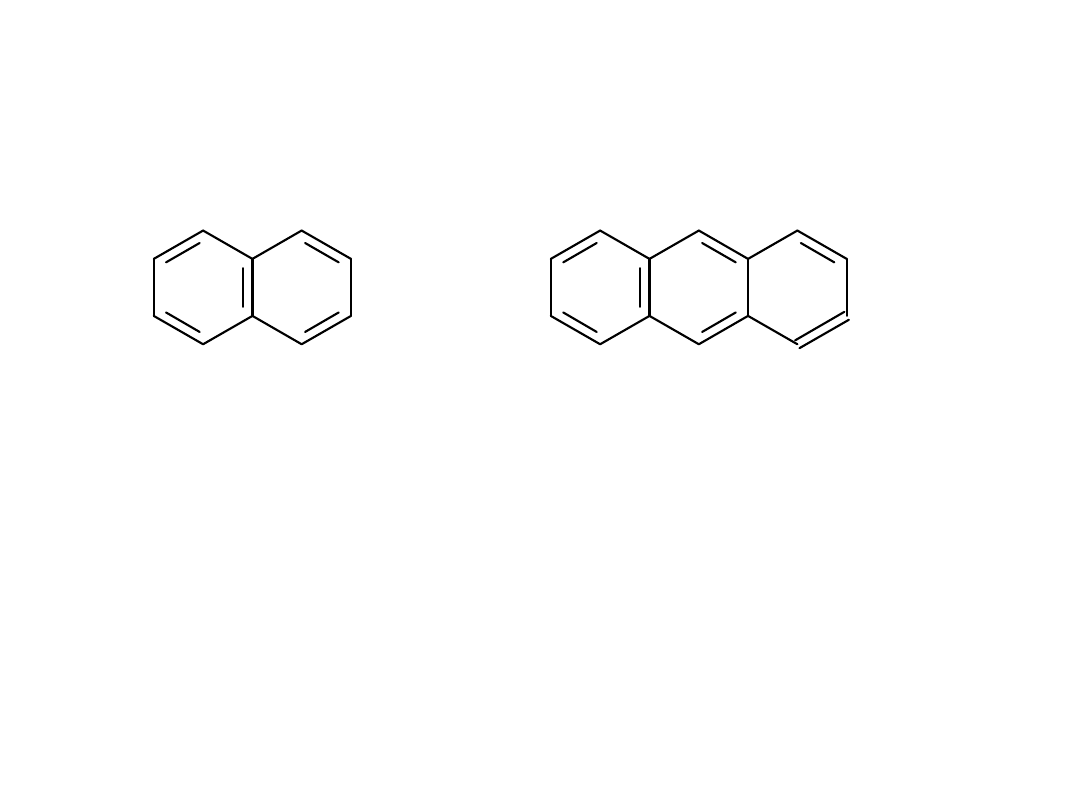
naftalen antracen
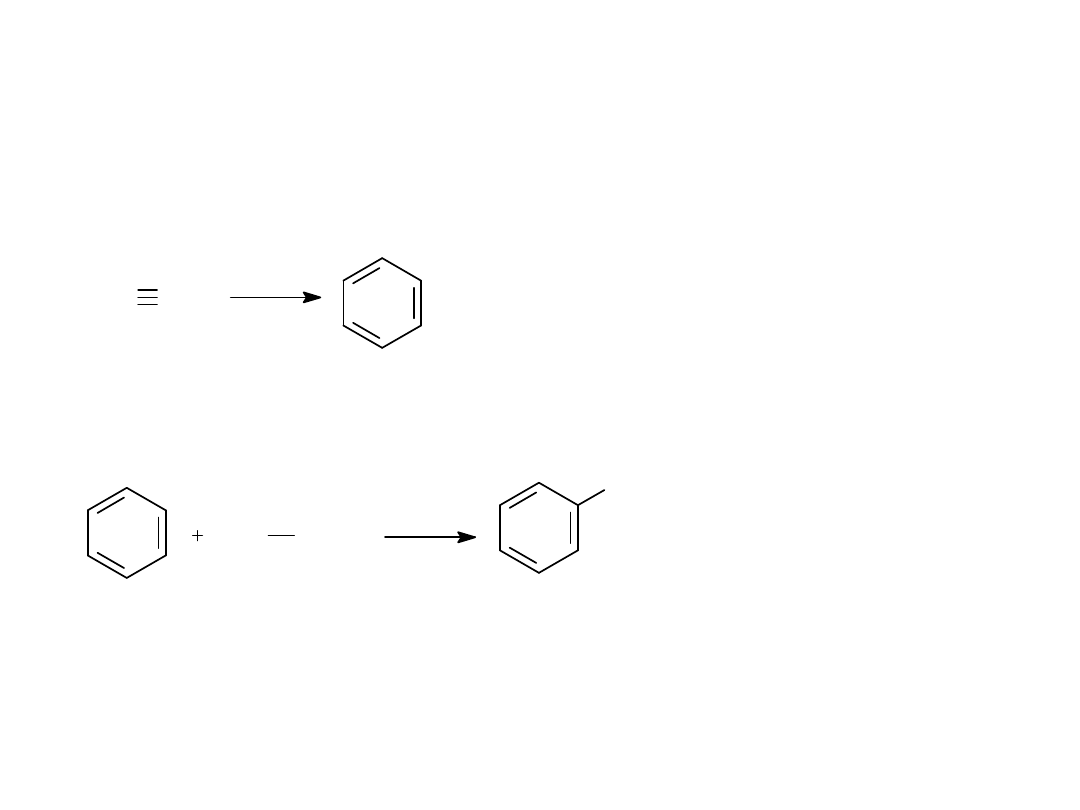
METODY OTRZYMYWANIA BENZENU I JEGO
POCHODNYCH
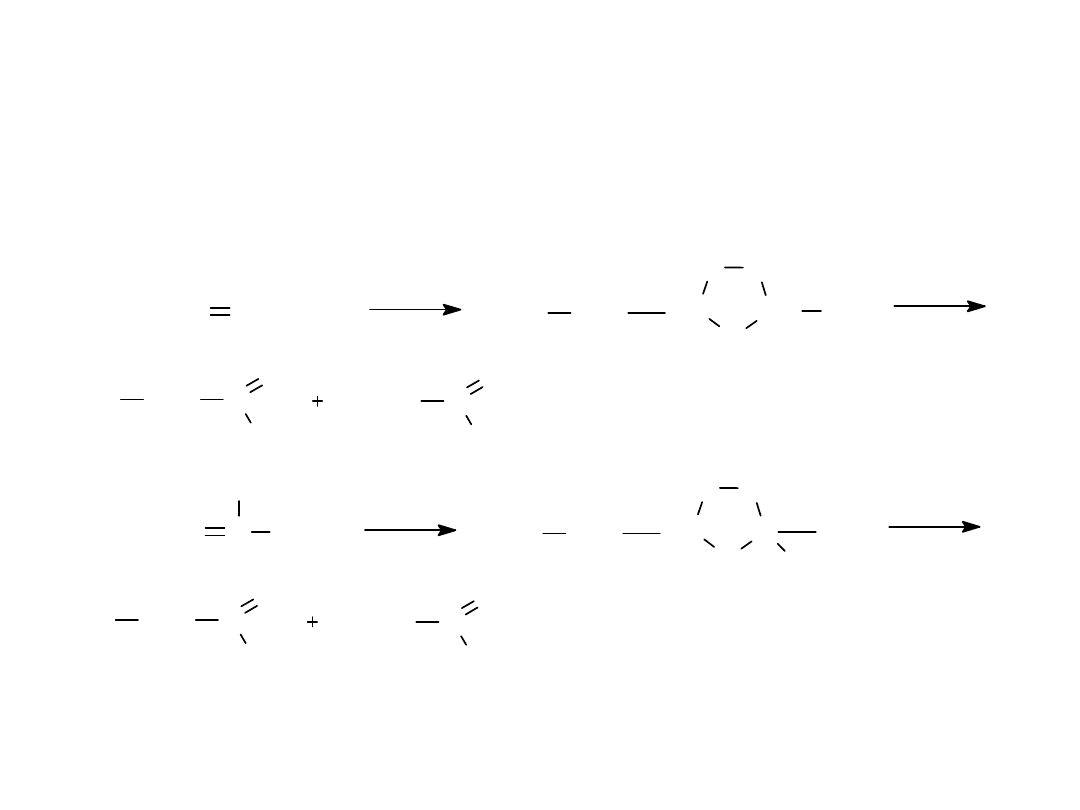
1.TRIMERYZACJA ACETYLENU
2. REAKCJA FRIDELA-CRAFTSA
CH CH
500
0
C
ciśn.
3
CH
3
CH
2
Cl
CH
2
CH
3
AlCl
3
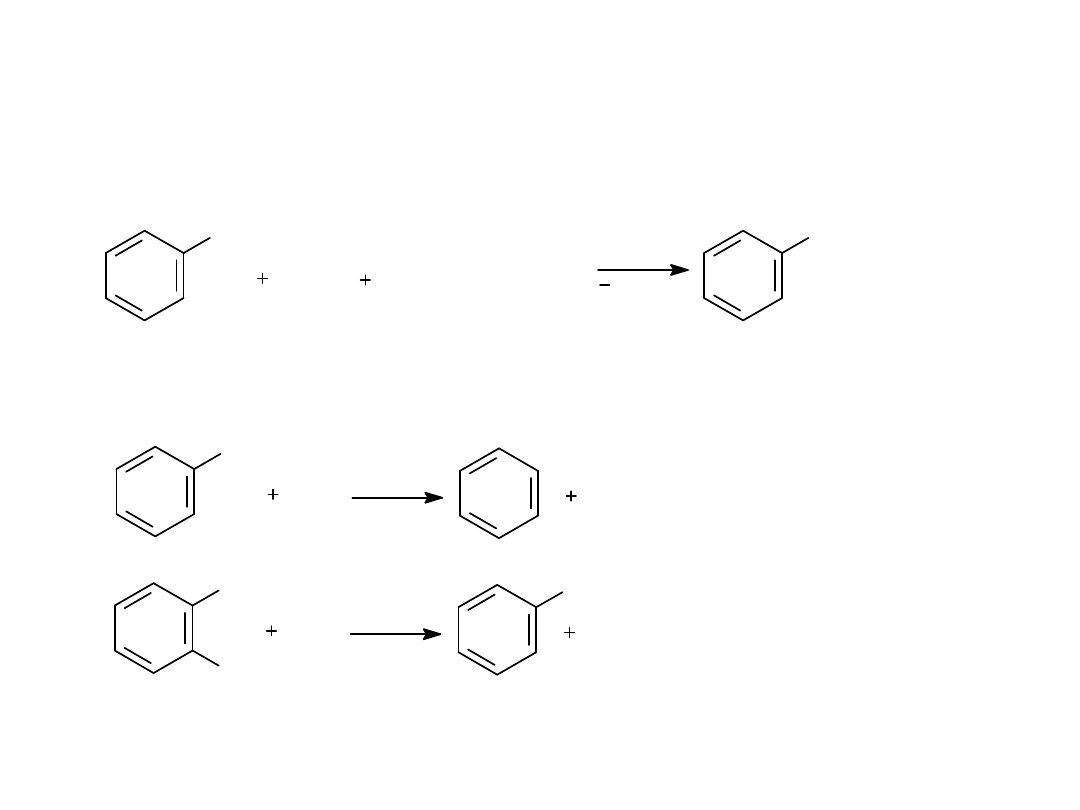
3. REAKCJA Würtza-Fittiga
4. DESTYLACJA FENOLI Z PYŁEM CYNKOWYM
Cl
Na
CH
3
CH
2
CH
2
Cl
CH
2
CH
2
CH
3
2
NaCl
2
OH
Zn
ZnO
ZnO
CH
3
Zn
OH
CH
3
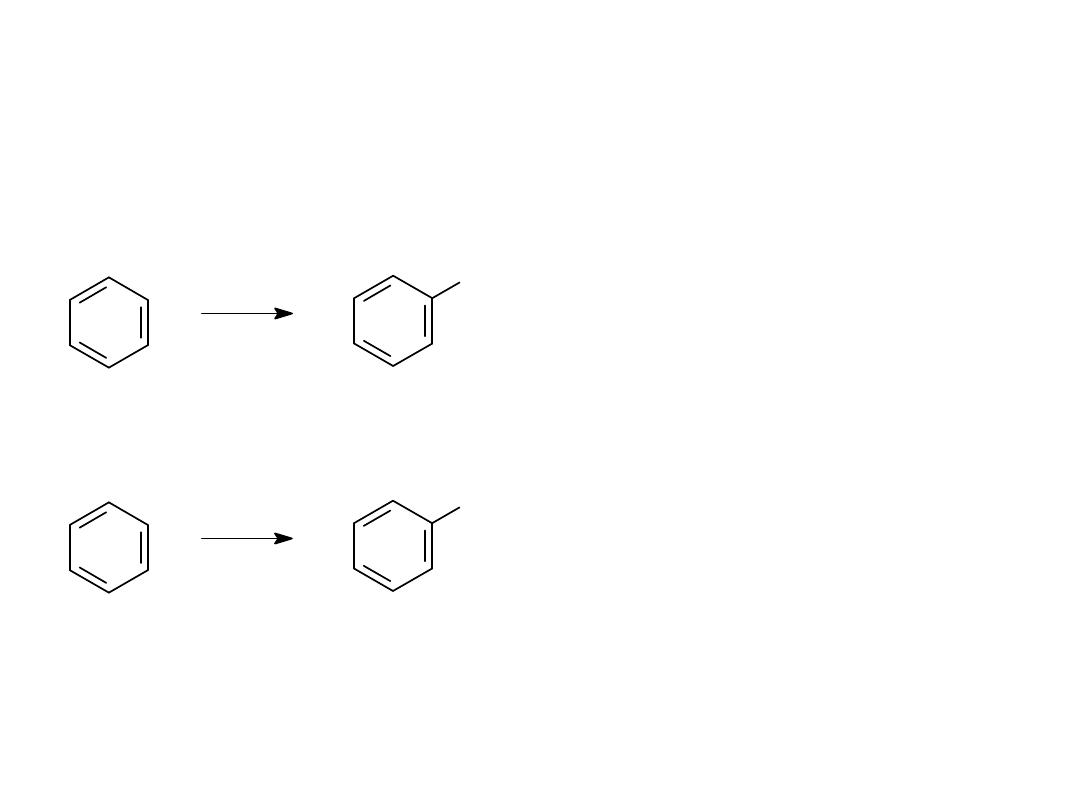
WŁAŚCIWOŚCI BENZENU I JEGO POCHODNYCH
1.REAKCJA NITROWANIA
2. REAKCJA SULFONOWANIA
HNO
3
stęż.
H
2
SO
4
NO
2
SO
3
H
H
2
SO
4
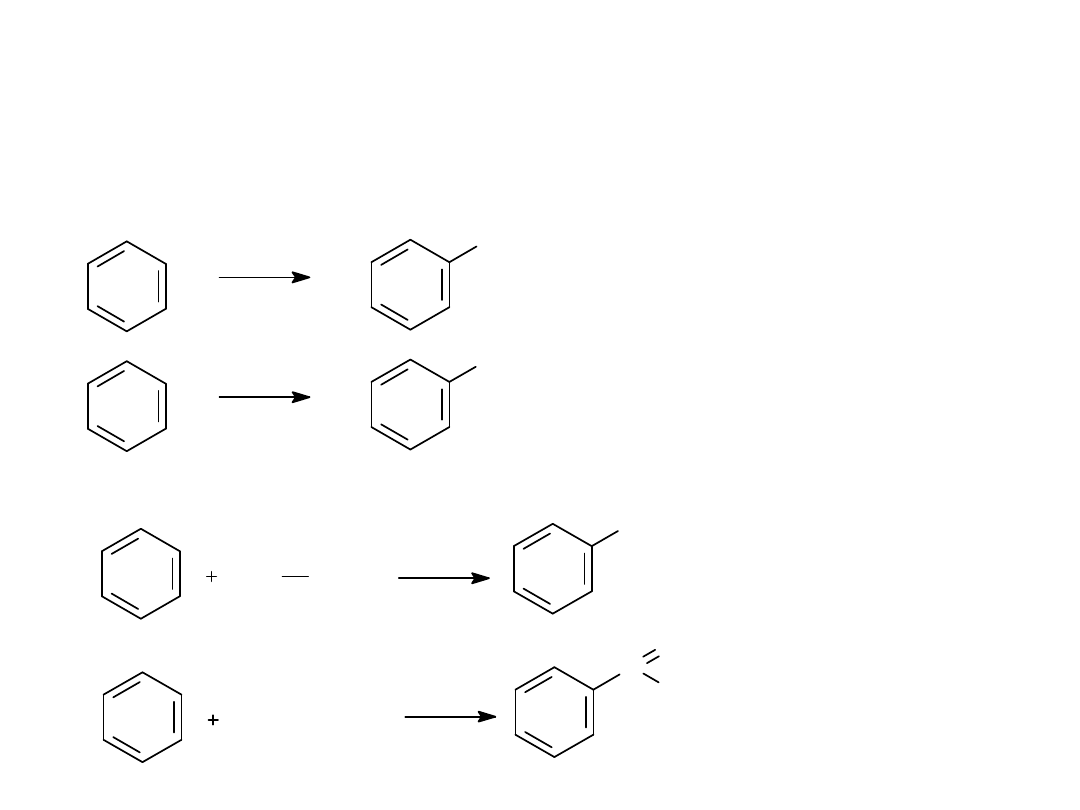
3. REAKCJE Z FLUOROWCOPOCHODNYMI
4. REAKCJE FRIEDELA-CRAFTSA
Br
Br
2
FeBr
3
Cl
Cl
2
FeCl
3
CH
3
CH
2
Cl
CH
2
CH
3
AlCl
3
AlCl
3
C
O
CH
3
CH
3
COCl
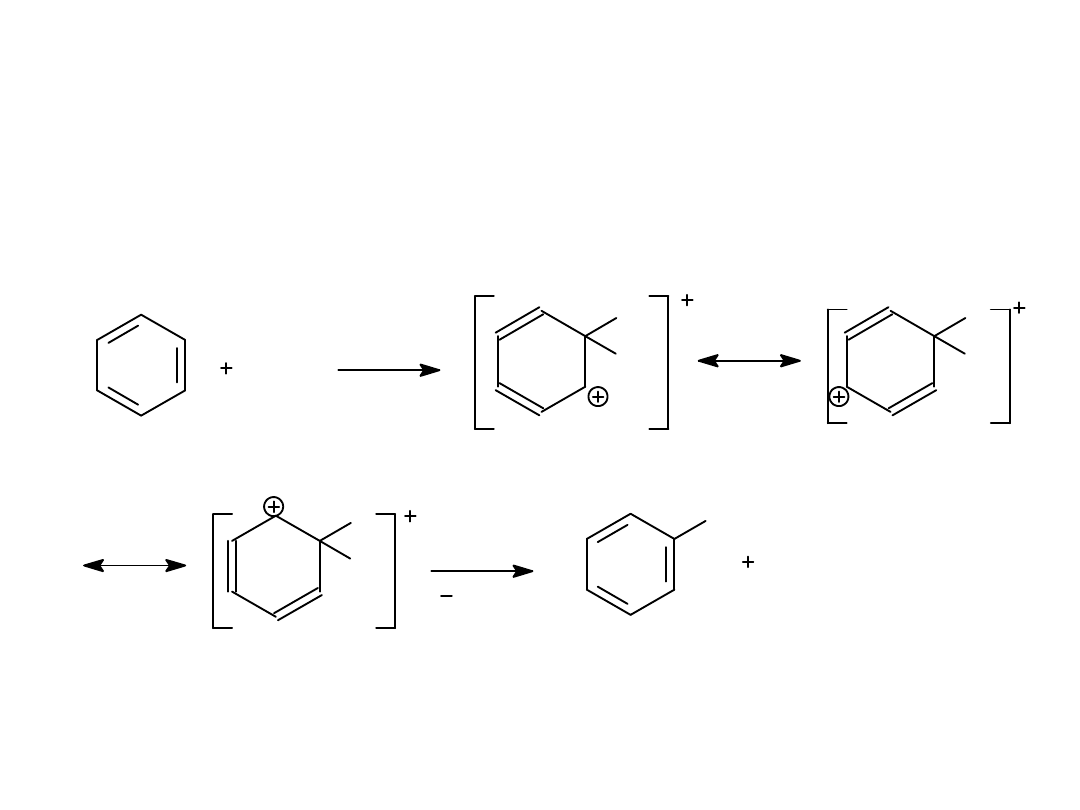
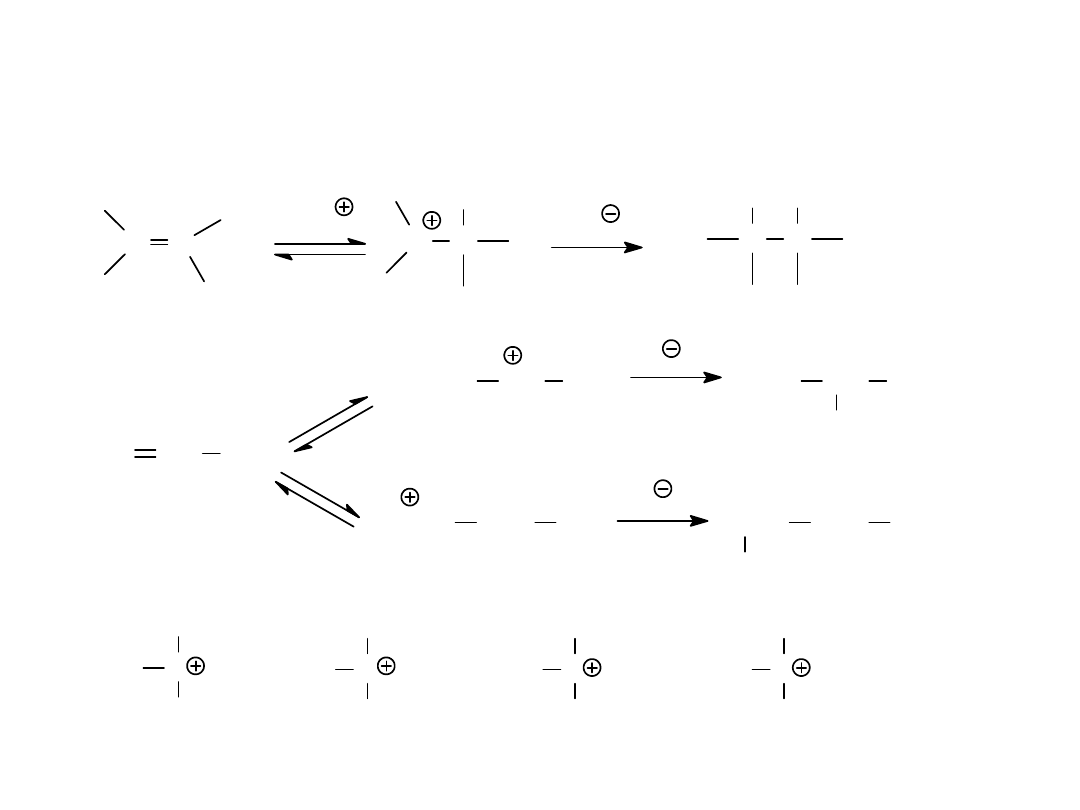
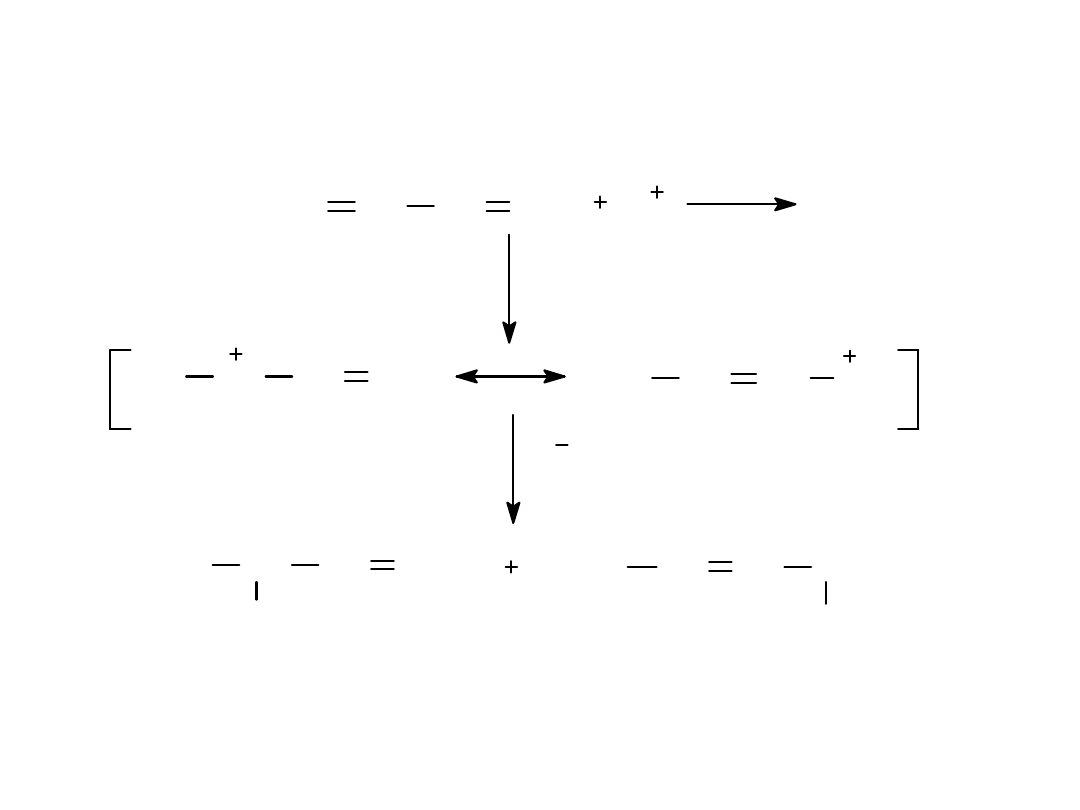
Mechanizm substytucji elektrofilowej w
benzenie
Y
Y
H
Y
H
Y
H
X
-
H
+
Y
HX
kompleks
+
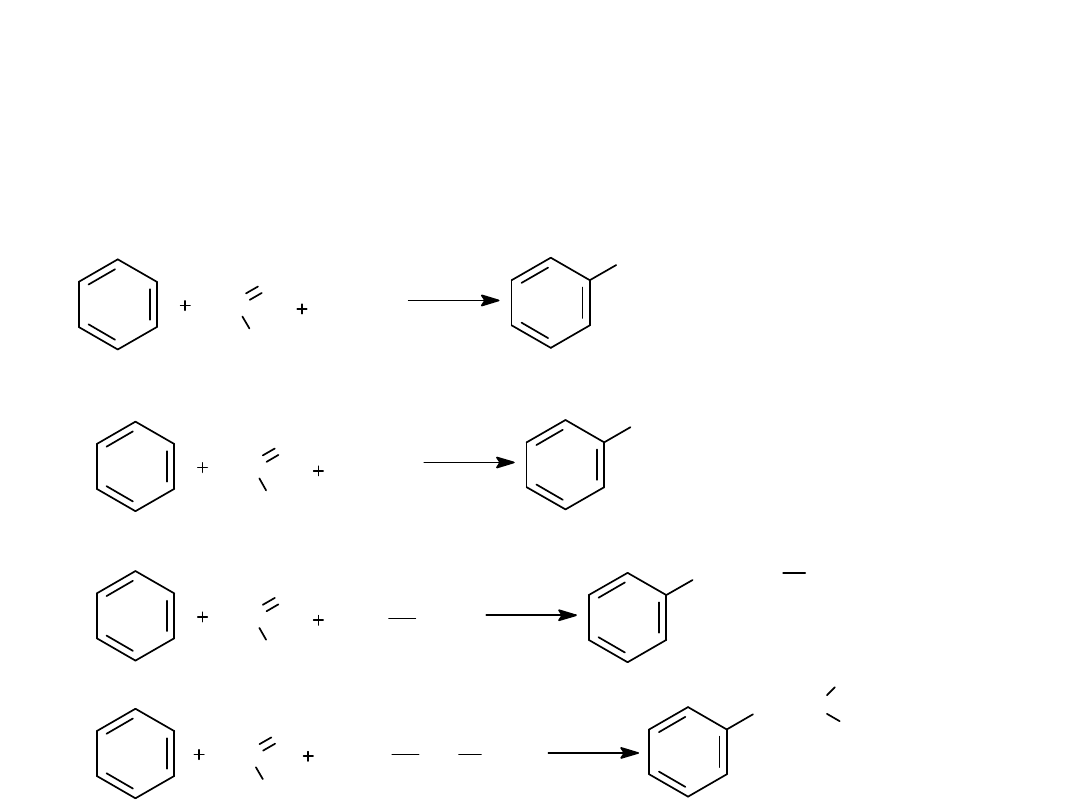
5. REAKCJA BLANCKA - CHLOROMETYLOWANIE
6. REAKCJA MANNICHA - AMINOMETYLOWANIE
CH
2
Cl
HC
O
H
HCl
ZnCl
2
HC
O
H
CH
2
NH
2
NH
3
ZnCl
2
ZnCl
2
CH
2
NH CH
3
HC
O
H
CH
3
NH
2
CH
3
NH CH
3
HC
O
H
CH
2
N
CH
3
CH
3
ZnCl
2
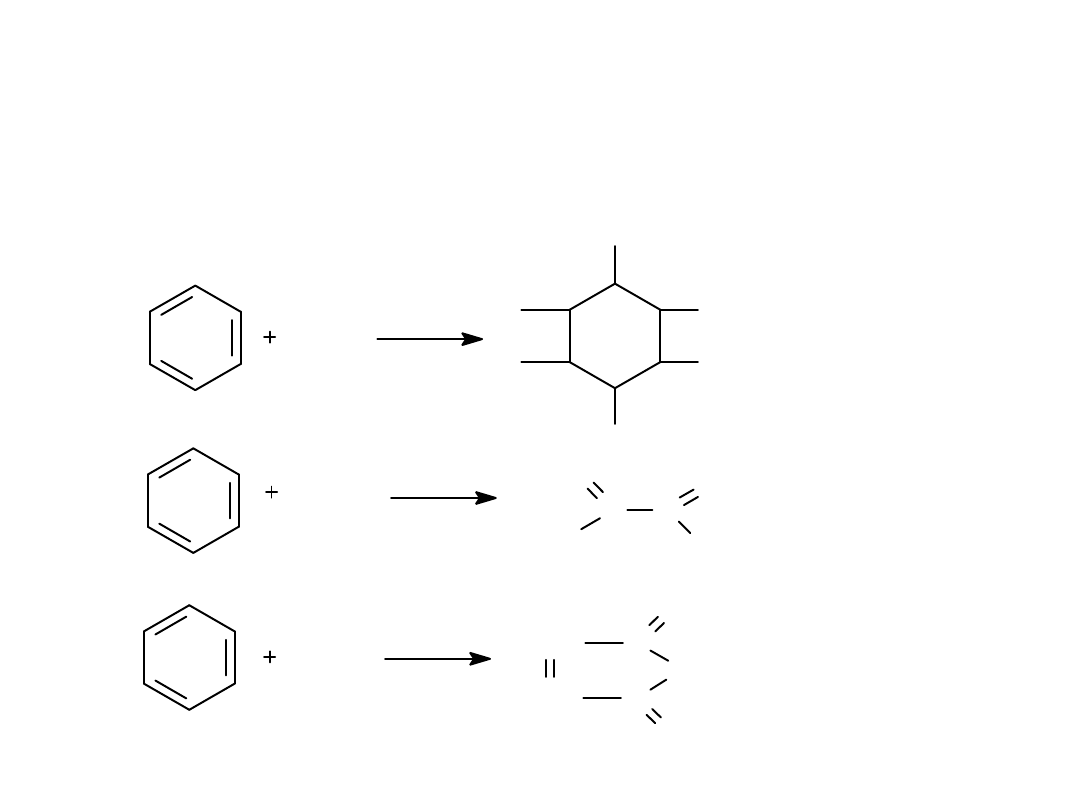
Cl
2
3
Cl
Cl
Cl
Cl
Cl
Cl
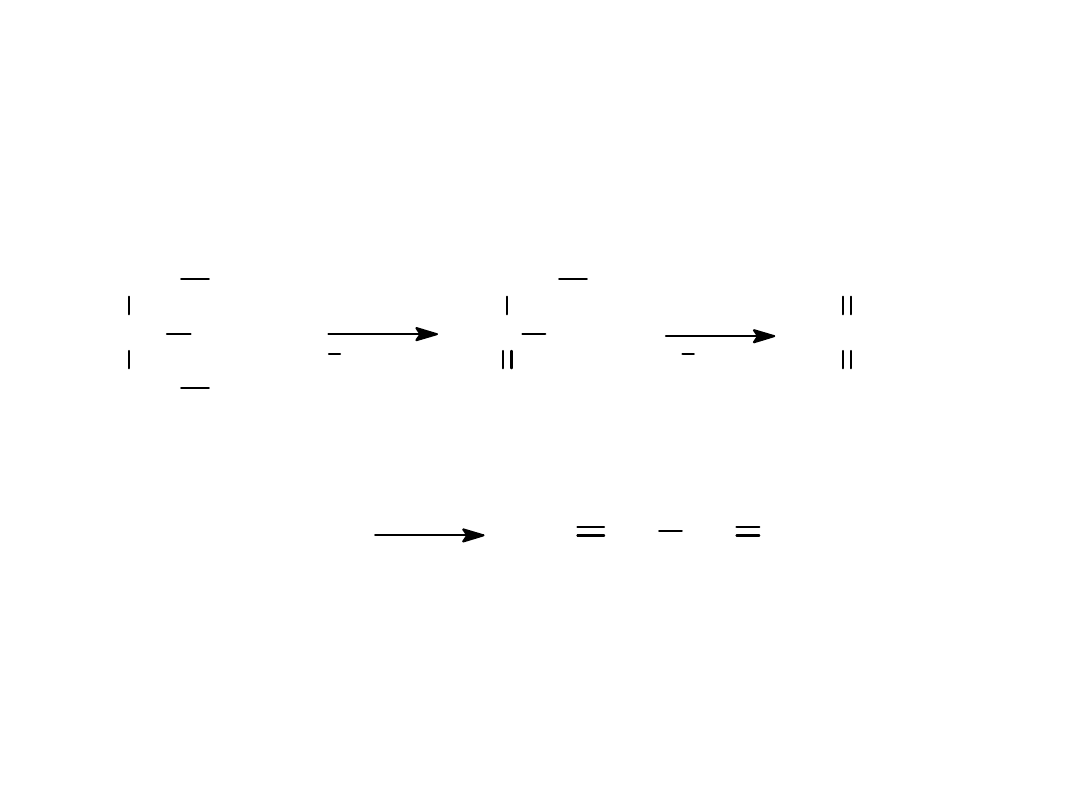
światło
3O
3
C C
O
H
O
H
3
O
2
V
2
O
5
CH
CH
C
C
O
O
O
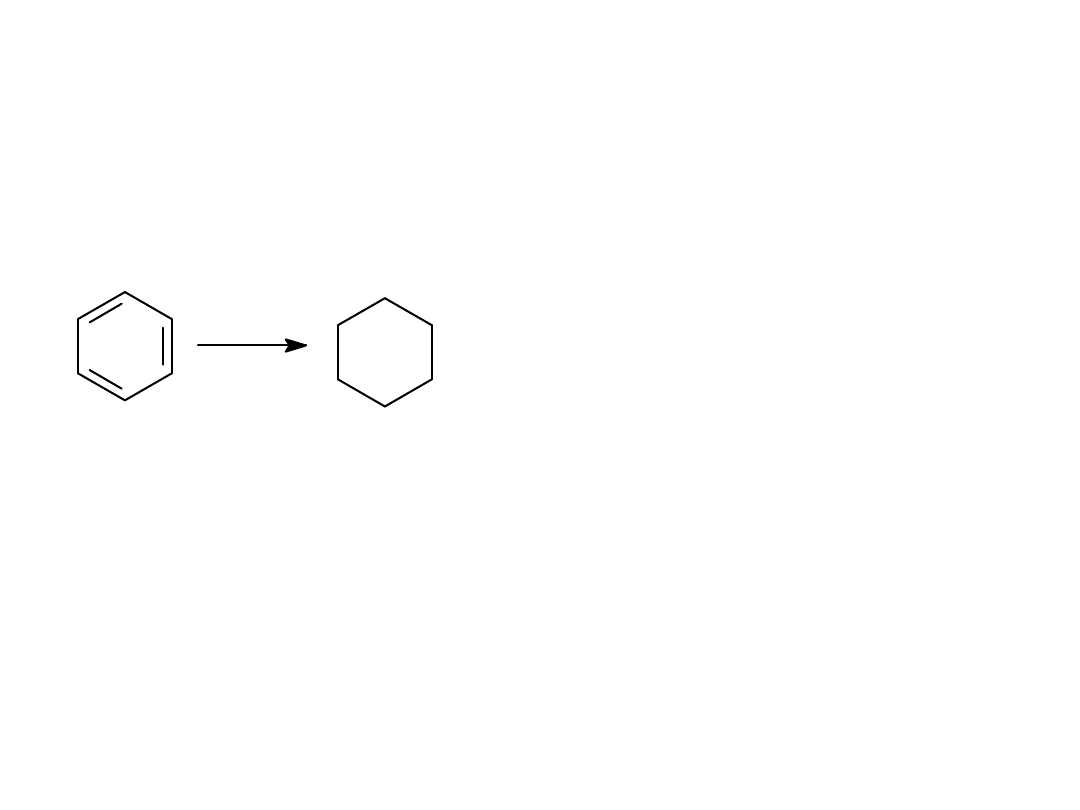
REAKCJE REDUKCJI
3H
2
/Ni
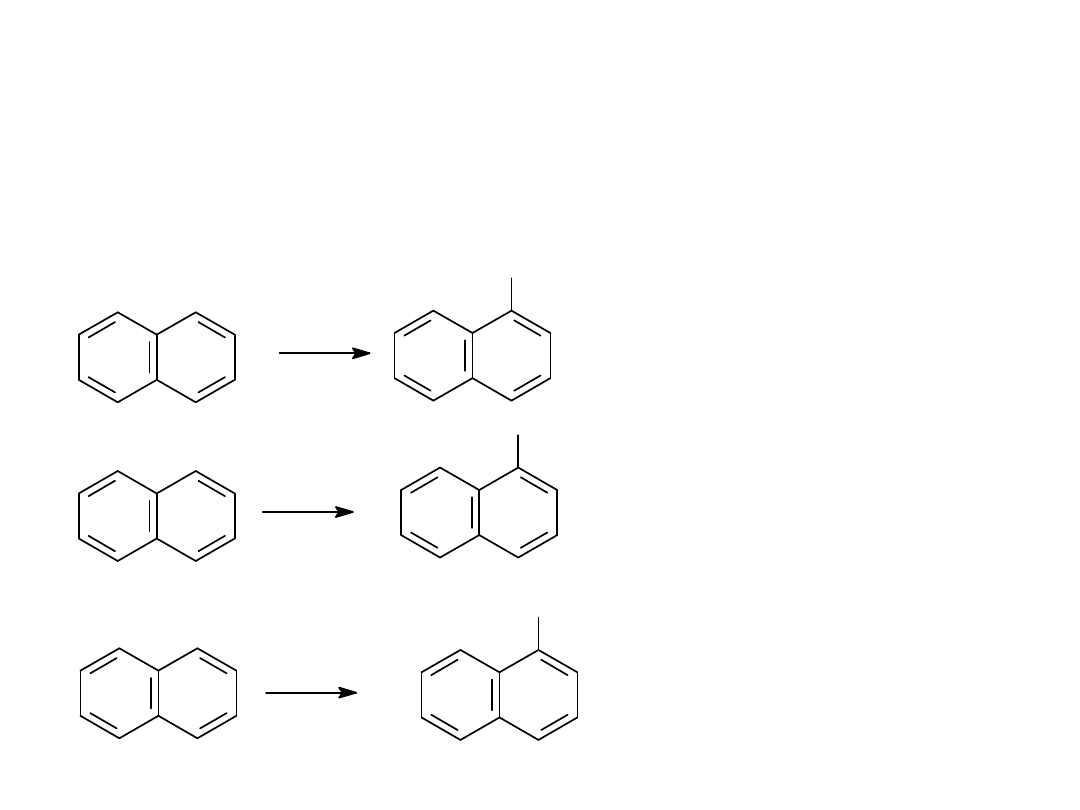
REAKCJE NAFTALENU
Br
2
FeBr
3
Br
HNO
3
st
H
2
SO
4
NO
2
HCHO
HCl, ZnCl
2
CH
2
Cl
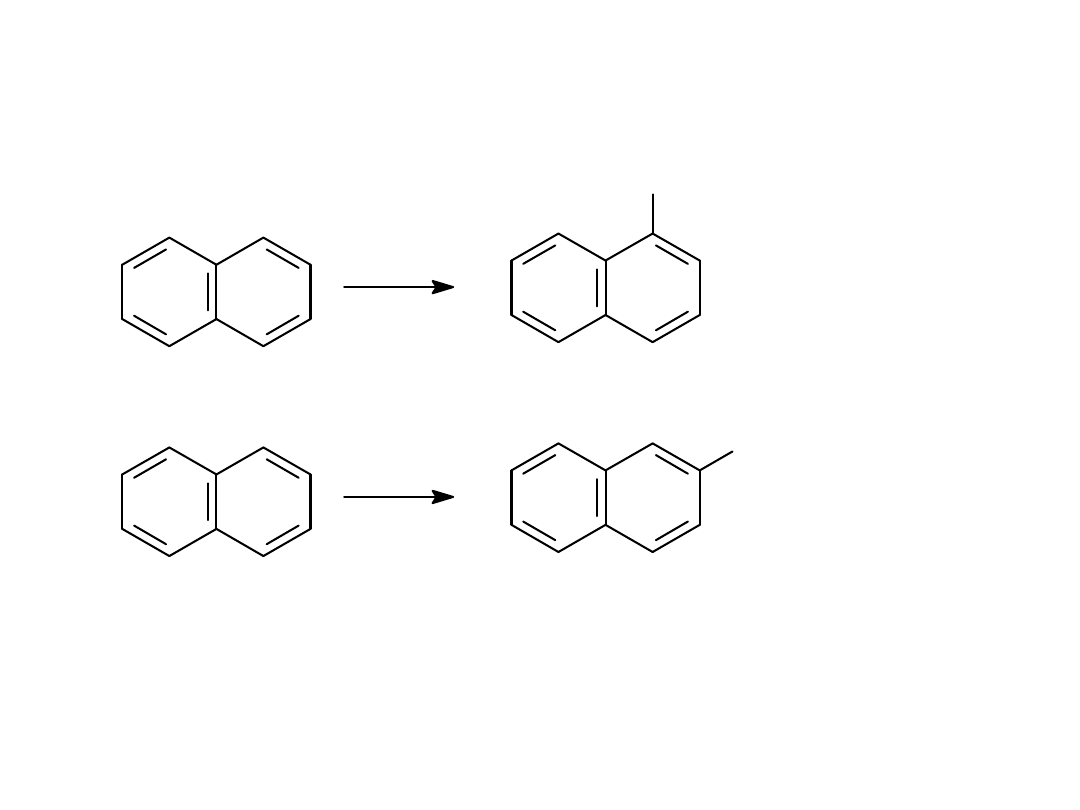
SO
3
H
H
2
SO
4
80
0
C
SO
3
H
H
2
SO
4
180
0
C
160
0
C-

Wpływ na reaktywność Wpływ skierowujący Podstawniki
pierścienia
Silna aktywacja pierścienia orto, para -NR
2
, -NHR,
-NH
2
,-OH,-OR,
-NHCOR, -SH,
-CH=CH
2
Słaba aktywacja pierścienia orto, para -C
6
H
5
, -CH
3
,
Słaba dezaktywacja pierścienia orto, para -F, -Cl, -Br, -I, -CH
2
Cl,
Silna dezaktywacja pierścienia meta -COR, -CHO, -COOR,
-CONH
2
, -COOH,
-SO
3
H,
-CN, -NO
2
,
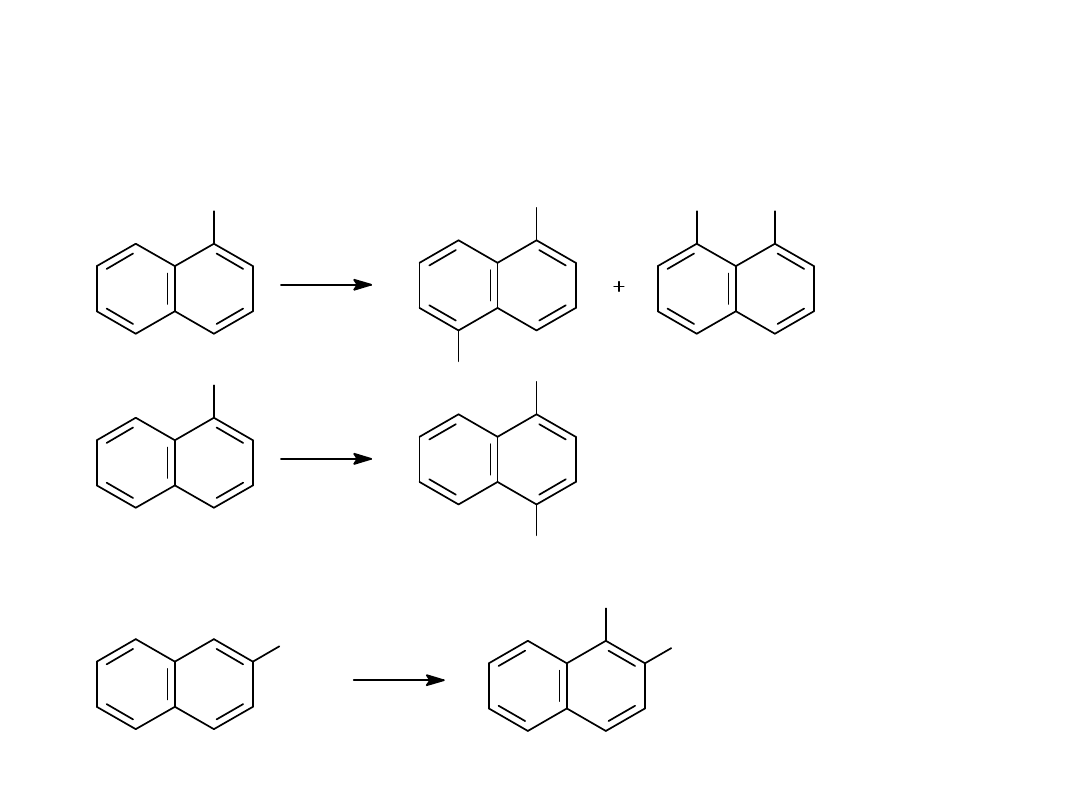
NO
2
NO
2
NO
2
CH
3
NO
2
CH
3
HNO
3
H
2
SO
4
NO
2
NO
2
HNO
3
H
2
SO
4
H
2
SO
4
HNO
3
CH
3
NO
2
CH
3
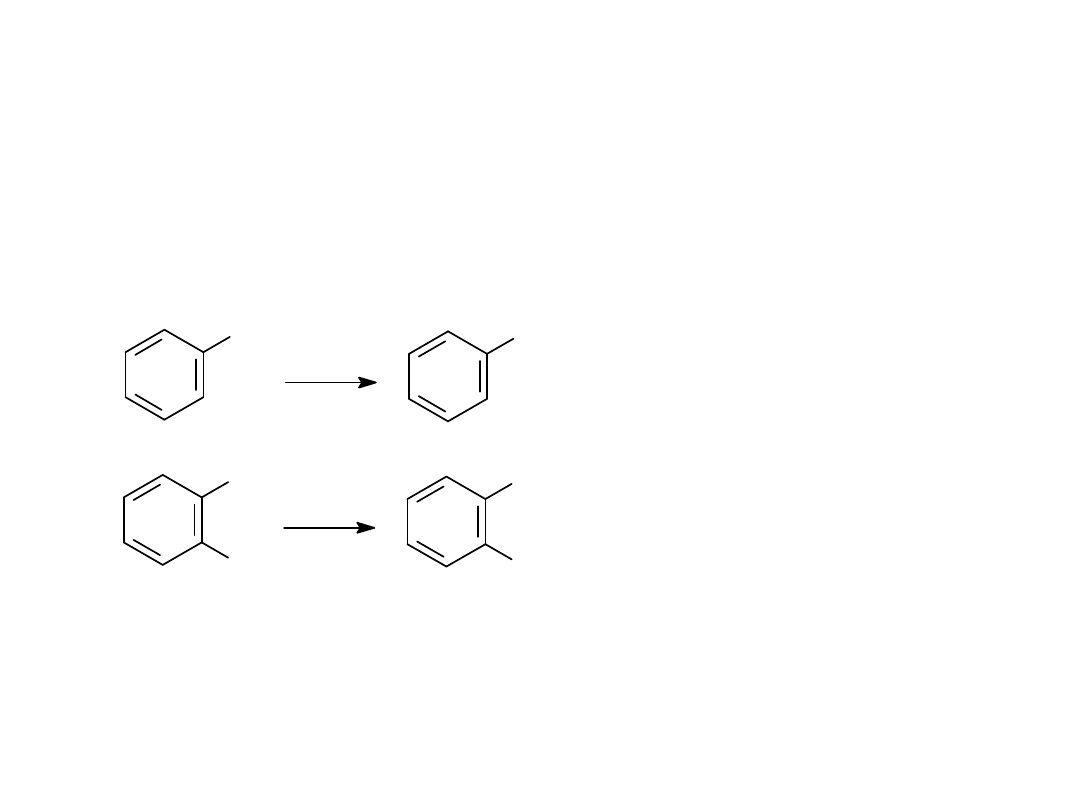
REAKCJE UTLENIANIA POCHODNYCH BENZENU
CH
3
KMnO
4
COOH
COOH
COOH
KMnO
4
CH
3
CH
3
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
- Slide 40
- Slide 41
- Slide 42
- Slide 43
- Slide 44
- Slide 45
- Slide 46
- Slide 47
- Slide 48
- Slide 49
- Slide 50
- Slide 51
- Slide 52
- Slide 53
- Slide 54
Wyszukiwarka
Podobne podstrony:
Węglowce (2), 08. MEDYCYNA, 1.Analityka medyczna, I rok, Chemia ogólna i nieorganiczna, Inne
analityka zab weglowodanowo tłuszczowe 4
Węglowce (1), 08. MEDYCYNA, 1.Analityka medyczna, I rok, Chemia ogólna i nieorganiczna, Inne
9 Ch organiczna WĘGLOWODANY
Aminy analityka
3 ANALITYCZNE METODY OBLICZANIA PŁYWÓW
W08 Patofizjologia zaburzeń gospodarki węglowodanowej
FENOLE analityka
WĘGLOWODANY 3
WĘGLOWODORY
Chemia węglowodory
Trawienie i wchlanianie weglowodanow AW
AT kurs analityka giełdowego 3
więcej podobnych podstron