Enzymy
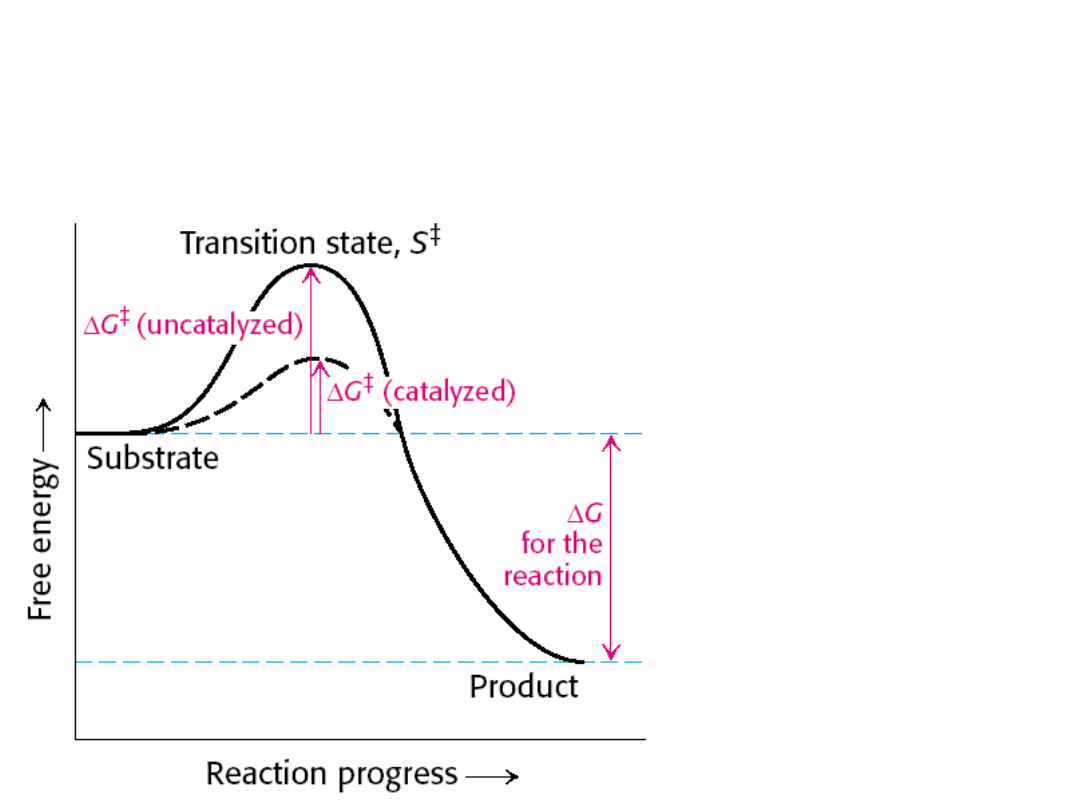
Katalizator obniża
energię aktywacji
reakcji chemicznej,
przez co zwiększa jej
szybkość.
Katalizatorami w układach biologicznych
są enzymy
Większość enzymów
to białka
Oraz kilka znanych
fragmentów RNA
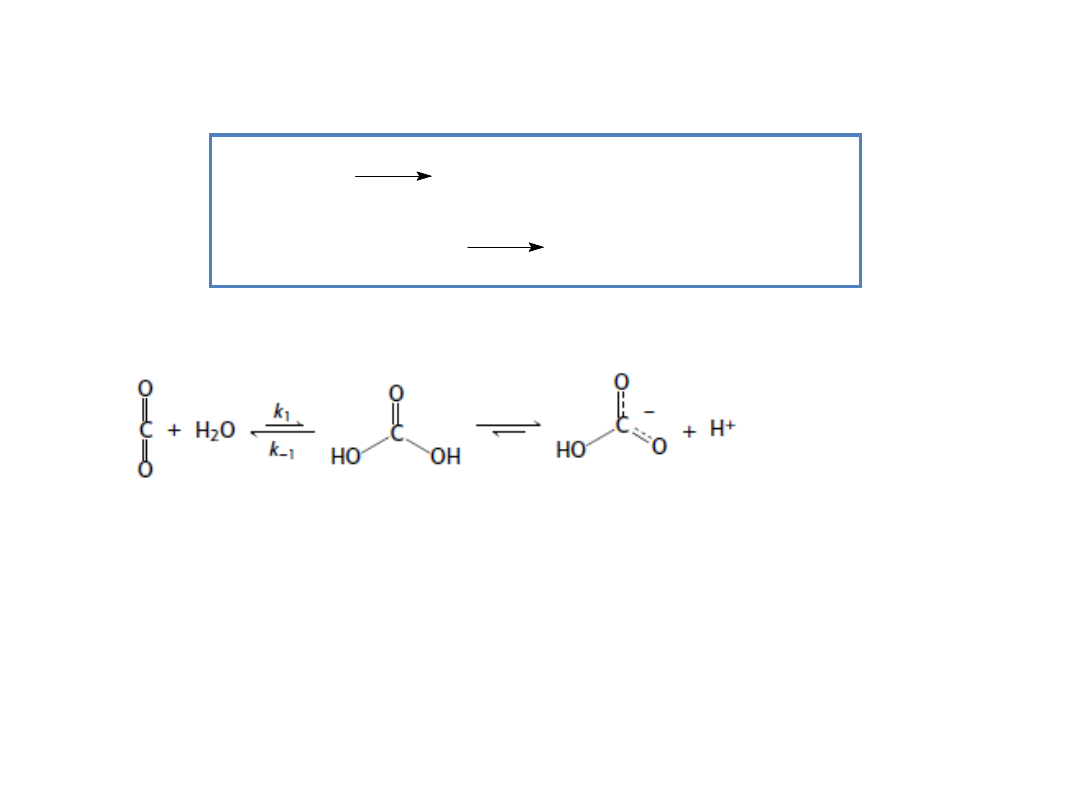
Enzymy są bardzo specyficzne i charakteryzują się
dużą siłą katalityczną
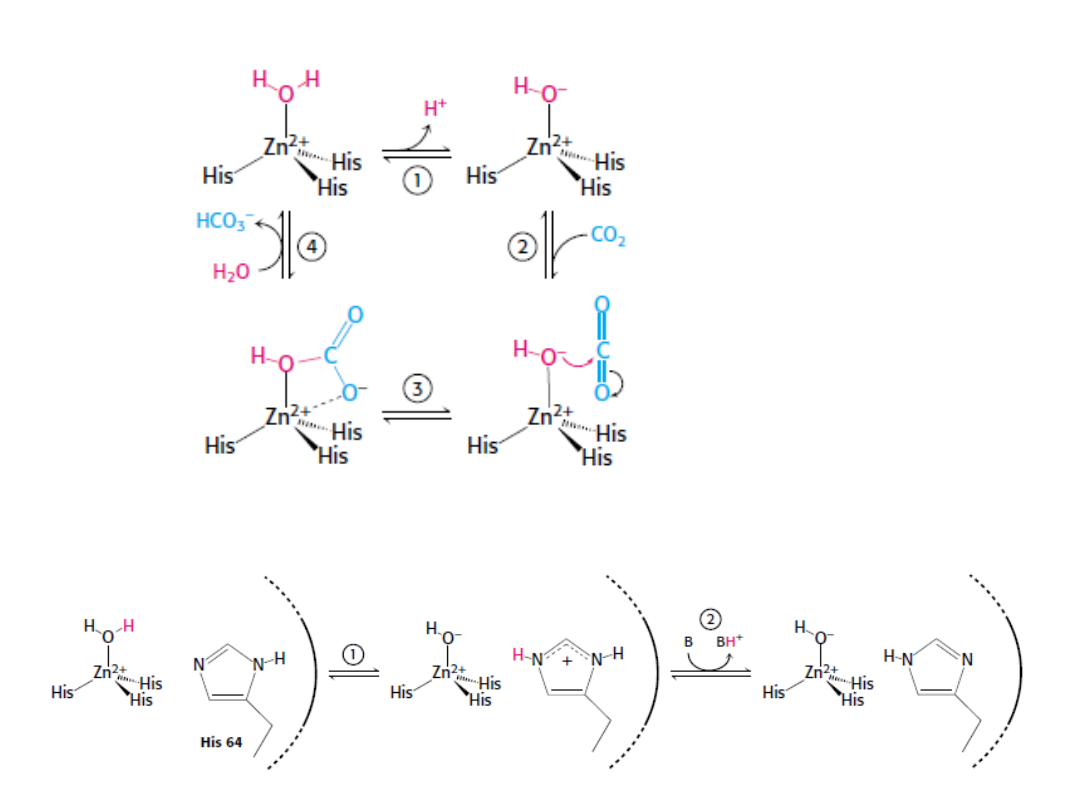
Anhydraza węglanowa katalizuje reakcję:
Dzięki temu dwutlenek węgla może być skutecznie wiązany w
komórkach oraz uwalniany w płucach.
Anhydraza węglanowa jest jednym z najszybszych znanych
enzymów.
Każda cząsteczka enzymu może uwodnić 100.000 cząsteczek CO
2
w czasie jednej sekundy.
A + B
C + D
k
A + B + enzym
C + D
k
1
2
1
k
>>
k
2
Enzymy
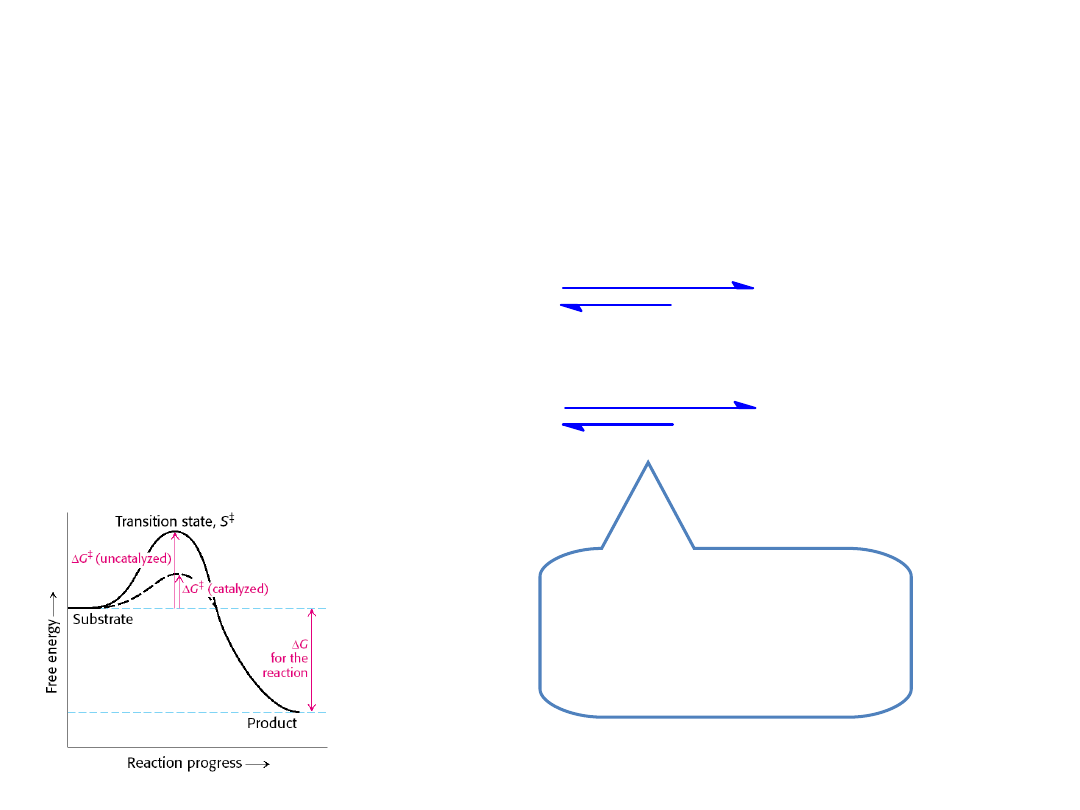
NIE
zmieniają równowagi reakcji,
lecz służą jako katalizatory
zmniejszające energie aktywacji reakcji chemicznych.
C + D
A + B
A + B + enzym
C + D
Stan równowagi nie
zmienia się
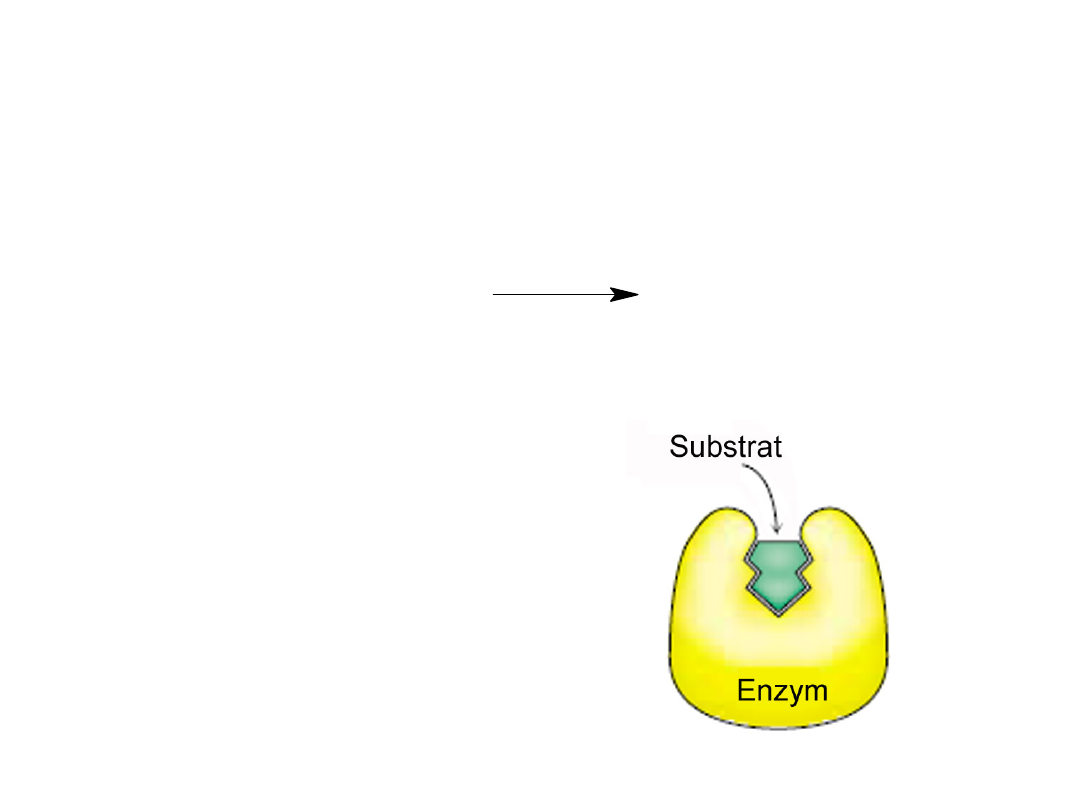
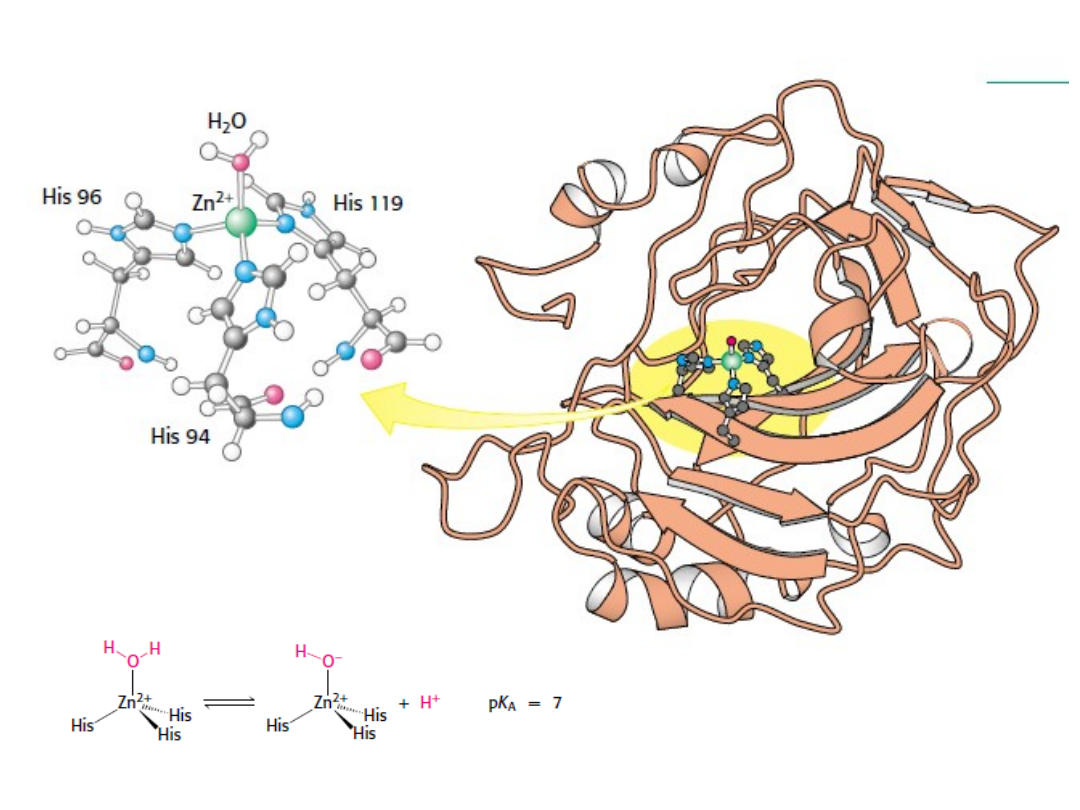
Pierwszym etapem katalizy jest tworzenie
kompleksu enzym-substrat.
Substraty są związane z
enzymem w miejscu aktywnym
umieszczonym w szczelinie, w
której po związaniu substratu,
woda jest w zasadzie nieobecna.
S + E
ES
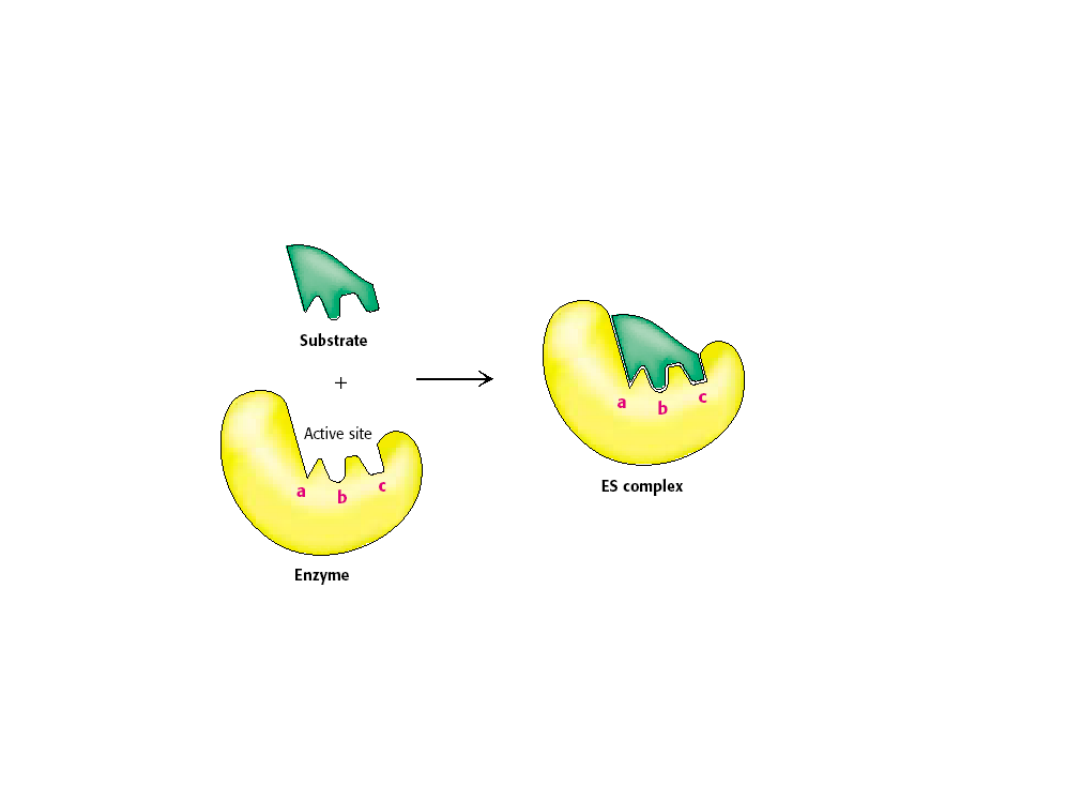
Model klucza i zamka
Emil Fischer
1890
Centrum aktywne - obejmuje małą część cząsteczki
- jest układem przestrzennym
- jest specyficzne, zależy od ułożenia atomów
- wiązanie S z E odbywa się przez słabe siły
Reakcja enzymatyczna zachodzi w centrum aktywnym
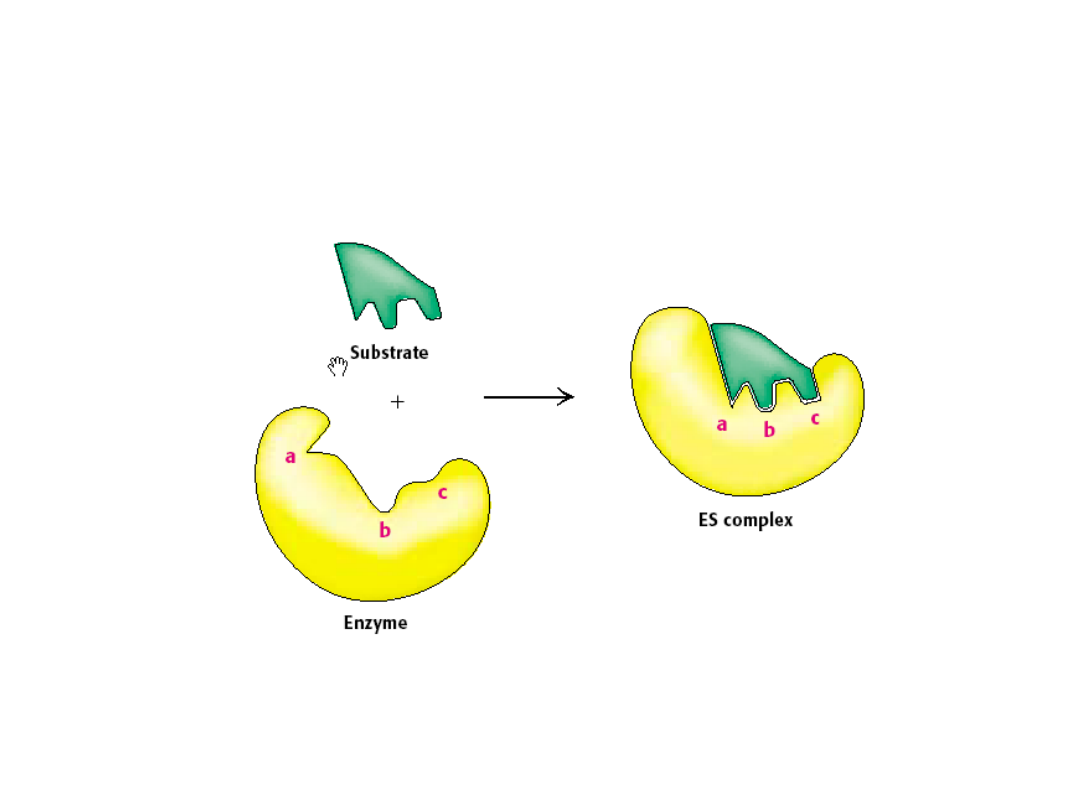
Model wymuszonego dopasowywania
Daniel E. Koshland 1958

Specyficzność oddziaływań enzymu z
substratem zdeterminowana jest głównie
wiązaniami
wodorowymi,
które
są
ukierunkowane, oraz kształtem miejsca
aktywnego, które nie dopuszcza cząsteczek
o
niedostatecznie
komplementarnym
kształcie.
Rozpoznanie substratów przez enzymy jest
procesem dynamicznym, któremu
towarzysza
konformacyjne
zmiany
w
miejscach aktywnych.

OKSYDOREDUKTAZY
- należą tutaj enzymy katalizujące reakcje oksydo-
redukcyjne, przemiany związane z przeniesieniem elektronów i tlenu; przenoszą
protony i elektrony z substratu na koenzymy lub odwrotnie, czasem na tlen.
Reduktazy - katalizują przeniesienie protonów i elektronów. Oksydazy - to
enzymy, które aktywują tlen cząsteczkowy. Oksygenazy i hydroksylazy -
katalizują przyłączanie tlenu do związku organicznego z przeniesieniem protonów i
elektronów, a peroksydazy działają utleniająco na związki organiczne w
obecności H
2
O
2
.
TRANSFERAZY
- enzymy te katalizują reakcje przenoszenia grup pomiędzy
poszczególnymi związkami i to zwykle z udziałem specjalnych koenzymów.
Przedstawiciele: aminotransferazy, glikozylotransferazy,kinazy.
HYDROLAZY
- enzymy tej klasy katalizują reakcje hydrolizy, czyli rozkładu wiązań
z udziałem cząsteczki wody. Ważniejsze gr. to esterazy, glikozydazy,
peptydazy, amidazy.
LIAZY
- enzymy, które odwracalnie lub nieodwracalnie katalizują odłączenie grup
od substratu, bez udziału wody.
IZOMERAZY
- tu należą enzymy katalizujące takie reakcje izomeryzacji jak:
racemizacja, epimeryzacja, izomeryzacja.
LIGAZY
- enzymy katalizujące wytwarzanie wiązań między 2- cząsteczkami co jest
związane z reakcją rozpadu bogatego w energię związku makroergicznego np. z
udziałem ATP.
W przemianach katabolicznych cukrów biorą udział enzymy katalizujące rozkład
wiązań glikozydowych.
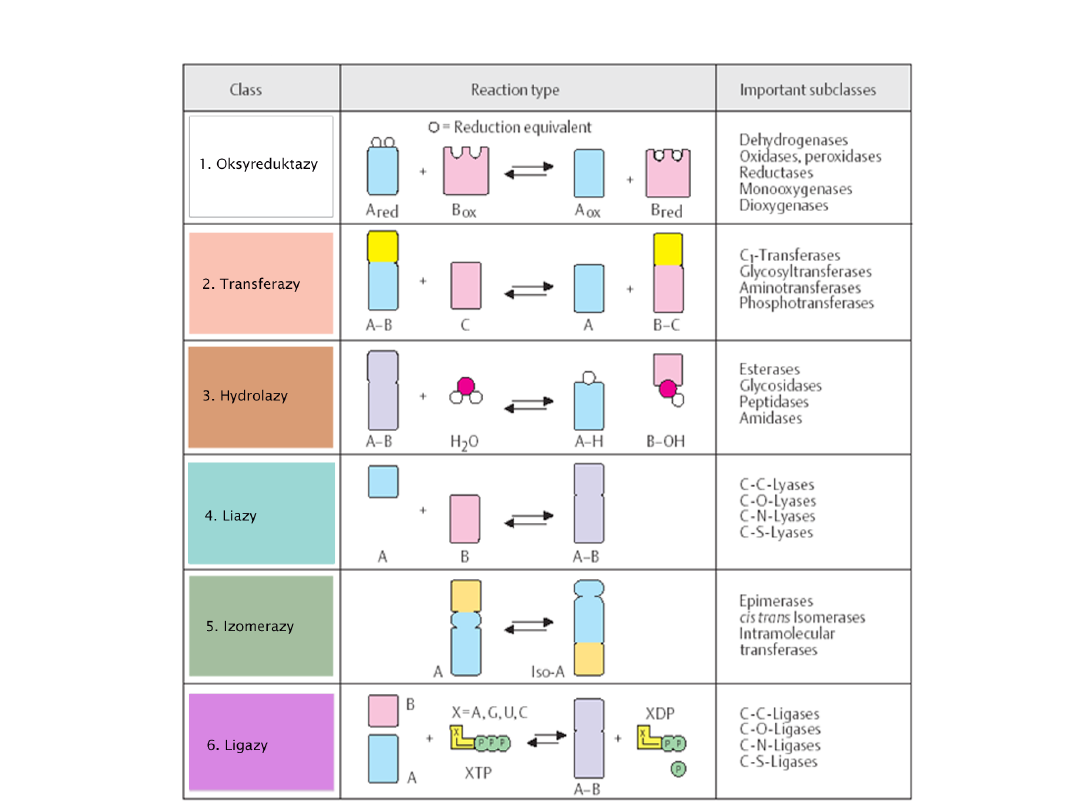
Typy enzymów

Model Michaelisa-Menten tłumaczy właściwości kinetyczne pewnych enzymów.
W modelu tym enzym
(E)
łączy sie z substratem
(S)
tworząc kompleks enzym-
substrat
(ES)
,
który może sie przekształcać, tworząc produkt (P) lub dysocjować z
powrotem do E i S.
Model Michaelisa-Menten
Szybkość
V
tworzenia produktu jest określona przez równanie Michaelisa-
Menten
V
max
- szybkość reakcji w warunkach całkowitego wysycenia enzymu substratem,
K
M
stała Michaelisa - stężenie substratu, w którym szybkość osiąga połowę wartości
maksymalnej. K
M
jest równe takiemu stężeniu substratu, dla którego szybkość
reakcji
osiąga polowe swojej wartości maksymalnej.
Szybkość maksymalna, V
max
, jest równa iloczynowi k
3
i całkowitego stężenia
enzymu.
Stała kinetyczna k
3
, nazywana liczba obrotów enzymu, jest liczba cząsteczek
substratu przekształconych w produkt reakcji w jednostce czasu przez pojedyncze
miejsce katalityczne w warunkach pełnego wysycenia enzymu substratem, Dla
większości enzymów liczba obrotów leży w granicach od 1 do 10
4
na sekundę.
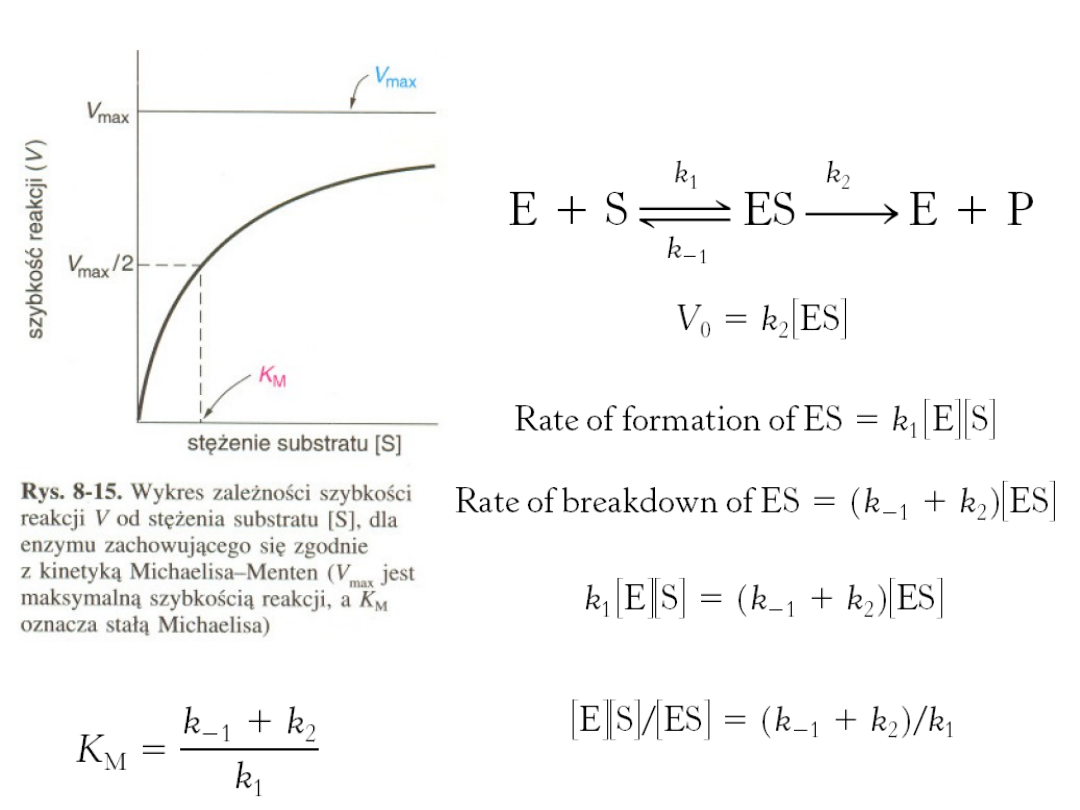
8. Właściwości kinetyczne wielu E opisuje model Michaelisa -
Menten
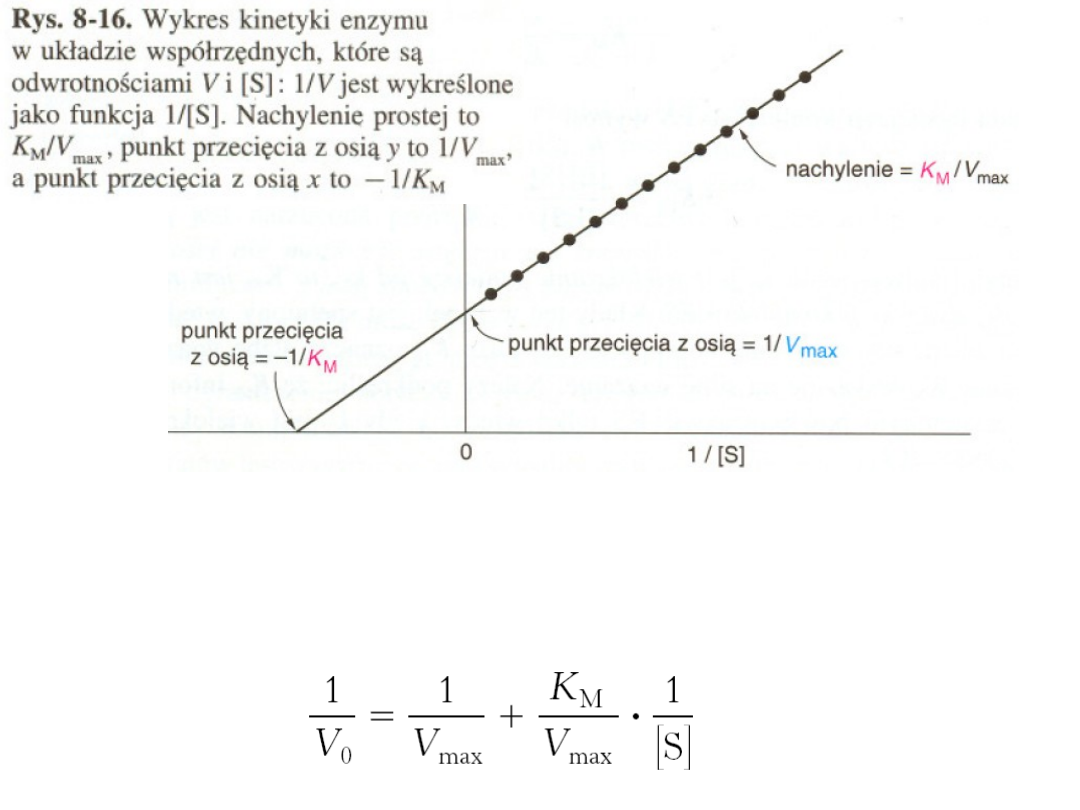
Szybkość maksymalną reakcji V i stałą Michaelisa K
M
wyznacza się przy użyciu
metod przekształcających równanie Michaelisa-Menten z zależności hiperbolicznej
w prostoliniową.
Najczęściej stosowana jest metoda Lineweavera-Burke'a, gdzie zastosowano
odwrotność równania podstawowego

Enzymy mogą ulęgać inhibicji przez specyficzne małe cząsteczki lub jony.
W
inhibicji nieodwracalnej
inhibitor łączy sie kowalencyjnie z enzymem
lub
wiąże z nim tak silnie, ze jego dysocjacja jest bardzo powolna.
Inhibicję odwracalną
charakteryzuje szybko ustalający sie stan
równowagi między enzymem a inhibitorem.
Inhibitor kompetycyjny (konkurencyjny, współzawodniczący)
zapobiega wiązaniu sie substratu z miejscem aktywnym. Zmniejsza on
szybkość reakcji przez zmniejszenie liczby cząsteczek enzymu
związanych z substratem.
W
inhibicji niekompetycyjnej (niekonkurencyjnej
,niewspółzawodniczącej )
inhibitor zmniejsza liczbę obrotów enzymu.
Inhibicje kompetycyjna można odróżnić od niekompetycyjnej
stwierdzając, czy zwiększenie stężenia substratu znosi efekt inhibicji.
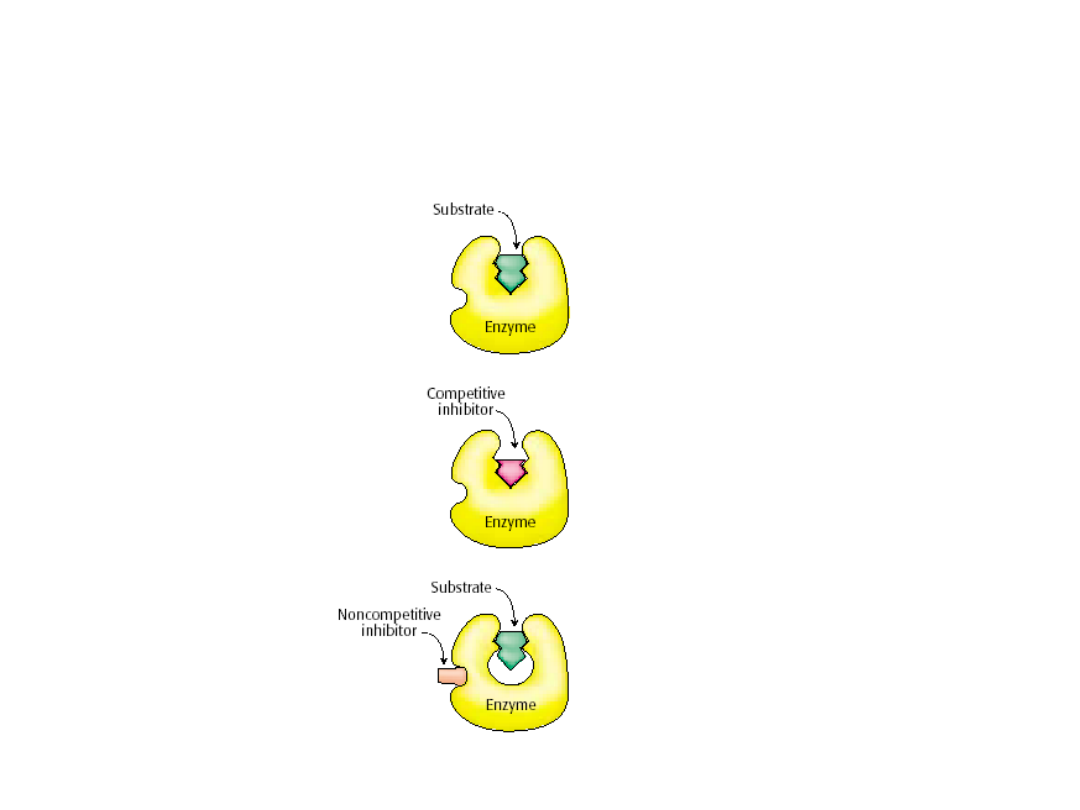
Inhibicja niekonkurencyjna

E
+
S
E
S
E
+
P

E
+
S
E
S
E
I
E
+
P
I
+
E
+
S
E
S
E
I
I
E
S
E
+
P
I
+
I
+
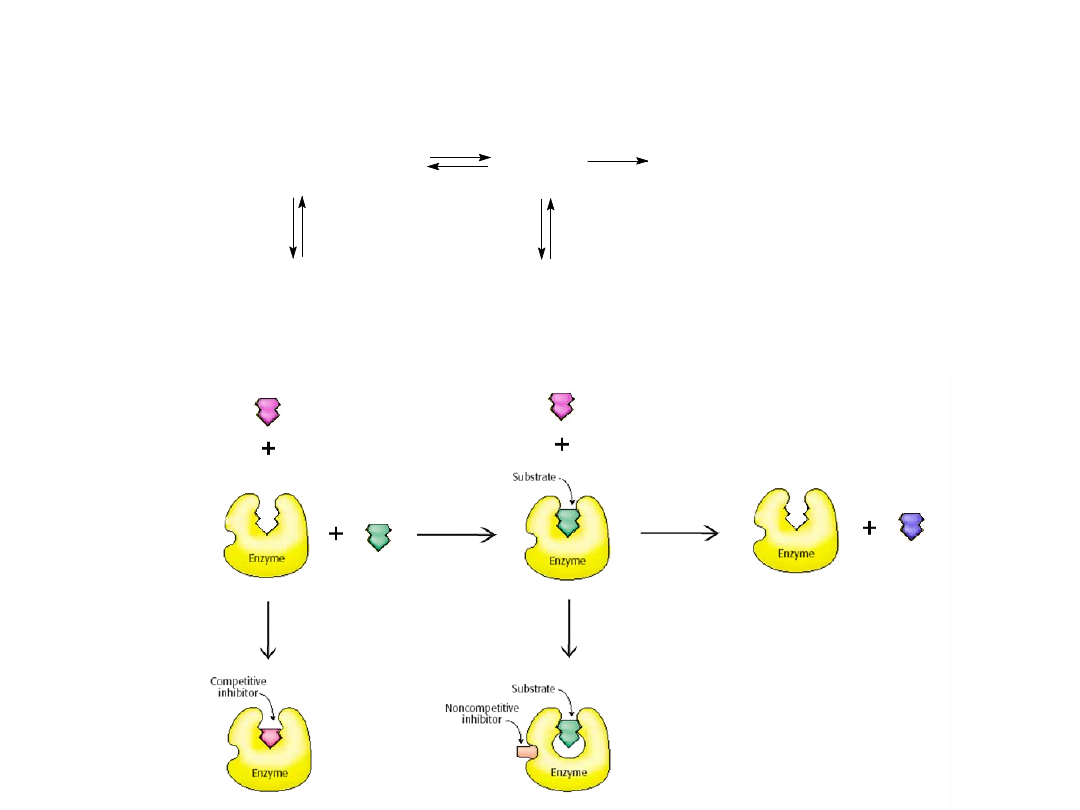
E
+
S
E
S
E
I
I
E
S
E
+
P
I
+
I
+
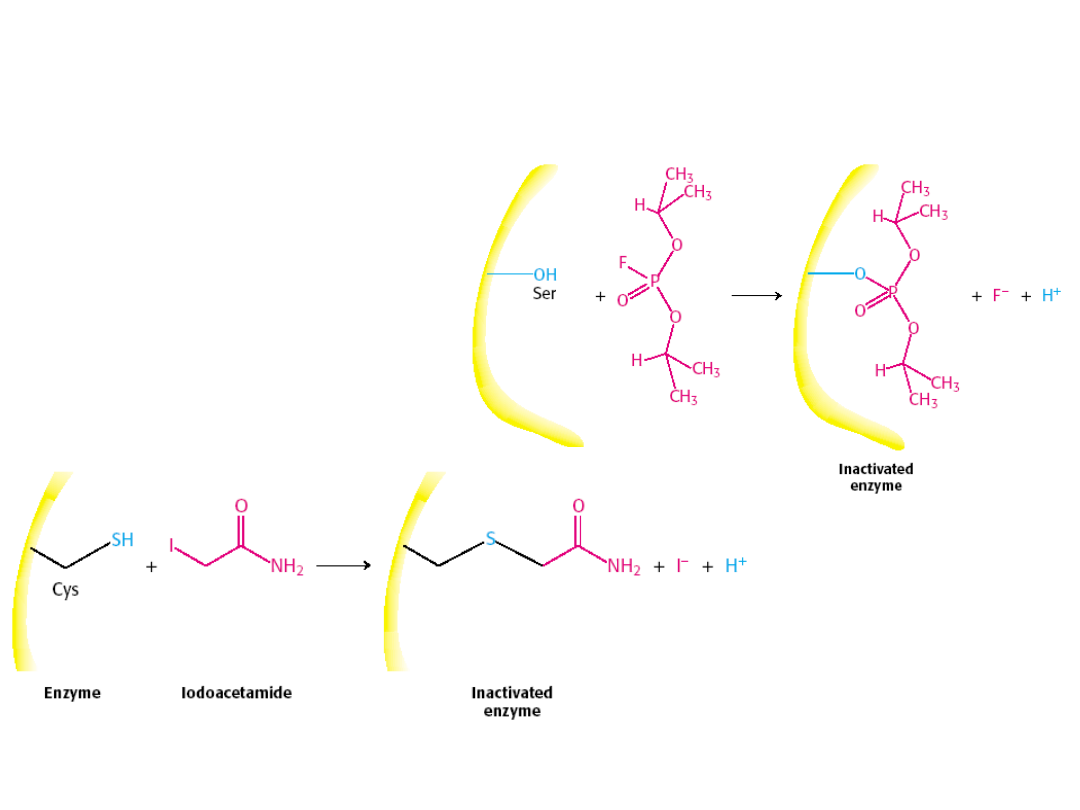
Inaktywacja
chymotrypsyny
diizopropylofluorofosforan
em (DIPF)
Inaktywacja
amidem kwasu
jodooctowego
9. Enzymy mogą ulegać procesom inhibicji (głównie kontroli biologicznej)
nieodwracalna i odwracalna
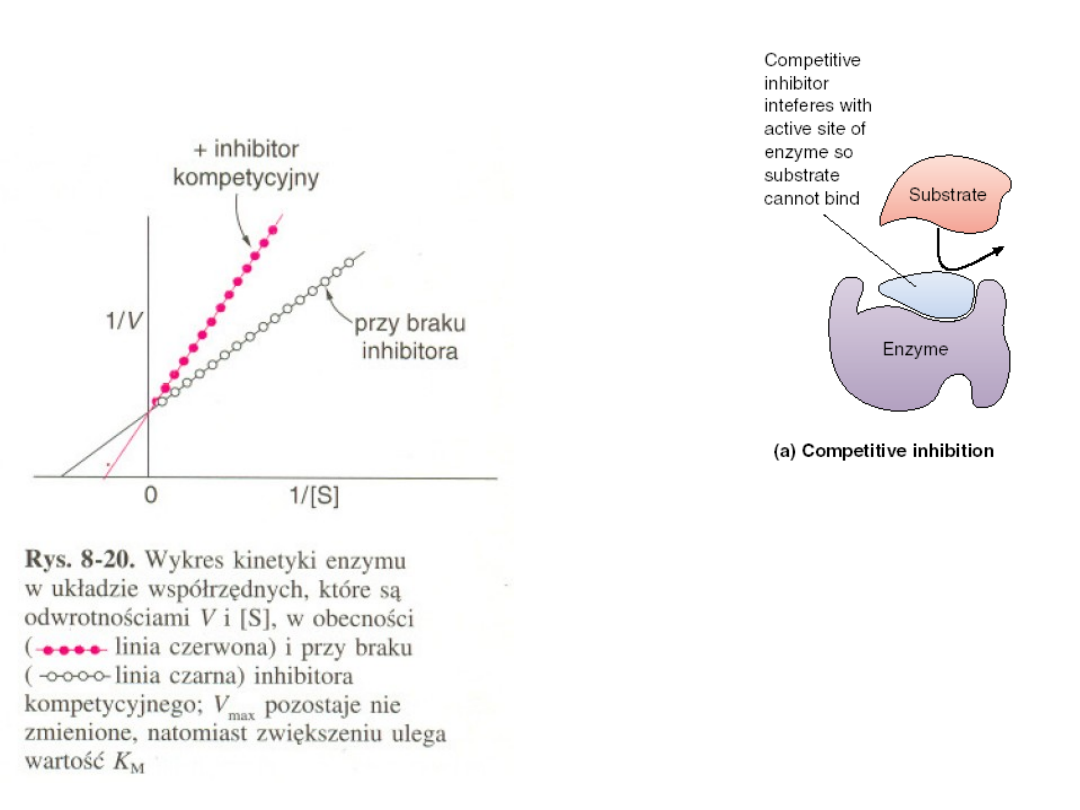
Odwracalna:
Inhibicja konkurencyjna
Cechą charakterystyczna inhibicji
kompetycyjnej jest możliwość jej
cofnięcia przez dostatecznie duże
stężenie substratu.
Substrat i inhibitor współzawodniczą
o to samo miejsce. Przy odpowiednio
dużym stężeniu substratu praktycznie
wszystkie miejsca są obsadzone
substratem i enzym jest w pełni
aktywny.
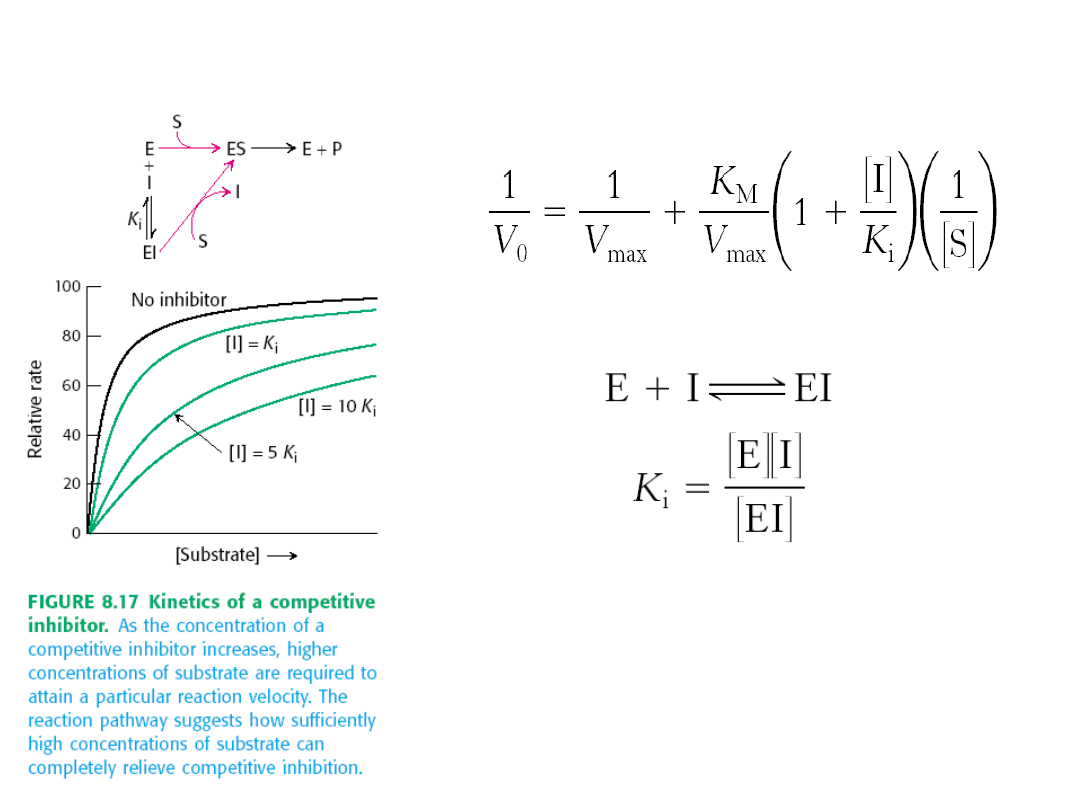
Inhibicja konkurencyjna

Inhibicja konkurencyjna
Inhibitor konkurencyjny
wykazuje strukturalne podobieństwo do
normalnego substratu danego enzymu, przez co współzawodniczy w
wiązaniu się z miejscem aktywnym enzymu. Inhibitor kompetencyjny
wiąże się z miejscem aktywnym enzymu odwracalnie.
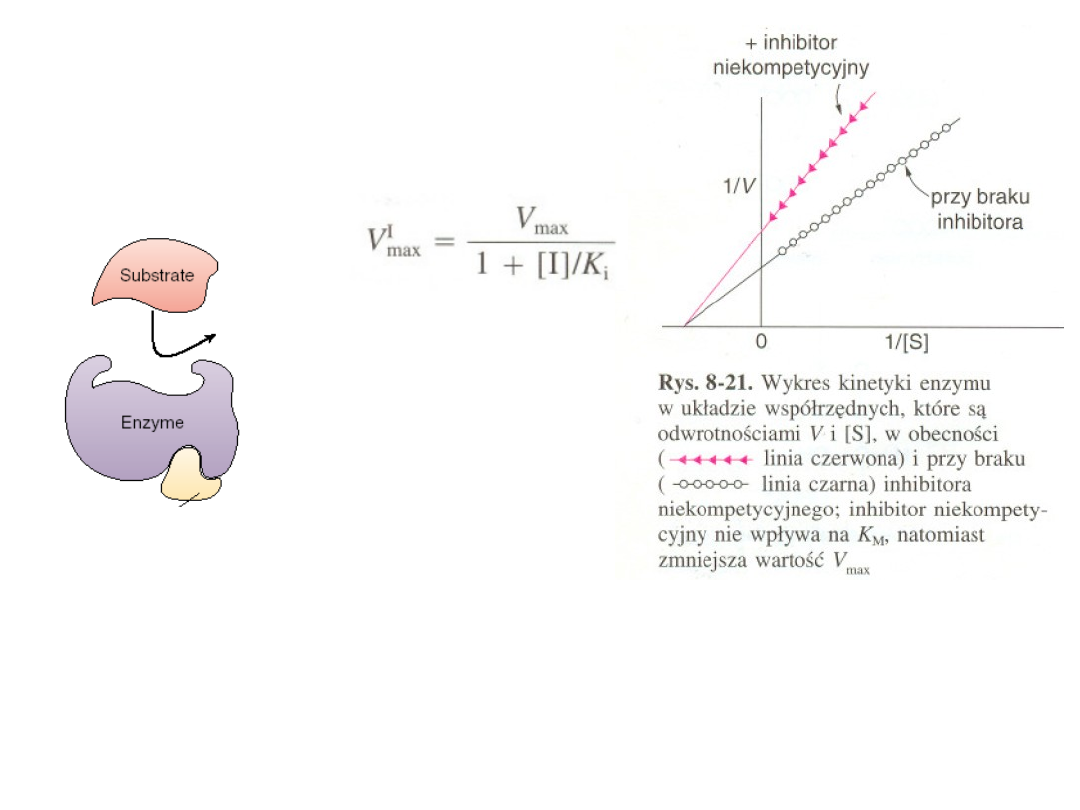
Odwracalna:
Inhibicja niekonkurencyjna
Inhibitor niekonkurencyjny
wiąże się odwracalnie w innym miejscu
enzymu niż jego miejsce aktywne i wywołuje taką zmianę przestrzenną
struktury enzymu, która zmniejsza jego aktywność katalityczną (
inhibicja
allosteryczna
).
Inhibicji niekompetycyjnej
nie da sie przezwyciężyć
przez zwiększenie stężenia
substratu.
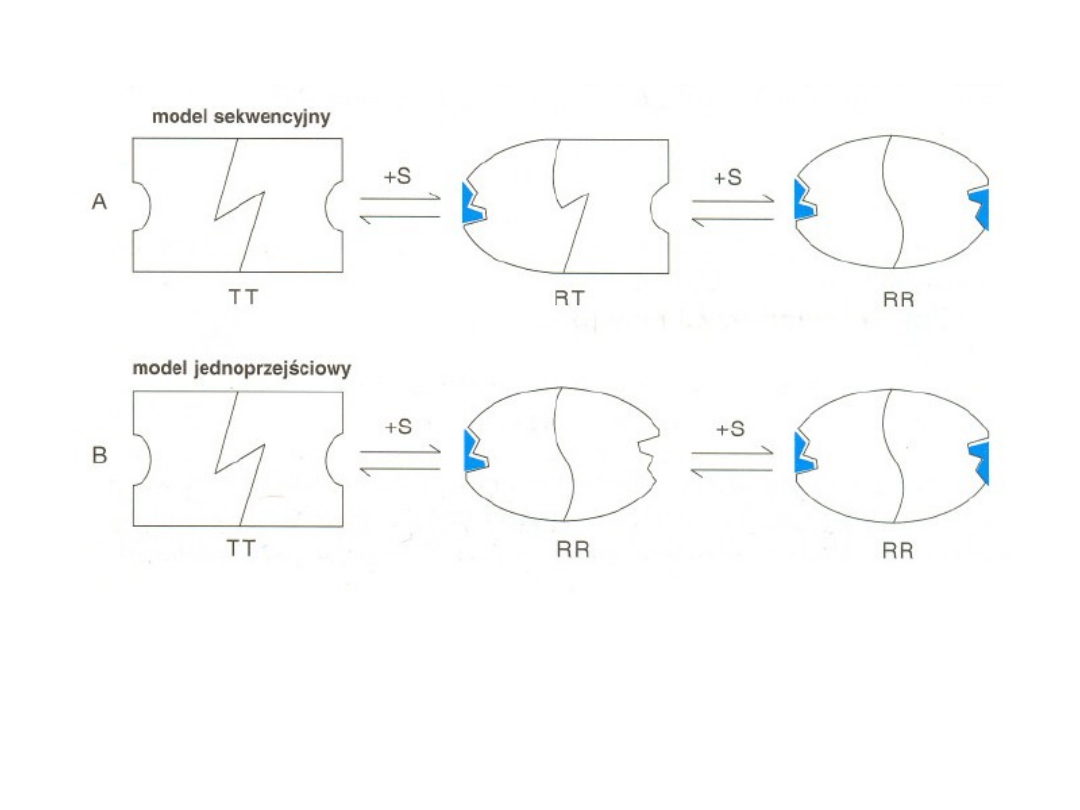
Enzymów allosterycznych nie obowiązuje kinetyka
Michaelisa-Menten
Inhibitor allosteryczny
przesuwa równowagę R T
w kierunku T
,
aktywator allosteryczny natomisat -
w kierunku R
.
Zarazem allosteryczny aktywator zwiększa zdolność wiązania substratu do
enzymu, natomiast allosteryczny inhibitor zdolność te zmniejsza.
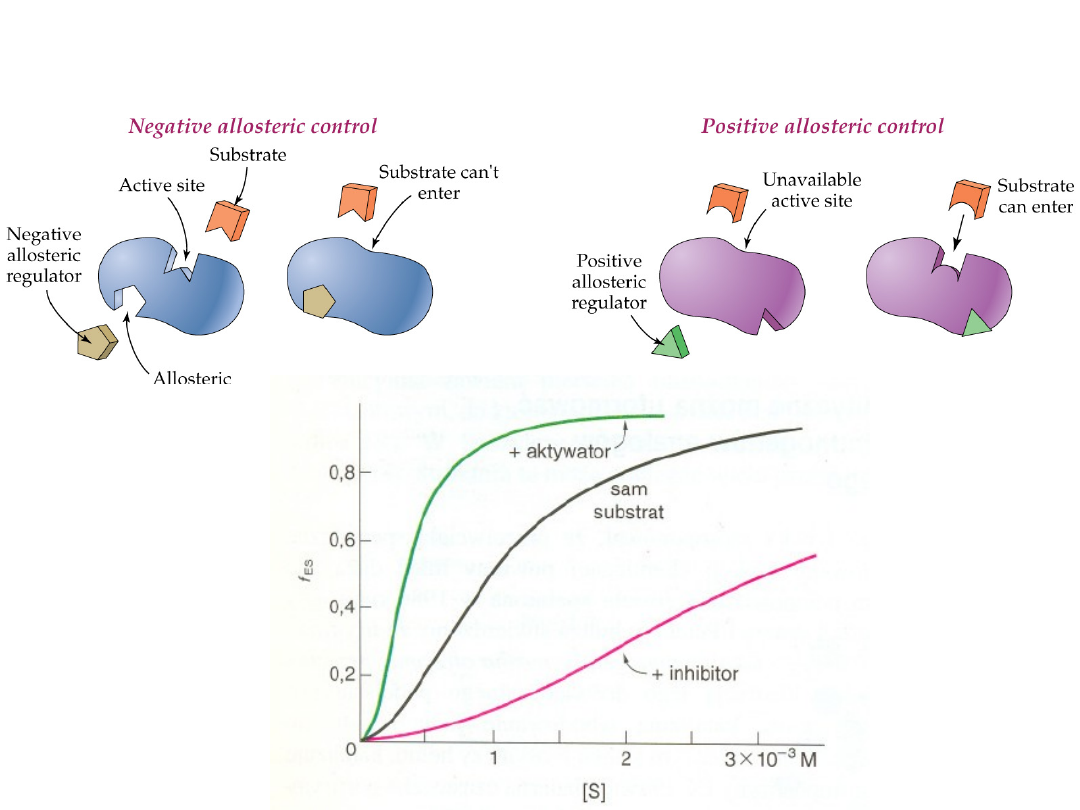
Allosteryczna kontrola enzymów
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
Wyszukiwarka
Podobne podstrony:
enzymy
inhibicja enzymy wykresy
ENZYMY prezentacja biochemia
Enzymy
enzymy prezentacja
kol enzymy
enzymy
odpowiedzi-Habryka zagadnienia do kolosa, INZYNIERIA-BIO, ENZYMY, A Habryka Zamawiany i Aut2
pytania-enzymy, Technologia żywności UWM, enzymologia
enzymy
Enzymy
prośba o?zpłatny dzień wolny
biochemia enzymy2
Enzymy podział na klasy
07 Enzymy 1
08 Enzymy 2
enzymy restrykcyjne
więcej podobnych podstron