
Struktura atomów
wieloelektronowych
• Przybliżenie
jednoelektronowe (orbitalne)
• Zasada Pauliego
• Konfiguracje
• Stany singletowe i
trypletowe
• Reguła Hunda
• Sprzężenie spin-orbita
• Symbole termów
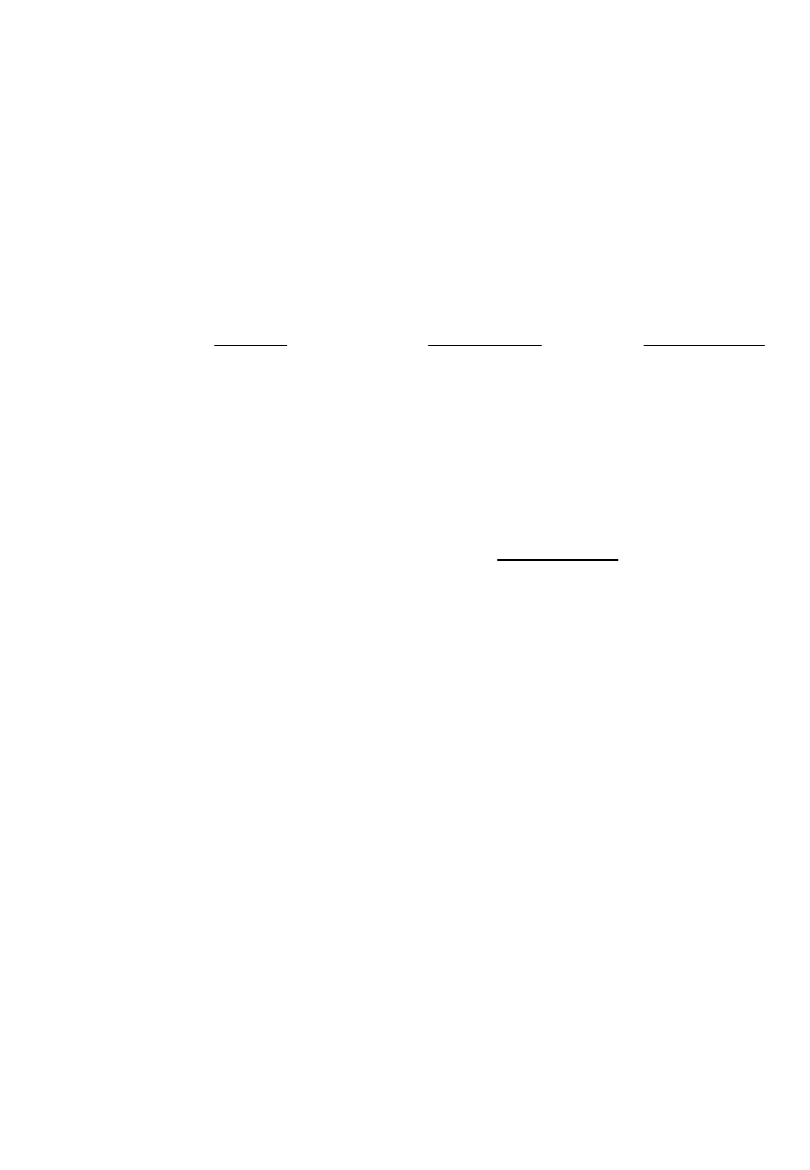
Równanie
Schrödingera dla N-
elektronowego atomu
N
j
i
ij
N
i
i
N
i
i
i
r
e
r
Ze
m
H
1
0
2
1
0
2
1
2
4
4
2
ˆ
N
j
i
ij
N
i
r
e
i
h
H
1
0
2
1
4
)
(
ˆ
ˆ

Przybliżenie
jednoelektronowe
Każdemu elektronowi
przypisujemy jego własny
orbital
)...
(
)
(
...)
,
(
2
1
2
1
r
r
r
r
s
l
s
l
m
nlm
m
nlm
Iloczyn funkcji
nlml
zależącej od
współrzędnych oraz funkcji
spinowej
ms
Spinorbital
Zakaz Pauliego
Dany orbital mogą zajmować co
najwyżej dwa elektrony o
sparowanych spinach
Zasada Pauliego:
funkcja falowa zmienia znak przy
zamianie wskaźników dwóch
identycznych fermionów
funkcja falowa nie zmienia znaku
przy zamianie wskaźników dwóch
identycznych bozonów
)
1
(
)
2
(
)
2
(
)
1
(
b
a
b
a
)
1
(
)
2
(
)
2
(
)
1
(
b
a
b
a
Nierozróżnialność elektronów:
|(1,2)|
2
=|(2,1)|
2
, więc (1,2) =
±(2,1)
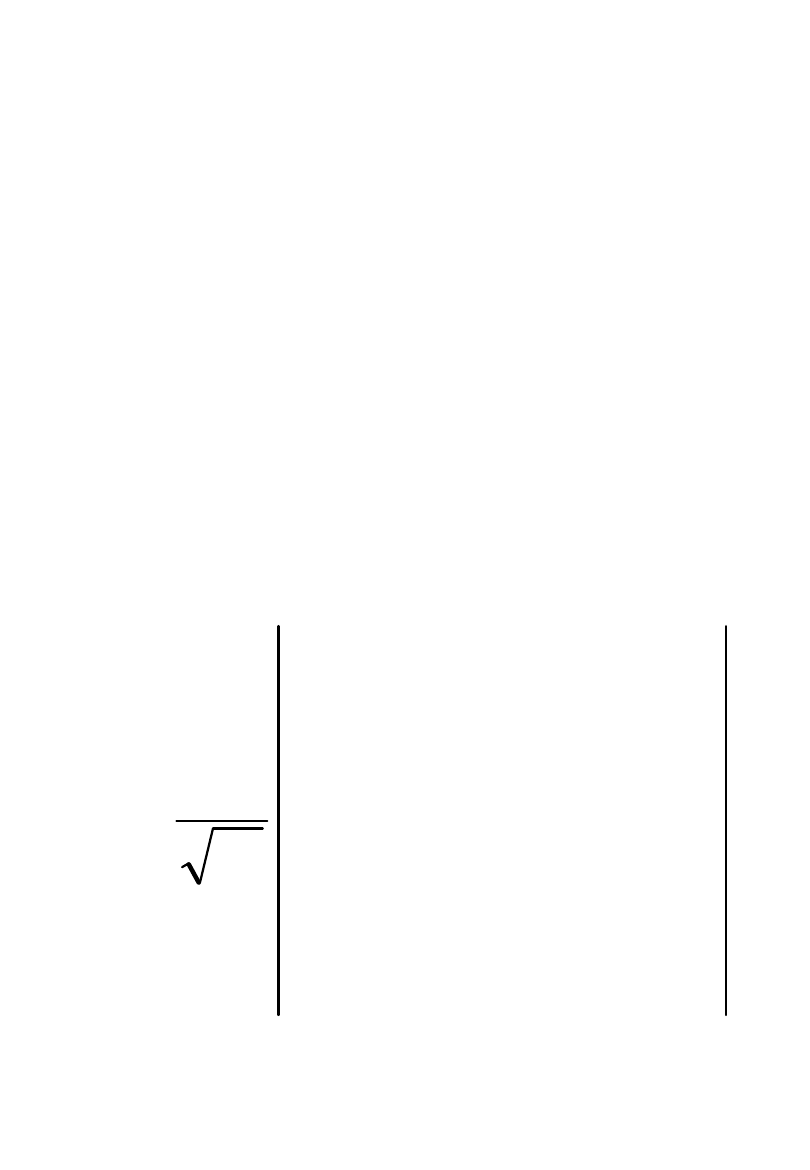
Przybliżenie
jednoelektronowe
Jak skonstruować funkcję
wieloelektronową?
* każdy elektron opisany
innym
spinorbitalem
* antysymetryczna względem
permutacji
elektronów
)
(
)...
2
(
)
1
(
.
...
.
.
.
...
.
.
)
(
)...
2
(
)
1
(
)
(
)...
2
(
)
1
(
1
2
2
2
1
1
1
N
N
N
N
N
N
N
)
(
)......
2
(
)
1
(
2
1
N
N
Nie
!
Wyznacznik Slatera

Metoda wariacyjna
E
H
ˆ
d
d
H
E
*
ˆ
*
d
d
H
E
*
ˆ
*
0
Funkcja próbna: f(c
1
,c
2
,…c
n
)
Znajdujemy minimum dla E
(c
1
,c
2
,…c
n
)
Przykład: orbitale Slatera
)
,
(
)
,
,
(
1
l
lm
r
n
nl
nlm
Y
e
r
N
r
S

Metoda wariacyjna
Metoda Ritza
N
p
p
p
c
1
Minimalizacja energii z
uwagi na współczynniki
prowadzi do:
ˆ
*
*
,...
2
,
1
0
)
(
1
d
H
H
d
S
N
p
ES
H
c
q
p
pq
q
p
pq
N
q
pq
pq
q
Przybliżona funkcja falowa dla
stanu i:
N
q
q
iq
i
c
1

Metoda pola
samouzgodnionego
)
(
)
(
4
)
(
)
(
*
)
(
4
)
(
)
(
*
2
4
)
(
2
1
2
2
1
2
12
0
2
2
2
2
1
2
2
12
0
2
2
2
1
0
2
1
2
2
1
2
r
E
r
d
r
e
r
r
r
d
r
e
r
r
r
Ze
r
m
p
p
i
i
p
i
p
i
i
i
p
e
Równania Hartree-Focka:
2
2
1
)
(
)
(
)
(
ˆ
....N/
,
p
i
i
i
F
p
p
p
i
K
i
J
i
h
i
F
q
N
q
q
)]
(
ˆ
-
)
(
ˆ
2
[
)
(
ˆ
)
(
ˆ
2
/
1
i
j
r
e
j
i
i
J
p
q
ij
q
p
q
)
(
)
(
4
)
(
*
)
(
)
(
ˆ
0
2
i
j
r
e
j
i
i
K
q
p
ij
q
p
q
)
(
)
(
4
)
(
*
)
(
)
(
ˆ
0
2
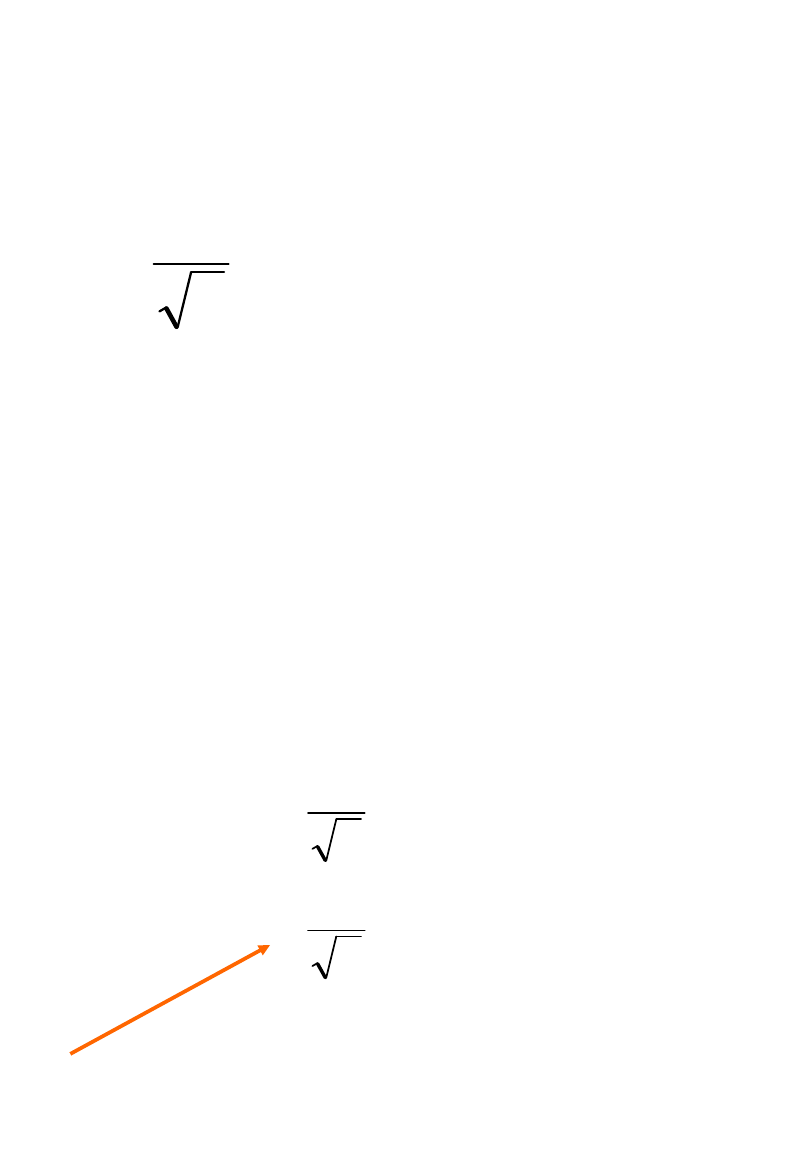
Przybliżenie
jednoelektronowe
Dla dwóch elektronów
))
1
(
)
2
(
)
2
(
)
1
(
(
2
1
2
1
2
1
Jeśli dwa elektrony zajmują ten sam
orbital :
Pełna funkcja falowa jest
iloczynem części orbitalnej i
spinowej:
))
2
(
)
1
(
)
2
(
)
1
(
(
2
1
))
2
(
)
1
(
)
2
(
)
1
(
(
2
1
)
2
(
)
1
(
)
2
(
)
1
(
)
2
(
)
1
(
Dozwolone; sparowane
spiny
Stany singletowe i trypletowe
Dla dwóch elektronów na różnych
orbitalach
a
i
b
:
))
2
(
)
1
(
)
2
(
)
1
(
(
2
1
))
2
(
)
1
(
)
2
(
)
1
(
(
2
1
)
2
(
)
1
(
)
2
(
)
1
(
)]
1
(
)
2
(
)
2
(
)
1
(
[
2
1
b
a
b
a
)]
2
(
)
1
(
)
2
(
)
1
(
[
2
1
)]
1
(
)
2
(
)
2
(
)
1
(
[
2
1
b
a
b
a
)]
2
(
)
1
(
)
2
(
)
1
(
[
2
1
)
2
(
)
1
(
)
2
(
)
1
(
)]
1
(
)
2
(
)
2
(
)
1
(
[
2
1
b
a
b
a
Stan
singletowy
Stan
trypletowy
Korelacja spinowa: E(singlet) >
E(tryplet)
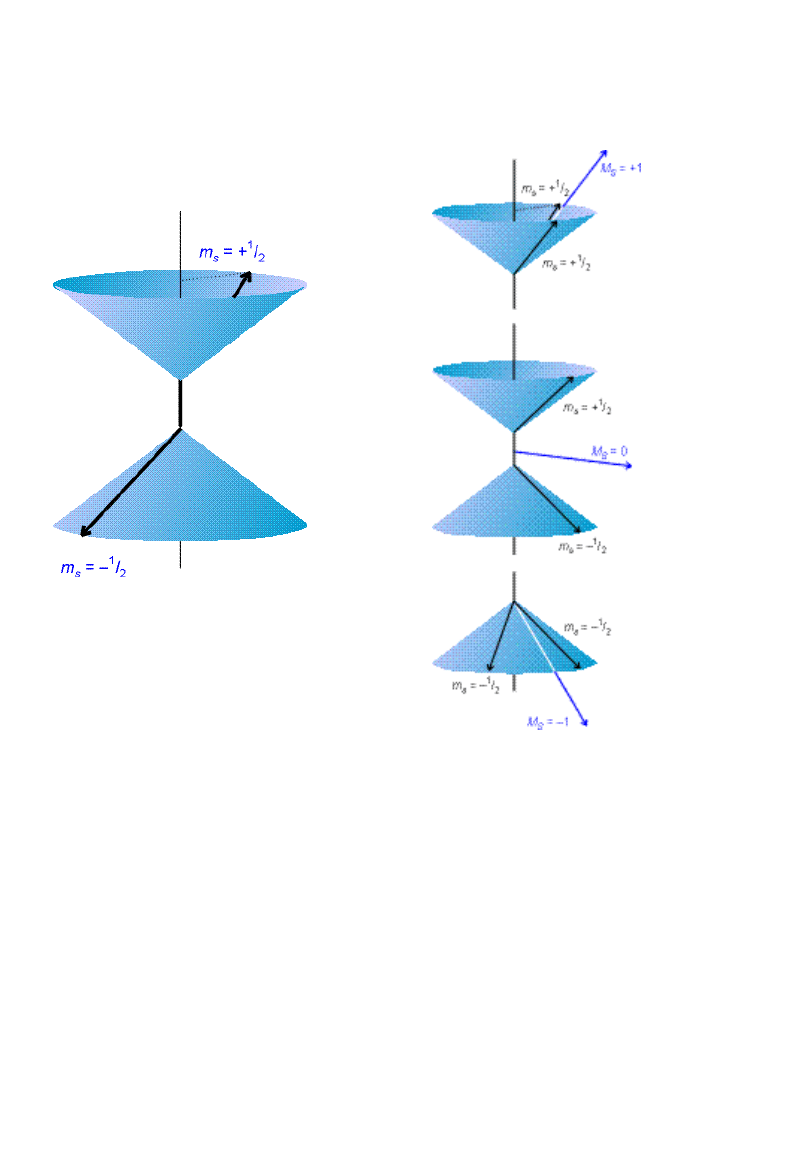
Stany singletowe i
trypletowe
Multipletowość:
2S+1
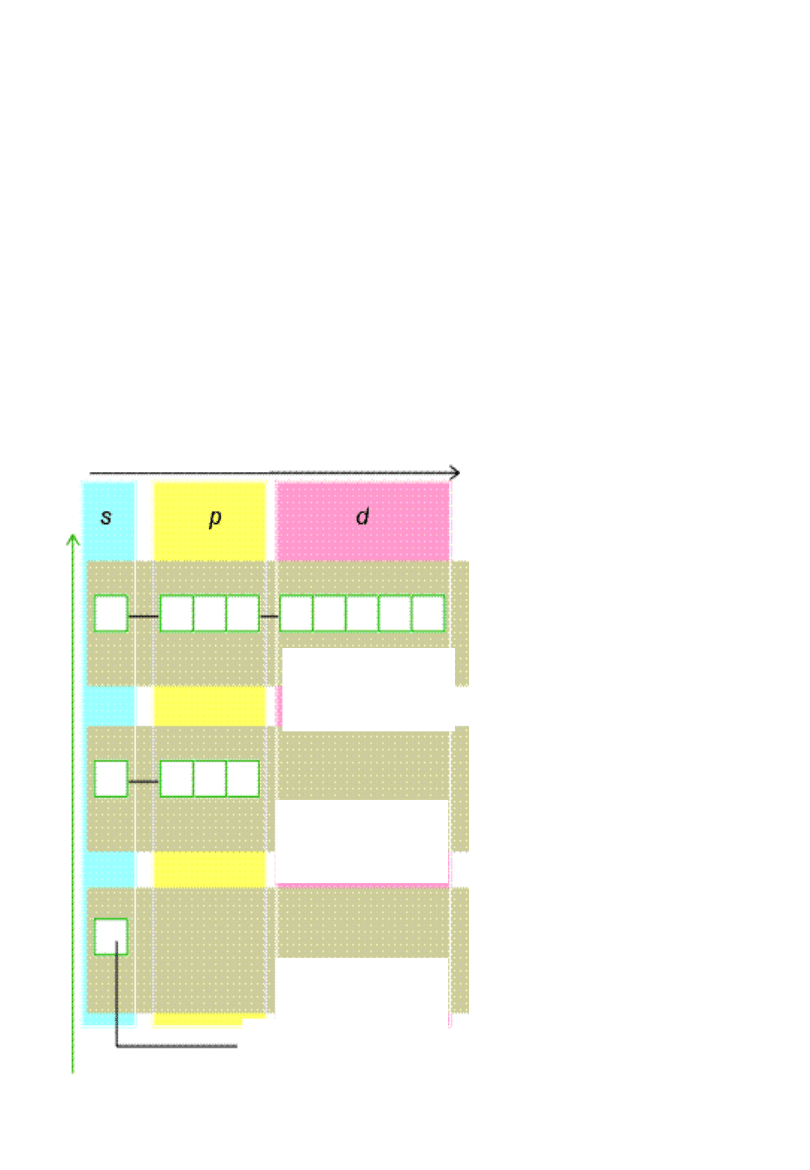
Konfiguracja
elektronowa
Sposób przyporządkowania
poziomów energetycznych
elektronom
podpowłoki
powło
ki
orbital
e
Powłoka
K, n=1
Powłoka
L, n=2
Powłoka
M, n=3
W atomach
wieloelektronowy
ch odpowłoki nie
są
zdegenerowane
!
Konfiguracja
elektronowa
1s 2s 2p 3s 3p 4s 3d 4p 5s 4d
5p 6s
Rozbudowa powłok
elektronowych
Węgiel, Z= 6: 1s
2
2s
2
2p
2
=
[He]
2s
2
2p
2
[He] 2s
2
2p
x
1
2p
y
1
Najpierw różne orbitale danej
podpowłoki
Reguła Hunda: atom w stanie
podstawowym przyjmuje
konfigurację o największej
liczbie niesparowanych
elektronów
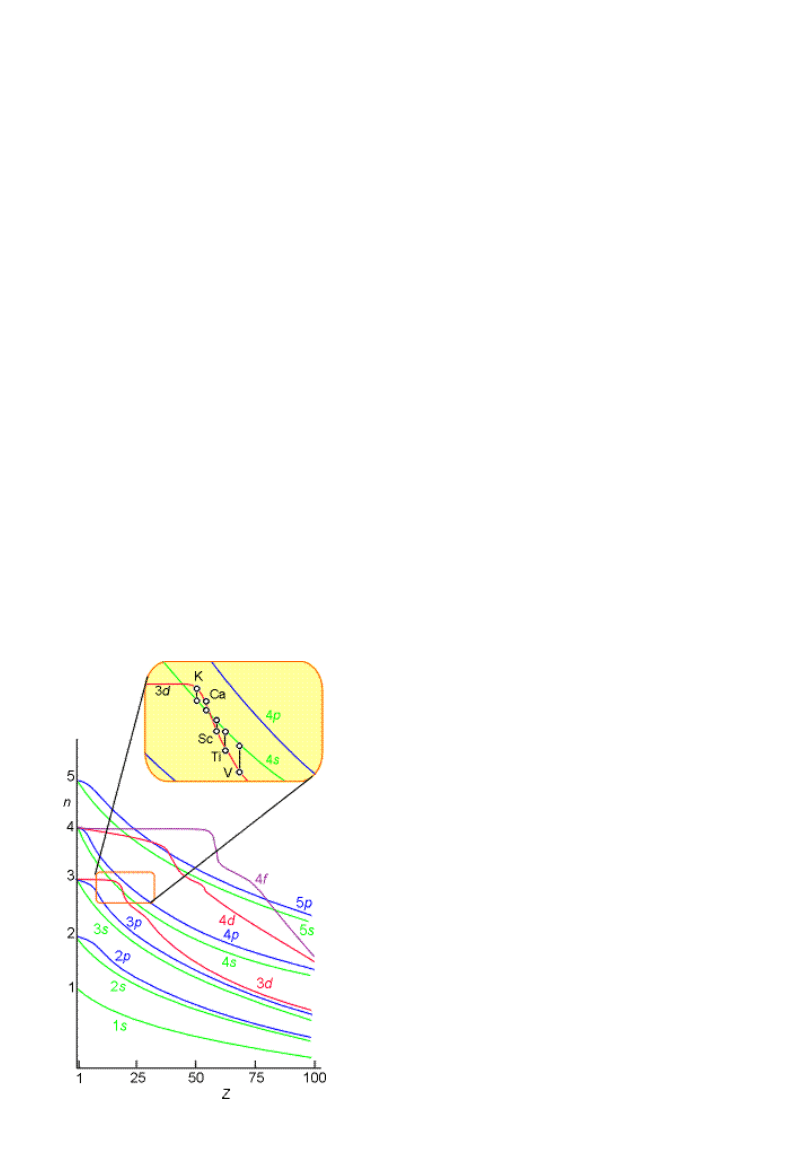
Okresowość
właściwości
chemicznych
Neon, Z=10
[He]2s
2
2p
6
zapełniona powłoka L:
[Ne]
Sód, Z=11: [Ne]3s
1
Lit, Z = 3: [He]3s
1
Potas, Z = 19 [Ar]3s
1
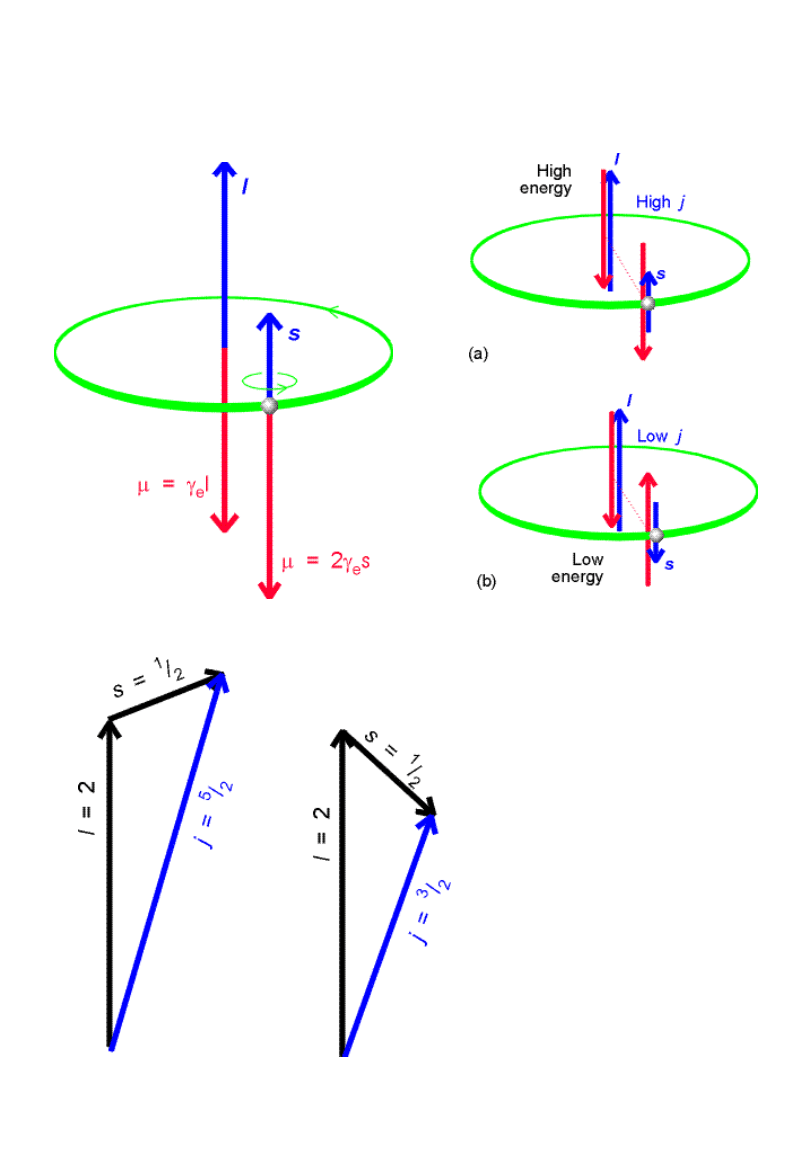
Sprzężenie spinowo-
orbitalne
Całkowit
y
moment
pędu: j

Sprzężenie spinowo-
orbitalne
Energia momentu
magnetycznego w polu B:
-· B
-· B s· l
2
2
2
2
2
2
ˆ
ˆ
ˆ
2
1
ˆ
ˆ
2
1
(
s
l
j
s
l
j
l
s
l
s
l
s
s
s
l
l
s
l
s
l
j
j
s
l
j
2
)
(
)
2
2
2
2
)}
1
(
)
1
(
)
1
(
{
2
1
,
,
ˆ
ˆ
ˆ
|
,
,
2
1
,
,
ˆ
ˆ
|
,
,
s
s
l
l
j
j
s
l
j
s
l
j
s
l
j
s
l
j
s
l
j
|
|
l
s
)}
1
(
)
1
(
)
1
(
{
2
1
,
,
s
s
l
l
j
j
hcA
E
j
s
l
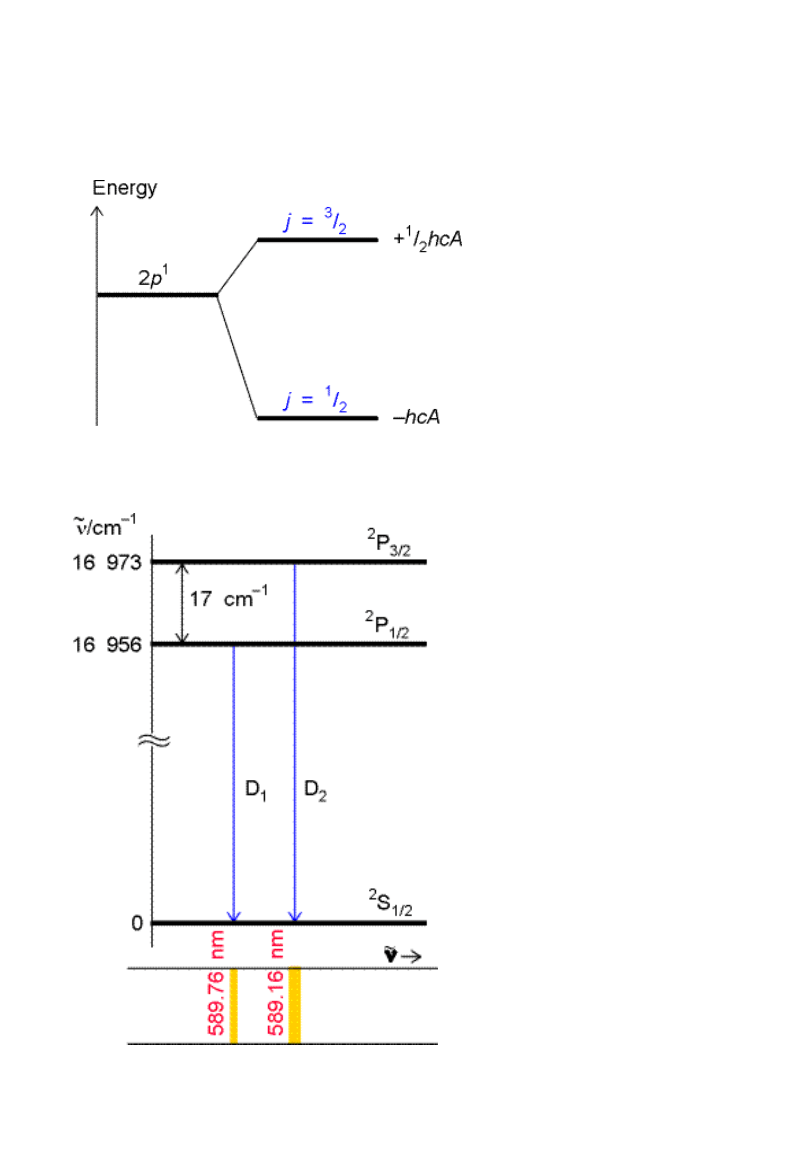
Sprzężenie spinowo-
orbitalne
Struktura
subtelna
widma:
dublet linii
sodu

Symbole termów
Informacja o całkowitym
orbitalnym momencie pędu L,
multipletowości (2S+1), oraz
całkowitym momencie pędu J dla
danej konfiguracji elektronowej
(konfiguracja
elektronowa)
2S+1
L
J
Liczba kwantowa całkowitego
orbitalnym momencie pędu L:
L = l
1
+l
2
, l
1
+l
2
-1,…,| l
1
-l
2
|L
0
S
1
P
2
D
3
F
4
G
5
H
Symbole termów
Multipletowość termu ma
wartość 2S+1
S = s
1
+s
2
, s
1
+s
2
-1,…,| s
1
-s
2
|
Pojedyńczy elektron - dublet,
np [Ne]3s
1
,
[Ne]3p
1
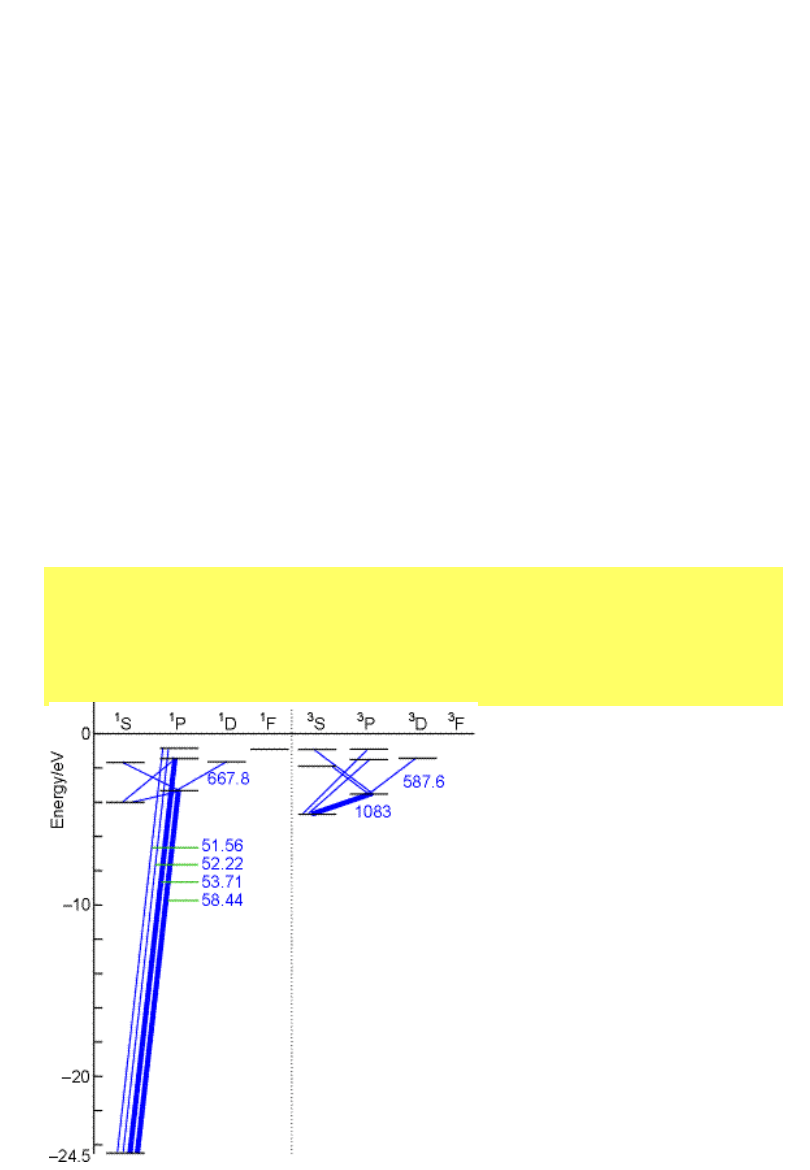
Symbole termów
Całkowity moment pędu J:
Sprzężenie Russela-Saundersa
L = l
1
+l
2
, l
1
+l
2
-1,…,| l
1
-l
2
|
Dla cięższych atomów -
sprzężenie jj
0)
0
wyj.
(z
1
0,
1
1
0,
0
J
J
J
l
L
S
Reguły wyboru:

Wpływ pola
magnetycznego
l
e
z
m
e
e
m
e
2
e
B
B
l
e
z
m
e
m
m
e
2
2
Energia momentu
magnetycznego w polu
magnetycznym B:
B
E
z
B
M
E
B
m
E
L
B
M
l
B
m
L
l
lub
Dla momentu spinowego:
s
e
e
z
m
g
...
002319
.
2
e
g
B
M
g
E
B
m
g
E
S
B
e
M
s
B
e
m
s
s
lub
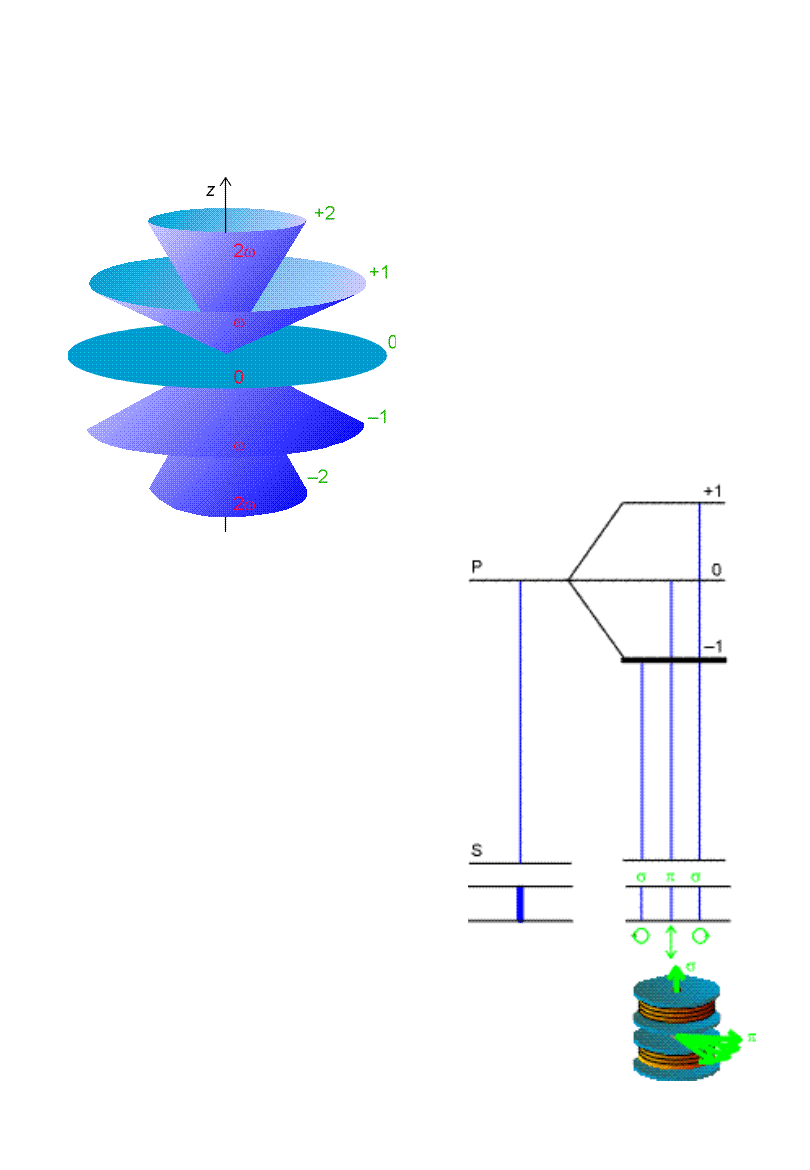
Efekt Zeemana
B
m
E
l
B
m
l
Document Outline
- Struktura atomów wieloelektronowych
- Równanie Schrödingera dla N-elektronowego atomu
- Przybliżenie jednoelektronowe
- Zakaz Pauliego
- Slide 5
- Metoda wariacyjna
- Slide 7
- Metoda pola samouzgodnionego
- Slide 9
- Stany singletowe i trypletowe
- Slide 11
- Konfiguracja elektronowa
- Slide 13
- Okresowość właściwości chemicznych
- Sprzężenie spinowo-orbitalne
- Slide 16
- Slide 17
- Symbole termów
- Slide 19
- Slide 20
- Wpływ pola magnetycznego
- Efekt Zeemana
Wyszukiwarka
Podobne podstrony:
Wykład Chemia kwantowa 11
Wykład Chemia kwantowa 2
Wykład Chemia kwantowa (3)
Wykład Chemia kwantowa 3 i 4
Wykład Chemia kwantowa (2)
Wykład Chemia kwantowa 7
Wykład Chemia kwantowa 11
Wykład 9 CHEMIA ORGANICZNA
Zakres materiału obowiązujący na II kolokwium wykładowe, Chemia ogólna i nieorganiczna, giełdy
WYKŁAD 1 chemia, Chemia
wykłady chemia sem 1
Rzeczy których nie ma u piegusa wykład chemia( 02 2014
WYKŁAD chemia gips
więcej podobnych podstron