
Związki chemiczne
Związki chemiczne
–
–
klasyfikacja,
klasyfikacja,
nomenklatura,
nomenklatura,
otrzymywanie
otrzymywanie
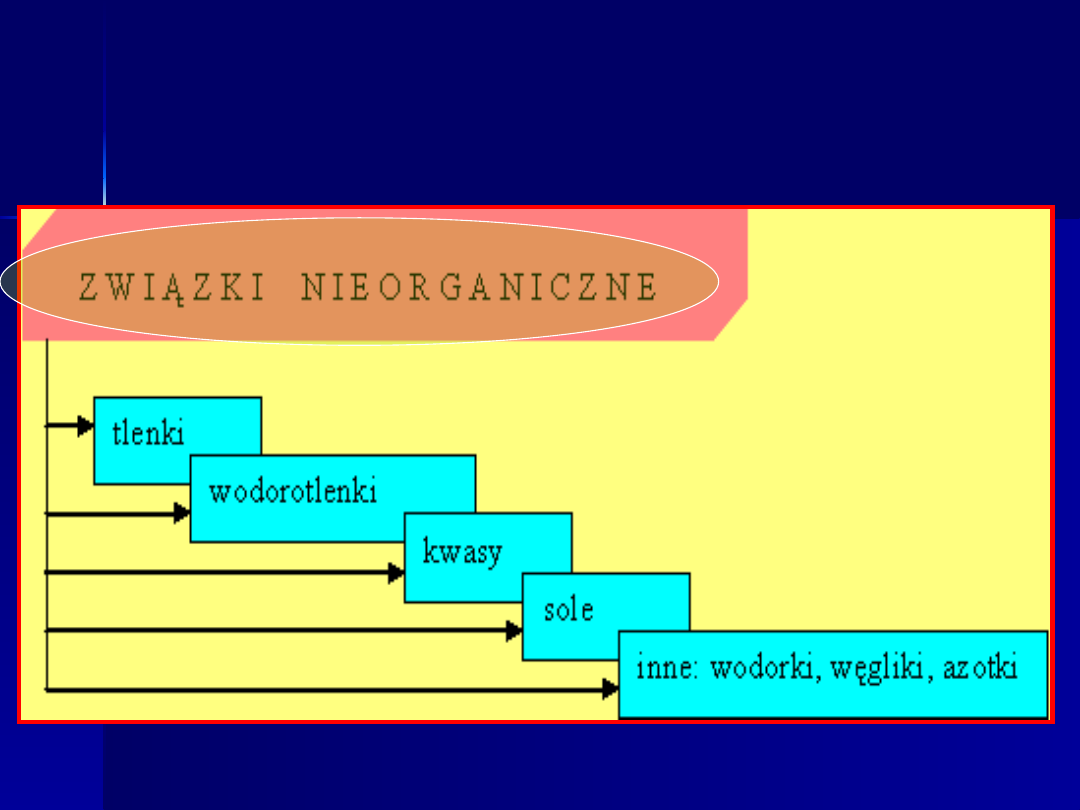
Podział związków
Podział związków
nieorganicznych
nieorganicznych
Tlenki
Tlenki
Przykłady:
Przykłady:
CO, CO
CO, CO
2
2
, Fe
, Fe
2
2
O
O
3
3
,
,
Al
Al
2
2
O
O
3
3
, NO, MnO
, NO, MnO
2
2
związki chemiczne tlenu z
innymi pierwiastkami o
wzorze X
n
O
m
ustalanym
metodą krzyżową

Metoda krzyżowa
Metoda krzyżowa

Podział tlenków
Podział tlenków
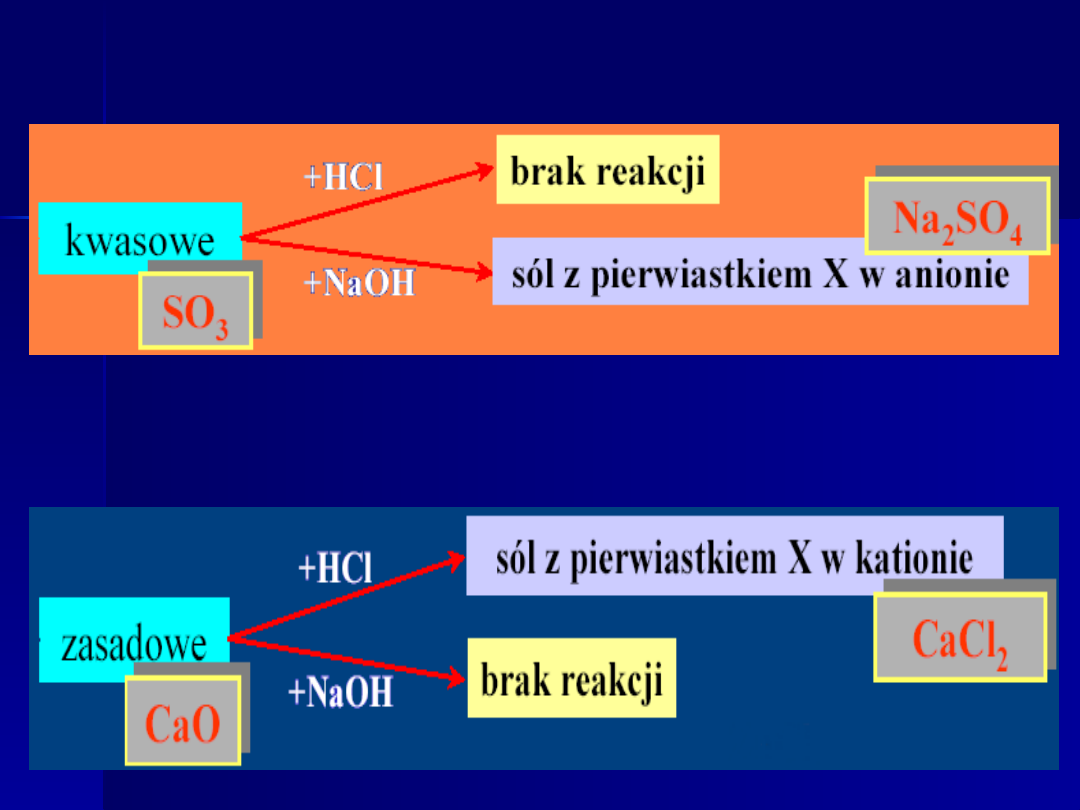
Tlenki kwasowe
Tlenki kwasowe
Tlenki zasadowe
Tlenki zasadowe
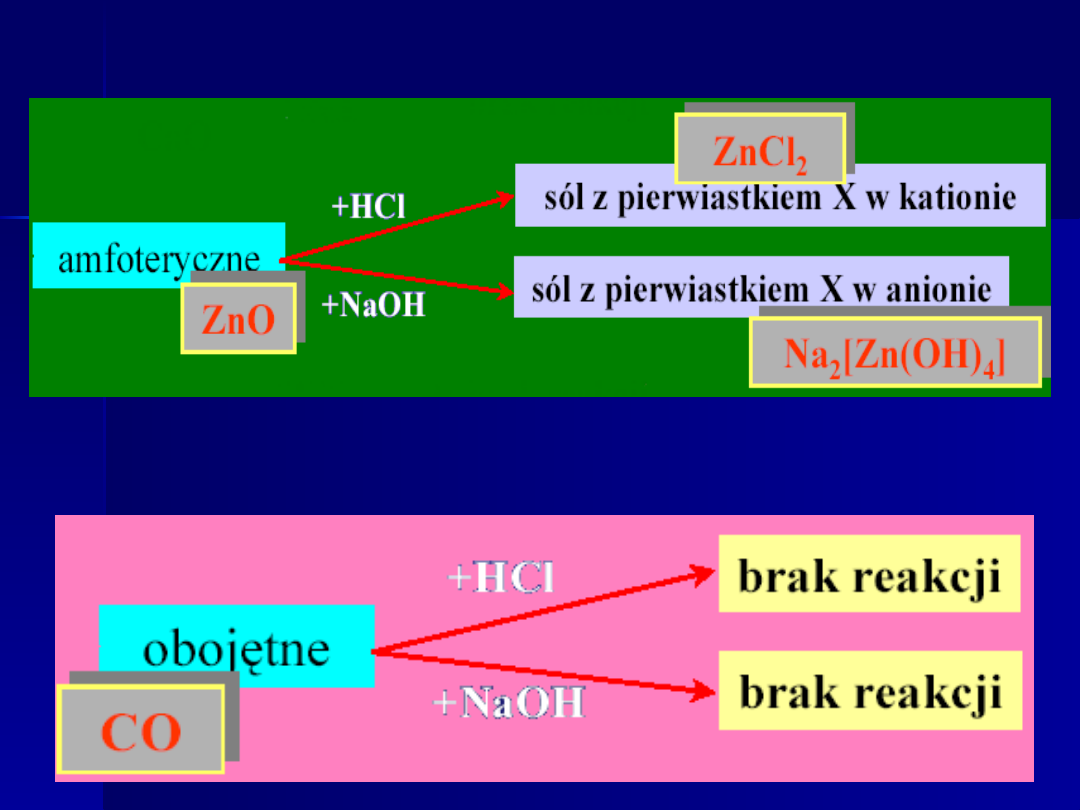
Tlenki kwasowe
Tlenki kwasowe
Tlenki kwasowe
Tlenki kwasowe

Otrzymywanie
Otrzymywanie
o
utlenianie
pierwiastków
S + O
2
→ SO
2
o
utlenianie niższych
tlenków
2CO + O
2
→ 2CO
2
o
odtlenianie
wyższych
tlenków:
Fe
2
O
3
+ C → 2FeO +
CO
o
rozkład tlenków:
N
2
O
3
→ NO + NO
2
o
rozkład
wodorotlenków
Fe(OH)
2
→ FeO +
H
2
O
o
termiczny rozkład
soli
CaCO
3
→ CaO + CO
2
o
utlenianie
związków
organicznych
CH
4
+ 2O
2
→
CO
2
+ 2H
2
O

Podstawowe tlenki
Podstawowe tlenki
CO
–
tlenek węgla: bezbarwny,
pozbawiony zapachu gaz, silnie
toksyczny, otrzymywany w reakcji
Boudouarda:
CO
2
–
dwutlenek węgla: bezbarwny gaz, bez
zapachu, nie podtrzymujący palenia,
toksyczny przy zawartości w powietrzu >
10%, słabo rozpuszczalny w wodzie,
otrzymywany poprzez spalanie węgla i
termiczny rozkład soli:
C + O
2
= CO
2
CaCO
3
= CaO +
CO
2

Podstawowe tlenki
Podstawowe tlenki
N
2
O
- tlenek azotu (I): bezbarwny, bezwonny
gaz o działaniu narkotycznym ( Zabójcza
broń II), podtrzymujący palenie
SiO
2
- ditlenek krzemu: jeden z najbardziej
rozpowszechnionych związków na Ziemi
piasek
NO
2
-
tlenek azotu (IV): brunatny, silnie
toksyczny gaz o ostrym zapachu ulegający
dimeryzacji w temperaturze <100°
:

Podstawowe tlenki
Podstawowe tlenki
Al
2
O
3
-
tlenek glinu: ciało stałe, nierozpuszczalne
w wodzie, o temp. topnienia >2000°C. w
przyrodzie występuje jako minerał korund o
wysokiej twardości (z domieszkami Cr
2
O
3
lub TiO
2
znany jest jako rubin i szafir), otrzymywanie:
Al(OH)
3
= Al
2
O
3
+ H
2
O
tlenek o właściwościach amfoterycznych

Podstawowe tlenki
Podstawowe tlenki
H
2
O
– tlenek wodoru –
woda: bezbarwna ciecz, bez
zapachu, 3 stany skupienia, t. top.
0°C, t. wrz. 100°C

Nadtlenki
Nadtlenki
związki zawierające jon nadtlenkowy
(O-
O)
2-
(wartościowość tlenu:
-1
np.
K
2
O
2
,
H
2
O
2
) zastosowanie w łodziach
podwodnych do oczyszczania powietrza z
CO
2
, utleniacze
Ponadtlenki
Ponadtlenki
związki zawierające
jon ponadtlenkowy
(O-O)
-
(wartościowość tlenu:
-0,5
np.
KO
2
), silne
utleniacze

Wodorotlenki
Wodorotlenki
związki chemiczne zbudowane z
kationów metali i anionów
wodorotlenkowych OH
-
o wzorze:
n
n
OH
Me
)
(
Me - metal, n – wartościowość
metalu
przykłady:
NaOH, Fe(OH)
3
, Mg(OH)
2
,
Ca(OH)
2
, Cu(OH)
2
, Al(OH)
3

Otrzymywanie
Otrzymywanie
reakcja metalu aktywnego
(z grupy litowców i berylowców) z wodą
2Li + 2H
2
O = 2LiOH + H
2
2Na + 2H
2
O = 2NaOH + H
2
reakcja tlenku litowca lub berylowca z wodą
Na
2
O + H
2
O = 2NaOH
CaO + H
2
O = Ca(OH)
2
reakcja dobrze rozpuszczalnej soli
z innym wodorotlenkiem
Pb(NO
3
)
2
+ NaOH = 2NaNO
3
+ Pb(OH)
2
↓

Podział wodorotlenków
Podział wodorotlenków
Wodorotlenki, których wodne
roztwory mają odczyn zasadowy
nazywamy wodorotlenkami
zasadowymi lub zasadami

Nazewnictwo
Nazewnictwo
nazwy wodorotlenków są dwuwyrazowe:
wodorotlenek i nazwa metalu, po
nazwie metalu podaje się w nawiasie
jego wartościowość
(gdy metal ma jedną wartościowość,
wówczas można ja w nazwie pominąć)
np.
Fe(OH)
2
– wodorotlenek żelaza (II),
Fe(OH)
3
– wodorotlenek żelaza (III),
NaOH – wodorotlenek sodu
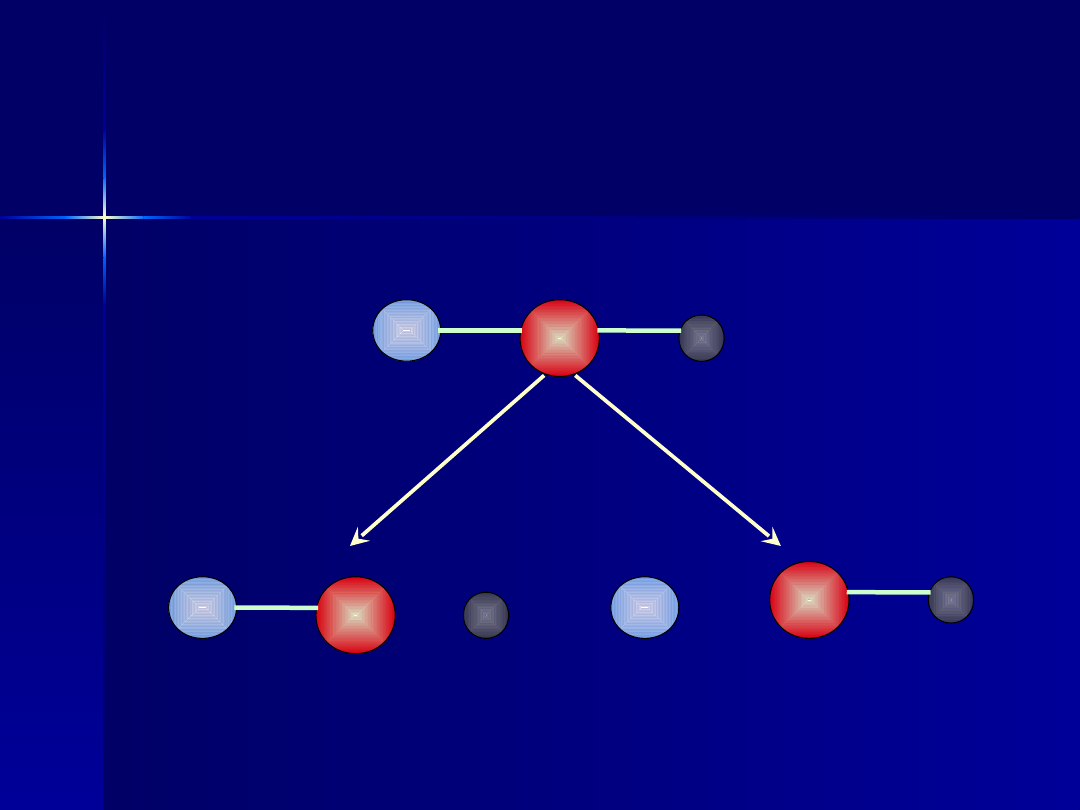
W każdym wodorotlenku lub kwasie
tlenowym istnieje ugrupowanie,
którego dysocjacja w roztworze
wodnym może zajść wg jednego ze
schematów:
X
O
H
X
X
O
O
H
H
E
1
< E
2
E
1
> E
2
Dysocjacja
kwasowa
Dysocjacja
zasadowa
E
1
E
2
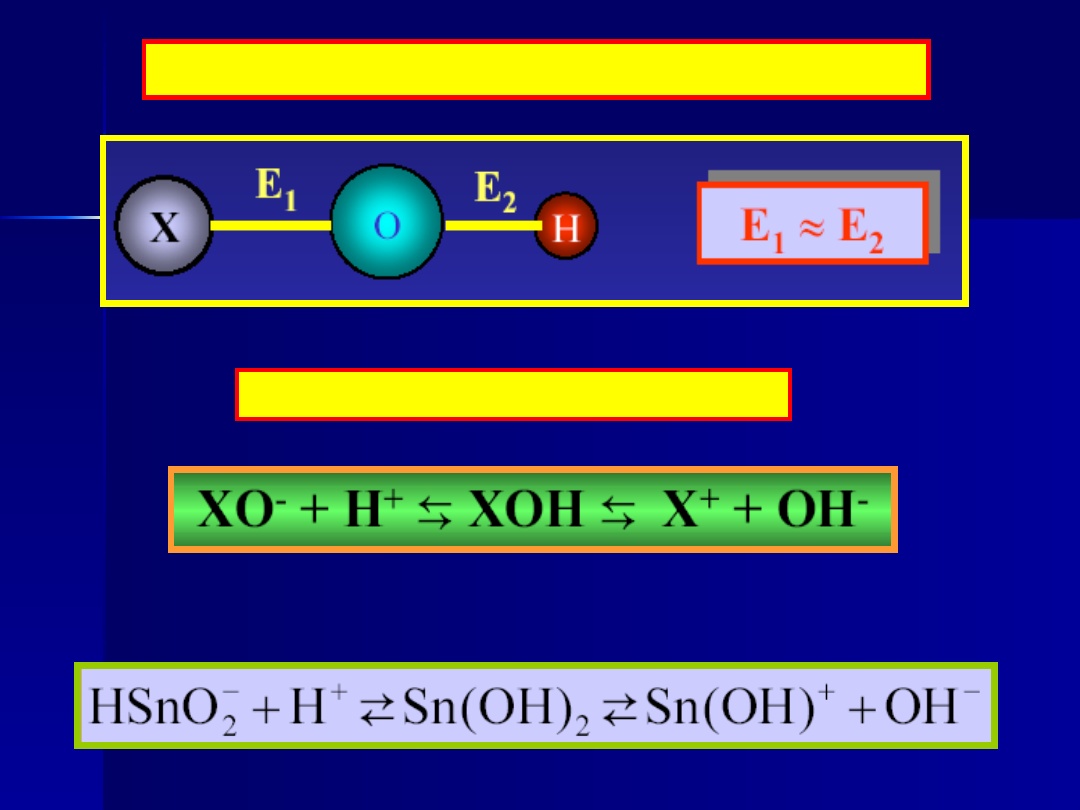
..dlatego istnieje równowaga:
Przykład:
W wodorotlenkach amfoterycznych:

Najważniejsze wodorotlenki
Najważniejsze wodorotlenki
litowców: np. LiOH, KOH, NaOH
-
silnie higroskopijne, bezbarwne ciała stałe,
wykazują dobrą rozpuszczalność w wodzie i
alkoholu C
2
H
5
OH, w stanie stałym wykazują
budowę jonową, w roztworach wodnych są
mocnymi zasadami
berylowców: np. Be(OH)
2
, Mg (OH)
2
,
Ca(OH)
2
- są ciałami stałymi, których
rozpuszczalność w wodzie jest stosunkowo
słaba, moc wodorotlenków rośnie w dół
grupy

Najważniejsze wodorotlenki
Najważniejsze wodorotlenki
pierwiastków bloku d: np. Cu(OH)
2
,
Zn(OH)
2
, Fe(OH)
3
, Fe(OH)
2
- praktyczny brak
rozpuszczalności w wodzie i dobra
rozpuszczalność w mocnych kwasach
tlenowych, większość wodorotlenków tego typu
powinna być uważana za uwodnione tlenki
Me
x
O
y
·nH
2
O, gdzie n zależy od warunków
otrzymywania, żaden z wodorotlenków tej grupy
nie tworzy struktur jonowych
pierwiastków bloku p: Al(OH)
3
, Pb(OH)
2
,
Sn(OH)
4
- białe substancje stałe, praktycznie
wszystkie są amfoteryczne i przy rozpuszczaniu
w mocnych zasadach tworzą jony kompleksowe
zawierające grupy wodorotlenkowe:
Na
2
[Sn(OH)
4
]

Kwasy
Kwasy
przykłady:
HCl, HF, H
2
SO
4
, H
2
CO
3
, H
3
PO
4
,
HNO
3
, HBr, H
2
S
2
O
7
związki chemiczne zbudowane z
atomów wodoru i atomów
wchodzących w skład reszty
kwasowej:
H
n
R
R - reszta kwasowa, n - liczba atomów
wodoru

Nazewnictwo
Nazewnictwo
kwasy beztlenowe
nazwa dwuwyrazowa: kwas i rdzeń nazwy
pierwiastka będącego resztą kwasową z
końcówką -wodorowy
Przykłady:
HCl
(aq)
– kwas chlorowodorowy
HF
(aq)
– kwas fluorowodorowy

Nazewnictwo
Nazewnictwo
kwasy tlenowe
nazwa dwuwyrazowa: kwas i nazwa pierwiastka
kwasotwórczego w formie przymiotnikowej wraz z jego
stopniem utlenienia, gdy stopień ten jest identyczny
dla kilku kwasów tego samego pierwiastka, to do
drugiej części nazwy dodaje się przedrostki: orto-,
meta-,
kwasy zawierające kilka atomów pierwiastka
niemetalu w cząsteczce mają przed nazwą tegoż
pierwiastka
przedrostki di-, tri-
HNO
2
– kwas azotowy (III), HNO
3
– kwas azotowy (V),
HPO
3
– kwas metafosforowy (V), H
3
PO
4
– kwas
ortofosforowy (V), H
2
S
2
O
7
– kwas disiarkowy (VI)
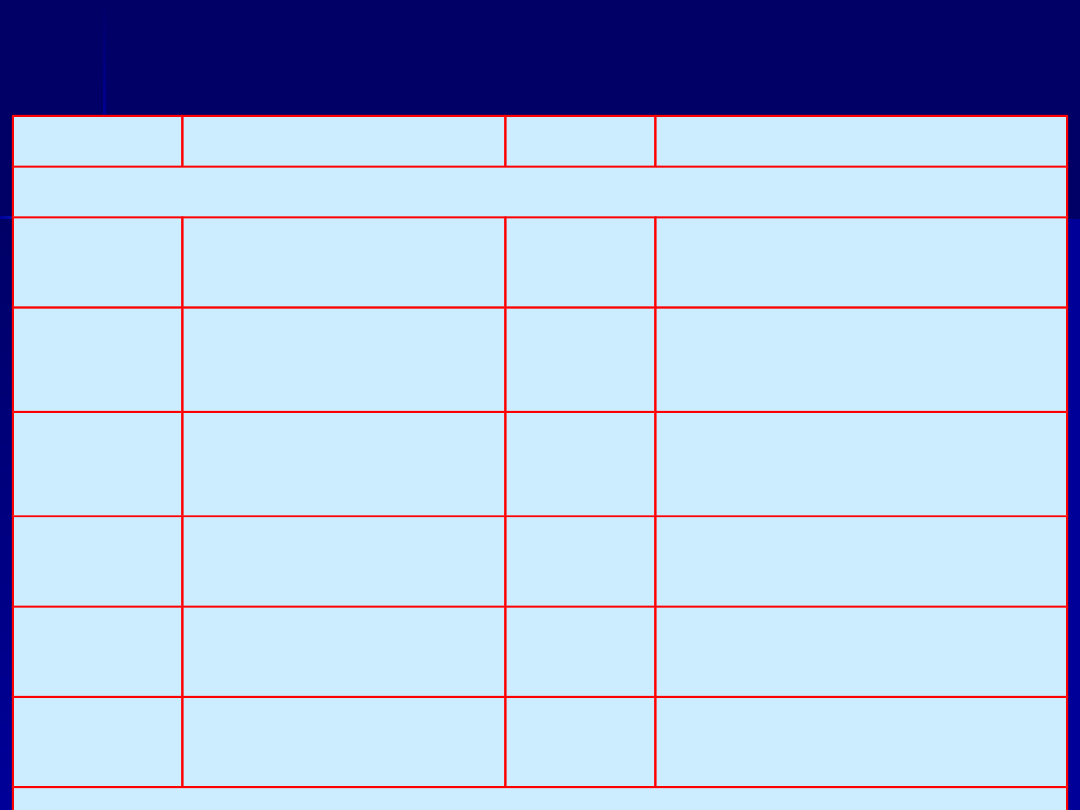
Przykłady
Przykłady
Wzór
Nazwa
Wzór
Nazwa
Tlenowe
H
3
BO
3
kwas
ortoborowy
HClO
4
kwas chlorowy (VII)
HBO
2
kwas
metaborowy
H
2
CrO
4
kwas chromowy (VI)
H
2
CO
3
kwas węglowy
H
2
Cr
2
O
7
kwas dwuchromowy
(VI)
HClO
kwas chlorowy
(I)
H
2
SO
4
kwas siarkowy (VI)
HClO
2
kwas chlorowy
(III)
H
2
SO
3
kwas siarkowy (IV)
HClO
3
kwas chlorowy
(V)
H
2
S
2
O
3
kwas tio (-II)
siarkowy (VI)
Beztlenowe
HF
(aq)
kwas
fluorowodorow
y
HI
(aq)
kwas jodowodorowy
HBr
(aq)
kwas
bromowodorow
y
H
2
S
(aq)
kwas
siarkowodorowy
aq - wodne roztwory substancji gazowych

Otrzymywanie
Otrzymywanie
reakcje niektórych tlenków niemetali z
wodą
SO
2
+ H
2
O = H
2
SO
3
reakcje mocnego kwasu z solą kwasu
słabszego
H
2
SO
4
+ 2CH
3
COONa → 2CH
3
COOH +
Na
2
SO
4
reakcje mocnego kwasu z solą kwasu
trudnorozpuszczalnego
Na
2
SiO
3
+ H
2
SO
4
→ H
2
SiO
3
↓ +
Na
2
SO
4
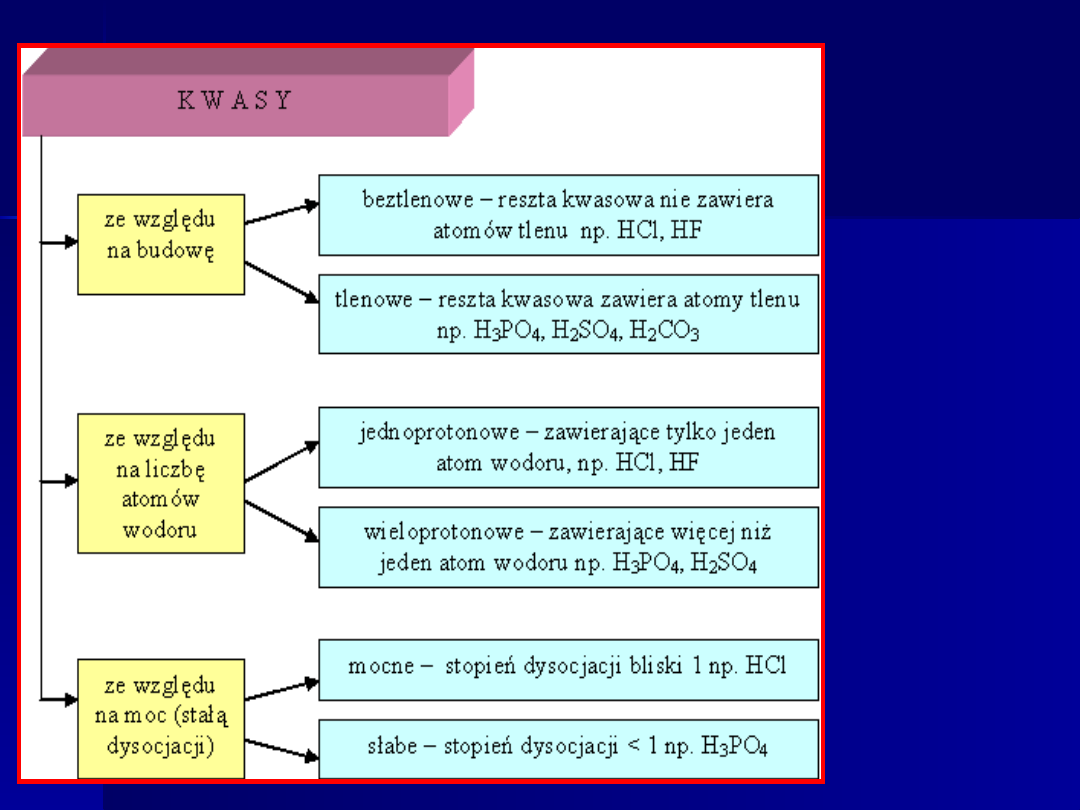
Podział
Podział
kwasów
kwasów

Definicje kwasów i zasad
Definicje kwasów i zasad
definicja Arrheniusa
Kwasami H
n
R
nazywamy
substancje, które w roztworach
wodnych dysocjują na jony
wodorowe H
+
i aniony reszt
kwasowych H
n-x
R
x-

Definicje kwasów i zasad
Definicje kwasów i zasad
definicja Arrheniusa
Zasadami Me(OH)
n
nazywamy
substancje, które w roztworach
wodnych dysocjują na kationy
metali Me
n+
(lub jony [Me(OH)
n-
x
]
x+
) i aniony wodorotlenkowe
OH
-

Definicje kwasów i zasad
Definicje kwasów i zasad
1923 - definicja Brönsteda (Dania)
i Lowry’ego (Anglia)
Kwasem
jest substancja (lub
jon), która w reakcji
dostarcza proton (jest
donorem protonu
)

Definicje kwasów i zasad
Definicje kwasów i zasad
1923 - definicja Brönsteda (Dania)
i Lowry’ego (Anglia)
Zasadą
jest substancja (lub
jon), która w reakcji pobiera
proton (jest
akceptorem
protonu
)
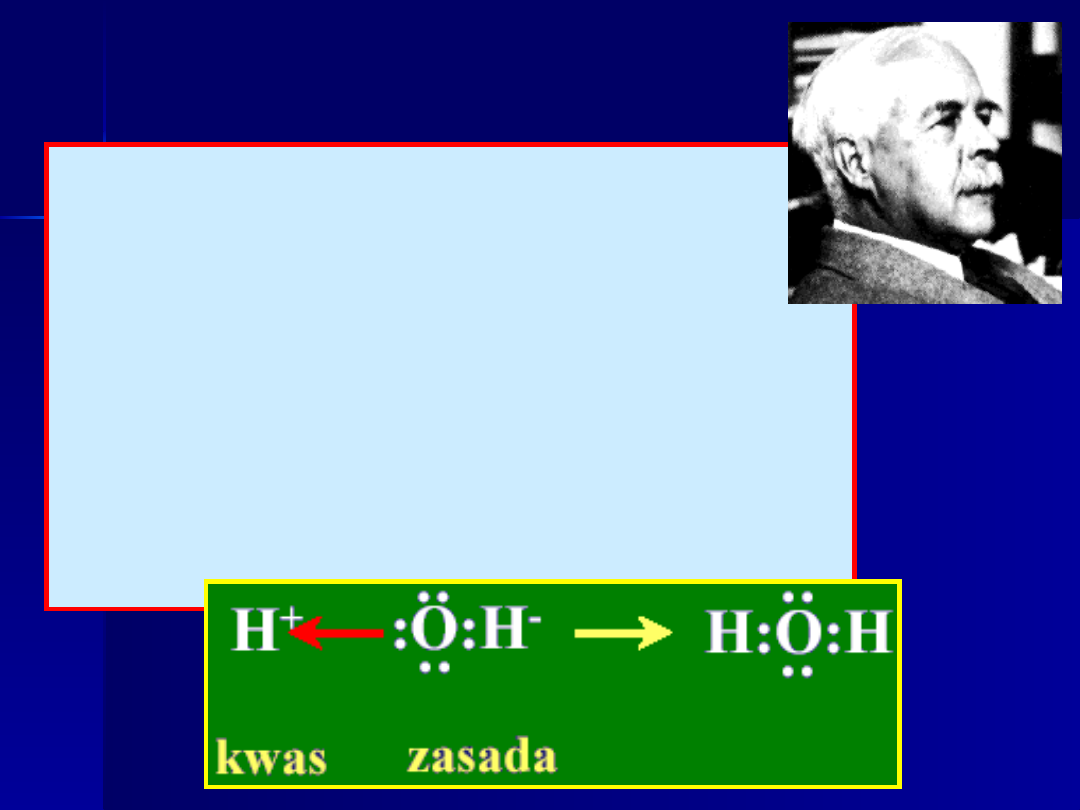
Definicje kwasów i
Definicje kwasów i
zasad
zasad
1938 - definicja Lewisa (USA)
KWAS
– jon, atom lub substancja,
która jest akceptorem pary
elektronowej
ZASADA
- jon, atom lub substancja,
która jest donorem pary
elektronowej
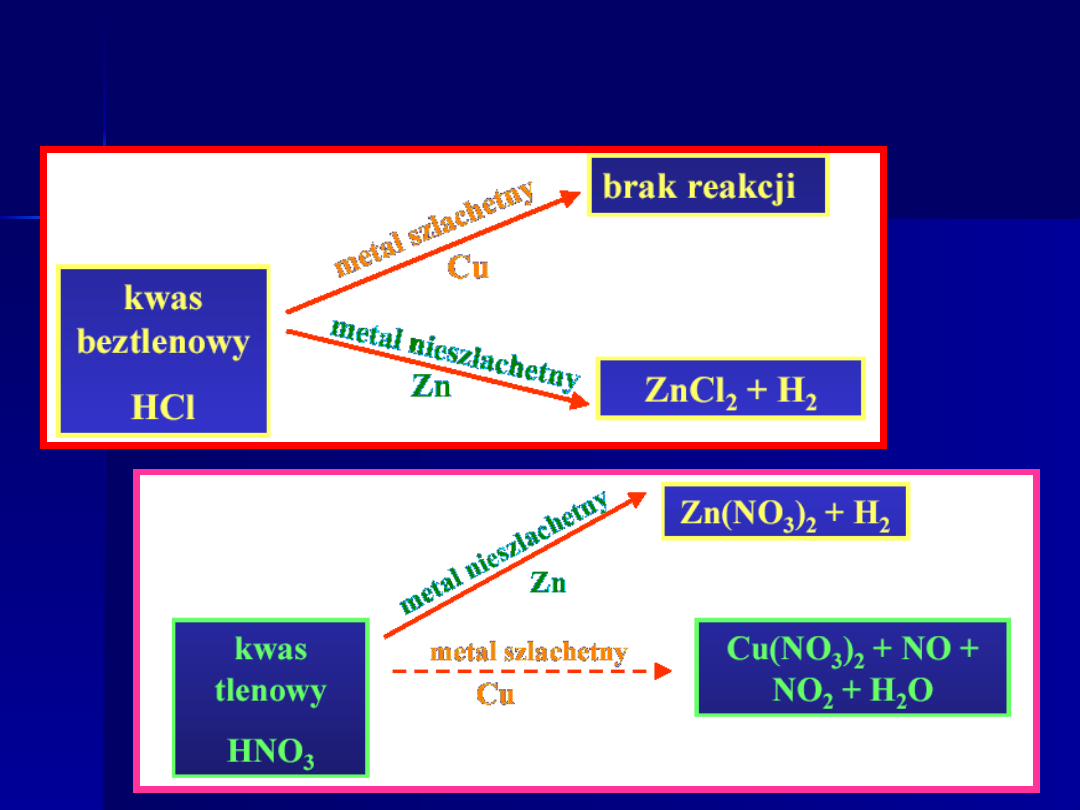
Reakcje kwasów z metalami
Reakcje kwasów z metalami

Szereg, w którym ustawiono
metale w kolejności
wzrastającej szlachetności
nosi nazwę
SZEREGU
NAPIĘCIOWEGO METALI
Au, Ag, Cu - w reakcji z kwasami nie wypierają wodoru
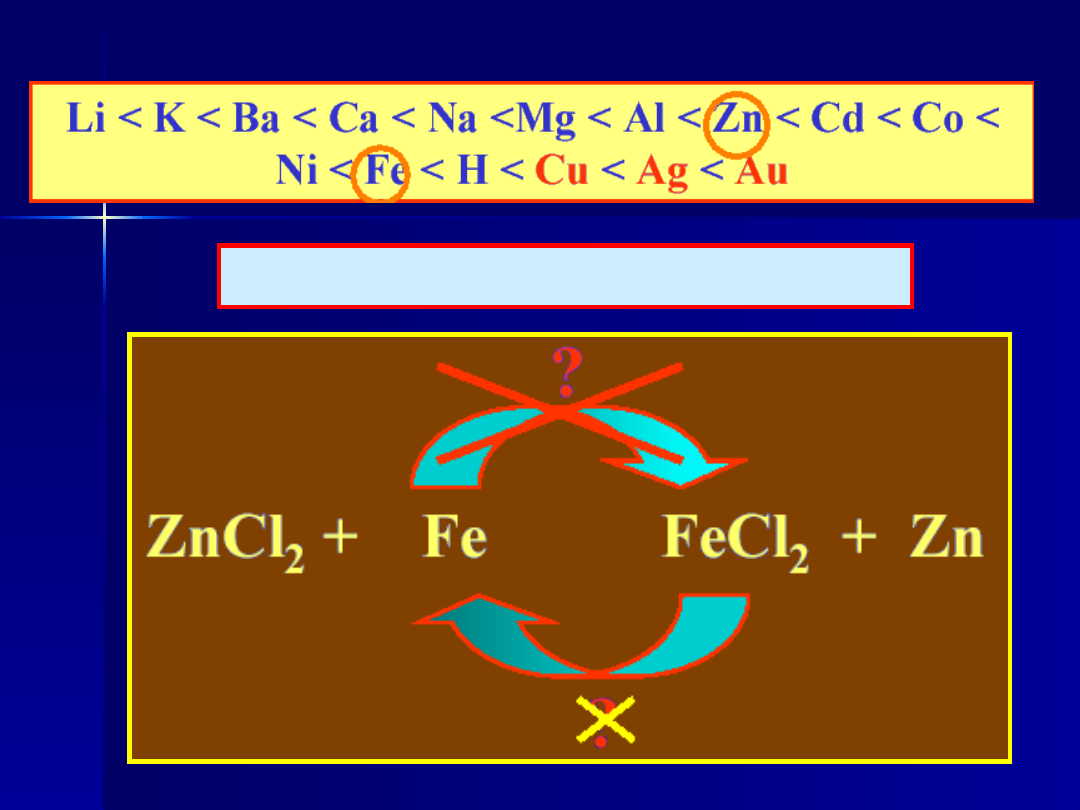
w którą stronę zajdzie reakcja
?
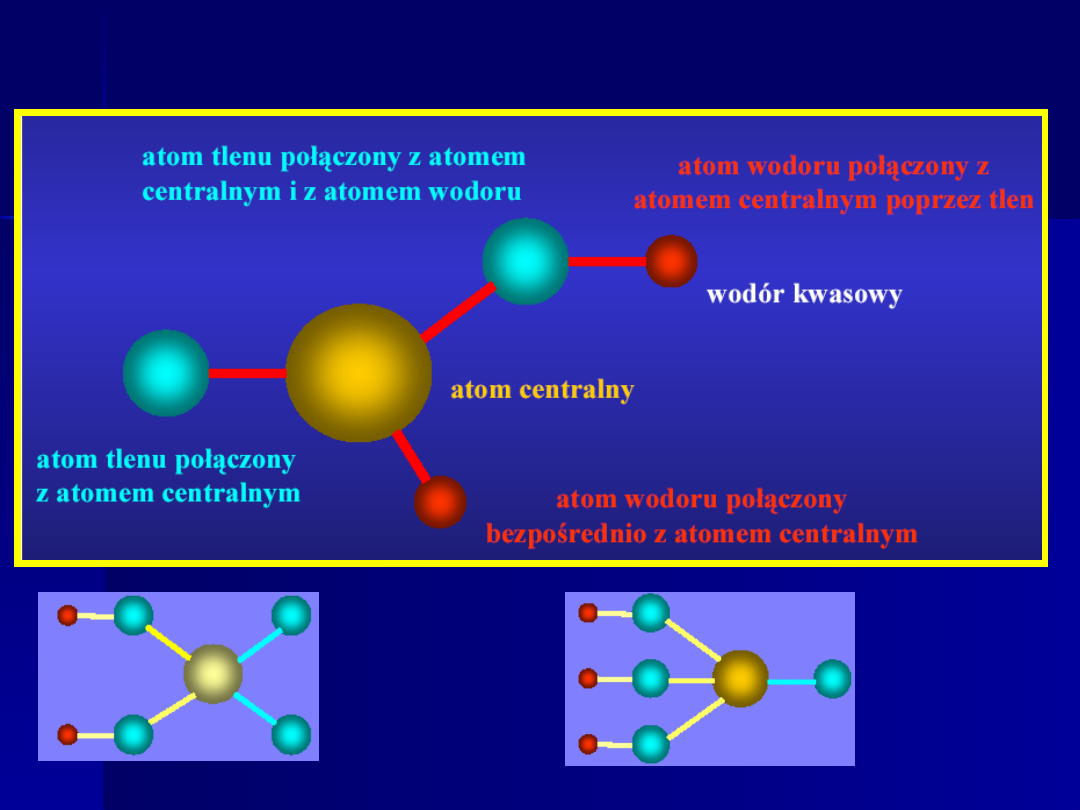
KWASY TLENOWE - budowa
KWASY TLENOWE - budowa
H
2
SO
4
H
3
PO
4

Przykłady kwasów
Przykłady kwasów
siarkowy (VI)
- bezbarwna, silnie higroskopijna,
oleista ciecz o właściwościach utleniających
chlorowy(VII)
- bezbarwna ruchliwa ciecz o
temperaturze topnienia –112°C, jest najmocniejszy ze
wszystkich znanych kwasów i jest silnym utleniaczem
azotowy(V)
- bezbarwna ciecz mieszająca się z
wodą w każdym stosunku, ulegająca powolnemu
rozkładowi, posiada silne właściwości utleniające,
stężony HNO
3
zmieszany z HCl (3 części HCl + 1
część
HNO
3
)
tworzy
tzw.
wodę
królewską
rozpuszczającą metale szlachetne (Au, Pt, Pd)

Sole
Sole
związki jonowe zbudowane z kationów
metali i anionów reszty kwasowej o
wzorze:
n
m
n
m
R
Me
przykłady:
NaNO
3
, Fe
2
(SO)
3
, MgSO
4
, CaCl
2
, Hg
2
S,
NH
4
NO
3,
Fe
3
(PO
4
)
2
Me kation prosty metalu: Na
+
lub kation złożony:
NH
4+
,
R – anion reszty kwasowej, n, m – indeksy
stechiometryczne

Nazewnictwo
Nazewnictwo
nazwy są dwuwyrazowe: pierwszy człon określa resztę
kwasową, drugi nazwę metalu i wartościowość:
sole kwasów tlenowych
- nazwa reszty kwasowej z
końcówką
–an, np. NaNO
3
azotan (V) sodu, NaNO
2
azotan (III) sodu,
NaClO
3
– chloran (V) sodu, Mg
3
(PO
4
)
2
– ortofosforan (V)
magnezu
sole kwasów beztlenowych
- nazwa reszty kwasowej z
końcówką –ek, np. Na
2
S – siarczek sodu, FeCl
3
- chlorek
żelaza (III), FeCl
2
- chlorek żelaza (II)
wodorosole
- przedrostek wodoro- dodaje się przed
nazwę reszty kwasowej i przedrostek di-, tri- (atomów
wodoru >1), np. NaHCO
3
– wodorowęglan sodu
hydroksosole
– nazwa reszty kwasowej i dalej
wodorotlenek oraz nazwa kationu, np. Ca(OH)Cl – chlorek
wodorotlenek wapnia
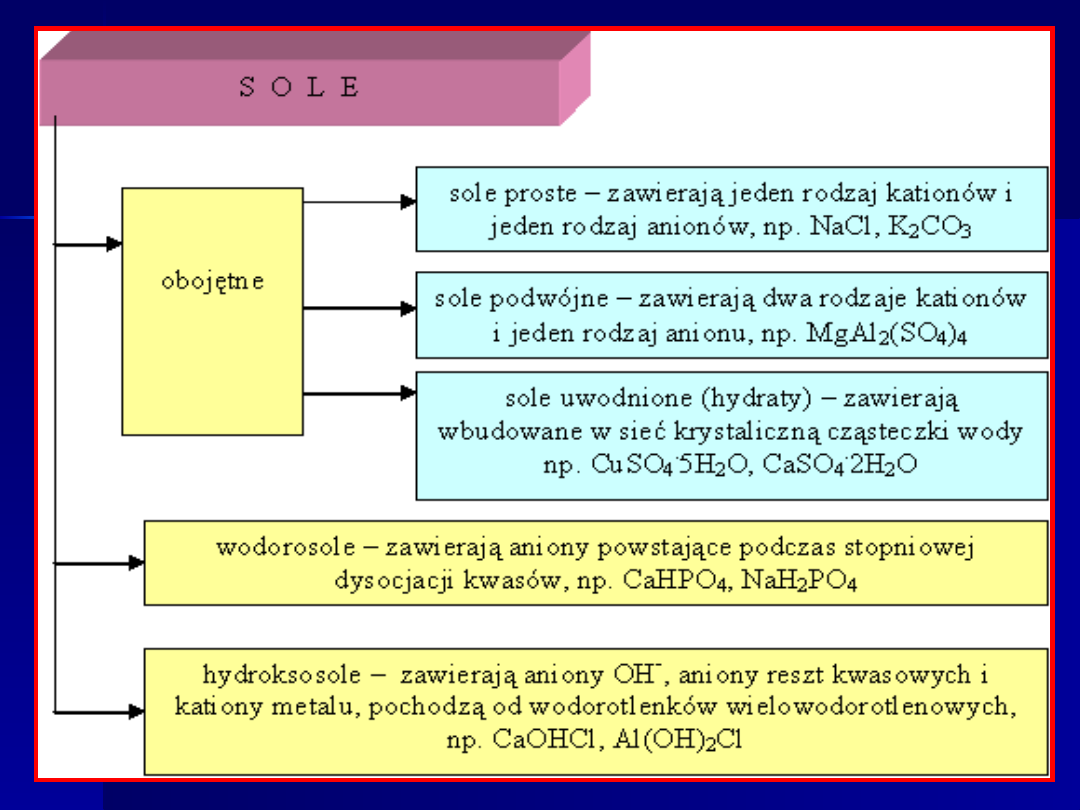
Podział
soli

Otrzymywanie
Otrzymywanie
reakcja dwóch wodnych roztworów substancji
jonowych
AgNO
3
+ HCl = AgCl↓ + HNO
3
reakcja zobojętniania kwasem:
NaOH + HCl = NaCl + H
2
O
reakcja tlenku zasadowego z kwasem:
NaO + HNO
3
= NaNO
3
+ H
2
O
reakcja metalu aktywnego z kwasem:
Zn + H
2
SO
4
= ZnSO
4
+ H
2
reakcja tlenku kwasowego tlenkiem z zasadowym:
PbO + SiO
2
= PbSiO
3
reakcja tlenku kwasowego z wodorotlenkiem:
Ba(OH)
2
+ CO
2
= BaCO
3
+ H
2
O
reakcja metalu z niemetalem:
2Cu + S = Cu
2
S
reakcje wymiany pomiędzy solami:
BaS + ZnSO
4
= BaSO
4
+ ZnS

Sole są bardzo rozpowszechnione
w przyrodzie, są stosowane jako
nawozy sztuczne, materiały
budowlane, reagenty w przemyśle
spożywczym, kosmetycznym i
farmaceutycznym.
Przykłady często stosowanych soli
sól kuchenna – NaCl, sól gorzka – MgSO
4
.
7H
2
O, soda
oczyszczona – NaHCO
3
, sól glauberska –
Na
2
SO
4
.
10H
2
O, lapis – AgNO
3
, anhydryt – CaSO
4
, gips
krystaliczny – CaSO
4
.
2H
2
O, saletra indyjska – KNO
3
,
saletra chilijska NaNO
3
, saletra amonowa – NH
4
NO
3
,
fosforyt – Ca
3
(PO
4
)
2

Azotki
Azotki
pochodne amoniaku, połączenia
metali z niemetalem
nazwa dwuczłonowa:
azotek + nazwa metalu
przykłady:
Ba
3
N
2
– azotek baru
GaN – azotek galu
Li
3
N – azotek litu

Węgliki
Węgliki
związki węgla z metalami i
niemetalami o elektroujemności
mniejszej niż elektroujemność
węgla
nazwa dwuczłonowa:
węglik + nazwa
metalu/niemetalu
przykłady:
SiC – węglik krzemu, TiC – węglik
tytanu, Al
4
C
3
– węglik glinu, B
4
C –
węglik boru

Wodorki
Wodorki
połączenia chemiczne wodoru z innymi
pierwiastkami o wzorze:
H
n
E
(n)
– wodorki pierwiastków grup 16 i 17
układu okresowego, nazwa dwuczłonowa:
nazwa pierwiastka E z końcówką – ek + słowo:
wodoru, np. H
2
O – tlenek wodoru, H
2
S – siarczek
wodoru, HCl – chlorek wodoru (chlorowodór)
E
(n)
H
n
– wodorki pierwiastków grup 1 do 15
układu okresowego, nazwa dwuczłonowa:
wodorek + nazwa pierwiastka E lub nazwę
pierwiastka łączy się z wyrazem: wodór za
pomocą litery o, np. LiH – wodorek litu, NH
3
–
wodorek azotu, SiH
4
– krzemowodór, CH
4
-
metan
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
- Slide 40
- Slide 41
- Slide 42
- Slide 43
- Slide 44
- Slide 45
- Slide 46
Wyszukiwarka
Podobne podstrony:
Związki chemiczne produkty reakcji tlenków z wodą
Zasady nomenklatury związków chemicznych, Chemia
Zanieczyszczeniami gleb i gruntów są wszelkie związki chemiczne i pierwiastki promieniotwórczex
gr3, Elektroliza - proces rozkładu związków chemicznych i separacji produktów tego rozkładu pod wpły
Gimznazjum Sprawdziany Chemia Związki chemiczne w życiu codziennym test
Zwiazki chemiczne pierwistakow Nieznany
Pierwiastki i związki chemiczne a zanieczyszczenia środowiska
Barwniki fotosyntetyczne, Barwniki fotosyntetyczne (asymilacyjne) - barwne związki chemiczne odgrywa
Sprawozdanie 1 typy związków chemicznych
Związki chemiczne nazywane feromonami, Studia, 1-stopień, inżynierka, Ochrona Środowiska
Ćw 3 rozpuszczalność związków chemicznych
PIERWIASTKI I ZWIĄZKI CHEMICZNE
biofizyka, błony, Budowa i właściwości struktur biologicznych zależy nie tylko od właściwości związk
Metalurgia sciaga, Metalurgia - to nauka zajmująca się otrzymywaniem metali z rud, Ruda- utwory skal
Chemia labolatorium, Hydroliza2, Hydroliza - reakcja niektórych zwiazków chemicznych z wodą, która p
zwiazki chemiczne, IB, I rok, Fizykochemia materiałów, Lista Zadań
Związki chemiczne w składnikach pokarmowych w życiu codziennym
ocena ryzyka zwiazkow chemicznych dla organizmow ladowych rosliny ptaki i ssaki
Bufory krwi układy związków chemicznych rozpuszczobych w osoczu krwi, Biochemia
więcej podobnych podstron