
Reakcje chemiczne
i ich morfologia

Podziały reakcji chemicznych
Podziały reakcji chemicznych
- Układy bezrozpuszczalnikowe
bezrozpuszczalnikowe
-
reakcje pomiędzy czystymi
reagentami:
- HCl
(g)
+ NH
3 (g)
- S
(c)
+ O
2 (g)
- C
(s)
+O
2 (g)
- BaO
(s)
+ CO
2 (g)
- CaO
(s)
+ SiO
2(s)
- LiI
(s)
+ AgF
(s)
- .........

Podziały reakcji chemicznych
Podziały reakcji chemicznych
- W rozpuszczalnikach:
W rozpuszczalnikach:
- w roztworach wodnych:
HCl
(aq)
+ NaOH
(aq)
BaCl
2(aq)
+ H
2
SO
4(aq)
ZnCl
2(aq)
+ NH
3(aq)
,
- w ciekłym NH
3
:
NaNH
2(NH3)
+ NH
4
Cl
(NH3)
,
- acetonie,
- w stopionych solach,
- w ciekłym NO
2
,
- innych rozpuszczalnikach.

Podziały reakcji chemicznych
Podziały reakcji chemicznych
- Z punktu widzenia rodzaju faz
rodzaju faz
reagujących substratów i tworzących się
produktów : stałych
stałych
, ciekłych
ciekłych
, gazowych
gazowych
i ich kombinacji (
zarówno
pomiędzy czystymi reagentami jak i w rozpuszczalnikach
):
- w fazie stałej (
najczęściej w podwyższonej temperaturze
):
CaO
CaO
(s)
(s)
+ SiO
+ SiO
2 (s)
2 (s)
CaSiO
CaSiO
3 (s)
3 (s)
- w fazie gazowej:
N
N
2
2
(s)
(s)
+
+ 3H
3H
2
2
(g)
(g)
2NH
2NH
3
3
(g)
(g)
- w fazie ciekłej (
w roztworze wodnym
):
HF
HF
(aq)
(aq)
+
+
NaOH
NaOH
(aq)
(aq)
NaF
NaF
(aq)
(aq)
+ H
H
2
2
O
O
- w układach wielofazowych (
wiele kombinacji
):
2HCl
2HCl
(aq)
(aq)
+
+
CaCO
CaCO
3
3
(s)
(s)
CaCl
CaCl
2
2
(aq)
(aq)
+ CO
CO
2
2
(g)
(g)
+
H
H
2
2
O
O
(aq)
Ba(NO
Ba(NO
3
3
)
)
2
2
(aq)
(aq)
+
+ CO
CO
2
2
(g)
(g)
+
+
H
H
2
2
O
O
BaCO
BaCO
3
3
(s)
(s)
+ 2HNO
HNO
3
3
(aq)
itd.. ......
itd.. ......

Podziały reakcji chemicznych
Podziały reakcji chemicznych
- reakcje niekatalityczne
niekatalityczne
(
większość reakcji
kwasowo-zasadowych
w roztworach wodnych i fazie stałej
),
- reakcje katalityczne
katalityczne
(
(
utlenianie SO
2
, synteza NH
3
),
),
- reakcje fotochemiczne
fotochemiczne
- reakcje mechanochemiczne
mechanochemiczne
- reakcje radiochemiczne
radiochemiczne
- itd.. .....
- itd.. .....

Podziały reakcji chemicznych
Podziały reakcji chemicznych
- podziały ze względu na mechanizm
mechanizm
reakcji
(
reakcje w
chemii organicznej, chemii związków
kompleksowych
)
- mechanizm SN
SN
1
1
- mechanizm SN
SN
2
2

Podziały reakcji chemicznych
Podziały reakcji chemicznych
- Z punktu widzenia efektu energetycznego
efektu energetycznego
reakcji, dzielimy na:
- egzoenergetyczne (egzotermiczne)
egzoenergetyczne (egzotermiczne)
(
dodatni efekt cieplny, następuje
wydzielenie ciepła)
:
CO
CO
(g)
(g)
+
+ O
O
2
2
(g)
(g)
CO
CO
2
2
(g)
(g)
+
+ Q
Q
2 H
H
2
2
(s)
(s)
+
+ O
O
2
2
(g)
(g)
2
2 H
H
2
2
O
O
(g)
(g)
+
+ Q
Q
CaO
CaO
(s)
(s)
+
+ H
H
2
2
O
O
(c)
(c)
Ca(OH)
Ca(OH)
2 (s)
2 (s)
+
+ Q
Q
KClO
KClO
4 (s)
4 (s)
KCl
KCl
(s)
(s)
+ 2
+ 2O
O
2
2
g)
g)
+
+ Q
Q
- endoenergetyczne (endotermiczne)
endoenergetyczne (endotermiczne)
(
ujemny efekt cieplny, następuje
pochłonięcie ciepła)
:
CaCO
CaCO
3 (s)
3 (s)
CaO
CaO
(s)
(s)
+
+ CO
CO
2
2
(g)
(g)
-
- Q
Q

Podziały reakcji chemicznych
Podziały reakcji chemicznych
- Z punktu widzenia refektu energetycznego
refektu energetycznego
reakcji, dzielimy je na:
- egzoenergetyczne (egzotermiczne)
egzoenergetyczne (egzotermiczne)
(
dodatni efekt cieplny, nastepuje
wydzielenie ciepła)
:
CO
CO
(g)
(g)
+
+ O
O
2
2
(g)
(g)
CO
CO
2
2
(g)
(g)
+
+ Q
Q
2 H
H
2
2
(s)
(s)
+
+ O
O
2
2
(g)
(g)
2
2 H
H
2
2
O
O
(g)
(g)
+
+ Q
Q
CaO
CaO
(s)
(s)
+
+ H
H
2
2
O
O
(c)
(c)
Ca(OH)
Ca(OH)
2 (s)
2 (s)
+
+ Q
Q
KClO
KClO
4 (s)
4 (s)
KCl
KCl
(s)
(s)
+ 2
+ 2O
O
2
2
g)
g)
+
+ Q
Q
- endoenergetyczne (endotermiczne)
endoenergetyczne (endotermiczne)
(
ujemny efekt cieplny, nastepuje
pochłonięcie ciepła)
:
CaCO
CaCO
3 (s)
3 (s)
CaO
CaO
(s)
(s)
+
+ CO
CO
2
2
(g)
(g)
-
- Q
Q

Z punktu widzenia zmian strukturalnych
Z punktu widzenia zmian strukturalnych
dzielimy reakcje
dzielimy reakcje
na:
na:
- zewnątrzdrobinowe:
tworzenie, najczęściej w układach
jonowych,
makroskopowych związków
chemicznych: np.
wymiana jonowa w roztworach i w fazie
stałej
:
NaCl
NaCl
(aq)
(aq)
+ AgNO
+ AgNO
3 (aq)
3 (aq)
AgCl
AgCl
(s)
(s)
+
+
NaNO
NaNO
3
3
(aq)
(aq)
Na
Na
2
2
O
O
(s)
(s)
+ CaCO
+ CaCO
3 (s)
3 (s)
Na
Na
2
2
CO
CO
3
3
(s)
(s)
+
+
CaO
CaO
(s)
(s)
- wewnątrzdrobinowe
:
zmiana otoczenia walencyjnego rdzeni
centralnych drobin, przez oddanie lub związanie
elektronów lub ligandów: np. przemiana O
O
2-
2-
w
OH
OH
-
-
czy w H
H
2
2
O
O
lub w H
H
3
3
O
O
+
+
, lub SO
SO
4
4
2-
2-
w S
S
2-
2-
,
,
S
S
8
8
w
w
SO
SO
2
2
temp.

Podział z punktu widzenia przekształceń
Podział z punktu widzenia przekształceń
drobin:
drobin:
- kwasowo - zasadowe
- kwasowo - zasadowe
(
nie zmienia się e
v
pierwiastków w reagujących drobinach
):
H
2
O
(g)
+ Na
2
O
(s)
2NaOH
(s)
BF
3(g)
+ NaF
(s)
NaBF
4(s)
- utleniania - redukcji
utleniania - redukcji
(
zmienia się e
v
pierwiastków w
reagujących drobinach
):
2Na
(s)
+ Cl
2(g)
2NaCl
(s)
Te
(s)
+ O
2(g)
TeO
2(s)

Reakcje kwasowo - zasadowe
Reakcje kwasowo - zasadowe
- I grupa definicji
wiąże pojęcie
kwasu
kwasu
i
zasady
zasady z
substratami
reakcji kwasowo-zasadowej
- II grupa definicji
wiąże pojęcie
kwasu
kwasu
i
zasady
zasady z
przebiegiem
reakcji kwasowo-zasadowej
- III grupa definicji
wiąże pojęcie
reakcji
reakcji
kwasowo
kwasowo
-zasadowej
-zasadowej
z budową produktów:

I grupa definicji
wiąże pojęcie
kwasu
kwasu
i
zasady
zasady z
substratami
reakcji kwasowo-zasadowej którymi są związki zawierające
drobiny na jakie ulega autodysocjacji rozpuszczalnik.
-
definicja Arrheniusa:
definicja Arrheniusa:
odnosi się do reakcji
kwasowo-zasadowych przebiegających w roztworach
wodnych.
Zgodnie z autodysocjacją wody:
2H
2H
2
2
O H
O H
3
3
O
O
+
+
+ OH
+ OH
-
-
kwasem
jest roztwór wodny zawierający
jony
H
H
3
3
O
O
+
+
,
zasadą
zaś roztwór z jonami
OH
OH
-
-
,
,
przebieg
reakcji kwasowo-zasadowej
(
zobojętnienia
) ujmuje się równaniem:
H
H
3
3
O
O
+
+
+ OH
+ OH
-
-
2H
2H
2
2
O
O
Definicje kwasów i zasad
I grupa
definicji reakcji kwasowo-zasadowych:
-
definicja Franklina
definicja Franklina (rozpuszczalnikowa):
jest rozszerzeniem definicji Arrheniusa na inne
rozpuszczalniki, zarówno protonowe jak i bezprotonowe.
Kwasami
w ciekłym amoniaku
NH
3
w którym istnieje
równowaga:
2NH
3
0
NH
4
+
+ NH
2
-
będą jego roztwory zawierające jony
NH
4
+
,
zasadami
zaś zawierające
jony
NH
2
-
. Reakcje pomiędzy nimi odtwarzają cząsteczki amoniaku.
Kwasami
w NH
3
będą więc roztwory soli amonowych: NH
4
Cl,
(NH
4
)
2
SO
4
, itd..,
zasadami
będą amidki, np. NaNH
2
.
przebieg
reakcji kwasowo-zasadowej
(
zobojętnienia
)
ujmuje się równaniem:
NH
NH
4
4
+
+
+ NH
+ NH
2
2
-
-
2NH
2NH
3
3
Definicje kwasów i zasad
I grupa
definicji reakcji kwasowo-zasadowych:
-
definicja Franklina
definicja Franklina
(rozpuszczalnikowa): cd.
Kwasami
w innych rozpuszczalnikach będą roztwory
zawierające
kationy
autodysocjacji rozpuszczalnika,
zasadami
zaś zawierające
aniony
:
Kwasy
Kwasy
zasady rozpuszczalnik
zasady rozpuszczalnik
H
3
O
+
OH
-
H
2
O
NH
4
+
NH
2
-
NH
3
CH
3
COOH
2
+
CH
3
COO
-
CH
3
COOH
H
3
SO
4
+
HSO
4
-
H
2
SO
4
SO
2+
SO
3
2-
SO
2
H
2
F
+
F
-
HF
(podaj przykłady reakcji dla każdego z
rozpuszczalników)
Definicje kwasów i zasad

II grupa definicji
wiąże pojęcie
kwasu i zasady
z przebiegiem
reakcji kwasowo-zasadowej:
-
definicja Brönsteda
definicja Brönsteda (
dotyczy jedynie reakcji związanych
z przenoszeniem kationów wodorowych
H
+
):
Kwasami
Kwasami
wg tej definicji są
donory kationów wodorowych H
+
,
zasadami
zasadami
zaś ich
akceptory.
Reakcja pomiędzy gazowym chlorowodorem i amoniakiem:
NH
3(g
+
HCl
(g)
NH
4
Cl
(s)
NH
3
+
HCl
NH
4
+
+ Cl
-
bas
1
ac
2
ac
1
bas
2
Definicje kwasów i zasad
II grupa definicji
:
definicja Brönsteda
definicja Brönsteda
Przykłady reakcji:
ac
1
bas
1
bas
2
ac
2
CH
3
COOH
+ H
2
O
CH
3
COO
-
+
H
3
O
+
Definicje kwasów i zasad

II grupa definicji
reakcji kwasowo-zasadowych wiąże
pojęcie reakcji
z jej przebiegiem
:
- definicja
(Luxa-Flooda) lub (Gutmanna - Lindquista)
(Luxa-Flooda) lub (Gutmanna - Lindquista)
:
Kwasami
Kwasami
są związki zawierające drobiny będące donorami
kationów wodorowych
H
+
albo wiążące proste aniony:
F
-
, OH
-
, O
2-
, Cl
-
, S
2-
, ....,
zasadami
zasadami
zaś drobiny wiążące kationy
H
+
lub będące donorami prostych anionów:
Definicje kwasów i zasad
ac
ac
bas
bas
A
A
m-
m-
H
H
+
+
A
A
m-
m-
= F
-
, OH
-
, O
2-
, Cl
-
, S
2-
,

II grupa definicji
reakcji kwasowo-zasadowych wiąże
pojęcie reakcji
z jej przebiegiem
:
definicja
(Luxa-Flooda)
(Luxa-Flooda)
lub (Gutmanna - Lindquista)
lub (Gutmanna - Lindquista)
:
Definicje kwasów i zasad
Przykłady reakcji:
Zn(OH)
2 (s)
+ 2NaOH
aq
Na
2
Zn(OH)
4 (aq)
Zn(OH)
2
+ 2NaOH
Zn(OH)
4
2-
+
2Na
+
ac
1
bas
1
bas
2
ac
2
H
3
BO
3(aq)
+ NaOH
(aq)
NaB(OH)
4 (aq)
BF
3 (g)
+ NaF
(s)
NaBF
4 (s)
SO
3(g)
+ Na
2
O
(s)
Na
2
SO
4 (s)
PF
5(g)
+ NaF
(s)
NaPF
6 (s)

II grupa definicji
reakcji kwasowo-zasadowych wiąże
pojęcie reakcji
z jej przebiegiem
:
- definicja
Usanowicza:
Usanowicza:
Kwasami
Kwasami
są związki zawierające drobiny będące donorami
kationów
M
n+
albo wiążące proste aniony:
F
-
, OH
-
, O
2-
, Cl
-
, S
2-
,
zasadami
zasadami
zaś drobiny wiążące kationy
M
n+
lub będące
donorami prostych anionów:
Definicje kwasów i zasad
ac
ac
bas
bas
A
A
m-
m-
M
M
n+
n+
A
A
m-
m-
= F
-
, OH
-
, O
2-
, Cl
-
, S
2-
,
M
M
n+
n+
= H
+
, Li
+
, Ca
2+
, Al
3+
, VO
2
+
,

II grupa definicji
reakcji kwasowo-zasadowych wiąże
pojęcie reakcji
z jej przebiegiem
:
definicja
Usanowicza
Usanowicza
Definicje kwasów i zasad
Przykłady reakcji:
ZnCl
2 (aq)
+ 2NaOH
aq
Zn(OH)
2 (s)
+ 2NaCl
(aq)
ZnCl
2
+ 2NaOH
Zn(OH)
2
+
2NaCl
ac
1
bas
1
bas
2
ac
2
AgNO
3(aq)
+ NaCl
aq)
AgCl
(s)
+ NaNO
3 (aq)
III grupa definicji
wiąże pojęcie reakcji kwasowo-zasadowej
z budową produktów:
- definicja
Lewisa
Lewisa
:
Reakcja polega na wytworzeniu kowalencyjnego wiązania
dwuelektronowego
pomiędzy kwasem i zasadą.
Zasada
jest
donor
em
pary elektronowej na to wiązanie a
kwas
akceptorem
czyli drobiną posiadającą możliwość tworzenia
takiego wiązania (najczęściej posiada układ wiązań
BF
3
+ NH
3
BF
3
NH
3
Definicje kwasów i zasad
B
F
F
F
B
F
F
F
+
N
H
H
H
N
H
H
H

III grupa definicji
wiąże pojęcie reakcji kwasowo-zasadowej
z budową produktów:
- definicja miękkich i twardych kwasów i zasad (
Pearson'a
Pearson'a
):
LiI
(s)
+ AgF
(s)
LiF
(s)
+ AgI
(s)
[
Li
Li
+
+
] [
I
I
-
-
]
+ [
Ag
Ag
+
+
] [
F
F
-
-
] [
Li
Li
+
+
] [
F
F
-
-
] + [
Ag
Ag
+
+
] [
I
I
-
-
]
[
k
k
t
t
] [
z
z
m
m
]
+ [
k
k
m
m
] [
z
z
t
t
] [
k
k
t
t
] [
z
z
m
m
] + [
k
k
t
t
] [
z
z
m
m
]
Definicje kwasów i zasad
t
Reakcje utleniania i redukcji
Reakcje utleniania i redukcji
ox
ox
red
red
x
xe
e
W reakcjach utleniania i redukcji
reakcjach utleniania i redukcji
między drobinami przenoszone
przenoszone
są elektrony
są elektrony
czyli następuje zmiana stopni utlenienia (G
zmiana stopni utlenienia (G
ox
ox
), (zmiana
), (zmiana
e
e
v
v
)
)
pierwiastków w drobinach.
Reduktor (red)
Reduktor (red)
jest donorem elektronów - utlenia się,
zwiększa swój stopień utlenienia G
ox
, zmniejsza e
v
Utleniacz (ox)
Utleniacz (ox)
jest akceptorem elektronów - redukuje się,
zmniejsza swój stopień utlenienia G
ox
, zwiększa e
v
:
Tradycyjnie
wszystkie reakcje w których następuje nie tylko
zmiana
liczby elektronów
ale również
zmiana liczby ligandów
zaliczane sa
do
reakcji utleniania - redukcji (red-ox), np:
C + O
2
CO
2
Ogólny schemat reakcji kwasowo-zasadowych (
ac
ac
-
bas
bas),
utleniania i redukcji (
red
red-
ox
ox
), sprzężonych (
red
red
ac
ac
-
ox
ox
bas
bas)
i niesprzężonych (
red
red-
ac
ac
-
ox
ox
-bas)
ac
ac
bas
bas
H
H
+
+
A
A
m-
m-
ox
ox
red
red
xe
xe
red
red
ac
ac
ox
ox
bas
bas
red
red
-ac
-ac
ox
ox
-bas
-bas
A
A
x-
x-
me
me
xH
xH
+
+
nH
nH
+
+
zA
zA
2-
2-
xe
xe
ac
ac
-
bas
bas
red
red-
ox
ox
red
red
ac
ac
-
ox
ox
bas
bas
red
red-
ac
ac
-
ox
ox
-bas

Jednolita definicja kwasów, zasad oraz utleniaczy i reduktorów
ac
ac
bas
bas
H
H
+
+
A
A
m-
m-
redac
redac
oxbas
oxbas
red-ac
red-ac
ox-bas
ox-bas
A
A
2-
2-
me
me
2H
2H
+
+
nH
nH
+
+
zA
zA
x-
x-
ox
ox
red
red
xe
xe

Jednolita definicja
Jednolita definicja
kwasów, zasad
kwasów, zasad
oraz
oraz
utleniaczy i reduktorów
utleniaczy i reduktorów
Jednolita definicja
Jednolita definicja
kwasów, zasad
kwasów, zasad
oraz
oraz
utleniaczy i reduktorów
utleniaczy i reduktorów
dla sp:
dla sp:
e
e
z
z
- otoczenie ligandowe, (ac-
- otoczenie ligandowe, (ac-
bas)
bas)
e
e
v
v
- otoczenie elektronowe, (red-
- otoczenie elektronowe, (red-
ox)
ox)
n - złożoność drobin
n - złożoność drobin
(wielocentryczne)
(wielocentryczne)
(polimeryzacja,
(polimeryzacja,
kondensacja)
kondensacja)
dla dsp i fdsp:
dla dsp i fdsp:
e
e
z
z
- otoczenie ligandowe, (ac-
- otoczenie ligandowe, (ac-
bas)
bas)
Q
Q
ck
ck
i e
i e
v
v
- otoczenie elektronowe
- otoczenie elektronowe
(red-ox)
(red-ox)
n - złożoność drobin
n - złożoność drobin
(wielocentryczne)
(wielocentryczne)
(polimeryzacja, kondensacja)
(polimeryzacja, kondensacja)
Opis centrum koordynacji drobin
Opis centrum koordynacji drobin
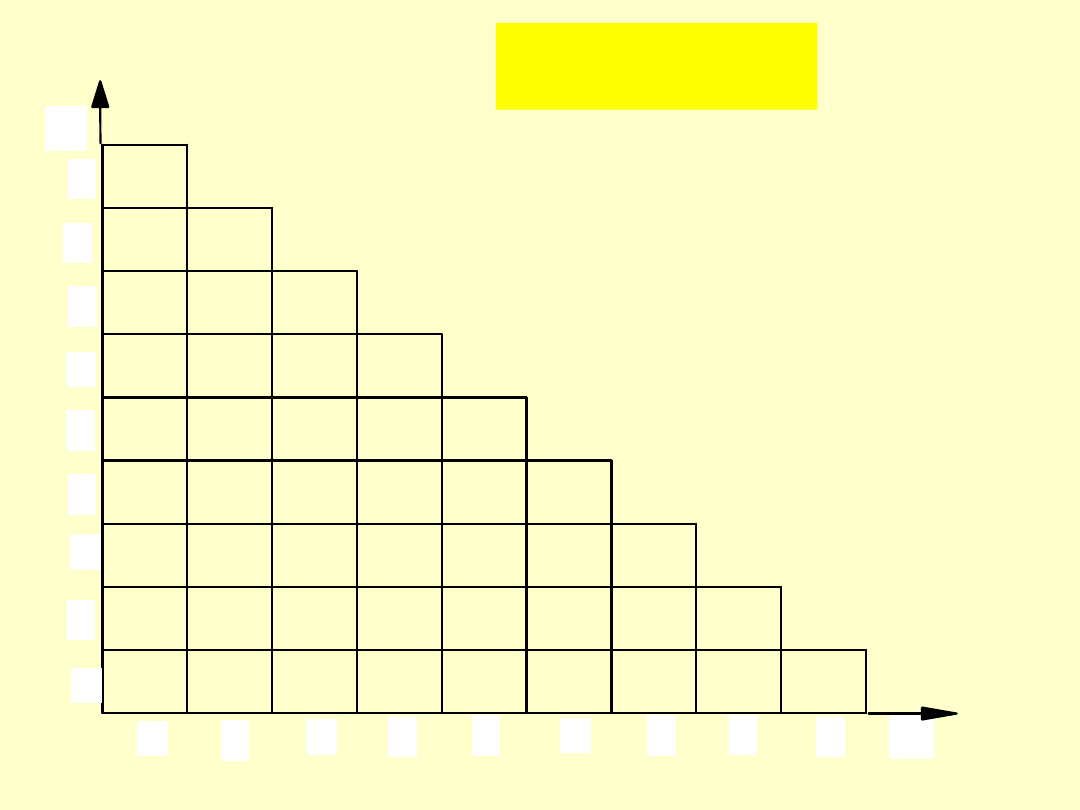
e
z
e
v
1
0
2
3
4
5
6
7
8
0
1
2
3
4
5
6
7
8
AO
4
n-8
AO
2
n-4
AO
2
n-6
AO
2
n-8
A
n+
A
n-8
AO
n-6
A
n-4
A
n-2
A
n-6
AO
3
n-8
AO
n-8
X
X
X
X
X
X
X
X
X
AO
3
n-6
AO
n-2
AO
n-4
X
Drobiny proste
monocentryczne
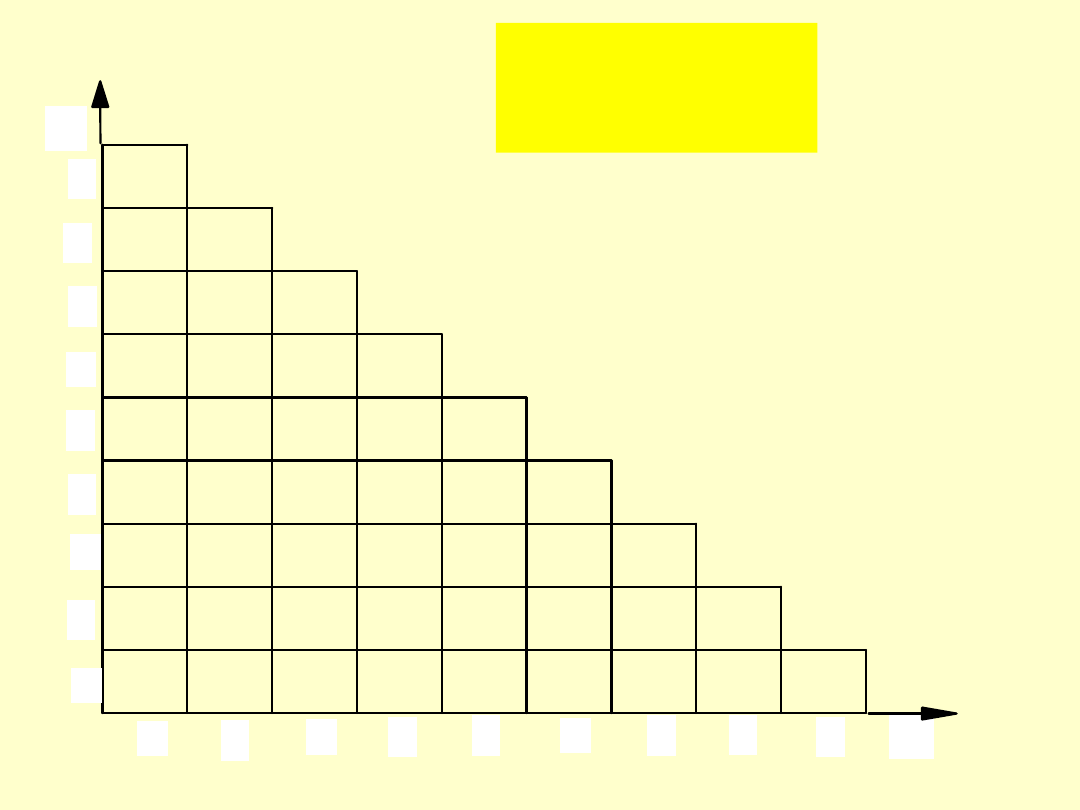
e
z
e
v
1
0
2
3
4
5
6
7
8
0
1
2
3
4
5
6
7
8
ClO
4
-
NO
2
+
SO
2
0
ClO
2
-
Na
+
Cl
-
CO
CO
2-
2-
Pb
2+
ClO
3
-
ClO
-
X
X
X
X
X
X
X
X
X
CO
3
2-
AlO
AlO
+
+
CO
0
X
Drobiny proste
Przykłady
Przykłady
monocentryczne
e
z
e
v
1
0
2
3
4
5
6
7
8
0
1
2
3
4
5
6
7
8
X
X
X
X
X
X
X
X
X
X
Drobiny proste
Przykłady
Przykłady
monocentryczne
rozmieść w tablicy drobiny:
SO
4
2-
, BrO
3
-
, CO
2
2-
, BO
3
3-
, NO
2
+
, NO
0
,
GaO
+
, PCl
3
, BF
3
0
, PF
5
0
, PCl
4
+
, CO
2
0
,
CO
0
, SOCl
2
0
, SO
3
F
-
,
POCl
3
0
, IO
6
5-
, ClO
2
+
, ClO
2
-
, ClO
2
0
, SeO
3
2-
,
NF
4
+
.....
AO
4
n-8
AO
2
n-4
AO
2
n-6
AO
2
n-8
A
n+
A
n-8
AO
n-6
A
n-4
A
n-2
A
n-6
AO
3
n-8
AO
n-8
X
X
X
X
X
X
X
X
X
AO
3
n-6
AO
n-2
AO
n-4
X
AO
3
n-7
AO
AO
2
2
n-5
n-5
AO
AO
2
2
n-7
n-7
AO
n-3
AO
AO
n-5
n-5
AO
n-7
e
z
e
v
1
0
2
3
4
5
6
7
8
0
1
2
3
4
5
6
7
8
Drobiny proste
monocentryczne i
rodniki
A
n-1
A
n-3
A
n-5
A
n-7
e
z
e
v
1
0
2
3
4
5
6
7
8
0
1
2
3
4
5
6
7
8
ClO
4
-
NO
2
+
SO
2
0
ClO
2
-
Na
+
Cl
-
CO
CO
2-
2-
Pb
2+
ClO
3
-
ClO
-
X
X
X
X
X
X
X
X
X
CO
3
2-
AlO
AlO
+
+
CO
0
X
Drobiny proste
Przykłady
Przykłady
monocentryczne i trwałe rodniki
NO
NO
2
2
0
0
ClO
ClO
2
2
0
0
NO
NO
0
0
e
z
e
v
1
0
2
3
4
5
6
7
8
0
1
2
3
4
5
6
7
8
AO
4
n-8
AO
2
n-4
AO
2
n-6
AO
2
n-8
A
n+
A
n-8
AO
n-6
A
n-2
AO
3
n-8
AO
n-8
X
X
X
X
X
X
X
X
X
AO
3
n-6
AO
n-2
AO
n-4
X
A
2
O
6
2n-14
A
2
O
4
2n-12
A
2
O
4
2n-14
A
2
O
2
2n-14
A
2
O
2
2n-10
A
2
O
2
2n-6
Drobiny proste
monocentryczne i
drobiny dwucentryczne
z wiązaniem A-A
A
2
2n-2
A
2
2n-6
A
2
2n-14
e
z
e
v
1
0
2
3
4
5
6
7
8
0
1
2
3
4
5
6
7
8
AO
4
n-8
AO
2
n-4
AO
2
n-6
AO
2
n-8
A
n+
A
n-8
AO
n-6
A
n-2
AO
3
n-8
AO
n-8
X
X
X
X
X
X
X
X
X
AO
3
n-6
AO
n-2
AO
n-4
X
A
2
O
6
2n-14
A
2
O
4
2n-10
A
2
O
4
2n-14
A
2
O
2
2n-14
A
2
O
2
2n-10
A
2
O
2
2n-6
Drobiny proste
monocentryczne i
dwucentryczne
z wiązaniem A-A i A-O-A
A
2
2n-2
A
2
2n-10
A
2
2n-14
A
2
O
7
2n-14
A
2
O
5
2n-14
A
2
O
3
2n-14
A
2
O
2n-14
A
2
O
5
2n-10
A
2
O
3
2n-10
A
2
O
2n-10
A
2
O
3
2n-6
A
2
O
2n-6
A
2
O
2n-2
e
z
e
v
1
0
2
3
4
5
6
7
8
0
1
2
3
4
5
6
7
8
ClO
4
-
NO
2
+
SO
2
0
ClO
2
-
Na
+
Cl
-
CO
CO
2-
2-
Pb
2+
O
2
0
ClO
3
-
ClO
-
X
X
X
X
X
X
X
X
X
CO
3
2-
AlO
AlO
+
+
CO
0
Drobiny proste
Przykłady
Przykłady
monocentryczne i dwucentryczne
z wiązaniami A-A i A-O-A
C
2
O
4
2-
S
2
O
4
2-
C
C
2
2
O
O
2
2
2-
2-
S
2
O
7
2-
P
2
O
6
4-
S
2
O
5
2-
B
2
O
5
4-
S
2
O
3
2-
C
C
2
2
O
O
3
3
2-
2-
C
C
2
2
O
O
2
2
6-
6-
B
B
2
2
O
O
2
2
0
0
Hg
2
O
3
2-
Zn
Zn
2
2
O
O
2+
2+
Hg
2
2+
Pb
Pb
2
2
O
O
2+
2+
C
C
2
2
O
O
2-
2-
C
2
2-
Cl
2
O
0
Cl
2
0
C
C
2
2
O
O
4-
4-
e
z
e
v
1
0
2
3
4
5
6
7
8
0
1
2
3
4
5
6
7
8
ClO
4
-
ClO
2
+
ClO
2
-
Cl
-
ClO
+
ClO
3
-
ClO
-
X
X
X
X
X
X
X
X
X
Drobiny proste
Przykłady
Przykłady
monocentryczne i dwucentryczne
z wiązaniami A-A i A-O-A
Drobiny tlenowe chloru
ClO
2
0
Cl
2
O
7
0
Cl
2
O
6
0
Cl
2
O
0
Cl
2
0
Cl
2
O
4
0
SO
4
2-
SO
2
0
S
2-
S
n
0
SO
3
2-
X
X
X
X
X
X
X
X
X
SO
3
0
Drobiny proste
Przykłady
Przykłady
monocentryczne i dwucentryczne
z wiązaniami A-A i A-O-A
Drobiny tlenowe siarki
S
2
O
4
2-
S
2
O
7
2-
S
2
O
6
2-
S
2
O
5
2-
S
2
O
3
2-
S
2
2-
e
z
e
v
1
0
2
3
4
5
6
7
8
0
1
2
3
4
5
6
7
8
e
z
e
v
1
0
2
3
4
5
6
7
8
0
1
2
3
4
5
6
7
8
CO
2
0
CO
2
2-
C
4-
CO
2-
C
n
0
C
2
4-
CO
4-
X
X
X
X
X
X
X
X
X
CO
3
2-
CO
0
Drobiny proste
Przykłady
Przykłady
monocentryczne i dwucentryczne
z wiązaniami A-A i A-O-A
Drobiny tlenowe węgla
oraz szkielety drobin
tlenowodorowych
C
2
O
4
2-
C
2
O
2
2-
C
2
O
3
2-
C
2
O
2
6-
C
2
O
2-
C
2
2-
C
2
O
6-
C
2
6-
C
2
O
4-
C
2
O
2
4-
SeO
4
2-
SeO
2
0
Se
2-
Se
n
0
SeO
3
2-
X
X
X
X
X
X
X
X
X
SeO
3
0
Drobiny proste
Przykłady
Przykłady
monocentryczne i dwucentryczne
z wiązaniami A-A i A-O-A
Drobiny tlenowe selenu
Se
2
O
7
2-
Se
2
O
5
2-
Se
2
2-
e
z
e
v
1
0
2
3
4
5
6
7
8
0
1
2
3
4
5
6
7
8
e
z
e
v
1
0
2
3
4
5
6
7
8
0
1
2
3
4
5
6
7
8
AlO
4
5-
AlO
2
-
Al
3+
X
X
X
X
X
X
X
X
X
AlO
3
3-
AlO
+
Drobiny proste
Przykłady
Przykłady
Drobiny tlenowe glinu
Al
2
O
7
8-
Al
2
O
5
4-
Al
2
O
3
0
Al
2
O
4+
Al
n
0
[AlO
6
9-
]
12
e
z
e
v
1
0
2
3
4
5
6
7
8
0
1
2
3
4
5
6
7
8
ZnO
4
6-
ZnO
2
2-
Zn
2+
X
X
X
X
X
X
X
X
X
ZnO
3
4-
ZnO
0
Drobiny proste
Przykłady
Przykłady
Drobiny tlenowe cynku
Zn
2
O
7
10-
Zn
2
O
5
6-
Zn
2
O
3
2-
Zn
2
O
2+
Zn
n
0
Zn
2
2+
e
z
e
v
1
0
2
3
4
5
6
7
8
0
1
2
3
4
5
6
7
8
Li
+
X
X
X
X
X
X
X
X
X
LiO
-
Drobiny proste
Przykłady
Przykłady
Drobiny tlenowe litu
Li
2
O
0
Li
-
Li
0
Fragment klasyfikacji
Fragment klasyfikacji
drobin
drobin
tlenowych
tlenowych
i
i
tlenowodorowych
tlenowodorowych
fosforu
fosforu
e
z
O
2-
i H
+
e
z
H
+
0
4
5
6
7
8
PO
4
3-
2
1
e
v
•
•
•
•
•
•
•
•
•
•
•
•
•
•
•
•
•
•
•
•
•
•
•
•
•
••
•
•
•
•
P
2
O
7
4-
PO
3
-
P
2
O
5
0
H
2
PO
4
2-
HPO
4
2-
PO
3
3-
H
2
P
2
O
7
2-
HPO
3
H
4
P
2
O
7
P
2
O
6
4-
H
3
PO
4
H
4
PO
4
+
H
2
P
2
O
6
2-
P
2
O
5
4-
HPO
3
2-
PO
2
-
H
2
P
2
O
5
2-
H
2
PO
3
-
H
4
P
2
O
6
0
-4
-3
-2
-1
e
z
e
v
1
0
2
3
4
5
6
7
8
0
1
2
3
4
5
6
7
8
AO
4
n-8
AO
2
n-4
AO
2
n-6
AO
2
n-8
A
n+
A
n-8
AO
n-6
A
n-4
A
n-2
A
n-6
AO
3
n-8
AO
n-8
X
X
X
X
X
X
X
X
X
AO
3
n-5
AO
n-2
AO
n-4
X
e
z
e
v
1
0
2
3
4
5
6
7
8
0
1
2
3
4
5
6
7
8
AO
4
n-8
AO
2
n-4
AO
2
n-8
A
n-8
4
2
AO
2
n-6
+
2
0
AO
n-2
6
2
AO
3
n-8
+
0
0
A
n+
AO
n-6
A
n-4
A
n-2
A
n-6
AO
n-8
X
X
X
X
X
X
X
X
X
AO
3
n-6
AO
n-4
X
Reakcje kwasowo-zasadowe (
Reakcje kwasowo-zasadowe (
ac -
ac -
bas
bas
)
)
ac
ac
bas
bas
H
H
+
+
A
A
m-
m-
ac
1
bas
1
bas
2
ac
2
Reakcje połówkowe:
ac
1
4
2
AO
2
n-6
+
O
2-
6
2
AO
3
n-8
bas
1
2
0
AO
n-2
0
0
A
n+
+
O
2-
e
v
= const.
AO
AO
3
3
n-8
n-8
AO
AO
2
2
n-6
n-6
AO
AO
n-2
n-2
A
A
n+
n+

Przykłady reakcji kwasowo-zasadowych
Przykłady reakcji kwasowo-zasadowych
:
:
SO
SO
3 (g)
3 (g)
+ Na
+ Na
2
2
SO
SO
3
3
(s)
(s)
Na
Na
2
2
SO
SO
4 (s)
4 (s)
+
+
SO
SO
2 (g)
2 (g)
6
0
SO
3
0
+
6
2
SO
3
2-
8
0
SO
4
2-
+
4
2
SO
2
ac
1
bas
2
bas
1
ac
2
Reakcje połówkowe:
Reakcje połówkowe:
(
ac
ac)
6
0
SO
3
0
+
O
2-
8
0
SO
4
2-
(
bas
bas)
6
2
SO
3
2-
6
2
SO
2
0
+ O
2
-
e
z
e
v
1
0
2
3
4
5
6
7
8
0
1
2
3
4
5
6
7
8
AO
2
n-4
AO
2
n-8
A
n+
A
n-8
AO
n-6
A
n-4
A
n-2
A
n-6
AO
n-8
X
X
X
X
X
X
X
X
X
AO
n-2
AO
n-4
X
6
0
SO
3
0
+
6
2
SO
3
2-
8
0
SO
4
2-
+
4
2
SO
2
ac
1
bas
2
bas
1
ac
2
SO
SO
3
3
2
2-
SO
SO
2
2
0
0
SO
SO
4
4
2-
2-
SO
SO
3
3
0
0
Reakcje połówkowe:
Reakcje połówkowe:
(
ac
ac)
6
0
SO
3
0
+
O
2-
8
0
SO
4
2-
(
bas
bas)
6
2
SO
3
2-
4
2
SO
2
0
+ O
2-
e
z
e
v
1
0
2
3
4
5
6
7
8
0
1
2
3
4
5
6
7
8
AO
4
n-8
AO
2
n-4
AO
2
n-6
AO
2
n-8
A
n+
O
2-
6
2
SO
3
2-
+
-3
8
H
3
O
+
5
2
HSO
3
2-
+
-2
8
H
2
O
0
AO
n-6
A
n-4
A
n-2
A
n-6
SO
SO
3
3
2-
2-
AO
n-8
X
X
X
X
X
X
X
X
X
AO
3
n-6
AO
n-2
AO
n-4
X
Reakcje kwasowo-zasadowe (
Reakcje kwasowo-zasadowe (
ac -
ac -
bas
bas
)
)
ac
ac
bas
bas
H
H
+
+
A
A
m-
m-
bas
1
ac
2
ac
2
b
as
1
Reakcje połówkowe:
(bas
1
)
6
2
SO
3
2-
+
H
+
5
2
HSO
3
2-
(
ac
2
)
-3
8
H
3
O
+
-2
8
H
2
O
0
+
H
+
e
v
= const.
-1
-2
-3
-4
SO
SO
3
3
2-
2-
HSO
HSO
3
3
-
-
H
H
2
2
O
O
0
0
H
H
3
3
O
O
+
+
e
z
e
v
1
0
2
3
4
5
6
7
8
0
1
2
3
4
5
6
7
8
AO
2
n-4
AO
2
n-6
AO
2
n-8
A
n+
A
n-8
AO
n-6
A
n-4
A
n-2
A
n-6
AO
3
n-8
AO
n-8
X
X
X
X
X
X
X
X
X
AO
n-2
AO
n-4
X
A
2
O
6
2n-14
A
2
O
4
2n-10
A
2
O
4
2n-14
A
2
O
2
2n-14
A
2
O
2
2n-10
A
2
O
2
2n-6
A
2
2n-2
A
2
2n-6
A
2
2n-10
A
2
2n-14
7
0
A
2
O
7
2n-14
8
0
AO
4
n-8
+
6
0
AO
3
n-6
7
0
S
2
0
7
2-
8
0
SO
4
2-
+
6
0
SO
3
A
2
O
5
2n-14
A
2
O
3
2n-14
A
2
O
2n-14
A
2
O
5
2n-10
A
2
O
3
2n-10
A
2
O
2n-10
A
2
O
3
2n-6
A
2
O
2n-6
A
2
O
2n-2
Reakcje kwasowo-zasadowe (
Reakcje kwasowo-zasadowe (
dysproporcjonacja
i synproporcjonacja
ac -
ac -
bas
bas
)
)
A
2
O
7
2n-14
AO
4
n-8
AO
3
n-6
e
z
e
v
1
0
2
3
4
5
6
7
8
0
1
2
3
4
5
6
7
8
AO
2
n-4
AO
2
n-6
AO
2
n-8
A
n+
A
n-8
AO
n-6
A
n-4
A
n-2
A
n-6
AO
3
n-8
AO
n-8
X
X
X
X
X
X
X
X
X
AO
n-2
AO
n-4
X
A
2
O
6
2n-14
A
2
O
4
2n-10
A
2
O
4
2n-14
A
2
O
2
2n-14
A
2
O
2
2n-10
A
2
O
2
2n-6
A
2
2n-2
A
2
2n-6
A
2
2n-10
A
2
2n-14
2
7
0
HAO
4
n-7
8
0
AO
4
n-8
+
6
0
H
2
AO
4
n-6
2HSO
4
-
8
0
SO
4
2-
+
6
0
H
2
SO
4
2Ba(HSO
4
)
2
BaSO
4
+ H
2
SO
4
A
2
O
5
2n-14
A
2
O
3
2n-14
A
2
O
2n-14
A
2
O
5
2n-10
A
2
O
3
2n-10
A
2
O
2n-10
A
2
O
3
2n-6
A
2
O
2n-6
A
2
O
2n-2
Reakcje kwasowo-zasadowe (
Reakcje kwasowo-zasadowe (
dysproporcjonacja
i synproporcjonacja
ac -
ac -
bas
bas
)
)
HAO
4
n-7
AO
4
n-8
H
2
AO
4
n-6

e
z
e
v
1
0
2
3
4
5
6
7
8
0
1
2
3
4
5
6
7
8
AO
4
n-8
AO
2
n-4
AO
2
n-8
A
n-8
AO
n-6
A
n-4
A
n-6
AO
3
n-8
AO
n-8
X
X
X
X
X
X
X
X
X
AO
3
n-5
AO
n-2
AO
n-4
X
Reakcje utleniania i redukcji
Reakcje utleniania i redukcji
(
red
red-
ox
ox
)
ox
ox
red
red
red
red-
ox
ox
xe
xe
4
2
AO
2
n-6
+
2
0
A
n-2
6
3
A
2
O
4
2n-14
+
0
0
A
n+
AO
2
n-6
A
2
O
4
2n-14
A
n+
A
n-2
Reakcje połówkowe:
Reakcje połówkowe:
(
ox
ox) 2
4
2
AO
2
n-6
+ 2
e
4
3
A
2
O
4
2n-14
(
red
red)
0
2
A
n-2
0
0
A
n+
+ e
-
e
z
= const.
ox
1
red
2
red
2
ox
1
e
z
e
v
1
0
2
3
4
5
6
7
8
0
1
2
3
4
5
6
7
8
AO
4
n-8
AO
2
n-4
AO
2
n-8
A
n-8
AO
n-6
A
n-4
A
n-6
AO
3
n-8
AO
n-8
X
X
X
X
X
X
X
X
X
AO
3
n-6
AO
n-2
AO
n-4
X
4
2
SO
2
0
+
2
0
Zn
0
6
3
S
2
O
4
2-
+
0
0
Zn
2+
Reakcje połówkowe:
Reakcje połówkowe:
(
ox
ox) 2
4
2
SO
2
0
+ 2
e
4
3
S
2
O
4
2-
(
red
red)
0
2
Zn
0
0
0
Zn
2+
+ 2e
-
Reakcje utleniania i redukcji
Reakcje utleniania i redukcji
(
red
red-
ox
ox
)
ox
ox
red
red
red
red-
ox
ox
xe
xe
S
2
O
4
2
-
Zn
2+
Zn
0
SO
2
0
e
z
= const.
ox
1
red
2
red
2
ox
1
Przykłady reakcji utleniania-redukcji
Przykłady reakcji utleniania-redukcji
:
:
1
/
8
S
8
0
(S)
+ 2Na
0
(s)
Na
2
S (s)
1
/
8
0
6
S
8
0
+ 2
0
1
Na
0
[
0
8
S
2-
+2
0
0
Na
+
]
ox
1
red
2
red
1
ox
2
Reakcje połówkowe:
Reakcje połówkowe:
(
ox
ox)
1
/
8
0
6
S
0
+ 2
e
0
8
S
2-
(
red
red)
0
1
Na
0
0
0
Na
+
+ e
AO
2
n-4
AO
2
n-6
AO
2
n-8
AO
n-6
A
n-4
AO
3
n-8
AO
n-8
X
X
X
X
X
X
X
X
X
AO
n-2
AO
n-4
X
A
2
O
6
2n-14
A
2
O
4
2n-10
A
2
O
4
2n-14
A
2
O
2
2n-14
A
2
O
2
2n-10
A
2
O
2
2n-6
A
2
2n-6
A
2
2n-10
0
0
A
n+
+
0
2
A
n-2 0
1
A
2
2n-2
0
0
Hg
2+
+
0
2
Hg
0
0
1
Hg
2
2+
0
7
A
2
2n-14
0
6
A
n-6
+
0
8
A
n-8
0
7
S
2
2-
0
6
1
/
8
S
8
0
+
0
8
S
2-
A
2
O
5
2n-14
A
2
O
3
2n-14
A
2
O
2n-14
A
2
O
5
2n-10
A
2
O
3
2n-10
A
2
O
2n-10
A
2
O
3
2n-6
A
2
O
2n-6
A
2
O
2n-2
Reakcje redukcji-utleniania (
Reakcje redukcji-utleniania (
dysproporcjonacja
i synproporcjonacja
red-
red-
ox)
ox)
HAO
4
n-7
AO
4
n-6
H
2
AO
4
n-6
Hg
2+
Hg
2
2+
Hg
0
e
z
e
v
1
0
2
3
4
5
6
7
8
0
1
2
3
4
5
6
7
8
S
2-
S
0
S
2
2-
AO
4
n-8

e
z
e
v
1
0
2
3
4
5
6
7
8
0
1
2
3
4
5
6
7
8
AO
2
n-4
AO
2
n-6
A
n+
AO
n-6
A
n-4
A
n-2
A
n-6
AO
n-8
X
X
X
X
X
X
X
X
X
AO
3
n-6
AO
n-2
AO
n-4
X
red
red
ac
ac
ox
ox
bas
bas
A
A
x-
x-
xe
xe
H
H
+
+
Reakcje
Reakcje
sprzężone
sprzężone
(
red
red
ac
ac
-
ox
ox
bas
bas)
e
z
+ e
v
= const.
2
6
2
AO
3
n-8
+
4
4
AO
2
n-8
2
8
0
AO
4
n-8
+
0
8
A
n-8
AO
4
n-8
AO
3
n-8
AO
2
n-8
A
n-8
Reakcje połówkowe:
Reakcje połówkowe:
(
red
red
ac
ac)
6
2
AO
3
n-8
+ O
2-
8
0
AO
4
n-8
+ 2e
(
ox
ox
bas
bas)
4
4
AO
2
n-8
+ 4e
0
8
A
n-8
+ 2O
2-
red
ac
1
ox
bas
2
ox
bas
2
red
ac
1
e
z
e
v
1
0
2
3
4
5
6
7
8
0
1
2
3
4
5
6
7
8
AO
2
n-4
AO
2
n-6
A
n+
AO
n-6
A
n-4
A
n-2
A
n-6
ClO
-
X
X
X
X
X
X
X
X
X
AO
3
n-6
AO
n-2
AO
n-4
X
red
red
ac
ac
ox
ox
bas
bas
A
A
x-
x-
xe
xe
xH
xH
+
+
Reakcje
Reakcje
sprzężone
sprzężone
(
red
red
ac
ac
-
ox
ox
bas
bas)
e
z
+ e
v
= const.
2
6
2
SO
3
2-
+
4
4
ClO
2
-
2
8
0
SO
4
2-
+
0
8
Cl
-
SO
4
2-
SO
3
2-
ClO
2
-
Cl
-
Reakcje połówkowe:
Reakcje połówkowe:
(
red
red
ac
ac)
6
2
SO
3
2-
+ O
2-
8
0
SO
4
2-
+ 2e
(
ox
ox
bas
bas)
4
4
ClO
2
-
+ 4e
0
8
Cl
-
+ 2O
2-
red
ac
1
ox
bas
2
ox
bas
2
red
ac
1
-2e
+
O
2-
-2
O
2-
+
4e
(
red
red
ac
ac)
6
2
SO
3
2-
+ O
0
8
0
SO
4
2-
(
ox
ox
bas
bas)
4
4
ClO
2
-
0
8
Cl
-
+ 2O
0
e
z
e
v
1
0
2
3
4
5
6
7
8
0
1
2
3
4
5
6
7
8
AO
AO
4
4
n-8
n-8
AO
2
n-4
AO
2
n-6
AO
2
n-8
A
n+
A
A
n-8
n-8
AO
n-6
A
n-4
A
n-2
A
n-6
AO
AO
3
3
n-8
n-8
AO
n-8
X
X
X
X
X
X
X
X
X
AO
3
n-6
AO
n-2
AO
n-4
X
Reakcje
Reakcje
sprzężone
sprzężone
(
dysproporcjonacja
dysproporcjonacja
red
red
ac
ac
-
ox
ox
bas
bas)
e
z
+ e
v
= const.
4
6
2
AO
3
n-8
3
8
0
AO
4
n-8
+
0
8
A
n-8
czyli
3
6
2
AO
3
n-8
+
6
2
AO
3
n-8
3
8
0
AO
4
n-8
+
0
8
A
n-8
red
ac
1
ox
bas
2
ox
bas
2
red
ac
1
e
z
e
v
1
0
2
3
4
5
6
7
8
0
1
2
3
4
5
6
7
8
AO
2
n-4
AO
2
n-6
SO
2
2-
A
n+
AO
n-6
A
n-4
A
n-2
A
n-6
SO
2-
X
X
X
X
X
X
X
X
X
AO
3
n-6
AO
n-2
AO
n-4
X
Reakcje
Reakcje
sprzężone
sprzężone
(
dysproporcjonacja
dysproporcjonacja
red
red
ac
ac
-
ox
ox
bas
bas)
e
z
+ e
v
= const.
4
6
2
SO
3
2-
3
8
0
SO
4
2-
+
0
8
S
2-
czyli
3
6
2
SO
3
2-
+
6
2
SO
3
2-
3
8
0
SO
4
2-
+
0
8
S
2-
red
ac
1
ox
bas
2
ox
bas
2
red
ac
1
SO
SO
3
3
2-
2-
SO
SO
4
4
2-
2-
S
S
2-
2-
Przykłady reakcji sprzężonych
Przykłady reakcji sprzężonych
(
red
red
ac
ac
-
ox
ox
bas
bas)
:
:
0
6
O
2
+ 2
-2
2
H
2
2
-2
8
H
2
O
(ox
ox
bas)
bas)
O
2
+ 4e 2O
2-
(
red
ac)
H
2
2H+ + 2e
0
5
N
2
+ 3
-2
2
H
2
2
-3
8
NH
3
3Na
2
SO
3
+ NaClO
3
3Na
2
SO
4
+
NaCl
3SO
3
2-
+ ClO
3
-
3SO
4
2-
+ Cl
-
(ox
ox
bas)
bas)
ClO
3
-
+ 6e Cl
-
+
3O
2-
(
red
ac)
SO
3
2-
+ O
2-
SO
4
2-
+
2e
C + O
2
CO
2
3NaPO
2
2NaPO
3
+ NaP
4NaClO
3
3NaClO
4
+ NaCl
e
z
e
v
1
0
2
3
4
5
6
7
8
0
1
2
3
4
5
6
7
8
AO
4
n-8
AO
2
n-4
AO
2
n-6
AO
2
n-8
A
n+
A
n-8
AO
n-6
A
n-4
A
n-2
A
n-6
AO
3
n-8
AO
n-8
X
X
X
X
X
X
X
X
X
AO
3
n-5
AO
n-2
AO
n-4
X
red-ac
red-ac
ox-bas
ox-bas
me
me
nH
nH
+
+
zA
zA
x-
x-
Reakcje nie
Reakcje nie
sprzężone
sprzężone
(
red-
red-
ac
ac
-
ox-
ox-
bas
bas)
Drobiny pierwiastków bloku dsp i fdsp
Drobiny pierwiastków bloku dsp i fdsp
i ich reakcje
i ich reakcje
Odmienny układ podpowłok walencyjnych u pierwiastków
bloku dsp
dsp
i fdsp
fdsp
w porównaniu z sp
sp
oraz niezależne
wypełnianie stanów walencyjnych elektronami (stany d
d
lub f
f
)
i ligandami (głównie stany sp
sp
) powoduje, iż diagramy
klasyfikacyjne drobin pierwiastków dsp
dsp
i fdsp
fdsp
są zestawiane
w oparciu o e
e
z
z
oraz Q
Q
ox
ox
e
z
(e
v
)
G
ox
0
1
2
3
5
7
8
4
0
6
1
2
3
4
5
6
8
7
12 AO
6
4-
AO
6
10-
AO
4
0
AO
4
-
AO
4
2-
AO
4
3-
AO
4
4-
AO
4
5-
AO
4
6-
A
2
O
7
0
A
2
O
7
2-
A
2
O
7
4-
A
2
O
7
6-
A
2
O
7
8-
A
2
O
7
10-
AO
3
0
AO
3
-
AO
3
2-
AO
3
3-
AO
3
4-
AO
2
2+
A
2
O
5
0
A
2
O
5
2-
A
2
O
5
4-
A
2
O
5
6-
AO
2
+
AO
2
0
AO
2
-
AO
2
2-
AO
2
3-
A
2
O
3
0
A
2
O
3
2-
A
2
O
3
4-
AO
0
AO
+
AO
2+
AO
-
A
2
O
0
A
2
O
2+
A
2
O
4+
A
0
Ogólny diagram drobin tlenowych pierwiastków bloku dsp
Ogólny diagram drobin tlenowych pierwiastków bloku dsp
e
z
(e
v
)
G
ox
0
1
2
3
5
7
8
4
0
6
1
2
3
4
5
6
8
7
12 AO
6
4-
AO
6
10-
AO
4
0
MnO
4
-
MnO
4
2-
MnO
4
3-
MnO
4
4-
MnO
4
5-
MnO
4
6-
Mn
2
O
7
0
Mn
2
O
7
6-
Mn
2
O
7
8-
Mn
2
O
7
10-
MnO
3
0
MnO
3
2-
MnO
3
3-
MnO
3
4-
Mn
2
O
5
2-
Mn
2
O
5
4-
Mn
2
O
5
6-
MnO
2
0
MnO
2
-
MnO
2
2
-
Mn
2
O
3
0
Mn
2
O
3
2
-
MnO
0
MnO
+
Mn
2
O
2+
Mn
0
Diagram drobin tlenowych
Diagram drobin tlenowych
manganu
manganu
Mn
2+
Mn
3+
e
z
(e
v
)
G
ox
0
1
2
3
5
7
8
4
0
6
1
2
3
4
5
6
8
7
12 AO
6
4-
AO
6
10-
AO
4
0
CrO
4
2-
CrO
4
3-
CrO
4
4-
CrO
4
5-
Cr
2
O
7
6-
CrO
3
0
CrO
3
2-
CrO
3
3-
Cr
2
O
5
4-
CrO
2
0
CrO
2
-
CrO
2
2
-
Cr
2
O
3
0
CrO
0
CrO
+
Cr
0
Diagram drobin tlenowych
Diagram drobin tlenowych
chromu
chromu
Cr
2+
Cr
3+
AO
4
-
A
2
O
7
0
Cr
2
O
7
2-
Cr
2
O
4+
Cr
2
O
7
8-
e
z
(e
v
)
G
ox
0
1
2
3
5
7
8
4
0
6
1
2
3
4
5
6
8
7
12 AO
6
4-
AO
6
10-
AO
4
0
VO
4
3-
VO
4
4-
VO
4
5-
V
2
O
7
6-
VO
3
2-
VO
3
3-
V
2
O
5
4-
VO
2
0
VO
2
-
VO
2
2
-
V
2
O
3
0
VO
0
VO
+
V
0
Diagram drobin tlenowych
Diagram drobin tlenowych
wanadu
wanadu
V
2+
V
3+
AO
4
-
A
2
O
7
0
V
2
O
4+
V
2
O
7
8-
AO
4
2--
A
2
O
7
2-
AO
3
0
V
2
O
7
4-
VO
3
-
V
2
O
5
0
V
2
O
5
2-
VO
2
+
VO
2+
e
z
(e
v
)
G
ox
0
1
2
3
5
7
8
4
0
6
1
2
3
4
5
6
8
7
12 AO
6
4-
AO
6
10-
AO
4
0
TiO
4
4-
TiO
4
5-
Ti
2
O
7
6-
TiO
3
2-
TiO
3
3-
Ti
2
O
5
4-
TiO
2
0
TiO
2
-
TiO
2
2
-
Ti
2
O
3
0
TiO
0
TiO
+
Ti
0
Diagram drobin tlenowych
Diagram drobin tlenowych
tytanu
tytanu
Ti
2+
Ti
3+
AO
4
-
A
2
O
7
0
Ti
2
O
4+
Ti
2
O
7
8-
AO
4
2--
A
2
O
7
2-
AO
3
0
AO
4
3--
A
2
O
7
4-
AO
3
-
Ti
2
O
5
2-
TiO
2+
AO
3
+
A
2
O
5
0
e
z
(e
v
)
G
ox
0
1
2
3
5
7
8
4
0
6
1
2
3
4
5
6
8
7
12 AO
6
4-
ScO
6
9
-
AO
4
0
ScO
3
3-
Sc
2
O
5
4-
ScO
2
-
Sc
2
O
3
0
ScO
+
Sc
0
Diagram drobin tlenowych
Diagram drobin tlenowych
skandu
skandu
Sc
3+
AO
4
-
A
2
O
7
0
Sc
2
O
4+
AO
4
2--
A
2
O
7
2-
AO
3
0
AO
4
3--
A
2
O
7
4-
AO
3
-
AO
2
+
A
2
O
5
0
AO
4
4--
A
2
O
7
6-
AO
3
2-
A
2
O
5
2-
AO
2
0
AO
2+
e
z
(e
v
)
G
ox
0
1
2
3
5
7
8
4
0
6
1
2
3
4
5
6
8
7
12 AO
6
4-
AO
6
9-
AO
4
0
Ca
0
Diagram drobin tlenowych
Diagram drobin tlenowych
wapnia
wapnia
AO
4
-
A
2
O
7
0
AO
4
2--
A
2
O
7
2-
AO
3
0
AO
4
3--
A
2
O
7
4-
AO
3
-
AO
2
+
A
2
O
5
0
AO
4
4--
A
2
O
7
6-
AO
3
2-
A
2
O
5
2-
AO
2
0
AO
2+
AO
4
5--
A
2
O
7
8-
AO
3
3-
A
2
O
5
4-
AO
2
-
A
2
O
3
0
AO
+
A
2
O
4+
A
3+
Ca
2+
CaO
0
CaO
2
2-
e
z
(e
v
)
G
ox
0
1
2
3
5
7
8
4
0
6
1
2
3
4
5
6
8
7
12 AO
6
4-
AO
6
10-
AO
4
0
CuO
3
3-
Cu
2
O
5
4-
CuO
2
-
CuO
2
2
-
CuO
0
Cu
0
Diagram drobin tlenowych
Diagram drobin tlenowych
miedzi
miedzi
Cu
2+
AO
4
-
A
2
O
7
0
AO
4
2--
A
2
O
7
2-
AO
3
0
AO
4
3--
A
2
O
7
4-
AO
3
-
AO
3
+
A
2
O
5
0
AO
4
4--
A
2
O
7
6-
AO
3
2-
A
2
O
5
2-
AO
3
0
AO
2+
Cu
2
O
2+
Cu
2
O
3
3+
Cu
2
O
5
6-
CuO
3
4-
CuO
4
6-
Cu
+
Cu
2
O
0
CuO
-
CuO
2
3
-
e
z
e
v
1
0
2
3
4
5
6
7
8
0
1
2
3
4
5
6
7
8
ac
AO
4
n-8
AO
2
n-4
AO
2
n-6
AO
2
n-8
A
n+
A
n-8
0
4
A
n-4
+ O
2-
2
4
AO
n-6
AO
n-6
A
n-4
A
n-4
A
n-2
A
n-6
AO
2
n-8
AO
2
n-8
AO
3
n-8
AO
n-8
X
X
X
X
X
X
X
X
X
AO
3
n-6
AO
n-2
AO
n-4
X
e
z
e
v
1
0
2
3
4
5
6
7
8
0
1
2
3
4
5
6
7
8
AO
2
n-6
AO
2
n-8
A
n+
A
n-8
AO
n-6
A
n-2
A
n-6
AO
n-8
X
X
X
X
X
X
X
X
X
AO
n-2
AO
n-4
X
Reakcje złożone
Reakcje złożone
(
ac
ac
-bas, red
-bas, red
ac
ac
-
ox
ox
bas
bas)
PO
4
3-
P
n
0
P
2
O
5
0
4
8
0
PO
4
3-
+
6
4
0
SiO
2
0
+ 5
0
4
C
0
P
4
0
+ 6
6
0
SiO
3
2-
+ 5
4
0
CO
2
0
PO
3
3-
SiO
2
0
CO
2
0
SiO
3
2-
C
n
0
P
2
O
3
0
4
8
0
PO
4
3-
+
6
4
0
SiO
2
0
P
4
O
10
+
6
6
0
SiO
3
2-
1
1
4
8
0
PO
4
3-
+
8
0
4
C
0
4 P
3-
+
8
4
0
CO
2
0
(1)
(2)
(2)
5
0
P
4
O
10
0
+
5
0
4
C
0
P
4
0
+
5
4
0
CO
2
0
(3)
(3)
(3)
Reakcje nie
Reakcje nie
sprzężone
sprzężone
(
red-
red-
ac
ac
-
ox-
ox-
bas
bas)
NaMnO
4(aq)
+ Na
2
C
2
O
4(aq)
+ H
2
SO
4
•2H
2
O
(aq)
MnSO
4 (aq)
+ Na
2
SO
4 (aq)
+
CO
2 (g)
+ H
2
O
(Na
+
,
MnO
4
-
)
aq
+ (2Na
+
,
C
2
O
4
2
-
)
aq
+
(2
H
3
O
+
, SO
4
2-
)
aq
(
Mn
2+
, SO
4
2-
)
aq
+ (2Na
+
, SO
4
2-
)
aq
+
(
CO
2
) + (
H
2
O
)
(
MnO
4
-
)
aq
+ (
C
2
O
4
2
-
)
aq
+ (
H
3
O
+
)
aq
(
Mn
2+
)
aq
+
(
CO
2
) + (
H
2
O
)

Reakcje nie
Reakcje nie
sprzężone
sprzężone
(
red-
red-
ac
ac
-
ox-
ox-
bas
bas)
Reakcje połówkowe:
Reakcje połówkowe:
(
ox-
ox-
bas
bas)
8
0
MnO
4
-
+ 5e
0
5
Mn
2+
+ 4O
2-
(
red
red
)
4
1
C
2
O
4
2-
4
0
CO
2
+ 2e
(ac)
(ac)
-3
8
H
3
O
+
-2
8
H
2
O
+ H
+
Reakcje nie
Reakcje nie
sprzężone
sprzężone
(
red-
red-
ac
ac
-
ox-
ox-
bas
bas)
Bilans reakcji:
Bilans reakcji:
Bilans red-ox :
Bilans red-ox :
(
ox-
ox-
bas
bas)
2
8
0
MnO
4
-
+ 2
0
5
Mn
2+
+
8O
2-
(
red
red
)
5
4
1
C
2
O
4
2-
5
4
0
CO
2
+
2
8
0
MnO
4
-
+
+
5
4
1
C
2
O
4
2-
2
0
5
Mn
2+
+
5
4
0
CO
2
+ 8O
2-
Bilans ac-bas :
Bilans ac-bas :
2
8
0
MnO
4
-
+
+
5
4
1
C
2
O
4
2-
2
0
5
Mn
2+
+
5
4
0
CO
2
+
ac-
ac-
bas
bas
+16
-3
8
H
3
O
+
24
-2
8
H
2
O
2
8
0
MnO
4
-
+
+
5
4
1
C
2
O
4
2-
+16
-3
8
H
3
O
+
2
0
5
Mn
2+
+
5
4
0
CO
2
+ 24
-2
8
H
2
O
10e
10e
8O
2-
8O
2-

Reakcje nie
Reakcje nie
sprzężone
sprzężone
(
red-
red-
ac
ac
-
ox-
ox-
bas
bas)
2NaMnO
4(aq)
+ 5Na
2
C
2
O
4(aq)
+
8H
2
SO
4
•2H
2
O
(aq)
2MnSO
4 (aq)
+ 6Na
2
SO
4 (aq)
+ 10CO
2
(g)
+ 24H
2
O
2[Na
+
,
MnO
4
-
]
aq
+ 5[2Na
+
,
C
2
O
4
2
-
]
aq
+
8[2
H
3
O
+
, SO
4
2-
]
aq
2[
Mn
2+
, SO
4
2-
]
aq
+ 6[2Na
+
, SO
4
2-
]
aq
+
10[
CO
2
] + 24[
H
2
O
]
2[
MnO
4
-
]
aq
+ 5[
C
2
O
4
2
-
]
aq
+ 16[
H
3
O
]
aq
2[
Mn
2+
]
aq
+ 10
[
CO
2
] + 24 [
H
2
O
]
e
z
e
v
1
0
2
3
4
5
6
7
8
0
1
2
3
4
5
6
7
8
AO
4
n-8
AO
2
n-6
AO
2
n-8
A
n+
A
n-8
AO
n-6
A
n-4
A
n-2
A
n-6
AO
3
n-8
AO
n-8
X
X
X
X
X
X
X
X
X
AO
3
n-6
AO
n-2
AO
n-4
X
CO
CO
2
2
C
C
2
2
O
O
4
4
2-
2-
(
red
red
)
4
1
C
2
O
4
2-
2
4
0
CO
2
+ 2e
Jon szczawianowy jako reagent
Jon szczawianowy jako reagent
red
red
e
z
(e
v
)
G
ox
0
1
2
3
5
7
8
4
0
6
1
2
3
4
5
6
8
7
12 AO
6
4-
AO
6
10-
AO
4
0
MnO
4
-
MnO
4
2-
MnO
4
3-
MnO
4
4-
MnO
4
5-
MnO
4
6-
Mn
2
O
7
0
Mn
2
O
7
6-
Mn
2
O
7
8-
Mn
2
O
7
10-
MnO
3
0
MnO
3
2-
MnO
3
3-
MnO
3
4-
Mn
2
O
5
2-
Mn
2
O
5
4-
Mn
2
O
5
6-
MnO
2
0
MnO
2
-
MnO
2
2
-
Mn
2
O
3
0
Mn
2
O
3
2
-
MnO
0
MnO
+
Mn
2
O
2+
Mn
0
Diagram drobin tlenowych
Diagram drobin tlenowych
manganu
manganu
Mn
2+
Mn
3+
-4
-4
O
O
2
2-
+ 5e
+ 5e
-
MnO
4
-
Mn
2+

Reakcje jonu MnO
Reakcje jonu MnO
4
4
-
-
Reakcje połówkowe:
Reakcje połówkowe:
środowisko kwaśne
środowisko kwaśne
(
ox-
ox-
bas
bas)
8
0
MnO
4
-
+ 5e
0
5
Mn
2+
+ 4O
2-
środowisko obojętne
środowisko obojętne
(
ox-
ox-
bas
bas)
8
0
MnO
4
-
+ 3e
4
3
MnO
2
0
+ 2O
2-
środowisko zasadowe
środowisko zasadowe
(
ox
ox
)
8
0
MnO
4
-
+ e
8
1
MnO
4
2-
środowisko silnie zasadowe
środowisko silnie zasadowe
(
ox
ox
)
8
0
MnO
4
-
+ 2e
8
2
MnO
4
3-
e
z
(e
v
)
G
ox
0
1
2
3
5
7
8
4
0
6
1
2
3
4
5
6
8
7
12 AO
6
4-
AO
6
10-
AO
4
0
MnO
4
-
MnO
4
4-
MnO
4
5-
MnO
4
6-
Mn
2
O
7
0
Mn
2
O
7
6-
Mn
2
O
7
8-
Mn
2
O
7
10-
MnO
3
0
MnO
3
2-
MnO
3
3-
MnO
3
4-
Mn
2
O
5
2-
Mn
2
O
5
4-
Mn
2
O
5
6-
MnO
2
-
MnO
2
2
-
Mn
2
O
3
0
Mn
2
O
3
2
-
MnO
0
MnO
+
Mn
2
O
2+
Mn
0
Reakcje jonu MnO
Reakcje jonu MnO
4
4
-
-
Mn
3+
-4
-4
O
O
2
2-
+ 5e
+ 5e
-
MnO
4
-
-2
-2
O
O
2
2-
+ 3e
+ 3e
-
+ e
+ e
-
+ e
+ e
-
MnO
2
0
Mn
2+
MnO
4
2-
MnO
4
3-
Reakcje nie
Reakcje nie
sprzężone
sprzężone
(
red-
red-
ac
ac
-
ox-
ox-
bas
bas)
Bilans reakcji :
Bilans reakcji :
Bilans red-ox :
Bilans red-ox :
(
ox-
ox-
bas
bas)
2
8
0
MnO
4
-
+ 2
0
5
Mn
2+
+ 8O
2-
(
red
red
ac
ac)
5
6
2
SO
3
2-
+ 5O
2-
5
8
0
SO
4
2-
+
2
8
0
MnO
4
-
+
+
5
6
2
SO
3
2-
2
0
5
Mn
2+
+
5
8
0
SO
4
2-
+ 3O
2-
Bilans ac-bas :
Bilans ac-bas :
2
8
0
MnO
4
-
+
+
5
6
2
SO
3
2-
2
0
5
Mn
2+
+ 5
8
0
SO
4
2-
+
ac-
ac-
bas
bas
+ 6
-3
8
H
3
O
+
9
-2
8
H
2
O
2
8
0
MnO
4
-
+
+
5
6
2
SO
3
2-
+ 6
-3
8
H
3
O
+
2
0
5
Mn
2+
+
5
8
0
SO
4
2-
+ 9
-2
8
H
2
O
2
2
8
0
MnO
4
-
+
+
5
5
6
2
SO
3
2-
+ 6
-3
8
H
3
O
+
2
2
0
5
Mn
2+
+
5
5
8
0
SO
4
2-
+
9
9
-2
8
H
2
O
10e
10e
10e
3O
2-
3O
2-
Reakcje nie
Reakcje nie
sprzężone
sprzężone
(
red-
red-
ac
ac
-
ox-
ox-
bas
bas)
Bilans reakcji :
Bilans reakcji :
Bilans red-ox :
Bilans red-ox :
(
ox-
ox-
bas
bas)
2
8
0
MnO
4
-
+ 2
0
5
Mn
2+
+ 8O
2-
(
red
red
ac
ac)
5
-2
6
CH
3
OH
0
5
0
4
CH
2
O
0
+ 10
H
+
+
2
8
0
MnO
4
-
+
+
5
-2
6
CH
3
OH
0
2
0
5
Mn
2+
+ 5
-2
6
CH
3
OH
0
+
3O
2-
+5
-
2
8
H
2
O
Bilans ac-bas :
Bilans ac-bas :
2
8
0
MnO
4
-
+
+
5
-2
6
CH
3
OH
0
2
0
5
Mn
2+
+ 5
-2
6
CH
3
OH
0
+
3O
2-
+5
-
2
8
H
2
O
ac-
ac-
bas
bas
+ 6
-3
8
H
3
O
+
9
-2
8
H
2
O
2
8
0
MnO
4
-
+
+
5
-2
6
CH
3
OH
0
+ 6
-3
8
H
3
O
+
2
0
5
Mn
2+
+ 5
-2
6
CH
3
OH
0
+ 14
-2
8
H
2
O
10e
10e
3O
2-
3O
2-
2
8
0
MnO
4
-
+
+
5
-2
6
CH
3
OH
0
+ 6
-3
8
H
3
O
+
2
0
5
Mn
2+
+ 5
-2
6
CH
3
OH
0
+ 14
-2
8
H
2
O
e
z
e
v
1
0
2
3
4
5
6
7
8
0
1
2
3
4
5
6
7
8
AO
4
n-8
AO
2
n-4
AO
2
n-6
AO
2
n-8
A
n+
A
n-8
AO
n-6
A
n-4
A
n-2
A
n-6
AO
3
n-8
AO
n-8
X
X
X
X
X
X
X
X
X
AO
3
n-6
AO
n-2
AO
n-4
X
Właściwości
kwasowe
kwasowe
i
zasadowe
zasadowe
drobin
Wzrost właściwości zasadowych
Wzrost właściwości zasadowych
CO
2
CO
3
2-
SO
2
SO
3
2-
SO
3
SO
3
2-
Wzrost właściwości kwasowych
Wzrost właściwości kwasowych

Właściwości
kwasowe
kwasowe
i
zasadowe
zasadowe
drobin
ac bas
H
H
+
+
ClO
4
-
ClO
3
-
ClO
2
-
Odl. Cl - O
142 pm 148 pm
157 pm
BrO
4
-
BrO
3
-
BrO
2
-
Odl. Br - O
160 pm 165 pm
172 pm
bas
SO
4
2-
SO
3
2-
Odl. S - O
145 pm
151 pm
SeO
4
2-
SeO
3
2-
Odl. Se - O
162 pm 169 pm
AsO
4
3-
AsO
3
3-
Odl. As - O
167 pm 177 pm
O
O
2-
2-

Właściwości
kwasowe
kwasowe
i
zasadowe
zasadowe
drobin
ac bas
H
+
HClO
4
HClO
3
Odl. Cl - OH
160 pm ? pm
ac
ac
HSO
4
-
HSO
3
-
Odl. S - OH
155
pm
145 pm
HSeO
4
-
HSeO
3
-
Odl. Se - OH
172 pm 178 pm
H
2
SeO
4
H
2
SeO
3
Odl. Se-OH
168 pm 174 pm

Właściwości
kwasowe
kwasowe
i
zasadowe
zasadowe
drobin
ac
ac
bas
bas
H
H
+
+
PO
4
3-
HPO
3
2-
H
2
PO
2
-
Odl. P-O
155 pm 152,6 pm
151,3 pm
bas
bas
CO
3
2-
HCO
2
-
Odl. C - O
128 pm
124 pm

Właściwości
kwasowe
kwasowe
i
zasadowe
zasadowe
drobin
ac
ac
bas
bas
H
+
HPO
4
2-
H
2
PO
3
-
H
3
PO
2
Odl. P-OH
160 pm 156 pm
- pm
ac
ac
HCO
3
-
H
2
CO
2
Odl. C-OH
135
pm
132 pm
HSiO
4
3-
HPO
4
2-
HSO
4
-
HClO
4
Odl. A-OH
169
pm 162 pm 156 pm
160 pm
Odl. A-O
161 pm 154 pm 145
pm 141 pm

Właściwości
kwasowe
kwasowe
i
zasadowe
zasadowe
drobin
ac
ac
bas
bas
H
H
+
+
HPO
4
2-
H
2
PO
3
-
H
3
PO
2
Odl. P-OH
160 pm 156 pm
- pm
ac
ac
HSiO
4
3-
HPO
4
2-
HSO
4
-
HClO
4
Odl. A-OH
169
pm 162 pm 156 pm
160 pm
Odl. A-O
161 pm 154 pm 145
pm 141 pm

Właściwości
kwasowe
kwasowe
i
zasadowe
zasadowe
drobin
ac
ac
bas
bas
H
+
ClO
4
-
ClO
3
-
ClO
2
-
Odl. Cl - O
141 pm 148 pm
157 pm
bas
bas
SO
4
2-
SO
3
2-
Odl. S - O
145 pm
150 pm
SeO
4
2-
SeO
3
2-
Odl. Se - O
162 pm 169 pm

Właściwości
kwasowe
kwasowe
i zasadowe
zasadowe
drobin
ac bas
H
+
P
2
O
7
4-
HP
2
O
7
3-
H
2
P
2
O
7
2-
H
3
P
2
O
7
-
H
4
P
2
O
7
0
Odl. P - OH
155
pm 157 pm 156
pm
Odl. P - O
142 pm 151-149pm 149 pm
148 pm
Odl. P - O
m
159 pm 162 pm 160
pm
pK
bas
bas
e
z
e
v
1
0
2
3
4
5
6
7
8
0
1
2
3
4
5
6
7
8
AO
4
n-8
AO
2
n-4
AO
2
n-6
AO
2
n-8
A
n+
A
n-8
AO
n-6
A
n-4
A
n-2
A
n-6
AO
3
n-8
AO
n-8
X
X
X
X
X
X
X
X
X
AO
3
n-6
AO
n-2
AO
n-4
X
Właściwości
red - ox
red - ox
drobin
Wzrost właściwości red
Wzrost właściwości red
Wzrost właściwości ox
Wzrost właściwości ox
ClO
4
-
ClO
3
-
ClO
2
-
ClO
-
e
z
e
v
1
0
2
3
4
5
6
7
8
0
1
2
3
4
5
6
7
8
AO
4
n-8
AO
2
n-4
AO
2
n-6
AO
2
n-8
A
n+
A
n-8
AO
n-6
A
n-4
A
n-2
A
n-6
AO
3
n-8
AO
n-8
X
X
X
X
X
X
X
X
X
AO
3
n-6
AO
n-2
AO
n-4
X
Właściwości
redac
redac
i
oxbas
oxbas
drobin
Wzrost właściwości oxbas
Wzrost właściwości oxbas
Wzrost właściwości redac
Wzrost właściwości redac
ClO
4
-
ClO
3
-
ClO
2
-
ClO
-

e
z
e
v
1
0
2
3
4
5
6
7
8
0
1
2
3
4
5
6
7
8
AO
4
n-8
AO
2
n-6
AO
2
n-8
A
n+
A
n-8
AO
n-6
A
n-2
A
n-6
AO
3
n-8
AO
n-8
X
X
X
X
X
X
X
X
X
AO
n-2
X
Reakcje drobin węgla
Reakcje drobin węgla
CO
3
2-
HCO
3
-
CO
2
0
Na
Na
2
2
CO
CO
3
3
(aq)
(aq)
+ HCl
+ HCl
(aq)
(aq)
NaHCO
NaHCO
3
3
+ NaCl
+ NaCl
(aq)
(aq)
6
6
0
0
CO
CO
3
3
2-
2-
+ H
+ H
3
3
O
O
+
+
5
5
0
0
HCO
HCO
3
3
-
-
+ H
+ H
2
2
O
O
NaHCO
NaHCO
3
3
(aq)
(aq)
+ HCl
+ HCl
(aq)
(aq)
CO
CO
2
2
+
+
2NaCl
2NaCl
(aq)
(aq)
5
5
0
0
HCO
HCO
3
3
-
-
+ H
+ H
3
3
O
O
+
+
4
4
0
0
CO
CO
2
2
0
0
+ 2H
2
O
MgCO
MgCO
3
3
(s)
(s)
CO
CO
2
2
+
+
MgO
MgO
(s)
(s)
6
6
0
0
CO
CO
3
3
2-
2-
4
4
0
0
CO
CO
2
2
0
0
+ O
2-
t~500°C
CO
0
C
n
0
CO
CO
2
2
(g)
(g)
+
+
C
C
(s)
2
2CO
CO
(g)
CO
CO
2
2
(g)
(g)
+ Mg
+ Mg
(s)
(s)
C
C
(g)
+
+
MgO
MgO
(s)
(s)
e
z
e
v
1
0
2
3
4
5
6
7
8
0
1
2
3
4
5
6
7
8
AO
4
n-8
AO
2
n-8
A
n+
A
n-8
AO
n-6
A
n-4
A
n-2
A
n-6
AO
3
n-8
AO
n-8
X
X
X
X
X
X
X
X
X
AO
n-4
X
Reakcje drobin węgla
Reakcje drobin węgla
CO
3
2-
CO
2
0
Na
Na
2
2
C
C
2
2
O
O
4
4
(s)
(s)
Na
Na
2
2
CO
CO
3
3
(g)
+
+
CO
CO
(g)
(g)
4
4
0
0
C
C
2
2
O
O
4
4
2-
2-
4
4
0
0
CO
CO
2
2
0
0
+
+
4
4
2
2
CO
CO
2
2
2-
2-
4
4
0
0
CO
CO
2
2
0
0
+
+
4
4
2
2
CO
CO
2
2
2-
2-
6
6
0
0
CO
CO
3
3
2-
2-
+
+
2
2
2
2
CO
CO
0
0
4
4
0
0
C
C
2
2
O
O
4
4
2-
2-
6
6
0
0
CO
CO
3
3
2-
2-
+
+
2
2
2
2
CO
CO
0
0
t~600°C
C
2
O
4
2-
CO
2
2-
CO
0
1
2
1
2
2
MgC
MgC
2
2
O
O
4
4
(s)
(s)
MgO
MgO
(s)
+ CO
CO
2
2
(g)
+
+ CO
CO
(g)
(g)
Ag
Ag
2
2
C
C
2
2
O
O
4
4
(s)
(s)
Ag
Ag
0
0
(s)
+ 2CO
CO
2
2
(g)
3
3
e
z
e
v
1
0
2
3
4
5
6
7
8
0
1
2
3
4
5
6
7
8
AO
4
n-8
AO
2
n-8
A
n+
A
n-8
AO
n-6
A
n-2
A
n-6
AO
3
n-8
AO
n-8
X
X
X
X
X
X
X
X
X
AO
3
n-6
AO
n-2
X
CO
0
CO
2
0
C
n
0
2CO
CO
0
0
(g)
(g)
CO
CO
2
2
(g)
+
+
CO
CO
(g)
(g)
CO
CO
(g)
(g)
+ NaOH
+ NaOH
NaHCO
NaHCO
2
2
2
2
2
CO
CO
0
0
+
+ OH
- 3
3
2
2
HCO
HCO
2
-
CsHCO
CsHCO
2
2
+
+ Cs
0
Cs
Cs
2
2
CO
CO
2
2
+
1
/
2
H
2
3
3
2
2
HCO
HCO
2
2
-
-
4
4
2
2
CO
CO
2
2
2-
2-
+
+
1
/
2
H
2
HCO
2
-
CO
2
2-
Reakcje drobin węgla
Reakcje drobin węgla
2CO
2CO
(g)
(g)
+ 2Na
+ 2Na
0
(NH3)
2
2Na
Na
2
2
CO
CO
2
mCO
mCO
(g)
(g)
+ n
+ nH
2
(H
H
x
x
C
C
y
y
O
O
z
z
)
C
2
O
2
2-
Gaz syntezowy
Różne związki
organiczne
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
- Slide 40
- Slide 41
- Slide 42
- Slide 43
- Slide 44
- Slide 45
- Slide 46
- Slide 47
- Slide 48
- Slide 49
- Slide 50
- Slide 51
- Slide 52
- Slide 53
- Slide 54
- Slide 55
- Slide 56
- Slide 57
- Slide 58
- Slide 59
- Slide 60
- Slide 61
- Slide 62
- Slide 63
- Slide 64
- Slide 65
- Slide 66
- Slide 67
- Slide 68
- Slide 69
- Slide 70
- Slide 71
- Slide 72
- Slide 73
- Slide 74
- Slide 75
- Slide 76
- Slide 77
- Slide 78
- Slide 79
- Slide 80
- Slide 81
- Slide 82
- Slide 83
- Slide 84
- Slide 85
- Slide 86
- Slide 87
- Slide 88
- Slide 89
- Slide 90
- Slide 91
- Slide 92
- Slide 93
- Slide 94
- Slide 95
- Slide 96
Wyszukiwarka
Podobne podstrony:
zagadnienia do egzaminu z Podstaw chemicznych, Studia, Chemia, Podstawy chemiczne nauk o Ziemi - dla
Tarcie na poziomie atomowym, UŁ Chemia, Technologia chemiczna
Gimznazjum Sprawdziany Chemia Związki chemiczne w życiu codziennym test
Chemia wiązania chemiczne
Chemia wiązania chemiczne
chemia, kinetyka chemiczna, KINETYKA CHEMICZNA- 1
J Minczewski,Z Marczenko T2 Chemia Analityczna Chemiczne Metody Analizy Ilościowej
Materialy wytrzym materialow, Chemia, technologia chemiczna, metaloznawstwo
ZAGADNIENIA NA ĆWICZENIA, Studia, Chemia, Podstawy chemiczne nauk o Ziemi - dla studentów 2012-13
Chemia - wskaźniki chemiczne, przydatne teksty (np. do szkoły)
Metaloznawstwo, Chemia, technologia chemiczna, metaloznawstwo
Chemia V Wiązania chemiczne
TEMATY SPRAWDZIANÓW-I i II sem, Materialy aktulane, Chemia, Pracownia chemiczna 2013
chemia, zwiazki chemiczne
chemia, Substancjie chemiczne - male, Acetylen
sprawdzian G kl III chemia obliczenia chemiczne, GIM CHEMIA
J Minczewski,Z Marczenko T2 Chemia Analityczna Chemiczne Metody Analizy Ilościowej
więcej podobnych podstron