
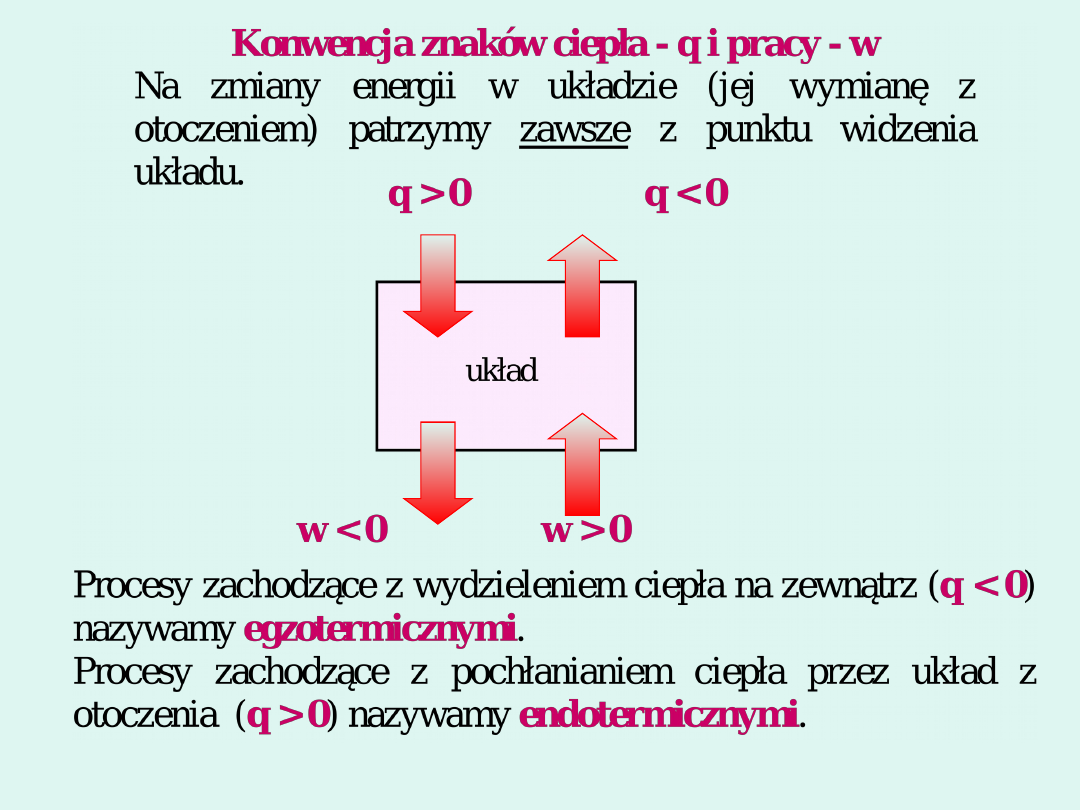
równowag
a
termiczna
równowag
a
termiczna
równowa
ga
termiczna
A ,
T
A
C ,
T
C
B ,
T
B
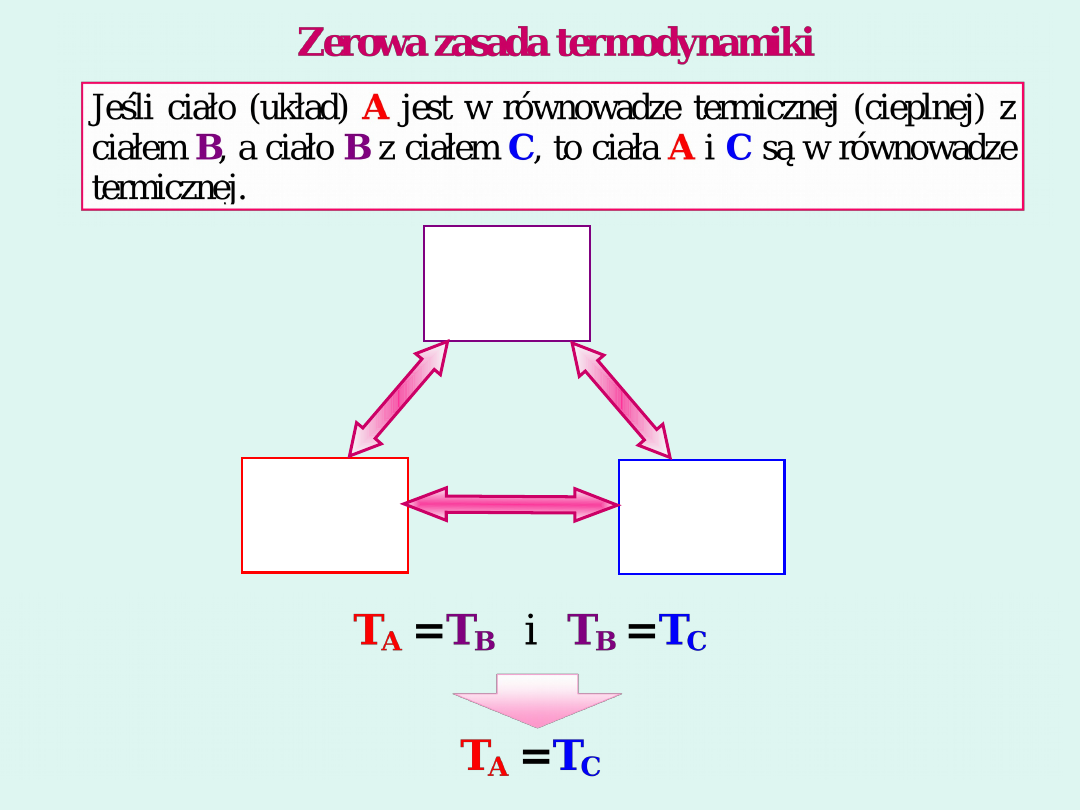
Procesy odwracalne i nieodwracalne
Izotermiczne rozprężanie gazu
V
o
,
p
o
p
k
V
o
,
p
o
p
o
-dp
w sposób nieodwracalny w sposób
odwracalny

Energia wewnętrzna U
jest to suma
wszystkich rodzajów energii zawartych w
układzie
(energii
kinetycznej
ruchu
postępowego i rotacyjnego cząsteczek,
energii kinetycznej i potencjalnej oscylacji
cząsteczek,
energii
oddziaływań
międzycząsteczkowych, energii oddziaływań
cząsteczek z zewnętrznymi polami), za
wyjątkiem energii kinetycznej i potencjalnej
układu jako całości.

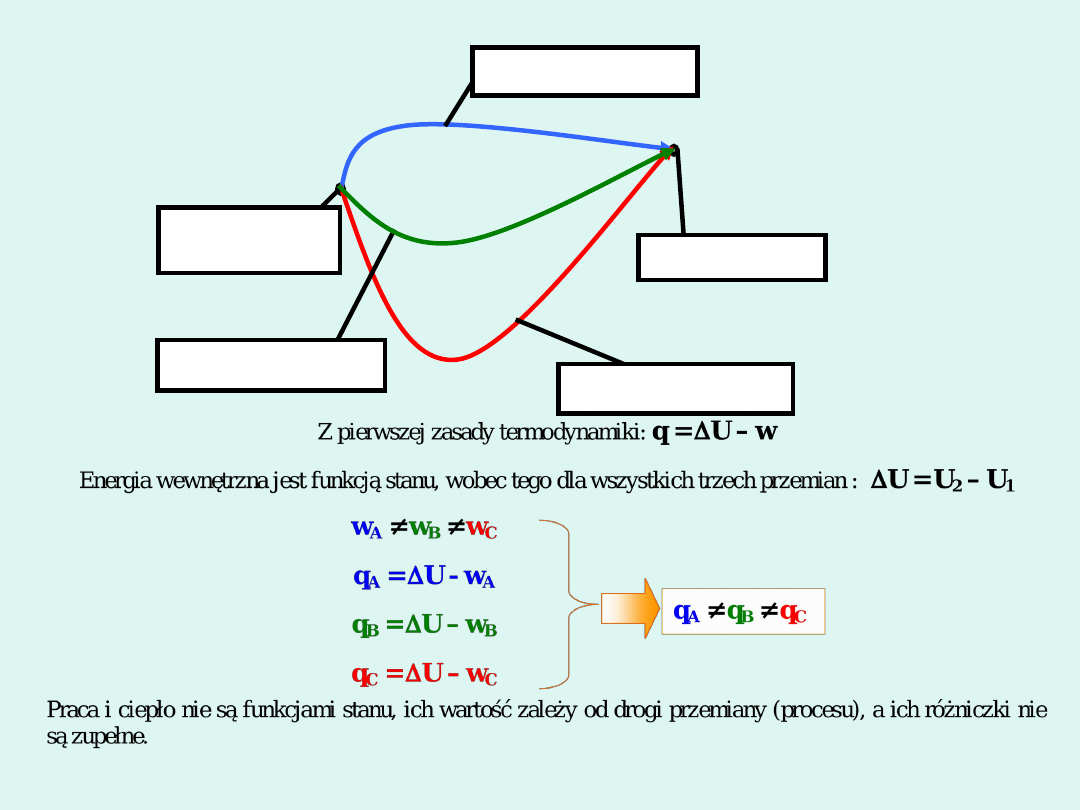
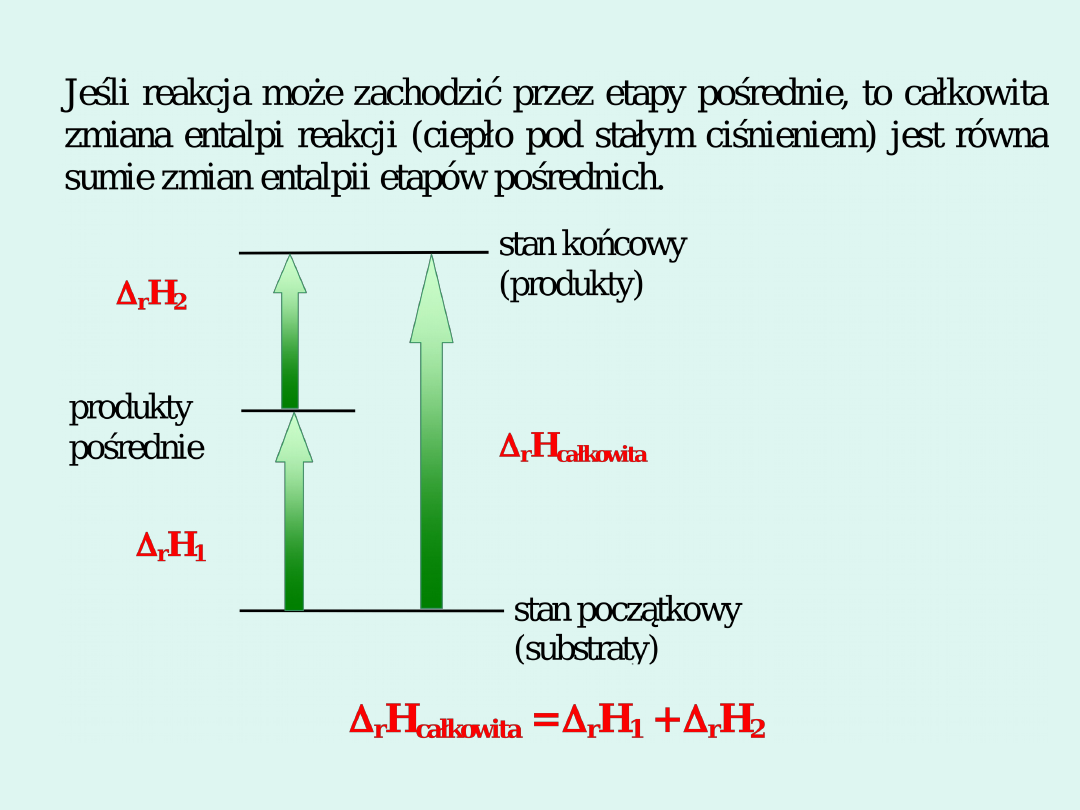
stan
początkowy
U
1
stan końcowy
U
2
przemiana
A, w
A
,
q
A
przemiana
B,
w
B
, q
B
przemiana
C, w
C
,
q
C
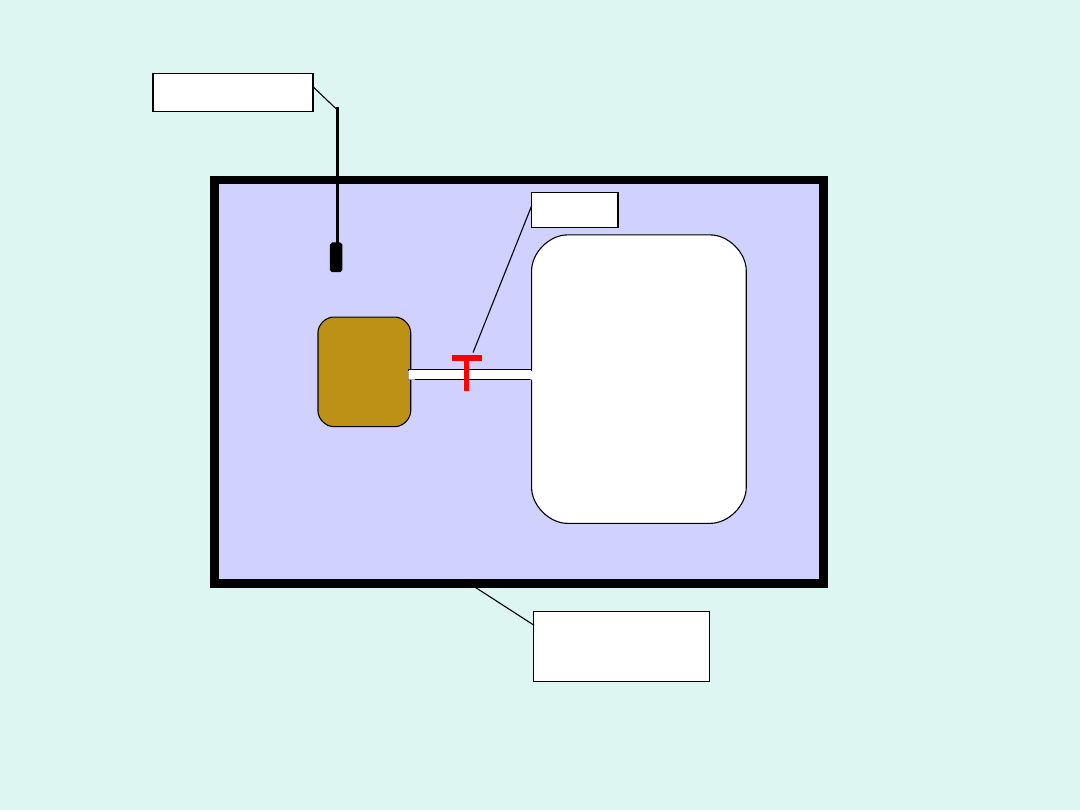
p
1
,V
1
próżnia,
V
2
kran
termomet
r
zbiornik z wodą
izolacja
cieplna
Doświadczenie Joule’a
obserwacja
–
temperatura nie
zmieniła się

Wniosek z doświadczenia Joule’a
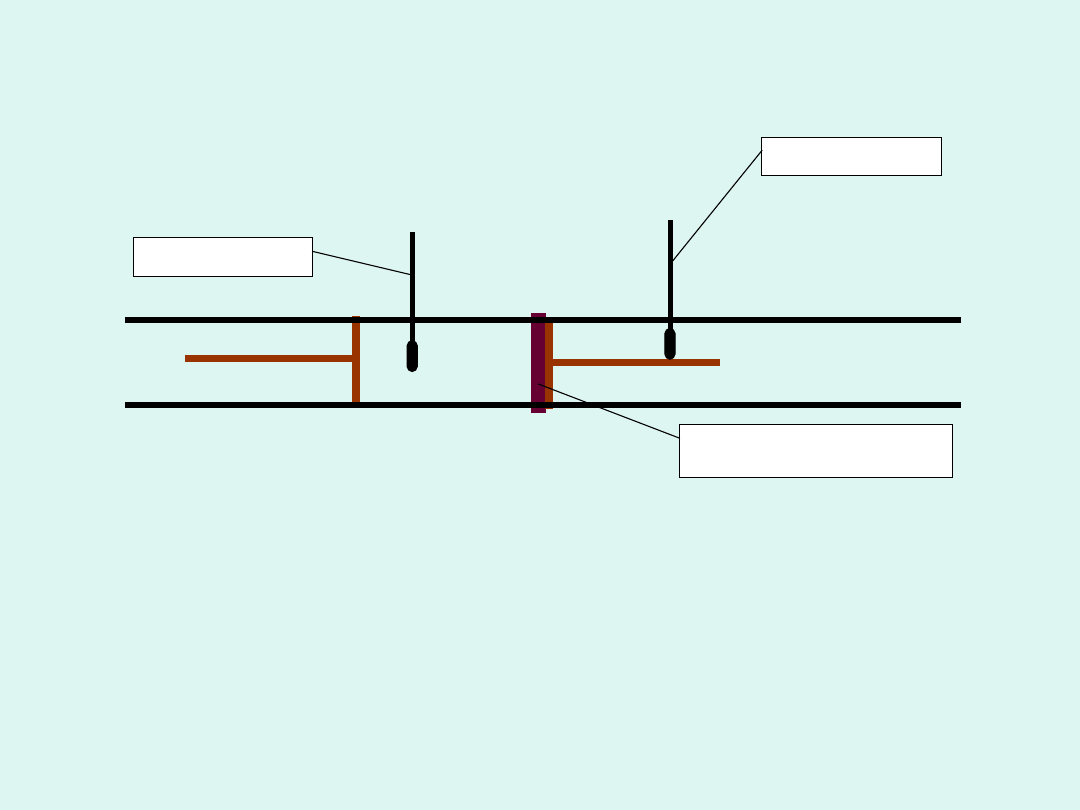
przegroda
porowata
p
1,
V
1
termomet
r
T
1
termomet
r
T
2
p
2,
V
2
Doświadczenie Joule’a-Thomsona
Układ jest izolowany termicznie –proces zachodzi w
sposób adiabatyczny
obserwacje
– w zależności od rodzaju gazu i
początkowej temperatury końcowa temperatura
po dławieniu rosła lub malała
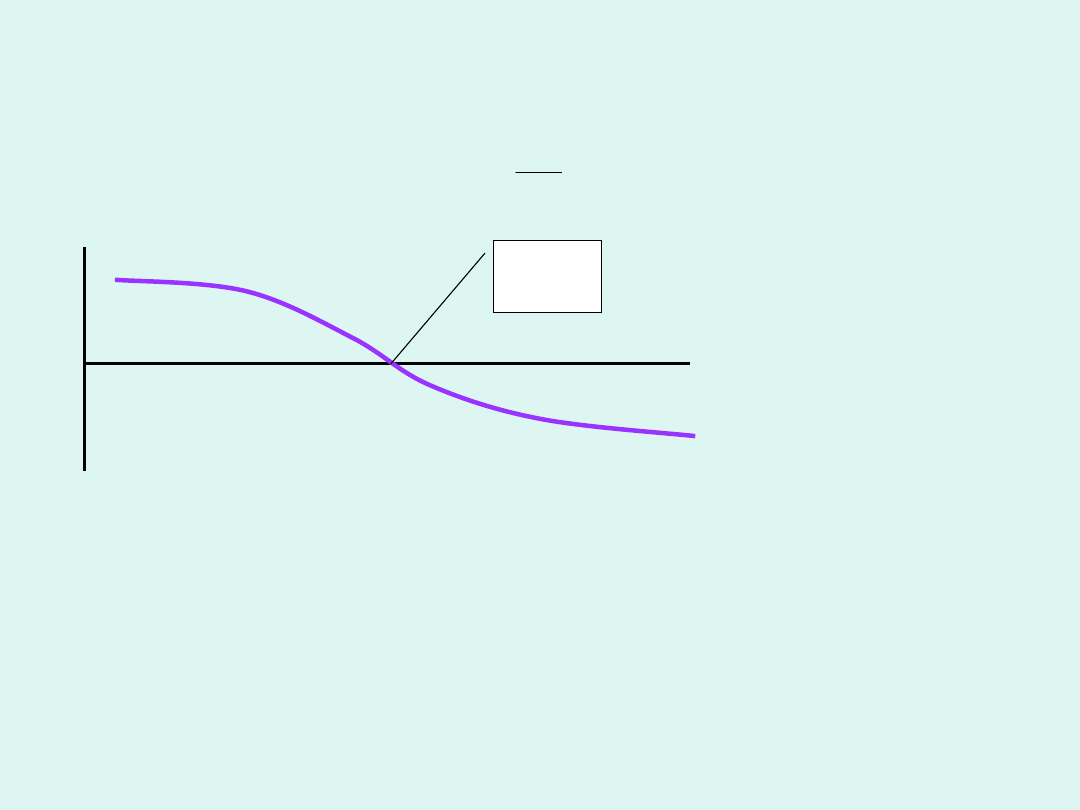
Współczynnik Joule’a – Thomsona
H
JT
p
T
T
JT
0
T
inw
0
JT
dla gazu
doskonałe
go
Jeśli to gdy ciśnienie maleje, to
temperatura gazu maleje.
Jeśli to gdy ciśnienie maleje, to
temperatura gazu rośnie.
0
JT
0
JT

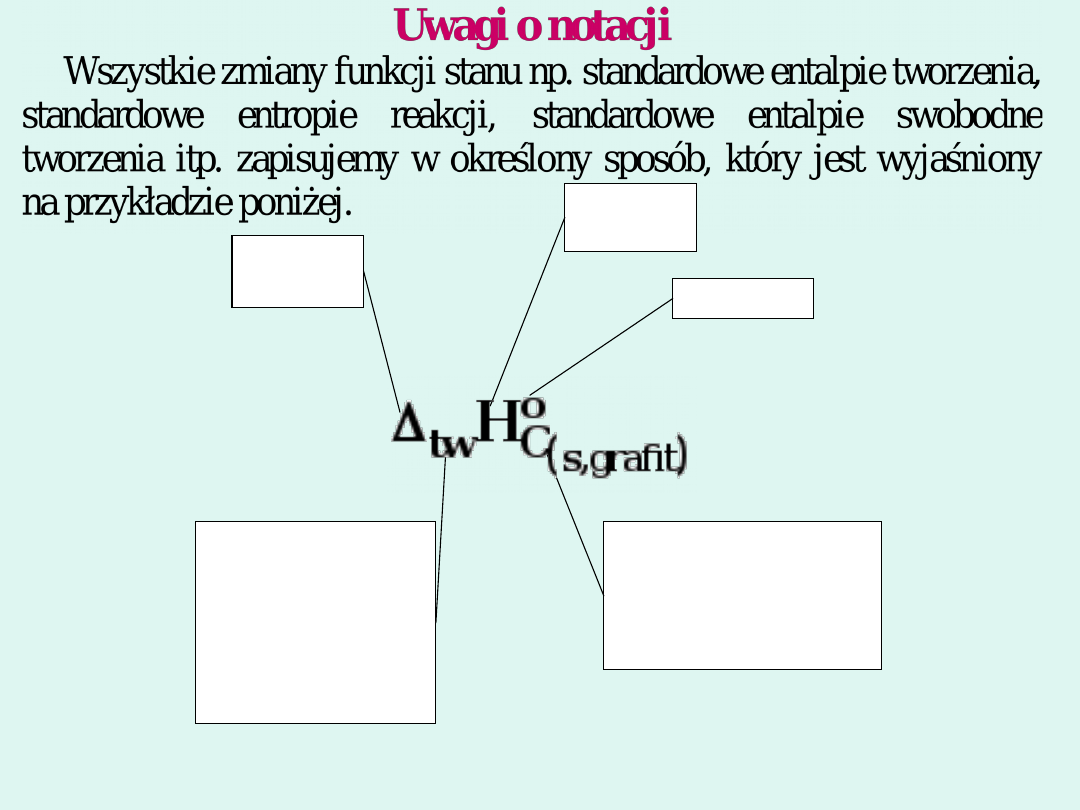
symbol
przyrostu
dolny indeks –
dodatkowe informacje
np. jakiej substancji
dotyczy, czasem
informacje o
temperaturze, itp
skrót rodzaju
reakcji lub
przemiany (jako
dolny indeks) np
r -reakcja
tw-tworzenia
p.f.-przemiana
fazowa
itp.
symbol
funkcji
standardo
wy

Stan standardowy
substancji to jej stan
w czystej postaci pod ciśnieniem 10
5
Pa w
dowolnej temperaturze.
ciśnienie standardowe p
o
= 10
5
Pa
Standardowa
entalpia
reakcji
(standardowa zmiana entalpii reakcji) bądź
przemiany fizycznej to różnica entalpii
czystych,
rozdzielonych
produktów
i
czystych, rozdzielonych substratów w
stanie
standardowym
w
tej
samej,
określonej temperaturze
.

Stanem standardowym dla roztworu
jest
stan roztworu nieskończenie rozcieńczonego
w warunkach standardowych, przy czym
elektrolity są całkowicie zdysocjowane na
jony, a cząsteczki bądź jony są solwatowane
.
Standardowa entalpia rozpuszczania
jest
to
zmiana
entalpii
towarzysząca
rozpuszczeniu 1 mola czystego związku w
warunkach standardowych, w nieskończenie
dużej
liczbie
moli
rozpuszczalnika
z
utworzeniem
roztworu
nieskończenie
rozcieńczonego,
w
którym
jony
bądź
cząsteczki są solwatowane.


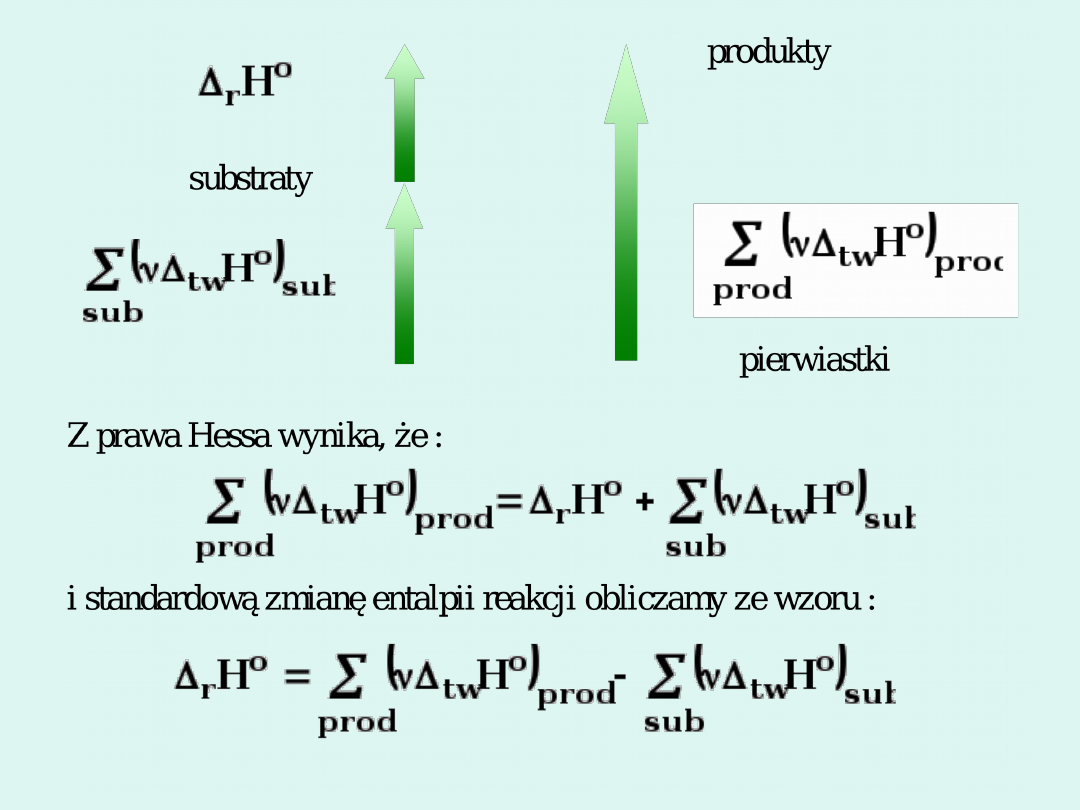
Standardowa
entalpia
tworzenia
związku
chemicznego
to zmiana entalpii towarzysząca
utworzeniu 1 mola związku z czystych, rozdzielonych
pierwiastków w warunkach standardowych, przy czym
powstający związek jak i pierwiastki muszą być w
najtrwalszej
w
tych
warunkach
odmianie
termodynamicznej. Standardowa entalpia tworzenia
pierwiastków
w
ich
najtrwalszej
odmianie
termodynamicznej wynosi zero.
Standardowa entalpia tworzenia jonu
to zmiana
entalpii
towarzysząca
powstaniu
1
mola
solwatowanych jonów w rozcieńczeniu nieskończenie
wielkim z czystych, rozdzielonych pierwiastków w
warunkach standardowych. Standardowa entalpia
tworzenia
jonu
wodorowego
w
dowolnym
rozpuszczalniku i temperaturze wynosi zero.
(
)
solw
o
tw H
H
0
+
D
=

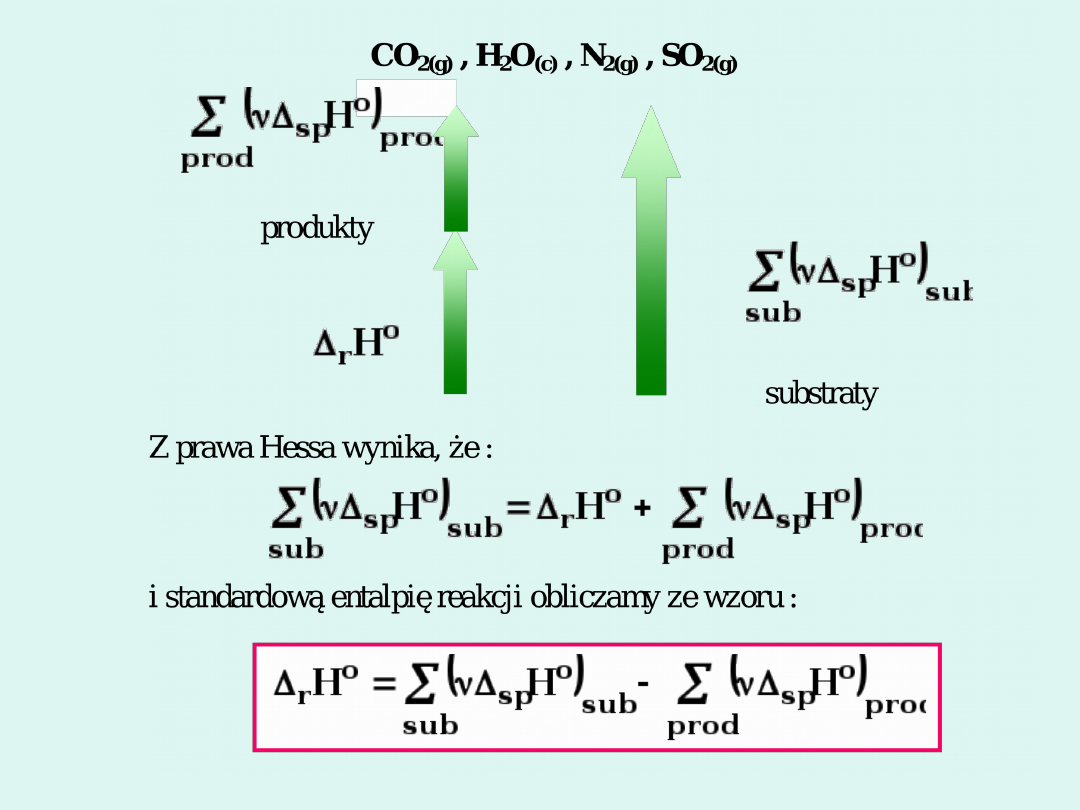
Standardowa entalpia spalania
to zmiana
entalpii towarzysząca pełnemu utlenieniu 1
mola związku w czystym tlenie, przy czym
jako produkty reakcji powstają : CO
2(g)
,
H
2
O
(c)
,
N
2(g)
,
SO
2(g)
,
w
warunkach
standardowych.

Energia wiązania
jest to pewna umowna
wielkość
przypisywana
wiązaniu
w
cząsteczce w ten sposób, że suma energii
wiązań jest równa entalpii rozpadu 1 mola
związku w stanie gazowym na atomy w
stanie gazowym w temperaturze 0 K, przy
czym analogiczne wiązania traktuje się
jako równocenne energetycznie.
C H
H
H
H
C
(g)
+ 4 H
(g)
C
(s,grafit)
+ 2 H
2(g)
gazowy
-
tw
H
o
4 E
C-
H
dys
H
o
sub
H
o
( )
(
)
( )
4 g
s,graf
2 g
o
o
o
C-H
tw CH
sub C
dys H
4 E
H
H
2
H
=- D
+D
+ D
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
Wyszukiwarka
Podobne podstrony:
3 Wykład Ch F I zasada1 2
5 Wykład Ch F II zasada1
Wykład Ch F II zasada
Wykład Ch F konduktometria
Wykład Ch F wielkości kol
Wykład Ch F potencjometria
10 Wykład Ch F wielkości koligatywne
więcej podobnych podstron