
SPEKTROSKOPIA
jest nauką, która bada i
wyjaśnia oddziaływania pomiędzy materią
będącą zbiorowiskiem atomów i cząsteczek a
promieniowaniem elektromagnetycznym.
Promieniowanie
elektromagnetyczne
jest
falowym
zaburzeniem
pola
elektromagnetycznego rozchodzącym się w
próżni z prędkością światła. W fizycznym
opisie promieniowania zakłada się jego
dualistyczną
naturę
.
Z
jednej
strony
uwzględnia się jego
charakter falowy
, a z
drugiej strony traktuje się je jako wiązkę
cząstek
–
fotonów,
mających
określoną
energię
.
Do badania budowy związków organicznych
metodami
spektroskopowymi
stosuje
się
promieniowanie
elektromagnetyczne
o
różnych zakresach długości fali, od ultrafioletu
aż do fal radiowych.
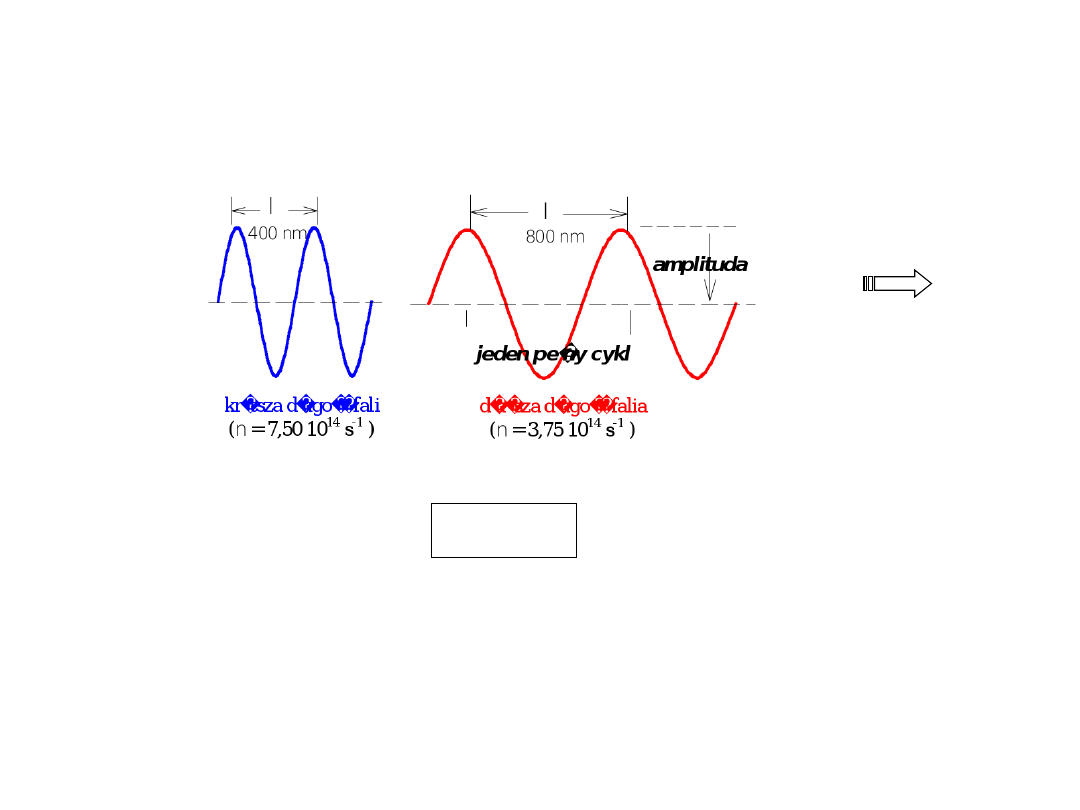
czas
(1 cykl/sek = 1
Hz)
odległość
(1 cykl/cm = 1
cm
-1
)
PROMIENIOWANIE ELEKTROMAGNETYCZNE
gdzie (c) - prędkość rozchodzenia się fali
elektromagnetycznej w próżni, tzw. prędkość światła,
jest wielkością stałą i wynosi, c = 2.9979 10
8
ms
-1
= 2.9979 10
10
cms
-1
.
λ
c
Fali promieniowania elektromagnetycznego można przypisać
długość () i/lub częstość (). Obydwie wielkości są ze sobą
związane zależnością:
Częstość ()
–
liczbę pełnych cykli fali przechodzących
przez dany punkt w każdej sekundzie, w miarę jak fala
przesuwa się w przestrzeni, mierzy się w cyklach na sekundę
(cps – cycles per second) lub w hercach (Hz- hertz)
Liczba falowa ( = 1/ = /c )
– liczba pełnych cykli fali
na cm
(cm
-1
)
Długość fali ()
– długość jednego pełnego cyklu fali,
wyraża się w:
metrach (m) lub centymetrach (1 cm = 10
-2
m)
mikrometrach (1 m = 10
-6
m) [ starsza nazwa
mikron, ]
nanometrach (1 nm = 10
-9
m) [ starsza nazwa
milimikron, m ]
_
podwielokrotności
decy, centy
mili = 10
-3
mikro = 10
-6
nano = 10
-9
piko = 10
-12
femto = 10
-15
atto = 10
-18
wielokrotności
deka, hekto
kilo (k) = 10
3
mega (M) = 10
6
giga (G) = 10
9
tera (T) = 10
12
peta (P) = 10
15
eksa (E) = 10
18
Angstrem (Å)
= 10
-10
m
(1868 r)
1 Å = 0,1 nm
1 Å = 100 pm
_
hc
λ
c
h
ν
h
E
prędkość światła
(m s
-1
)
częstość
(Hz)
stała
Plancka
energia
kwantu
(J mol
-1
)
liczba falowa
(m
-1
)
stała Plancka (h) = 6,626 10
–34
J s = 1,584 10
-34
cal
s
[1 cal = 4,184 J]
Równanie
Plancka:
długość fali
(m)
PROMIENIOWANIE ELEKTROMAGNETYCZNE
jako wiązka cząstek – FOTONÓW mających określoną
energię E
Energia promieniowania elektromagnetycznego jest
przenoszona jedynie przez ściśle określone porcje
energii zwane kwantami (lub fotonami).
Zależność
energii
przenoszonej
przez
kwanty
promieniowania z wielkościami charakteryzującymi
promieniowanie jako falę jest opisana równaniem
Plancka.
Im wyższa
częstość
() i większa
liczba falowa
( ), tym wyższa
energia
(
). (
)
Im większa
długość fali
( = c / ), tym niższa
energia
(
)
_
nm
w
mol
kcal
10
2,86
nm
w
mol
kJ
10
1,2
c
h
N
E
1
4
-1
5
A
(m)
E = 1,2 10
-4
; 2,86
10
-5
(cm)
E = 1,2 10
-2
; 2,86
10
-3
(m)
E = 1,2 10
2
; 2,86
10
1
Energia 1 mola
fotonów
liczba Avogadro (N
A
) = 6,02 x
10
23
stała Plancka (h) = 6,62 x 10
-31
kJ m
prędkość światła (c) = 3 x 10
8
m/ s
Dogodną relacją wiążącą długość fali (, w nm) z
energią promieniowania elektromagnetycznego (energią 1 mola
fotonów o długości fali ) jest zależność:
200 nm = 600 kJ/mol = 143
kcal/mol;
400 nm = 300 kJ/mol = 71,5
kcal/mol
800 nm = 150 kJ/mol = 35,7
kcal/mol;
2,5 m = 48 kJ/mol = 11,44
kcal/mol;
10 m = 12 kJ/mol = 2,86
kcal/mol;
25 m = 4,8 kJ/mol = 1,14
kcal/mol
N
A
· h · c = 1,2 x 10
-4
kJ · m /
mol
= 2,86 x 10
-5
kcal ·
m / mol
1 m = 0,00012
kJ/mol
5 m = 0,00002
kJ/mol
UV/vis
IR
NMR

_
nm
w
m
w
000
10
cm
w
7
10
1
Dogodną relacją wiążącą długość fali () z liczbą falową (w
cm
-1
) jest zależność:
m () = 10
-6
m
nm = 10
-9
m
(cm
-1
)
=
4000 cm
-1
= 10 000 / 2,5 m;
1000 cm
-1
= 10
000 / 10 m;
666 cm
-1
= 10 000 / 15 m;
400 cm
-1
= 10
000 / 25 m;
12 500 cm
-1
= 10
7
/ 800 nm;
25 000 cm
-1
= 10
7
/
400 nm;
50 000 cm
-1
= 10
7
/ 200 nm
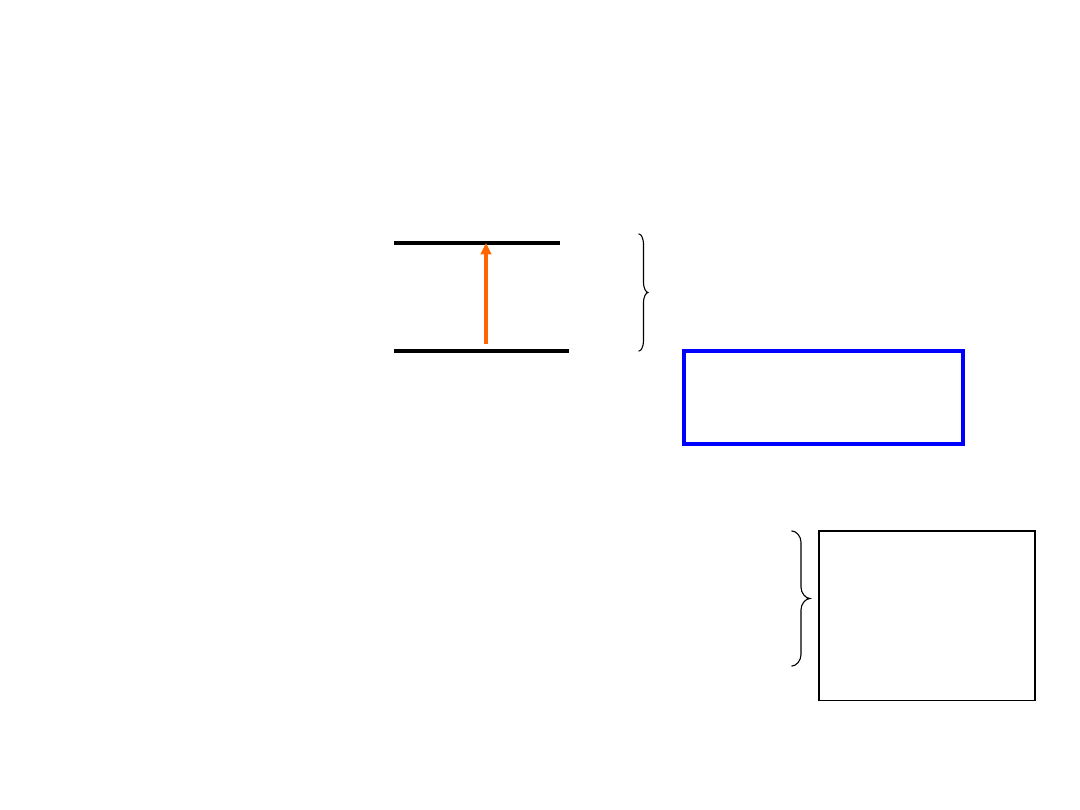
Energia
promieniowania
elektromagnetyc
znego
Różnica
poziomów
energetycznych
cząsteczki
E
2
E
1
h = E = E
2
– E
1
h
ABSORPCJA ENERGII JEST KWANTOWANA
Cząsteczka może absorbować tylko takie kwanty
promieniowania elektromagnetycznego, których energia
ściśle odpowiada różnicy poziomów energetycznych
cząsteczki
Absorpcja energii może:
powodować przejście elektronów z orbitali o niższej
energii (w stanie podstawowym) na orbitale o wyższej
energii (w stanie wzbudzonym)
zmieniać energię drgań oscylacyjnych cząsteczki
zmieniać energię rotacyjną ruchu obrotowego
cząsteczki
zmieniać energię ruchów translacyjnych cząsteczki
energię związaną z ukierunkowaniem spinu
niesparowanych elektronów – (spektroskopia EPR) lub
spinu niektórych jąder w stosunku do wektora indukcji
pola magnetycznego – (spektroskopia NMR)
3N stanów
swobody
N – liczba
atomów w
cząsteczce
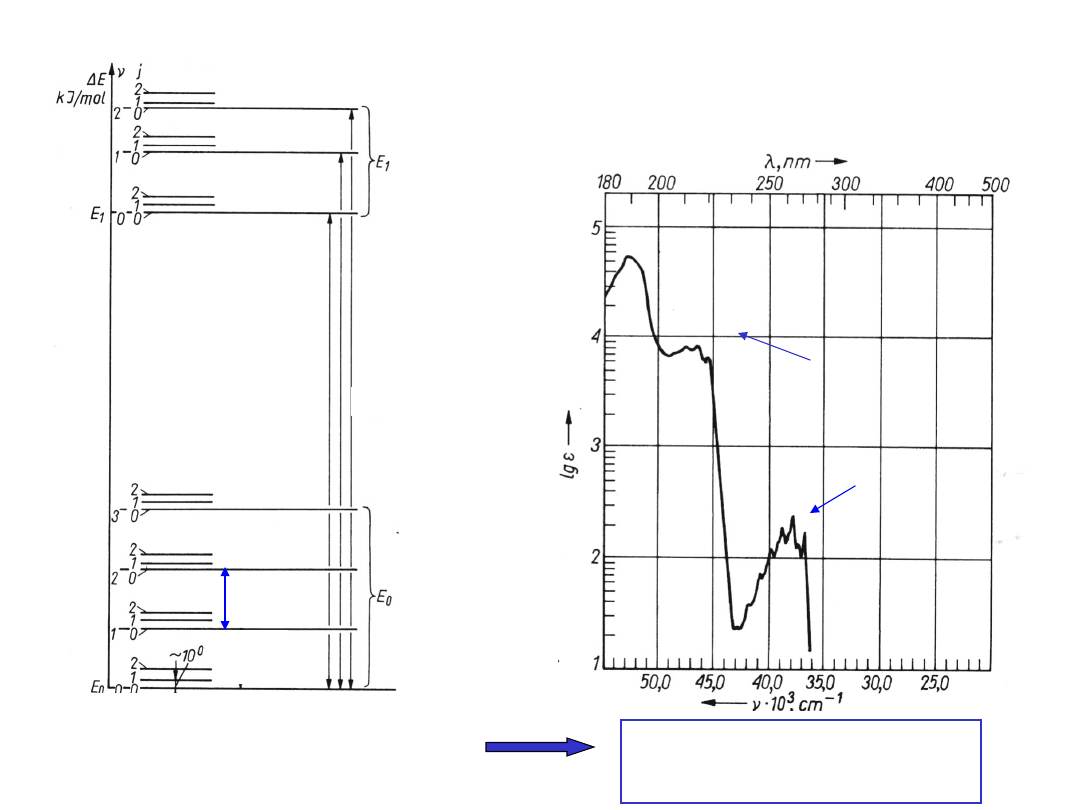
PRZEJŚCIA ELEKTRONOWE
Przejściom elektronowym
towarzyszą zmiany
energii oscylacyjnej i rotacyjnej
cząsteczki
wzbudzo
ne stany
elektrono
we
podstawo
we stany
elektrono
we
~10
3
kJ/m
ol
~10
kJ/m
ol
~1
kJ/mol
Widmo
elektronowe
chlorobenzenu
Szerokie pasma
absorpcji
Struktura
subtelna
przejść
oscylacyjny
ch
energia energia
energia
rotacyjna oscylacyjna
elektronowa
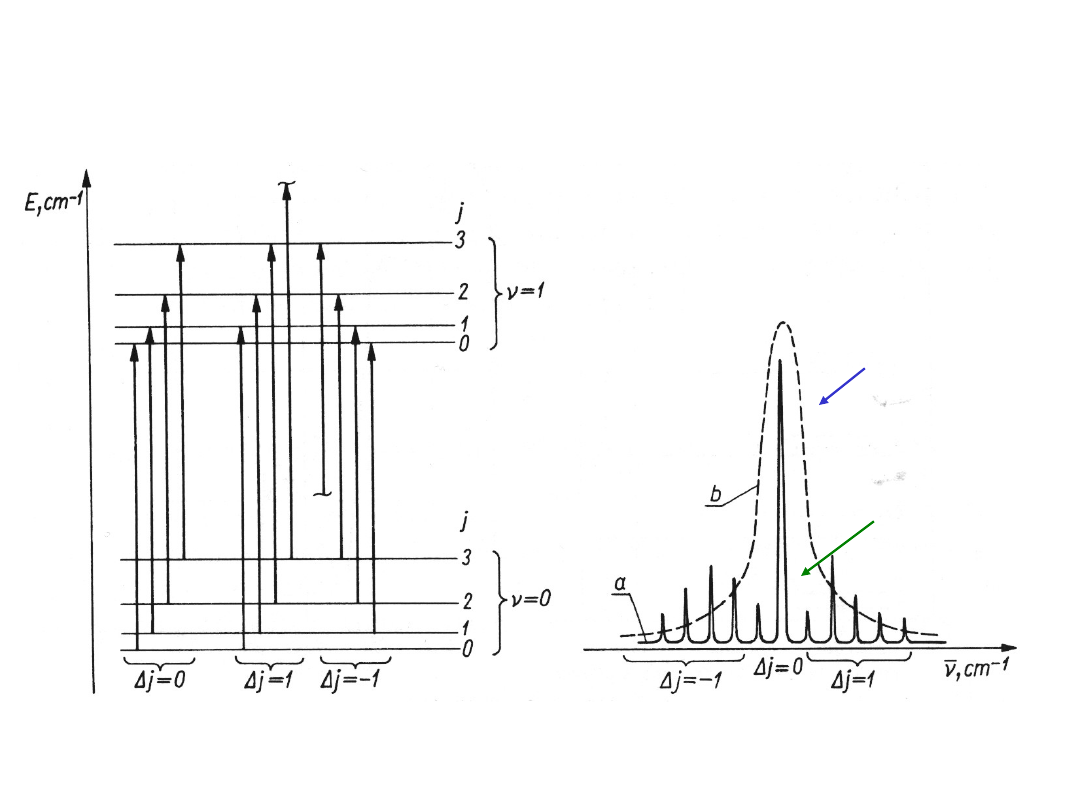
PRZEJŚCIA OSCYLACYJNO -
ROTACYJNE
~10
kJ/m
ol
Widmo
oscylacyjno-
rotacyjne
w fazie
skondensow
anej
w fazie
gazowe
j
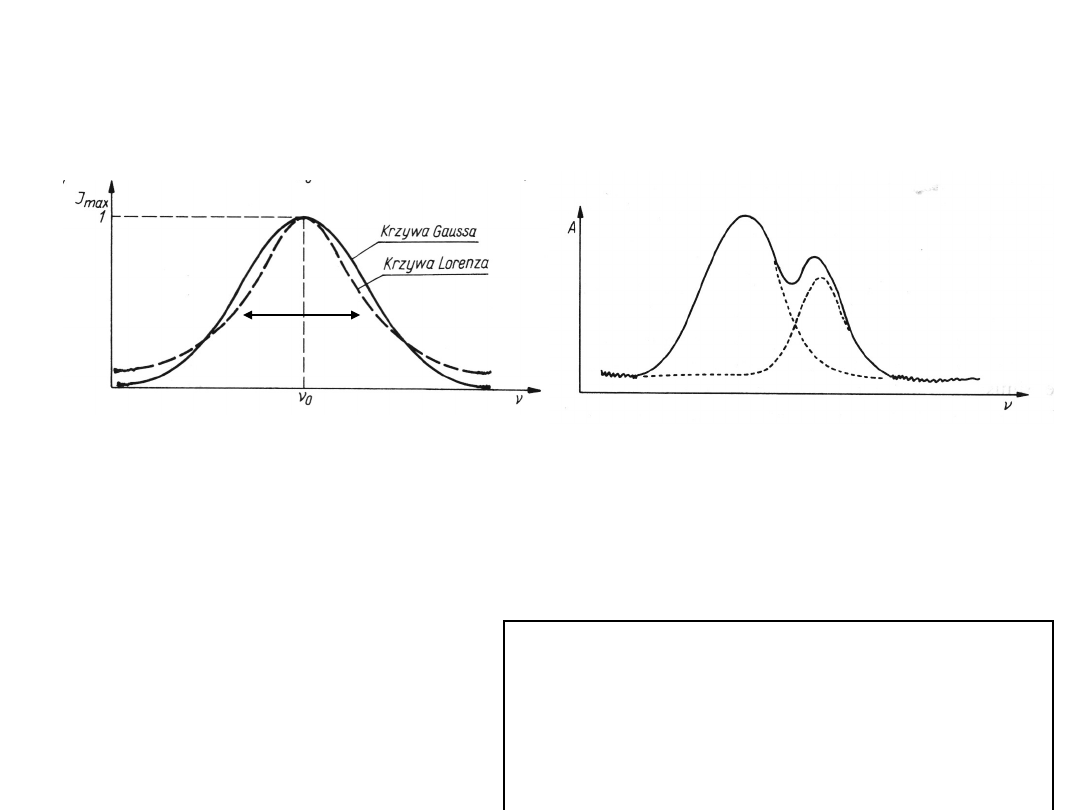
CHARAKTERYSTYKA PASM
ABSORPCYJNYCH
Kształt pasma absorpcji można w przybliżeniu opisać funkcją
Gaussa lub Lorenza
Parametry charakteryzujące absorpcję:
intensywność w maksimum absorpcji I
max
szerokość połówkowa
½
- w połowie wysokości pasma
intensywność integralna I
i
– powierzchnia pod linią pasma
absorpcyjnego
I
ma
x
½
d
I )
(
2
1
ν
ν
i
I
Oddziaływania międzycząsteczkowe
(np. wiązanie wodorowe, oddziaływania
dipolowe) - powodują poszerzenie i
wzrost intensywności pasma. Kształt
pasm absorpcyjnych informuje o
oddziaływaniach
międzycząsteczkowych.
Matematyc
zny rozkład
nakładając
ych się
pasm
absorpcyjn
ych
1
2
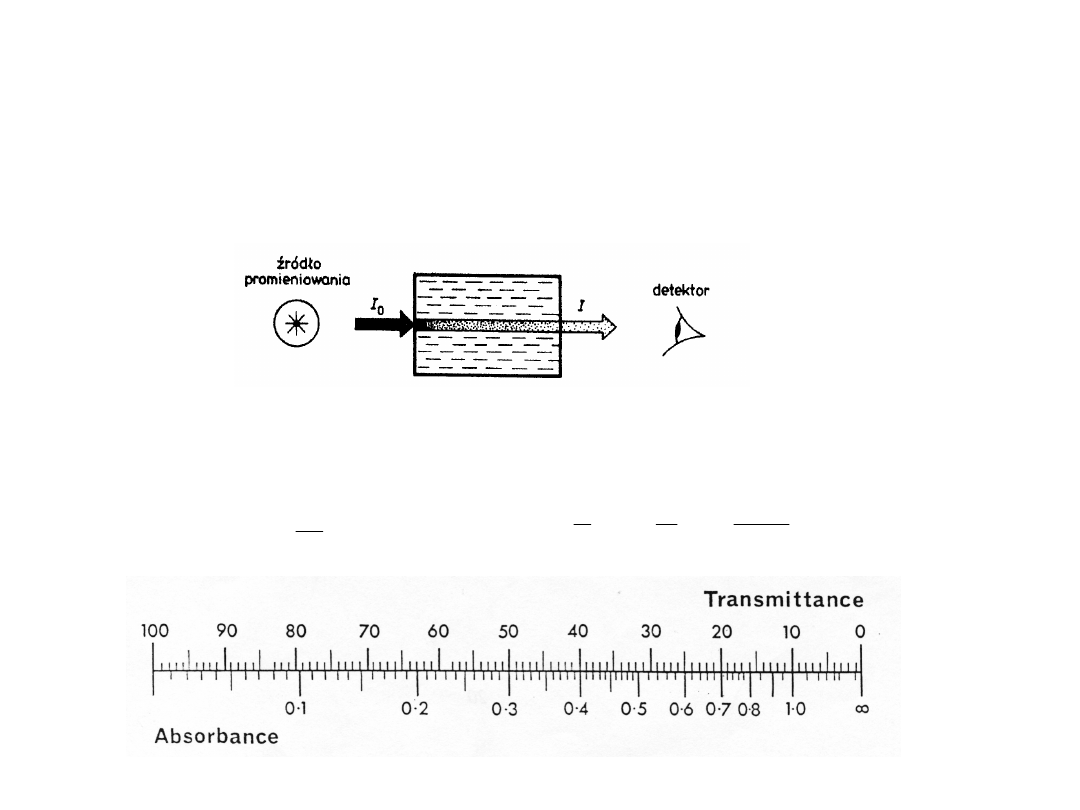
Pomiar spektrometryczny
–sygnał detektora, (I
S
) –
widma NMR i EPR
Pomiar
spektrofotometryczny
–
porównanie
intensywności
promieniowania padającego (I
0
)
i przechodzącego (I) przez próbkę
– widma UV/VIS i IR
ILOŚCIOWA OCENA ZJAWISKA
ABSORPCJI
(określenie ilości zaabsorbowanej energii)
Transmitancja
T
(przepuszczalność),
– jest to stosunek intensywności
promieniowania
przechodzącego przez próbkę (I) do jego
intensywności początkowej (I
0
)
Absorbancja A
– jest to logarytm z odwrotności transmitancji
100
0
I
I
T[%]
T[%]
100
log
I
I
log
T
1
log
A
0

ILOŚCIOWA ANALIZA
SPEKTROSKOPOWA
PRAWO LAMBERTA - BEERA
Absorbancja A jest wprost proporcjonalna do stężenia
(c) i grubości warstwy roztworu (l)
A =
c
l
= A /
c
l
(c) – stężenie w mol dm
-3
(l) – długość drogi optycznej (grubość
kuwety) w cm
(
) – molowy współczynnik absorpcji (dm
3
mol
-1
cm
-1
)
( molowy współczynnik ekstynkcji )
Absorbancja jest wprost proporcjonalna do ilości cząsteczek
absorbujących dane promieniowanie, dlatego łatwo ją powiązać
z chemicznym sposobem (stężeniem) wyrażania ilości
cząsteczek znajdujących się na drodze promieniowania,
zwłaszcza w roztworach.
Document Outline
Wyszukiwarka
Podobne podstrony:
PsychProcPoz - konspekt06 (orzechowski), PSYCHOLOGIA PROCESÓW POZNAWCZYCH - ORZECHOWSKI- WYKLADY, KO
Fotogrametria i SIP wyklad 1 2 3 konspekt
hpz wyklad 6 konspekt
hpz wyklad 7 konspekt
PsychProcPoz - konspekt01 (orzechowski), PSYCHOLOGIA PROCESÓW POZNAWCZYCH - ORZECHOWSKI- WYKLADY, KO
Re wyklad, konspekt, Ustawa z dnia 7 lipca 1994r
Re wyklad, konspekt, Ustawa z dnia 7 lipca 1994r
hpz wyklad 2 konspekt
hpz wyklad 1 konspekt
hpz wyklad 4 konspekt
badania marketingowe rynku wykład, Konspekt ZASADY OPRACOWYWANIA KWESTIONARIUSZA ANKIETOWANEGO, ZASA
badania marketingowe rynku wykład, Konspekt z BMR Wyklad Organizacja badan marketingowych w przedsie
Konspekt wykładu 1, Konspekt wykładu 1
Wykład1 konspekt
Wykład1 konspekt, BHP, SIKORA - Zarządzanie bezpieczeństwem pracy
PsychProcPoz - konspekt03 (orzechowski), PSYCHOLOGIA PROCESÓW POZNAWCZYCH - ORZECHOWSKI- WYKLADY, KO
Fotogrametria i SIP wyklad 5 konspekt
Hodowle komórek i tkanek zwierzęcych wykład 1 konspekt, Studia, I semestr III rok, Praktikum z hodow
więcej podobnych podstron