
WYKŁAD 1
1
Biotechnologie z ochrony
roślin w ochronie
środowiska

WYKŁAD 1
2
Literatura podstawowa
1.Boczek J., Lipa J. Biologiczne metody walki ze
szkodnikami roślin. PWN 1978.
2.Chmiel A. Biotechnologia . Podstawy
mikrobiologiczne i biochemiczne. PWN 1998.
3.I Krajowy Kongres Biotechnologii. Wrocław
1999. Postery.
4.Biotechnologia 2000. Komitet Biotechnologii
PAN. Instytut Chemii Organicznej PAN.
5.Canard M., Beyssat-Arnaouty V. Applied
Biological Control in Mediterranean
Countries. France 1999.
1
2
Literatura uzupełniająca
– referaty
szczegółowe z światowych Kongresów Ochrony
Roślin (1999 Izrael, 2004 Chiny)

WYKŁAD 1
3
3
Ochrona roślin a
ochrona środowiska
Wielodyscyplinarne
problemy ochrony roślin
powinny za punkt
odniesienia przyjmować
ochronę środowiska
rolniczego, czyste
środowisko rolnicze jest
bowiem podstawą
produkcji czystej żywności
mającej być dla ludzi
źródłem nie tylko
pokarmu, ale również
zdrowia.

WYKŁAD 1
4
3
Ochrona roślin a ochrona środowiska
a)zasady IPM i znaczenie dla ochrony
środowiska
b)ochrona gleb i wód przed
zanieczyszczeniem pestycydami i
metalami ciężkimi

WYKŁAD 1
5
4
Metody ochrony roślin w programie
IPM
Zasadniczy rozwój nowoczesnej ochrony
roślin datuje się od połowy ubiegłego
stulecia, kiedy to nastąpił gwałtowny
rozwój nauk przyrodniczych.
Opracowywano i wdrażano najróżniejsze
metody oraz wykorzystywano różne
środki. U podstaw powodzenia leżało
jednak zawsze poznanie biologii i ekologii
szkodników oraz czynników
chorobotwórczych. To dopiero pozwalało
na opracowanie metody lub zespołu
metod przeciwdziałających ich szkodliwej
działalności.

WYKŁAD 1
6
4
Metody ochrony roślin w programie
IPM
W walce ze szkodnikami ludzkość
wykorzystywała różne sposoby.
Jednym z pierwszych była prymitywna
metoda mechanicznego, czyli po prostu
ręcznego, niszczenia szkodników (np. w
starożytności).
Bardzo wcześnie zaczęto również
wykorzystywać proste metody biologiczne.
W miarę jednak powiększania areałów
upraw, a później wprowadzania
wielkoobszarowych upraw monokulturowych,
metody takie stały się niewystarczające.

WYKŁAD 1
7
4
Metody ochrony roślin w programie
IPM
Wyróżniamy sześć głównych metod, które
w miarę ich rozwoju, coraz powszechniej
używano w poszczególnych uprawach, są
to:
zwalczanie mechaniczne,
fizyczne,
biologiczne,
agrotechniczne,
chemiczne,
genetyczne.

WYKŁAD 1
8
4
Metody ochrony roślin w programie
IPM
W miarę rozwoju naszej wiedzy
zmieniały się techniki oraz materiały
i sposoby ich realizacji.
W przeciągu stulecia zmieniał się
także ranking ich ważności.
Pierwsze trzy dekady XX wieku to
duże zainteresowanie metodami
biologicznymi. Ich skuteczność była
jednak z ekonomicznego punktu
widzenia zbyt mała.

WYKŁAD 1
9
4
Metody ochrony roślin w programie
IPM
Od połowy lat trzydziestych
zaznacza się intensywny rozwój
metod chemicznych.
Wyznacznikiem „nowej ery” w
produkcji środków ochrony roślin
była synteza DDT.
Chemiczne środki ochrony roślin
zdobyły niezwykłą popularność
dzięki szybkim i ewidentnym,
wręcz „naocznym” efektom.
Wykład 1 slajd 9

WYKŁAD 1
10
4
Metody ochrony roślin w programie
IPM
Zabiegi chemiczne stały się prawie tak
automatyczną czynnością w uprawie roślin jak
oranie, sianie czy sadzenie,
a terminy ich wykonywania
wyznaczano zwykle na
podstawie faz
fenologicznych
poszczególnych gatunków
roślin, niezależnie od tego
czy istniało realne
zagrożenie ze strony
agrofagów.

WYKŁAD 1
11
4
Metody ochrony roślin w programie
IPM
Zgubne skutki takiego
postępowania nie kazały jednak
długo na siebie czekać. Zaliczamy
do nich:
rozwój ras odpornych,
wyniszczenie organizmów
pożytecznych,
zanieczyszczenie środowiska.

WYKŁAD 1
12
4
Metody ochrony roślin w programie
IPM
Zagrożenia wymusiły odejście od praktyki
schematycznego zwalczania chemicznego.
Impulsem do zmiany koncepcji i realizacji
takiego stosowania chemicznego sposobu
ochrony roślin, było ukazanie się w 1962
roku książki Rachel Carson „Milcząca
wiosna”, która wstrząsnęła opinią
publiczną.
Cytowane przez nią naukowe dane odegrały
ważną rolę przy wprowadzaniu ustawowego
zakazu używania chlorowanych
węglowodorów, a pośrednio do powołania
rządowych instytucji nadzorujących
rejestrację i stosowanie pestycydów.

WYKŁAD 1
13
4
Metody ochrony roślin w
programie IPM
Kolejnym etapem w praktyce ochrony roślin
było tzw.
zwalczanie nadzorowane
.
Wprowadzenie metody zwalczania
nadzorowanego wymagało opracowania metod
lustracji upraw oraz progów zagrożenia.
Równolegle z koncepcją zwalczania
nadzorowanego pojawiła się koncepcja
zwalczania integrowanego.

WYKŁAD 1
14
4
Metody ochrony roślin w programie
IPM
Definicja koncepcji integracji przyjęta
przez Międzynarodową Organizację
Biologicznego i Integrowanego
Zwalczania Szkodliwych Zwierząt i roślin
brzmi:
„Jest to zwalczanie szkodników i chorób
przy użyciu wszystkich metod zgodnie z
wymaganiami ekonomicznymi,
ekologicznymi i toksykologicznymi,
dających pierwszeństwo naturalnym
czynnikom ograniczającym i
ekonomicznym programom zagrożenia”.

WYKŁAD 1
15
4
Metody ochrony roślin w programie
IPM
Metody i techniki wykorzystywane w ochronie
integrowanej (agrotechniczne, mechaniczne,
fizyczne, biologiczne, chemiczne, genetyczne,
prawne) muszą odpowiadać standardom
nowoczesnego rolnictwa.
Jednak ranga ich ważności zmienia się
zarówno ze względu na rodzaj rośliny
uprawianej, jak i gatunek lub zespół
gatunków zwalczanych agrofagów.

WYKŁAD 1
16
4
Metody ochrony roślin w programie
IPM
Integrowany system
ochrony roślin jest
realizowany nie tylko w
uprawach roślin
polowych, ale także
szklarniowych.
W przypadku roślin
polowych, największy
postęp odnotowano w
produkcji sadowniczej,
a zwłaszcza w uprawie
jabłoni.

WYKŁAD 1
17
4
Metody ochrony roślin w programie
IPM
Podstawą integrowanych metod produkcji jest
integrowanie różnych sposobów zwalczania
agrofagów.
Jednak obiektem zainteresowania nowoczesnej
ochrony nie są agrofagi „same w sobie”, ale
roślina - jej właściwości genetyczne, reakcja
na grupy zasiedlających ją organizmów oraz na
poszczególne metody ich zwalczania.

WYKŁAD 1
18
4
Metody ochrony roślin w programie
IPM
Znaczne możliwości w
dalszym rozwoju
integrowanych metod
ochrony roślin, a w
związku z tym
integrowanych metod
produkcji, niesie ze sobą
rozwój biotechnologii.

WYKŁAD 1
19
4
Metody ochrony roślin w programie
IPM
Możliwości te, to zarówno
pozyskiwanie przy pomocy
inżynierii genetycznej roślin
odpornych
na czynniki
chorobotwórcze i szkodniki,
jak i
genetyczna modyfikacja
pożytecznych stawonogów
,
w celu efektywniejszego
wykorzystania ich wraz z
chemicznymi środkami
ochrony roślin.

WYKŁAD 1
20
4
Metody ochrony roślin w programie
IPM
Rozwój nowych koncepcji
ochrony roślin wymusił również
daleko idące zmiany w
asortymencie używanych
środków ochrony roślin.
Ze względu na pozostałości
pestycydów w środowisku, a
także w organizmach zwierząt
wycofano najbardziej
niebezpieczne np. związki
arsenowe, nitrowane i
chlorowane węglowodory.

WYKŁAD 1
21
4
Metody ochrony roślin w programie
IPM
Pocieszające jest, że duże i
liczące się koncerny
chemiczne prowadzą
intensywne badania nad
syntezą nowych,
bezpieczniejszych związków,
w tym pochodzenia
naturalnego.
Jedną z takich grup są
syntetyczne pyretroidy.

WYKŁAD 1
22
4
Metody ochrony roślin w programie
IPM
Jednak ze względu na wady:
toksyczne działanie na stawonogi, pszczoły
i ryby oraz zwierzęta stałocieplne;
szybkie indukowanie odporności wśród
wielu roślinożerców)
wiele krajów podjęło działania ograniczające
ich stosowanie.

WYKŁAD 1
23
4
Metody ochrony roślin w programie
IPM
Znacznie bezpieczniejszą grupę związków
nowej generacji stanowią
inhibitory syntezy
chityny,
zakłócające proces przeobrażania
stadiów larwalnych owadów.
W ostatnich latach pojawiły się
związki z
grupy tzw. MAC’s
. Są to związki
uniemożliwiające prawidłowe zmiany wahań
w poziomie hormonu linienia, co udaremnia
proces przechodzenia z jednego stadium
larwalnego w drugie.

WYKŁAD 1
24
4
Metody ochrony roślin w programie
IPM
Przewiduje się, że duże
możliwości wykorzystania
mają także substancje
pochodzenia roślinnego,
ale o innych
właściwościach niż
pyretroidy.
Przykładem jest np.
azadirachtyna
wykazująca
działanie w stosunku do
gąsienic wielu gatunków
motyli, uznanych za
szkodniki roślin uprawnych
lub magazynów.

WYKŁAD 2
25
Przedmiot biotechnologii i
definicje podstawowych
pojęć

WYKŁAD 2
26
Biotechnologia
jest interdyscyplinarną
dziedziną nauki, obejmującą
różne kierunki technicznego
wykorzystania materiałów i
procesów biologicznych.
Obejmuje ona procesy
biosyntezy i biotransformacji
przebiegające przy udziale
drobnoustrojów, kultur
komórkowych – roślinnych i
zwierzęcych – in vitro oraz
enzymów, a także izolację tak
otrzymanych bioproduktów.

WYKŁAD 2
27
Naukowe podstawy oraz zakres zastosowań
biotechnologii
BIOTECHNOLOGIA
ekologia
mikrobiologia
biologia
komórki
genetyka
biochemia
biologia
molekularna
chemia
inżynieria
informatyk
a
matematyka
fizyk
a
ekonomia
ochrona
zdrowia
ochrona
środowisk
a
rolnictw
o
przemysł
spożywczy
przemysł
chemicznysurowce
nośniki
energii
analityka
inne
zastosowania

WYKŁAD 2
28
Biotechnologie tradycyjne,
przebiegające z użyciem
naturalnych enzymów lub
drobnoustrojów i komórek
organizmów wyższych nie
zawierających obcego
materiału genetycznego
Biotechnologie nowoczesne
,
w których stosowane są
szczepy drobnoustrojów lub
linie komórkowe,
skonstruowane metodami
inżynierii genetycznej,
względnie enzymy
modyfikowane technikami
inżynierii białka.
WYKŁAD 2
29
Technologia mikrobiologiczna
– procesy
uwarunkowane działalnością
drobnoustrojów, wyróżniają się
ogromnymi możliwościami w zakresie
praktycznego wykorzystania zdolności
poszczególnych mikroorganizmów do
wywoływania różnorodnych przemian
chemicznych.
Jest to dział biotechnologii obejmujący
procesy mikrobiologicznej biosyntezy i
biotransformacji, który powstał na
gruncie technologii fermentacji i
mikrobiologii przemysłowej.

WYKŁAD 2
30
Fermentacja
– termin
pochodzi od łacińskich słów:
fervere, fermentatio co
oznacza burzenie się.
Pierwotnie używano go do
określenia wizualnych
efektów towarzyszących
procesom zachodzącym w
sokach, zacierach zbożowych
na skutek wydzielania się
pęcherzyków CO
2
podczas
przemiany cukrów.
Wg Pasteura fermentacja to
„życie bez tlenu”.

WYKŁAD 2
31
W mikrobiologii technicznej i praktyce
przemysłowej termin „fermentacja” określa
różne procesy mikrobiologiczne, w których
związki organiczne podlegają przemianom
chemicznym w wyniku aktywności
metabolicznej drobnoustrojów.

WYKŁAD 2
32
Pojęciem fermentacji zostały objęte zarówno
procesy beztlenowe np. fermentacja etanolowa
czy mleczanowa, jak i tlenowe np. fermentacja
cytrynianowa czy octanowa, procesy
biosyntezy (np. fermentacja penicylinowa) jak
również biotransformacji (np. przekształcenia
związków steroidowych).
Technologia fermentacji jest synonimem
technologii mikrobiologicznej.

WYKŁAD 2
33
Technologia enzymów
– enzymy znalazły
zastosowanie w
przemyśle
spożywczym,
chemicznym,
farmaceutycznym i
włókienniczym, w
lecznictwie, analityce i
gospodarstwie
domowym.

WYKŁAD 2
34
Zostały opracowane techniki
unieruchamiania (immobilizacji)
biokatalizatorów, co nadaje im większą
stabilność, pozwala na wielokrotne użycie
oraz opracowanie enzymowych procesów
ciągłych.
Opracowano także metody immobilizacji
całych komórek oraz procesy technologiczne
z ich użyciem. Dzięki temu powstał nowy
dział biotechnologii – technologia
biokatalizatorów unieruchomionych.

WYKŁAD 2
35
Inżynieria bioprocesowa
– wcześniej używano
terminów „inżynieria biochemiczna”,
„inżynieria fermentacji”, „inżynieria
mikrobiologiczna.
Jest to element biotechnologii, który
warunkuje wykorzystanie osiągnięć biologów i
chemików przez przeniesienie „technologii
laboratoryjnej” do warunków fabrycznych.
Rozwój inżynierii bioprocesowej pozwolił na
praktyczne wykorzystanie nowych koncepcji w
biologii – technika hodowli in vitro.

WYKŁAD 2
36
Inżynieria genetyczna
(technologia genowa) –
określa nowoczesne metody biologii
molekularnej i genetyki, które umożliwiają
manipulacje genetyczne poza komórką, czyli
rekombinowanie DNA in vitro (np. konstruowanie
nowych genotypów, które nie występują w
naturze).

WYKŁAD 2
37
Praktyczne wykorzystanie inżynierii
genetycznej to biotechnologia środków
leczniczych (hormony, białka odpornościowe,
szczepionki nowych generacji). Możliwa jest
biosynteza metabolitów, których
otrzymywanie przy użyciu drobnoustrojów
było dotychczas niemożliwe.
Duże usługi oddaje inżynieria genetyczna w
badaniach molekularnych w zakresie
immunologii i onkologii.

WYKŁAD 2
38
Inżynieria cytogenetyczna
– inżynieria
genetyczna na poziomie komórkowym.
Praktyczne wykorzystanie w biotechniologii
to np. fuzja protoplastów, jako metoda
doskonalenia właściwości biosyntetycznych
szczepów i linii komórkowych, metody fuzji
komórek zwierzęcych (np. fuzja
nowotworowych komórek szpiczaka –
technologia wytwarzania przeciwciał
monoklonalnych)
WYKŁAD 2
39
Inżynieria białka
– metody chemiczne lub
biologiczne dążące do otrzymania enzymów
w postaci zmodyfikowanej, półsyntetycznej
lub zmutowanej w stosunku do enzymów
naturalnych.

WYKŁAD 2
40
Modyfikacja enzymów w celu zmiany ich
charakterystyki funkcjonalnej, np.
specyficzności substratowej , stabilności,
optymalnych warunków działania, wymaga
rozwoju badań nad zależnością pomiędzy ich
strukturą a funkcją.
Pomocna staje się komputerowa analiza
struktury chemicznej enzymu i substratu,
która umożliwia zaprojektowanie optymalnej
budowy chemicznej enzymu.
Dzięki inżynierii białka możliwe jest
wzbogacanie białek drobnoustrojowych i
roślinnych w aminokwasy egzogenne, które
występują w zbyt małych ilościach.

WYKŁAD 3
41
Rys historyczny biotechnologii

WYKŁAD 3
42
Termin „biotechnologia" wprowadzony
został niedawno.
Dziedzina ta reprezentuje jeden z
najstarszych kierunków gospodarczej
działalności człowieka.
W jej historycznym rozwoju można
wyróżnić trzy zasadnicze okresy.

WYKŁAD 3
43
Okresy rozwoju
biotechnologii
1.Okres przedpasteurowski
(od zarania ludzkości do połowy
XIX w.) — era spontanicznych
procesów fermentacyjnych
wykorzystywanych do
otrzymywania ważnych
produktów żywnościowych:
chleba, wina, piwa,
produktów mlecznych,
przetworów roślinnych.

WYKŁAD 3
44
2.Okres przejściowy
(druga połowa XIX w. oraz
pierwsze czterdziestolecie XX w.).
Poznawanie w sposób naukowy biologicznej i
chemicznej natury bioprocesów —
zapoczątkowane
przez L. Pasteura — zaowocowało rozwojem
nowych koncepcji, nowych biotechnologii
nowych bioproduktów, a postęp techniczny
umożliwił tworzenie podstaw biotechnologii
wielkoprzemysłowej.
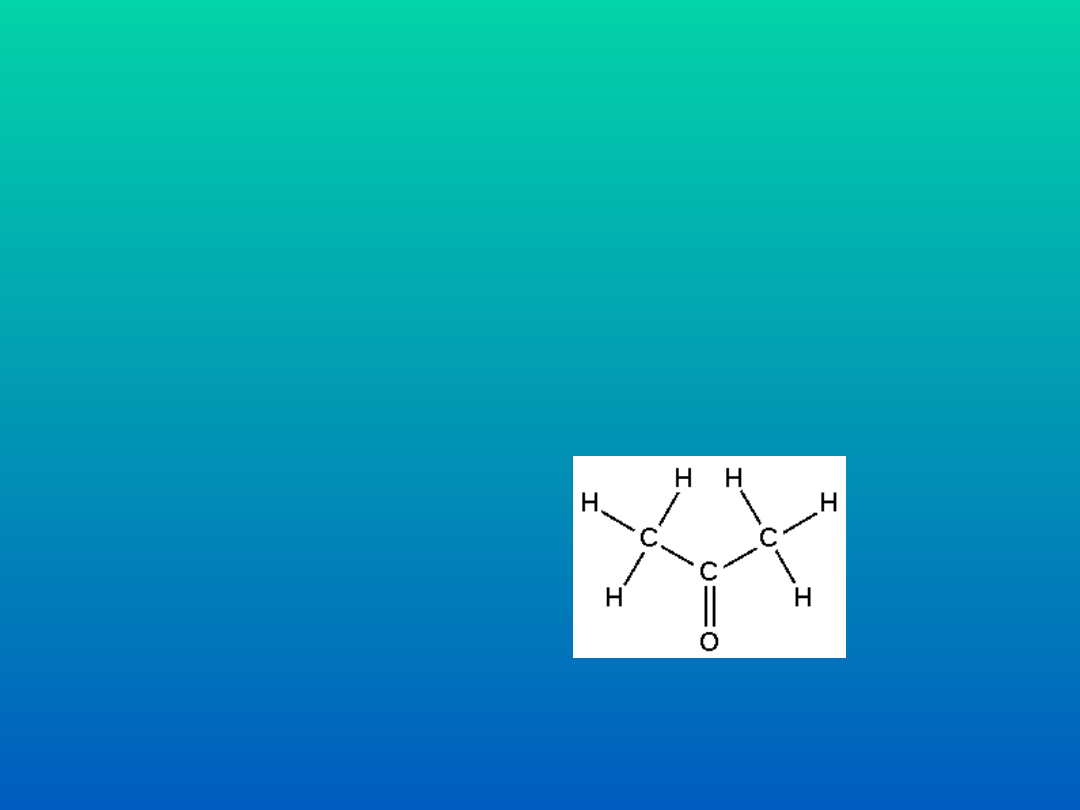
WYKŁAD 3
45
Etap ten można określić jako erę
mikrobiologicznych początków współczesnej
biotechnologii i opracowania produkcji
kwasu mlekowego i cytrynowego, acetonu i
butanolu, technologii otrzymywania drożdży.
W tym okresie zapoczątkowano stosowanie
czystych kultur drobnoustrojów oraz
prowadzenie bioprocesów w warunkach
aseptycznych

WYKŁAD 3
46
3.
Era nowoczesnej
biotechnologii
rozpoczęła
się pod koniec II wojny
światowej od opracowania
przemysłowej produkcji
penicyliny metodą tlenowej
hodowli wgłębnej
prowadzonej
w warunkach aseptycznych
w bioreaktorach o
pojemności kilkudziesięciu
m
2
.

WYKŁAD 3
47
3a. Podokres 1
(do roku
1970).
Dzięki integracji dyscyplin
biologicznych, chemicznych
i inżynieryjnych
opracowano nowe
technologie, m.in.
biosyntezy antybiotyków,
aminokwasów, enzymów i
biotransformacji steroidów
oraz wprowadzono pierwsze
technologie, w których
zastosowano
biokatalizatory
immobilizowane

WYKŁAD 3
48
3b. Podokres 2
(od roku 1970) — praktyczne
wykorzystanie genetyki i biologii
molekularnej w biotechnologii. Pod koniec
1969 r. narodziła się koncepcja manipulacji
genami poza
komórką.
Nastąpił rozwój metod rekombinacji DNA in
vitro i in vivo.
Opracowano szereg nowych biotechnologii,
m.in. mikrobiologiczną produkcję insuliny,
hormonów wzrostu, interferonów, białek
odpornościowych, oraz technologię
wytwarzania przeciwciał monoklonalnych.

WYKŁAD 3
49
Zakres zastosowań współczesnych
biotechnologii
I. Produkcja żywności
Przemysł spożywczy
1) tradycyjne procesy fermentacyjne —
produkcja pieczywa, fermentowanych
produktów mlecznych i roślinnych, drożdży,
napojów alkoholowych;
2) nowe technologie mikrobiologiczne
wytwarzania białka jednokomórkowców (SCP),
aminokwasów, witamin, nukleotydów, kwasów
organicznych, polisacharydów;

WYKŁAD 3
50
3) zastosowanie enzymów do wytwarzania
wyrobów mleczarskich, owocowo-
warzywnych, napojów fermentowanych,
przetworów skrobiowych;
4) utrwalanie żywności: oksydaza
glukozowa (antyutleniacz), nizyna;

WYKŁAD 3
51
Rolnictwo (produkcja roślinna i zwierzęca)
1) produkcja pasz: preparaty białkowe,
witaminowe, aminokwasowe,
antybiotyczne, stymulatory wzrostu,
kiszonki roślinne;
2) nowoczesne techniki hodowli tkanek i
komórek in vitro oraz metody inżynierii
genetycznej;
3) ochrona roślin: antybiotyki,
bioinsektycydy, biopestycydy,
4) lecznictwo zwierząt: antybiotyki,
szczepionki.

WYKŁAD 3
52
II. Ochrona zdrowia
1) namnażanie drobnoustrojów oraz hodowla
komórek zwierzęcych in vitro w celu
wytworzenia szczepionek i przeciwciał;
2) mikrobiologiczna biosynteza naturalnych
metabolitów drobnoustrojowych:
antybiotyków, aminokwasów, kwasów
organicznych, witamin, enzymów,
inhibitorów enzymów, dekstranu,
alkaloidów;

WYKŁAD 3
53
3) mikrobiologiczna biosynteza hormonów
peptydowych, antygenów oraz innych
produktów przy użyciu szczepów
konstruowanych metodami inżynierii
genetycznej, zawierających obcą
informację genetyczną;
4) zastosowanie procesów biotransformacji
mikrobiologicznej i enzymatycznej w
produkcji leków steroidowych,
aminokwasów, antybiotyków, witaminy C,
glukonianu wapnia, efedryny;
5) wytwarzanie przeciwciał
monoklonalnych, m.in. do celów
diagnostycznych (testy immunologiczne).

WYKŁAD 3
54
III. Przemysł chemiczny i inne przemysły
1) wytwarzanie surowców:
alkohole: etanol, butanol, izopropanol,
glikol etylenowy, glikol propylenowy,
glicerol;
kwasy: octowy, cytrynowy, adypinowy,
itakonowy, akrylowy;
polimery: dekstran, ksantan, pululan,
kwas poli--hydroksymasłowy

WYKŁAD 3
55
2) nośniki energii — paliwa: etanol, metan,
potencjalnie wodór;
3) biotechnologiczna obróbka surowców
naturalnych: roszenie roślin
włókienniczych, hydroliza skrobi w trakcie
wytwarzania tkanin, odwłasianie i
wytrawianie skór, fermentacja tytoniu;
4) biohydrometalurgia: ługowanie rud,
biozatężanie, odzyskiwanie metali;
5) bioelektronika: bioczipy.

WYKŁAD 3
56
IV. Ochrona środowiska
1) oczyszczanie ścieków:
złoża zraszane, filtry
biologiczne, osad
czynny;
2) bioutylizacja
odpadów:
namnażanie biomasy,
procesy biosyntezy
mikrobiologicznej,
produkcja biogazu.

WYKŁAD 3
57
V. Analiza
l) zastosowanie enzymów
rozpuszczalnych, np. oksydazy
glukozowej (łącznie z katalazą lub
peroksydazą) lub dehydrogenazy
glukozo-6-fosforanowej (w połączeniu z
heksokinazą);
2) czujniki enzymowe i komórkowe:
oksydaza glukozowa + elektroda
tlenowa, ureaza + elektroda PH;
3) analiza genomów: analiza restrykcyjna,
sekwencjonowanie, sondy molekularne.

WYKŁAD 3
58
Główne atuty biotechnologii:
1) przetwarzanie surowców odnawialnych i
bioproduktów
2) duża różnorodność bioprocesów i
bioproduktów,
3) selektywne otrzymywanie enancjomerów
biologicznie czynnych,

WYKŁAD 3
59
Główne atuty biotechnologii:
4) łagodne warunki przebiegu bioprocesów,
5) mała ich energochłonność,
6) duży stopień bezpieczeństwa
bioprocesów,
7) mniej groźne niż w technologiach
chemicznych oraz łatwiejsze do
zneutralizowania zanieczyszczenie
środowiska.

WYKŁAD 3
60
Najważniejsze zadania
biotechnologii:
1) opracowywanie produkcji nowych leków i
preparatów do ochrony zdrowia ludzi i
zwierząt,
2) rozwiązywanie problemów
żywieniowych,
3) udział w kompleksowym rozwiązywaniu
problemów ochrony środowiska,
4) upowszechnianie procesów biokatalizy
w przemyśle chemicznym oraz w
przetwórstwie surowców naturalnych,
5) udział w rozwiązywaniu problemów
energetycznych.
WYKŁAD 3
61
Głównymi surowcami
w procesach
biotechnologicznych są węglowodany —
skrobia i sacharoza oraz produkty
uboczne przetwórstwa rolno-
spożywczego, np. melasa. Skrobia i
sacharoza, najłatwiej przez
drobnoustroje przyswajane
węglowodany, stanowią jednak zaledwie
ok. 1% biomasy roślinnej. W przyszłości
będzie prawdopodobnie można
wykorzystywać celulozę (40% biomasy
roślinnej), ligniny i hemicelulozę
WYKŁAD 3
62
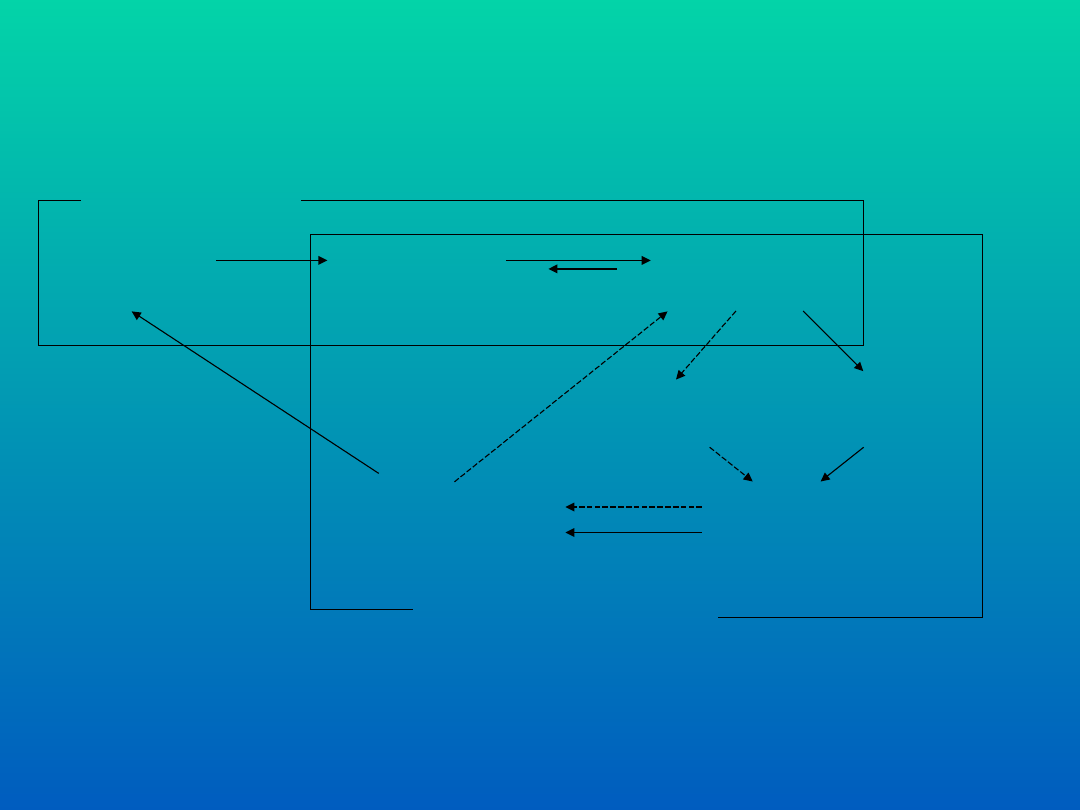
obszar
nauki
PROCES BIOTECHNOLOGICZNY
Relacje pomiędzy nauką i technologią:
strzałkami ciągłymi zaznaczono dużą, a przerywanymi małą pętlę naukowo-
technologiczną
badania
podstawow
e
wiedza
(publikacj
e)
badania
aplikacyjn
e
obszar
technologii
nowe
problem
y
wdrożenia
(produkcja
)
uspra-
wnienia
nowe
technologi
e
WYKŁAD 3
63
PROCES BIOTECHNOLOGICZNY
Program opracowywania procesu
biotechnologicznego obejmuje:
1)fazę wstępną, czyli analizę
zapotrzebowania społecznego na
określone produkty oraz analizę
możliwości biotechnologicznego ich
pozyskiwania;
2) fazę badawczą, mającą na celu
opracowanie technologii, kończącą się
rachunkiem ekonomicznym i podjęciem
decyzji inwestycyjnych;
3) fazę wdrożenia, czyli projektowanie oraz
budowę linii technologicznej i
uruchomienie produkcji.

WYKŁAD 3
64
Etapy opracowywania procesu
biosyntezy:
1) Pozyskiwanie odpowiednich
drobnoustrojów (skrining) -
poszukiwanie właściwych drobnoustrojów
prowadzących określony bioproces lub
wytwarzających określony bioprodukt.
Pierwszym źródłem drobnoustrojów jest
ich naturalne środowisko: gleba, części
roślin, woda, otoczenie określonych
zakładów przemysłowych.
Wykład 3 slajd 24
WYKŁAD 3
65
Etapy opracowywania procesu
biosyntezy:
1) Pozyskiwanie odpowiednich
drobnoustrojów (skrining) -
Powodzenie skriningu zależy od umiejętności
wyboru właściwych nisz ekologicznych
oraz zastosowania właściwych metod
namnażania i selekcji drobnoustrojów.
Mikrobiolog ma obecnie do dyspozycji
szereg metod i testów pozwalających na
wyselekcjonowanie pożądanego
drobnoustroju.
WYKŁAD 3
66
Etapy opracowywania procesu
biosyntezy:
2)Wstępne ustalenie warunków ich hodowli
na etapie skriningu określane są wstępne
warunki hodowli drobnoustrojów przez
dobór podłoży, temperatury, natlenienia.
Badania te są następnie kontynuowane w
celu stworzenia warunków zapewniających
wyselekcjonowanym szczepom
maksymalną ekspresję fenotypową
określonej cechy, np. produkcji enzymu.
WYKŁAD 3
67
Etapy opracowywania procesu
biosyntezy:
2)Wstępne ustalenie warunków ich hodowli
Należy dokonać również wyboru sposobu
prowadzenia bioprocesu: hodowla
powierzchniowa lub wgłębna, okresowa
lub ciągła, w zawiesinie lub na nośniku, z
użyciem całych komórek lub izolowanych
enzymów. Na tym etapie rozpoczyna się
zazwyczaj opracowywanie warunków
wyodrębnienia i oczyszczania
bioproduktów.
WYKŁAD 3
68
Etapy opracowywania procesu
biosyntezy:
3) Doskonalenie cech produkcyjnych
szczepów
Podstawową metodą jest mutagenizacja.
Wynikiem ulepszania szczepów jest
produkcja określonych metabolitów w
ilości przewyższającej potrzeby własne
drobnoustrojów od kilkuset (aminokwasy)
do kilkudziesięciu tysięcy razy (witaminy).
Można konstruować szczepy, które zdolne
są do syntezy bioproduktów, jakich
drobnoustroje macierzyste nigdy nie
produkowały
.
WYKŁAD 3
69
Etapy opracowywania procesu
biosyntezy:
4) Optymalizacja bioprocesu
Każdy wysokowydajny szczep ma
określony potencjał metaboliczny w
zakresie biosyntezy, biodegradacji lub
biotransformacji, uwarunkowany
genotypowo. Jednakże maksymalne
wykorzystanie tego potencjału wymaga
doboru optymalnych warunków
prowadzenia bioprocesu. Są one
ustalane w etapie projektowania
technologii laboratoryjnej.
WYKŁAD 3
70
Etapy opracowywania procesu
biosyntezy:
4) Optymalizacja bioprocesu
Na etapie optymalizacji procesu w
laboratorium ustalany jest skład
podłoża, warunki jego mieszania i
napowietrzenia oraz szereg dalszych
parametrów procesowych. Ważnym
zagadnieniem jest też ustalenie
kinetyki bioprocesu. Coraz częściej
etap optymalizacji i następujące po
nim etapy opracowywane są przy
użyciu techniki komputerowej.

WYKŁAD 3
71
Etapy opracowywania procesu
biosyntezy:
5) Powiększenie jego skali
Przejście od warunków laboratoryjnych
do technologii przemysłowej
bioprocesu stanowi z inżynieryjnego
punktu widzenia etap najtrudniejszy.
Powiększenie skali procesu od
objętości kilku lub kilkunastu litrów
hodowli do kilkudziesięciu lub
kilkuset metrów sześciennych
wymaga stosowania instalacji
pilotażowych i stopniowego
zwiększenia pojemności
bioreaktorów.

WYKŁAD 3
72
Etapy opracowywania procesu
biosyntezy:
6)
Uruchomienie produkcji
Stwarza wiele problemów natury technicznej, jak
i biologicznej. Znaczne trudności może sprawić
dotrzymanie optymalnych parametrów
procesu, np. natlenienie środowiska,
odprowadzenie wydzielającego się ciepła,
zmienność morfologiczno-fizjologiczna szczepu
produkcyjnego, utrzymanie czystości
mikrobiologicznej procesu.
Przez cały czas trwania produkcji prowadzi się
nadal ulepszanie szczepów, optymalizację i
ekonomizację podłoża oraz usprawnianie
sposobu prowadzenia procesu.

WYKŁAD 3
73
Trzy warunki powodzenia w zakresie
opracowywania i usprawniania
biotechnologii:
1) stały wzrost udziału nauki w rozwiązywaniu
problemów technologicznych oraz
zastosowanie nowoczesnych metod
badawczych i analitycznych;
2) postęp w zakresie budowy aparatury i
urządzeń biotechnologicznych;
3) właściwa organizacja badań, polegająca na
wyborze problemów, powoływaniu zespołów
składających się ze specjalistów różnych
dyscyplin naukowych oraz koordynacji ich
współpracy podczas rozwiązywania
problemów technologicznych

WYKŁAD 3
74
BEZPIECZEŃSTWO W BIOTECHNOLOGII
Zagadnienia bezpieczeństwa w biotechnologii
są przedmiotem dyskusji w wielu krajach oraz
na forum Światowej Organizacji Zdrowia, w
Europejskiej Wspólnocie Gospodarczej oraz w
Europejskiej Federacji Biotechnologicznej.

WYKŁAD 3
75
BEZPIECZEŃSTWO W BIOTECHNOLOGII
Problemy:
analiza patogeniczności drobnoustrojów
opornych na antybiotyki w wyniku ich
powszedniego stosowania
zagrożenie, które wynika z otrzymania i
stosowania organizmów konstruowanych
metodami inżynierii genetycznej
możliwości ich przenikania do otoczenia.

WYKŁAD 3
76
BEZPIECZEŃSTWO W BIOTECHNOLOGII
Wśród drobnoustrojów stosowanych w
biotechnologii przeważają gatunki całkowicie
bezpieczne.
W biotechnologii stosowane są jednak również
drobnoustroje chorobotwórcze (konieczne w
produkcji wielu szczepionek bakteryjnych i
wirusowych).
Istnieją ścisłe przepisy pracy z
drobnoustrojami procesowymi i tworzone są
bardzo precyzyjne mechanizmy kontroli
warunków technicznych bezpiecznego
namnażania drobnoustrojów patogennych.

WYKŁAD 3
77
BEZPIECZEŃSTWO W BIOTECHNOLOGII
W porównaniu z biotechnologią znacznie
większe zagrożenie stwarzają tradycyjne
metody rolnicze w produkcji żywności i pasz,
gdzie w warunkach ograniczonej kontroli
możliwe jest, i w istocie często występuje,
skażenie surowca, materiału w fazie produkcji
lub produktu w fazie przechowywania
drobnoustrojami chorobotwórczymi i
wytwarzanymi przez nie toksynami.

WYKŁAD 3
78
BEZPIECZEŃSTWO W
BIOTECHNOLOGII
Biotechnologia traktowana kompleksowo,
rozwijana racjonalnie i w sposób
kontrolowany, należy obecnie do
technologii bezpiecznych. Winna ponadto
przyczynić się do zmniejszenia zagrożeń,
jakie dla człowieka i środowiska stwarzają
inne technologie, zwłaszcza chemiczne.
Odrębnym zagadnieniem, budzącym duży
niepokój, jest potencjalne
niebezpieczeństwo związane z rozwojem
inżynierii genetycznej i biotechnologii z
użyciem organizmów modyfikowanych
genetycznie.
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
- Slide 40
- Slide 41
- Slide 42
- Slide 43
- Slide 44
- Slide 45
- Slide 46
- Slide 47
- Slide 48
- Slide 49
- Slide 50
- Slide 51
- Slide 52
- Slide 53
- Slide 54
- Slide 55
- Slide 56
- Slide 57
- Slide 58
- Slide 59
- Slide 60
- Slide 61
- Slide 62
- Slide 63
- Slide 64
- Slide 65
- Slide 66
- Slide 67
- Slide 68
- Slide 69
- Slide 70
- Slide 71
- Slide 72
- Slide 73
- Slide 74
- Slide 75
- Slide 76
- Slide 77
- Slide 78
Wyszukiwarka
Podobne podstrony:
Termin witamina pochodzi od słowa kluczowe i aminy
wszystkie Imiona żeńskie, S, Sabina - To imię wywodzi się od słowa łacińskiego, określającego nazwę
Daleko od słowa, Interesujące, PSYCHOLOGIA, PSYCHOLOGIA (materiały)
Neurochirurgia całośc od Marcina, Studia - ratownictwo medyczne, 3 rok, Podstawy neurochirurgii
Mathcad projekt mw calosc od michala do druku
SZOW testy calosc od Arka z odpowiedziami1
CAŁOSC OD W6 DO W10, podstawy woiągów i kanalizacji
PEDAGOGIKA RESOCJALIZACYJNA caloscsciaga od ani
IWN materiały od Galczaka całość
Termin kryminologia pochodzi od łacińskiego słowa crimen
W ujęciu etymologicznym termin projektowanie wywodzi się od łacińskiego słowa proiectus
Określenie czasu powstania kryminalistyki jest uzależnione od pojmowania słowa
Zinterpretuj słowa Od nas także zależy co w dziełach widzimy Moje spotkania z klasyką, Zinterpretuj
OD STRONY 8 EWE Całość, IWE EWE
Każdy nosi w sobie dżumę, nikt bowiem , nikt na świecie nie jest od niej wolny uczyń
więcej podobnych podstron