Seminarium 2
Ciecze mieszające się
nieograniczenie
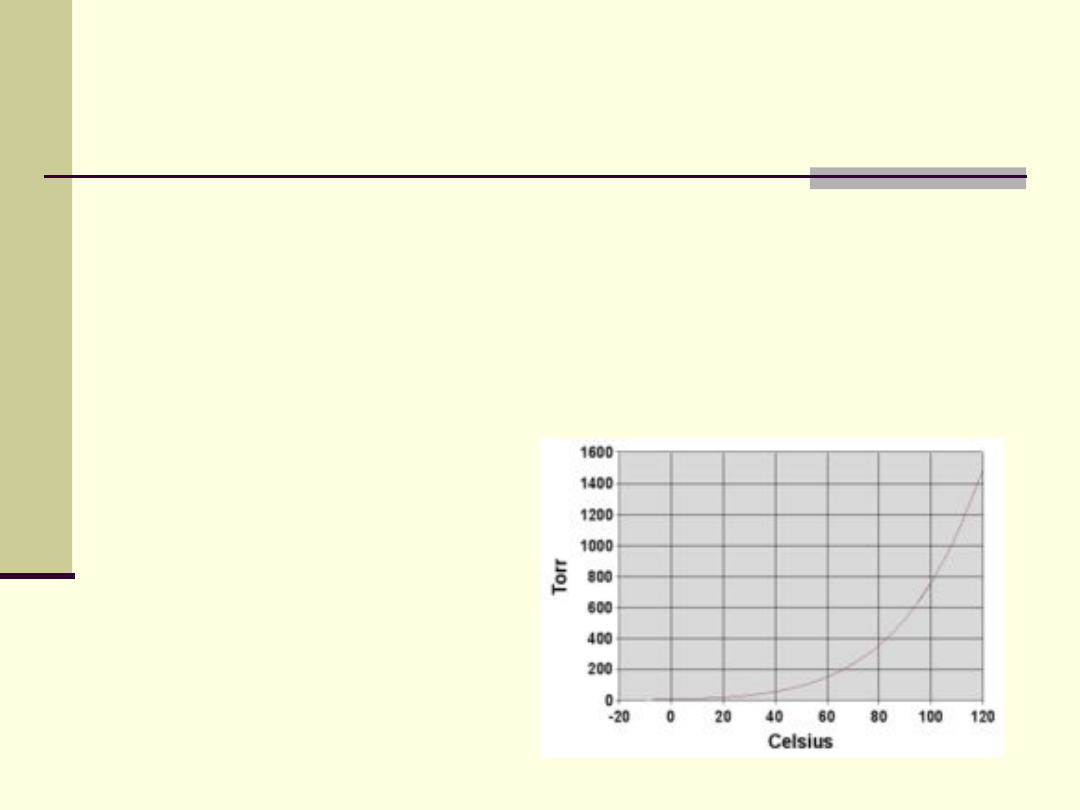
Prężność pary
Prężność (ciśnienie) pary nasyconej jest
to ciśnienie, przy którym w określonej
temperaturze gaz jest w stanie
równowagi z cieczą
Prężność pary
jest
charakterystyczn
a dla cieczy i
rośnie ze
wzrostem
temperatury
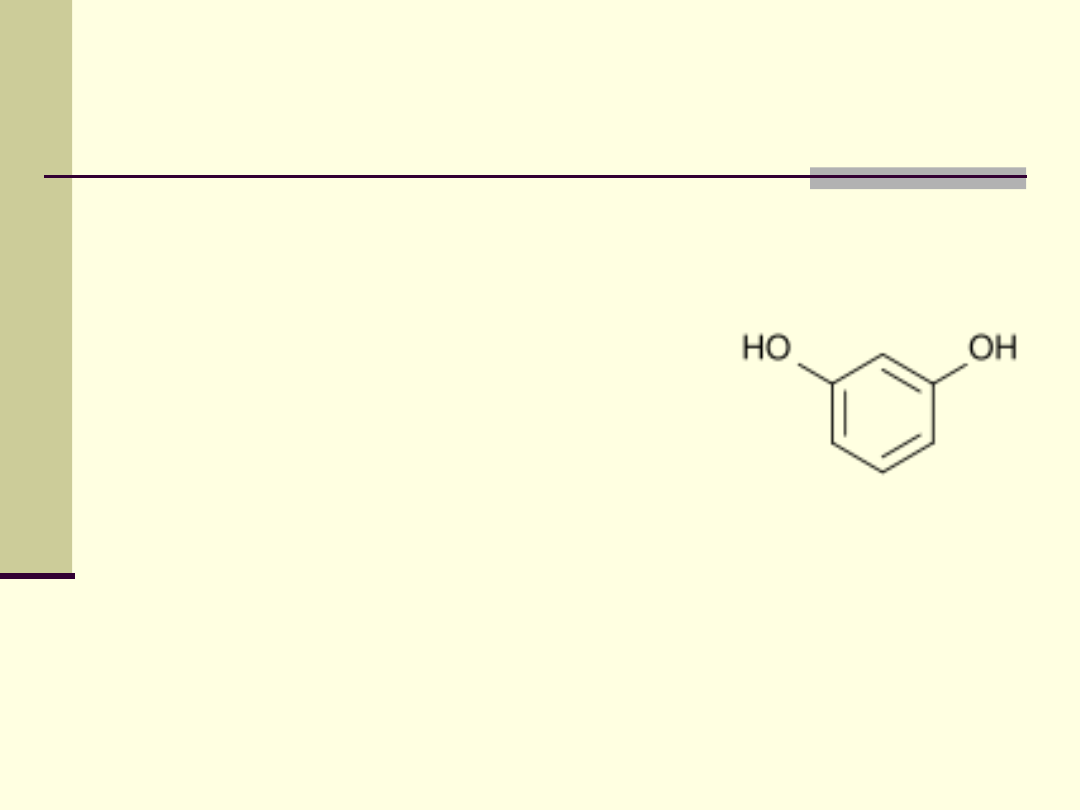
Rezorcyna
Rezorcyna jest składnikiem farb do włosów, płynów do
układania włosów, leków zewnętrznych o działaniu
grzybobójczym i keratolitycznym
Dane fizykochemiczne:
(141 st.C)- 1,1586 g/cm
3
Gęstość par: 3,8 (powietrze = 1)
Masa właściwa: 1,27 g/cm
3
Prężność pary nasyconej w funkcji temperatury:
lg(p) = A - B / (C+t) p[mmHg] t[C]
A: 7,88906
B:2231,138
C:169,288
Granice wybuchowości:
dolna - 1,4 % obj.
górna - 9,8 % obj.
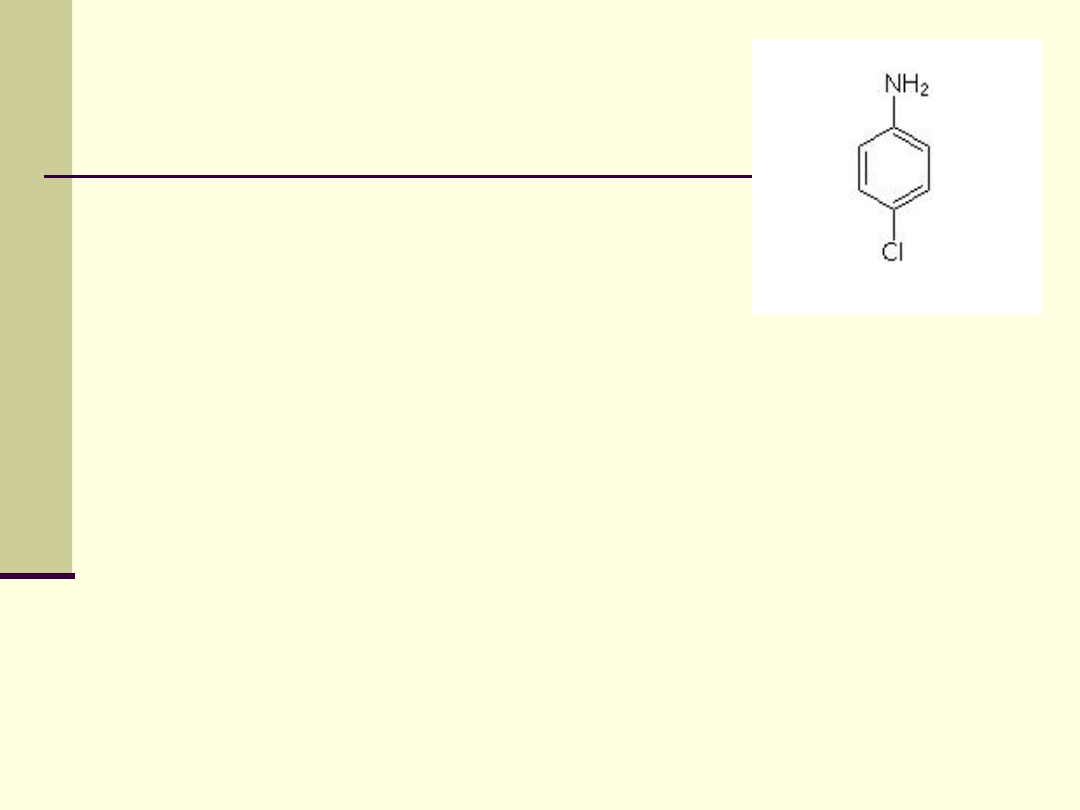
p-chloroanilina
Stosowana jest do produkcji
barwników, leków i środków
kosmetycznych.
Jako składnik kosmetyków
odpowiada za działanie
bakteriobójcze.
Dane fizykochemiczne:
masa cząsteczkowa: 127.57334
lepkość dynamiczna: 1,2 mPa * sek (90 °C)
prężność pary: 0,07 hPa (20
o
C); 0,7 hPa (50
°C)
gęstość nasypowa: 790 kg / m3
log P(oktanol / woda): 1,83

Ułamek molowy
B
A
A
n
n
n
X
+
=
X – ułamek molowy
n
A
– liczba moli substancji A
n
B
– liczba moli substancji B
0 X 1

Roztwory doskonałe
Procesowi ich mieszania nie towarzyszy
efekt cieplny.
Zachowują się jak roztwór doskonały 2
lotnych substancji i dlatego prężności par
obu składników nad roztworem spełniają
prawo Raoulta w całym zakresie stężeń.
oddziaływania międzycząsteczkowe w
roztworze są takie same jak oddziaływania
w czystych składnikach
Np. metanol i etanol, benzen i toluen,
heksan i heptan

Prawo Raoulta
Prężność pary danego składnika nad
roztworem jest równa iloczynowi prężności
pary czystego składnika i jego ułamka
molowego w roztworze
p
a
= X
a
∙ p
a
*
p
a
* - prężność pary czystego składnika
X
a
– ułamek molowy

Prawo Daltona
Całkowita prężność pary nad roztworem
jest równa sumie prężności pary
składników roztworu
p
tot
= p
a
+ p
b
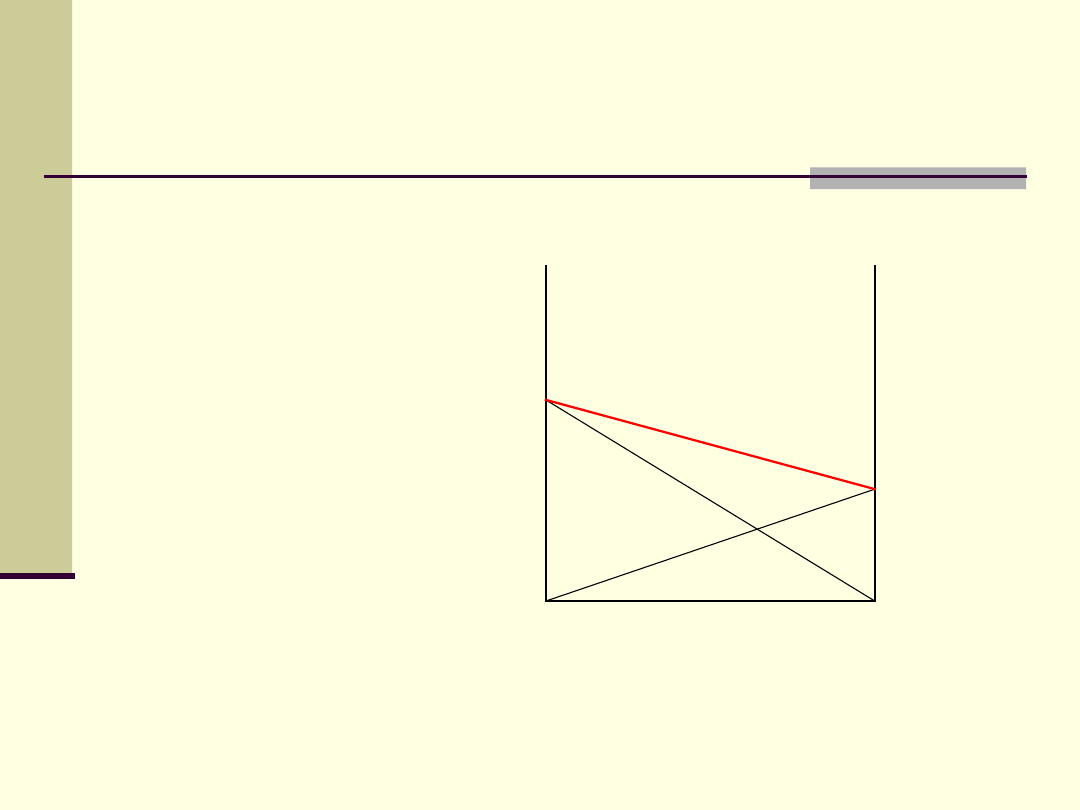
Całkowita prężność pary
p
= p
a
+ p
b
p
a
= X
a
∙ p
a
*
p
b
= X
b
∙ p
b
*
1
0
p
a
*
X
a
p
p
a
p
b
p
b
*

Całkowita prężność pary
p
tot
= p
a
+ p
b
p
a
= X
a
∙ p
a
*
p
b
= X
b
∙ p
b
*
p
tot
= X
a
∙ p
a
* + X
b
∙ p
b
*
X
a
+ X
b
= 1, X
b
= 1 - X
a
p
tot
= X
a
∙ p
a
* + (1 – X
a
) ∙ p
b
*
p
tot
= X
a
∙ p
a
* + p
b
* - X
a
∙ p
b
*
p
tot
= p
b
* + X
a
∙ (p
a
* - p
b
*)
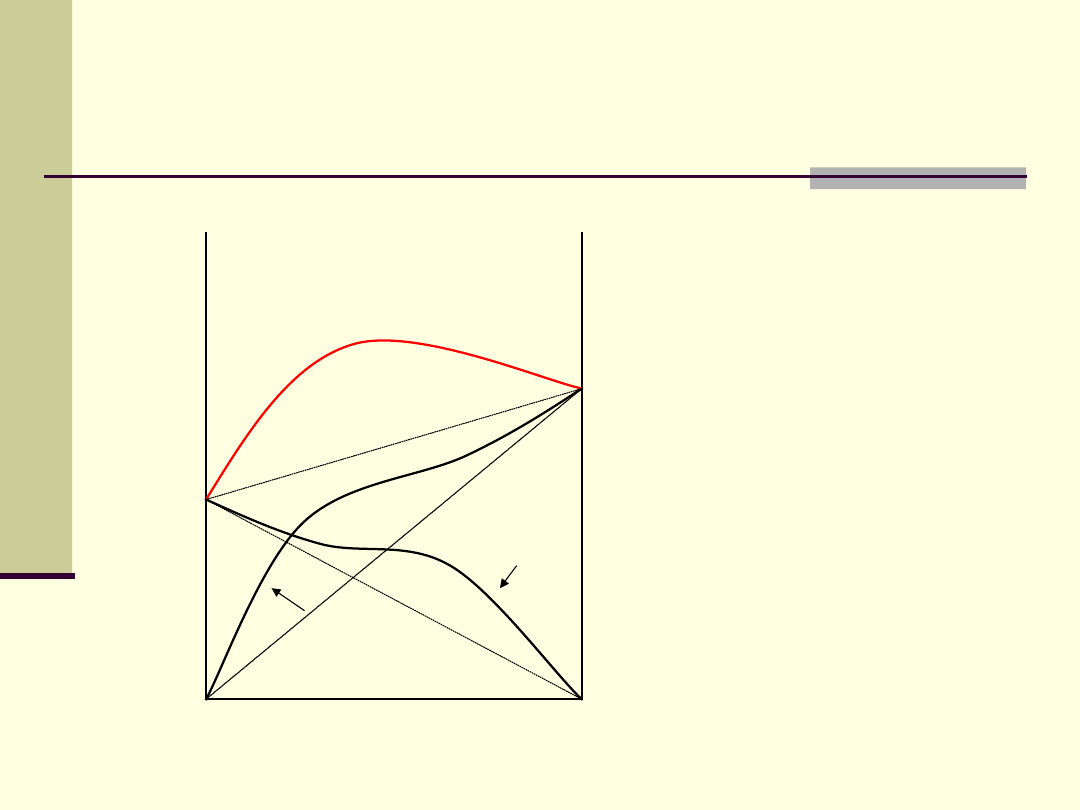
Ciecze z dodatnimi
odchyleniami od prawa
Raoulta
Aceton i disiarczek
węgla,
etanol i woda,
etanol i benzen,
etanol i chloroform,
metanol i aceton
A-A, B-B > A-B
ΔH
miesz
> 0
(proces
endotermiczny)
Acetone
Carbon
disulfide
0
1
p
total
p
X
carbon disulfide
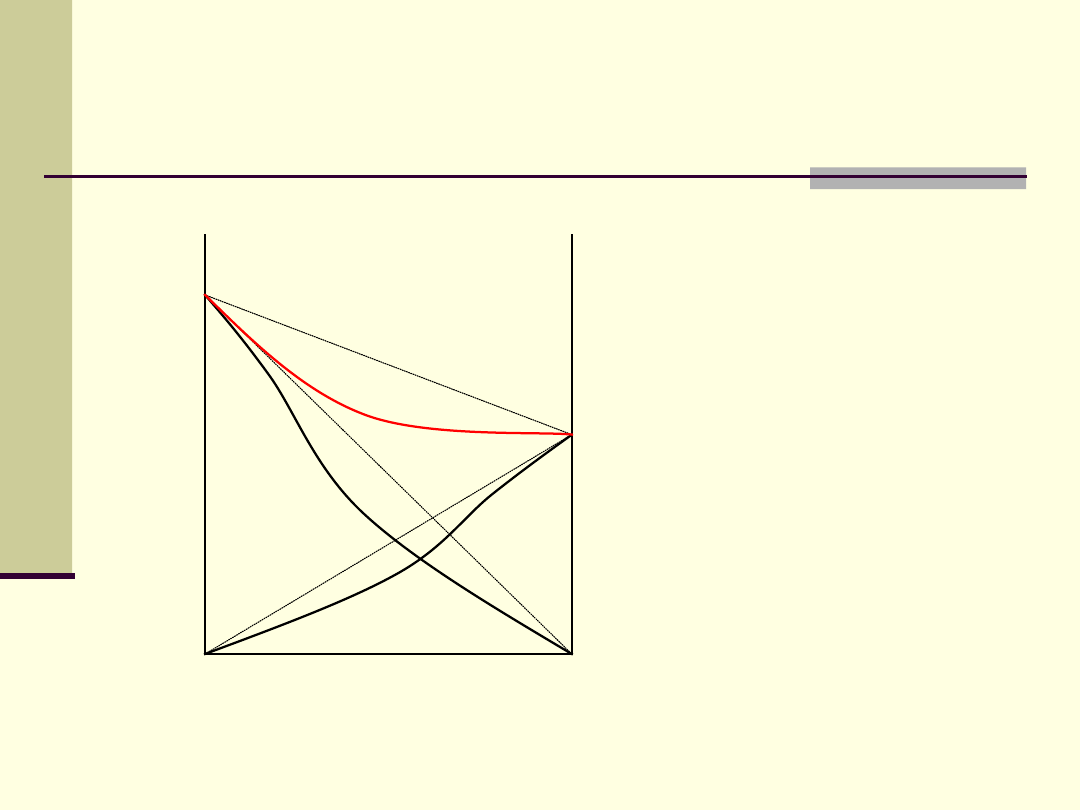
Ciecze z ujemnymi
odchyleniami od prawa
Raoulta
woda i kwas azotowy,
pirydyna i kwas
mrówkowy, aceton i
chloroform
A-A, B-B < A-B
ΔH
miesz
< 0
(proces egzotermiczny)
0
1
p
total
p
X
chloroform
chloroform
acetone

Roztwory idealnie
rozcieńczone – prawo
Henrego
Prężność pary substancji rozpuszczonej
jest proporcjonalna do jej ułamka
molowego w roztworze
p
B
= X
B
∙ K
B
K
B
jest stałą charakterystyczną dla substancji
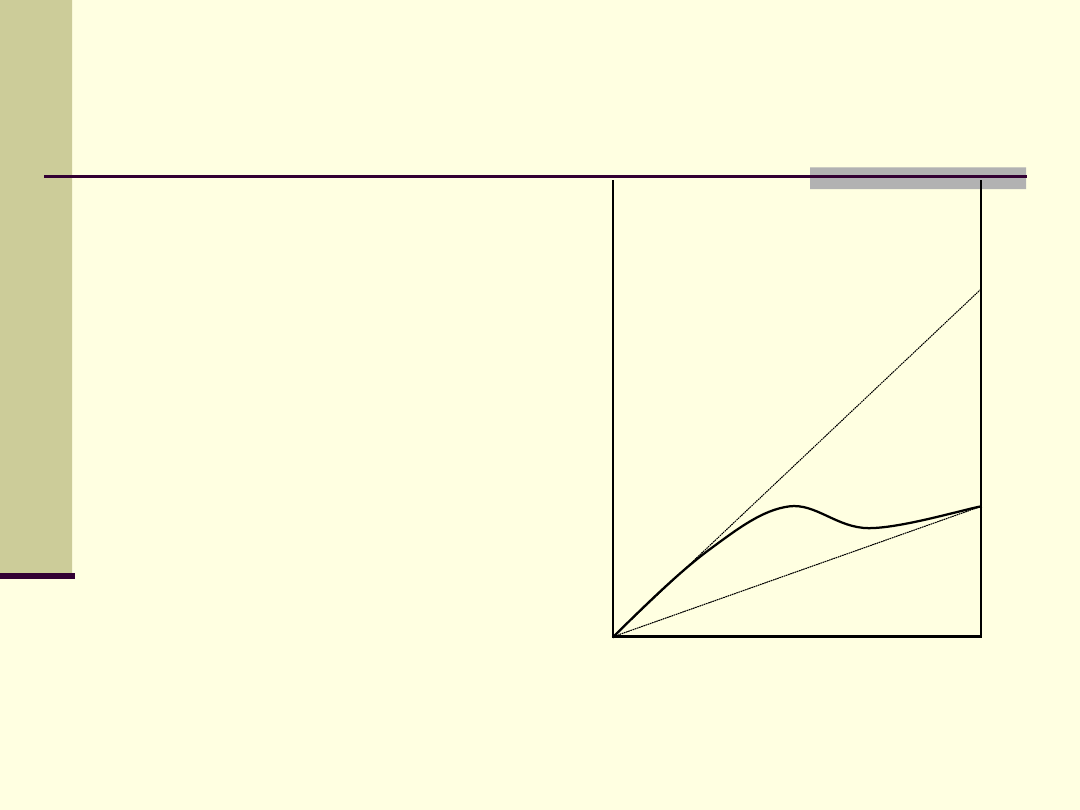
Prawo Raoulta i prawo
Henrego
Kiedy składnik roztworu jest
w
nadmiarze
(rozpuszczalnik)
zachowuje się zgodnie z
prawem
Raoulta
. Kiedy ta
sama substancja ma małe
stężenie (
s. rozpuszczona
)
zachowuje się zgodnie z
prawem
Henrego
.
0
1
p
Ułamek molowy
p*
K
Roztwór idealny
Roztwór idealnie
rozcieńczony

Skład pary nad roztworem
p
a
= p
tot
∙ X
ap
(Prawo Daltona)
Xap –
ułamek molowy składnika w parze
p
tot
∙ X
ap
= X
a
∙ p
a
*
p
tot
∙ X
bp
= X
b
∙ p
b
*
b
b
a
a
p
b
p
a
X
*
p
X
*
p
=
X
X
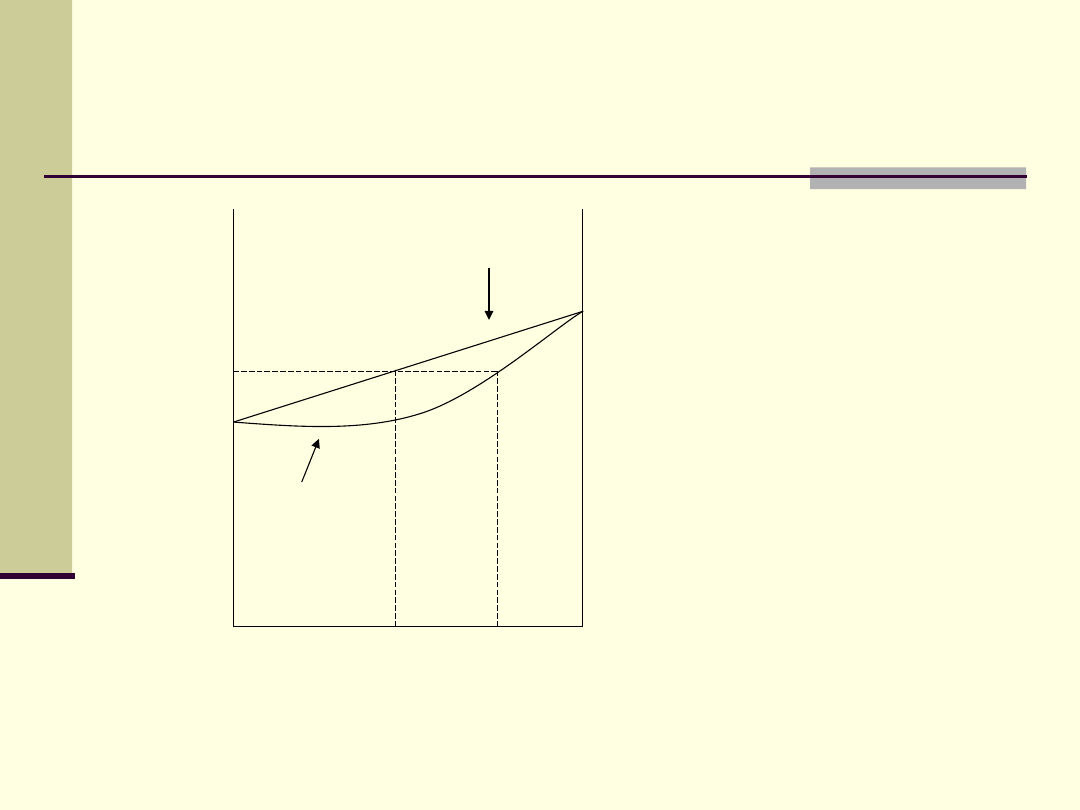
Skład pary nad roztworem
idealnym
p
0
1
s
1
s
1
’
skład pary
prężność pary
s
1
p
1
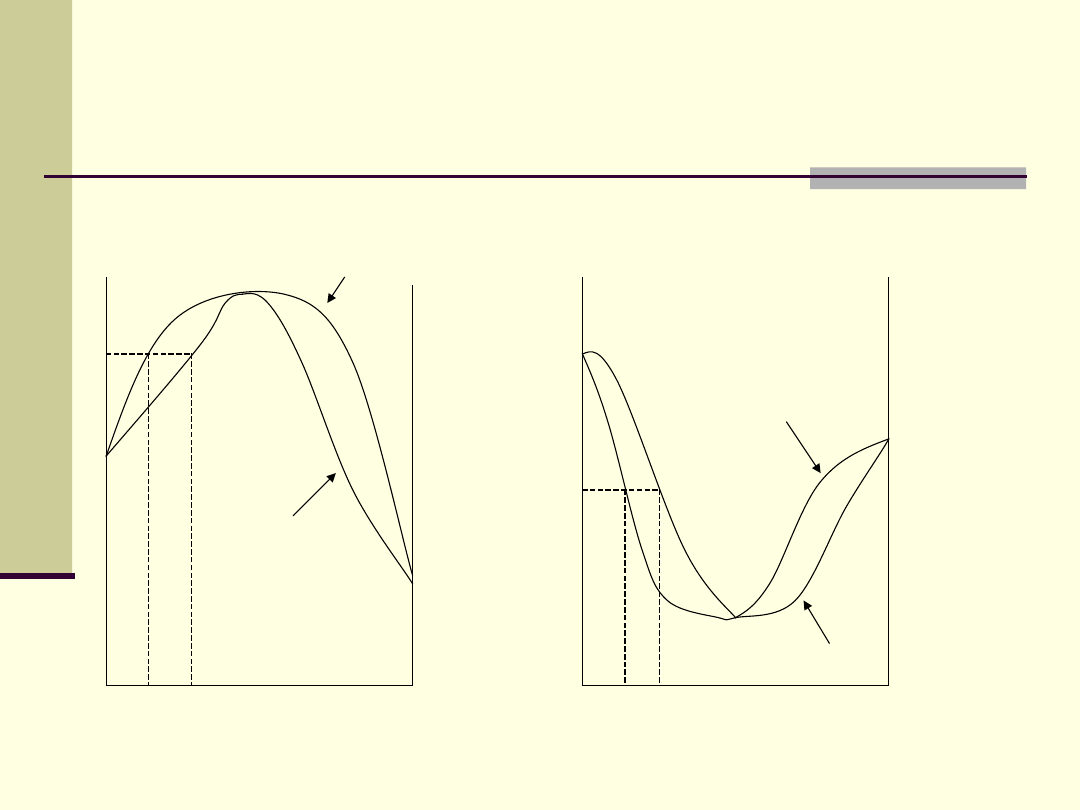
Skład pary nad roztworem
rzeczywistym
1. Dodatnie odchylenie od pr. Raoulta
2. Ujemne odchylenie od prawa Raoulta
p
1
s
1
s
1
s
1
’
Az
skład pary
prężność pary
Az
p
1
s
1
’
s
1
skład pary
prężność pary
s
1

Destylacja
Destylacja jest to metoda rozdzielania
składników tworzących roztwór opartą
na zjawisku wzbogacania pary nad
wrzącym roztworem w składnik bardziej
lotny

Zastosowanie destylacji
W rafineriach – destylacja frakcyjna ropy
naftowej
Produkcja ciekłego tlenu, azotu i argonu
Badanie składu lotnych olejków roślinnych
Destylacja chlorosilanów do produkcji
silikonu
Produkcja olejów rafinowanych,
stosowanych w kosmetykach do
pielęgnacji skóry
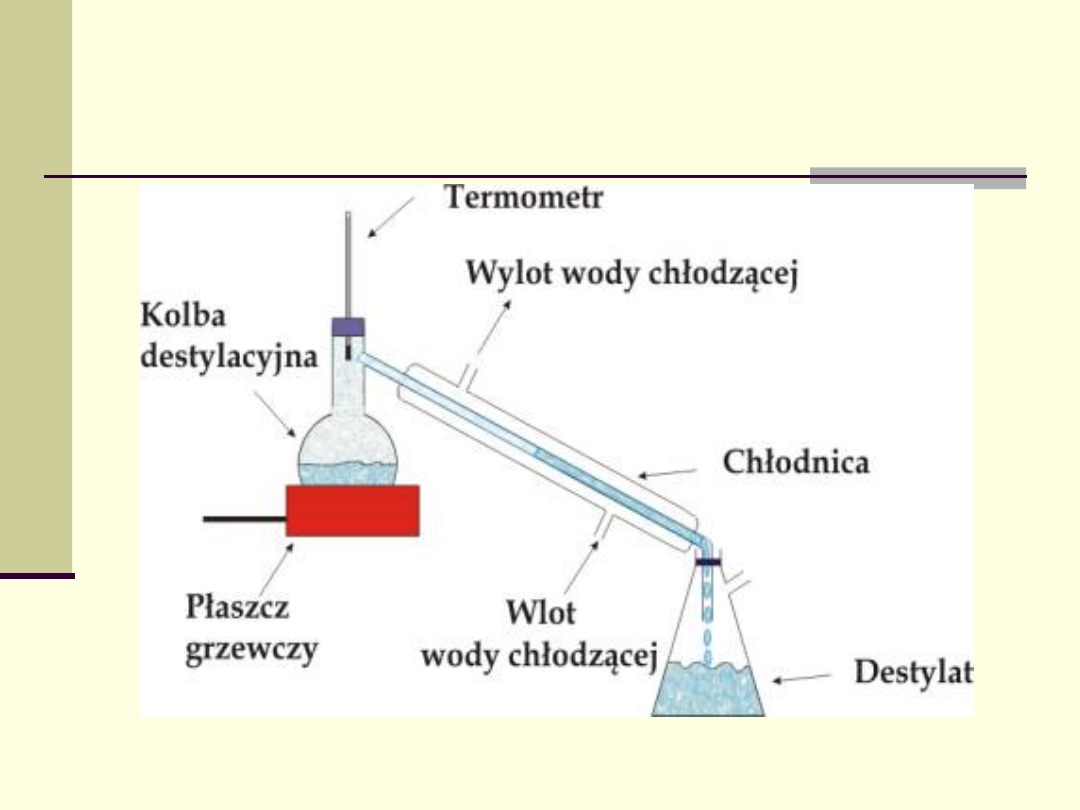
Destylacja - aparatura
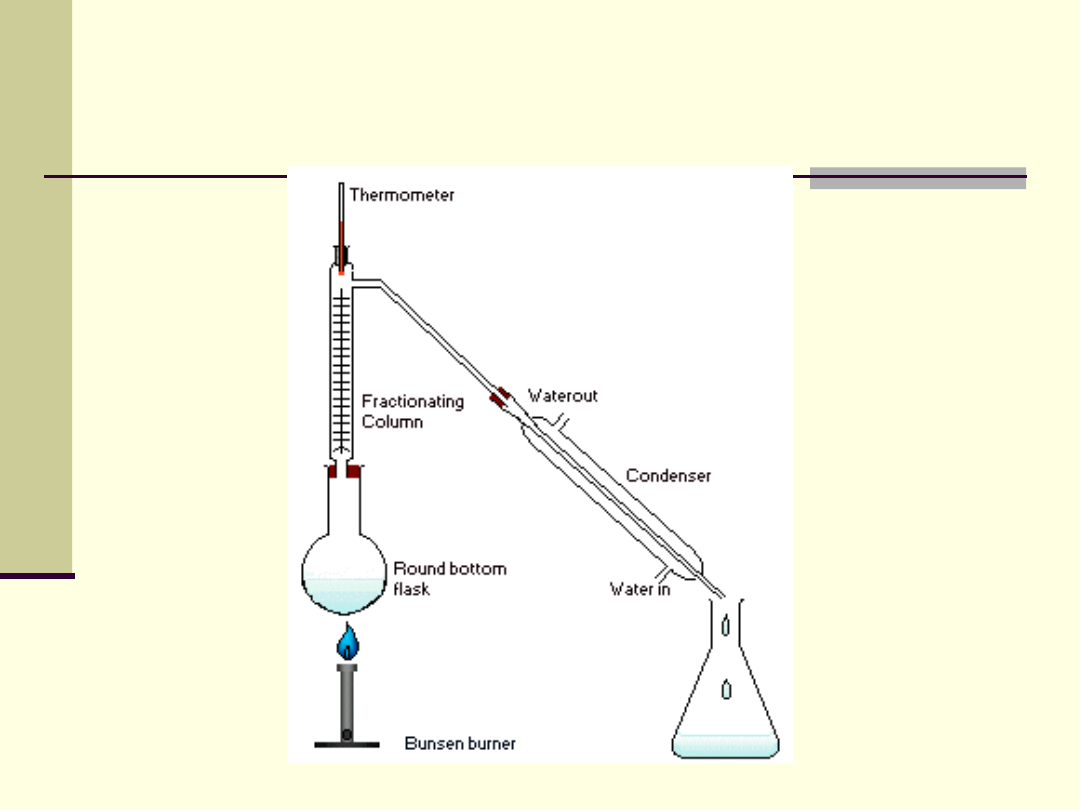
Destylacja frakcyjna
Destylacja
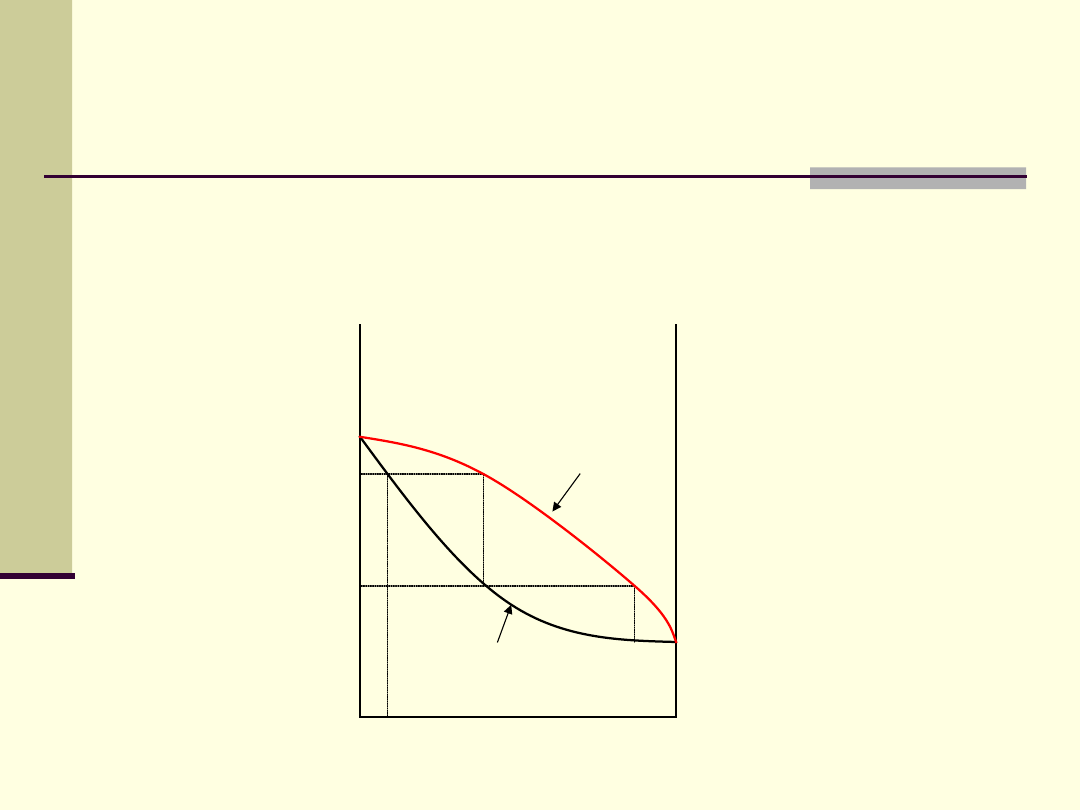
1. Roztwory idealne
0
1
Stężenie składnika, X
a
Temp
.
Skład pary
a
1
a
2
a
2
’
a
3
a
3
’
a
4
Temperatura
wrzenia cieczy
T
3
T
2
Destylacja
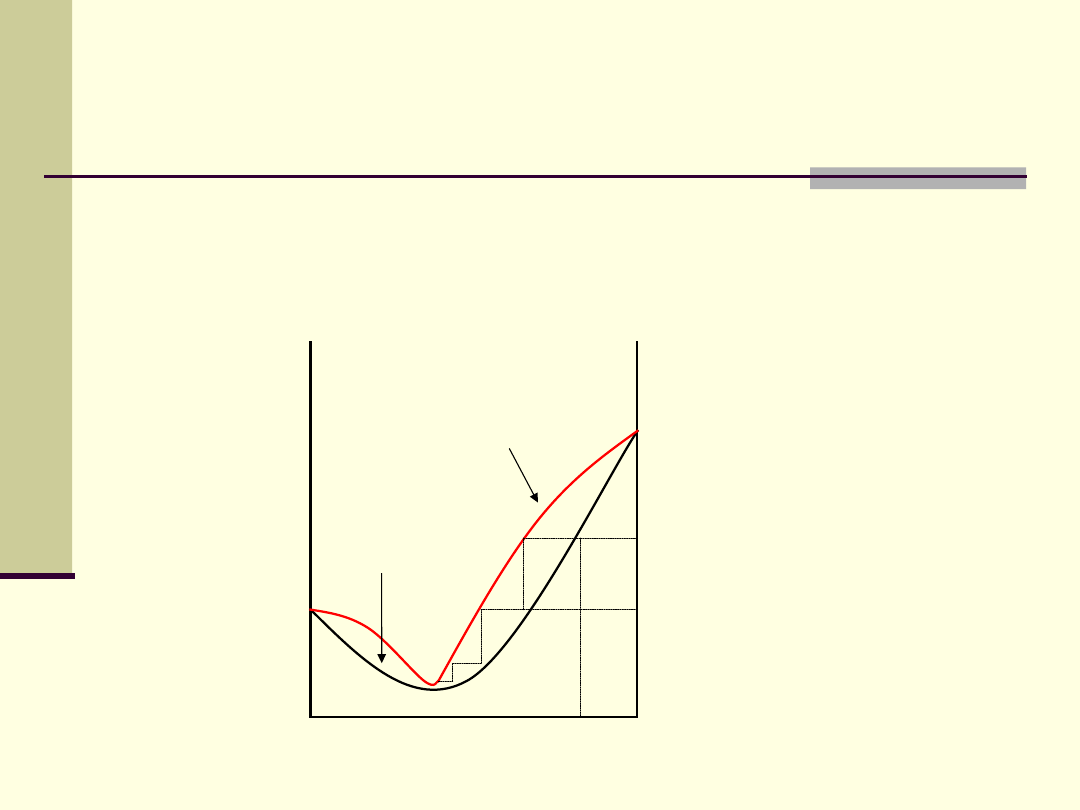
2. Dodatnie odchylenia od prawa Raoulta
0
1
Stężenie składnika, X
a
Temp
.
Skład pary
a
1
a
2
a
2
’
a
3
a
3
’
a
4
Temperatura
wrzenia
T
2
T
3
Destylacja
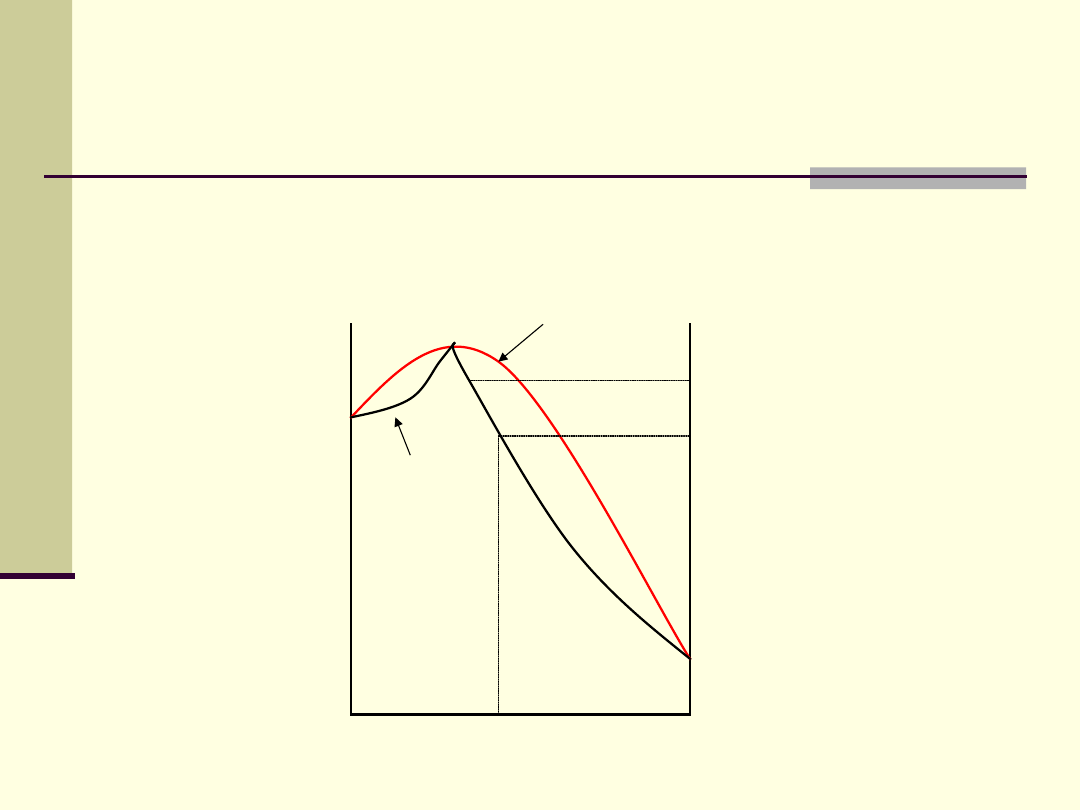
3. Ujemne odchylenie od prawa Raoulta
0
1
Composition, X
a
Temp
.
Skład pary
a
1
a
2
’
a
2
a
3
a
3
’
a
4
Temperatura
wrzenia cieczy
T
2
T
3
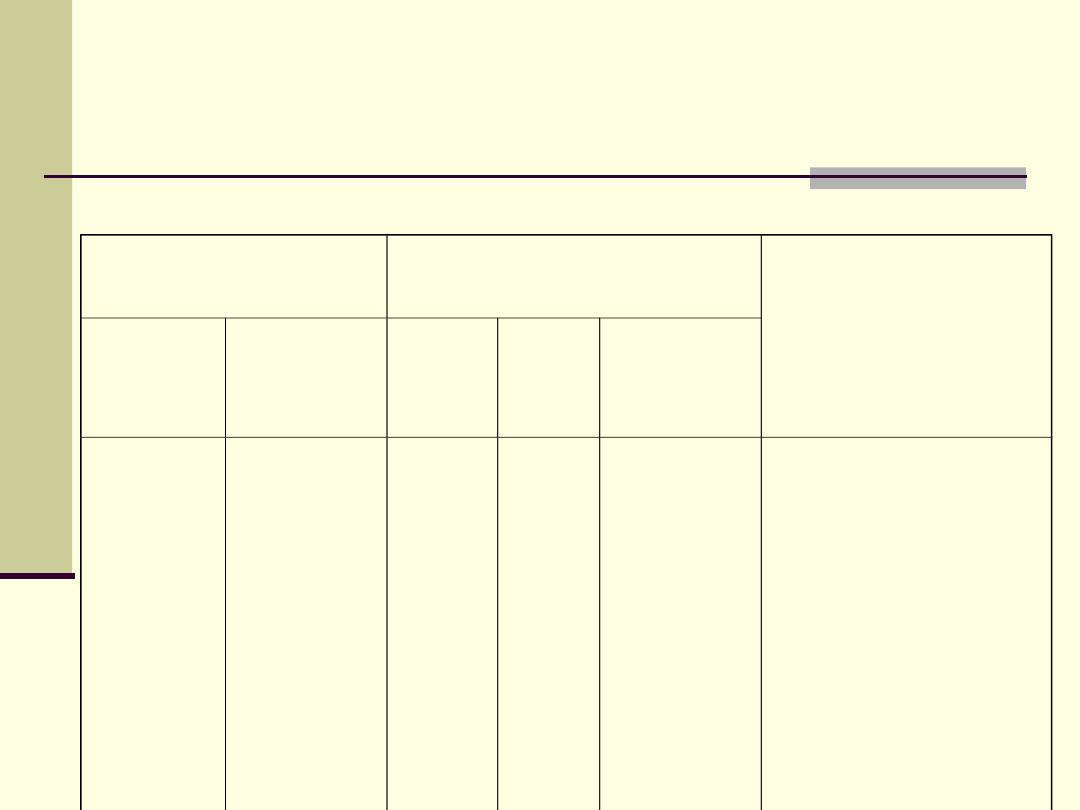
Azeotropy z dodatnim
odchyleniem od prawa
Raoulta
Sładnik azeotropu
Temperatura wrzenia
[K]
Stężenie [%]
składnika A w
azeotropie
A
B
A
B
azeotrop
woda
Benzen
Aceton
Benzen
Woda
Aceton
Etanol
Etanol
Metanol
Metanol
Propanol
Disiarcze
k węgla
373,2
353,4
329,6
353,4
373,2
329,6
351,
4
351,
4
337,
8
337,
8
370,
4
319,
4
351,3
341,4
328,8
331,5
360,8
312,4
4,4
67,6
87,9
60,4
28,3
34,0

Azeotropy z ujemnym
odchyleniem od prawa
Raoulta
Składnik azeotropu
Temperatura wrzenia
[K]
Stężenie [%]
składnika A w
azeotropie
A
B
A
B
azeotrop
Kwas
azotowy
HCl
HBr
formaldehyd
woda
woda
woda
woda
359,2
188,2
206,2
373,8
373,
2
373,
2
373,
2
373,
2
393,6
381,6
399,2
380,4
68,0
20,2
47,5
77,5

Rozdzielenie azeotropu na
składniki
Destylacja azeotropu z trzecim
składnikiem
Destylacja ekstrakcyjna z trzecim
składnikiem
Ekstrakcja ciecz-ciecz
Perwaporacja – częściowa waporyzacja
przez błonę
sorpcja
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
Wyszukiwarka
Podobne podstrony:
Higiena seminaria, Kosmetologia 9 Higiena psychiczna
Higiena seminaria, Kosmetologia 10 statystyka
Higiena seminaria, Kosmetologia 8 Higiena w roznych okresach zycia
Fizjoterapia Ogólna Zaliczenie Seminaria, kosmetologia magisterka, semestr 3, rehabilitacja
Higiena seminaria, Kosmetologia 5 kosmetyki
Higiena seminaria, Kosmetologia 7 czynniki zakazne
Higiena seminaria, Kosmetologia 9 Higiena psychiczna
technologia kosm seminaria, Technologia form kosmetyku
seminarium - Definicja oraz znaczenie masażu, WSZKiPZ, semestr III, kosmetyka pielęgnacyjna
więcej podobnych podstron