
Leczenie choroby
Leczenie choroby
Parkinsona przy pomocy
Parkinsona przy pomocy
przeszczepów
przeszczepów
komórkowych.
komórkowych.
Sylwia Leppert
Sylwia Leppert
Biotechnologia grupa2
Biotechnologia grupa2

Przedstawienie problemu
Przedstawienie problemu
klinicznego
klinicznego
Choroba Parkinsona (PD):
Choroba Parkinsona (PD):
►
Degeneracja i utrata neuronów
Degeneracja i utrata neuronów
dopaminergicznych w istocie czarnej
dopaminergicznych w istocie czarnej
►
Formowanie ciałek Lewy’ego w istocie czarnej
Formowanie ciałek Lewy’ego w istocie czarnej
Objawy kliniczne:
Objawy kliniczne:
►
Drżenie spoczynkowe
Drżenie spoczynkowe
►
Spowolnienie ruchowe
Spowolnienie ruchowe
►
Zesztywnienie
Zesztywnienie
►
Zaburzenia równowagi
Zaburzenia równowagi

Przebieg doświadczenia
Przebieg doświadczenia
CEL
CEL
►
Przywrócenie utraconych neuronów dopaminergicznych w
Przywrócenie utraconych neuronów dopaminergicznych w
istocie czarnej oraz unerwienia dopaminowego w prążkowiu.
istocie czarnej oraz unerwienia dopaminowego w prążkowiu.
►
Wykorzystanie komórek zrębowych szpiku kostnego-
Wykorzystanie komórek zrębowych szpiku kostnego-
mezenchymalnych komórek macierzystych (BMSCs)
mezenchymalnych komórek macierzystych (BMSCs)
►
Porównanie efektu terapeutycznego:
Porównanie efektu terapeutycznego:
Przeszczepionych komórek zróżnicowanych
Przeszczepionych komórek zróżnicowanych
Przeszczepionych komórek niezróżnicowanych
Przeszczepionych komórek niezróżnicowanych

METODYKA
METODYKA
►
Bezpośrednie wszczepienie BMSCs
Bezpośrednie wszczepienie BMSCs
►
Wszczepienie wcześniej indukowanych do
Wszczepienie wcześniej indukowanych do
różnicowania BMSCs
różnicowania BMSCs
►
Ocena poprzez: próbę obrotową, barwienie
Ocena poprzez: próbę obrotową, barwienie
immunohistochemiczne
immunohistochemiczne

Hodowla, pasażowanie i identyfikacja BMSCs
Hodowla, pasażowanie i identyfikacja BMSCs
Indukowanie różnicowania:
Indukowanie różnicowania:
+EGF (epidermalny czynnik wzrostu),+ BFGF ( czynnik wzrostu
+EGF (epidermalny czynnik wzrostu),+ BFGF ( czynnik wzrostu
fibroblastów), +BDNF ( neurotropowy czynnik pochodzenia
fibroblastów), +BDNF ( neurotropowy czynnik pochodzenia
mózgowego), +GDNF ( glejopochodny czynnik neurotroficzny)
mózgowego), +GDNF ( glejopochodny czynnik neurotroficzny)
►
Wyznakowanie pc nestyny – ocena zróżnicowania
Wyznakowanie pc nestyny – ocena zróżnicowania
►
+ 100uM BrdU, Wyznakowanie pc BrdU- ocena proliferacji
+ 100uM BrdU, Wyznakowanie pc BrdU- ocena proliferacji
Model szczura z PD
Model szczura z PD
stereotaktyczne podanie 6- OHDA w
stereotaktyczne podanie 6- OHDA w
obrębie obszarów MFB (pęczka przyśrodkowego
obrębie obszarów MFB (pęczka przyśrodkowego
przodomózgowia) oraz prawej strony VTA (brzusznej części
przodomózgowia) oraz prawej strony VTA (brzusznej części
nakrywki śródmózgowia)
nakrywki śródmózgowia)
+apomorfina
+apomorfina
Próba obrotowa- ocena uszkodzeń mózgu
Próba obrotowa- ocena uszkodzeń mózgu

Przed transplantacją komórek- trypsynizacja, przepłukanie
Przed transplantacją komórek- trypsynizacja, przepłukanie
DMEM, wirowanie.
DMEM, wirowanie.
3grupy diagnostyczne
3grupy diagnostyczne
:
:
1
1
- 25 szczurów z przeszczepionymi wcześniej
- 25 szczurów z przeszczepionymi wcześniej
zróżnicowanymi
zróżnicowanymi
komórkami BMSCs
komórkami BMSCs
2
2
- 25 szczurów z przeszczepionymi
- 25 szczurów z przeszczepionymi
nie zróżnicowanymi
nie zróżnicowanymi
komórkami BMSCs
komórkami BMSCs
3
3
- 21 szczurów, grupa kontrolna z solą fizjologiczną
- 21 szczurów, grupa kontrolna z solą fizjologiczną
Każdy szczur- 6*10
Każdy szczur- 6*10
5
5
komórek
komórek
+apomorfina
+apomorfina
pomiar ilości obrotów w przedziale czasu
pomiar ilości obrotów w przedziale czasu

Histologiczna identyfikacja po transplantacji
Histologiczna identyfikacja po transplantacji
1 tydzień
1 tydzień
+pc anty BrdU
+pc anty BrdU
+pc anty nestyna
+pc anty nestyna
+pc anty NSE (enolaza swoista dla neuronów)
+pc anty NSE (enolaza swoista dla neuronów)
+pc anty GFAP (kwaśne białko włókienkowe)
+pc anty GFAP (kwaśne białko włókienkowe)
+pc anty TH ( hydroksylaza tyrozyny)
+pc anty TH ( hydroksylaza tyrozyny)
1,3,5 miesięcy
1,3,5 miesięcy
Detekcja TH dodatnich komórek (TH- IR)
Detekcja TH dodatnich komórek (TH- IR)
Detekcja poziomu DA w prążkowiu przy pomocy HPLC
Detekcja poziomu DA w prążkowiu przy pomocy HPLC
Ocena statystyczna wyników - ANOVA
Ocena statystyczna wyników - ANOVA
WYNIKI
WYNIKI
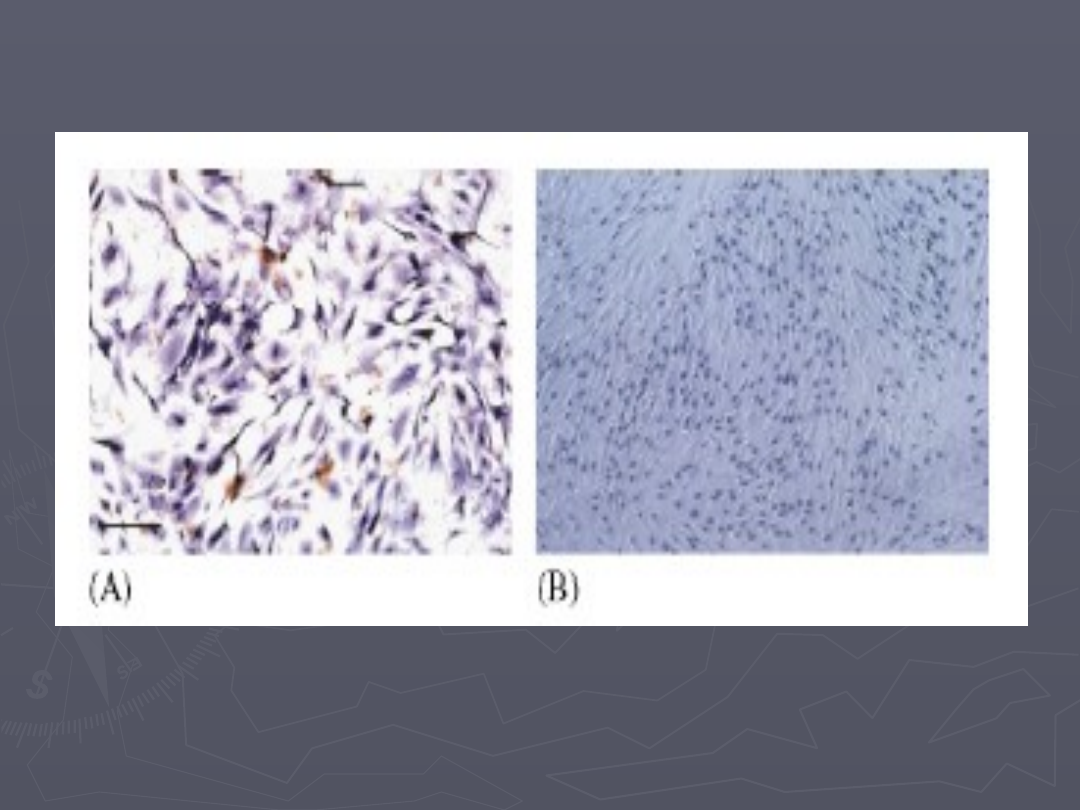
Immunohistochemiczne barwienie hodowli BMSCs in vitro poddanej
Immunohistochemiczne barwienie hodowli BMSCs in vitro poddanej
działaniu czynników różnicujących
działaniu czynników różnicujących
A- komórki nestyno- dodatnie
A- komórki nestyno- dodatnie
64,8
64,8
+/- 7,8%
+/- 7,8%
B- komórki BrdU- dodatnie
B- komórki BrdU- dodatnie
72
72
+/- 10,6%
+/- 10,6%
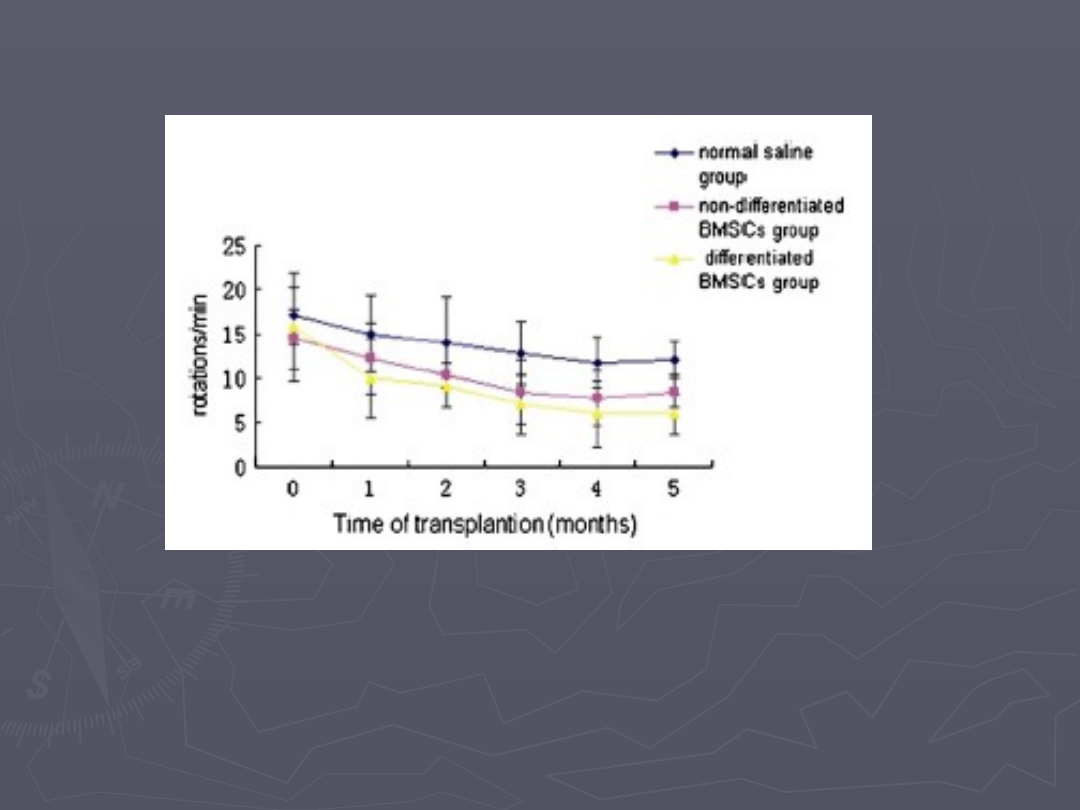
►
Zmniejszone zahowanie rotacyjne u szczurów po 5 miesiącach
Zmniejszone zahowanie rotacyjne u szczurów po 5 miesiącach
od transplantacji
od transplantacji
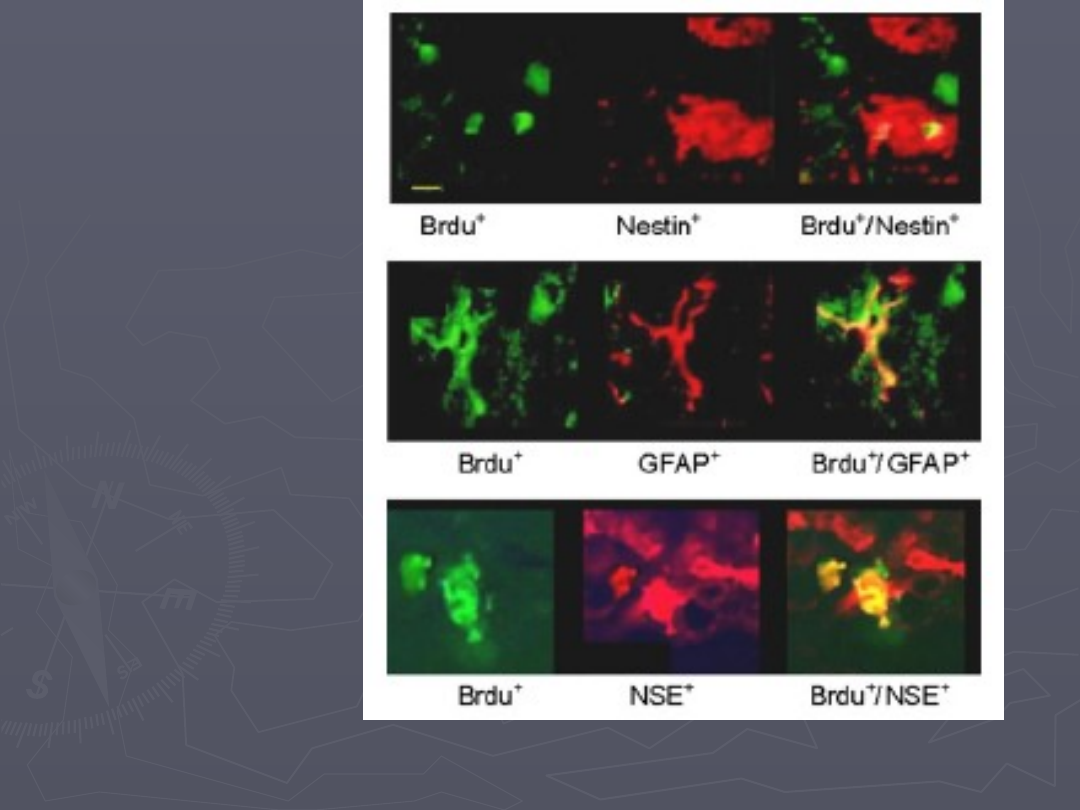
Tydzień po
Tydzień po
tranplantacji
tranplantacji
(komórek grupy 1)
(komórek grupy 1)
Miesiąc po
Miesiąc po
transplantacji
transplantacji
(komórek grupy 1)
(komórek grupy 1)
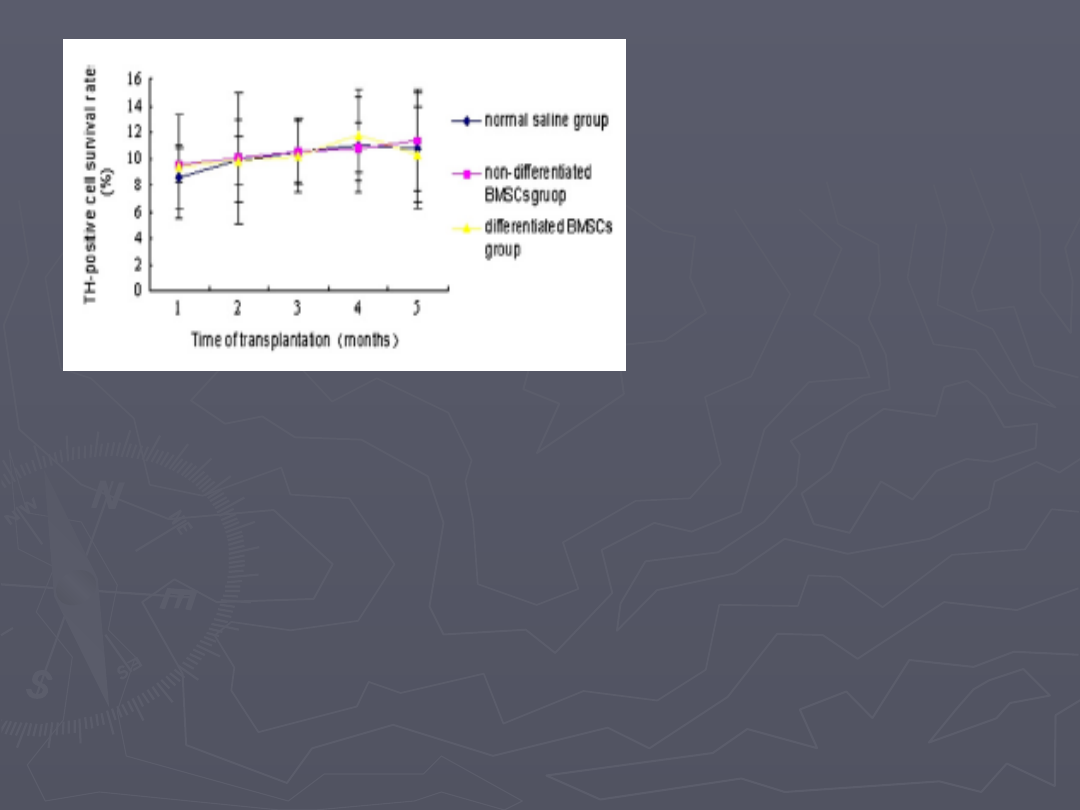
Brak znaczących różnic
Brak znaczących różnic
wśród komórek TH-
wśród komórek TH-
dodatnich w istocie czarnej.
dodatnich w istocie czarnej.
►
Zawartość DA w prążkowiu 3miesiące po transplantacji:
Zawartość DA w prążkowiu 3miesiące po transplantacji:
334
334
ug/g w grupie 1
ug/g w grupie 1
325
325
ug/g w grupie 2
ug/g w grupie 2
76 ug/g w grupie kontrolnej
76 ug/g w grupie kontrolnej
►
W obecnych badanich odsetek powstałych astrocytów w prążkowiu po
W obecnych badanich odsetek powstałych astrocytów w prążkowiu po
tranplantacji był większy w przypadku grupy1 niż w pozostałych dwóch,
tranplantacji był większy w przypadku grupy1 niż w pozostałych dwóch,
co wkskazuje, iż wszczepienie już zróżnicowanych BMSCs zapewnia
co wkskazuje, iż wszczepienie już zróżnicowanych BMSCs zapewnia
lepszy efekt terapeutyczny
lepszy efekt terapeutyczny

wnioski
wnioski
►
BMSCs in vivo mogą przekraczać barierę krew- mózg,
BMSCs in vivo mogą przekraczać barierę krew- mózg,
integrować z lokalną tkanką, migrować wewnątrz mózgu,
integrować z lokalną tkanką, migrować wewnątrz mózgu,
wywoływać rekonstrukcję
wywoływać rekonstrukcję
►
Są zdolne do trans- dyferencjacji (po działaniu induktorów) w
Są zdolne do trans- dyferencjacji (po działaniu induktorów) w
komórki nerwowe i glejowe
komórki nerwowe i glejowe
►
Ponadto są łatwe do izolowania, oczyszczenia, hodowania i
Ponadto są łatwe do izolowania, oczyszczenia, hodowania i
zdolne do przeżycia przez długi czas po transplantacji do OUN.
zdolne do przeżycia przez długi czas po transplantacji do OUN.
Nadzieja dla terapii genowej chorób układu nerwowego
Nadzieja dla terapii genowej chorób układu nerwowego

żródło
żródło
Na pdst.
Na pdst. Min Ye, Xi-Jin Wang, Yu-Hong Zhang, Guo-
Qiang Lu, Liang Liang, Jie-Yi Xu, Sheng-Di Chen
„
„Therapeutic effects of differentiated bone marrow
stromal cell transplantation on rat models of
Parkinson’s disease” 2007
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
Wyszukiwarka
Podobne podstrony:
Leczenie mięśniaków macicy przy pomocy zogniskowanej wiązki ultradźwięków
Leczenie choroby Parkinsona i stwardnienia zanikowego bocznego
Leczenie farmakologiczne choroby Parkinsona
LECZENIE CUKRZYCY PRZY POMOCY D Nieznany
Leczenie farmakologiczne choroby Parkinsona
Leczenie chorób stawów u zwierząt towarzyszących z zastosowaniem przeszczepu mezenchymalnych komórek
CHOROBA PARKINSONA 4
Choroba Parkinsona
Choroba Parkinsona jest to choroba postępująca, Fizjoterapia
więcej podobnych podstron