I Liceum Ogólnokształcące w Rzeszowie
im. ks. Stanisława Konarskiego
Materiały wewnątrzszkolne – wszystkie prawa zastrzeżone || autorzy: Aleksandra Kopacz i Agnieszka Ciąpała || Strona 1 z 3
Główne liczby kwantowe
De Broglie w 1924r. wysunął hipotezę, że elektrony wykazują dualizm korpuskularno
falowy tzn. elektron dotychczas traktowany jako cząstka materii w pewnych warunkach może
zachowywać się jak fala elektromagnetyczna.
Każdy elektron ma właściwy sobie zasób energii. Mówimy ze dany elektron zajmuje
określony stan kwantowy.
Zasada nieoznaczoności Heisenberga:
Nie jest możliwe równoczesne podanie po jakim torze elektron porusza się w atomie i gdzie
znajduje się w danym momencie.
Stan kwantowy – to jeden z możliwych stanów energetycznych elektronu.
W stanie podstawowym elektron nie emituje ani nie pochłania energii natomiast zmiana stanu
kwantowego powoduje jej emisję lub pochłanianie.
Stan kwantowy elektronu opisują liczby kwantowe.
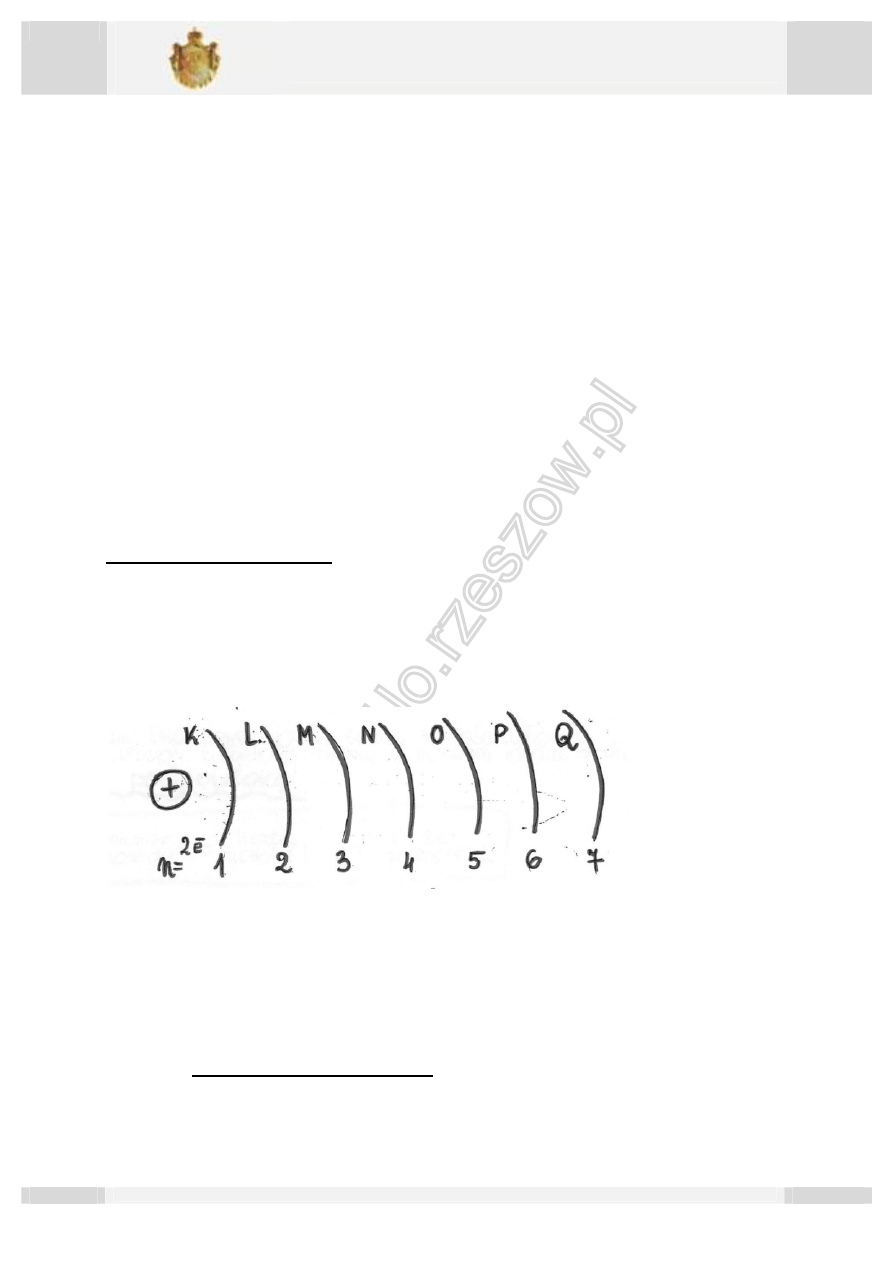
Główna liczba kwantowa „n” ( n>0 i jest liczbą naturalną)
Określa ona energie elektronu.
Wszystkie stany kwantowe o identycznej wartości głównej liczby kwantowej tworzą zbiór,
który nazywamy powłoką elektronową. Powłoki elektronowe oznacza się literami (zaczynając
od K) i przyporządkowuje głównej liczbie kwantowej.
Energia elektronu rośnie wraz ze wzrostem „n”.
Liczbę stanów kwantowych, a tym samym maksymalną liczbę elektronów jakie mogą
wypełnić daną powłokę obliczamy z wyrażenia 2
ଶ
np. gdy n=2 to mamy 8 stanów
kwantowych.
Rozróżnieniem stanów energetycznych elektronów znajdujących się w tej samej powłoce
zajmuje się orbitalna liczba kwantowa „l”. (tzw. poboczna liczba kwantowa).
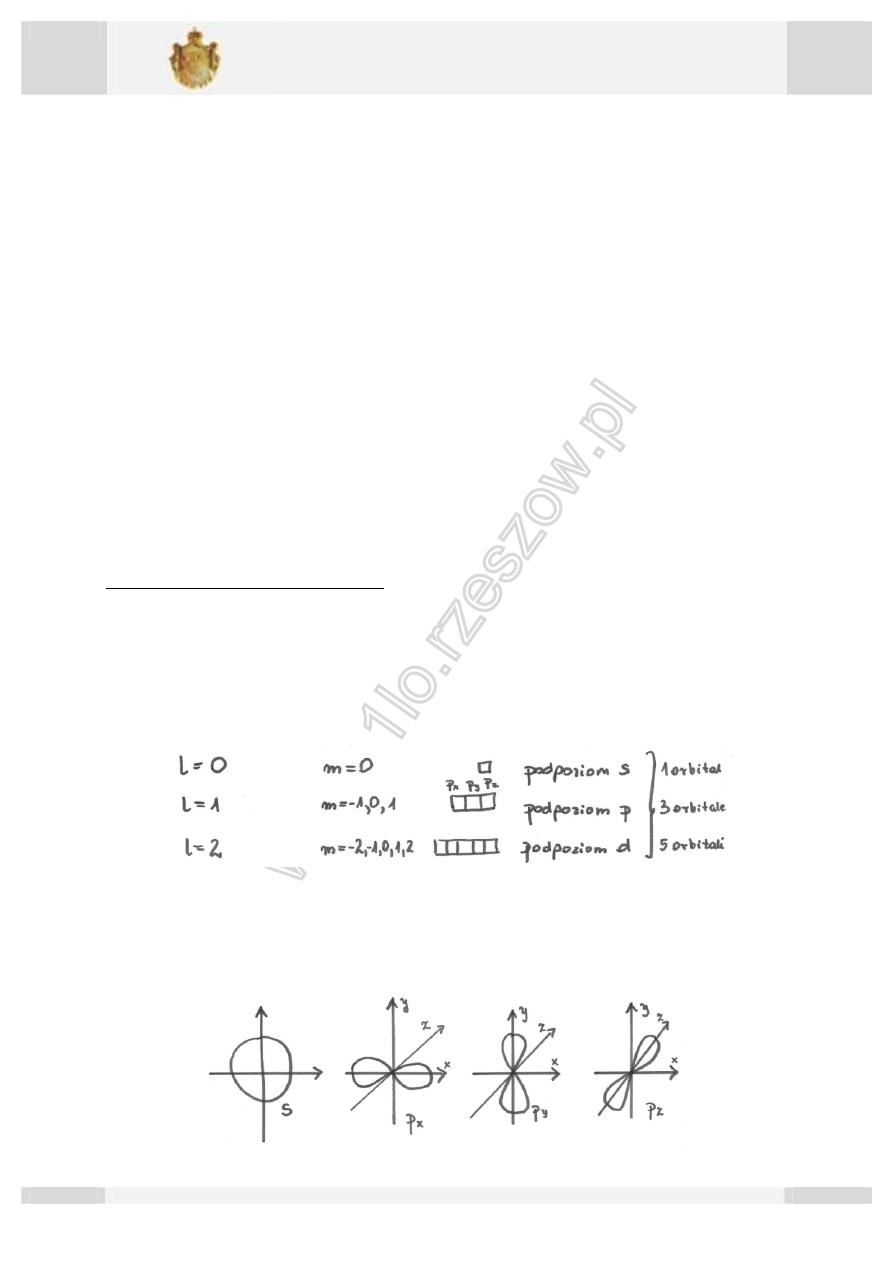
l= 0,1,2, … , n-1
I Liceum Ogólnokształcące w Rzeszowie
im. ks. Stanisława Konarskiego
Materiały wewnątrzszkolne – wszystkie prawa zastrzeżone || autorzy: Aleksandra Kopacz i Agnieszka Ciąpała || Strona 2 z 3
Poboczna liczba kwantowa:
•
Kwantuje moment pędu elektronu w obrębie poziomu energetycznego
•
Różnicuje podpoziomy (podpowłoki).
Np. dla n=3 : l=0 lub l=1 lub l=2
tzn. że w 3 powłoce są 3 podpowłoki
Wszystkie stany kwantowe o tej samej wartości głównej i orbitalnej liczby kwantowej tworzą
w ramach danej powłoki podpowłokę.
n = numer powłoki = liczba wartości l = liczba podpowłok
Każda podpowłoka ma przypisany jej symbol literowy. Liczba stanów kwantowych
w podpowłoce jest stała i wynosi 4 2.
Gdy l=0 litera s
Gdy l=1 litera p
Gdy l=2 litera d
Gdy l=3 litera f.
Magnetyczna liczba kwantowa „m”.
m= -l,…,0,…,l (czyli w sumie 2l+1)
np. l=3 wówczas m=-3,-2,-1,0,1,2,3.
Magnetyczna liczba kwantowa różnicuje w obrębie podpowłoki stany orbitalne, kwantuje rzut
momentu pędu na wyróżniony kierunek i decyduje o orientacji przestrzennej.
Orbital – przestrzeń maksymalnego prawdopodobieństwa znalezienia elektronu opisanego
danymi liczbami kwantowymi.
Orbital typu s ma symetrię sferyczną. Orbital typu p ma kształt ósemki (klepsydra).

I Liceum Ogólnokształcące w Rzeszowie
im. ks. Stanisława Konarskiego
Materiały wewnątrzszkolne – wszystkie prawa zastrzeżone || autorzy: Aleksandra Kopacz i Agnieszka Ciąpała || Strona 3 z 3
Magnetyczna spinowa liczba kwantowa „
࢙
”
Kwantuje rzut spinu na wyróżniony kierunek, decyduje o zwrocie wektora spinu w obrębie
stanu orbitalnego.
௦
ଵ
ଶ
lub m
ୱ
ଵ
ଶ
Zad. 1.
Oblicz liczbę podpowłok elektrycznych znajdujących się w powłoce 4. Oznacz je symbolami.
n=4 l=0
s
l=1
p
l=2
d
l=3
f
Tych podpowłok jest 4.
Zad. 2.
Określ liczbę stanów kwantowych:
a)
W podpowłoce „d” czwartej powłoki
b)
W podpowłoce „p” czwartej powłoki
c)
W podpowłoce o n=4.
Ad.a.
n=4 l=2
d m=-2,-1,-0,-1,-2 10 stanów kwantowych (ilość „m” razy 2, gdyż
są dwie możliwości zwrotu wektora spinu)
Ad.b.
n=4
l=1
p
m=-1,0,1
6 stanów kwantowych
Ad.c.
n=4 2
ଶ
32 32 stany kwantowe
Zad.3.
Podaj wartości liczb kwantowych n, l, m dla 4 powłoki.
n=4
l=3
m=-3,-2,-1,0,1,2,3.
Wyszukiwarka
Podobne podstrony:
Glowne liczby kwantowe id 18507 Nieznany
liczby kwantowe
Liczby kwantowe, chemia(2)
Liczby kwantowe, Notatki i materiały dodatkowe, Chemia, materiały dodatkowe
Liczby kwantowe, chemia dla liceum
LICZBY KWANTOWE I PRAWA ZACHOWANIA
Liczby kwantowe chemia dla liceum
liczby kwantowe
06 Orbitale i liczby kwantowe
19 Liczby kwantowe
5) Liczby kwantowe
więcej podobnych podstron