Zakład Chemii Fizycznej
Laboratorium Studenckie
Sprawozdanie z ćwiczenia nr 19
Wyznaczanie ciepła zobojętniania kwasu siarkowego wodorotlenkiem sodowym w roztworze wodnym.
Aparatura :
Kalorymetr
Zasilacz
Stoper
Strzykawka
Odczynniki :
Kwas siarkowy
Wodorotlenek sodowy
Wykonali :
Sebastian Trochim
Krystian Siodłak
Inż. Chem.rok II gr. 1
Sposób przeprowadzania pomiarów :
Do naczynia kalorymetrycznego wlałem 450 cm3 NaOH . Następnie do naczyńka wewnętrznego odpipetowałem 25 cm3 H2SO4 . po umocowaniu naczyńka do pokrywy tłoczek strzykawki odciągamy do góry . po opuszczeniu pokrywy mieszadełko włączamy i ustawiamy obroty na 20-30 obrotów na min.
Rozpoczynając pomiar odczytujemy pomiar temperatury co 1 min. (ok..8 odczytów ).następnie przy pomocy strzykawki przetłoczyć zawartość naczynka wewnętrznego do kalorymetru i odczytu dokonywać co 30 sek.
( ok. . 2 pomiary ). Następnie odczytywać temperaturę w odstępach minutowych ( ok. .8 pomiarów ) .później podłączany grzałkę do zasilacza (odczytu dokonujemy co minutę aż temperatura wzrośnie o 1 °C od momentu włączenia grzałki ). Wyłączmy grzałkę i dokonujemy odczytu temperatury co 1 min osiem razy .
Opracowanie wyników
Ciepło reakcji zobojętnienia Q obliczamy ze wzoru:
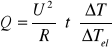
gdzie
U - napięcie równe 30 V
R - opór grzałki równy 934 Ω
ΔT i ΔTel - przyrosty temperatury spowodowane reakcją chemiczną i przepływem przez grzałkę prądu elektrycznego .
ΔT - 1,33 °C
ΔTel - 1 °C
Q = 5667,81 [ J ]
Molowe ciepło reakcji zobojętniania ΔH obliczam ze wzoru
![]()
gdzie nNaOH =V⋅f V = 450⋅ 10-3 dm3 f = 0,1 mol/dm3
ΔH=125951,33 [ J/ mol ]
Wyszukiwarka