Data wykonania: 23.03.2010r. |
|
Dr inż. Magdalena Frańska |
Data oddania: 30.03.2010r. |
Ćw. Nr 1; Skala pH |
Ocena: |
I. Wstęp teoretyczny:
W chemii mamy kilka teorii dotyczących tego co jest kwasem, a co zasadą. Oto kilka z nich:
I. teoria Brönsteda- teoria ta głosi, że zasadą jest substancja mogąca przyłączyć protony a kwasem substancja je oddająca. Kwas oddający proton przechodzi w sprzężoną z nim zasadę.
II. teoria Arrhemiusa- według tej teorii kwasem jest cząsteczka która odczepia jony H+ a zasada odczepia jony OH-
III. teoria Usanowicza- kwasem nazywamy substancję zdolną do tworzenia soli, odszczepiającą jony H+ i przyjmującą protony, zaś zasadą substancję zobojętniającą kwasy, odszczepiającą jony OH- lub oddającą elektrony
Cząsteczki wody wykazują w zależności od środowiska (kwasowego lub zasadowego) zdolności pobierania lub oddawania protonów, natomiast w zupełnie czystej wodzie (bez kwasu lub zasady) ulega w bardzo małym stopniu dysocjacji:
H2O+ H2O H3O++OH-
W temperaturze 25oC stała równowagi wody wynosi 1,8*10-16, można ją obliczyć ze wzoru:
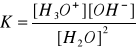
W każdym roztworze H2O jest stałość iloczynu stężeń jonów wodorowych i wodorotlenowych (dużo mniejsza od stężenia wody) równa iloczynowi jonowemu wody. Stężenie obu jonów w czystej wodzie wynosi 10-7mol/dm3. Ponieważ wartość iloczynu jonowego wody pozostaje stała w stałej temperaturze, wprowadzeniu do roztworu jonów H+ i towarzyszy zmniejszenie stężenia jonów OH-. Analogicznie wzrost stężenia jonów OH- odbywa się kosztem zmniejszenia stężenia jonów H+ .
Ponieważ operowanie liczbami typu 10-7 jest dość kłopotliwe Soerensen wprowadził tzw. skalę pH i określił jako ujemny logarytm stężenia jonów wodorowych:
pH= - log[H3O+]
II. Przebieg i opracowanie ćwiczenia.
Po rozcieńczeniu 0.1 M HCl do stężeń 0.01M, 0.001M i 0.0001M zmierzyliśmy jego pH. To samo zrobiliśmy z NaOH i CH3COOH. Oto wyniki:
Cm HCl: |
0,1 |
0,01 |
0,001 |
0,0001 |
0,00001 |
pH: |
2,00 |
3,00 |
7,40 |
7,40 |
7,80 |
pH teoretyczne: |
1 |
2 |
3 |
4 |
5 |
pH teoretyczne dla HCl:
Cm = 0,1 M Cm = 0,01 M
pH = - log [H+] pH = - log [H+]
pH = -log(10-1) pH = -log(10-2)
pH = 1 pH = 2
Cm = 0,001 M Cm = 0,0001 M
pH = - log [H+] pH = - log [H+]
pH = -log(10-3) pH = -log(10-4)
pH = 3 pH = 4
Cm = 0,0001 M
pH = - log [H+]
pH = -log(10-5)
pH = 5
Cm NaOH: |
0,1 |
0,01 |
0,001 |
0,0001 |
0,00001 |
pH: |
12,80 |
11,40 |
9,30 |
8,30 |
7,70 |
pH teoretyczne: |
13 |
12 |
11 |
10 |
9 |
pH teoretyczne dla NaOH
Cm = 0,1 M Cm = 0,01 M
pH = 14 + log[OH-] pH = 14 + log[OH-]
pH = 14 + log(10-1) pH = 14 + log(10-2)
pH = 14 - 1 pH = 14 - 2
pH = 13 pH = 12
Cm = 0,001 M Cm = 0,0001 M
pH = 14 + log[OH-] pH = 14 + log[OH-]
pH = 14 + log(10-3) pH = 14 + log(10-4)
pH = 14 - 3 pH = 14 - 4
pH = 11 pH = 10
Cm = 0,00001 M
pH = 14 + log[OH-]
pH = 14 + log(10-5)
pH = 14 - 5
pH = 9
Cm CH3COOH: |
0,1 |
0,01 |
0,001 |
0,0001 |
0,00001 |
pH |
3,00 |
4,80 |
7,30 |
7,40 |
7,54 |
pH teoretyczne: |
2,875 |
3,375 |
3,875 |
4,375 |
4,875 |
pH teoretyczne dla CH3COOH:
Cm = 0,1 M
pH = ˝ pKa - ˝ log [CH3COOH] pKa = 4,75
pH = 2,375 + ½ log(10-1) = 2,375 + 0,5
pH = 2,875 ≈ 2,88
Cm = 0,01 M
pH = ½ pKa - ½ log [CH3COOH] pKa = 4,75
pH = 2,375 + ½ log(10-2) = 2,375 + 1
pH = 3,375 ≈ 3,38
Cm = 0,001 M
pH = ½ pKa - ½ log [CH3COOH] pKa = 4,75
pH = 2,375 + ½ log(10-3) = 2,375 + 1,5
pH = 3,875 ≈ 3,88
Cm = 0,0001 M
pH = ½ pKa - ½ log [CH3COOH] pKa = 4,75
pH = 2,375 + ½ log(10-4) = 2,375 + 2
pH = 4,375 ≈ 4,38
Cm = 0,00001 M
pH = ½ pKa - ½ log [CH3COOH] pKa = 4,75
pH = 2,375 + ½ log(10-5) = 2,375 + 2,5
pH = 4,875 ≈ 4,88
Mieszanina kwasów o różnej mocy zachowuje się jak kwas wieloprotonowy, ponieważ taki kwas dysocjuje etapami odrywając po jednym kationie wodorowym dając kolejny kwas o innej mocy
Miareczkowanie kwasem solnym wyciągu z czerwonej kapusty
pH roztworu |
Barwa roztworu |
12 |
Zgniła zieleń |
10 |
Zielony |
9,3 |
Jasnozielony |
8,7 |
Miętowy |
8,1 |
Jasnomiętowy |
7,15 |
Bladoherbaciany |
6,7 |
Lekko pomarańczowy |
6,1 |
Lekko różowy |
5,1 |
Jasnoróżowy |
4,7 |
Różowy |
4,1 |
Intensywny różowy |
3,9 |
Malinowy |
3,5 |
Landrynkowy |
3 |
Pomarańczowo-różowy |
2,6 |
Jasnoczerwony |
1 |
Czerwony |
Najpopularniejszym wskaźnikiem pH pochodzenia naturalnego jest lakmus. Jest to niebieski barwnik otrzymywany z porostów. Roztwór lakmusu w środowisku zasadowym barwi się na niebiesko, zaś w obecności kwasów na czerwono. Zakres zmiany barwy przypada na pH ok. 5-8.
Sok z buraków jest purpurowy w środowisku kwaśnym (w obecności kwasu octowego w barszczu). Zabarwienie to utrzymuje się do pH=7. Po dodaniu do takiego roztworu amoniaku następuje zmiana barwy na niebiesko-fioletowy, a przy pH=12 na brązowy.
III. Wnioski
pH kwasu wzrasta w miarę rozcieńczania.
pH zasady maleje w miarę rozcieńczania.
Dzięki znajomości jak zmieniają barwę wskaźniki w różnych środowiskach można określić jakie to środowisko (kwasowe czy zasadowe).
pH teoretyczne różni się od pH zmierzonego w praktyce, co dokładnie widać na wykresach, ponieważ była nie dokładność pomiarowa na przyrządach pomiarowych.
Wyszukiwarka