98.10.26
Igor Czerski
Wydział Chemiczny
Laboratorium z chemii fizycznej
ćwiczenie Nr 131
Temat: „Wpływ elektrolitu na lepkość rozpuszczalników dwuskładnikowych”
Igor Czerski
Wydział Chemiczny
kurs magisterski
Nr grupy dziekańskiej 1
Zagadnienia teoretyczne
W stałej temperaturze podczas przepływu wymuszonego gradientem ciśnienia zewnętrznego grad(p) szybkości warstw cieczy vi są różne i zależą od ich odległości od osi przepływu r. Zmiana szybkości warstw jest skutkiem dynamicznej lepkości cieczy i można ją obliczyć rozwiązując równanie Naviera-Stokesa dla określonych warunków przepływu:
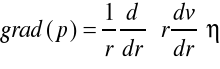
Lepkość cieczy , właściwość makroskopowa jest skutkiem oddziaływań międzycząsteczkowych i molekularnej strukturze cieczy. Lepkość roztworów dwu- i więcej składnikowych może być źródłem informacji o zmianach struktury spowodowanych zmianą składu roztworu.
W temperaturze pokojowej lepkości rozpuszczalników dwuskładnikowych nie są addytywne i ich zależności od składu roztworu nie można przewidzieć w oparciu o lepkości czystych składników. Nieliniowe zmiany lepkości z ułamkiem molowym składnika organicznego są charakterystyczne dla rozpuszczalników wodno-organicznych, szczególnie jeżeli składnik organiczny ma dobrze wykształconą strukturę.
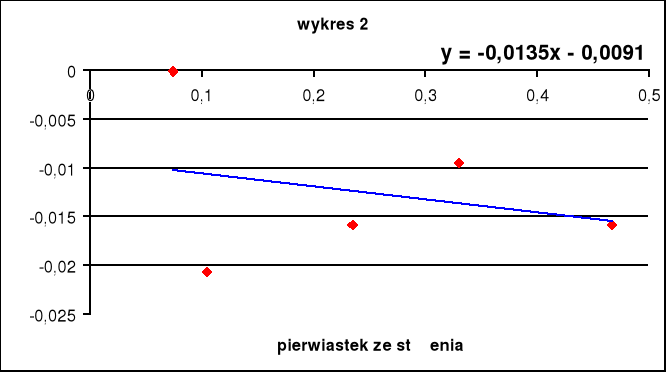
Wpływ stężenia elektrolitu na lepkość rozpuszczalnika opisuje doświadczalne równanie Jonesa i Dola:
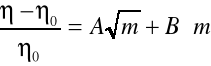
W którym oznacza lepkość roztworu elektrolitu o stężeniu molarnym m, natomiast 0 jest lepkością rozpuszczalnika.
Współczynnik A zależy od oddziaływań międzyjonowych. Współczynnik B jest miarą oddziaływań jonów z cząsteczkami rozpuszczalnika jeżeli elektrolit dzięki wytworzeniu dobrze uporządkowanych, stabilnych sfer solwatacyjnych wzmacnia strukturę rozpuszczalnika (jak np. układy woda-LiCl...LiF, NaF, MgCl2) B przyjmuje wartości dodatnie. Wartości B bliskie zeru lub nieznacznie ujemne świadczą albo o braku wpływu elektrolitu na strukturę, albo o nieznacznej niezgodności struktur rozpuszczalnika i sfer solwatacyjnych jonów. Wyraźne dodatnie wartości przyjmuje wsp. B dla wodnych roztworów soli tetraalkiloamoniowych.
W rozpuszczalnikach słabo uporządkowanych, np. acetonie, acetonitrylu, wsp. B dla halogenków metali alkalicznych jest dodatni, natomiast w rozpuszczalnikach o strukturze dobrze wykształconej wsp. B dla tych samych soli przyjmuje wartości ujemne. Dzięki temu halogenki metali alkalicznych są stosowane jako próbniki w badaniach struktury rozpuszczalników dwuskładnikowych.
Sprawozdanie
Otrzymałem układ MeOH-H2O w stosunku 1:4.
Otrzymałem zadane stężenia roztworów 0,2; 0,1; 0,05; 0,01; 0,005kol/dm3
Zważyłem KCl dla próbek 1 i 3
1. 0,8167g ; 0,0109mola ; 0,215mol/dm3
3. 0,2054g ; 2,75*10-3mola ; 0,055mol/dm3
resztę roztworów uzyskałem metodą kolejnych rozcieńczeń. Zatem stężenia molowe roztworów wynoszą kolejno (w mol/dm3)
0,218
0,109
0,055
0,011
0,0055
Lp. |
Stężenie (mol/dm3) |
Gęstość (g/cm3) |
Średni czas wypływu(s) |
Lepkość (cP) |
Cząstkowa objętość molowa(cm3/mol) |
1 |
0,218 |
0,9835 |
141,54 |
1,312 |
17,72 |
2 |
0,109 |
0,9771 |
143,08 |
1,318 |
19,14 |
3 |
0,055 |
0,9744 |
143,39 |
1,317 |
13,11 |
4 |
0,011 |
0,9724 |
143,91 |
1,319 |
-54,30 |
5 |
0,0055 |
0,9720 |
144,28 |
1,321 |
-110,47 |
mix |
--------- |
0,971 |
144,43 |
1,322 |
---------- |
Gęstości, po zważeniu roztworów w piknometrze o masie 8 1063g wynoszą kolejno
9,2693g ; 0,9835 g/cm3
9,2089g ; 0,9771 g/cm3
9,1833g ; 0,9744 g/cm3
9,1648g ; 0,9724 g/cm3
9,1614g ; 0,9720 g/cm3
gęstość układu MeOH-H2O obliczam ze wzoru:
dmix=0,99556-0,2546xm+0,056xm2-0,0111xm3
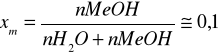
dmix=0,971 g/cm3
Lepkość układu MeOH-H2O obliczam ze wzoru:
mix=0,88307+5,8377xm-15,9185xm2+14,318xm3-4,573xm4
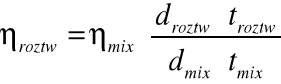
mix=1,322Pas
Cząstkowa objętość molowa roztworów soli obliczam ze wzoru:
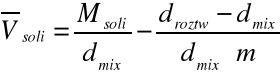
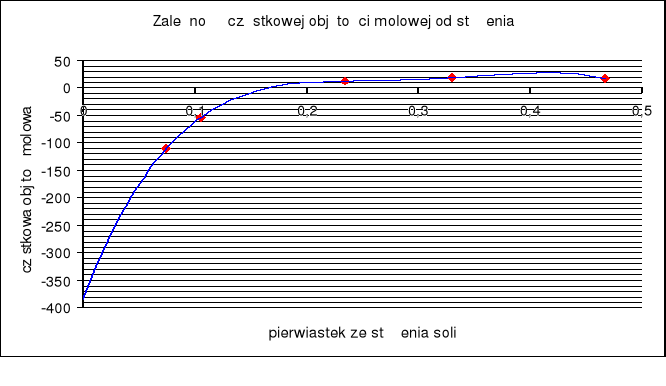
Wykres zależności
![]()
Wyekstrapolowana wartość cząstkowej objętości molowej w nieskończenie rozcieńczonym roztworze wynosi -380cm3/mol
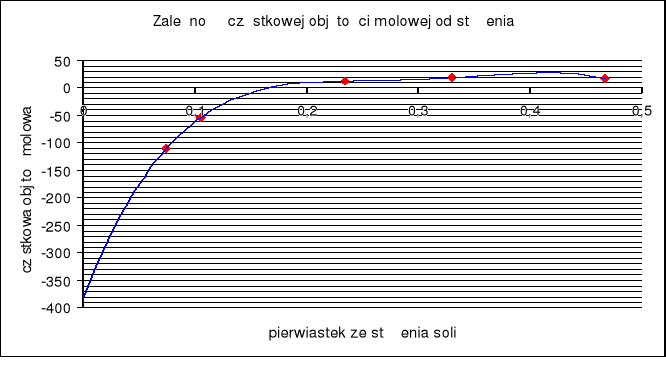
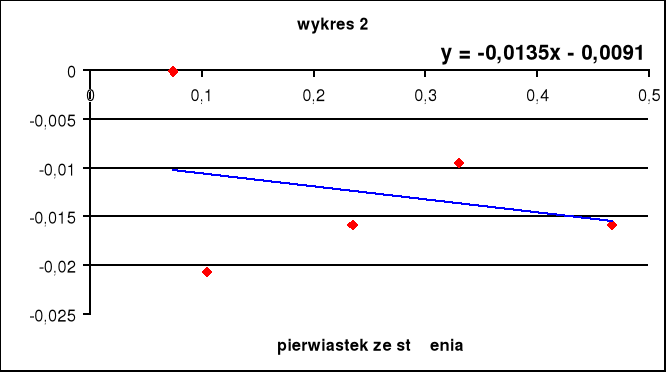
Wykres zależności
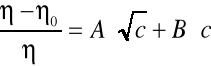
Wartość współczynnika A zależy od oddziaływań międzyjonowych a B- charakteryzuje oddziaływanie jonów z rozpuszczalnikiem. Wyznaczona wartość B wynosi -0,0135. Wartość ta świadczy o słabych oddziaływaniach pomiędzy KCl a rozpuszczalnikiem mieszanym H2O-MeOH co jest zgodne z danymi źródłowymi.
Wnioski:
Współczynnik B w równaniu Jonesa-Dole'a, wyznaczony przeze mnie na podstawie doświadczenia jest bliski zeru (-0,0135). Wartość ta mówi nam, iż KCl jest solą, która nie wpływa na strukturę rozpuszczalnika mieszanego jakim jest roztwór H2O-MeOH w stosunku objętościowym 4:1.
Metoda ta jest dobra tylko w zakresie stężeń soli od 0,05mol/dm3. Mniejsze stężenia zastosowane przy tym ćwiczeniu powodują zbyt duże odchylenia od rzeczywistości spowodowane dużym błędem przy wyznaczaniu gęstości tychże roztworów soli
![]()
![]()
![]()
![]()
![]()
![]()
Wyszukiwarka