Politechnika Lubelska Wydział Mechaniczny |
Ćwiczenie nr 5 Temat ćwiczenia: |
Imię i Nazwisko Paweł Banach |
|
Laboratorium Inżynierii Ekologicznej |
Oznaczanie tlenu rozpuszczonego w wodzie metodą Winklera. |
Nr grupy: MD-506.5a |
Data wykonania ćwiczenia: 22.05.2009 |
Cel ćwiczenia:
Celem oznaczenia jest:
Zapoznanie się metodologią oznaczania zawartości tlenu w wodzie metodą Winklera.
Zasada oznaczania:
Tlen rozpuszczony w wodzie w roztworze alkalicznym utlenia powstały w wodzie wodorotlenek manganawy (Mn2+) do związków manganu czterowartościowego (Mn4+), które po zakwaszeniu próbki utleniają dodany jodek do jodu wolnego w ilości równoważnej ilości tlenu rozpuszczonego w wodzie. Zachodzą przy tym reakcje:
2Mn+ + 4OH- → 2Mn(OH)2
2Mn(OH)2 + O2 → 2MnO(OH)2
MnO(OH)2 + 4H+ → Mn4+ + 3H2O
Mn4+ + 2 I- → Mn2+ + I2
Wydzielony jod miareczkuje się tiosiarczanem sodowym w obecności skrobi:
Wykonanie oznaczenia:
Do butelki z nieutrwaloną próbką wody dodać, wprowadzając koniec pipety pod powierzchnię wody, 1 cm3 siarczanu manganawego i 2 cm3 alkalicznego roztworu jodku potasowego. Zamknąć szczelnie butelkę korkiem tak, aby pod nim nie powstał pęcherzyk powietrza (przy zamykaniu butelki część wody wypływa na zewnątrz). Zawartość butelki dokładnie wymieszać poprzez jej wstrząsanie przez 30-50 sek. a następnie butelkę pozostawić w ciemności aż do opadnięcia zawiesiny na dno. Dodać następnie 1 cm3 kwasu siarkowego, wprowadzając koniec pipety pod powierzchnię wody, butelkę zamknąć korkiem, unikając pozostawienia pod korkiem pęcherzyka powietrza, dobrze wymieszać i pozostawić na kilka minut do rozpuszczenia się osadu. Odmierzyć pipetą z butelki 100 cm3 roztworu i przenieść ją do kolby stożkowej z korkiem doszlifowanym i odmierzony roztwór miareczkować 0,025 n roztworem tiosiarczanu sodowego, dodając pod koniec miareczkowania 1 cm3 skrobi. Powtórnego pojawienia się zabarwienia po 5 minutach od chwili zakończenia miareczkowania nie bierze się pod uwagę. Jeżeli próbka wody została wcześniej utrwalona, to przy oznaczaniu nie dodaje się siarczanu manganawego i alkalicznego jodku potasowego, próbkę od razu się zakwasza i wykonuje się oznaczenie jak podano powyżej.
Obliczanie zawartości tlenu rozpuszczonego w wodzie:
Zawartość tlenu rozpuszczonego w wodzie oblicza się ze wzoru:
gdzie: X - Zawartość tlenu rozpuszczonego w wodzie, mg O2/dm3,
a - ilość tiosiarczanu sodowego 0,025 n zużytego na zmiareczkowanie wydzielonego jodu w 100 cm3 próbki wody, cm3,
b - ilość dodanych roztworów siarczanu manganawego i alkalicznego roztworu jodku potasowego, cm3,
0,2 - ilość w mg tlenu odpowiadająca zużyciu 1 cm3 tiosiarczanu sodowego 0,025 n.
Przy oznaczeniach masowych można przyjąć, że b = 0 i obliczyć zawartość tlenu według uproszczonego wzoru:
X = 2 · a [mg O2/dm3]
Wykonanie oznaczania:
Czynności poczynione przy badaniu wody nienatlenionej:
Pobieramy wodę do buteleczki o pojemności 300 cm3
Dodajemy 1 cm3 MnSO4 oraz 2 cm3 KJ + NaOH
Następuje wytrącanie się osadu w roztworze
Tlen zawarty w wodzie utlenia mangan do +4 stopnia utleniania
Mierzymy temperaturę wody, która wynosi 21°C
Zakwaszamy roztwór dodając 1 cm3 H2SO4, aby z jodku potasu wytrącił się jod
Mangan wydziela wolny jod w ilości równoważnej ilości tlenu
Chcąc oznaczyć zawartość jodu miareczkujemy roztworem Na2S2O3 o stężeniu 0,025n
Miareczkujemy 100 cm3 badanego roztworu
Dodajemy skrobię celem ułatwienia wyznaczenia końcowego punktu miareczkowania
Objętość roztworu zużytego do miareczkowania a1= 0,6 cm3
Stężenie tlenu dla wody nienatlenionej:
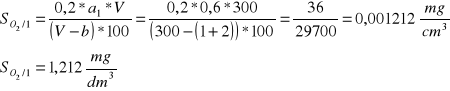
Obliczenie procentu nasycenia tlenem wody:
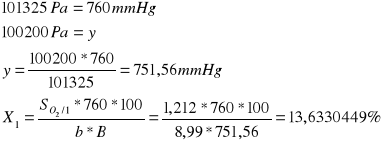
Analogiczne postępowanie przeprowadzamy dla wody natlenionej.
Temperatura wody natlenionej wynosi 23°C
Objętość roztworu zużytego do miareczkowania a2= 2 cm3
Stężenie tlenu dla wody natlenionej:
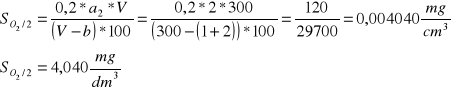
Obliczenie procentu nasycenia tlenem wody:
![]()
Zadanie:
Ilość tlenu potrzeba do całkowitego nasycenia 1 dm3 wody stykającej się z powietrzem wynosi 10,15 mg O2/dm3 (wartość dla 288 K; 15°C). Podaj tę wartość w procentach masowych oraz procentach objętościowych.
![]()
W warunkach normalnych 1 mol dowolnego gazu zajmuje 22,4 dm3, więc aby obliczyć jaką objętość zajmuje 1 mol tego samego gazu w warunkach określonych( uwzględnienie temperatury) w zadaniu musimy skorzystać z równania Clapeyrona:

W zadaniu przyjąłem, że ciśnienie jest wartością stałą i wynosi 101325 Pa czyli ciśnienie jakie jest określone w warunkach normalnych.
Obliczenie procentu objętościowego:
![]()
Obliczenie procentu masowego:
![]()
W obliczeniach przyjęto gęstość wody w temperaturze 15°C wynoszącą 999,10 g/dm3. Przy obliczaniu % masowego można by było pominąć sumowanie masy 1 dm3 wody oraz tlenu, który nasyca taką ilość wody uznając to, jako znikomy błąd w obliczeniach.
Uwagi końcowe:
W przeprowadzonym pomiarze została oznaczona zawartość tlenu rozpuszczonego w wodzie w 2 próbkach. Pomiary te są proste w wykonaniu i dają wyniki, które mogą być porównywane między sobą. Otrzymane wyniki jednoznacznie wskazują na większą zawartość tlenu w próbce poddanej procesowi „natleniania”. Różnica w procesie nasycenia tlenem wody jest ponad 3- krotna na korzyść wody natlenionej; można z tego wnioskować wody natlenione można szybciej poddać procesowi oczyszczania, co może skutkować zwiększeniem wydajności oraz znacznym zwiększeniem ekonomiczności procesu oczyszczania.
str. 1
Wyszukiwarka