VII. BOROWCE
Właściwości ogólne
|
Bor |
Glin |
Gal |
Ind |
Tal |
|
elektro- ujemność |
2,01 |
1,47 |
1,82 |
1,49 |
1,44 |
|
|
niemetal |
metale |
||||
|
|
s |
px |
py |
pz |
|
struktura elektronowa s2p1: |
↓↑ |
↑ |
|
|
||
- stopnie utlenienia: +3 i +1
- w miarę wzrostu masy atomowej wzrasta tendencja do oddawania tylko jednego elektronu (efekt nieczynnej pary elektronowej)
- bor dysponuje jedynie orbitalami typu s i p, pozostałe borowce również orbitalami typu
Podobieństwo diagonalne (po przekątnej):
Be B C
Mg Al Si
Skutek: bor jest bardziej podobny do krzemu niż do glinu
|
T.topn., K |
Eo,V (Me3+/Me) |
gęstość kg/dm3 |
B Al Ga In Tl |
2300 932 312 429 577 |
- -1,67 -0,53 -0,35 +1,25* |
2,34 2,70 5,90 7,30 11,8 |
* Me3+/Me+
2. Bor
Stanowi 1 ⋅ 10-3 % skorupy ziemskiej. Występuje jako
- kwas oksoborowy - H3BO3 (gorące źródła, wulkany)
- oraz boraks - Na2B4O7 ⋅ 10H2O
Otrzymywanie boru :
B2O3 + 3Mg = 2B + 3MgO ΔHo = -532 kJ/mol
Właściwości - bor to bardzo twardy niemetal → w skali Mosha→"9"
Skala Mosha:
1 talk 6 ortoklaz
2 gips 7 kwarc
3 kalcyt 8 topaz
4 fluoryt 9 korund
5 apatyt 10 diament
Alotropia boru
Trzy odmiany alotropowe boru - to 2 odmiany romboedryczne α i β oraz 1 odmiana tetraedryczna. Wszystkie zbudowane są z IKOSAEDRÓW (20-to ścianów). Różnią się sposobem powiązania tych IKOSAEDRÓW.
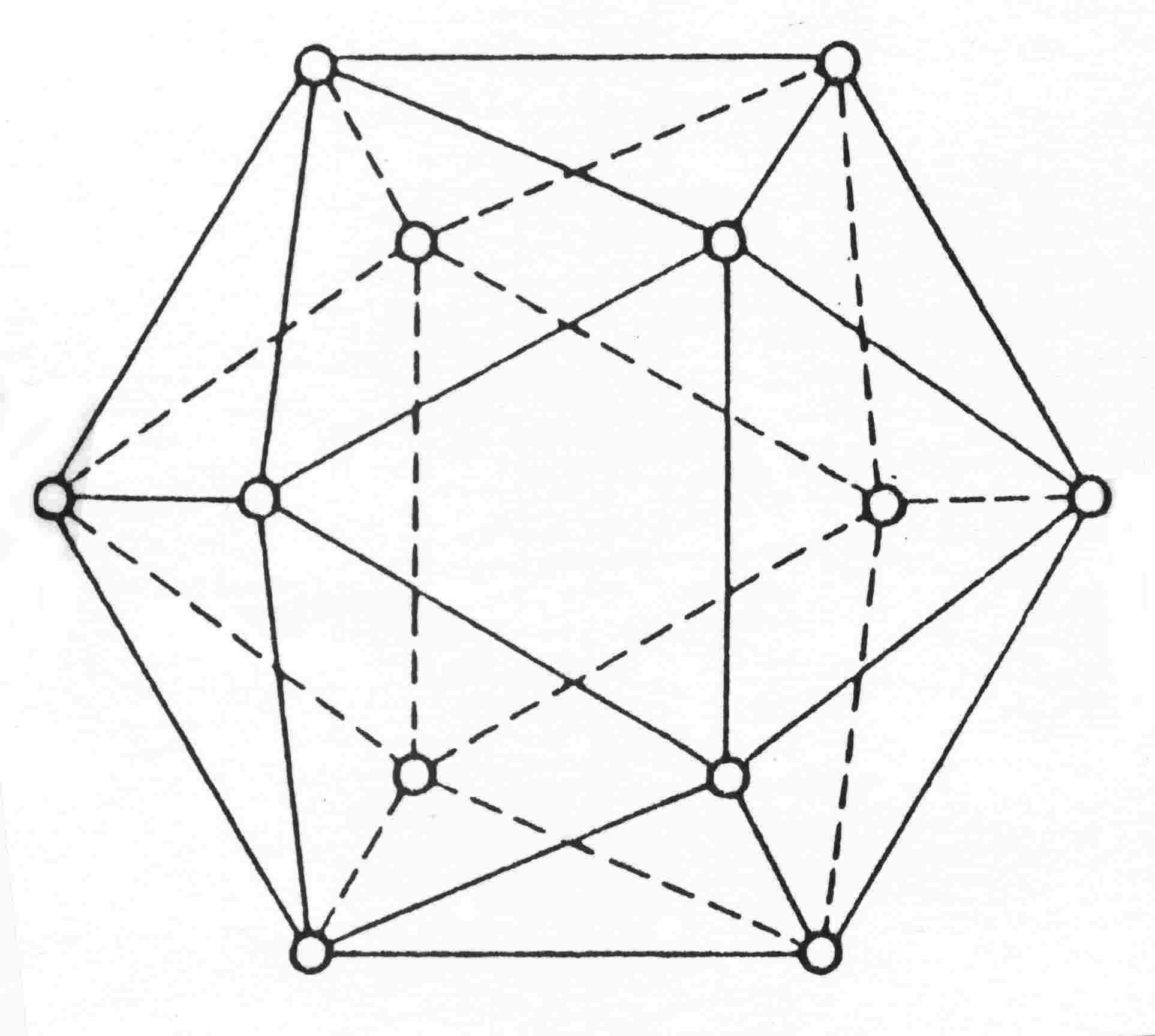
Struktura
ikosaedru - B12
l.k. boru = 5
3. Połączenia boru z wodorem
Są to BORANY (borowodory)
B2H6, B5H9, B8H12, B16H20 |
BnHn+4 |
B4H10, B6H12, B10H16 |
BnHn+6 |
B8H16, B10H18 |
Inne |
Brak BH3 → znany jest jedynie addukt BH4- , tj. anion tetrahydroboranu
Otrzymywanie diboranu:
4BCl3 + 3LiAlH4 = 2B2H6 + 3LiAlCl4
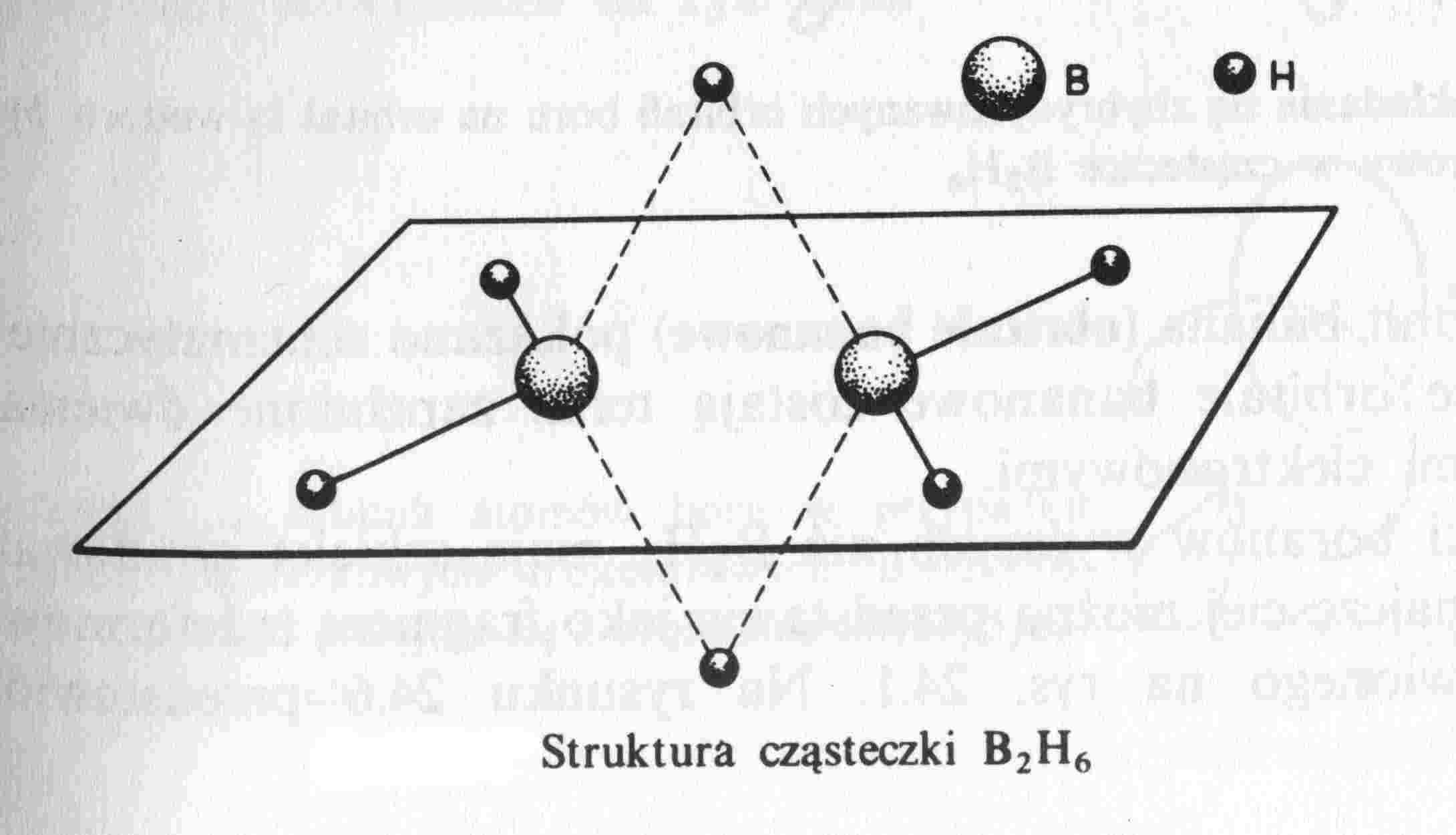
Hybrydyzacja orbitali elektronowych obu atomów boru jest typu sp3

Następuje nakładanie się zhybrydyzowanych orbitali obu atomów boru na orbital 1s wodoru (położony pomiędzy atomami boru) - powstaje zdelokalizowany orbital trójcentrowy, tzw. orbital bananowy.
Liczba elektronów walencyjnych: 2 x 3 + 6 x 1 = 12 el.
Gdyby były wyłącznie wiązania typu σ to 8 x 2 = 16 el.
Borany są związkami elektronowo "deficytowymi"
Budowa cząsteczek C2H6 i B2H6 - porównanie !
Poliborany:
370 - 520 K
B2H6 + H2 POLIBORANY
NaBH4, LiBH4 → tetrahydroborany
NaB2H7, NaB3H8 → hydrodi- i hydrotriborany sodu
B10C2H12 → karboboran
4. Tlenowe kwasy boru → pochodne B2O3
HBO2 - kwas metaborowy
H3BO3 - kwas ortoborowy
Kwas metaborowy powstaje:
400 K
H3BO3 HBO2 + H2O
HBO2 jest nietrwały w roztworze wodnym:
HBO2 + H2O = H3BO3
Kwas H3BO3 jest b. słabym kwasem jednoprotonowym:
H3BO3 + 2H2O = [B(OH)4]- + H3O+
Sole kwasów borowych to OKSOBORANY
Najważniejsza sól boru:
Na2B4O7 ⋅ 10H2O - BORAKS
Perła boraksowa - stopiony boraks rozpuszcza liczne tlenki metali ciężkich dając charakterystyczne zabarwienie |
5. Związki boru z azotem, fosforem, węglem i metalami
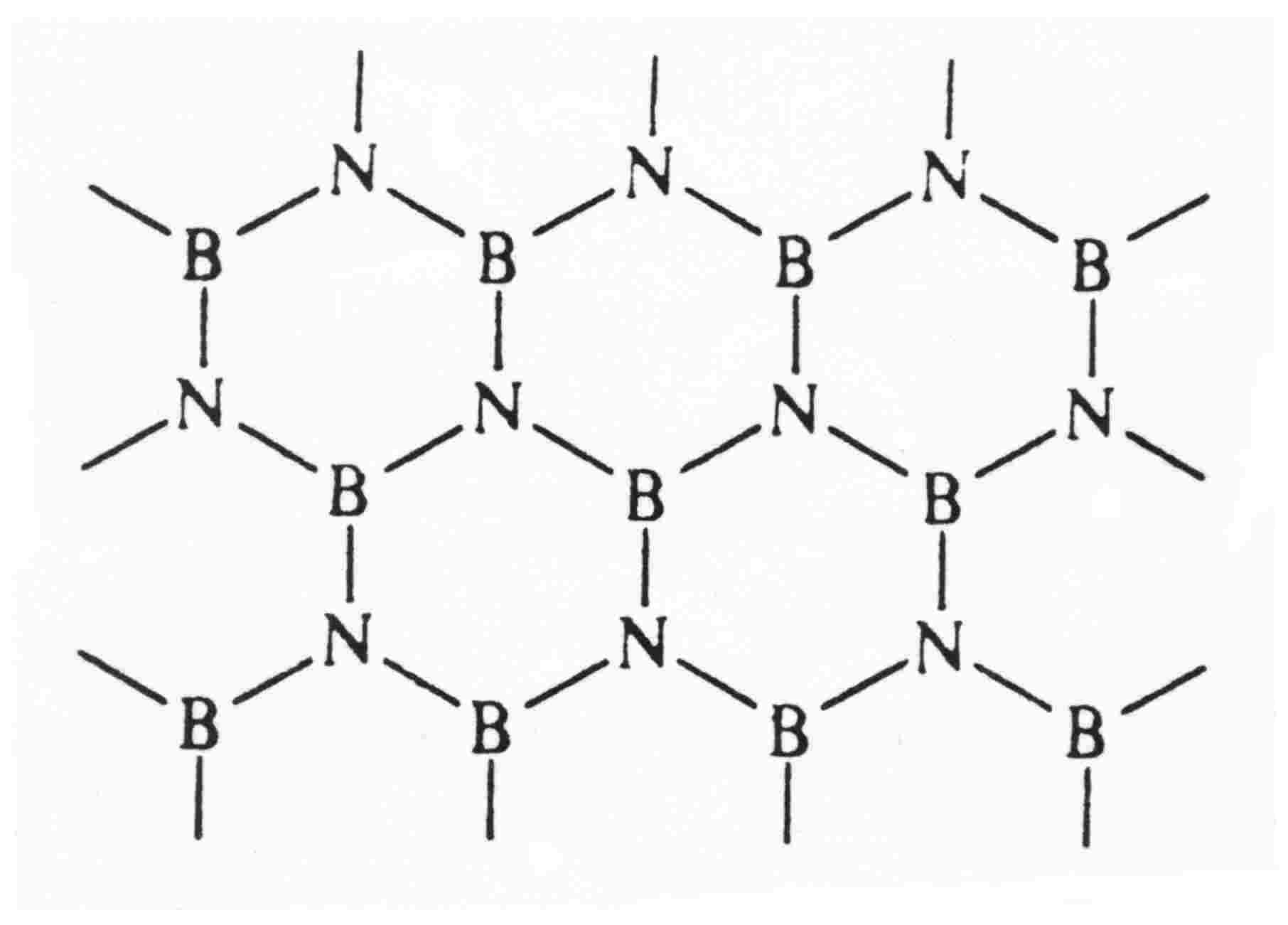
BN - azotek boru (struktura grafitu) "biały grafit"
Warstwa BN
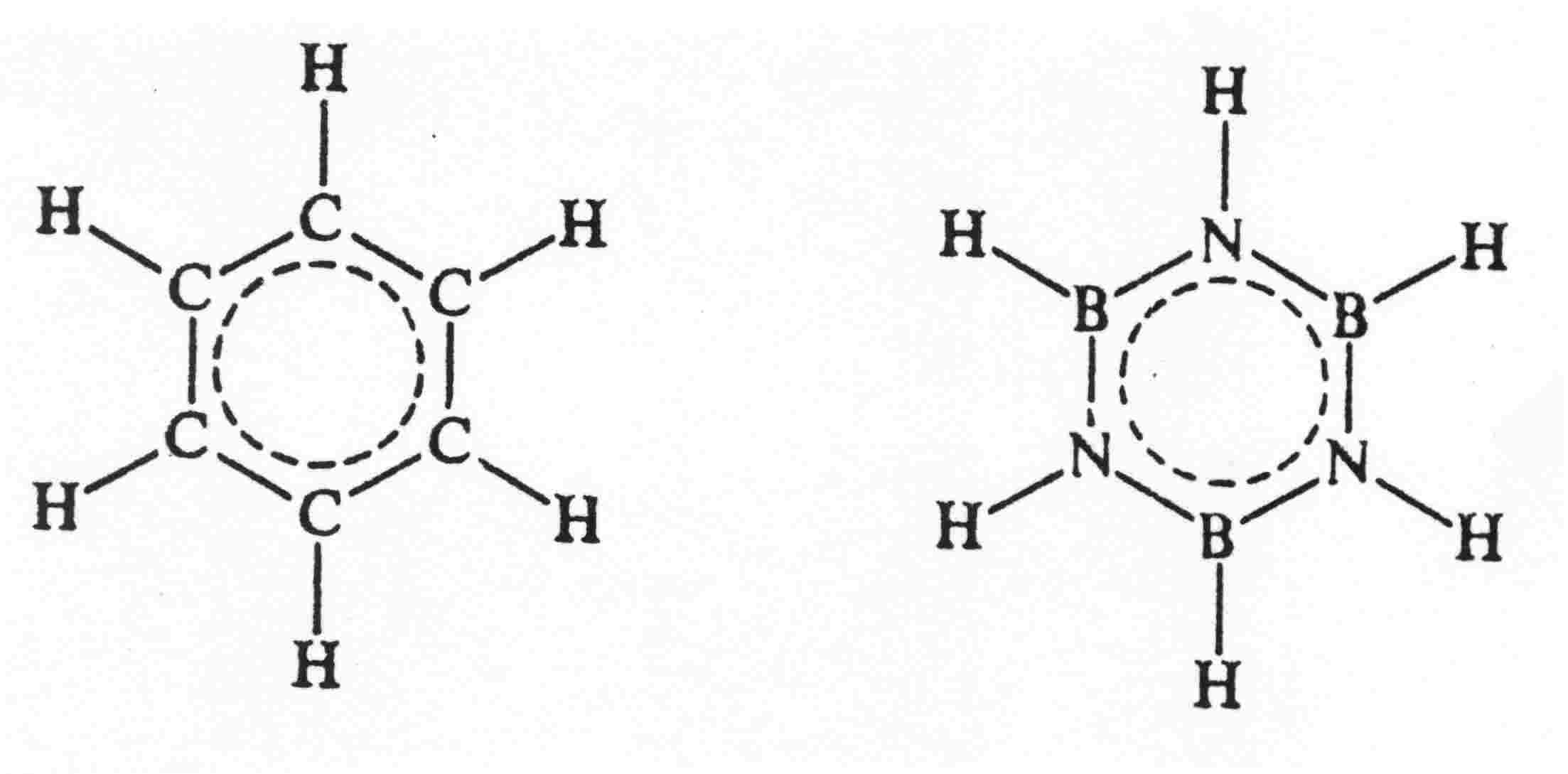
B3N3H6 - borazyna - podobieństwo do benzenu:
BP - fosforek boru - sieć diamentu
Borki : MenBm
1) Odporne na czynniki chemiczne
2) Wysokie temperatury topnienia; > 2300 K
Zastosowania:
1) dysze rakiet
2) elektrody pracujące w wysokich temperaturach
6. Glin
7,4 % mas. w skorupie ziemskiej (3-ci pierwiastek)
Minerały :
korund - odmiana Al2O3
ortoklas - KAl[Si3O8]
bemit - AlO ⋅ OH → gł. składnik boksytów
kriolit - Na3AlF6
Pozostałe metale tj. gal, ind i tal występują w małych ilościach, tj. 10-3 - 10-5 % → nie tworzą własnych minerałów.
Otrzymywanie aluminium → elektroliza Al2O3 w stopionym Na3AlF6 w 1220 K
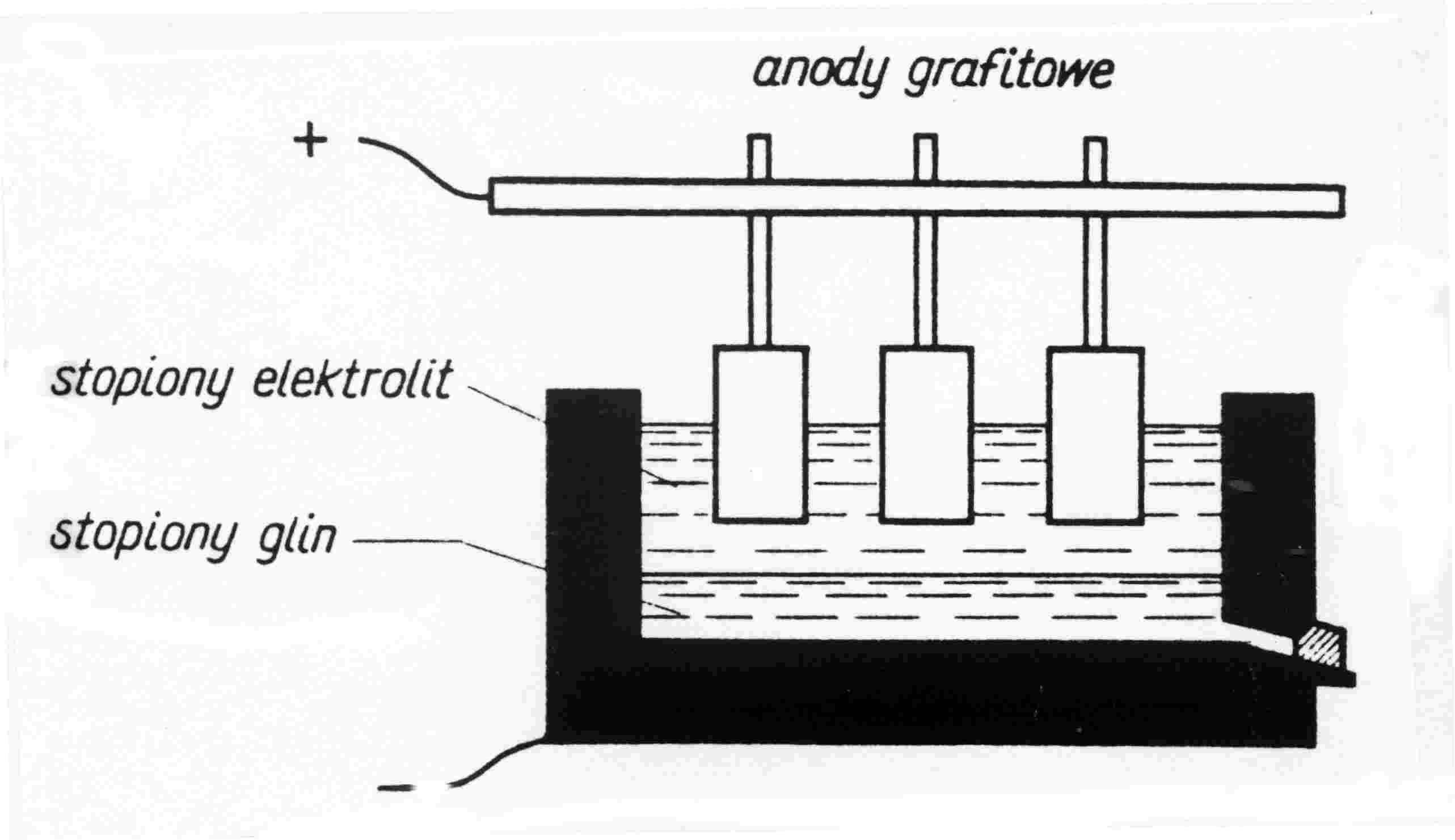
Katoda : Al3+ + 3e = Al
Anoda : 2OH- = H2O + 1/2 O2 + 2e
Wysoki koszt energii.
W USA 5% energii zużywana jest na produkcję aluminium
→ odzysk zużytego Al.
Glin roztwarza się w kwasach i zasadach :
2Al + 6H+ = 2Al3+ + 3H2
Al + 2OH- + 6H2O = 2[Al(OH)4]- + 3H2
Gal też jest amfoteryczny
Ind, tal → roztwarzają się tylko w kwasach
In + 3H+ = In3+ + 3/2 H2
Tl + H+ = Tl+ + 1/2 H2
Glin →jako tworzywo konstrukcyjne → pasywacja (Al2O3)
7. Tlenki i wodorotlenki glinowców
hydralgilit Ponadto → bezpostaciowy
Al(OH)3 wodorotlenek glinu
bajeryt
diaspor
AlO(OH)
bemit
![]()
wzrost st. OH-
wzrost st. H+
prażenie
Wodorotlenek glinu α-Al2O3 (korund)
1500 K
Ga2O3 → Ga(OH)3
In2O3 → In(OH)3
Tl2O3 → Tl(OH)3 → nie jest znany
Tl2O → TlOH → mocna zasada
Ogrzewanie Al2O3 z MeIIO (np. MgO) w wysokich temperaturach:
Al2O3 + MgO = MgAl2O4
Jest to tzw. spinel.
Posiada strukturę: aniony tlenkowe - w węzłach sieci regularnej płasko centrowanej.
Położenie kationów w sieci spinelu:
Al3+ w lukach oktaedrycznych
Mg2+ w lukach tetraedrycznych
8. Inne sole glinowców
Siarczan glinu: Al2(SO4)3 ⋅ 18H2O
Ałuny: M2ISO4 ⋅ M2III(SO4)3 ⋅ 24H2O
MI: Na, K, NH4
MIII : Al, Cr, Fe,
Ałun glinowo-potasowy: K2SO4 ⋅ Al2(SO4)3 ⋅ 24H2O
Chlorek glinu: Al2Cl6 → budowa jak B2H6
Związki glinu na +1 stopniu utlenienia: Al2S, Al2Se, AlCl
Związki galu i indu na +2 stopniu utlenienia: GaCl2, InCl2
Związki talu na +1 stopniu utlenienia:
Siarczan talu(I) Tl2SO4
Chlorek talu(I) TlCl
Węglan talu(I) Tl2CO3
Jony Tl+ - właściwościami zbliżone do kationów litowców
9. Wyroby ceramiczne
Otrzymuje się je przez wypalanie GLIN
GLINY to mieszanina minerałów ilastych takich jak: kaolinit, haloizyt, illit
Kaolinit: Al2(OH)4(Si2O5)
Ogólnie gliny zawierają:
xSiO2, yAl2O3, z H2O
Proces otrzymywania wyrobów ceramicznych:
1o Zarabianie z wodą gliny
2o Formowanie
3o Wypalanie
Wyroby ceramiczne: cegły, pustaki, kamionka, porcelana.
Pustaki z betonu komórkowego (np. YTONG) zawierają niewielką ilość proszku aluminiowego (przed wypalaniem):
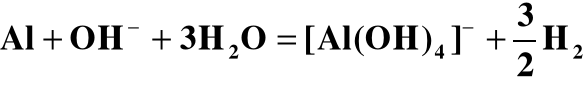
Koniec rozdziału VII-mego
Władysław Walkowiak Wykład - Chemia Nieorganiczna
13/17
ChN_Wykład 7_VII. Borowce.
} amfoteryczność
} amfoteryczne
![]()
![]()
Wyszukiwarka
Podobne podstrony:
Wykład 8 Berylowce CHC13005w, VII BERYLOWCE
Zarzdzanie wiedza organizacji Wyklad 2, WAT, semestr VI, Psychologia
wykłady mikro sem VI
Ściąga PLP wykład, ZIP sem VI, PLP
zarzadzanie wiedza organizacji - wyklad 1, WAT, semestr VI, Psychologia
Zarzadzanie wiedza w organizacji Wyklad 7, WAT, semestr VI, Psychologia
Wyklady z Matematyki czesc VI, MATMA, matematyka, Matma, Matma, Stare, II semestr, Wykłady mini
Wyklady z Matematyki czesc VI, MATMA, matematyka, Matma, Matma, Stare, II semestr, Wykłady mini
Wykład 3 Fluorowce CHC13005w, II. FLUOROWCE
Wyklad-NO, MEDYCYNA VI rok, Choroby wewnętrzne, KARDIOLOGIA
Zarzdzanie wiedza organizacji Wyklad 6, WAT, semestr VI, Psychologia
WYKŁADY-fabian-sem-VI, mm005
Zarzdzanie wiedza organizacji Wyklad 3, WAT, semestr VI, Psychologia
Wykład 6 Weglowce CHC13005w, chemia, chemia ogólna ; nieorganiczna ; metale
Wykład Wprowadzenie CHC13005 w, CHEMIA NIEORGANICZNA II CHC 1040 s
Wykład 1 Wodor CHC13005w, Wodór
Psychologia - całość bez 1 wykładu, WAT, semestr VI, Psychologia
Wykład 5 Azotowce CHC13005w, IV. AZOTOWCE - ChN II
Zagadnienia egzaminacyjne wg wykładówz KB sem VI inż r ak 14 15
więcej podobnych podstron