
Zadania z I Powiatowego Konkursu Chemicznego
Część I – Wybierz jedną poprawną odpowiedź:
1. Jon glinu Al
3+
składa się z 14 neutronów oraz:
a) 16 protonów i 13 elektronów
b) 16 protonów i 10 elektronów
c) 10 protonów i 13 elektronów
d) 13 protonów i 10 elektronów
2. W którym zestawie wszystkie metale będą reagowały z wodą w temperaturze pokojowej:
a) Ca, Na, K
b) Ca, Mg, Al
c) K, Mg, Fe
d) Na, Fe, Al
3. Która para tlenków w reakcji z wodą tworzy substancje zmieniające barwę lakmusu z niebieskiej na
czerwoną i reagujące z zasadami:
a) MgO i CaO
b) Na
2
O i K
2
O
c) K
2
O i CO
2
d) P
2
O
5
i SO
2
4. Uczniowie otrzymali CaSO
4
działając kwasem siarkowym (VI) na:
I. CaO,
II. Ca(OH)
2
,
III. Ca,
IV. CaCl
2
Skróconym równaniem jonowym: Ca
2+
+ SO
4
2-
CaSO
4
można przedstawić reakcje zachodzące w
doświadczeniach:
a) I, II i III
b) II i IV
c) I, II i IV
d) I, II, III i IV
5. W jakim stosunku wagowym należy zmieszać 80% roztwór H
2
SO
4
(1) z 20% roztworem H
2
SO
4
(2), aby
otrzymać 30% roztwór tego kwasu.
a) 2(1) : 3(2)
b) 1(1) : 5(2)
c) 3(1) : 2(2)
d) 5(1) : 1(2)
6. Zmieszano 100 g roztworu HCl o stężeniu 20% i 50 g roztworu NaOH o stężeniu 10%. Stężenie
procentowe otrzymanego roztworu NaCl wynosi:
a) 21,4%
b) 4,8%
c) 16,7%
d) 30%
7. Węglowodór zawierający 80% węgla w cząsteczce, której masa wynosi 30 u, to:
a) metan
b) etan
c) eten

d) etyn
8. Ile procent czystego CaCO
3
zawierał wapień, jeśli podczas prażenia 120 g wapienia otrzymano 48 g CO
2
:
a) 90,9 %
b) 100 %
c) 40 %
d) 9,09 %
9. Wzór sumaryczny związku, który zawiera 26 % azotu i tlen to:
a) N
2
O
5
b) NO
2
c) N
2
O
3
d) N
2
O
10. W wyniku reakcji alkoholu z kwasem organicznym otrzymano ester o wzorze sumarycznym C
5
H
10
O
2
.
Estru tego nie można otrzymać w reakcji:
a) kwasu etanowego z etanolem
b) kwasu metanowego z butanolem
c) kwasu propanowego z etanolem
d) kwasu butanowego z metanolem
Część II – rozwiąż zadania
Zadanie 1.
3,06g mieszaniny octanu sodu i siarczanu (VI) sodu rozpuszczono w wodzie destylowanej. Do otrzymanego
roztworu dodano wodny roztwór chlorku baru do całkowitego strącenia osadu. Następnie wytrącony osad
odsączono, wysuszono i zważono. Jego masa wynosiła 2,33g.
a) Oblicz, jaki był skład procentowy mieszaniny wyjściowej
b) Oblicz, jaki procent mieszaniny wyjściowej stanowiła masa sodu
c) Napisz w formie cząsteczkowej i jonowej równania zachodzących reakcji
d) Jony baru są silną trucizną, jednak siarczan (VI) baru stosowany jest jako kontrast w badaniach przewodu
pokarmowego człowieka, Wyjaśnij, dlaczego substancję tę można bezpiecznie stosować w badaniach.
Zadanie 2.
1. Uczniowie otrzymali do odróżnienia po dwie substancje w następujących zestawach:
a) Etan od etenu
b) Etanol od kwasu etanowego
c) Heksan od propionianu propylu
Zaproponuj po jednym równaniu reakcji pozwalającej odróżnić od siebie związki w podanych parach
2. Kwas organiczny zmieszano z wodą w takim stosunku, że na jedną cząsteczkę kwasu przypada 10
cząsteczek wody. Na podstawie obliczeń wyprowadź wzór tego kwasu, wiedząc, że powstały roztwór był
25-procentowy. Napisz cząsteczkowo równania reakcji tego kwasu z:
a) Ca
b) KOH
c) CH
3
OH

Zadania z II Powiatowego Konkursu Chemicznego
Część I – Wybierz jedną poprawną odpowiedź
1. 100 g stopu glinu z cynkiem utleniono i otrzymano 51 g Al
2
O
3
i 91 g ZnO. W skład badanego stopu
wchodzi:
a) 73% Zn i 27% Al
b) 50% Zn i 50% Al
c) 27% Zn i 73% Al
d) 46% Zn i 54% Al
2. W wyniku całkowitego spalenia próbki pewnego węglowodoru otrzymano 22 g CO
2
i 9 g H
2
O. Masa
spalonej próbki była równa:
a) 31 g
b) 19 g
c) 15 g
d) 7 g
3. Stężenie i nasycenie roztworu pozostają w stosunku do siebie w następującym związku:
a) roztwór nasycony jest zawsze bardzo stężony
b) roztwór nasycony nie może być bardzo rozcieńczony
c) roztwór nienasycony jest zawsze bardzo rozcieńczony
d) roztwór nienasycony może być bardzo stężony
4. Przygotowano roztwory wodne trzech substancji:
1. 7,5 g KNO
3
i 30 g wody
2. 125 g 20% CaCl
2
i 125 g wody
3. 155 cm
3
30% KOH o gęstości 1,29 g/cm
3
i 400 g wody
Wskaż prawidłowo obliczone stężenia procentowe roztworów 1, 2, 3
a) 20% 10% 13%
b) 20% 10% 10%
c) 25% 20% 13%
d) 20% 20% 10%
5. Spośród podanych niżej zdań wybierz zdanie słuszne: jony Na
+
, F
-
, Mg
2+
zawierają jednakową liczbę
elektronów jony Ca
2+
, Cl
-
, S
2-
mają taką samą liczbę powłok elektronowych jon glinu ma 10 elektronów
Prawdziwe są zdania:
a) wszystkie
b) tylko I i II
c) tylko I i III
d) tylko II i III
6. Suma liczby protonów, neutronów i elektronów w atomie pewnego pierwiastka X jest równa 40.
Liczba neutronów w jądrze atomu jest o 1 większa od liczby protonów. Ładunek jądra tego pierwiastka wynosi:
a) 16
b) 15
c) 14
d) 13
7. Do wodnego roztworu substancji I dodano roztwór substancji II. Wytrącił się niebieski osad
substancji III, który nie rozpuszcza się w wodzie, a rozpuszcza się w kwasach i zasadach. Substancje I, II, III to
związki o wzorach:
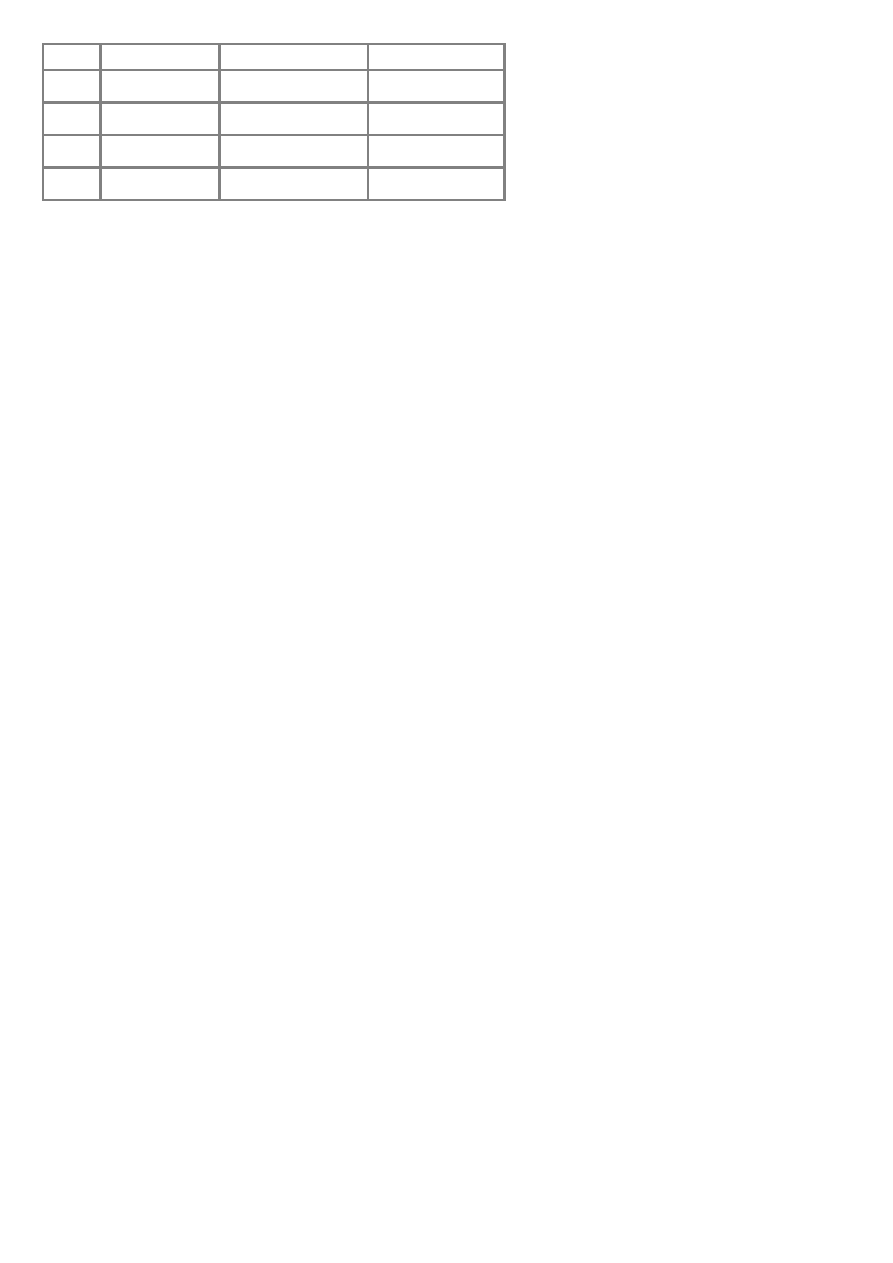
I
II
III
a
CuSO
4
NaOH
Cu(OH)
2
b
Al
2
(SO
4
)
3
NH
3
H
2
O
Al.(OH)
3
c
Cr
2
(SO
4
)
3
NH
3
H
2
O
Cr(OH)
3
d
Ca(NO
3
)
2
NaOH
Ca(OH)
2
8. Węglowodorem, który może mieć tylko dwie różne dibromopochodne może być:
a) propan
b) n – butan
c) 2 – metylobutan
d) 2,2 – dimetylopropan
9. Spośród trzech następujących związków:
1. octan etylu,
2. mrówczan propylu,
3. kwas butanowy
Izomerami propionianu metylu są:
a) 1, 2 i 3
b) tylko 1 i 2
c) tylko 2 i 3
d) tylko 1 i 3
10. Hemoglobina, białko, za pomocą którego tlen jest przenoszony z płuc do tkanek ciała, zawiera 0,355%
żelaza. Jeżeli jedna cząsteczka hemoglobiny zawiera 4 atomy żelaza, to jej masa cząsteczkowa wynosi:
a) 126000 u
b) 63000 u
c) 31500 u
d) 15700 u
Część II – rozwiąż zadania
Zadanie 1.
8,1 g glinu rozpuszczono w 500 cm
3
10 % kwasu siarkowego (VI) o gęstości 1,06 g/cm
3
. Oblicz w procentach
wagowych stężenie siarczanu (VI) glinu w roztworze po reakcji.
Zadanie 2.
Alkohole reagują z metalicznym sodem. Produktami reakcji są odpowiednie alkoholany i wodór,
1. Ustal wzór sumaryczny alkoholu, jeżeli w reakcji 2 g tego alkoholu z sodem otrzymano 0,027 g
wodoru.
2. Napisz wzory półstrukturalne i podaj nazwy wszystkich izomerów tego alkoholu.
3. Napisz równanie reakcji jednego wybranego izomeru z kwasem mrówkowym i podaj nazwę
produktu.

Zadania z III Powiatowego Konkursu Chemicznego
Część I – Wybierz jedną poprawną odpowiedź
1. Suma protonów, neutronów i elektronów w atomie pewnego pierwiastka wynosi 80. Ładunek jądra
atomowego wynosi + 25. Wskaż poprawnie podaną liczbę cząstek składowych w tym atomie.
protony
neutrony
elektrony
a 25
55
25
b 30
25
25
c 25
30
25
d 20
30
30
2. Zredukowano wodorem 32 g pewnego tlenku żelaza i otrzymano żelazo oraz 10,8 g wody. Wzór
sumaryczny tego tlenku to:
a) FeO
b) Fe
3
O
4
c) Fe
2
O
3
d) FeO Fe
2
O
3
3. W 100 g wody o temperaturze 323 K rozpuszczono 270 g sacharozy. Ile gramów tej substancji
wykrystalizuje po ochłodzeniu roztworu do temperatury 303 K. Rozpuszczalność sacharozy w temperaturze
323 K wynosi 278g/na 100g H
2
O, a w temperaturze 303 K 225g/na 100g H
2
O.
a) 270g
b) 225g
c) 124g
d) 45g
4. 20g pewnej substancji X rozłożono całkowicie zgodnie z równaniem: X
A + B. Dwie nowe
substancje powstały w stosunku masowym A : B = 14 : 11. Masa substancji A otrzymanej w tej reakcji wynosi:
a) 11,2g
b) 8,8g
c) 14,3g
d) 16,94g
5. Roztworem, w którym znajduje się dwa razy więcej anionów niż kationów jest roztwór soli:
a) Na
2
S
b) Na
2
SO
4
c) MgSO
4
d) Mg(NO
3
)
2
6. Zmieszano substancje w sposób przedstawiony na rysunku:
1. Cl
2(aq)
+ KBr
2. Br
2(aq)
+ KCl
3. Br
2(aq)
+ KI
Wskaż, w których probówkach zajdzie reakcja
a) tylko w 2
b) tylko w 1 i 3
c) tylko w 2 i 3
d) we wszystkich
7. W którym punkcie znajdują się pierwiastki toksyczne dla zwierząt i człowieka:

a) Fe, Mg, Cu, Ca, P(V)
b) Mn(II), K, Co, S, Se
c) Cd, Hg, Pb, As, Cr(VI)
d) K, Na, Si, Ta, Ag
8. Badany ester jest cieczą bezbarwną, lotną, słabo rozpuszczalną w wodzie o zapachu ananasów, a
podczas jego hydrolizy pojawia się zapach zjełczałego tłuszczu. Wskaż, który z podanych estrów posiada te
właściwości:
a) mrówczan etylu
b) octan butylu
c) maślan etylu
d) stearynian etylu
9. Wybierz poprawne informacje dotyczące kwaśnych deszczów:
a) niszczą zaprawę murarską starych domów
b) powodują wzrost pH wód gruntowych
c) zakwaszają glebę
d) przyczyną powstawania kwaśnych deszczów jest rozwój motoryzacji
e) są główną przyczyną eutrofizacji jezior
Poprawne informacje zawierają punkty……………………………………
10. Octan propylu i propanian metylu
a) są homologami
b) są izomerami
c) są różnymi nazwami tego samego związku
d) należą do dwóch odmiennych typów związków
Część II – rozwiąż zadania
Zadanie 1.
Ile gramów tlenku fosforu (V) należy rozpuścić w 100g wody, aby otrzymać roztwór H
3
PO
4
o stężeniu 20%.
Zadanie 2.
Podaj wzory substancji, które rozpuszczone w wodzie tworzą:
1. wodę bromową,
2. wodę amoniakalną,
3. wodę utlenioną,
4. wodę wapienną,
5. wodę sodową
Zadanie 3.
Aminokwasy jako związki dwufunkcyjne wykazują właściwości wynikające z obecności kwasowej grupy –
COOH jak i zasadowej grupy –NH
2
. Dlatego wchodzą w reakcje z kwasami i zasadami. Do związków
dwufunkcyjnych należą także hydroksykwasy, które zawierają grupę kwasową –COOH i grupę hydroksylową –
OH. Najprostszym hydroksykwasem jest kwas mlekowy CH
3
-CH(OH)-COOH, wobec którego postawiono
następujące hipotezy:
a) reaguje z metalami, tlenkami metali i wodorotlenkami;
b) reaguje z alkoholami;
c) reaguje z kwasami.
Rozwiąż następujące zadania:
1. Napisz równania reakcji kwasu mlekowego z magnezem, tlenkiem
miedzi (II), zasadą sodową, metanolem i kwasem octowym. Podaj nazwy otrzymanych produktów.
2. Oblicz, ile gramów kwasu mlekowego i ile gramów metanolu potrzeba na otrzymanie 208g produktu
organicznego tej reakcji, jeżeli straty towarzyszące jej przebiegowi wynoszą 20%.

Zadania z IV Powiatowego Konkursu Chemicznego
Część I – Wybierz jedną poprawną odpowiedź
1. Wskaż, w którym z podanych wariantów wydzieli się gaz o największej masie cząsteczkowej:
a) Na
2
CO
3
+ HCl
b) Cu + HNO
3(stęż.)
c) KMnO
4
+ HCl
d) Cu + H
2
SO
4(stęż.)
2. Wzory niektórych soli można formalnie przedstawiać w postaci tlenkowej, np. CaSiO
3
jako CaO
SiO
2
. Jaki jest wzór „tlenkowy” soli o zawartości 34,56% CaO, 54,32% CO
2
i 11,12% H
2
O
CaO
CO
2
H
2
O
a
2
2
3
b
1
2
1
c
1
1
2
d
1
1
1
3. Sporządzono 25% roztwór KNO
3
w temperaturze 303 K, a następnie obniżono temperaturę do 293 K.
Otrzymany roztwór w podanych warunkach temperatury jest:
303 K
293 K
a
nienasycony
nienasycony
b
nienasycony
nasycony
c
nasycony
nasycony
d
nasycony
nienasycony
4. Na zobojętnienie roztworu zawierającego 0,6 g pewnego organicznego kwasu jednokarboksylowego
zużyto 50 cm
3
roztworu NaOH o stężeniu 0,2 mol/dm
3
. Kwasem tym jest:
a) kwas mrówkowy
b) kwas masłowy
c) kwas octowy
d) kwas stearynowy
5. W wyniku przemian promieniotwórczych jąder:
•
Ra przekształciło się w
At
•
Pb przekształciło się w
Hg
•
U przekształciło się w
Th
Sumaryczna liczba wyemitowanych cząstek i
-
w czasie trwania przemian we wszystkich procesach wynosi:
a) 6 i 6
-
b) 4 i 5
-
c) 5 i 5
-
d) 6 i 5
-
6. W czterech zlewkach znajdują się jednakowe objętości następujących roztworów otrzymanych przez
rozpuszczenie w nich następujących ilości soli:
1. 200 g Cr
2
(SO
4
)
3
2. 200 g CrCl
3
3. 600 g K
2
Cr
2
O
7
4. 200 g K
2
CrO
4

Największe stężenie jonów Cr
3+
będzie w zlewce:
a) 1
b) 2
c) 3
d) 4
7. Przygotowano po 200 cm
3
0,1-molowych wodnych roztworów dziesięciu substancji i zmieszano je parami:
1. kwas siarkowy (VI) i wodorotlenek sodu
2. kwas azotowy (V) i wodorotlenek baru
3. kwas solny i amoniak
4. kwas etanowy i wodorotlenek potasu
5. kwas solny i azotan(V) srebra
Wartość pH < 7 mają roztwory:
a) 1, 3, 5
b) 2, 4, 5
c) 2, 3, 4
d) 1, 2, 5
8. Stosunek mas cząsteczkowych dwóch kolejnych homologów w szeregu homologicznym alkanów jest
równy 1,47. Alkanami tymi są:
a) C
2
H
6
i CH
4
b) C
3
H
8
i C
2
H
6
c) C
4
H
10
i C
3
H
8
d) C
5
H
12
i C
4
H
10
9. Ile gramów alkoholu można otrzymać z 1 mola jodku etylu w reakcji z wodorotlenkiem sodu jeżeli
wydajność reakcji wynosiła 80%?
a) 142g
b) 36,8g
c) 57,5g
d) 46g
10. W wyniku hydrolizy estru powstaje kwas o masie molowej 60 g/mol i alkohol. Po odwodnieniu tego
alkoholu otrzymuje się but-1-en, po utlenieniu zaś produkt, który reaguje z odczynnikiem Tollensa. Estrem tym
jest:
a) metanian butylu
b) etanian etylu
c) etanian propylu
d) etanian butylu
Część II – rozwiąż zadania
Zadanie 1.
Próbkę sody kalcynowanej o masie 10 g rozpuszczono w wodzie i dodano 70 cm
3
kwasu solnego o stężeniu 1
mol/dm
3
. Roztwór gotowano, aż przestał wydzielać się dwutlenek węgla. Następnie zobojętniono pozostały
kwas 10 cm
3
roztworu wodorotlenku sodu o stężeniu 1 mol/dm
3
. Ile procent czystego węglanu sodu zawierała
badana próbka sody kalcynowanej.
Zadanie 2.
Spalono 2,12 g mieszaniny etanolu i propanolu. Otrzymane produkty przepuszczono przez bezwodny CaCl
2
, a
następnie przez roztwór NaOH. Masa naczynia z NaOH wzrosła o 4,4 g.
a) zapisz równania reakcji spalania obu alkoholi
b) oblicz, ile gramów etanolu i propanolu zawierała badana mieszanina
Wyszukiwarka
Podobne podstrony:
zadania konkurs Swinarskiego XLII konkurs chemiczny zadania
Bukiety matematyczne dla gimnazjum zadania przygotowujące do konkursów
Zakres działania i zadania powiatu, Szkoła, Gospodarka przestrzenna
Zadania na rozgrzewke, Technologia chemiczna PWR, SEMESTR IV, Obliczenia w chemii technicznej
zadania powiatu
Międzyszkolny konkurs chemiczny
Zadania powiatowego centrum zarządzania kryzysowego, Zarządzanie kryzysowe
Powiat Łowicki, Notatki Rolnictwo, 4 rok, IV rok, Projekty -SZUR
Zadania domowe statystyka 6, Technologia Chemiczna PW, III SEMESTR, Statystyka
Zadania powiatu, Studia, Samorząd terytorialny
Konkurs chemiczny id 245057 Nieznany
Zakres działania i zadania powiatu
Zadania Powiatowego?ntrum Pomocy Rodzinie to
Zakres działania i zadania powiatu
Bukiety matematyczne dla gimnazjum zadania przygotowujące do konkursów
konkurs chemiczny
ZADANIA POWIATU Z ZAKRESU AKTYWIZACJI RYNKU PRACY I PRZECIWDZIAŁANIU BEZROBOCIU
więcej podobnych podstron