
82/8-9(2003)
521
Politechnika Poznańska
J
JJ
J
J
ULIUSZ
ULIUSZ
ULIUSZ
ULIUSZ
ULIUSZ
P
P
P
P
P
ERNAK
ERNAK
ERNAK
ERNAK
ERNAK
*
*
*
*
*
Ciecze jonowe. Związki na miarę XXI wieku
Ciecze jonowe. Związki na miarę XXI wieku
Ciecze jonowe. Związki na miarę XXI wieku
Ciecze jonowe. Związki na miarę XXI wieku
Ciecze jonowe. Związki na miarę XXI wieku
Ionic liquids. Compounds for the 21st century
* Adres do korespondencji:
Prof. Juliusz PERNAK w roku 1971 ukończył Wydział
Technologii i Inżynierii Chemicznej Politechniki Śląskiej
w Gliwicach. Pracuje na Wydziale Technologii Chemicz-
nej Politechniki Poznańskiej. Specjalność - technolo-
gia chemiczna.
Wydział Technologii Chemicznej, Politechnika Poznańska,
pl. Skłodowskiej-Curie 2, 60-965 Poznań, tel. 0 prefix 61 665-36-82,
fax: 0 prefix 61 665-36-49, e-mail: juliusz.pernak@put.poznan.pl
Przedstawiono historyczny przegląd prac z za-
kresu syntezy, właściwości i zastosowań cieczy
jonowych, zwłaszcza z podstawnikami alkoksy-
metylowymi (rozpuszczalniki, katalizatory, ba-
terie słoneczne, przerób odpadów radioaktyw-
nych). Nakreślone zostały również problemy
pozostające jeszcze do rozwiązania (oczyszcza-
nie, odwadnianie, wymiana ciepła i masy).
A review with 34 refs. covering history, synthesis, proper-
ties, and applications (neoteric solvents, extraction, solar
batteries, radioactive waste treatment, etc.), and ionic liqu-
ids with an alkoxymethyl substituent. Of the many known,
only very few liquids have been synthesized. Purification to
yield specpure salts, methods to follow water content in
ionic liquids, heat and mass transfer in ionic liquids etc.
still remain to be studied and/or developed.
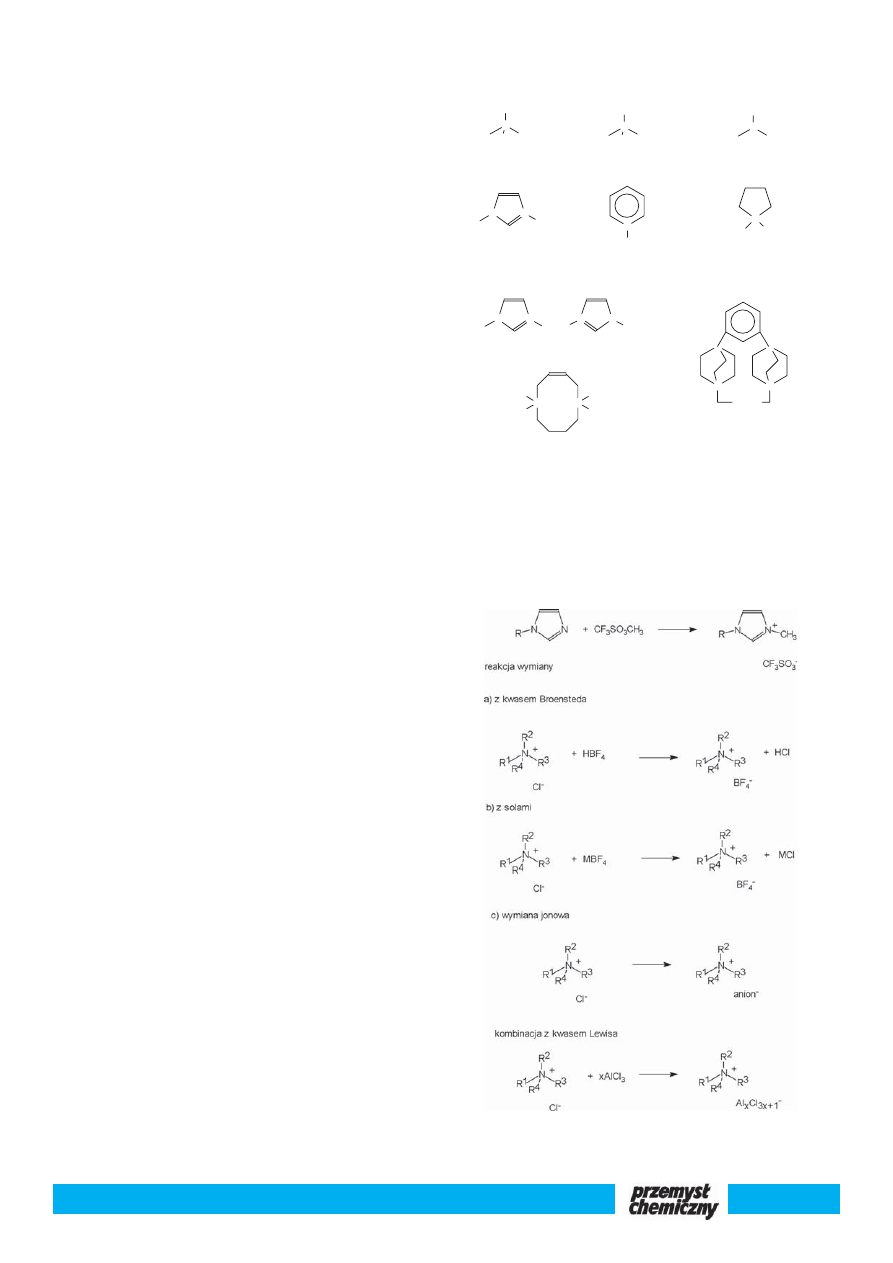
Ciecz jonowa to związek chemiczny składający się z kationu i anio-
nu. W temperaturze pokojowej jest cieczą przypominającą wodę. Ka-
tion ma wyłącznie charakter organiczny. Sole z kationem organicznym
mające temperaturę topnienia do 50
o
C są przez niektórych chemików
zaliczane jeszcze do cieczy jonowych. W cieczach jonowych najpopu-
larniejsze obecnie są dwa kationy 1,3-dialkiloimidazoliowy i 1-alkilo-
pirydyniowy. Anion może być zarówno nieorganiczny jak i organicz-
ny. Z nieorganicznych anionów najczęściej spotykany jest tetrafluoro-
boran BF
4
-
, heksafluorofosforan PF
6
-
, di(trifluorometylosulfonylo)amid
(CF
3
SO
2
)
2
N
-
oraz chlorogliniany Al
2
Cl
7
-
i Al
3
Cl
10
-
. Ciecze jonowe za-
wierające trzy pierwsze aniony nie są wrażliwe na kontakt z wodą i po-
wietrzem. Natomiast anion chloroglinianowy może być używany je-
dynie w warunkach bezwodnych. Na rys. 1 przedstawiono struktury
kationów i anionów w opisanych dotychczas cieczach jonowych. Pierw-
szym wymienionym anionem jest anion chlorkowy. Generalnie chlor-
ki są silnie higroskopijne i początkowo nie były brane pod uwagę jako
ciecze jonowe. Okazało się jednak, że można syntezować chlorki nie-
rozpuszczalne w wodzie przez modyfikację kationu a raczej podstaw-
nika alkilowego.
Możliwość kombinacji kation–anion jest olbrzymia i ocenia się
ją na 10
18
. To co znamy to tylko wierzchołek góry lodowej. Prze-
strzegam jednak przed zbytnim optymizmem, nie każda kombina-
cja anion–kation musi dać ciecz jonową. W obszarze jednego szere-
gu homologicznego najczęściej pierwsza i ostatnie sole są ciałami
stałymi o temperaturach topnienia powyżej 50
o
C. Tak duża liczba
możliwych połączeń musi zaowocować związkami, które znajdą
praktyczne zastosowanie w XXI w. Dlatego też chemicy na całym
świecie mają przed sobą wielkie zadanie polegające na syntezowa-
niu i ustaleniu właściwości cieczy jonowych, które ostatecznie wy-
generują ich praktyczne zastosowanie. Już dziś prawie na wszyst-
kich konferencjach naukowych prezentowane są prace o cieczach
jonowych.
Najprawdopodobniej pierwszą ciecz jonową (azotan etyloamonio-
wy [EtNH
3
]
+
[NO
3
]
-
) opisał Walden
1)
w 1914 r. Następnie ukazywały
się w literaturze pojedyncze prace opisujące syntezę i podstawowe wła-
ściwości fizykochemiczne cieczy jonowych. Chemicy, którzy zajmo-
wali się czwartorzędowymi solami amoniowymi byli początkowo za-
fascynowani związkami rozpuszczalnymi w wodzie. Zastosowanie prak-
tyczne tej grupy związków z podaniem autora i roku pierwszej publi-
kacji zamieszczono w tabeli. Z zestawienia tego wynika, że są to związ-
ki wielofunkcyjne.
Cieczami jonowymi zainteresowano się intensywnie dopiero
w 1998 r. Przyszedł wtedy czas na czwartorzędowe sole amoniowe nie-
rozpuszczalne w wodzie. Pierwsze dwie monografie o cieczach jono-
wych ukazały się w 2002 r.
2, 3)
. W Chemical Abstracts każdego tygo-
dnia pojawia się kilka rekordów dotyczących cieczy jonowych. Ustalo-
nym obecnie słowem kluczowym jest ionic liquids. Ciecze jonowe od
prawie dwóch lat są dostępne jako odczynniki oferowane w katalogu
firmy Fluka. Można je również zakupić w ilościach do 4 litrów przez
Internet.
Synteza
Ciecze jonowe otrzymywane są trzema znanymi metodami. Pierw-
sza metoda polega na syntezie soli z substratów posiadających tylko
wiązania kowalencyjne. W wyniku reakcji powstaje wiązanie jonowe.
Najprościej jest zastosować aminę trzeciorzędową i odpowiedni czyn-
nik czwartorzędujący. Jest to nieodwracalna reakcja substytucji nukle-
ofilowej przebiegającej wg mechanizmu S
N
2, z niewielkim egzotermicz-
Rok Zastosowanie
praktyczne
Autor
1890 Synteza
–
trzecio
rzêdowa amina
z halogenkiem alkilowym
Menschutkin
1916
W³aciwoci bakteriobójcze
Jacobs i wspó³pr.
W³aciwoci powierzchniowe
1935 Dezynfekcja
Domagk
Lata 60.
Zmiêkczacze tkanin
1965
Kataliza przeniesienia miêdzyfazowego
Jarousse i M¹kosza
Lata 70.
Antelektrostatyki
1977 Ochrona
drewna
Butcher i wspó³pr.
Lata 80.
Modyfikatory asfaltów
Lata 90.
Modyfikatory gliny
1998 Ciecze
jonowe
Seddon
Tabela. Zastosowanie praktyczne czwartorzędowych soli amoniowych
Table. Practical applications of quaternary ammonium salts
522
82/8-9(2003)
nym efektem cieplnym. Pierwszy opisał ją w 1890 r. Menschutkin i
dlatego dziś nazywana jest reakcją Menschutkina.
Druga metoda polega na wymianie anionu w soli o charakterze or-
ganicznym. Wymianę można prowadzić używając zarówno kwasu Bro-
ensteda jak i soli metalu. Opisana jest również wymiana jonowa z udzia-
łem jonitu. W przypadku użycia soli czy kwasu Broensteda istotną rolę
odgrywa rodzaj wymienianych anionów jak i rozpuszczalnika. Na przy-
kład, anion chlorkowy łatwo wymienia się na anion tetrafluoroborano-
wy w roztworze wodnym, natomiast w tym samym rozpuszczalniku
bardzo trudno jest wymienić anion bromkowy czy jodkowy. Reakcja
przebiega z wydajnością przekraczającą 90%. Jedynym problemem jest
rozpuszczalność produktu w użytym rozpuszczalniku, co wyraźnie ob-
niża wydajność. Rozpuszczalność powstałej soli można kontrolować tem-
peraturą. Obniżając temperaturę z mieszaniny reakcyjnej wypada ciecz
jonowa. Produktem ubocznym w przypadku wymiany z użyciem soli
jest sól nieorganiczna. Początkowo tak dobierano substraty, aby produk-
tem ubocznym był nierozpuszczalny chlorek srebra. Sole srebra są dro-
gie, dlatego obecnie wychodzi się z soli sodu, potasu lub litu. Produkt
uboczny rozpuszcza się w cieczy jonowej i jest trudny do usunięcia. Dla-
tego też czystość cieczy jonowej powinno się planować już przy wyborze
sposobu syntezy. Zwracam uwagę, że wymiana jonowa czy reakcja Men-
schutkina nie dają produktu ubocznego.
Trzecia metoda polega na bezpośredniej kombinacji najczęściej
dwóch ciał stałych, np. czwartorzędowego chlorku amoniowego z AlCl
3
(kwasem Lewisa). Nawet najbardziej doświadczonego syntetyka zadzi-
wia fakt, że mieszając dwa proszki uzyskuje się ciecz. Mieszanie musi
być prowadzone ostrożnie pod kontrolą, ponieważ jest to proces silnie
egzotermiczny. Na rys. 2 przedstawiono obecnie stosowane metody
syntezy cieczy jonowych.
Właściwości
Ciecze jonowe są związkami polarnymi. Rozpuszczają w sobie al-
kohole, octan etylu, chloroform, aceton, DMF, DMSO, sole nieorga-
niczne, niektóre polimery jak i niektóre minerały, natomiast nie mie-
szają się z heksanem i olejami. Najwięcej dyskusji dotyczy rozpuszczal-
ność w wodzie. Są ciecze jonowe, które nie mieszają się z wodą, ale i
takie, które słabo lub dobrze rozpuszczają się w niej. Rozpuszczalność
ta silnie zależy od rodzaju anionu i długości podstawników. Na przy-
kład, tetrafluoroboran 3-etylo-1-metyloimidazoliowy jest rozpuszczalny
w wodzie a tetrafluoroboran 1-metylo-3-oktyloimidazoliowy nie mie-
sza się z nią. Tak silnie wpływa na rozpuszczalność zamiana podstaw-
nika w pozycji trzy pierścienia imidazolu z etylowego na oktylowy.
Długość podstawnika alkilowego wpływa również silnie na gęstość
cieczy. Generalnie, znane ciecze jonowe są cięższe od wody. Najwięk-
szą gęstość w szeregu homologicznym ma pierwszy związek o najmniej-
szej masie molowej. Każda następna grupa metylenowa powoduje
zmniejszenie gęstości. Można się zbliżyć do gęstości wody a nawet otrzy-
mać ciecz lżejszą. W większości przypadków wydłużanie łańcucha po-
woduje znaczny wzrost masy molowej a w konsekwencji powstają kry-
staliczne sole. Zamiast cieczy jonowej lżejszej od wody powstaje sól
krystaliczna o temperaturze topnienia powyżej 50
o
C.
Lepkość cieczy jonowych jest ponad dwukrotnie większa od lepko-
ści tradycyjnych rozpuszczalników organicznych i jest bardziej zbliżo-
na do typowych olejów. W szeregach homologicznych (np. tetraflu-
oroboran 3-alkilo-1-metyloimidazoliowy) lepkość rośnie wraz ze wzro-
stem długości podstawnika. Cieczami newtonowskimi są homologi
zawierające do 8 atomów węgla w alkilu, natomiast sole z podstawni-
kiem alkilowym powyżej 12 atomów węgla są cieczami nienewtonow-
skimi
4)
. Ciecz jonowa charakteryzuje się wysoką temperaturą wrzenia,
która jest równocześnie temperaturą rozkładu. Przeważnie są to tem-
peratury powyżej 300
o
C (heksafluorofosforan 3-butylo-1-metyloimi-
dazoliowy 349
o
C
4)
) ale są znane przypadki, kiedy przekroczona jest
nawet temperatura 400
o
C [di(trifluorometylosulfonylo)amid 1-mety-
lo-3-propyloimidazoliowy 452
o
C
5)
]. Związki te są cieczami w dużym
przedziale temperatury przekraczającym dwukrotnie wartość dla DMF
równą 214
o
C (różnica pomiędzy temperaturą wrzenia i topnienia),
uznawanego za związek trudno lotny. Reakcje jak i badania kinetyczne
można wiec prowadzić w dużym przedziale temperatur. Charaktery-
styczną cechą cieczy jonowych, wynikającą z ich jonowej budowy, jest
ich mała prężność par w temperaturze pokojowej. Soli tych nie można
destylować a więc najbardziej popularny sposób oczyszczania czy za-
wracania rozpuszczalnika w tym przypadku nie może mieć miejsca.
Niska skłonność do parowania uznana została za zaletę cieczy jono-
wych. Uznano je za rozpuszczalniki przyjazne dla środowiska. Są one
ciekłe w temperaturze pokojowej i w szerokim zakresie temperatury,
R1
R3
N
R2
R4
R1
R3
S
R2
R1
R3
P
R2
R4
+
+
+
kation
N
N
R1
R2
N
R2
R1
N
R
+
+
+
N
N
R2
R1
N
N
(CH
2
)x
N
N
(CH
2
)x
N
N
N
N
CH
3
CH
3
H
3
C
H
3
C
+
+
+
+
+
+
+
+
anion
Cl-, NO
3
-, BF
4
-, PF
6
-, SbF
6
-, (CF
3
SO
2
)
2
N-, CF
3
SO
3
-, CF
3
CO
2
-, CH
3
CO
2
-, CF
3
SO
3
-, itp.
AlCl
4
-, Al
2
Cl
7
-, Al
3
Cl
10
-, CuCl
2
-, CuCl
3
-, AlEtCl
3
-, Al
2
Et
2
Cl
5
-, itp.
Rys. 1. Struktury kationu i anionu w opisanych cieczach jonowych
Fig. 1. The cation and anion structures in the ionic liquids described here
reakcja Menschutkina
Rys. 2. Metody syntezy cieczy jonowych
Fig. 2. Routes to synthesize ionic liquids
82/8-9(2003)
523
stabilne termicznie, chemicznie i elektrochemicznie są cięższe od wody,
mają małą prężność par w temperaturze pokojowej, rozpuszczają w so-
bie związki organiczne i nieorganiczne oraz mogą mieć charakter za-
równo cieczy newtonowskich jak i nienewtonowskich. Rozpuszczal-
ność związków organicznych i nieorganicznych w cieczach jonowych
jest intensywnie badana. Okazało się przy tym, że wiele katalizatorów,
szczególnie kompleksów metali przejściowych, rozpuszcza się w cie-
czy jonowej. Istotne okazało się również, że enzymy zachowują tu swoją
aktywność.
Zastosowania
Niewątpliwie najważniejszym obecnie zastosowaniem cieczy jono-
wych jest użycie ich jako rozpuszczalników oraz katalizatorów i roz-
puszczalników jednocześnie. Ciecze jonowe jako rozpuszczalniki dzie-
limy na ciecze złożone i proste. Ciecze złożone zawierają co najmniej
dwuskładnikowy anion. Przykładem są chlorogliniany występujące w
formie AlCl
4
-
, Al
2
Cl
7
-
i Al
3
Cl
10
-
. Łącząc stały czwartorzędowych chlo-
rek amoniowy z AlCl
3
powstaje ciecz, której anion przyjmuje formy
zapisane wcześniej. Stosunek molowy substratów x może być różny,
dlatego ciecze te charakteryzowane są indeksem N = x/(1+x). Jeżeli
wychodzi się z ilości stechiometrycznej x = 1 wtedy indeks wynosi
N = 0,5. Taką ciecz określa się jako obojętną. W przypadku użycia
AlCl
3
w ilości mniejszej od stechiometrycznej N jest mniejszy od 0,5 i
przyjmuje się, że ciecz ma charakter zasadowy, a dominującą formą
anionu jest AlCl
4
-
. Ciecz o charakterze kwaśnym ma aniony Al
2
Cl
7
-
i
Al
3
Cl
10
-
a indeks N jest powyżej 0,5. Ta ostatnia ciecz jest katalizato-
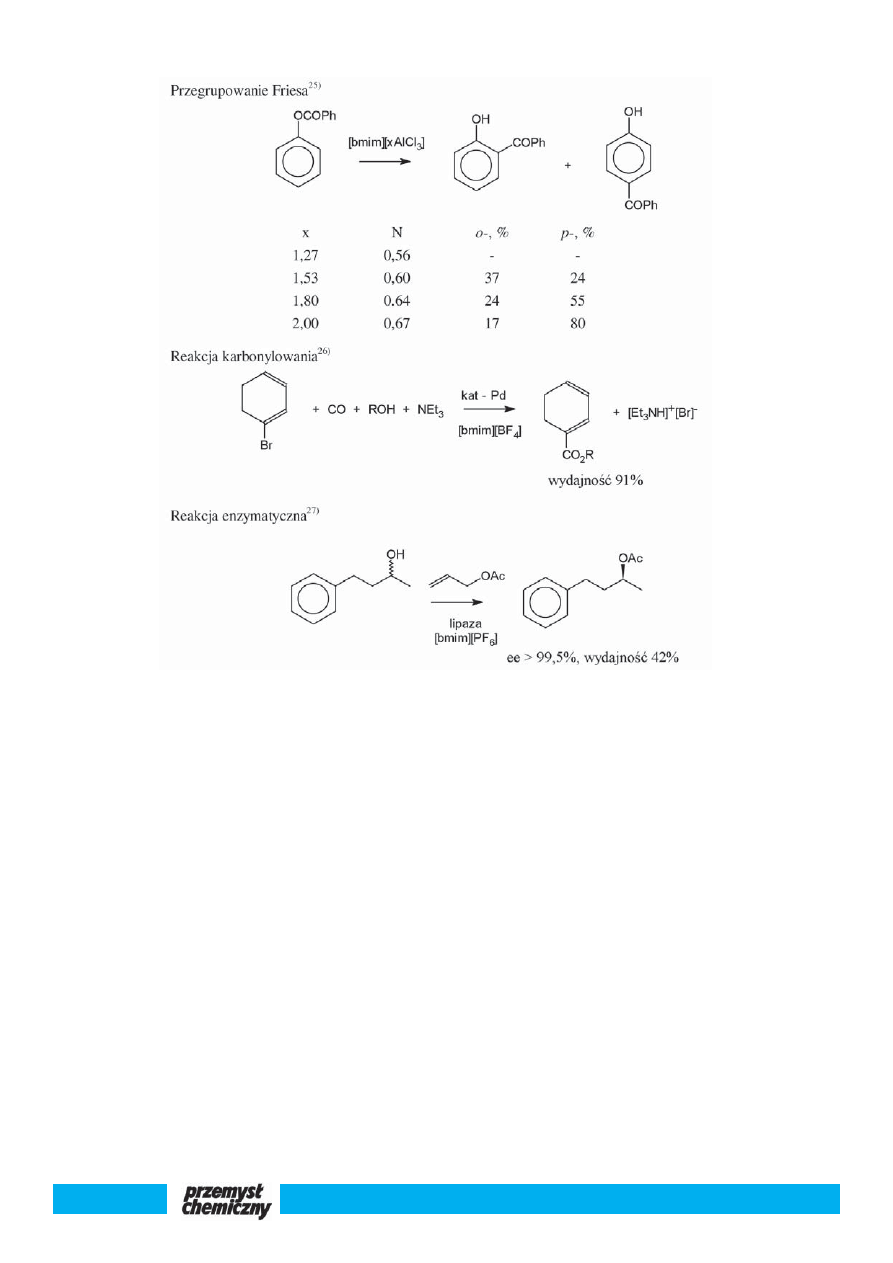
rem i zarazem rozpuszczalnikiem w reakcjach Friedla i Craftsa. Prze-
prowadzono również z powodzeniem reakcje alkilowania, izomeryza-
cji, acylowania, estryfikacji i krakingu w chloroglinianach 3-alkilo-1-
metyloimidazoliowych. Istotnym ograniczeniem w stosowaniu cieczy
podwójnych są warunki bezwodne, gdyż woda rozkłada anion z wy-
dzieleniem chlorowodoru.
Ciecze proste posiadają jeden anion, są niewrażliwe na kontakt z
wodą i powietrzem. Okazały się skutecznymi rozpuszczalnikami wielu
reakcji, m.in. Dielsa i Aldera, Hecka, Wittga, Knoevenagela oraz reak-
cji polimeryzacji. Reakcje te najczęściej przebiegają w łagodnych wa-
runkach z większą wydajnością i selektywnością. Stosowane kataliza-
tory można używać wielokrotnie. Katalizator w cieczy jonowej jest
zawracany a produkt wydzielany przez dekantację albo poprzez desty-
lację lub ekstrakcję. Ciecze proste zostały z powodzeniem zastosowane
w reakcjach enzymatycznych. Pierwszy eksperyment został przepro-
wadzony w 2000 r.
6)
. Od tego momentu ukazało się wiele prac, w tym
jedna polskich kolegów
7)
. Enzymy tworzą zawiesinę w cieczy jonowej,
w której są stabilne. W układach tych uzyskuje się większą enantiose-
lektywność. Okazało się, że układ enzym—ciecz jonowa może być za-
wracany kilka razy bez istotnego zmniejszenia aktywności lipazy.
Ciecze jonowe zaliczane są do nowych rozpuszczalników (neoteric
solvents), do których również zaliczany jest CO
2
w stanie nadkrytycz-
nym. W literaturze ukazało się kilka prac przeglądowych omawiają-
cych zastosowanie cieczy jonowych jako rozpuszczalników
8—19)
. W ję-
zyku polskim można również znaleźć prace przeglądowe o cieczach
jonowych
20—24)
. Przykładowe reakcje zachodzące w cieczy jonowej
przedstawia rys. 3.
Istotnym zastosowaniem cieczy jonowych są procesy ekstrakcji. Ze
względu na ograniczoną mieszalność z wodą można ekstrahować z wody
Rys. 3. Przykładowe reakcje w cieczy jonowej; [bmim] oznacza kation 3-butylo-1-metyloimidazoliowy
Fig. 3. Illustrative reactions occurring in an ionic liquid: [bmim] - 3-butyl-1-methylimidazolium cation

524
82/8-9(2003)
zarówno związki organiczne (np. kwasy karboksylowe, chlorowcopo-
chodne, rozpuszczalniki organiczne lub fenole) jak i jony metali (m.in.
Fe
3+
, Ni
2+
, Co
2+
, Hg
2+
) oraz ich kompleksy. W USA ciecze jonowe
były badane jako elektrolity w chemicznych źródłach prądu już w la-
tach siedemdziesiątych. Efektem tych utajnionych wówczas prac były
baterie słoneczne, zawierające ciecz jonową. Z powodzeniem zastoso-
wano je również w kąpielach do elektrolitycznego nanoszenia metali i
ich stopów.
Ciecze jonowe znajdują coraz większe zastosowanie w procesach
separacji. Są używane przy oczyszczaniu i odzysku materiałów w prze-
myśle jądrowym oraz do produkcji selektywnych ciekłych membran i
sensorów. Okazało się, że kation 1-alkilo-3-metyloimidazoliowy wy-
kazuje porównywalną z benzenem stabilność wobec promieniowania
alfa, beta i gama. Ponadto ukazały się prace nad zastosowaniem cieczy
jonowych jako środka smarującego, plastyfikatora (np. poly(akrylanu
metylu)
28)
), środka bakterio- i grzybobójczego
29)
, środka utrwalającego
i balsamującego tkanki
30)
, środka antyelektrostatycznego
31)
, składnika
atramentu
32)
oraz selektywnego absorbera związków siarki z benzyny i
olejów
33)
.
Ciecze jonowe z podstawnikiem alkoksymetylowym
Przedmiotem badań prowadzonych nad cieczami jonowymi w Po-
litechnice Poznańskiej są sole z podstawnikiem alkoksymetylowym.
Otrzymuje się je w reakcji Menschutkina, gdzie czynnikiem czwarto-
rzędujacym jest eter chlorometylowoalkilowy. Jest to szczególny przy-
padek reakcji Menschutkina, przebiegającej wg mechanizmu S
N
1. Naj-
lepiej rozpoznane zostały sole imidazoliowe
29—31, 34)
. Struktury tych soli
zostały przedstawione na rys. 4. Okazało się, że heksafluorofosforany
mają większą gęstość niż tetrafluoroborany. Są to ciecze cięższe od wody.
Dla danego szeregu homologicznego obserwuje się liniową zależność
pomiędzy gęstością d a liczbą atomów węgla x w podstawniku alkok-
sylowym i tak dla heksafluorofosforanu 3-alkoksymetylo-1-metyloimi-
dazoliowego d = - 0,0432 x + 1,5688 (g/cm
3
), a dla tetrafluorobora-
nu 3-alkoksymetylo-1-metyloimidazoliowego d = - 0,0272 x + 1,3232
(g/cm
3
).
Na rys. 4 przedstawiono sole imidazoliowe z anionem o charakte-
rze organicznym. Syntezowane mleczany są dobrze rozpuszczalne w
wodzie natomiast salicylany nie mieszają się z wodą. W tym przypad-
ku cięższe są salicylany: dla salicylanu 1-alkoksymetyloimidazoliowe-
go d = - 0,0145 x + 1,1898 (g/cm
3
), a dla mleczanu 1-alkoksymetylo-
imidazoliowego d = - 0,0106 x + 1,0969 (g/cm
3
). W pierścieniu imi-
dazoliowym proton przy drugim węglu może tworzyć z katalizatorem
wiązanie wodorowe. Wykazano, że jest możliwość syntezowania cie-
czy jonowych nie zawierających tego protonu; są to tetrafluoroborany
i heksafluorofosforany 2-alkilo-3-alkoksymetylo-1-butoksymetylo-
imidazoliowe
34)
.
Ciecze jonowe z podstawnikem alkoksymetylowym dobrze zwilża-
ją powierzchnię polietylenu. Okazały się też dobrymi antyelektrosta-
tykami
31)
. Ponadto wykazują aktywność wobec bakterii i grzybów. W
tym przypadku długość podstawnika alkoksylowego odgrywa istotną
rolę. Aktywne są sole z podstawnikem dłuższym od heksyloksymetylo-
wego. Najskuteczniejsze są sole z podstawnikem dodecyloksymetylo-
wym
29)
. Wykazano również, że można używać tych cieczy do balsamo-
wania i utrwalania tkanek miękkich. Przechowywana tkanka przez trzy
lata nie uległa zniszczeniu
30)
. Jednocześnie okazało się, że ciecze te są
mało szkodliwe dla organizmów stało-cieplnych. Wyznaczona wartość
LD
50
dla tetrafluoroboranu 3-heksyloksymetylo-1-metyloimid-azolio-
wego wynosi 1400 mg/kg wagi szczura z gatunku Wistar
31)
.
Podsumowanie
Przedstawiony przeglądowy materiał wskazuje, że jesteśmy na po-
czątku badań nad cieczami jonowymi. Zsyntezowanych i rozpozna-
nych zostało zaledwie kilka związków z olbrzymiej grupy. Ich właści-
wości są dostatecznie dobrze opisane. Jednak nie jest dokładnie rozpo-
znany sposób ich oczyszczania w celu otrzymania soli spektralnie czy-
stych. Nie umiemy monitorować obecności wody w cieczy jonowej.
Otwarty jest problem utylizacji tych ciekawych związków. Również
nie znaleziono w literaturze danych na temat wymiany masy i ciepła w
cieczy jonowej. Przedmiotem zainteresowania pozostaje sposób wy-
izolowywania produktu reakcji. W literaturze są opisane sposoby se-
paracji jednak żaden z nich nie nadaje się na metodę uniwersalną i dla
każdego procesu opracowuje się indywidualną metodę.
Zastosowanie cieczy jonowych w świetle olbrzymiej liczby możli-
wych kombinacji kation–anion ocenianych na poziomie 10
18
jest jedy-
nie limitowane przez naszą twórczą wyobraźnię.
LITERATURA
1. P. Walden, Bull. Acad. Imper. Sci. (St. Petersburg) 1914, 1880.
2. R.D. Rogers, K.R. Seddon, Ionic liquids: Industrial applications for green
chemistry, Oxford University Press, New York 2002, stron 464.
3. P. Wasserscheid, Ionic liquids in synthesis, John Wiley & Sons, New York
2002, stron 350.
4. J.G. Huddleston, A.E. Visser, W.M. Reichert, H.D. Willauer, G.A. Broker, R.D.
Rogers, Green Chemistry 2001, 3, 156.
5. H.L. Ngo, K. LeCompte, L. Hargens, A.B. McEwen, Thermochim. Acta 2000,
357
, 97.
6. S.G. Cull, J.D. Holbrey, V. Vargas-Mora, K.R. Seddon, G.J. Lye, Biotechnol.
Bioeng. 2000, 69, 227.
7. P. Kiełbasiński, M. Albrycht, J. Łuczak, M. Mikołajczyk, Tetrahedron Asym-
metry 2002, 13, 735.
8. J.D. Holbrey, K.R. Seddon, Clean Products and Processes 1999, 1, 223.
9. T. Welton, Chem. Rev. 1999, 99, 2071.
10. P. Wasserscheid, W. Keim, Angew. Chem. Int. Ed. 2000, 39, 3772.
11. M.J. Earle, K.R. Seddon, Pure Appl. Chem. 2000, 72, 1391.
12. R. Hagiwara, Y. Ito, J. Fluorine Chem. 2000, 105, 221.
13. J. Dupont, C.S. Consorti, J. Spencer, J. Brazil Chem. Soc. 2000, 11, 337.
14. R. Sheldon, Chem. Commun., 2001, 2399.
15. J.F. Brennecke, E.J. Maginn, AIChE J. 2001, 47, 2384.
16. C.M. Gordon, Appl. Catalysis, A: General 2001, 222, 101.
17. H. Olivier-Bourbigou, L.J. Magnal, J. Mol. Catal. A-Chem. 2002, 182-3,
419.
18. D. Zhao, M. Wu, Y. Kou, E. Min, Catal. Today 2002, 74, 157.
19. J. Dupont, R.F. de Souza, P.A.Z. Suarez, Chem. Rev. 2002, 102, 3667.
20. J. Pernak, Przem. Chem. 2000, 79, 159.
21. M. Kosmulski, B. Tendaj, Przem. Chem. 2001, 80, 280.
22. J. Pernak, Czwartorzędowe sole amoniowe i ich obszary zastosowania,
ITD, Poznań 2001, 188—199.
23. M. Kosmulski, K. Marczewska-Boczkowska, C. Saneluta, Przem. Chem.
2002, 81, 106.
24. M. Kosmulski, C. Saneluta, K. Marczewska-Boczkowska, Przem. Chem.
2002, 81, 234.
25. J.R. Harjani, S J. Nara, M.M. Salunkhe, Tetrahedron Lett. 2001, 42, 1979.
26. E. Mizushima, T. Hayashi, M. Tanaka, Green Chemistry 2001, 3, 76.
27. K-W. Kim, B. Song, M-Y. Choi, M-J. Kim, Org. Lett. 2001, 3, 1507.
28. M.P. Scott, C.S. Brazel, M.G. Benton, J.W. Mays, J.D. Holbrey, R.D. Ro-
gers, Chem. Commun. 2002, 1370.
29. J. Pernak, K. Sobaszkiewicz, I. Mirska, Green Chemistry 2003, 5, 52.
30. P. Majewski, A. Pernak, M. Grzymisławski, K. Iwanik, J. Pernak, Acta Histo-
chem. 2003, 105, 135.
31. J. Pernak, A. Czepukowicz, R. Poźniak, Ind. Eng. Chem. Res., 2001, 40,
2379.
32. Zgł. pat. USA, US 6 048 388 (2000); CA 132:266598.
33. S. Zhang, Z.C. Zhang, Preprints of Symposia – ACS, Division of Fuel Che-
mistry, 2002, 47, 449.
34. J. Pernak, A. Olszówka, R. Olszewski, Polish J. Chem. 2003, 77, 179.
N
N
R1
CH
2
OR2
N
N
CH
2
OR2
R1
N
N
CH
2
OR
H
C
4
H
9
OCH
2
+
+
+
BF
4
- lub PF
6
-
BF
4
- lub PF
6
-
[mleczan lub
salicylan]-
Rys. 4. Syntezowane ciecze jonowe
Fig. 4. Synthesized ionic liquids
Wyszukiwarka
Podobne podstrony:
Prawo autorskie na miarę XXI wieku namiary
Lek na miarę XXI wieku - MMS
Beton towarowy nowe oblicze starego materiału na miarę XXI wieku(2)
Luksus, na jaki każdy sobie zasłużył – mieszkać w nowoczesnym i pięknym otoczeniu na miarę XXI wieku
Zeppelin Na Miarę XXI Wieku
Depilacja przyjemność na miarę XXI wieku
Inne Więziennictwo na progu XXI wieku wersja do druku
Edukacja wczesnoszkolna w warunkach przemian na początku XXI wieku
Na początku XXI wieku
Segregacja spoleczna w miescie postsocjalistycznym Bukareszt Warszawa Tallin na poczatku XXI wieku
2010 AON Budżet obrony Polski na początku XXi wieku
więcej podobnych podstron