POLITECHNIKA ŁÓDZKA
INSTYTUT MASZYN PRZEPŁYWOWYCH
Zakład Techniki Cieplnej i Chłodnictwa
LABORATORIUM
Z TERMODYNAMIKI
Ćwiczenie nr T-02
Temat:
Oznaczanie ciepła spalania i wartości
opałowej paliw stałych.
Opracował: dr inż. Władysław Kasieczka
Łódź - 2014
Laboratorium Techniki Cieplnej i Chłodnictwa
90-924 Łód
ź
; ul. Stefanowskiego 1/15

T-02.
Oznaczanie ciepła spalania i warto
ś
ci opałowej paliw stałych.
strona: 2/23
1 . CEL ĆWICZENIA
Celem ćwiczenia jest określenie ciepła spalania paliwa stałego - węgla przy pomocy kalorymetru zwykłego z bombą
kalorymetryczną oraz obliczenie wartości opałowej badanego paliwa.
2. PODSTAWY TEORETYCZNE ANALIZY TECHNICZNEJ PALIW
STAŁYCH
W termodynamice zaś spalanie jest jedną z przemian cieplnych, dla których analizy stworzono szereg modeli
pomocnych przy ocenie energetycznych skutków określonego procesu spalania. Podstawy teoretyczne spalania
przedstawione są w pracach [2, 7, 10].
Spalaniem teoretycznym nazwano spalanie całkowite i zupełne, w którym stosunki składników wyjściowych
i produktów reakcji są zgodne ze znanymi z chemii zależnościami stechiometrycznymi. Proces spalania może być
niecałkowity i niezupełny.
Spalanie niecałkowite występuje w zasadzie tylko przy paliwach stałych i charakteryzuje się zawartością części
palnych w odpadach paleniskowych - w żużlu, przesypie i lotnym popiele. Przyczyną spalania niecałkowitego są niepalne
substancje mineralne tworzące popiół, którego zawartość utrudnia dopalanie się paliwa.
W przypadku spalania niezupełnego w produktach spalania pojawiają się gazy palne - CO, H
2
, CH
4
. Przyczyny
spalania niezupełnego mogą być bardzo różne - za mała ilość doprowadzonego powietrza, niedostateczne wymieszanie paliwa
z utleniaczem, przewlekle spalanie w wyniku zbyt niskich temperatur w palenisku i inne.
Najczęściej produktem spalania niezupełnego jest tlenek węgla CO, który jest gazem trudnym do dopalenia. Jego
obecność w spalinach wynika z własności węgla, który jest nie tylko pierwiastkiem palnym, ale silnym środkiem
redukującym. Dlatego spalanie węgla przebiega zawsze przez zgazowanie. W wyniku tego, w warstwie paliwa tworzy się
CO
2
wraz z CO. Tlenek węgla CO może nie znaleźć w przestrzeni paleniska warunków do spalenia. W rzeczywistym
procesie spalania zachodzą bardzo złożone przemiany chemiczne.
Głównymi palnymi składnikami paliw są związki węgla i wodoru.
Paliwami nazywa się w technice materiały charakteryzujące się tym, że:
1) w procesie spalania wywiązują stosunkowo dużą ilość energii cieplnej z jednostki masy;
2) produkty ich spalania stanowią mieszaninę gazów, która może być wykorzystana jako czynnik termodynamiczny;
3) mają własności, przy których proces jest sprawny, ekonomiczny i łatwy w eksploatacji;
4) są łatwo dostępne ze względu na duże zapasy w naturze i możliwość ich łatwego wydobycia i przetwórstwa;
5) ich utleniaczem jest przede wszystkim powietrze atmosferyczne.
Z technicznego punktu widzenia paliwami nazywa się substancje celowo wykorzystywane do otrzymywania dużych
ilości ciepła.
Paliwa stosowane w energetyce można podzielić na naturalne i sztuczne, a ze względu na stan skupienia - na paliwa
stałe, ciekłe i gazowe.
2.1. Ciepło spalania i wartość opałowa paliw.
Najważniejszymi cechami paliwa z punktu widzenia jego praktycznego wykorzystania jest wartość opałowa i ciepło
spalania
Ciepło spalania (Q
s
) jest to ilość ciepła, jaka się wydziela przy spalaniu całkowitym i zupełnym jednostki masy lub
objętości paliwa, jeśli wszystkie produkty spalania wracają do temperatury początkowej składników, biorących udział w
spaleniu, a para wodna powstała po spalaniu paliwa ulegnie skropleniu.
Dla uściślenia definicji podaje się jeszcze, że temperatura początkowa i końcowa procesu spalania ma być równa
0
°
C z uwagi na zależność ciepła spalania od temperatury. Zależność ta w zakresie temperatur otoczenia jest bardzo słaba.
Wartością opałową paliwa (Q
j
) nazywa się ilość ciepła, jaka wydziela się przy spaleniu całkowitym i zupełnym
jednostki masy lub objętości paliwa i ochłodzeniu produktów spalania do temperatury początkowej, którą jest 0°C (lecz w
tym przypadku para wodna powstała przy spalaniu nie ulegnie wykropleniu).
Przypadek ten jest niemożliwy do realizacji para wodna po ochłodzeniu spalin do 0
°
C ulegnie zawsze wykropleniu,
jednak w praktyce bardziej użyteczną wielkością jest wartość opałowa. Decyduje o tym fakt, że spaliny uchodząca ze
wszystkich urządzeń cieplnych mają temperaturę wyższą od 100°C, zawierają więc nieskroploną parę wodną.
Wartość opałowa Q
j
jest więc liczbowo równa różnicy między ciepłem spalania Q
s
, a ilością ciepła potrzebną do
odparowania wody zawartej w paliwie oraz powstałej ze spalania wodoru z tego paliwa.
Można ją określić wzorem:
Q
j
= Q
s
– r m
w
(1)
gdzie: Q
s
– ciepło spalania paliwa [kJ/kg pal.]; Q
j
– wartość
opałowa paliwa [kJ/kg pal.]; r - ciepło parowania wody
w temperaturze pomiaru (dla t = 0°C, r = 2500 kJ/kg wody); m
w
- całkowita masa wody powstałej przy spaleniu
jednostki masy paliwa [kg wody/kg paliwa].
Ciepła spalania i wartości opałowe poszczególnych składników paliwa podano w tablicy 2.1.
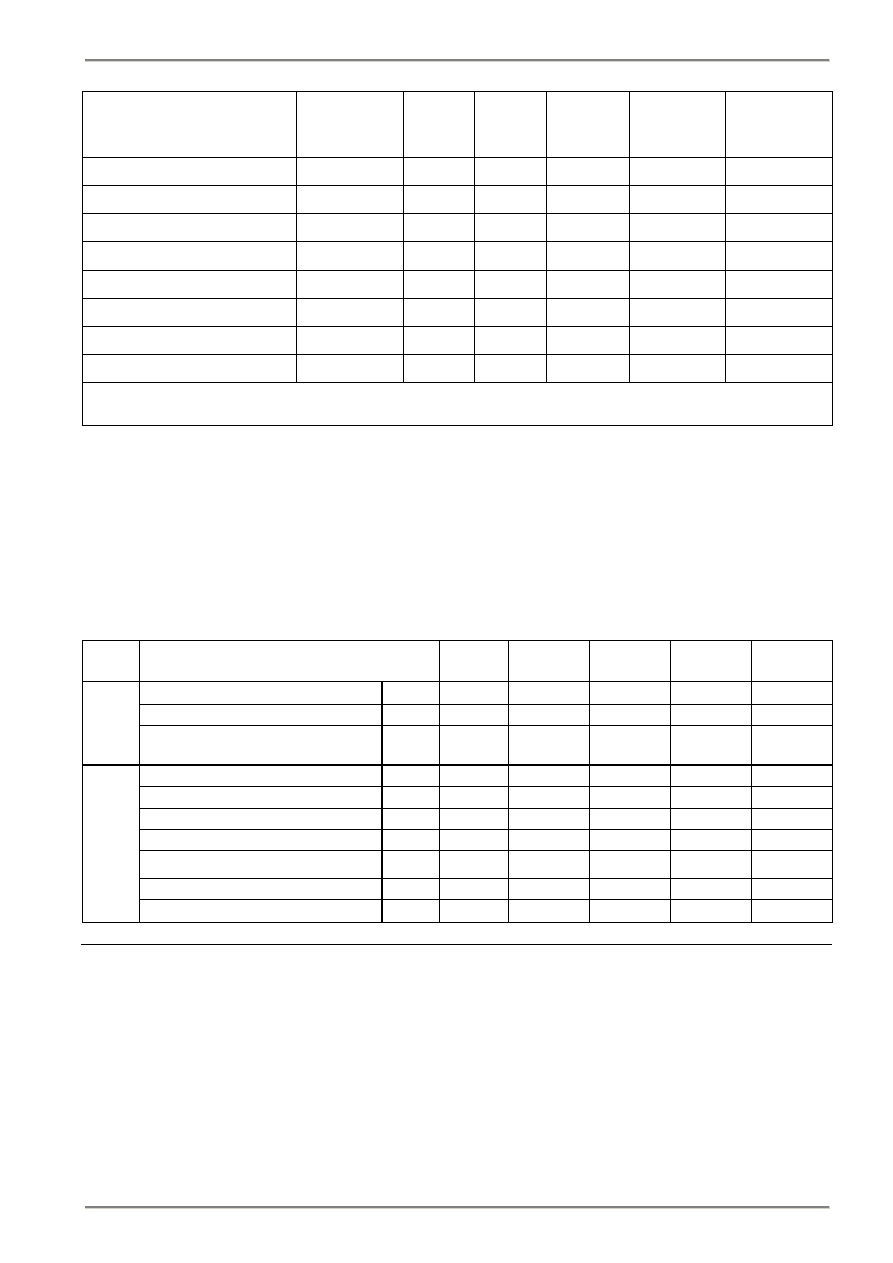
T-02.
Oznaczanie ciepła spalania i warto
ś
ci opałowej paliw stałych.
strona:
3/23
Tablica 2.1. Ciepło spalania i wartość opałowa poszczególnych składników paliwa
Równania stechiometryczne
Jednostka
objętościowa
1
Ciepło
spalania
Q
s
Wartość
opałowa
Q
j
Jednostka
masowa
Ciepło
spalania
Q
s
Wartość
opałowa
Q
j
H
2
+ ½0
2
= H
2
O
kJ/m
3
12770
10760
kJ/kg
141974
119169
C + ½O
2
= CO
kJ/m
3
-
-
kJ/kg
10216
10216
C + O
2
= CO
2
kJ/m
3
-
-
kJ/kg
33913
33913
CO + ½O
2
= CO
2
kJ/m
3
12644
12644
kJ/kg
10132
10132
S + O
2
= SO
2
kJ/m
3
-
-
kJ/kg
9064
÷
12351
9064
÷
12351
CH
4
+ 2O
2
= CO
2
+ 2H
2
O
kJ/m
3
39858
35672
kJ/kg
55601
49949
C
2
H
4
+ 3O
2
= 2C0
2
+ 2H
2
O
kJ/m
3
64016
59955
kJ/kg
50786
47562
C
2
H
6
+ 3,5O
2
= 2CO
2
+ 3H
2
O
kJ/m
3
70422
64351
kJ/kg
-
-
1)
Objętość paliw gazowych wyraża się w m
3
mierzonych w warunkach normalnych, tzn. przy ciśnieniu 101,3 kPa,
w temperaturze 0°C (273,15 K).
2.2. Paliwa stałe
Do najważniejszych naturalnych paliw stałych według wzrastającego stopnia uwęglenia zalicza się: drewno, torf,
węgiel brunatny, węgiel kamienny, antracyt. Najstarszym geologicznie węglem o największej zawartości pierwiastka C jest
antracyt (>94% C), najmłodszym torf (~30% C) [5]. Pośrednie miejsca zajmują węgiel kamienny (70
÷
88% C) oraz młodszy,
mniej uwęglony węgiel brunatny (<70%C). Węgiel naturalny jest mieszaniną węgla bezpostaciowego oraz różnych
organicznych związków chemicznych powstałych w wyniku uwęglania, czyli rozkładu materiału organicznego bez dostępu
powietrza.
Orientacyjna charakterystykę podstawowych paliw stałych przedstawiono w tablicy 2.2.
Tablica 2.2. Orientacyjna charakterystyka podstawowych paliw stałych
Stan
paliwa
Paliwo
Drewno
Torf
Węgiel
brunatny
2)
Węgiel
kamienny
2)
Antracyt
R
o
b
o
cz
y
Wartość opałowa Q
j
r
MJ/kg
7,9
÷
15,5
8,4
÷
12,5
6,3
÷
21
13
÷
29,3
20,9
÷
29,3
Zawartość wilgoci całkowitej W
t
r
%
15
÷
50
30
÷
50
1)
15
÷
60
5
÷
27
5
÷
30
Zawartość popiołu A
r
%
0,5
÷
1
2
÷
10
7
÷
20
5
÷
40
5
÷
35
S
u
ch
y
i
b
ez
p
o
p
io
ło
w
y
Zawartość części lotnych V
daf
%
85
67
÷
75
40
÷
60
10
÷
48
3
÷
10
Zawartość pierwiastka węgla C
daf
%
50
53
÷
62
66
÷
78
76
÷
90
93
÷
97
Zawartość wodoru H
daf
%
6
5
÷
6
4
÷
7
4
÷
6
1
÷
3
Zawartość tlenu O
daf
%
43,9
29
÷
39
14
÷
27
3
÷
15
1
÷
3
Zawartość azotu N
daf
%
0,1
2,3
÷
3,3
0,7
÷
3,5
1,3
÷
1,8
0,5
÷
1,5
Zawartość siarki palnej S
c
daf
%
0
0,2
÷
0,3
0,5
÷
2
0,5
÷
2
0,5
÷
1
Wartość opałowa Q
j
daf
MJ/kg
18,8
20,4
÷
23,3
25,5
÷
28,8
30,3
÷
35,2
33,4
÷
34,2
1)
Świeżo wydobyty torf ma ok. 90% wilgoci.
2)
Dotyczy węgli wydobywanych w kraju.
2.2.1. Węgiel kamienny.
Podstawowym paliwem energetycznym w naszym kraju jest węgiel kamienny [5]. Podstawą podziału węgla
kamiennego na typy (wg PN-82/G-97002 - Węgiel kamienny. Typy) są naturalne cechy, charakteryzujące jego przydatność
technologiczną, określane wg następujących wskaźników:
-
zawartości części lotnych w węglu w przeliczeniu na stan suchy i bezpopiołowy – V
daf
(wg PN-81/G-04516);
-
zdolności spiekania, oznaczona metodą Rogi – RI (wg PN-81/G-04518);;
-
dylatacji - b (wg PN-81/G-04517);
-
wskaźnika wolnego wydymania - SI (wg PN-81/G-04515);
-
ciepła spalania w przeliczeniu na stan suchy i bezpopiołowy - Q
daf
(wg PN- 81/G-04513).
Rozróżnia się następujące typy węgla kamiennego: węgiel płomienny, gazowo - płomienny, gazowy, gazowo-koksowy,
ortokoksowy, metakoksowy, semikoksowy, chudy, antracyt, metaantracyt. Do węgli typowo energetycznych przeznaczonych
do bezpośredniego spalania zalicza się trzy pierwsze typy. Podział na klasy węgli energetycznych w zależności od wartości

T-02.
Oznaczanie ciepła spalania i warto
ś
ci opałowej paliw stałych.
strona: 4/23
opałowej w stanie roboczym Q
j
r
i zawartości popiołu w węglu w stanie roboczym A
r
jest przedstawiony w PN-82/G-97003 -
Węgiel kamienny do celów energetycznych. Charakterystykę polskich energetycznych węgli kamiennych podano w tablicy
2.3 [18].
Tablica 2.3. Charakterystyka polskich energetycznych węgli kamiennych [1]
Wskaźniki
Rejon
Południowo
−
wschodni
Rejon
Wschodni
Rejon
Centralny
Rejon
Południowy
Części lotne, %
42,5
÷
40,5
41,0
÷
37,0
38,5
÷
37,0
40,0
÷
39,5
Koks, %
57,5
÷
59,5
59,0
÷
63,0
61,5
÷
63,0
60,0
÷
60,5
Ciepło spalania, kJ/kg
33 000
÷
31000 32 800
÷
32 600 32 600
÷
33 400
31 800
÷
32800
Zawartość C, %
80,5
÷
76,5
78,0
÷
79,5
80,5
÷
81,5
77,5
÷
79,5
Zawartość H
2
, %
5,9
÷
5,2
5,2
÷
5,0
5,6
÷
5,3
5,8
÷
5,3
Zawartość (0
2
+ N
2
), %
12,4
÷
16,7
16,0
÷
14,2
13,2
÷
12,4
16,0
÷
14,1
Zawartość siarki całkowitej, %
1,3
÷
2,0
0,9
÷
1,3
0,8
1,3
Zawartość siarki palnej, %
1,2
÷
2,0
0,8
÷
1,3
0,7
÷
0,8
1,2
÷
1,1
Zawartość prasmoły, %
12,0
÷
8,0
8,0
÷
10,0
13,0
12,5
÷
13,0
Wilgoć całkowita (po urobieniu), %
7,0
÷
20,0
13,0
÷
8,0
8,0
÷
7,0
9,0
÷
8,0
Wilgoć higroskopijna, %
10,0
÷
4,0
8,0
÷
4,5
6,0
÷
2,0
6,0
÷
3,0
Uwaga: Sortymenty płukane zawierają 2
÷
6% wilgoci więcej. Części lotne, koks i inne składniki podano dla suchej masy
palnej.
2.2.2. Inne paliwa stałe
Palne łupki charakteryzują się dużą zawartością popiołu (do 50%) i małą wilgotnością. Wartość opałowa łupków
waha się w granicach 14000
÷
21000 kJ/kg. W kraju łupki spalane są po zmieszaniu z węglem o małej zawartości popiołu.
Koks i półkoks. Jednym z procesów przeróbki chemicznej węgla jest proces odgazowywania, który polega na
rozkładzie termicznym paliwa ogrzewanego bez dostępu powietrza. Paliwa stałe jak drewno, torf oraz węgiel brunatny
odgazowuje się prawie wyłącznie w niskich temperaturach i w tym wypadku proces ten nazywa się wytlewaniem. Ze względu
na zastosowanie koksu i związane z tym wymagania techniczne rozróżnia się następujące g a t u n k i k o k s u :
wielkopiecowy, odlewniczy, generatorowy, opałowy, karbidowy, koksik.
Wymagania dotyczące koksu z węgla kamiennego (gatunków, sortymentów) przedstawione są w PN-86/C-
02050.01
÷
07, a półkoksu w normie PN-88/C-97957 - Półkoks z węgla kamiennego. Norma PN-86/C-02050.06 - Koks z węgla
kamiennego. Koks przemysłowo-opałowy przedstawia wymagania dotyczące koksów dla celów opałowych.
Węgiel brunatny. Produkcja energii elektrycznej w krajowej energetyce zawodowej w dużym stopniu opiera się na
węglu brunatnym. Podstawowe własności węgla brunatnego podano w tabl. 10.2. W węglach brunatnych spotyka się duże
zawartości siarki. Zwykle wzrost ilości siarki towarzyszy wzrostowi zasolenia węgla brunatnego. Technika racjonalnego
spalania węgli zasolonych w energetyce nie jest jeszcze opanowana.
Polska klasyfikacja węgli brunatnych wprowadza podział na typy w zależności od zawartości wilgoci całkowitej
przeliczonej na stan bezpopiołowy oraz wydajności smoły wytlewnej przeliczonej na stan bezpopiołowy i suchy (PN-75/G-
97051.00. Węgiel brunatny. Typy).
Podział węgla brunatnego na klasy dla celów energetycznych przedstawia PN-91/G- 97051.01 - Węgiel brunatny.
Klasy węgla dla celów energetycznych, podział zaś na sortymenty PN-75/G-97051.05 - Węgiel brunatny. Sortymenty.
Torf jest produktem rozkładu roślin, podobnie jak węgiel i jest geologicznie tworem najmłodszym wśród paliw
kopalnych. Zależnie od sposobu wydobycia otrzymuje się torf w kawałkach (kształt cegieł), frezowany (drobne kawałki),
hydrotorf (wypłukany woda - błoto wysuszone i pokruszone). Świeżo wydobyty torf ma do 90% wilgoci i jest suszony na
powietrzu do 40
÷
50% zawartości wilgoci. Podstawowe własności torfu podano w tabl. 10.2.
Paliwa roślinne. Do najczęściej stosowanych paliw roślinnych zalicza się drewno i jego odpady z obróbki (trociny,
wióry,...). Wyjątkowo stosowane są jako paliwa: słoma zbożowa (Q
j
r
≅
15.9 MJ/kg), paździerze z lnu (Q
j
r
≅
16.3 MJ/kg) i
konopi. Podstawowe własności drewna jako paliwa podano w tabl. 10.2.
Paliwa odpadowe. Odpady palne otrzymuje się z różnych procesów technologicznych. Maja one różną wartość
opałową (np. odpady starej gumy - Q
j
r
~13400 kJ/kg, ścinki skóry - Q
j
r
~18400 kJ/kg). W przemyśle papierniczym spala się
ługi posulfitowe o zawartości wilgoci 15
÷
50%, zawartości popiołu 10
÷
25%, wartości opałowej 4100
÷
14700 kJ/kg.
Gospodarka komunalna, zwłaszcza w Europie Zachodniej, spala śmieci w specjalnych paleniskach. Wartość opałowa śmieci
miejskich wynosi około Q
j
r
= 3400
÷
12500 kJ/kg.
T-02.
Oznaczanie ciepła spalania i warto
ś
ci opałowej paliw stałych.
strona:
5/23
3. ANALIZA TECHNICZNA PALIW STAŁYCH
Najważniejszymi wielkościami technicznymi charakteryzującymi paliwo stałe są: zawartość wilgoci i popiołu,
zawartość części lotnych, ciepło spalania i wartość opałowa. Jednym ze składników paliwa decydującym o efektywności
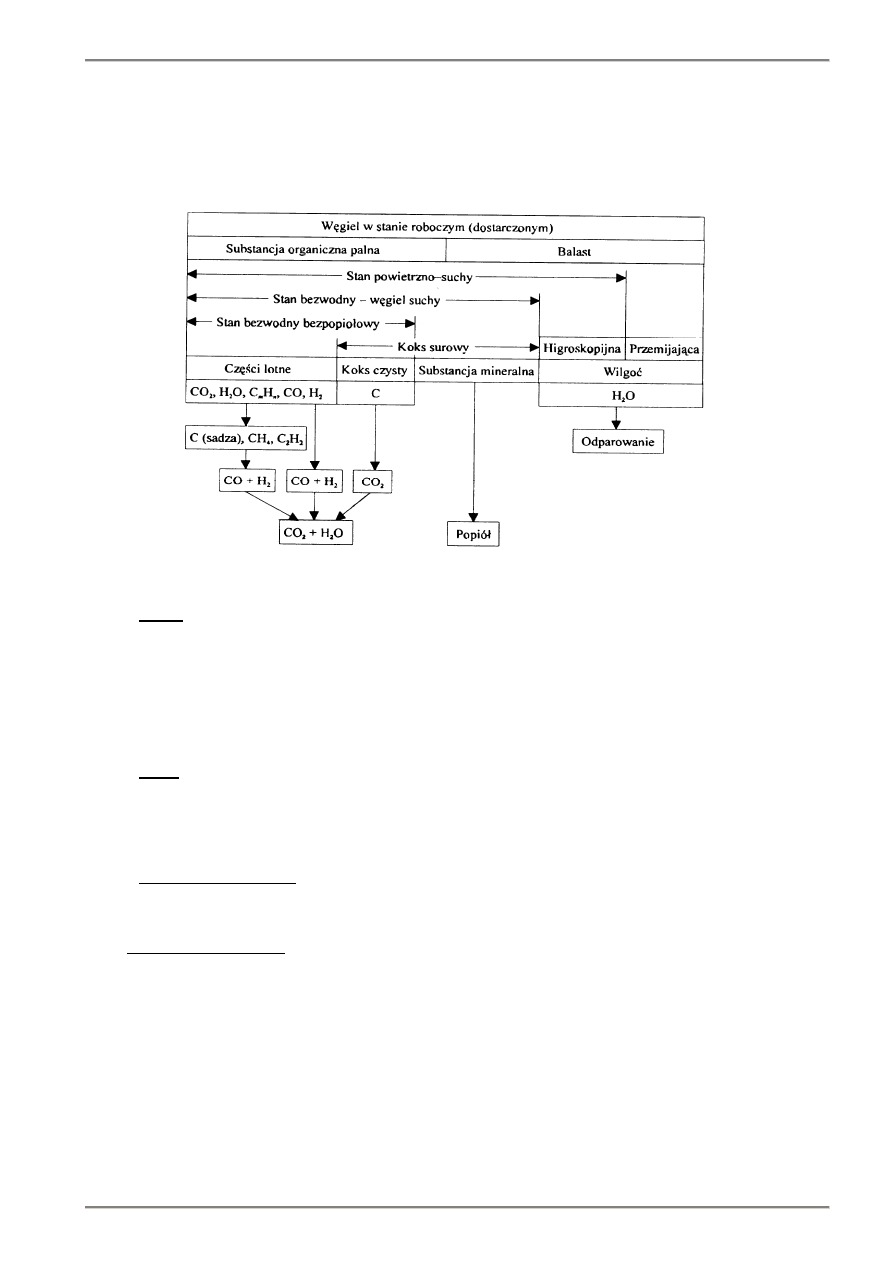
spalania jest wilgoć (rys. 3.1) [1].
Rys. 3.1. Schemat składu węgla i przebiegu procesu spalania [1]
Wilgoć zawartą w paliwie można podzielić na następujące rodzaje: wilgoć konstytucjonalną (chemicznie związaną z
substancją), wilgoć higroskopijną (znajdującą się w powierzchniowych warstwach substancji i utrzymującą się w wyniku sił
adsorpcji) oraz wilgoć zewnętrzną. Wilgoć zewnętrzna dzieli się na powierzchniową (utrzymującą się na powierzchni cząstek)
i grawitacyjną (ściekającą pod działaniem siły ciążenia).
Wilgoć można podzielić wg energii wiązania z paliwem tj. na chemiczną, fizykochemiczną i fizykomechaniczną.
Wilgoć równoważną, którą ma paliwo przy względnej zawartości wilgoci powietrza 60% i temperaturze 20
°
C
nazywa się wilgocią higroskopijną lub wilgocią paliwa powietrzno-suchego. Charakteryzuje ona higroskopijne własności
paliwa.
Popiół powstaje z niepalnej, mineralnej substancji paliwa. Zmniejsza on udział masy palnej, co obniża wartość
opałowa paliwa, utrudnia proces spalania i zanieczyszcza powierzchnię wymiany ciepła. W zależności od ilości i postaci
poszczególnych substancji, przemiany chemiczne podczas spalania wpływają na skład i właściwości powstającego popiołu.
Dlatego zawartość popiołu w paliwie jest wielkością umowną i temperatura jego oznaczania nie może być dowolna (zgodnie z
Polską Normą - 815±15
°
C). Popiół w stanie sypkim nazywamy popiołem lotnym, a w stanie stopionym i zlanym - żużlem.
Zawartość części lotnych jest jedną z najbardziej charakterystycznych cech węgla (rys. 10.3) [9]. Z każdego węgla
pod wpływem ogrzewania wydziela się pewna ilość par, gazów i smół, a pozostaje pewna ilość substancji nielotnej, nazywana
koksem lub pozostałością po odgazowaniu.
Wartość opałowa paliwa zależy głownie od zawartości części palnych oraz balastu, tj. głownie wilgoci i popiołu.
W celu jednoznacznego zdefiniowania stanu odniesienia paliwa wprowadzono sztucznie stworzone pochodne
podstawowego składu roboczego: stan roboczy, analityczny, suchy, suchy - bezpopiołowy, organiczny.
Stan roboczy jest to stan węgla o takiej zawartości wilgoci i popiołu, jaką ma węgiel, z którego pobrano próbkę
ogólną.
W stanie analitycznym zawartość wilgoci i popiołu jest taka sama, jaką posiada próbka analityczna doprowadzona
do stanu równowagi z wilgocią atmosferyczną (stan powietrzno-suchy).
W stanie suchym węgiel nie zawiera wilgoci całkowitej. W stanie suchym i bezpopiołowym węgiel nie zawiera
wilgoci całkowitej i popiołu a w stanie organicznym - wilgoci całkowitej i substancji mineralnej.
Przy przeliczaniu wartości parametrów paliw stałych z danego stanu na inny stosuje się współczynniki
przeliczeniowe określone w PN-91/G-04510 - Paliwa stałe. Symbole i współczynniki przeliczeniowe. Nie maja one
zastosowania przy przeliczaniu wartości opałowej, którą należy przeliczać zgodnie z PN-81/G- 04513 - Paliwa stałe.
Oznaczanie ciepła spalania i obliczanie wartości opałowej.
T-02.
Oznaczanie ciepła spalania i warto
ś
ci opałowej paliw stałych.
strona: 6/23
3.1. Pobieranie próbek paliwa stałego do badań
Pobieranie próbek ma na celu uzyskanie niewielkiej ilości paliwa, które reprezentowałaby wszystkie cechy
jakościowe badanej partii. Pobieranie, przygotowanie i sprawdzanie próbek paliw stałych omówione są w odpowiednich
normach.
Wymienione normy stanowią zbiór praktycznych przepisów podających metody pobierania, pomniejszania
i przygotowania próbek paliw. Od prawidłowości pobrania próbki i jej przygotowania do analizy zależy zgodność wyników
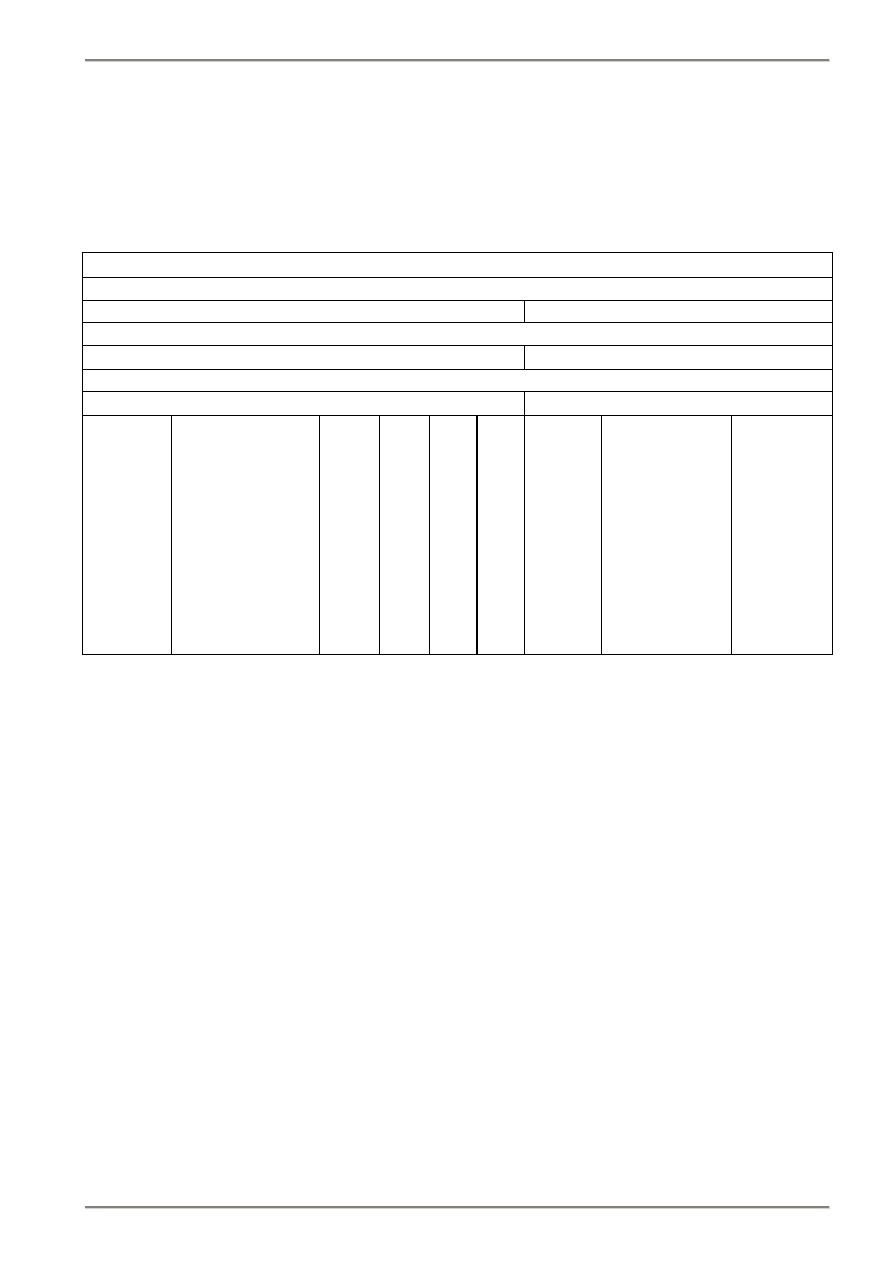
oznaczeń z rzeczywistymi własnościami paliwa. Podział próbek produkcyjnych zestawiono w tablicy 3.1.
Tablica 3.1. Podział próbek produkcyjnych węgla do analizy chemicznej wg PN-90/G-04502
Próbki pierwotne
Próbki ogólne
zwykłe
specjalne
Średnie próbki laboratoryjne
zwykłe
specjalne
Próbki analityczne
zwykłe
specjalne
d
o
o
zn
ac
za
n
ia
z
aw
ar
to
śc
i
w
il
g
o
ci
p
rz
em
ij
aj
ąc
ej
W
ex
d
o
o
zn
ac
za
n
ia
z
aw
ar
to
śc
i
w
il
g
o
ci
w
w
ęg
lu
p
o
w
ie
tr
zn
o
su
ch
y
m
(
w
il
g
o
ci
h
ig
ro
sk
o
p
ij
n
ej
)
W
h
d
o
o
zn
ac
za
n
ia
z
aw
ar
to
śc
i
w
il
g
o
ci
ca
łk
o
w
it
ej
W
t
1
1
,4
0
,2
S
0
,2
d
o
o
zn
ac
za
n
ia
z
aw
ar
to
śc
i
w
il
g
o
ci
p
rz
ze
m
ij
aj
ąc
ej
W
ex
d
o
o
zn
ac
za
n
ia
z
aw
ar
to
śc
i
w
il
g
o
ci
w
w
ęg
lu
p
o
w
ie
tr
zn
o
su
ch
y
m
(
w
il
g
o
ci
h
ig
ro
sk
o
p
ij
n
ej
)
W
h
d
o
o
zn
ac
za
n
ia
z
aw
ar
to
śc
i
w
il
g
o
ci
ca
łk
o
w
it
ej
W
t
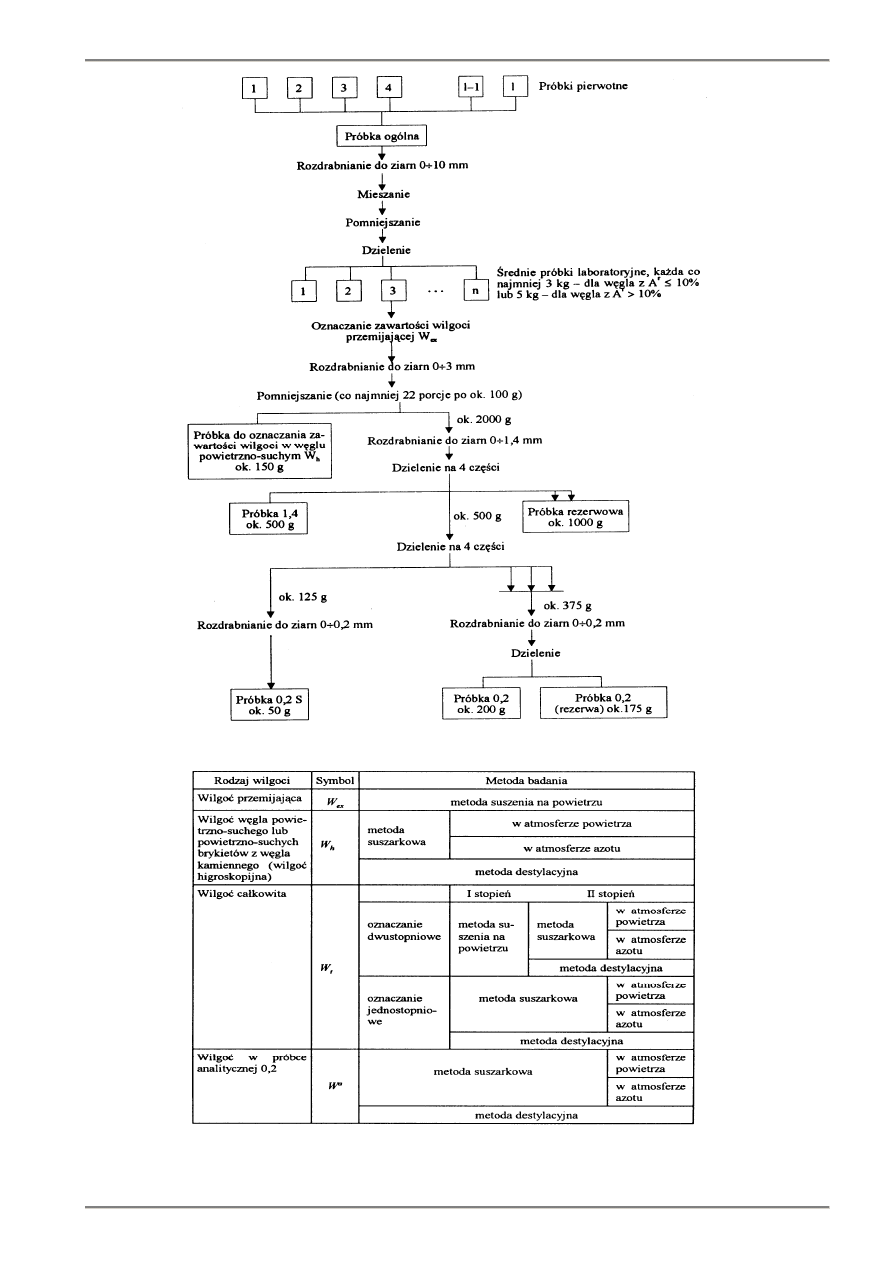
3.2. Przygotowanie próbek laboratoryjnych i analitycznych.
Z próbki ogólnej, po jej odpowiednim rozdrobnieniu i wymieszaniu, wydziela się średnie próbki laboratoryjne.
Wszystkie czynności związane z ich przygotowaniem powinno być prowadzone szybko w takich warunkach, aby paliwo nie
zmieniło za wartości wilgoci. Przed oznaczeniem zawartości wilgoci przemijającej próbki powinny być transportowane i
przechowywane w szczelnych naczyniach. Sposób pobierania i przygotowania próbek węgla do analizy przedstawiono
przykładowo na rys. 3.2.
3.3. Oznaczanie zawartości wilgoci
Sposoby oznaczania zawartości wilgoci w paliwach stałych szczegółowo opisano w normie PN-80/G-04511 -
Paliwa stałe. Oznaczanie zawartości wilgoci.
Wprowadza ona następujące określenia:
- wilgoć przemijająca (W
ex
) - jest to cześć wody zawartej w paliwie tracona podczas suszenia w powietrzu do
osiągnięcia stanu przybliżonej równowagi z wilgocią powietrza otoczenia;
- wilgoć węgla powietrzno-suchego (wilgoć higroskopijna) (W
h
) - jest to woda pozostała w węglu po osiągnięciu
przybliżonej równowagi z wilgocią powietrza otoczenia;
- wilgoć całkowita (W
t
r
) - jest łączna zawartość wilgoci przemijającej i wilgoci higroskopijnej w paliwie roboczym;
- wilgoć analityczna (W
a
) - jest to wilgoć zawarta w próbce analitycznej 0,2 przygotowanej do prowadzenia oznaczeń.
Rodzaje wilgoci w paliwie stałym i metody ich oznaczania wg PN-80/G-04511 przedstawiono na rys. 3.3.
T-02.
Oznaczanie ciepła spalania i warto
ś
ci opałowej paliw stałych.
strona:
7/23
Rys. 3.2. Uproszczony schemat pobierania i przygotowania próbek węgla wg PN-80/G – 04502
Rys. 3.3. Rodzaje wilgoci w paliwie stałym i metody ich oznaczania wg PN-80/G - 04511

T-02.
Oznaczanie ciepła spalania i warto
ś
ci opałowej paliw stałych.
strona: 8/23
3.3.1. Oznaczanie zawartości wilgoci przemijającej.
Zgodnie z PN-80/G- 04511 zawartość wilgoci przemijającej w paliwie można wyznaczyć dwoma sposobami:
-
metodą suszenia na powietrzu - polegająca na suszeniu próbek paliwa o granulacji poniżej 10 mm w atmosferze
powietrza w temperaturze pokojowej i na oznaczeniu wagowym ubytku masy próbki podczas suszenia;
-
metodą suszarkową - jest to metoda przyspieszona, polega na wysuszeniu próbki paliwa w suszarce o temperaturze
50 ± 5
°
C przy zapewnionej ciągłej wymianie powietrza.
Suszenie należy zakończyć, jeżeli w ciągu 2 godzin zmiana masy jest mniejsza niż 0,1% początkowej masy paliwa.
Zawartość wilgoci przemijającej W
ex
r
, w %, oblicza się wg wzoru:
m
-
m
m
-
m
W
r
ex
100
3
1
2
1
⋅
=
%
(10.8)
gdzie: m
1
- masa tacy z odważką paliwa przed suszeniem, g; m
2
- masa tacy z odważką paliwa po suszeniu, g; m
3
- masa
tacy, g.
Dane pomiarowe podano w tablicy pomiarowej 3.2. Oznaczenie zawartości wilgoci przemijającej W
ex
r
[%]
3.3.2. Oznaczanie zawartości wilgoci w próbce analitycznej paliwa powietrzno-suchego
(higroskopijnego)
Celem oznaczenia zawartości wilgoci higroskopijnej w paliwie stosuje się dwie metody: suszarkową i destylacyjną.
M e t o d a s u s z a r k o w a polega na suszeniu, przez co najmniej 60 min, próbki paliwa powietrzno-suchego
(o granulacji poniżej 3 mm) w suszarce w atmosferze powietrza lub azotu (paliwa utleniające się w powietrzu w temperaturze
suszenia) w temperaturze 105
÷
110
°
C i na oznaczeniu wagowym ubytku masy próbki podczas suszenia. Zawartość wilgoci w
paliwie powietrzno-suchym (higroskopijnej) W
h
w %, oblicza się wg wzoru:
m
m
m
m
W
h
100
6
4
5
4
⋅
−
−
=
%
(10.9)
gdzie: m
4
- masa naczynia z odważką paliwa przed suszeniem, g; m
5
- masa naczynia z odważką paliwa po suszeniu, g; m
6
-
masa naczynia, g.
M e t o d a d e s t y l a c y j n a polega na oddestylowaniu z toluenem wody zawartej w odważce paliwa (około
50 g), pomiarze objętości oddestylowanej wody po skropleniu par i obliczeniu zawartości wilgoci na podstawie masy odważki
oraz objętości oddestylowanej wody wg normy PN-80/G-04511.
Dane pomiarowe podano w tablicy pomiarowej 3.3. Oznaczenie zawartości wilgoci higroskopijnej metodą
suszarkową w próbce analitycznej paliwa W
h
[%]
3.3.3. Oznaczenie zawartości wilgoci całkowitej.
Celem określenia zawartości wilgoci całkowitej oddzielnie oznacza się zawartość wilgoci przemijającej W
ex
r
, po
czym zawartość wilgoci w stanie powietrzno-suchym W
h
a następnie zawartość wilgoci całkowitej W
t
r
, w %, oblicza się ze
wzoru:
100
W
100 -
W
W
W
r
ex
h
r
ex
r
t
+
=
%
(10.10)
M e t o d ę
c i ą g ł e g o pomiaru zawartości wilgoci mikrofalowym miernikiem wilgotności węgla
przedstawiono w normie PN-87/G-04542 - Węgiel kamienny. Ciągły pomiar zawartości wilgoci mikrofalowym miernikiem
wilgotności węgla, a metodę i m p e d a n c y j n ą - w normie PN-87/G-04547 - Węgiel kamienny. Ciągły pomiar
zawartości wilgoci impedancyjnym miernikiem wilgotności węgla.
3.4. Oznaczanie zawartości popiołu i jego analiza
Popiół jest pojęciem umownym, określającym pozostałość składającą się z substancji mineralnych, otrzymaną po
całkowitym spaleniu i wyprażeniu paliwa w określonych warunkach. Zawartość niepalnej substancji mineralnej w paliwie i
jej skład, oznaczanej jako popiół (nazwa ogólna niepalnej substancji mineralnej w paliwie) wpływa na jego jakość i
przydatność paliwa oraz własności eksploatacyjne palenisk.
Sposób oznaczania zawartości popiołu w paliwach stałych metoda spalania szczegółowo opisano w normie
PN-80/G-04512 - Paliwa stałe. Oznaczanie zawartości popiołu metodą wagową. Metoda ta polega na całkowitym spaleniu

T-02.
Oznaczanie ciepła spalania i warto
ś
ci opałowej paliw stałych.
strona:
9/23
1
÷
2 g odważki paliwa w piecu laboratoryjnym (muflowym) w temperaturze 815±15
°
C i wyprażeniu pozostałego popiołu w
warunkach umownych.
Wyróżnia się dwie metody spopielania paliwa:
•
powolnego spopielania, polegająca na stopniowym ogrzewaniu pieca do temperatury 815±15
°
C wraz z umieszczonym
w nim tygielkami z odważkami badanego paliwa;
•
szybkiego spopielania, polegająca na powolnym wsuwaniu tygielków z odważkami badanego paliwa do wcześnie
nagrzanego pieca do temperatury 815±15
°
C i wyprażeniu ich w tej temperaturze (metody tej nie stosuje się do węgla
brunatnego).
Spopielanie można prowadzić w atmosferze powietrza lub w atmosferze powietrza z dodatkiem tlenu (tylko
w metodzie szybkiego spopielania).
Procentową zawartość popiołu w próbce analitycznej (w stanie powietrzno - suchym) określa się ze wzoru:
m
-
m
m
-
m
A
a
100
1
2
1
3
⋅
=
%
(10.11)
gdzie: m
1
- masa wyprażonego tygielka, g; m
2
- masa tygielka z odważką paliwa przed spopieleniem, g; m
3
- masa tygielka
z popiołem, g.
Dane pomiarowe podano w tablicy pomiarowej 3.4.
Oznaczenie zawartości popiołu w próbce analitycznej paliwa stałego A
a
[%]
Przy przeliczeniu otrzymanych wyników zawartości popiołu w próbce analitycznej należy stosować wzory podane
w PN-91/G-04510 - Paliwa stałe. Symbole i współczynniki przeliczeniowe.
4. TEORETYCZNE PODSTAWY KALORYMETRYCZNEGO OKREŚLANIA
EFEKTÓW CIEPLNYCH.
Ogromna większość kalorymetrów daje się przedstawić uproszczonym modelem zwanym modelem jednego ciała.
Zakłada się, że kalorymetr składa się z dwóch części (rys.1):
1.
części wewnętrznej, którą stanowi napełnione naczynie kalorymetryczne
2.
części zewnętrznej t.j. osłony
,
którą stanowi najczęściej płaszcz wodny.
Zakłada się, że obie części są jednorodne termicznie.
Rys. 4.1. Teoretyczny model kalorymetru: 1 - naczynie
kalorymetryczne o temperaturze t; 2 - osłona o
temperaturze t
z
W celu określenia efektu cieplnego powstałego w naczyniu kalorymetrycznym (rys.4.1) należy wyznaczyć
zależność miedzy jego wielkością a temperatura. Zakłada się jednorodność termiczną naczynia kalorymetru i osłony.
Ciepło wydzielone w kalorymetrze dQ na skutek np. spalenia próbki składa się z ciepła zakumulowanego w
naczyniu kalorymetrycznym dU w postaci przyrostu jego energii cieplnej (niekoniecznie wewnętrznej) oraz części ciepła
przenikającego do osłony dQ
z
; tj.:
dQ = dU + dQ
z
(4.1)

T-02.
Oznaczanie ciepła spalania i warto
ś
ci opałowej paliw stałych.
strona: 10/23
Przyrost energii cieplnej dU naczynia kalorymetrycznego wraz z całą jego zawartością przy wzroście temperatury o dt
wynosi:
dU = K · dt
(4.2)
gdzie: K [J/K] - współczynnik proporcjonalności nazywany pojemnością cieplną kalorymetru, będący stosunkiem ciepła
zakumulowanego w kalorymetrze do przyrostu jego temperatury. Pojemność cieplna K określana jest podczas
cechowania kalorymetru przy spalaniu próbki paliwa wzorcowego.
Ilość ciepła dQ
z
przenikająca do osłony w czasie d
τ
można wyznaczyć z zależności:
dQ
z
=
α
A (t – t
z
)d
τ
(4.3)
gdzie:
α
- współczynnik proporcjonalności charakteryzujący ilość ciepła przenikająca do osłony; t, t
z
- temperatura wody
w naczyniu kalorymetrycznym i osłonie.
Równanie bilansu cieplnego kalorymetru będzie miało postać:
dQ = K dt +
α
A (t – t
z
)d
τ
(4.4)
stad:
)
(
d
d
d
d
z
t
t
A
t
K
Q
−
+
=
α
τ
τ
(4.5)
Efekt cieplny uzyskany w kalorymetrze można wyznaczyć poprzez scałkowanie równania (4.5), przy znajomości
zmian temperatur t i t
z
w czasie pomiaru oraz stałych K i
α
.
5. KALORYMETRY DO OZNACZANIA CIEPŁA SPALANIA
5.1. Podział
Spośród kalorymetrów do oznaczania ciepła spalania można wyróżnić:
a) kalorymetry zwykłe, których temperatura osłony jest stała podczas pomiaru (t
z
= const) - przy ich pomocy pomiar
przeprowadzony jest zgodnie z Polskimi Normami (PN-67/G-04513 "Paliwa stałe. Oznaczanie ciepła spalania i wartości
opałowej").
b) kalorymetry adiabatyczne, których temperatura osłony jest w każdej chwili pomiaru równa zmieniającej się
temperaturze naczynia kalorymetrycznego
c) mikrokalorymetry rożnych typów pozwalające określić ciepło spalania z bardzo dużą dokładnością.
5.2. Układ kalorymetryczny. Bomba kalorymetryczna
Zasadniczą częścią każdego kalorymetru do oznaczania ciepła spalania paliw stałych jest bomba kalorymetryczna,
w której spala się odważkę badanego paliwa.
Bomba kalorymetryczna (rys. 5.1b) stanowi cylindryczne grubościenne naczynie ciśnieniowe wykonane
z nierdzewnej stali. Odważkę paliwa w postaci sprasowanej pastylki lub pyłu w woreczku koloidalnym umieszcza się
w tyglu. Zapłon paliwa jest inicjowany spaleniem drutu stalowego zawieszonego miedzy elektrodami bomby 2, do których
doprowadza się w tym celu prąd elektryczny przewodami dołączonymi do bomby. W przekazywaniu płomienia
uczestniczy nitka bawełniana łącząca drut stalowy z pastylką paliwa.
Spalenie paliwa następuje w atmosferze tlenu, którym napełnia się przed pomiarem bombę pod ciśnieniem
2
÷
2,5 MPa (20 – 25 atn), przewodem 4 z zaworem zwrotnym.
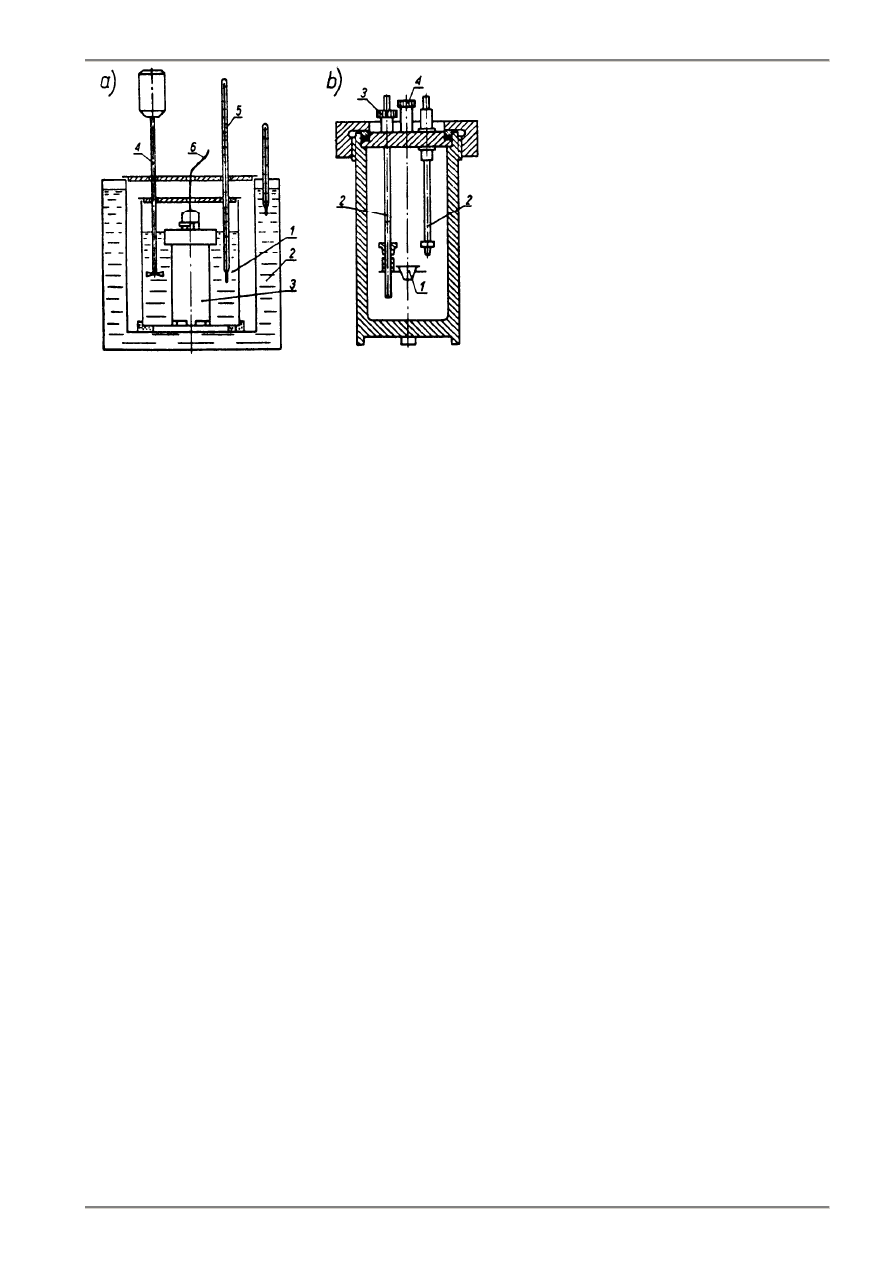
T-02.
Oznaczanie ciepła spalania i warto
ś
ci opałowej paliw stałych.
strona:
11/23
Rys. 5.1. Układ kalorymetryczny do oznaczania ciepła
spalania:
(a)
Zestaw kalorymetryczny: 1 - naczynie
kalorymetryczne, 2 - płaszcz wodny, 3 - bomba
kalorymetryczna, 4 - mieszadło,
(b)
Bomba kalorymetryczna: 1 - tygiel, 2 - elektrody,
3 - zawór wylotowy, 4 - zawór do napełniania
tlenem
5.3. Kalorymetr zwykły
Kalorymetr zwykły (rys.5.1) składa się z dwóch zasadniczych części naczynia kalorymetrycznego (1) z umieszczoną
wewnątrz bombą kalorymetryczną (3) i wypełnionego wodą w ilości około 2,5 kg oraz płaszcza wodnego (2) otaczającego
naczynie kalorymetryczne.
Na skutek spalenia odważki paliwa w bombie następuje wzrost temperatury wody wypełniającej naczynie
kalorymetryczne . Temperaturę tą mierzy się termometrem (5) z działką elementarną 0,01
°
C zanurzonym w naczyniu.
Mieszadło (4) służy do zintensyfikowania wymiany ciepła z bombą oraz - do wyrównania temperatur wody
w naczyniu kalorymetrycznym.
Płaszcz wodny stanowi naczynie o podwójnych ścianach dużej pojemności (co najmniej 15 dcm
3
), co zapewnić ma
stałą jego temperaturę podczas pomiaru.
Szczegółowe warunki, jakie musi spełnić kalorymetr do pomiaru ciepła spalania określa norma PN-67/G-04513.
6. POMIAR ILOŚCI CIEPŁA WYDZIELONEGO W KALORYMETRZE
6.1. Pomiar temperatury płynu kalorymetrycznego.
Właściwy pomiar temperatury dzieli się na trzy okresy, w czasie których dokonuje się odczytów temperatury
(rys.6.1):
a)
okresu początkowego – charakteryzującego się wymianą ciepła między naczyniem kalorymetrycznym
a płaszczem wodnym na skutek różnicy temperatur pomiędzy nimi;
b)
okresu głównego - rozpoczyna się on z chwilą zapłonu paliwa w bombie i kończy gdy temperatura
kalorymetru przestanie rosnąć (zakończy się wydzielanie ciepła spalania);
c)
okresu końcowego - następuje po okresie głównym i temperatura zmienia się w nim tylko na skutek wymiany
ciepła osłony
Dla określenia ilości ciepła wydzielonego w kalorymetrze zwykłym stosuje się metodę poprawionego przyrostu
temperatury.
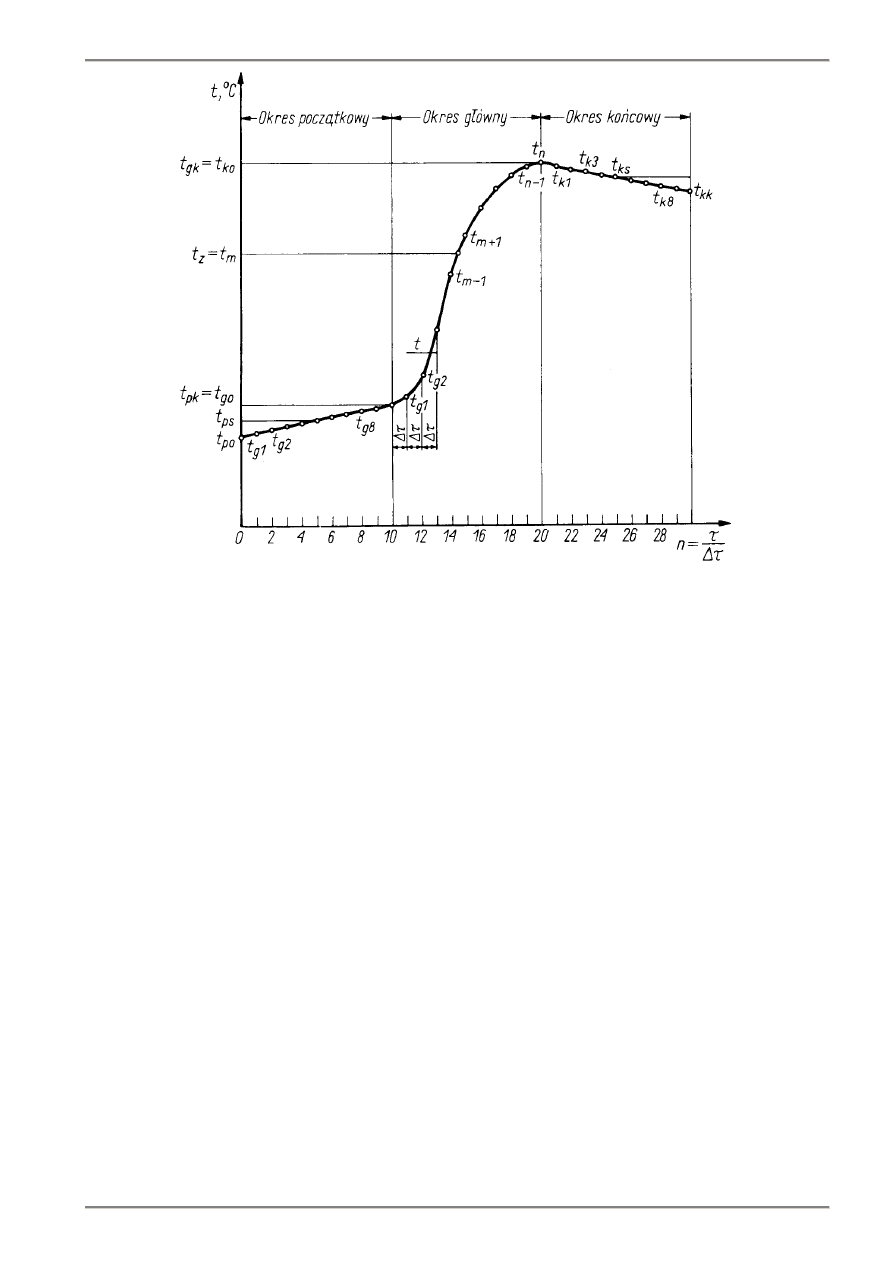
T-02.
Oznaczanie ciepła spalania i warto
ś
ci opałowej paliw stałych.
strona: 12/23
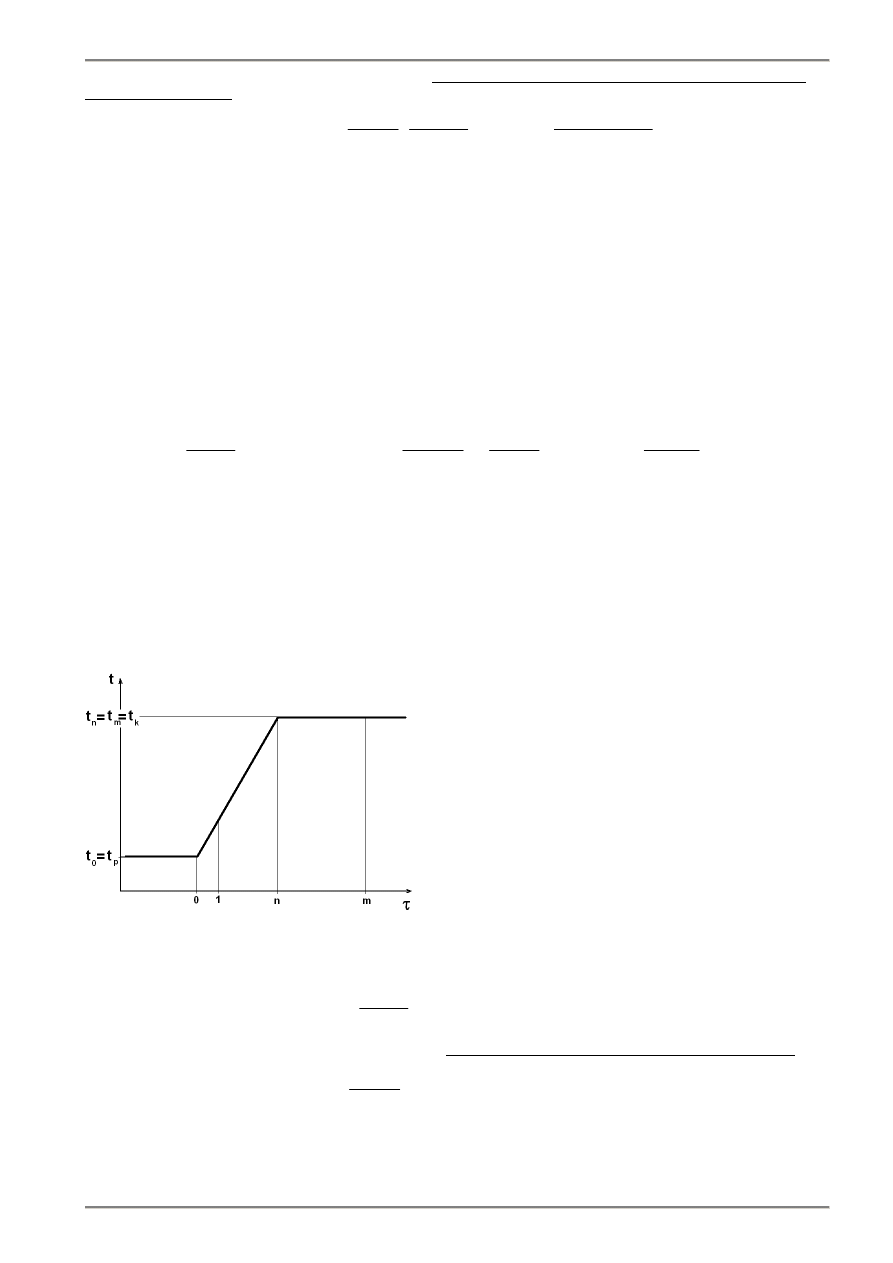
Rys.6.1. Zależność temperatury wody w naczyniu kalorymetru od czasu podczas wyznaczania ciepła spalania
Temperaturę początkową naczynia kalorymetrycznego dobiera się tak aby temperatura osłony t
z
zawierała się
między nią a przewidywaną temperaturą końcową kalorymetru w celu zmniejszenia do minimum wymiany ciepła z osłoną
podczas okresu głównego.
6.2. Bilans cieplny kalorymetru zwykłego.
Dla wyznaczenia ciepła wydzielonego Q oblicza się całkowity (poprawiony) przyrost temperatury kalorymetru
∆
t
c
.
Przyrost ten miałby miejsce podczas wydzielania się tego efektu cieplnego, lecz wtedy, gdy naczynie kalorymetryczne
byłoby izolowane adiabatycznie od otoczenia.
To ciepło wydzielone obliczamy:
Q = K
⋅
∆
t
c
(6.1)
gdzie : K - pojemność cieplna kalorymetru;
∆
t
c
- poprawiony przyrost temperatury:
∆
t
c
=
∆
t +
θ
(6.2)
gdzie:
∆
t = t
kk
– t
k0
- rzeczywisty przyrost temperatury w okresie głównym;
Θ
- poprawka na wymianę ciepła naczynia
kalorymetrycznego z otoczeniem.
W dokładnych pomiarach:
∆
t
c
= (t
kk
+
δ
k
) – (t
k0
+
δ
0
)+
θ
+ b
t
(6.3)
gdzie:
δ
k
,
δ
0
– poprawki na kalibrację termometru przy temperaturze t
kk
i t
k0
podane w świadectwie termometru;
b
t
- poprawka na wystający słupek rtęci obliczona z zależności:
b
t
=
β⋅
[t
gk
(t
gk
- t
ot
) – t
g0
(t
g0
– t
ot
)]
(6.4)
gdzie:
β
= 0,00016 – współczynnik rozszerzalności względnej rtęci w szkle, t
ot
– temperatura otoczenia w okresie pomiaru.

T-02.
Oznaczanie ciepła spalania i warto
ś
ci opałowej paliw stałych.
strona:
13/23
Równanie bilansu cieplnego naczynia kalorymetrycznego w dowolnym okresie w czasie d
τ
przybiera postać:
dQ + W
⋅
d
τ
= K
⋅
dt +
α
A(t – t
z
) d
τ
(6.5)
gdzie: dQ - ciepło wydzielone w kalorymetrze; Wd
τ
- praca mieszania (W - moc mieszania);
α
(t – t
z
)d
τ
- ciepło oddane do
osłony;
α
- współczynnik proporcjonalności.
Całkując równanie (6.5) w czasie trwania okresu głównego otrzymujemy:
(
)
(
)
−
−
−
+
∆
=
∫
n
n
z
K
W
d
t
t
K
t
Q
τ
τ
τ
τ
τ
α
0
0
(6.6)
Przez porównanie (6.1), (6.2) i (6.6) otrzymujemy
(
)
(
)
0
0
τ
τ
τ
α
τ
τ
−
−
−
=
Θ
∫
n
z
K
W
d
t
t
K
n
(6.7)
gdzie: (
τ
n
-
τ
0
) - czas trwania okresu głównego.
Oznaczając
z
z
t
K
K
W
t
K
′
=
+
α
α
, uzyskujemy
(
)
τ
α
τ
τ
d
t
t
K
n
z
∫
′
−
=
Θ
0
(6.8)
gdzie: t
z
' - jest poprawioną temperaturą osłony o wartość odpowiadającą zrównoważeniu pracy mieszania ciepłem
wymienionym dodatkowo z osłoną, tak by bilans cieplny kalorymetru nie uległ zmianie.
W okresie początkowym i końcowym dQ = O i równanie bilansu cieplnego (8) przyjmuje postać:
W
t
t
d
dt
K
z
=
−
+
)
(
α
τ
(6.9)
Okresy początkowy i końcowy są dużo krótsze od stałej czasowej kalorymetru K/
α
, można więc przyjąć, że zmiany
temperatury w tych okresach są liniowe.
Otrzymujemy więc równanie bilansu cieplnego dla tych okresów
(
)
(
)
=
′
−
+
=
′
−
+
W
t
t
Ka
W
t
t
Ka
z
z
α
α
2
1
(6.10)
gdzie: a
1
- średni przyrost temperatury w jednostce czasu w okresie początkowym; a
2
- średni przyrost temperatury
w jednostce czasu w okresie końcowym; t
p
- średnia temperatura okresu początkowego; t
k
- średnia temperatura
okresu końcowego.
Pomiar wyżej wymienionych wielkości a
1
, a
2
, t
p
, t
k
umożliwia wyznaczenie z równań (6.10) stałych
α
/K i t
z
',
można bowiem równania te zapisać w postaci:
′
=
+
′
=
+
z
k
z
p
t
K
t
K
a
t
K
t
K
a
α
α
α
α
2
1
(13)
stąd
p
k
t
t
a
a
K
−
−
=
2
1
α
i
2
1
2
1
a
a
a
t
a
t
t
p
k
z
−
−
=
′
(6.11)
T-02.
Oznaczanie ciepła spalania i warto
ś
ci opałowej paliw stałych.
strona: 14/23
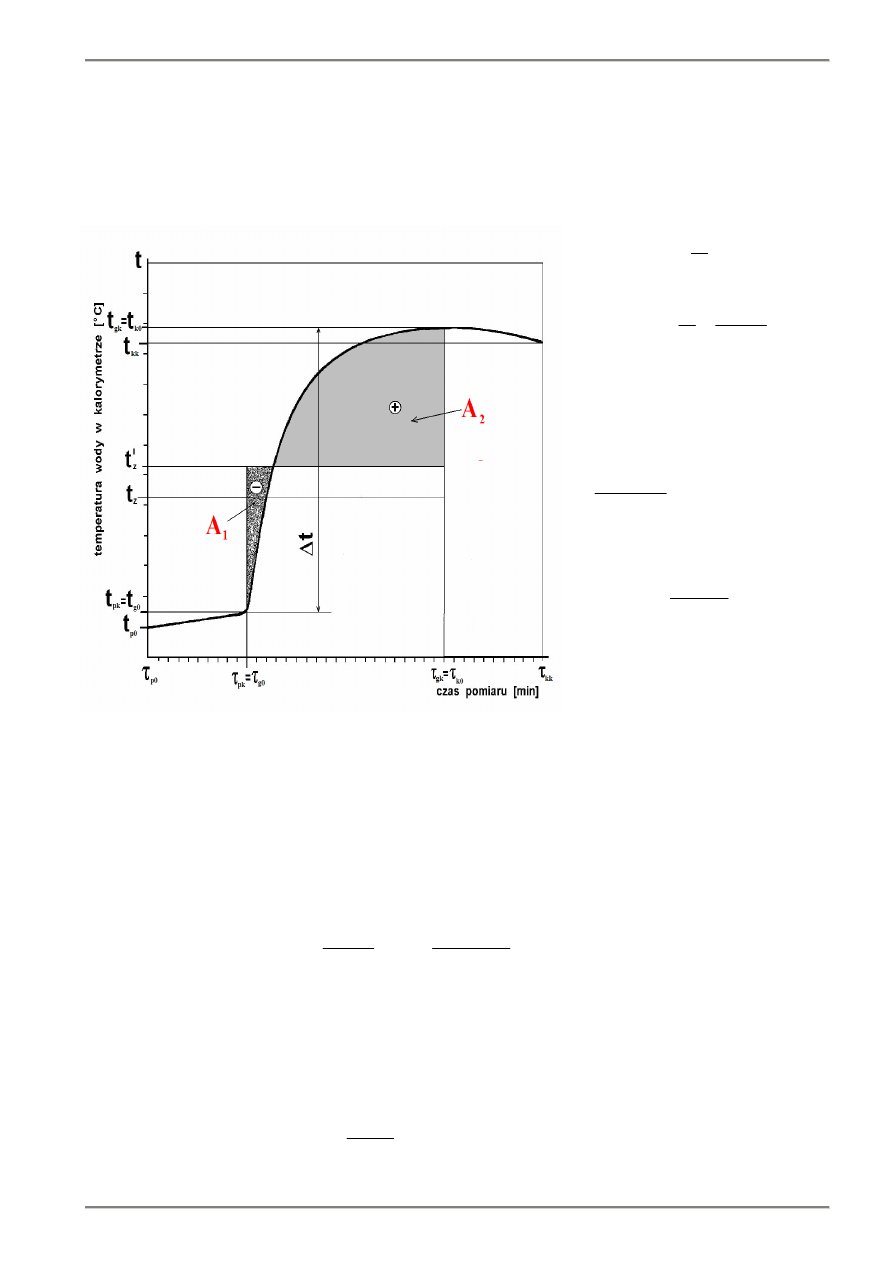
6.3 . Oznaczenie poprawki temperaturowej metodą wykreślną
Poprawkę temperaturową można wyznaczyć ze wzorów (6.8) i (6.11) jeśli mamy jest przebieg temperatury w czasie
w okresach początkowym, głównym i końcowym.
Całkę we wzorze (6.6, 6.7, 6.8) znajdujemy wyznaczając pola powierzchni zawartej między linią przebiegu zmian
temperatury w okresie głównym a prostą poziomą t = t'
z
(najwygodniej na wykresie wykonanym na papierze
milimetrowym) i sumując je z odpowiednim znakiem biorąc pod uwagę przelicznik jednostek (rys. 6.2).
(
)
τ
α
τ
τ
d
t
t
K
n
z
∫
′
−
=
Θ
0
p
k
t
t
a
a
K
−
−
=
2
1
α
( )
A
c
d
t
t
A
A
a
z
n
∆
⋅
=
−
=
−
∫
τ
τ
τ
0
'
1
2
(
)
⋅
2
0
min
mm
C
c
a
- współczynnik
przeliczeniowy zależny od skali wykresu
A
c
t
t
a
a
a
g
k
wykr
∆
Θ
⋅
⋅
−
−
=
0
0
2
1
Rys.6.2. Zależność temperatury wody w naczyniu kalorymetru od czasu podczas wyznaczania ciepła spalania – wyznaczanie
poprawki temperatury metodą wykreślną
6.4. Oznaczenie poprawki temperaturowej metodą rachunkową
Poprawkę temperaturową można też obliczyć w sposób czysto rachunkowy podstawiając zależność (6.11) do (6.8)
otrzymujemy
(
)
0
2
1
2
1
0
τ
τ
τ
τ
τ
−
−
−
−
−
−
=
Θ
∫
n
k
k
p
k
p
k
n
t
t
a
t
a
t
td
t
t
a
a
(6.12)
Należy jeszcze obliczyć całkę z przebiegu temperatury naczynia kalorymetrycznego w okresie głównym.
Dla jego wyznaczenia oraz dla określenia wielkości a
1
, a
2
, t
p
, t
k
. dokonuje się pomiarów temperatury kalorymetru,
we wszystkich okresach pomiarowych co pewien z góry ustalony i jednakowy odstęp czasu. Odstęp ten jest uznany za
jednostkę czasu (również do obliczenia a
1
i a
2
).
Przyjęcie tej w zasadzie dowolnej jednostki czasu nie wpływa na wynik obliczeń, to jest na wartość Q. Jeśli kolejne
temperatury pomierzone w okresie głównym są: t
o
, t
1
, t
2
..... t
n
w odstępach czasu
∆τ
= 1 to korzystając z metody trapezów
mamy:
∑
∫
−
=
=
+
+
=
1
1
0
2
0
n
i
i
i
n
t
t
t
td
n
τ
τ
τ
gdzie
τ
0
-
τ
1
= n
(6.13)
T-02.
Oznaczanie ciepła spalania i warto
ś
ci opałowej paliw stałych.
strona:
15/23
podstawiając powyższe do równania (6.12) otrzymujemy poprawkę temperaturową
Θ
RP
, która nosi nazwę poprawki
Regnaulta - Pfaundlera.:
n
a
a
a
t
a
t
t
t
t
t
t
a
a
p
k
n
i
i
gi
gk
g
p
k
RP
⋅
−
⋅
−
⋅
−
+
−
−
−
=
∑
−
=
=
2
1
2
1
1
1
0
2
1
2
Θ
(6.14)
gdzie: n – liczba jednostek minutowych okresu głównego; a
1
– średni przyrost temperatury okresu początkowego
przypadający na jedną minutę; a
2
– średni przyrost temperatury okresu końcowego przypadający na jedną minutę; t
p
i t
k
- średnie temperatury okresu początkowego i końcowego; t
0
= t
g0
– temperatura początkowa okresu głównego
(ostatni odczyt okresu początkowego); t
n
= t
gk
– ostatni odczyt okresu głównego (początkowa temperatura okresu
końcowego); t
gi
– kolejne temperatury okresu głównego odczytywane w okresach jednominutowych.
Wielkość a
1
i a
2
oblicza się jako średnią arytmetyczną z przyrostów temperatury w jednostkach pomiarowych
odstępach czasu
∆τ
okresu początkowego i końcowego, t
p
i t
k
jako średnie arytmetyczne temperatur pomierzonych
w odpowiednich okresach.
Najczęściej
∆τ
= 0,5 min, czas okresu początkowego i końcowego t
o
- t
p
= t
k
-
t
n
= 10
⋅
∆τ
= 5 min.
Na podstawie przeprowadzonej analizy wymiany ciepła w kalorymetrze zalecane jest wyznaczanie poprawki
temperaturowej dla bardzo dokładnych pomiarów ciepła spalania przy pomocy bomby kalorymetrycznej z zależności
(
)
+
−
−
−
∆
−
+
+
+
−
−
−
∆
=
Θ
∑
∑
−
=
−
+
=
1
1
0
1
1
1
2
2
2
m
i
m
g
i
z
ps
z
n
m
i
gk
gm
i
z
z
ks
t
t
t
mt
t
t
a
t
t
t
t
m
n
t
t
a
τ
τ
(6.15)
gdzie: a
1
, a
2
- oblicza się jako średnie z przyrostów temperatury w okresie początkowym i końcowym w jednakowych
odstępach czasu
∆τ
= 30 s; m - liczba pół minut okresu głównego do momentu, kiedy temperatura wody w kalorymetrze
zrówna się z temperaturą wody w osłonie, tj. t
m
= t
z
.
Całkę we wzorze (6.12) można obliczyć w sposób znacznie uproszczony przyjmując, że pierwsza temperatura
okresu głównego t
o
= t
p
, oraz, że do n - tego odczytu przebieg temperatury ma charakter liniowy a następnie temperatura
naczynia kalorymetrycznego jest stała i równa temperaturze okresu końcowego.
Ten założony przebieg temperatury kalorymetru przedstawiony jest na rys. 8.
Rys. 6.3. Założony przebieg temperatury
kalorymetru
Przy powyższych założeniach:
(
)
m
n
t
m
t
t
td
k
k
p
n
−
+
⋅
+
=
∫
τ
τ
τ
0
2
(6.16)
Podstawiając powyższe do wzoru (15) otrzymujemy poprawkę temperaturową wyznaczoną wg Buntego
Θ
B
(
)
m
n
a
m
a
a
B
−
−
⋅
+
−
=
Θ
2
2
1
2
(6.17)
gdzie: n – liczba jednostek minutowych okresu głównego; m - liczba minut okresu głównego do momentu, kiedy
temperatura wody w kalorymetrze zrówna się z temperaturą wody w osłonie, tj. t
m
= t
z
.; a
1
– średni przyrost temperatury
okresu początkowego przypadający na jedną minutę; a
2
– średni przyrost temperatury okresu końcowego przypadający na
jedną minutę;

T-02.
Oznaczanie ciepła spalania i warto
ś
ci opałowej paliw stałych.
strona: 16/23
Zgodnie z Polskimi Normami dla oznaczania ciepła spalania węgla przyjmuje się m = 1 i otrzymuje się zależność
dla wyznaczenia poprawki temperaturowej wg PN -
Θ
PN
(
)
1
2
2
2
1
−
−
+
−
=
Θ
n
a
a
a
PN
(6.18)
gdzie: n – liczba jednostek minutowych okresu głównego; a
1
– średni przyrost temperatury okresu początkowego
przypadający na jedną minutę; a
2
– średni przyrost temperatury okresu końcowego przypadający na jedną minutę;
Jedną z głównych trudności oznaczenia wydzielonego efektu cieplnego w kalorymetrze zwykłym wyżej
przedstawioną metodą jest trudność w określeniu końca okresu głównego pomiaru.
Przyjmuje się więc, że zakończenie okresu głównego pomiaru następuje po pięciu kolejnych odczytach
jednakowych temperatur kalorymetru.
7. OKREŚLENIE CIEPŁA SPALANIA.
Efekt cieplny wydzielony w kalorymetrze jest sumą efektu cieplnego spalania odważki paliwa w ubocznych efektów
cieplnych, które pojawiają się w bombie kalorymetrycznej. Ich źródłem jest synteza kwasów azotowego i siarkowego oraz
spalenie drutu i nitki bawełnianej doprowadzającej płomień do paliwa
Aby dokładnie ustalić ciepło spalania paliwa należy określić ilość odpowiednich kwasów powstałych w bombie
kalorymetrycznej. Można togo zaniechać stosując odpowiedni współczynnik korygujący oraz znając zawartość siarki
w badanym paliwie.
Ciepło spalania można obliczyć ze wzoru:
S
k
m
m
Q
m
Q
m
f
Q
Q
d
sd
b
sb
a
s
⋅
−
⋅
−
⋅
−
−
=
1
(7.1)
gdzie: Q
s
a
- ciepło spalania paliwa w stanie analitycznym (stanie, w jakim znajduje się próbka, z której pobrano odważkę
do spalenia); Q - wyznaczona wielkość efektu cieplnego w kalorymetrze; Q
sb
- ciepło spalania bawełny; Q
sd
- ciepło
spalania drutu stalowego; m - masa odważki paliwa; m
b
-w masa nitki bawełnianej; m
d
- masa spalonego drutu;
f -współczynnik korygujący dla węgla f = 0,0015 g; dla koksu f = 0,001 g; S -procentowa zawartość siarki
w paliwie; k - umowne ciepło syntezy i rozpuszczania kwasu siarkowego odniesiona do 1% zawartości siarki
w paliwa; k = 95 J/g.
7.1. Oznaczenie pojemności cieplnej kalorymetru.
Oznaczanie efektu cieplnego wydzielonego w kalorymetrze wymaga znajomości jego pojemności cieplnej.
Dla jej wyznaczenia w kalorymetrach do oznaczania ciepła spalania spala się w bombie odważkę pewnego wzorca
termochemicznego o znanym cieple spalania. Wzorcem tym jest najczęściej kwas benzoesowy o cieple spalania:
Q
swz
= 26 456 kJ/kg.
Przyrost temperatury kalorymetru jest mierzony i obliczany tak samo jak podczas pomiaru ciepła spalania.
Dla określenia ilości kwasu azotowego powstałego w bombie kalorymetrycznej przemywa się ją wodą destylowaną
którą po wlaniu do naczynia i ogrzaniu do wrzenia miareczkuje się 0,1 n KOH w obecności fenoloftaleiny do uzyskania
trwałego różowego zabarwienia.
Pojemność cieplną kalorymetru wyznaczamy ze wzoru:
c
d
sd
b
sb
wz
swz
t
V
c
m
Q
m
Q
m
Q
K
∆
⋅
+
⋅
+
⋅
+
⋅
=
(7.2)
gdzie: m
wz
- — masa spalonego wzorca termochenicznego; m
b
- masa nitki bawełnianej; m
d
- masa spalonego drutu;
Q
swz
- ciepło spalania wzorca termochemicznego; Q
sb
- ciepło spalania bawełny; Q
sd
- ciepło spalania drutu stalowego;
c - ciepło syntezy 0, 1 n kwasu azotowego; c = 6 J/ml; V [ml] - ilość zużytego do miareczkowania 0,1 n KOH;
∆
t
c
- przyrost temperatury kalorymetru (dla kalorymetru zwykłego poprawiony przyrost temperatury).

T-02.
Oznaczanie ciepła spalania i warto
ś
ci opałowej paliw stałych.
strona:
17/23
Wyznaczona pojemność cieplna kalorymetru K jest sumą pojemności cieplnej wody K
w
wypełniającej naczynie
kalorymetryczne i tzw. wartości wodnej kalorymetru X, którą stanowi pojemność cieplna naczyń kalorymetrycznych
K = K
w
+ X
(7.3)
gdzie: K
w
= c
pw
. m
w;
- pojemność cieplna wody;
c
pw
- średnie ciepło właściwe wody w okresie mierzonych temperatur;
m
w
- masa wody w naczyniu kalorymetrycznym.
7.1. Obliczanie ciepła spalania na podstawie pomiaru przy pomocy kalorymetru.
Ciepło spalania obliczamy ze wzoru:
m
m
Q
m
Q
m
f
t
K
S
k
m
m
Q
m
Q
m
f
Q
Q
d
sd
b
sb
c
d
sd
b
sb
a
s
⋅
−
⋅
−
−
⋅
=
⋅
−
⋅
−
⋅
−
−
=
1
1
∆
(
)
(
) (
)
S
k
m
m
Q
m
Q
m
f
t
X
c
m
S
k
m
m
Q
m
Q
m
f
t
K
Q
d
sd
b
sb
w
w
d
sd
b
sb
a
s
⋅
−
⋅
−
⋅
−
−
+
⋅
+
⋅
=
⋅
−
⋅
−
⋅
−
−
+
⋅
=
1
1
θ
θ
∆
∆
(7.4)
gdzie: Q
s
a
- ciepło spalania paliwa w stanie analitycznym (stanie, w jakim znajduje się próbka, z której pobrano odważkę
do spalenia); Q - wyznaczona wielkość efektu cieplnego w kalorymetrze;
∆
t - rzeczywisty przyrost temperatury w
okresie głównym;
Θ
- poprawka na wymianę ciepła naczynia kalorymetrycznego z otoczeniem; K – pojemność
cieplna kalorymetru, K
w
= c
pw
. m
w;
- pojemność cieplna wody;
c
pw
- średnie ciepło właściwe wody w okresie
mierzonych temperatur; m
w
- masa wody w naczyniu kalorymetrycznym, X - pojemność cieplna naczyń
kalorymetrycznych; Q
sb
- ciepło spalania bawełny; Q
sd
- ciepło spalania drutu stalowego; m - masa odważki
paliwa; m
b
-w masa nitki bawełnianej; m
d
- masa spalonego drutu; f -współczynnik korygujący dla węgla
f = 0,0015 g; dla koksu f = 0,001 g; S -procentowa zawartość siarki w paliwie; k - umowne ciepło syntezy
i rozpuszczania kwasu siarkowego odniesiona do 1% zawartości siarki w paliwa; k = 95 [J/g].
8. OBLICZANIE WARTOŚCI OPAŁOWEJ.
Wartość opałowa paliwa Q
j
a
, w kJ/kg, w stanie analitycznym oblicza się ze wzoru:
Q
j
a
= Q
s
a
– 2455(8,94 H
a
– W
a
)
⋅
0,01
(8.1)
gdzie: Q
s
a
- ciepło spalania próbki analitycznej, w kJ/kg; H
a
- zawartość wodoru w próbce analitycznej, w %;
W
a
- zawartość wilgoci w próbce analitycznej, %; 2455 kJ/kg - ciepło parowania wody, przyjęto zgodnie
z PN- 81/G- 04513; 8.94 - współczynnik liczbowy, wynika z dokładnej wartości masy atomowej wodoru, równej
1,008.
Jeżeli zawartość wodoru H
a
, w %, w paliwie nie jest znana, przybliżona jej wartość można obliczyć z zależności:
-
dla węgla kamiennego:
5
,
18
100
a
a
a
W
A
H
−
−
=
(8.2)
-
dla węgla brunatnego:
18
100
a
a
a
W
A
H
−
−
=
(8.3)
gdzie: A
a
, W
a
- zawartość popiołu i wilgoci higroskopijnej w próbce analitycznej, %.

T-02.
Oznaczanie ciepła spalania i warto
ś
ci opałowej paliw stałych.
strona: 18/23
Przeliczanie wartości opałowej ze stanu analitycznego na inny stan przelicza się wg zależności podanych w PN-
81/G-04513 - Paliwa stałe. Oznaczanie ciepła spalania i obliczanie wartości opałowej - i tak:
-
na stan roboczy:
100
2455
100
2455
100
100
r
t
a
a
j
a
r
t
r
j
W
W
Q
W
W
Q
−
⋅
+
−
−
=
(8.4)
gdzie: W
t
r
- zawartość wilgoci całkowitej w paliwie, %.
-
na stan bezpopiołowy - suchy:
+
−
−
=
100
2455
100
100
a
a
j
a
a
daf
j
W
Q
A
W
Q
(8.5)
9. PRZEBIEG ĆWICZENIA.
9.1. Oznaczenie pojemności cieplnej kalorymetru.
•
Napełnić naczynie kalorymetryczne wodą o temperaturze około 1°C niższą od temperatury płaszcza wodnego w ilości
m = 2400 g.
•
Przygotować około 10 cm nitki bawełnianej i zważyć ją na wadze analitycznej.
•
Przygotować pastylkę z wzorca termochemicznego przez sprasowanie razem z jednym końcem nitki i zważyć na
wadze analitycznej. (masa pastylki powinna być 1,3
÷
1,5 g).
•
Zważyć około 5 cm drutu stalowego na wadze analitycznej.
•
Załadować bombę przez ułożenie pastylki w tyglu, złożenie drutu między elektrodami i przewieszenie na nim nitki
bawełnianej oraz napełnienie bomby tlenem do ciśnienia 20
÷
25 atn.
•
Unieść bombę z podłączonymi przewodami zapłonowymi w naczyniu kalorymetrycznym umieścić w nim mieszadło
i termometr, zamknąć kalorymetr i włączyć mieszadło.
•
Po okresie wyrównania się temperatur (około 5 min.) rozpocząć okres pomiarowy Wszystkich odczytów temperatur
kalorymetru dokonywać w odstępach 0,5 min.
Okres początkowy składa się z 11-tu pomiarów temperatury. Ostatnia temperatura okresu początkowego jest pierwszą
temperaturą okresu głównego i w chwili jej odczytu należy włączyć zapłon paliwa.
Okres główny kończy się po odczycie pięciu jednakowych temperatur z dokładnością do 0,005°C
Ostatnia temperatura okresu głównego jest pierwszą temperaturą okresu końcowego. Okres końcowy składa się z 11-
tu pomiarów temperatury (5 minut).
•
Po zakończeniu pomiaru rozładować kalorymetr i bombę oraz oczyścić bombę. Zważyć pozostały po spaleniu
w bombie drut stalowy i wyznaczyć ilość drutu spalonego.
9.2. Oznaczenie ciepła spalania węgla.
Pomiar wykonać zgodnie z punktem 9.1. zastępując pastylkę wzorca termochemicznego pastylką wykonaną ze
sproszkowanego paliwa.
Wyniki pomiarów przedstawić w tablicy 9.1.

T-02.
Oznaczanie ciepła spalania i warto
ś
ci opałowej paliw stałych.
strona:
19/23
10. OBLICZENIA BŁĘDU LABORATORYJNEGO OZNACZANIA CIEPŁA
SPALANIA NA PODSTAWIE WYNIKÓW POMIARU.
Ciepło spalania oblicza się z zależności (7.4)
(
) (
)
S
k
m
m
Q
m
Q
m
f
t
X
c
m
Q
d
sd
b
sb
w
w
a
s
⋅
−
⋅
−
⋅
−
−
+
⋅
+
⋅
=
1
θ
∆
(10.1)
gdzie: Q
s
a
[kJ/kg]- ciepło spalania paliwa w stanie analitycznym (stanie, w jakim znajduje się próbka, z której pobrano
odważkę do spalenia); c
pw
[kJ/kg
⋅
K]- średnie ciepło właściwe wody w okresie mierzonych temperatur;
m
w
[kg] - masa wody w naczyniu kalorymetrycznym, X[kJ/K] - pojemność cieplna naczyń kalorymetrycznych;
∆
t - rzeczywisty przyrost temperatury w okresie głównym;
Θ
- poprawka na wymianę ciepła naczynia
kalorymetrycznego z otoczeniem; Q
sb
[kJ/kg] - ciepło spalania bawełny; Q
sd
[kJ/kg] - ciepło spalania drutu
stalowego; m [kg] - masa odważki paliwa; m
b
[kg] -w masa nitki bawełnianej; m
d
[kg] - masa spalonego drutu;
f -współczynnik korygujący dla węgla f = 0,0015 g; dla koksu f = 0,001 g; S -procentowa zawartość siarki
w paliwie; k - umowne ciepło syntezy i rozpuszczania kwasu siarkowego odniesiona do 1% zawartości siarki
w paliwa; k = 95 [J/g].
Wyznacza się wartości średnie wielkości mierzonych: m
w
; m; m
d
;
∆
t; X – oraz dla wielkości nie podlegających
pomiarowi: c
w
;
θ
; f.
Ustala odchylenia standardowe każdej z mierzonych wielkości:
w
m
σ
;
m
σ
;
d
m
σ
;
t
∆
σ
;
X
σ
;
w
c
σ
;
θ
σ
;
f
σ
biorąc
pod uwagę dokładność pomiarów dla zastosowanych przyrządów pomiarowych.
Wariancję i odchylenie standardowe wielkości Q
s
a
oblicza się w tym przypadku z zależności (przykład patrz [1],
rozdz.1.10 - szczegółowy opis w przykładzie obliczeniowym)
∑
=
i
x
i
a
s
a
s
i
dx
dQ
Q
D
2
2
2
σ
gdzie: x
i
– mierzone wielkości lub zależne od nich;
i
x
σ
- błąd pomiaru mierzonych wielkości
W tym celu oblicza się pochodne Q
s
a
(zależność 10.1) względem jej zmiennych i ustalono ich wartość liczbową dla
wartości średnich z pomiarów
w
a
s
m
Q
∂
∂
;
m
a
s
m
Q
∂
∂
;
d
a
s
m
Q
∂
∂
;
t
Q
a
s
∆
∂
∂
;
X
Q
a
s
∂
∂
;
w
a
s
c
Q
∂
∂
;
θ
∂
∂
a
s
Q
;
f
Q
a
s
∂
∂
2
2
2
2
2
2
2
2
2
2
2
2
2
2
2
2
f
a
s
a
s
c
w
a
s
X
a
s
t
a
s
m
d
a
s
m
a
s
m
w
a
s
Q
f
Q
Q
c
Q
X
Q
t
Q
m
Q
m
Q
m
Q
w
d
w
a
s
σ
σ
θ
σ
σ
σ
σ
σ
σ
σ
θ
∂
∂
+
∂
∂
+
∂
∂
+
∂
∂
+
∂
∂
+
∂
∂
+
∂
∂
+
∂
∂
=
∆
∆
Samą wartość Q
s
a
oblicza się podstawiając wartości średnie wielkości mierzonych do wzoru (7.4)
Jeżeli jako przedział ufności przyjmuje się ±3
⋅
a
s
Q
σ
, to wynik pomiaru ciepła spalania określamy z dokładnością
Q
s
a
= Q
s
a
± 3
⋅
a
s
Q
σ
,

T-02.
Oznaczanie ciepła spalania i warto
ś
ci opałowej paliw stałych.
strona: 20/23
11. OPRACOWANIE WYNIKÓW POMIARU.
•
Wykorzystując wyniki pomiarów (tablica 9.1)., wykonać wykresy przebiegu temperatury kalorymetru w czasie
pomiarów pojemności cieplnej kalorymetru i ciepła spalania paliwa.
•
Wyznaczyć pojemność cieplną kalorymetru wg wzoru (7.2) metodą poprawionego przyrostu temperatury, obliczając
poprawkę temperatury metodą obliczeniową (w przypadku pomiaru pojemności cieplnej kalorymetru).
•
Wyznaczyć poprawki temperaturowe i poprawione przyrosty temperatury dla pomiaru ciepła spalania paliwa
metodami: wykreślną (bezpośrednio z wykresu), Regnaulta-Pfaundlera, Buntego, ze wzoru (6.15)
(
przyjmując pewną
aproksymację liniową ze wzrostu temperatury w okresie głównym) oraz poprawkę wg Polskiej Normy.
•
Wyznaczyć efekt cieplny wydzielony w kalorymetrze oraz ciepło spalania paliwa Q
s
a
zgodnie z wzorem (7.4)
z uwzględnieniem uprzednio określonych poprawek temperaturowych różnymi metodami. Porównać wyniki.
•
Obliczyć zawartość wilgoci i popiołu w badanym węglu.
•
Obliczyć wartość opałową badanego paliwa z zależności (8.1), (8.4) i (8.5).
•
Obliczyć błąd wykonanego oznaczenia ciepła spalania (przykład patrz [1], rozdz.1.10 - szczegółowy opis w przykładzie
obliczeniowym)
•
Wyniki zestawić w tablicy
•
Przedstawić własne wnioski i uwagi.
LITERATURA:
1.
Praca zbiorowa: Pomiary cieplne. Cz. I. Podstawowe pomiary cieplne. WNT, Warszawa 1995; 2001.
2.
Wiśniewski S.: Termodynamika techniczna. WNT, Warszawa 1987.
3.
Odpowiednie Polskie Normy (m. in. PN-ISO 1928:2002 Paliwa stałe - Oznaczanie ciepła spalania metodą
spalania w bombie kalorymetrycznej i obliczanie wartości opałowej; PN-ISO 1171:2002 Paliwa stałe -
Oznaczanie popiołu)
4.
Dokumentacja Techniczno-Ruchowa. Kalorymetr KL-10. Spółdzielnia Pracy "Precyzja" w Bydgoszczy.
5.
Hnatkow R.: Doskonalenie techniki oznaczania ciepła spalania na przykładzie kwasu benzoesowego. PAK, 1983,
nr 10, s. 331-333.
6.
Kordylewski W. (red.): Spalanie i paliwa. Oficyna Wydawnicza Politechniki Wrocławskiej; Wrocław 1999.
7.
Mielecki T.: Wiadomości o badaniu i własnościach węgla. Śląsk. Katowice 1972.
8.
Rudnicki R.: Określenie poprawki różnicy temperatur uwzględniającej przepływ ciepła miedzy układem
a otoczeniem przy pomiarach kalorymetrycznych. PAK, 1976, nr 8, s.272-274.
T-02.
Oznaczanie ciepła spalania i warto
ś
ci opałowej paliw stałych.
strona:
21/23
Ćwiczenie - T02
TABELA POMIAROWA
Data
Grupa
DZIEŃ MIESIĄC
ROK
P
ALIWO
:
Rodzaj: …………………………. Typ: ……………………… Sortyment: ……..……..
OZNACZANIA ZAWARTOŚCI WILGOCI I POPIOŁU W WĘGLU
Tablica pomiarowa 3.2.
Oznaczenie zawartości wilgoci przemijającej W
ex
r
[%]
Próbka 1
Próbka 2
Próbka 3
masa tacy
m
3
[g]
masa tacy z odważką paliwa przed suszeniem
m
1
[g]
masa tacy z odważką paliwa po suszeniu
m
2
[g]
zawartość wilgoci przemijającej w próbce
W
ex
r
[%]
Ś
rednia zawartość wilgoci przemijającej
W
ex
r
[%]
Tablica pomiarowa 3.3.
Oznaczenie zawartości wilgoci higroskopijnej metodą suszarkową
w próbce analitycznej paliwa W
a
[%]
Próbka 1
Próbka 2
Próbka 3
masa naczynia
m
6
[g]
masa naczynia z odważką paliwa przed suszeniem
m
4
[g]
masa naczynia z odważką paliwa po suszeniu
m
5
[g]
zawartość wilgoci analitycznej (higroskopijnej) w próbce
W
a
[%]
Ś
rednia zawartość wilgoci analitycznej (higroskopijnej)
W
a
[%]
Tablica pomiarowa 3.4.
Oznaczenie zawartości popiołu w próbce analitycznej paliwa stałego A
a
[%]
Próbka 1
Próbka 2
Próbka 3
masa tygielka
m
1
[g]
masa tygielka z odważką paliwa przed spopieleniem
m
2
[g]
masa tygielka z popiołem
m
3
[g]
zawartość popiołu w próbce analitycznej
A
a
[%]
Ś
rednia zawartość popiołu w próbce
A
a
[%]
T-02.
Oznaczanie ciepła spalania i warto
ś
ci opałowej paliw stałych.
strona: 22/23
9.1. Tabela pomiarów dla oznaczenia ciepła spalania węgla
Masa wody w naczyniu
kalorymetrycznym
m
w
[kg]
Masa drutu założonego do elektrod
m
d1
[g]
Masa nici bawełnianej
m
b
[g]
Masa drutu pozostałego po spaleniu m
d2
[g]
Masa pastylki paliwa z nicią
m + m
b
[g]
Masa drutu spalonego
m
d
[g]
Masa pastylki paliwa
m [g]
Wartość wodna kalorymetru
X
Ciepło właściwe wody
dla temperatury t
z
(z tablic)
c
w
[kJ/kg
⋅
K]
Stała kalorymetru K
K = X + c
w
⋅
m
w
Ciepło spalania kwasu
benzoesowego Q
swz
26456 kJ/kg
Ciepło spalania
bawełny Q
sb
17460 kJ/kg
Ciepło spalania drutu
chromonikielinowego Q
sd
6700 kJ/kg
Pomiar temperatury wody w naczyniu kalorymetrycznym
Lp
Okres początkowy
Lp.
Okres główny
Lp.
Okres końcowy
Temperatura osłony
t
p
[
°
C]
a
1
[
°
C/½min]
t
g
[
°
C]
t
k
[
°
C]
a
2
[
°
C/½min]
Lp.
t
z
[
°
C]
0
0
0
0
1
1
1
1
2
2
2
2
3
3
3
3
4
4
4
4
5
5
5
5
6
6
6
6
7
7
7
7
8
8
8
8
9
9
9
9
10
10
10
10
a
1i
= t
pi
– t
p(i-1)
wartość średnia
a
1
= [
°
C/½min]
a
1
= [
°
C/min]
11
a
2i
= t
ki
– t
k(i-1)
wartość średnia
a
2
= [
°
C/½min]
a
2
= [
°
C/min]
11
12
12
13
13
14
14
15
15
16
16
17
17
18
18
19
19
20
20
21
21
22
22
23
23
24
24
25
25
26
26
27
27
28
28
29
29
30
30
31
31
32
32
33
33
34
34
35
35
36
36
37
37
38
38
39
39
40
40
Średnia
Średnia
Średnia
Średnia
T-02.
Oznaczanie ciepła spalania i warto
ś
ci opałowej paliw stałych.
strona:
23/23
Ćwiczenie nr T-02
Data
Grupa
DZIEŃ MIESIĄC
ROK
P
ALIWO
:
Rodzaj: …………………………. Typ: ……………………… Sortyment: ……..……..
ZESTAWIENIE WYNIKÓW OBLICZEŃ I OZNACZEŃ
Wyniki oznaczeń zawartości wilgoci wg. PN
Zawartość wilgoci przemijającej
W
ex
%
Zawartość wilgoci w próbce powietrzno-suchej (analitycznej)
W
a
%
Zawartość wilgoci całkowitej
W
t
r
%
Wyniki oznaczeń zawartości popiołu wg. PN
Zawartość popiołu w próbce analitycznej
A
a
%
Zawartość popiołu w próbce roboczej
A
r
%
Wyniki oznaczeń ciepła spalania i wartości opałowej wg. PN
Oznaczenie poprawki temperaturowej metodą wykreślną
Θ
wykr
deg
Oznaczenie poprawki temperaturowej Regnaulta - Pfaundlera
Θ
RP
deg
Oznaczenie poprawki temperaturowej wzór 6.15
Θ
Rud
deg
Oznaczenie poprawki temperaturowej wg Buntego
Θ
B
deg
Oznaczenie poprawki temperaturowej wg PN
Θ
PN
deg
Oznaczenie poprawki temperaturowej metodą wykreślną
Θ
wykr
deg
Ciepło spalania próbki analitycznej wg PN
Q
s
a
kJ/kg
Ciepło spalania próbki paliwa roboczego wg PN
Q
s
r
kJ/kg
Wartość opałowa próbki analitycznej wg PN
Q
j
a
kJ/kg
Wartość opałowa próbki paliwa roboczego wg PN
Q
j
r
kJ/kg
Ciepło spalania próbki paliwa suchego bezpopiołowego wg PN
Q
s
daf
kJ/kg
Wartość opałowa próbki paliwa suchego bezpopiołowego wg PN
Q
j
daf
kJ/kg
Dokładność pomiaru ciepła spalania
±3
⋅
a
s
Q
σ
kJ/kg
Wyszukiwarka
Podobne podstrony:
Sprawko 3 spalanie paliw stałych
5 Spalanie paliw stalych
3 Spalanie paliw stałych
Znaczenie dodatków paliwowych w procesach spalania paliw stałych Chyc
5 Spalanie paliw stalych
Ciepło spalania i wartość opałowa paliw stałych
Ciepło spalania i wartość opałowa paliw stałych
fizyczna cieplo spalania wykres
3 Spalanie paliw gazowych
Spalanie paliw 2012
zawiejski, inżynieria materiałowa - semestr 4, Inżynieria Materiałowa pwr - semestr 4, Chemia Fizycz
Pracownia Paliw Stałych - KOLOKWIUM1, Energetyka AGH, semestr 4, IV Semestr, Technika Cieplna, LAB
ciepło właściwe ciał stałych poprawione
Ocena wydajności wytlewania naturalnych paliw stałych
2Podstawowe wiadomości o spalaniu paliw lot
Ciepło spalania DRUK
cieplo spalania w bombie, SGSP, SGSP, cz.1, fizykochemia splania, Fizykochemia spalania
Spalanie paliw ciekłych
więcej podobnych podstron