2.1 Kwantowa teoria atomów
Nasza wiedza o elektronowej budowie atomów powstała głównie dzięki badaniu światła
wysyłanego przez atomy, pobudzane działaniem wysokiej temperatury, łuku elektrycznego lub
iskry. Światło emitowane przez atomy składa się z linii o określonych częstotliwościach drgań;
określa się je jako widmo liniowe atomu.
Szczegółowe badania widm rozpoczęto w ok.1880 roku. Pierwsi badacze osiągnęli postęp w
interpretacji widm i w rozpoznawaniu prawidłowości w częstościach poszczególnych linii. Na
przykład częstości linii widmowych atomu wodoru wykazują szczególny prosty związek liczbowy
między sobą, który będzie opisany w dalszej części.
Niemniej jednak dopiero w 1913 r. Opracowano interpretację widm atomu wodoru, opierając się na
jego budowie elektronowej. W tym właśnie roku Bohr z powodzeniem zastosował do tego
zagadnienia teorię kwantów i położył w ten sposób podwaliny pod niezwykły postęp z zrozumieniu
istoty materii, dokonany w ciągu ubiegłych lat.
Kwantowa teoria atomu wodoru
Atom wodoru składa się z elektronu i protonu. Wzajemne oddziaływanie ich ładunków
elektrycznych zmienia się odwrotnie proporcjonalnie do kwadratu ich odległości. Gdyby prawo
ruchu Newtona można było zastosować do atomu wodoru, należałoby oczekiwać, że elektron jako
lekki w porównaniu z jądrem będzie krążył dookoła jądra po orbicie eliptycznej. Najprostszą orbitą
dla elektronu poruszającego się dookoła jądra byłoby koło, a prawo ruchu Newtona dopuszczają
wielkość tego koła , wynikającą z energii układu.
Model ten rozpatrywali fizycy interesujący się budową atomu. Okazało się, że dawniejsza teoria
ruchu cząsteczek oraz teoria elektryczności i magnetyzmu nie mogą znaleźć zastosowania do
atomu.
Gdyby elektron krążył dookoła jądra powinien, zgodnie z teorią elektromagnetyczną wysyłać
światło o częstotliwości równej częstotliwości obiegu elektronu w atomie.
Jednak w miarę wysyłania przez atom energii w formie światła, elektron poruszałby się po kole o
promieniu malejącym, zbliżając się stopniowo do jądra, a częstość obiegu stopniowo by wzrastała.
Wobec tego należałoby oczekiwać, że atom wodoru będzie emitował światło o wszystkich
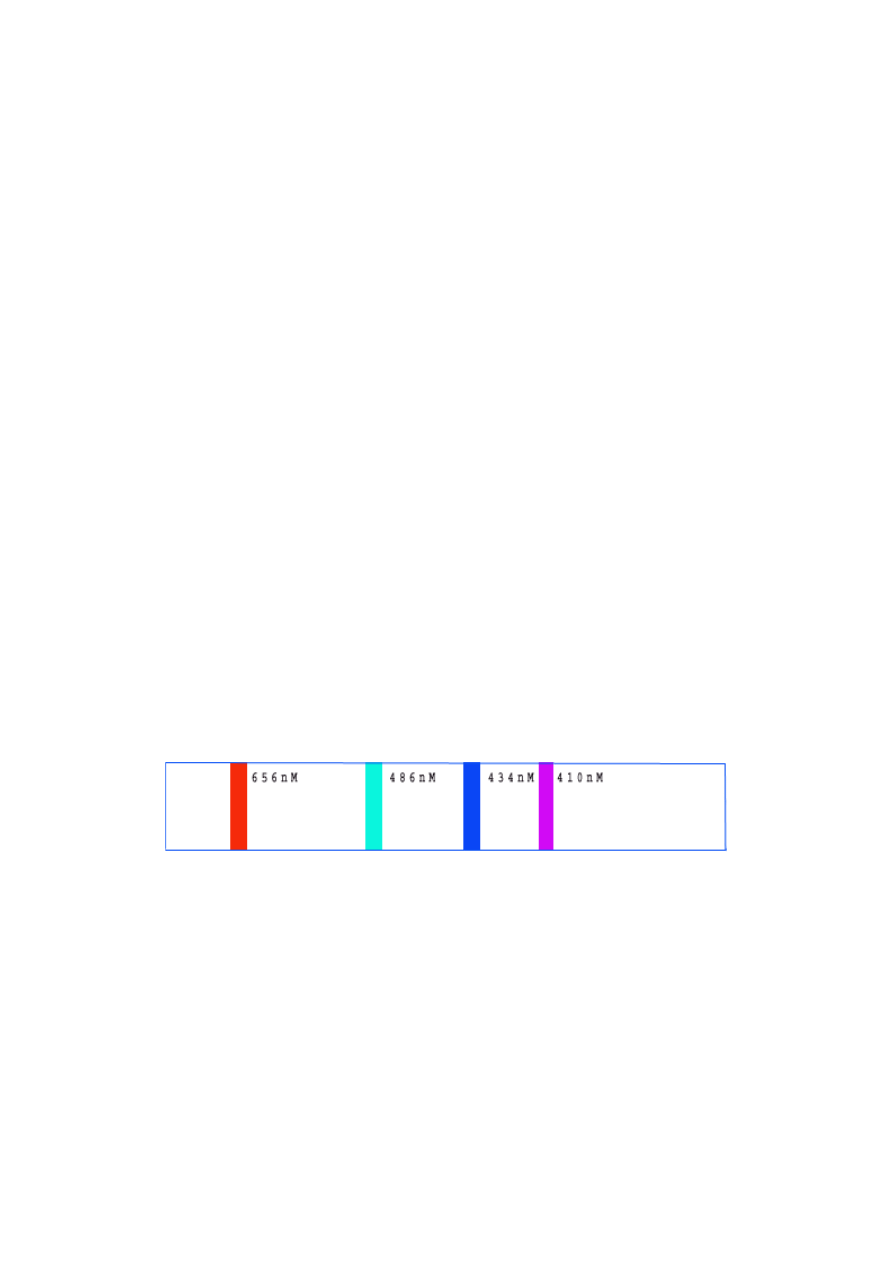
długościach fali. Nie zgadza się to z doświadczeniami: widmo wodoru składa się z linii / rys. 2.1/
Rys.2.1 Seria Balmera linii widma wodoru atomowego. Linia o największej długości fali (na lewo)
jest linią, która odpowiada przejściu od stanu n = 3 do stanu n = 2
Wskazówki do rozwiązania tej trudności dała Bohrowi kwantowa teoria Plancka emisji światła
przez ciało doskonale czarne oraz teoria Einsteina zjawiska fotoelektrycznego i kwantów
promieniowania.
Zarówno Planck jak i Einstein założyli, że światło o określonej częstotliwości nie jest emitowane
ani absorbowane przez materię w dowolnie małych ilościach, lecz tylko w postaci kwantów energii
h * v . Wykorzystując założenia teorii kwantów Bohr skonstruował w 1913 r "planetarny" model
atomu.
Głównym sukcesem teorii Bohra było wskazanie fizycznego sensu rozmieszczenia linii w widmie
emisyjnym wodoru i powiązanie go z budową atomu tego pierwiastka. Struktura liniowa tego widma jest
według Bohra konsekwencją skwantowania poziomów energetycznych elektronów. W widmie emisyjnym
atomu wodoru występują charakterystyczne zespoły zwane seriami. Odpowiadają one przejściom elektronów
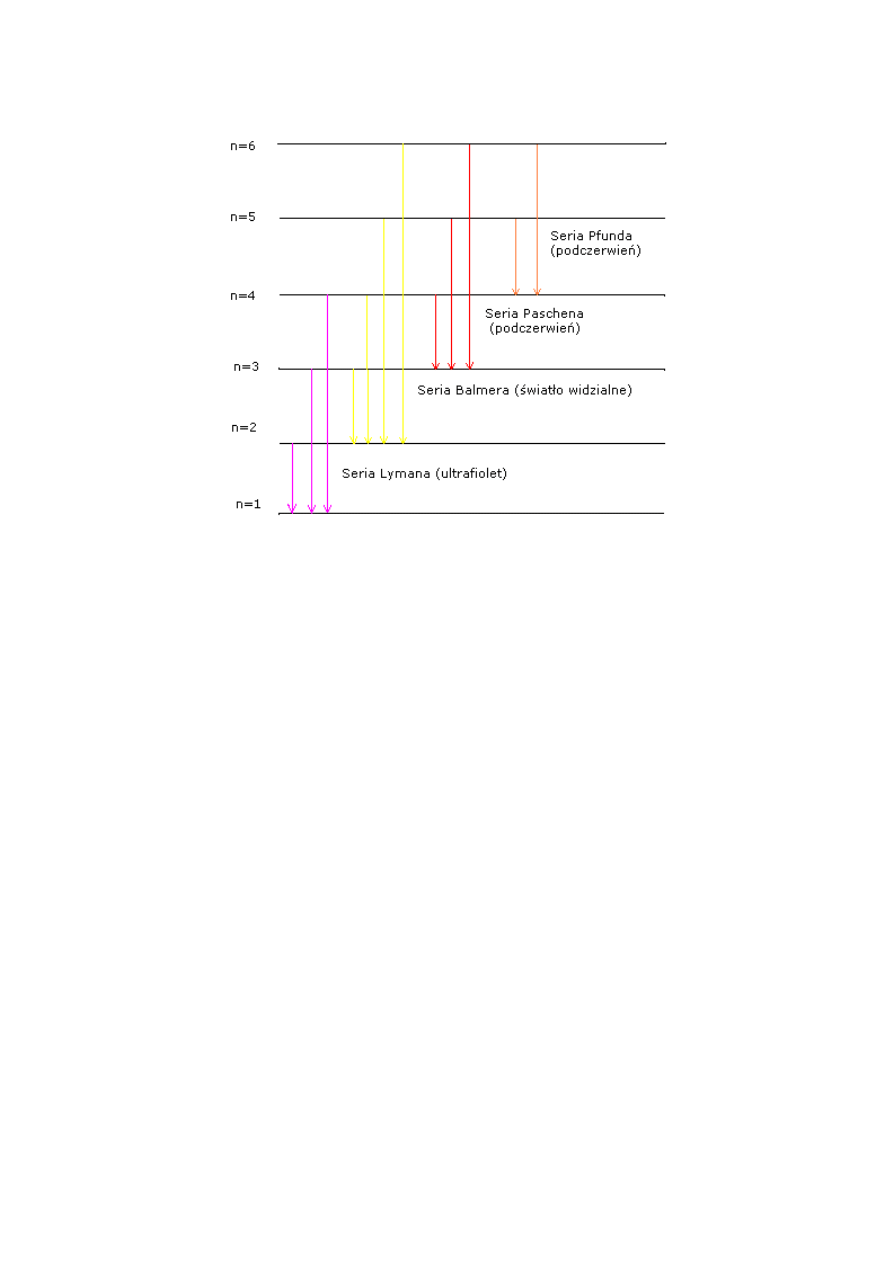
z wyższych poziomów energetycznych na poziom o niższej energii /rys. 2.2/.
Rys. 2.2 Schemat powstawania serii widma emisyjnego wodoru
Jeżeli atom wodoru wyśle kwant energii hv, elektron będzie musiał się znaleźć na innej /mniejszej/
orbicie kołowej, odpowiadającej energii pierwotnej zmniejszonej o hv.
Bohr w swoich założeniach przyjął, że atom może istnieć tylko w pewnych stanach, które
nazywamy stanami stacjonarnymi atomu. Założył dalej, że jeden z tych stanów - stan podstawowy
reprezentuje najmniejszy możliwy zasób energii atomu, jest wobec tego stanem o największej
trwałości. Inne stany o nadmiarze energii w stosunku do podstawowego, nazywamy stanami
wzbudzonymi atomu. Określa to równanie:
hv = E' - E''
/2-1/
gdzie: h -stała Plancka, v - częstotliwość
Bohr wynalazł również metodę obliczania energii stanów stacjonarnych atomów wodoru przy
zastosowaniu stałej Plancka. Ogólnie według Bohra moment pędu elektronu na orbicie kołowej
dookoła jądra ma wartość
Moment pędu = (n * h)/2
Gdzie: n = 1, 2, 3, 4, 5, ........ , główna liczba kwantowa
Główna liczba kwantowa n, wprowadzona w ten sposób do teorii Bohra, jest numerem orbity
Bohra. Obliczony pierwszy promień orbity ma wartość.
r
1
= h
2
/4∏
2
me
2
= 53 pm
gdzie: m -masa elektronu, e - ładunek elektronu
Nowoczesna teoria kwantów
Teoria Bohra dając poprawne teoretyczne wytłumaczenie układu licznych doświadczalnie
obserwowanych linii widmowych w przypadku lekkich atomów, nie sprawdzała się dla bardziej
skomplikowanych układów wieloelektronowych. Ponadto teoria Bohra do końca nie wyjaśniała w
jasny sposób sensu fizycznego orbity.
Dopiero ogłoszenie przez Schrodingera zasad mechaniki falowej, opartej na wprowadzonym przez
Broglie'a pojęciu fal materii pozwoliło fizycznie wytłumaczyć rozmieszczenie elektronów w
atomie.
Podstawowym pojęciem mechaniki falowej jest funkcja falowa opisująca amplitudę fali przypisanej
danej cząstce w przestrzeni i czasie. Funkcję falową układu z jego energią całkowitą wiąże we
wzajemnej zależności podstawowe równanie mechaniki falowej, zwane równaniem Schrodingera.
Gdzie: m - masa elektronu poruszającego się w polu o potencjale V(x, y, z), E - energia całkowita
elektronu, h - stała Plancka
Z klasycznej mechaniki falowej wiadomo, że kwadrat amplitudy jest miarą natężenia
promieniowania. W przypadku cząstek kwadrat funkcji falowej (f(x, y, z))
2
jest miarą
prawdopodobieństwa znalezienia cząstki w danym miejscu przestrzeni.
Odnosząc funkcję falową do opisu elektronów w atomie można wykreślić rozkład
prawdopodobieństwa znalezienia elektronu w funkcji odległości od jądra atomowego.
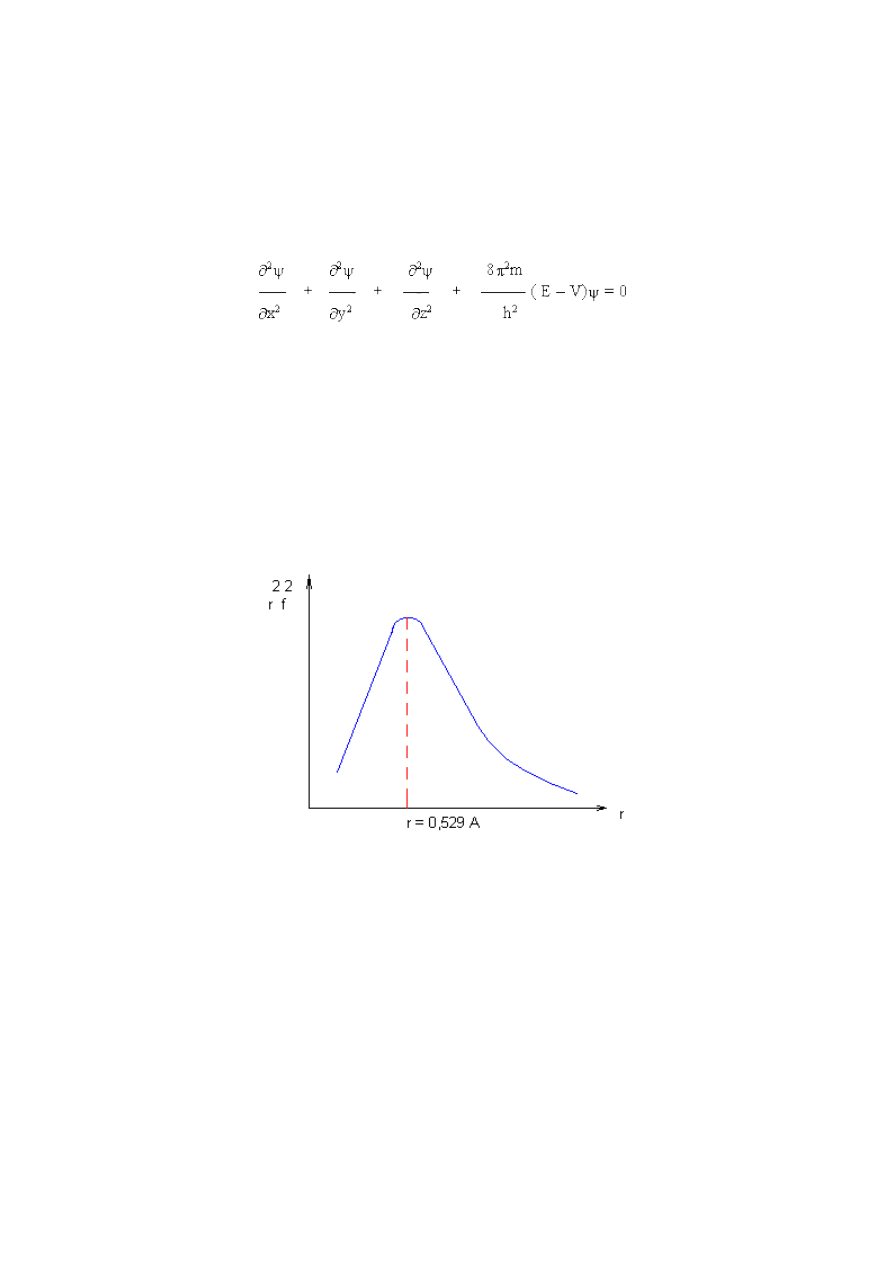
Jeżeli rozkład jest radialny, otrzymuje się wówczas wykres pokazany na rys. 2.3, z którego wynika,
że istnieje skończone prawdopodobieństwo znalezienia elektronu nawet na znacznych
odległościach od jądra.
Rys. 2.3 Radialny rozkład gęstości elektronu w atomie wodoru w stanie podstawowym /1s/
wyrażony wartością r
2
f
2
Istnieje pewna odległość r dla której prawdopodobieństwo jest maksymalne. Obliczenia teoretyczne
wykazały, że to maksymalne prawdopodobieństwo występuje na odległościach równych
promieniowi orbity obliczonego zgodnie z teorią Bohra. Ale zgodnie z nową teorią i w odróżnieniu
od teorii Bohra elektron w atomie można rozpatrywać modelowo pod postacią chmury, której
gęstość zależy od promienia r a sama chmura tworzy wokół jądra powłokę. Najczęściej jest
stosowane pojecie gęstości elektronowej lub gęstości ładunku jako wielkości charakteryzującej
rozkład prawdopodobieństwa znalezienia elektronu.
Do opisania powłoki elektronowej potrzebne są cztery liczby kwantowe.
Dwie pierwsze podają kształt i rozmiary orbity eliptycznej; trzecią określa kąt pomiędzy płaszczyzną orbity
a kierunkiem zewnętrznego pola magnetycznego, w którym jest rozmieszczony atom lub jon; czwarta
wskazuje kierunek obrotu elektronu wokół własnej osi w stosunku do kierunku przebiegu na orbicie.
Liczby kwantowe oznaczono za pomocą liter n, l, m oraz s.

2.2.1 Główna liczba kwantowa
Główną liczbę kwantową oznacza się za pomocą litery n; może ona przyjmować wartości
całkowitych liczb dodatnich
1, 2, 3, ...................
Określa więc powłokę elektronową do której należy elektron. Oprócz oznaczeń liczbowych często
powłoki elektronowe oznacza się również za pomocą kolejnych dużych liter wziętych z badań
widm emisyjnych lub absorbcyjnych promieniowania rentgenowskiego.
Główna liczba kwantowa n określa energię powłoki elektronowej;
Wartość n
1
2
3
4
5
6
Symbol literowy
K
L
M
N
O
P
Liczba kwantowa n ściśle związana jest z długością wielkiej osi elipsy. Długość ta jest jednakowa
dla wszystkich torów należących do tej samej powłoki. W szczególności jest ona równa średnicy
orbity kołowej.
W przypadku wodoru i jonów wodoropochodnych ich wartości promieni orbit kołowych zmieniają
się razem z n.
2.2.2 Poboczna /dodatkowa, orbitalna, azymutalna / liczba
kwantowa
Poboczną liczbę kwantową oznacza się literą l i może przyjmować n wartości:
0, 1, 2, .......do / n-1 /
Charakteryzuje ona podpowłokę elektronową, do której należy elektron. W przypadku atomów
zawierających więcej niż jeden elektron, trzeba znać równocześnie liczby n oraz l by określić
poziom energetyczny odpowiadający orbicie elektronowej. Z wartości l można określić małą oś
elipsy i kształt orbity.
Przykład obliczenia wartości liczby pobocznej l
Dla pierwszej powłoki gdzie n = 1 liczba poboczna l przyjmie wartość l = n - 1 = 1 -1 = 0
Dla drugiej powłoki gdzie n = 2 liczba poboczna l będzie miała wartości 0 oraz n - 1 = 2 - 1 =1,
czyli otrzymany dwie wartości liczby pobocznej l = 0, 1.
Odpowiednio dla n = 3 wartości liczby pobocznej wyniosą l = 0, 1, 2
Poboczna liczba kwantowa l uściśla wartość energii elektronu oraz charakteryzuje kształt orbitali
atomowych.
Oprócz wartości liczbowych, liczby poboczne l oznacza się małymi literami : s, p, d, f, g , itd.
Poboczna liczba kwantowa l 0
1
2
3
4
5
Symbol podpowłoki
s
p
d
f
g
h
Symbol podpoziomu
S
P
D
F
G
H
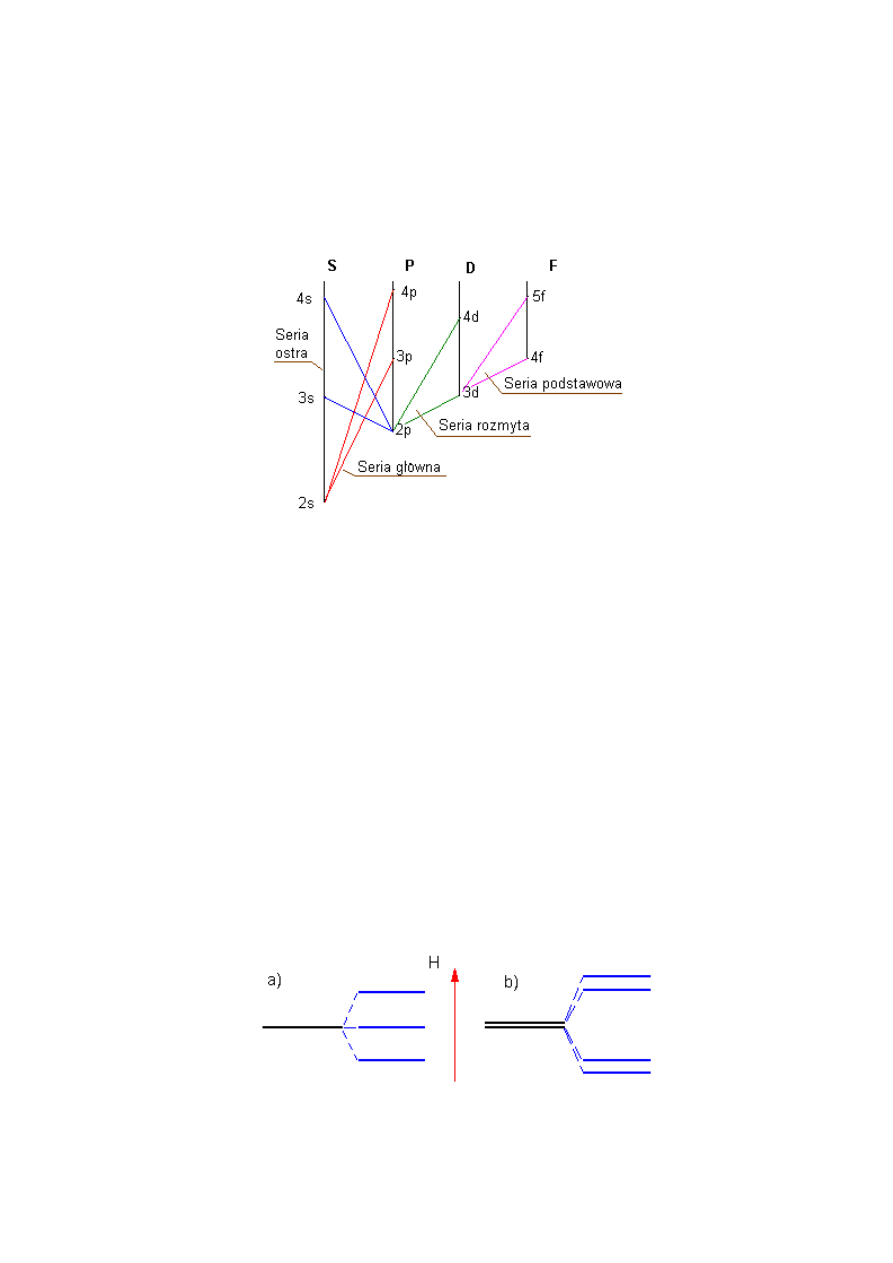
Cztery pierwsze oznaczenia zostały wzięte ze słownictwa spektroskopowego (rys.2.4):
•
s dla serii ostrej /sharp/,
•
p dla serii głównej /principle/,
•
d dla serii rozmytej /difusel/
•
f dla serii podstawowej /fundamental/
dalej stosuje się porządek alfabetyczny.
Rys. 2.4 Schemat poziomów energetycznych w atomie litu.
2.2.3 Magnetyczna liczba kwantowa
Magnetyczna liczba kwantowa m określa niewielkie różnice energetyczne pomiędzy elektronami o
tej samej liczbie kwantowej n i l oraz wzajemne ustawienie się orbitali w przestrzeni pod wpływem
zewnętrznego pola magnetycznego. Przy braku zewnętrznego pola magnetycznego orbitale nie
mają określonego kierunku w przestrzeni i nie różnią się energią, są zatem zdegenerowane.
Degeneracja oznacza istnienie dwóch lub wiecej różnych stanów o tej samej energii. Stany p są
trzykrotne, stany d - pięciokrotne, a stany f - siedmiokrotnie zdegenerowane. Liczba m może
przyjmować (2l + 1) wartości.
m = - l, -(l - 1), ......-1, 0, +1, .......,+(l -1) +l
Przykład:
dla l = 2 liczba magnetyczna m przyjmie wartości - 2, - (2 -1), 0, +(2 -1) , +2
m = -2, -1, 0, +1, +2
Magnetyczna liczba kwantowa m pozwoliła na wyjaśnienie tzw. Zjawiska Zeemana, polegającego
na dalszym rozszczepieniu składników subtelnej budowy prążków widmowych w polu
magnetycznym, co ilustruje rys. 2.5.
Rys.2.5 Zjawisko Zeemana. a)rozszczepienie pojedynczego prążka w polu magnetycznym
b)rozszczepienie podwójnego prążka w polu magnetycznym
Istnienie trzeciej liczby kwantowej m stanie się zrozumiałe jeśli weźmiemy pod uwagę, że elektron
w trójwymiarowej przestrzeni ma trzy stopnie swobody tzn. jego położenie może być określone
dopiero za pomocą trzech wspólnych przestrzennych.
.
Liczby n, l oraz m definiują pewien stan kwantowy, zwany orbitalem.
2.2.4 Spinowa liczba kwantowa
Liczba ta może przyjmować tylko dwie wartości: + 1/2 albo - 1/2. oznacza się ją literą s.
Charakteryzuje ona najmniejsze różnice w stanach energetycznych elektronu związane z
kierunkiem obrotu elektronu dookoła własnej osi /tzw. spin elektronu/. Liczbę tę wprowadził w
1925 r Uhlenbeck i Goudsmit dla oznaczenia obrotu elektronu.
Rotacja ta jest skwantowana . Moment pędu w odniesieniu do tej osi wynosi +/- 1/2 mierzony w
jednostkach kwantowych h/2. Znak + oznacza, że rotacja własna elektronu ma ten sam kierunek co
elektron na orbicie, a znak -, że obrót własny elektronu odbywa się w kierunku przeciwnym.
2.3 Symboliczne przedstawianie orbitali atomowych
Orbital jest określony za pomocą trzech liczb kwantowych n, l, m. Przedstawia się go symbolicznie
w postaci małego kwadratu. Łącząc wszystkie kwadraty zdefiniowane liczbą n oraz l otrzymamy
podpowłoki.
W razie braku zakłócenia zewnętrznego elektrony z jednej podpowłoki mają taką samą energię.
Jeżeli l = 0, m = 0 i występuje tylko jeden orbital. Jeżeli l = 1 to m przyjmuje wartości -1, 0, +1.
Przy trzech wartościach m występują trzy orbitale. Jeżeli l = 2, to orbitali jest 5, gdyż m przyjmuje
pięć różnych wartości itd.
m=0
m=
-1
0
+1
m=
-2
-1
0
+1
+2
l=0
l=1
l=2
Zauważmy, że liczba orbitali zależy wyłącznie od wartości l. Jest ona niezależna od n, lecz l
powinno spełniać warunek 0 < l < n.
Aby przedstawić elektron odpowiadający danemu orbitalowi, wewnątrz klatki rysuje się strzałkę,
której ostrze zwrócone jest do góry, jeżeli spin wynosi + 1/2 albo do dołu, jeśli s = - 1/2.
W celu dalszego ułatwienia zapisu można także stosować zapis kwantowy. Otrzymuje się go pisząc
dla każdej podpowłoki grupę trzech symboli: pierwszy jest liczbą, która podaje wartość głównej
liczby kwantowej; drugi jest literą s, p, d, f, .....itd. charakteryzującą podpowłokę ekektronową;
trzeci umieszczony jako wykładnik u góry na prawo wskazuje liczbę elektronów obecnych w danej
podpowłoce.
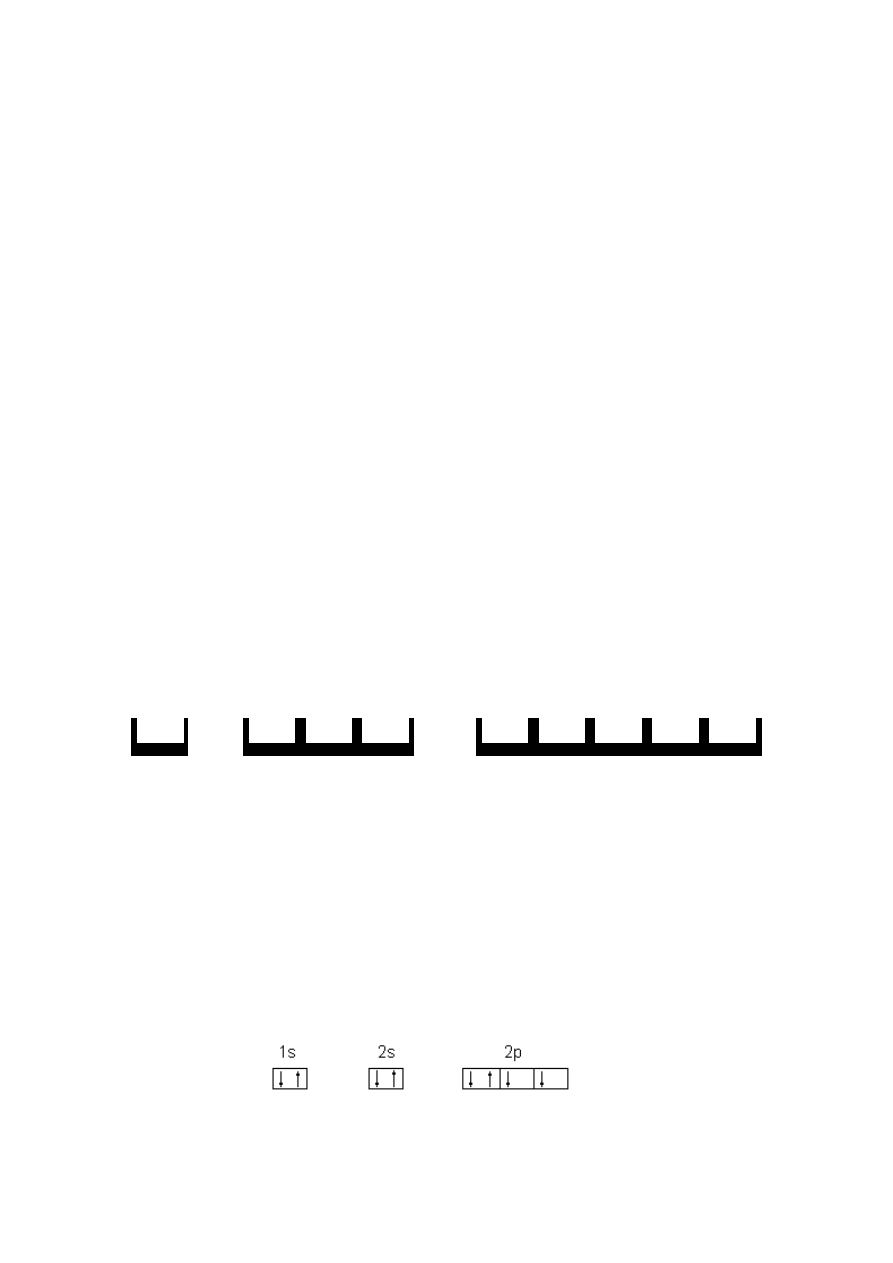
Symbole te można grupować według powłok. Na przykład dla atomu tlenu 1s
2
2s
2
2p
4
, co
odpowiada schematowi

2.4 Zakaz Pauliego
Dwa elektrony mogą zajmować ten sam orbital tylko wóczas, gdy ich spiny są przeciwne tj.
zorientowane w przeciwnych kierunkach.
Zdanie to stanowi sformułowanie zakazu Pauliego.
Fizyk australijski Wolfgang Pauli /1950 - 1959 / pierwszy zauważył, że obecność jednego elektronu
na orbitalu wyklucza możliwość znalezienia się na nim innego elektronu o tej samej orientacji
spinu.
Zakaz Pauliego okazał się podstawową zasadą budowy materii, dotyczącą struktury wszystkich
układów złożonych z cząstek jednakowego rodzaju. Jest on słuszny nie tylko dla budowy atomu,
lecz także w przypadku wiązań chemicznych elektronów w ciałach stałych i budowy jądra
atomowego.
Na podstawie zakazu Pauliego łatwo można wyliczyć maksymalną liczbę elektronów jaka może
pomieścić się na poszczególnych powłokach i podpowłokach atomu.
Maksymalna pojemność powłok wynosi: K - 2, L - 8, M - 18, N - 32, O - 50.
Maksymalna liczba elektronów dla podpowłok wynosi: s - 2, p - 6, d - 10, f - 14.
2.5 Typy orbitali
Orbitale s, p, d, f różnią się między sobą zarówno kształtem jak i orientacją w przestrzeni. Pod
określeniem " kształt orbitalu" należy rozumieć powierzchnię graniczną obejmującą większą część
gęstości prawdopodobieństwa.
Powłoka o głównej liczbie kwantowej n = 1 składa się z jednego tylko orbitalu 1s, tworzącego
kulistą powłokę K. Orbital 1s ma zatem charakter bezkierunkowy i przypisywanie mu przez Bohra
orbitalnego momentu pędu było błędem. Podobnie i wyższe orbitale 2s, 3s, itd. tworzą powłoki
kuliste, co przedstawia rys. 2.6.
Rys. 2.6 Powierzchnia graniczna orbitali s
Ruch elektronu w obrębie orbitali s prawdopodobnie odbywa się wzdłuż promienia w kierunku od i
dośrodkowym.
Elektrony w powłoce n = 2 mogą mieć wartość liczby pobocznej l = 0 i 1 tzn. oprócz orbitalu s
pojawiają się orbitale p. Trzy zdegenerowane / tzn. o jednakowej energii/ orbitale p mają w
przybliżeniu kształt figur powstałych przez obrót ósemki dookoła podłużnej osi i są ustawione
względem siebie w przestrzeni pod kątem prostym. Prawdopodobieństwo znalezienia się elektronu
w środkowej części jest równe zeru. Orbitale p są przedstawione na rys. 2.7.
Rys. 2.7 Powierzchnia graniczna orbitali p

Poziom n = 3 obejmuje podpoziomy s, p, d. Pięć równoważnych / zdegenerowanych/ orbitali typu d
przedstawia rys. 2.8
Rys. 2.8 Powierzchnia graniczna orbitali d
Orbitale typu f mają również symetryczny rozkład w przestrzeni, ale jeszcze bardziej złożony
kształt
Document Outline
- 2.1 Kwantowa teoria atomów
- 2.3 Symboliczne przedstawianie orbitali atomowych
- 2.4 Zakaz Pauliego
- 2.5 Typy orbitali
Wyszukiwarka
Podobne podstrony:
06 Orbitale i liczby kwantowe
Chemia wykłady, Chemia wykłady-mini, → ORBITALE ATOMOWE WODORU
ORBITALE ATOMOWE
Hybrydyzacja orbitali atomowych
liczby kwantowe
Liczby kwantowe, chemia(2)
orbitale atomowe, Do matury, Chemia, Notatki
Kwantowa struktura atomów antywodoru ujawniona
Liczby kwantowe, Notatki i materiały dodatkowe, Chemia, materiały dodatkowe
Liczby kwantowe, chemia dla liceum
LICZBY KWANTOWE I PRAWA ZACHOWANIA
Liczby kwantowe chemia dla liceum
więcej podobnych podstron