
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
MINISTERSTWO EDUKACJI
NARODOWEJ
Małgorzata Klimczak
Wykonywanie analizy jakościowej i ilościowej produktów
leczniczych 322[10].Z1.01
Poradnik dla nauczyciela
Wydawca
Instytut Technologii Eksploatacji – Państwowy Instytut Badawczy
Radom 2007

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
1
Recenzenci:
dr hab. n. farm. Anna Gumienniczek
dr n. farm. Dorota Kowalczuk
Opracowanie redakcyjne:
mgr Alina Krawczak
Konsultacja:
dr hab. inż. Henryk Budzeń
Poradnik stanowi obudowę dydaktyczną programu jednostki modułowej „Wykonywanie
analizy jakościowej i ilościowej produktów leczniczych” 322[10].Z1.01 zawartego
w modułowym programie nauczania dla zawodu technik farmaceutyczny.
Wydawca
Instytut Technologii Eksploatacji – Państwowy Instytut Badawczy, Radom 2007

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
2
SPIS TREŚCI
1. Wprowadzenie
3
2. Wymagania wstępne
5
3. Cele kształcenia
6
4. Przykładowe scenariusze zajęć
7
5. Ćwiczenia
11
5.1. Analiza jakościowa związków nieorganicznych i organicznych
11
5.1.1. Ćwiczenia
11
5.2. Analiza ilościowa
16
5.2.1. Ćwiczenia
16
6. Ewaluacja osiągnięć uczniów
23
7. Literatura
37

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
3
1. WPROWADZENIE
Przekazuję Państwu Poradnik dla nauczyciela, który będzie pomocny w prowadzeniu
zajęć dydaktycznych w szkole kształcącej w zawodzie technik farmaceutyczny.
W poradniku zamieszczono:
−
cele kształcenia – wykaz umiejętności, jakie uczeń opanuje podczas zajęć,
−
wykaz umiejętności, które uczeń powinien mieć opanowane przystępując do realizacji
jednostki modułowej,
−
przykładowe dwa scenariusze zajęć,
−
ćwiczenia – każde ćwiczenie zawiera wskazówki do realizacji, propozycje metod
nauczania–uczenia się, środki dydaktyczne.
−
ćwiczenia zamieszczone w programie jednostki umożliwią kształtowanie umiejętności
intelektualnych i praktycznych.
−
dwa testy osiągnięć szkolnych zawierające: plan testu sporządzony w formie tabelarycznej,
punktację zadań, propozycję norm wymagań, instrukcję dla nauczyciela, instrukcję dla
ucznia, kartę odpowiedzi.
Wskazane jest, aby zajęcia dydaktyczne były prowadzone różnymi metodami
ze szczególnym uwzględnieniem:
−
pokazu z objaśnieniem (instruktażem),
−
metod problemowych,
−
metody tekstu przewodniego,
−
metody projektów.
Formy organizacyjne pracy uczniów mogą być zróżnicowane, począwszy od samodzielnej
pracy uczniów do pracy zespołowej.
Bezpieczeństwo i higiena pracy
W czasie pobytu w laboratorium należy bezwzględnie zwrócić uwagę na przestrzeganie
regulaminów, przepisów bhp oraz instrukcji przeciwpożarowych, wynikających z rodzaju
wykonywanych prac. Z przepisami tymi należy zapoznawać uczniów od początku trwania
nauki i należy je bezwzględnie stosować.
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
4
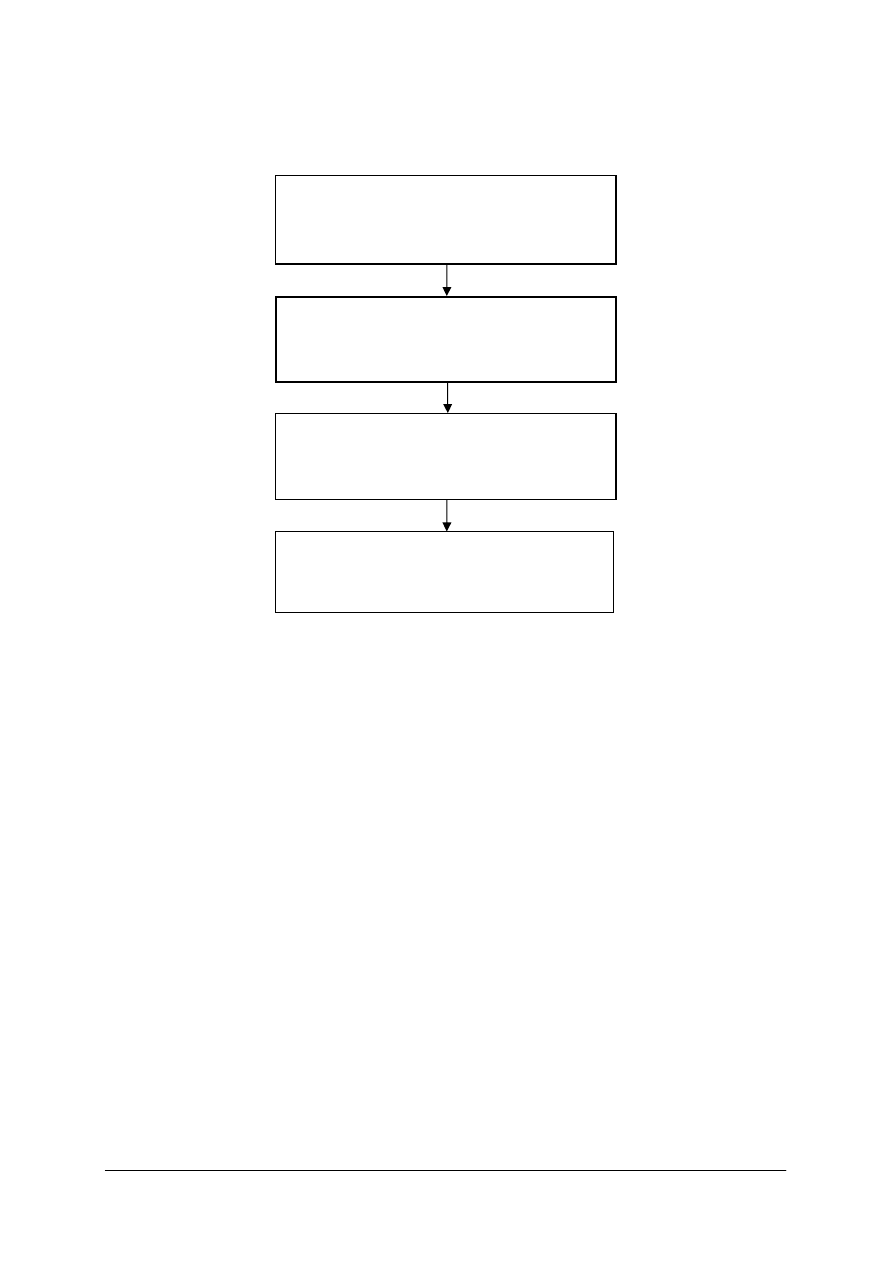
Schemat układu jednostek modułowych
322[10].Z1
Podstawy analizy i wytwarzania produktów
leczniczych
322[10].Z1.01
Wykonywanie analizy jakościowej
i ilościowej produktów leczniczych
322[10].Z1.02
Pozyskiwanie i przetwarzanie roślinnych
surowców leczniczych
322[10].Z1.03
Analizowanie procesów technologicznych
produkcji leków

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
5
2. WYMAGANIA WSTĘPNE
Przystępując do realizacji programu jednostki modułowej, uczeń powinien umieć:
−
korzystać z różnych źródeł informacji,
−
przestrzegać przepisów bezpieczeństwa i higieny pracy, ochrony przeciwpożarowej oraz
ochrony środowiska,
−
organizować stanowisko pracy zgodnie z wymaganiami ergonomii,
−
udzielać pierwszej pomocy w stanach zagrożenia życia i zdrowia,
−
zadbać o stan wyposażenia oraz ład i porządek w miejscu pracy.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
6
3. CELE KSZTAŁCENIA
W wyniku realizacji programu jednostki modułowej uczeń powinien umieć:
−
wykonać podstawowe czynności laboratoryjne,
−
obsłużyć sprzęt, aparaturę oraz urządzenia stosowane w laboratoriach,
−
wypełnić dokumentację laboratoryjną,
−
wykonać oznaczenia z zakresu analizy jakościowej związków nieorganicznych
i organicznych,
−
określić tożsamość surowców farmaceutycznych i środków leczniczych,
−
pobrać i przygotować próbki do badań,
−
przeprowadzić wybranymi metodami analizę jakościową i ilościową, klasyczną
i instrumentalną leków, surowców farmaceutycznych i produktów leczniczych,
−
obliczyć wyniki analizy ilościowej z wykorzystaniem metod matematycznych, graficznych i
statystycznych,
−
przechować zgodnie z zasadami próbki analityczne substancji leczniczych,
−
zastosować metody wagowe, miareczkowe i instrumentalne do badania czystości
i zawartości substancji leczniczych,
−
ocenić czystość surowców i produktów leczniczych,
−
dokonać rozdziału leków złożonych metodą: destylacji, ekstrakcji, wytrącania osadów,
sączenia, przemywania, wirowania, krystalizacji,
−
zinterpretować wyniki przeprowadzonych badań,
−
zastosować obowiązujące normy oceny jakości produktów leczniczych i surowców
różnego pochodzenia,
−
zastosować zasady Dobrej Praktyki Laboratoryjnej.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
7
4. PRZYKŁADOWE SCENARIUSZE ZAJĘĆ
Scenariusz zajęć 1
Osoba prowadząca
…………………………………………
Modułowy programu nauczania: Technik farmaceutyczny 322 [10]
Moduł:
Podstawy analizy i wytwarzania produktów leczniczych
322[10].Z1
Jednostka modułowa:
Wykonywanie analizy jakościowej i ilościowej produktów
leczniczych 322[10].Z1.01
Temat: Badanie tożsamości kwasu cytrynowego według Farmakopei Polskiej.
Cel ogólny: Określanie tożsamości surowców farmaceutycznych i produktów leczniczych.
Po zakończeniu zajęć edukacyjnych uczeń powinien umieć:
−
zastosować informacje zawarte w Farmakopei Polskiej,
−
identyfikować kwas cytrynowy,
−
prowadzić obserwację,
−
konstruować wnioski,
−
dobierać szkło laboratoryjne.
Metody nauczania–uczenia się:
−
wykład problemowy,
−
ćwiczenia laboratoryjne.
Formy organizacyjne pracy uczniów:
−
praca indywidualna,
−
praca zbiorowa.
Czas: 5 godzin dydaktycznych.
Środki dydaktyczne:
−
poradnik dla ucznia jednostki modułowej „Wykonywanie analizy jakościowej i ilościowej
produktów leczniczych”,
−
literatura fachowa,
−
szkło laboratoryjne,
−
odczynniki chemiczne, substancje,
−
próbka do badań,
−
waga analityczna,
−
łaźnia wodna,
−
zeszyty,
−
przybory do pisania,
−
foliogramy lub płyta CD,
−
rzutnik pisma lub rzutnik multimedialny.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
8
Przebieg zajęć:
1. Czynności organizacyjne, przypomnienie regulaminu pracowni.
2. Sprawdzenie gotowości do pracy (odzież ochronna).
3. Zapoznanie uczniów z tematem i celami zajęć.
4. Wykład problemowy – wytworzenie sytuacji problemowej „Jak zbadać tożsamość kwasu
cytrynowego”. Nauczyciel stawiając odpowiednie pytania prowadzi do przypomnienia
znanych treści, które są niezbędne przy badaniu tożsamości (reakcja charakterystyczna,
reakcja grupowa, podział anionów, podział kationów, identyfikacja związków
organicznych, określanie grup funkcyjnych, określanie tożsamości substancji leczniczych i
surowców farmaceutycznych).
5. Kierowanie dyskusją, stawianie pytań problemowych, weryfikacja pomysłów.
6. Uzyskanie informacji zwrotnej od ucznia, weryfikacja pomysłów uczniów.
7. Ustalenie właściwego sposobu rozwiązania problemu.
8. Przypomnienie przepisów bezpieczeństwa i higieny pracy i zapoznanie z kartami
charakterystyk substancji niebezpiecznych.
9. Wydanie uczniom próbek do analizy.
10. Wykonywanie przez uczniów ćwiczenia nr 4 z poradnika dla ucznia z rozdziału 4.1.3.
11. Formułowanie wniosków przez uczniów.
12. Prezentacja wykonanego zadania przez uczniów, komentarz nauczyciela.
13. Sprawdzenie stopnia przyswojenia wiedzy przez uczniów.
14. Porządkowanie stanowisk pracy.
Zakończenie zajęć
Uczniowie sygnalizują które etapy pracy sprawiały najwięcej trudności. Nauczyciel ponownie
wskazuje jakie istotne umiejętności były ćwiczone, jakie wystąpiły nieprawidłowości i jak ich w
przyszłości unikać.
Praca domowa
Korzystając z Farmakopei Polskiej zaplanuj sposób badania tożsamości kwasu mlekowego.
Sposób uzyskania informacji zwrotnej od ucznia:
−
ankieta ewaluacyjna,
−
ocena przez uczniów stopnia trudności ćwiczenia,
−
wskazanie najtrudniejszego etapu.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
9
Scenariusz zajęć 2
Osoba prowadząca
…………………………………………
Modułowy programu nauczania: Technik farmaceutyczny 322 [10]
Moduł:
Podstawy analizy i wytwarzania produktów leczniczych
322[10].Z1
Jednostka modułowa:
Wykonywanie analizy jakościowej i ilościowej produktów
leczniczych 322[10].Z1.01
Temat: Oznaczenie kwasu cytrynowego metodą alkacymetryczną.
Cel ogólny: Rozwijanie umiejętności stosowania metod analizy miareczkowej do oznaczania
czystości i zawartości substancji leczniczych.
Po zakończeniu zajęć edukacyjnych uczeń powinien umieć:
−
planować tok pracy przy wykonywaniu miareczkowania,
−
dobierać szkło i odczynniki,
−
dobierać wskaźnik,
−
wykonać miareczkowanie,
−
obliczyć wynik oznaczania,
−
prowadzić dokumentację,
−
prowadzić obserwację.
Metody nauczania–uczenia się:
−
wykład informacyjny,
−
dyskusja dydaktyczna,
−
pokaz,
−
ćwiczenia laboratoryjne.
Formy organizacyjne pracy uczniów:
−
praca indywidualna.
Czas: 5 godzin dydaktycznych.
Środki dydaktyczne:
−
poradnik dla ucznia jednostki modułowej „Wykonywanie analizy jakościowej i ilościowej
produktów leczniczych”,
−
literatura fachowa,
−
szkło laboratoryjne: naczynko wagowe, zlewka, kolba stożkowa, biureta, pipety,
−
odczynniki chemiczne, substancje,
−
waga analityczna,
−
zeszyty,
−
przybory do pisania,
−
foliogramy lub płyta CD,
Przebieg zajęć:
1. Czynności organizacyjne, przypomnienie regulaminu pracowni.
2. Sprawdzenie gotowości do pracy (odzież ochronna).
3. Zapoznanie uczniów z tematem i celami kształcenia.
4. Wstęp do wykładu – przypomnienie znanych treści dotyczących analizy ilościowej.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
10
5. Wykład informacyjny – przedstawienie przy pomocy rzutnika multimedialnego zagadnień
dotyczących metod alkacymetrycznych (roztwory mianowane, wskaźniki, alkacymetria,
krzywe miareczkowania, obliczanie pH, substancja wzorcowa, obliczanie wyników
oznaczania).
6. Uzyskanie informacji zwrotnej od uczniów dotyczącej zrozumienia zrealizowanych treści
(w formie dyskusji dydaktycznej).
7. Omówienie sposobu prowadzenia miareczkowania.
8. Omówienie czynności wykonywanych przez ucznia.
9. Pokaz nauczyciela – czynności wykonywanych podczas ćwiczenia.
10. Dobór przez uczniów szkła i odczynników.
11. Przypomnienie przepisów bezpieczeństwa i higieny pracy i zapoznanie z kartami
charakterystyk substancji niebezpiecznych.
12. Wykonanie ćwiczenia nr 1 z działu 4.2.3.
13. Obliczenie zawartości kwasu cytrynowego.
14. Dokumentowanie badań w zeszycie.
15. Prezentacja wykonanego zadania, komentarz nauczyciela.
16. Sprawdzenie stopnia przyswojenia wiedzy przez uczniów.
17. Porządkowanie stanowisk pracy.
Zakończenie zajęć
Uczniowie sygnalizują które etapy pracy sprawiały najwięcej trudności. Nauczyciel podkreśla
ważne elementy ćwiczenia, znaczenie wykonania poszczególnych etapów ćwiczenia, podaje
temat następnych zajęć, w których wykorzystane będą opanowane podczas zajęć
umiejętności.
Praca domowa
Wykonaj obliczenia związane ze sporządzaniem roztworów mianowanych o następujących
stężeniach: 0,1mol/l HCl, 0,5 mol/l HCl, 0,1 mol/l NaOH.
Oblicz zawartość kwasu salicylowego oznaczanego za pomocą roztworu 0,1 mol/l NaOH.
1 ml wodorotlenku sodu 0,1 mol/l odpowiada 13,81 mg kwasu salicylowego.
Sposób uzyskania informacji zwrotnej od ucznia:
-
ocena przez uczniów stopnia trudności ćwiczenia, wskazanie najtrudniejszego etapu.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
11
5. ĆWICZENIA
5.1. Analiza
jakościowa
związków
nieorganicznych
i organicznych
5.1.1. Ćwiczenia
Ćwiczenie 1
Zmierz gęstość alkoholu izopropylowego za pomocą areometru i piknometru.
Wskazówki do realizacji
Przed przystąpieniem do realizacji ćwiczenia nauczyciel powinien omówić zakres
i technikę wykonania ćwiczenia z uwzględnieniem przepisów bezpieczeństwa i higieny pracy.
Podstawą realizacji zajęć powinny być ćwiczenia indywidualne. Uczniom należy udostępnić
literaturę uzupełniającą. Efektem pracy będzie podanie prawidłowej gęstości alkoholu
izopropylowego. W przypadku błędnego wyniku należy ponownie przeprowadzić badanie.
Nauczyciel powinien zwracać uwagę na prawidłowe wykonywanie wszystkich czynności,
w szczególności ważenia.
Sposób wykonania ćwiczenia
Uczeń powinien:
1) przeczytać materiał nauczania z poradnika dla ucznia i poszerzyć wiadomości z literatury
uzupełniającej,
2) uważnie przeczytać treść zadania,
3) napełnić alkoholem cylinder o pojemności 50 ml,
4) zanurzyć w alkoholu areometr,
5) odczytać poziom zanurzenia na skali, zapisać wynik w zeszycie,
6) napełnić piknometr alkoholem izopropylowym,
7) zważyć napełniony piknometr na wadze analitycznej,
8) zważyć taką samą objętość wody,
9) obliczyć gęstość wg wzoru,
m
D
20
= ∙ 0,997 + 0,0012 [g/ml]
w
m – masa badanej substancji w g
w – masa takiej samej objętości wody w g
0,997 – gęstość wody
0,0012 – poprawka na ważenie w powietrzu
Wszystkie dane dotyczą temp. otoczenia 20
o
C.
10) zapisać obserwacje i efekty pracy w zeszycie.
Zalecane metody nauczania–uczenia się:
−
wykład informacyjny,
−
pokaz,
−
ćwiczenia laboratoryjne.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
12
Środki dydaktyczne:
−
poradnik dla ucznia,
−
literatura fachowa,
−
areometr, piknometr
−
szkło laboratoryjne,
−
waga analityczna,
−
tablice gęstości,
−
zeszyty,
−
przybory do pisania.
Ćwiczenie 2
Rozpoznaj kationy w otrzymanej mieszaninie kationów.
Wskazówki do realizacji
Przed przystąpieniem do realizacji ćwiczenia nauczyciel powinien omówić zakres
i technikę wykonania ćwiczenia z uwzględnieniem przepisów bezpieczeństwa i higieny pracy.
Powinien także przedstawić sposoby przeprowadzania reakcji charakterystycznych
i grupowych na wybranych przykładach oraz wskazać reakcje specyficzne. Zaleca się
ćwiczenia indywidualne uczniów. Efektem pracy powinna być prawidłowa identyfikacja
kationów w otrzymanej mieszanie.
Sposób wykonania ćwiczenia
Uczeń powinien:
1) przeczytać materiał nauczania z poradnika dla ucznia i poszerzyć wiadomości z literatury
uzupełniającej,
2) uważnie przeczytać treść zadania,
3) przenieść część otrzymanej analizy do probówek,
4) przeprowadzić próby wstępne w celu identyfikacji kationu NH
4
+
,
5) przeprowadzić reakcje specyficzne jonów Fe
2+
, Fe
3+
, Mn
2+
,
6) dokonać rozdziału kationów na grupy analityczne dodając kolejne odczynniki grupowe,
7) po wytrąceniu grupy oddzielić osad przez wirowanie i przemyć wodą destylowaną,
8) przeprowadzić identyfikację kationu za pomocą reakcji charakterystycznych,
9) zapisać efekty pracy w zeszycie.
Zalecane metody nauczania–uczenia się:
−
metoda projektów,
−
ćwiczenia laboratoryjne.
Środki dydaktyczne:
−
poradnik dla ucznia,
−
literatura fachowa,
−
szkło laboratoryjne,
−
odczynniki chemiczne, substancje
−
wirówka,
−
zeszyty,
−
przybory do pisania.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
13
Ćwiczenie 3
Rozpoznaj aniony w otrzymanej mieszaninie anionów.
Wskazówki do realizacji
Przed przystąpieniem do realizacji ćwiczenia nauczyciel powinien omówić zakres
i technikę wykonania ćwiczenia z uwzględnieniem przepisów bezpieczeństwa i higieny pracy.
Powinien także przedstawić sposoby przeprowadzania reakcji charakterystycznych
i grupowych na wybranych przykładach oraz wskazać reakcje specyficzne. Zaleca się
ćwiczenia indywidualne uczniów. Efektem pracy powinna być prawidłowa identyfikacja
anionów w otrzymanej mieszaninie.
Sposób wykonania ćwiczenia
Uczeń powinien:
1) przeczytać materiał nauczania z poradnika dla ucznia i poszerzyć wiadomości z literatury
uzupełniającej,
2) uważnie przeczytać treść zadania,
3) przenieść część otrzymanej analizy do kliku probówek,
4) dodać odczynniki grupowe AgNO
3
i BaCl
2
,
5) po otrzymaniu osadu sprawdzić jego rozpuszczalność w rozcieńczonym kwasie azotowym
(V),
6) po przeprowadzonych próbach zakwalifikować anion do jednej z grup analitycznych,
7) zidentyfikować anion w obrębie grupy za pomocą reakcji charakterystycznych,
8) przeprowadzić próbę z manganianem (VII) potasu, jeżeli anion należy do I, II, III i IV
grupy analitycznej anionów,
9) zapisać efekty pracy w zeszycie.
Zalecane metody nauczania–uczenia się:
−
metoda projektów,
−
ćwiczenia laboratoryjne.
Środki dydaktyczne:
−
poradnik dla ucznia,
−
literatura fachowa,
−
szkło laboratoryjne,
−
odczynniki chemiczne, substancje,
−
wirówka,
−
zeszyty,
−
przybory do pisania.
Ćwiczenie 4
Zbadaj tożsamość kwasu cytrynowego według Farmakopei Polskiej.
Wskazówki do realizacji
Przed przystąpieniem do realizacji ćwiczenia nauczyciel powinien omówić zakres
i technikę wykonania ćwiczenia z uwzględnieniem przepisów bezpieczeństwa i higieny pracy, a
także przedstawić sposoby realizacji ćwiczenia. Udostępnić literaturę uzupełniająca
i Farmakopeę Polską. Efektem powinno być zapisanie prawidłowych obserwacji
i potwierdzenie tożsamości kwasu cytrynowego.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
14
Sposób wykonania ćwiczenia
Uczeń powinien:
1) przeczytać materiał nauczania z poradnika dla ucznia i poszerzyć wiadomości z literatury
uzupełniającej,
2) uważnie przeczytać treść zadania,
3) sprawdzić rozpuszczalność kwasu cytrynowego w 95
o
etanolu i eterze etylowym,
4) rozpuścić 50 mg substancji w 1 ml wody i zmierzyć pH roztworu,
5) przeprowadzić ostrożne ogrzewanie substancji, dokonać obserwacji,
6) wrzucić substancję do tetrachlorku węgla i obserwować czy tonie,
7) rozpuścić 1,0 g substancji w 10 ml wody,
8) przenieść po 2 ml roztworu do dwóch probówek,
9) zobojętnić roztwór w pierwszej probówce roztworem wodorotlenku sodu (20 g/l) i dodać
2 ml roztworu chlorku wapnia (100 g/l),
10) dokonać obserwacji, a następnie zagotować,
11) do probówki drugiej dodać 0,25 ml etanolowego roztworu waniliny (10 g/l), odparować
na łaźni wodnej do sucha,
12) do suchej pozostałości dodać 0,1 ml kwasu siarkowego (178 g/l), ogrzewać 15 min.,
obserwować zabarwienie,
13) dodać do analizy wody, obserwować zabarwienie,
14) następnie dodać do analizy wodorotlenku amonu (96 g/l), obserwować zabarwienie,
15) zapisać efekty pracy w zeszycie.
Zalecane metody nauczania–uczenia się:
−
wykład problemowy,
−
ćwiczenia laboratoryjne.
Środki dydaktyczne:
−
poradnik dla ucznia,
−
literatura fachowa,
−
szkło laboratoryjne,
−
pehametr,
−
odczynniki chemiczne, substancje,
−
waga analityczna,
−
łaźnia wodna,
−
zeszyty,
−
przybory do pisania.
Ćwiczenie 5
Zbadaj czystość azotanu srebra według Farmakopei Polskiej.
Wskazówki do realizacji
Przed przystąpieniem do realizacji ćwiczenia nauczyciel powinien omówić zakres
i technikę wykonania ćwiczenia z uwzględnieniem przepisów bezpieczeństwa i higieny pracy, a
także przedstawić sposoby realizacji ćwiczenia. Udostępnić literaturę uzupełniająca
i Farmakopeę Polską. Efektem powinno być zapisanie obserwacji i prawidłowych wyników
reakcji chemicznej.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
15
Sposób wykonania ćwiczenia
Uczeń powinien:
1) przeczytać materiał nauczania z poradnika dla ucznia i poszerzyć wiadomości z literatury
uzupełniającej,
2) uważnie przeczytać treść zadania,
3) rozpuścić 5 g substancji w 50 ml wody,
4) obserwować przezroczystość roztworu,
5) przenieść po 5 ml roztworu do 4 probówek,
6) do pierwszej probówki dodać 0,1 ml roztworu czerwieni fenolowej i obserwować
zabarwienie,
7) do drugiej probówki dodać 0,1 ml roztworu zieleni bromokrezolowej,
8) do trzeciej probówki dodać 5 ml wody, 1 ml kwasu azotowego (287 g/l); 0,05 ml
roztworu manganianu (VII) potasu (0,02 mol/l),
9) do czwartej probówki dodać kroplami wodorotlenek amonowy (96 g/l) do rozpuszczenia
powstającego osadu,
10) do 10 ml roztworu wyjściowego dodać 10 ml wody, 4 ml kwasu solnego (105 g/l), silnie
wytrząsnąć, ogrzać 5 min. na łaźni wodnej, przesączyć, odparować 12 ml przesączu
i wysuszyć do stałej masy,
11) zapisać obserwacje i efekty pracy w zeszycie.
Zalecane metody nauczania–uczenia się:
−
wykład informacyjny,
−
ćwiczenia laboratoryjne,
−
metoda tekstu przewodniego.
Środki dydaktyczne:
−
poradnik dla ucznia,
−
literatura fachowa,
−
szkło laboratoryjne,
−
odczynniki chemiczne, substancje,
−
waga analityczna,
−
suszarka,
−
zeszyty,
−
przybory do pisania.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
16
5.2. Analiza ilościowa
5.2.1. Ćwiczenia
Ćwiczenie 1
Oznacz alkacymetrycznie kwas cytrynowy.
Wskazówki do realizacji
Przed przystąpieniem do realizacji ćwiczenia nauczyciel powinien omówić zakres
i technikę wykonania ćwiczenia z uwzględnieniem przepisów bezpieczeństwa i higieny pracy.
Nauczyciel powinien udostępnić uczniom literaturę uzupełniającą. Efektem powinno być
podanie zawartości kwasu cytrynowego.
Sposób wykonania ćwiczenia.
Uczeń powinien:
1) przeczytać materiał nauczania z poradnika dla ucznia i poszerzyć wiadomości z literatury
uzupełniającej,
2) uważnie przeczytać treść zadania,
3) odważyć na wadze analitycznej dokładnie ok. 0,50 g substancji,
4) rozpuścić substancję w 50 ml wody w kolbie stożkowej o pojemności 250 ml,
5) dodać 0,05 ml roztworu fenoloftaleiny,
6) miareczkować roztworem 0,5 mol/l wodorotlenku sodu,
7) obliczyć zawartość kwasu cytrynowego wykorzystując do obliczeń informację, że 1 ml
roztworu wodorotlenku sodu 0,5 ml/l odpowiada 32,02 mg bezwodnego kwasu
cytrynowego,
8) zapisać efekty pracy w zeszycie.
Zalecane metody nauczania–uczenia się:
−
wykład informacyjny,
−
dyskusja dydaktyczna,
−
pokaz,
−
ćwiczenia laboratoryjne.
Środki dydaktyczne:
−
poradnik dla ucznia,
−
literatura fachowa,
−
szkło laboratoryjne: naczynko wagowe, zlewka, kolba stożkowa, biureta, pipety,
−
odczynniki chemiczne, substancje,
−
waga analityczna,
−
zeszyty,
−
przybory do pisania,
−
foliogramy lub płyta CD.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
17
Ćwiczenie 2
Oznacz metodą jodometryczną kwas askorbowy.
Wskazówki do realizacji
Przed przystąpieniem do realizacji ćwiczenia nauczyciel powinien omówić zakres
i technikę wykonania ćwiczenia z uwzględnieniem przepisów bezpieczeństwa i higieny pracy.
Nauczyciel powinien udostępnić uczniom literaturę uzupełniającą. Efektem powinno być
podanie zawartości kwasu askorbowego w badanej próbie.
Sposób wykonania ćwiczenia
Uczeń powinien:
1) przeczytać materiał nauczania z poradnika dla ucznia i poszerzyć wiadomości z literatury
uzupełniającej,
2) uważnie przeczytać treść zadania,
3) odważyć na wadze analitycznej dokładnie ok. 0,10 g substancji,
4) rozpuścić substancję w 20 ml świeżo przegotowanej i ochłodzonej wody w kolbie
stożkowej o pojemności 250 ml,
5) dodać do analizy 10 ml kwasu siarkowego o stężeniu 178 g/l,
6) dodać 1 ml skrobi (100g/l),
7) miareczkować roztworem jodu (0,05 mol/l) do pojawienia się trwałego niebieskiego
zabarwienia roztworu,
8) obliczyć zawartość kwasu askorbowego wiedząc, że 1 ml roztworu jodu 0,05 mol/l
odpowiada 8,81 mg kwasu askorbowego,
9) zapisać wyniki pracy w zeszycie.
Zalecane metody nauczania–uczenia się:
−
wykład problemowy,
−
ćwiczenia laboratoryjne.
Środki dydaktyczne:
−
poradnik dla ucznia,
−
literatura fachowa,
−
szkło laboratoryjne: naczynko wagowe, zlewka, kolba stożkowa, pipety,
−
odczynniki chemiczne, substancje,
−
waga analityczna,
−
foliogramy, płyta CD,
−
zeszyty,
−
przybory do pisania.
Ćwiczenie 3
Oznacz stratę masy po suszeniu w mieszance ziołowej.
Wskazówki do realizacji
Przed przystąpieniem do realizacji ćwiczenia nauczyciel powinien omówić zakres
i technikę wykonania ćwiczenia z uwzględnieniem przepisów bezpieczeństwa i higieny pracy.
Nauczyciel powinien udostępnić uczniom literaturę uzupełniającą. Efektem powinny być
prawidłowe obliczenia zapisane w zeszycie.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
18
Sposób wykonania ćwiczenia
Uczeń powinien:
1) przeczytać materiał nauczania z poradnika dla ucznia i poszerzyć wiadomości z literatury
uzupełniającej,
2) uważnie przeczytać treść zadania,
3) rozdrobnić i przesiać mieszankę ziołową przez sito o wielkości oczek 0,5 mm,
4) wysuszyć naczynko wagowe w suszarce przez 2 h w temperaturze 105
o
C,
5) ostudzić naczynko w eksykatorze,
6) zważyć naczynko z dokładnością do czwartego miejsca po przecinku,
7) powtórzyć czynności suszenia i ważenia do uzyskania stałej masy naczynka wagowego,
wyniki nie powinny się różnić między sobą o więcej niż 0,0002 g,
8) odważyć dokładnie ok. 2 g mieszanki ziołowej i suszyć w temperaturze 105
o
C przez 2 h,
ochłodzić w eksykatorze,
9) zważyć naczynko z mieszanką (i ponownie suszyć do stałej masy),
10) obliczyć zawartość wody,
11) zapisać efekty pracy w zeszycie.
Zalecane metody nauczania–uczenia się:
−
wykład problemowy,
−
ćwiczenia laboratoryjne.
Środki dydaktyczne:
−
poradnik dla ucznia,
−
literatura fachowa,
−
zestaw sit,
−
szkło laboratoryjne: naczynko wagowe,
−
waga analityczna,
−
eksykator,
−
suszarka,
−
zeszyty,
−
przybory do pisania.
Ćwiczenie 4
Oznacz glukozę w syropie przeciwkaszlowym.
Wskazówki do realizacji
Przed przystąpieniem do realizacji ćwiczenia nauczyciel powinien omówić zakres
i technikę wykonania ćwiczenia z uwzględnieniem przepisów bezpieczeństwa i higieny pracy.
Nauczyciel powinien udostępnić uczniom literaturę uzupełniającą. Nauczyciel powinien
wprowadzić uczniów w zagadnienia metod optycznych, uwypuklając różnice w tych
metodach. Efektem powinno być dokładne podanie zawartości glukozy w badanej próbie.
Sposób wykonania ćwiczenia
Uczeń powinien:
1) przeczytać materiał nauczania z poradnika dla ucznia i poszerzyć wiadomości z literatury
uzupełniającej,
2) uważnie przeczytać treść zadania,

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
19
3) uzupełnić otrzymany roztwór do kreski, w kolbie miarowej o pojemności 100 ml, wodą
z dodatkiem 2–3 kropli roztworu wodorotlenku amonu (96 g/l),
4) napełnić roztworem rurkę polarymetryczną o długości 1 dm,
5) wykonać pomiar skręcalności optycznej w temperaturze 20
o
C w świetle sodowym,
6) obliczyć procentową zawartość glukozy posługując się wzorem:
α ·100
c=
l· [ α]
D
20
c – stężenie roztworu
α – odczytany kąt skręcenia płaszczyzny polaryzacji (w stopniach)
α
D
20
– skręcalność dla linii D sodu (dcm)
l – długość rurki polarymetrycznej
7) zapisać obserwacje, wyniki i obliczenia w zeszycie,
Zalecane metody nauczania–uczenia się:
−
wykład informacyjny,
−
pokaz,
−
ćwiczenia laboratoryjne.
Środki dydaktyczne:
−
poradnik dla ucznia,
−
literatura fachowa,
−
polarymetr,
−
szkło laboratoryjne,
−
odczynniki chemiczne, substancje
−
waga analityczna,
−
zeszyty,
−
przybory do pisania
Ćwiczenie 5
Oznacz żelazo metodą krzywej wzorcowej za pomocą kolorymetru.
Wskazówki do realizacji
Przed przystąpieniem do realizacji ćwiczenia nauczyciel powinien omówić zakres
i technikę wykonania ćwiczenia z uwzględnieniem przepisów bezpieczeństwa i higieny pracy.
Nauczyciel powinien udostępnić uczniom literaturę uzupełniającą. Zaleca się pracę w grupach
dwuosobowych. Efektem powinny prawidłowe wyniki badań próbki analitycznej i analiza
błędów.
Sposób wykonania ćwiczenia
Uczeń powinien:
1) przeczytać materiał nauczania z poradnika dla ucznia i poszerzyć wiadomości z literatury
uzupełniającej,
2) uważnie przeczytać treść zadania,

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
20
3) odmierzyć z biurety do kolb miarowych o pojemności 100 ml następujące objętości
roztworu wzorcowego żelaza (III) wg podanych objętości:
−
kolba 1 – 2 ml
−
kolba 2 – 4 ml
−
kolba 3 – 6 ml
−
kolba 4 – 8 ml
−
kolba 5 – x – badana analiza
4) dodać do każdej kolby 1 ml roztworu 6 mol/l kwasu azotowego,
5) następnie dodać do każdej z kolb po 5 ml roztworu 10% tiocyjanianu potasu,
6) uzupełnić roztwory w kolbach wodą do objętości 100 ml i dokładnie wymieszać,
7) zmierzyć po 5 minutach absorbancję stosując wodę jako odnośnik,
8) wyniki zestawić w tabeli,
9) wykreślić na podstawie uzyskanych wyników krzywą wzorcową A=f(C),
10) odczytać z krzywej wzorcowej stężenie roztworu badanego,
11) zapisać efekty pracy w zeszycie.
Zalecane metody nauczania–uczenia się:
−
wykład informacyjny,
−
metoda tekstu przewodniego,
−
ćwiczenia laboratoryjne.
Środki dydaktyczne:
−
poradnik dla ucznia,
−
literatura fachowa,
−
szkło laboratoryjne: biureta, naczynko wagowe, zlewka, kolba miarowa, pipety,
−
odczynniki chemiczne, substancje,
−
waga analityczna,
−
kolorymetr,
−
zeszyty,
−
przybory do pisania.
Ćwiczenie 6
Dokonaj
badania
czystości
hydroksybenzoesanu
etylu
metodą
chromatografii
cienkowarstwowej według Farmakopei Polskiej.
Wskazówki do realizacji
Przed przystąpieniem do realizacji ćwiczenia nauczyciel powinien omówić zakres
i technikę wykonania ćwiczenia z uwzględnieniem przepisów bezpieczeństwa i higieny pracy.
Nauczyciel powinien udostępnić uczniom literaturę uzupełniającą. Efektem powinno być
prawidłowe wnioskowanie uczniów.
Sposób wykonania ćwiczenia
Uczeń powinien:
1) przeczytać materiał nauczania z poradnika dla ucznia i poszerzyć wiadomości z literatury
uzupełniającej,
2) uważnie przeczytać treść zadania,
3) sporządzić roztwór A substancji badanej w acetonie o stężeniu 50 mg/ml,

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
21
4) sporządzić roztwór B substancji badanej w acetonie o stężeniu 0,15 mg/ml,
5) nanieść po 5 μl roztworu A i B na płytkę chromatograficzną,
6) umieścić płytkę w komorze chromatograficznej zawierającej fazę ruchomą: chlorek
metylenu - octan etylu - kwas siarkowy (1,762 kg/l) w stosunku 90: 10 : 0,5,
7) rozwinąć chromatogram na wysokość 10 cm,
8) wyjąć płytkę i wysuszyć w temperaturze pokojowej,
9) obejrzeć chromatogram w świetle nadfioletowym (254 nm), jeżeli na chromatogramie
roztworu A wystąpią inne plamy poza plamą główną, nie mogą być większe ani
intensywniejsze niż plama główna na chromatogramie roztworu B.
10) zapisać obserwacje i efekty pracy w zeszycie.
Zalecane metody nauczania–uczenia się:
−
wykład informacyjny,
−
metoda tekstu przewodniego,
−
ćwiczenia laboratoryjne.
Środki dydaktyczne:
−
poradnik dla ucznia,
−
literatura fachowa,
−
płytki chromatograficzne GF
254
−
lampa kwarcowa laboratoryjna,
−
komora chromatograficzna,
−
mikropipety,
−
szkło laboratoryjne,
−
odczynniki chemiczne, substancje
−
waga analityczna,
−
zeszyty,
−
przybory do pisania.
Ćwiczenie 7
Oznacz chloramfenikol metodą spektrofotometryczną w zakresie światła nadfioletowego.
Wskazówki do realizacji
Przed przystąpieniem do realizacji ćwiczenia nauczyciel powinien omówić zakres
i technikę wykonania ćwiczenia z uwzględnieniem przepisów bezpieczeństwa i higieny pracy.
Nauczyciel powinien udostępnić uczniom literaturę uzupełniającą. Efektem powinno być
prawidłowe podanie wyniku pomiaru (wartość średnia ± 2 %).
Sposób wykonania ćwiczenia
Uczeń powinien:
1) przeczytać materiał nauczania z poradnika dla ucznia i poszerzyć wiadomości z literatury
uzupełniającej,
2) uważnie przeczytać treść zadania,
3) odważyć dokładnie 0,10 g substancji,
4) rozpuścić substancję ogrzewając w 80 ml wody w zlewce,
5) po ochłodzeniu roztwór przenieść ilościowo do kolby miarowej,
6) popłukać zlewkę, przenieść popłuczyny do kolby i uzupełnić do kreski,

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
22
7) odmierzyć 2,0 ml tego roztworu i rozcieńczyć do 100 ml wody,
8) zmierzyć absorbancję rozcieńczonego roztworu przy długości fali 278 nm,
9) obliczyć zawartość chloramfenikolu przyjmując absorpcję właściwą α
1%
1 cm
= 297
wykorzystując wzór:
A·b
c=
a
1cm
1%
·l·d
a
1cm
1%
– wartość absorpcji właściwej badanego związku
A – zmierzona absorbancja
b – współczynnik rozcieńczenia
l – grubość warstwy w cm
d – odważka w g
10) zapisać obserwacje i efekty pracy w zeszycie,
Zalecane metody nauczania–uczenia się:
−
wykład problemowy,
−
ćwiczenia laboratoryjne.
Środki dydaktyczne:
−
poradnik dla ucznia,
−
literatura fachowa,
−
spektrofotometr,
−
szkło laboratoryjne,
−
odczynniki chemiczne, substancje
−
waga analityczna,
−
zeszyty,
−
przybory do pisania.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
23
6. EWALUACJA OSIĄGNIĘĆ UCZNIA
Przykłady narzędzi pomiaru dydaktycznego
Test dwustopniowy do jednostki modułowej „Wykonywanie analizy
jakościowej i ilościowej produktów leczniczych”
Test składa się z 20 zadań wielokrotnego wyboru, z których:
−
zadania 1, 3, 4, 5 ,6, 7,.8, 9, 10, 11,12, 13, 14 są z poziomu podstawowego,
−
zadania 2, 15, 16, 17, 18, 19, 20 są z poziomu ponadpodstawowego.
Punktacja zadań: 0 lub 1 punkt
Za każdą prawidłową odpowiedź uczeń otrzymuje 1 punkt. Za złą odpowiedź lub jej brak
uczeń otrzymuje 0 punktów.
Proponuje się następujące normy wymagań – uczeń otrzyma następujące
oceny szkolne:
−
dopuszczający – za rozwiązanie co najmniej 10 zadań z poziomu podstawowego,
−
dostateczny – za rozwiązanie co najmniej 12 zadań z poziomu podstawowego,
−
dobry – za rozwiązanie 16 zadań, w tym co najmniej 3 z poziomu ponadpodstawowego,
−
bardzo dobry – za rozwiązanie 18 zadań, w tym co najmniej 5 z poziomu
ponadpodstawowego.
Klucz odpowiedzi: 1. c, 2. b, 3. d, 4. c, 5. c, 6. a, 7. a, 8. b, 9. a, 10. c, 11. c,
12. d, 13. d, 14. a, 15. a, 16. b, 17. a, 18. b, 19. a, 20. b.
Plan testu
Nr
zad.
Cel operacyjny
(mierzone osiągnięcia ucznia)
Kategoria
celu
Poziom
wymagań
Poprawna
odpowiedź
1
Pobrać i przygotować próbki do badań
A
P
c
2
Przeprowadzić wybranymi metodami analizę
jakościową i ilościową, klasyczną i instrumentalną
leków, surowców farmaceutycznych i produktów
leczniczych
C
PP
b
3
Wykonać oznaczenia z zakresu analizy
jakościowej związków nieorganicznych
i organicznych
A
P
d
4
Wykonać oznaczenia z zakresu analizy
jakościowej związków nieorganicznych
i organicznych
A
P
c
5
Zastosować zasady Dobrej Praktyki
Laboratoryjnej
B
P
c

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
24
6
Wykonać podstawowe czynności laboratoryjne,
pobrać i przygotować próbki do badań
B
P
a
7
Wykonać oznaczenia z zakresu analizy
jakościowej związków nieorganicznych
i organicznych
A
P
a
8
Obsłużyć sprzęt, aparaturę oraz urządzenia
stosowane w laboratoriach
A
P
b
9
Zastosować metody wagowe, miareczkowe
i instrumentalne do badania czystości i zawartości
substancji leczniczych
C
P
a
10
Wykonać oznaczenia z zakresu analizy
jakościowej związków nieorganicznych
i organicznych
A
P
c
11
Przeprowadzić wybranymi metodami analizę
jakościową i ilościową, klasyczną i instrumentalną
leków, surowców farmaceutycznych i produktów
leczniczych
A
P
c
12
Wykonać oznaczenia z zakresu analizy
jakościowej związków nieorganicznych
i organicznych
A
P
d
13
Wykonać podstawowe czynności laboratoryjne,
pobrać i przygotować próbki do badań
A
P
d
14
Określić tożsamość surowców farmaceutycznych
i środków leczniczych,
B
P
a
15 Wykonać podstawowe czynności laboratoryjne
C
PP
a
16
Dokonać rozdziału leków złożonych metodą:
destylacji, ekstrakcji, wytrącania osadów,
sączenia, przemywania, wirowania, krystalizacji
C
PP
b
17
Obsłużyć sprzęt, aparaturę oraz urządzenia
stosowane w laboratoriach
C
PP
a
18
Określić tożsamość surowców farmaceutycznych
i środków leczniczych
C
PP
b
19 Zinterpretować wyniki przeprowadzonych badań
C
PP
a
20
Wykonać oznaczenia z zakresu analizy
jakościowej związków nieorganicznych
i organicznych
C
PP
b

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
25
Przebieg testowania
Instrukcja dla nauczyciela
1. Ustal z uczniami termin przeprowadzenia sprawdzianu z co najmniej jednotygodniowym
wyprzedzeniem.
2. Omów z uczniami cel stosowania pomiaru dydaktycznego.
3. Zapoznaj uczniów z rodzajem zadań podanych w zestawie oraz z zasadami punktowania.
4. Przeprowadź z uczniami próbę udzielania odpowiedzi na takie typy zadań testowych, jakie
będą w teście.
5. Omów z uczniami sposób udzielania odpowiedzi (karta odpowiedzi).
6. Zapewnij uczniom możliwość samodzielnej pracy.
7. Rozdaj uczniom zestawy zadań testowych i karty odpowiedzi, podaj czas przeznaczony
na udzielanie odpowiedzi.
8. Postaraj się stworzyć odpowiednią atmosferę podczas przeprowadzania pomiaru
dydaktycznego (rozładuj niepokój, zachęć do sprawdzenia swoich możliwości).
9. Kilka minut przed zakończeniem sprawdzianu przypomnij uczniom o zbliżającym się
czasie zakończenia udzielania odpowiedzi.
10. Zbierz karty odpowiedzi oraz zestawy zadań testowych.
11. Sprawdź wyniki i wpisz do arkusza zbiorczego.
12. Przeprowadź analizę uzyskanych wyników sprawdzianu i wybierz te zadania, które
sprawiły uczniom największe trudności.
13. Ustal przyczyny trudności uczniów w opanowaniu wiadomości i umiejętności.
14. Opracuj wnioski do dalszego postępowania, mającego na celu uniknięcie niepowodzeń
dydaktycznych – niskie wyniki przeprowadzonego sprawdzianu.
Instrukcja dla ucznia
1. Przeczytaj uważnie instrukcję.
2. Podpisz imieniem i nazwiskiem kartę odpowiedzi.
3. Zapoznaj się z zestawem zadań testowych.
4. Test zawiera 20 zadań dotyczących jednostki „Wykonywanie analizy jakościowej
i ilościowej produktów leczniczych”.
5. Zadania są zamknięte wielokrotnego wyboru.
6. Tylko jedna odpowiedź jest prawidłowa.
7. Udzielaj odpowiedzi na załączonej karcie odpowiedzi.
8. Prawidłowe odpowiedzi zaznacz w odpowiedniej rubryce znakiem X.
9. Na rozwiązanie testu masz 45 minut.
10. Kolejność rozwiązania jest dowolna.
11. W przypadku pomyłki błędną odpowiedź zakreśl kółkiem, a następnie prawidłową
zaznacz X.
12. Uważnie przeczytaj zestaw zadań testowych.
13. Jeżeli będziesz miał problem z udzieleniem odpowiedzi na jakieś pytanie, zostaw je,
przejdź do następnych a do niego wrócisz na końcu.
14. Po zakończeniu rozwiązywania zadań, sprawdź w karcie odpowiedzi, czy dla wszystkich
zadań zaznaczyłeś odpowiedź.
15. Rozwiązuj zadania samodzielnie.
Powodzenia.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
26
ZESTAW ZADAŃ TESTOWYCH
1. Próbka ogólna to
a) próbka jednostkowa pobrana z partii materiału.
b) próbka pierwotna pobrana z partii materiału.
c) połączone próbki pierwotne pobrane z partii materiału.
d) próbka przeznaczona do badań.
2. Pomiar skręcalności właściwej wykonujemy
a) refraktometrem.
b) polarymetrem.
c) spektofotometrem z przystawką TR.
d) spektofotometrem z przystawką TK.
3. Odczynnikiem grupowym kationów III grupy według podziału Bunsena jest
a) amid kwasu tiooctowego wobec HCl.
b) amid kwasu tiooctowego wobec NH
3
· H
2
O.
c) amid kwasu tiooctowego wobec NH
4
Cl
d) amid kwasu tiooctowego wobec NH
3
·H
2
O, NH
4
Cl.
4. Aniony grupy II z roztworem AgNO
3
a) nie tworzą osadu.
b) wytrącają się w postaci białego osadu.
c) wytrącają się w postaci osadu rozpuszczalnego w HNO
3.
d) wytrącają się w postaci osadu nierozpuszczalnego w HNO
3.
5. W przypadku poparzenia ręki stężonym kwasem solnym w pierwszej kolejności należy
ranę
a) przemyć wodą utlenioną.
b) przemyć roztworem amoniaku.
c) przemyć dużą ilością wody.
d) przemyć 1 % roztworem NaHCO
3.
6. Miareczkowanie podstawieniowe polega na tym, że
a) miareczkujemy substancję będącą produktem reakcji składnika oznaczanego
z jakimkolwiek odczynnikiem.
b) miareczkujemy bezpośrednio mianowanym roztworem.
c) dodajemy
do
analizy
roztworu
mianowanego
w
nadmiarze,
nadmiar
odmiareczkowujemy.
d) miareczkujemy roztworem pomocniczym.
7. W metodach miareczkowych przy doborze wskaźnika wskazane jest aby
a) PK=PR.
b) PK>PR.
c) PK<PR.
d) PK≠PR.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
27
8. Do metod optycznych, które wykorzystują światło i jego oddziaływanie na materię nie
należy
a) spektrofotometria.
b) polarografia.
c) refraktometria.
d) polarymetria.
9. Zawartość kwasu askorbowego oznaczamy
a) metodą jodometryczną.
b) metodą manganometryczną.
c) metodą alkacymetryczną.
d) metodą argentometryczną.
10. Jodometria to dział analizy miareczkowej, w którym wskaźnikiem jest
a) roztwór jodu.
b) roztwór KMnO
4
.
c) skrobia
d) wskaźniki redoks.
11. Stratę masy po suszeniu substancji sproszkowanych przeprowadzamy
a) w temperaturze 50-60
o
C.
b) w temperaturze 60-90
o
C.
c) w temperaturze 100-105
o
C.
d) w temperaturze dobranej do rodzaju substancji.
12. Roztwór mianowany to
a) roztwór odczynnika chemicznego.
b) roztwór do badania tożsamości.
c) roztwór do badania czystości.
d) roztwór o dokładnie znanym stężeniu.
13. Do wykonania miareczkowania potrzebny jest następujący zestaw szkła
a) biureta, kolba stożkowa, pipeta.
b) biureta, kolba miarowa, pipeta.
c) biureta, kolba miarowa, cylinder.
d) biureta, kolba miarowa, pipeta jednomiarowa.
14. Badanie tożsamości polega na
a) identyfikacji.
b) określeniu zawartości.
c) określeniu czystości.
d) wszystkie odpowiedzi są poprawne.
15. Sączenie osadów drobnoziarnistych przeznaczonych do prażenia przeprowadzamy na
a) sączkach gęstych.
b) sączkach średnich.
c) sączkach rzadkich.
d) saczkach z dnem porowatym.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
28
16. Metodą rozdzielania i oczyszczania wykorzystującą prężność pary jest
a) ekstrakcja.
b) destylacja.
c) krystalizacja.
d) sublimacja.
17. W laboratorium najwłaściwszymi metodami badań są metody
a) precyzyjne i dokładne.
b) precyzyjne i mało dokładne.
c) mało precyzyjne i dokładne.
d) mało precyzyjne i mało dokładne.
18. Roztwór azotanu srebra używamy do określenia tożsamości
a) jonów azotanowych (V) [NO
3
-
].
b) jonów chlorkowych [Cl
-
].
c) jonów wapnia [Ca
2+
].
d) jonów cynku [Zn
2+
].
19. Do badania tożsamości syropu zwykłego używamy
a) odczynnika Fehlinga.
b) roztwór Lugola.
c) odczynnika Nesslera.
d) odczynnika Schiffa.
20. Ile wodorotlenku sodu należy odważyć aby sporządzić 1 l roztworu o stężeniu
0,05 mol/l?
a) 0,2 g.
b) 2 g.
c) 0,5 g.
d) 5 g.
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
29
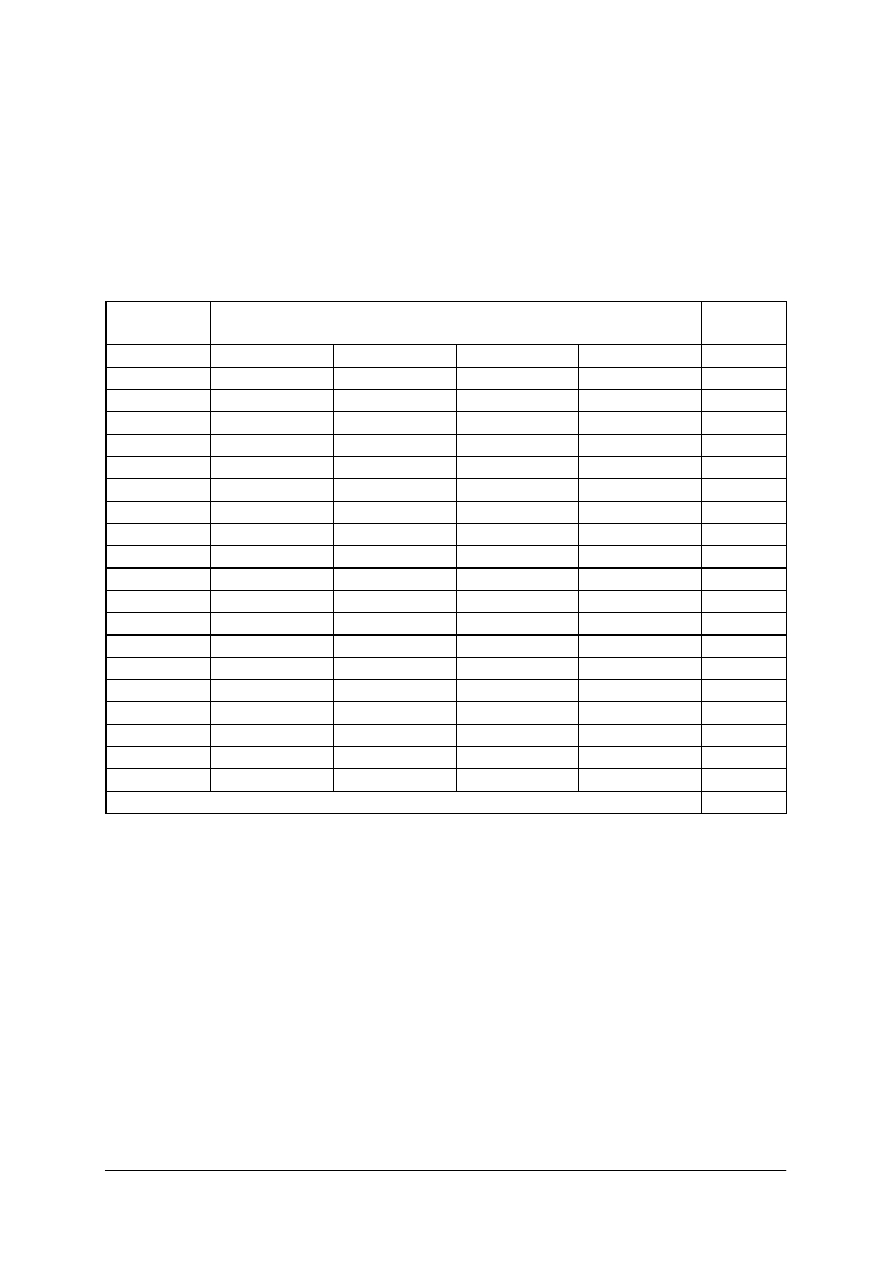
KARTA ODPOWIEDZI
Imię i nazwisko..........................................................................................
Wykonywanie analizy jakościowej i ilościowej produktów leczniczych
Zakreśl poprawną odpowiedź.
Nr
zadania
Odpowiedź
Punkty
1
a
b
c
d
2
a
b
c
d
3
a
b
c
d
4
a
b
c
d
5
a
b
c
d
6
a
b
c
d
7
a
b
c
d
8
a
b
c
d
9
a
b
c
d
10
a
b
c
d
11
a
b
c
d
12
a
b
c
d
13
a
b
c
d
14
a
b
c
d
15
a
b
c
d
16
a
b
c
d
17
a
b
c
d
18
a
b
c
d
19
a
b
c
d
20
a
b
c
d
Razem:

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
30
Test 2
Test dwustopniowy do jednostki modułowej „Wykonywanie analizy
jakościowej i ilościowej produktów leczniczych”
Test składa się z 20 zadań wielokrotnego wyboru, z których:
−
zadania 2, 3, 5, 6, 7, 9, 12, 13, 14, 15, 17, 20 są z poziomu podstawowego,
−
zadania 1, 4, 8, 10, 11, 16, 18, 19 są z poziomu ponadpodstawowego.
Punktacja zadań: 0 lub 1 punkt
Za każdą prawidłową odpowiedź uczeń otrzymuje 1 punkt. Za złą odpowiedź lub jej brak
uczeń otrzymuje 0 punktów.
Proponuje się następujące normy wymagań – uczeń otrzyma następujące
oceny szkolne:
−
dopuszczający – za rozwiązanie co najmniej 10 zadań z poziomu podstawowego,
−
dostateczny – za rozwiązanie co najmniej 12 zadań z poziomu podstawowego,
−
dobry – za rozwiązanie 16 zadań, w tym co najmniej 4 z poziomu ponadpodstawowego,
−
bardzo dobry – za rozwiązanie 18 zadań, w tym co najmniej 6 z poziomu
ponadpodstawowego.
Klucz odpowiedzi: 1. c, 2. b, 3. b, 4. a, 5. d, 6. d, 7. a, 8. d, 9. c, 10. d, 11. a,
12. b, 13. d, 14. a, 15. a, 16. b, 17. c, 18. a, 19. c, 20. b.
Plan testu
Nr
zad.
Cel operacyjny
(mierzone osiągnięcia ucznia)
Kategoria
celu
Poziom
wymagań
Poprawna
odpowiedź
1
Wykonać oznaczenia z zakresu analizy
jakościowej związków nieorganicznych
i organicznych
C
PP
c
2
Wykonać oznaczenia z zakresu analizy
jakościowej związków nieorganicznych
i organicznych
A
P
b
3
Przechować zgodnie z zasadami próbki
analityczne substancji leczniczych
A
P
b
4
Obliczyć wyniki analizy ilościowej
z wykorzystaniem metod matematycznych,
graficznych i statystycznych
C
PP
a
5
Przeprowadzić wybranymi metodami analizę
jakościową i ilościową, klasyczną i instrumentalną
leków, surowców farmaceutycznych i produktów
leczniczych
A
P
d
6
Obsłużyć sprzęt, aparaturę oraz urządzenia
stosowane w laboratoriach
A
P
d

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
31
7 Wykonać podstawowe czynności laboratoryjne
B
P
a
8
Obsłużyć sprzęt, aparaturę oraz urządzenia
stosowane w laboratoriach
C
PP
d
9
Określić tożsamość surowców farmaceutycznych
i środków leczniczych
C
P
c
10
Zastosować metody wagowe, miareczkowe
i instrumentalne do badania czystości i zawartości
substancji leczniczych
C
PP
d
11
Zastosować obowiązujące normy oceny jakości
produktów leczniczych i surowców różnego
pochodzenia
D
PP
a
12
Dokonać rozdziału leków złożonych metodą:
destylacji, ekstrakcji, wytrącania osadów,
sączenia, przemywania, wirowania, krystalizacji
B
P
b
13
Przeprowadzić wybranymi metodami analizę
jakościową i ilościową, klasyczną i instrumentalną
leków, surowców farmaceutycznych i produktów
leczniczych
A
P
d
14
Pobrać i przygotować próbki do badań
A
P
a
15
Obliczyć wyniki analizy ilościowej
z wykorzystaniem metod matematycznych,
graficznych i statystycznych,
C
P
a
16
Obliczyć wyniki analizy ilościowej
z wykorzystaniem metod matematycznych,
graficznych i statystycznych
D
PP
b
17
Wykonać oznaczenia z zakresu analizy
jakościowej związków nieorganicznych
i organicznych
A
P
c
18
Określić tożsamość surowców farmaceutycznych
i środków leczniczych
C
PP
a
19
Wykonać oznaczenia z zakresu analizy
jakościowej związków nieorganicznych
i organicznych
C
PP
c
20
Określić tożsamość surowców farmaceutycznych
i środków leczniczych
B
P
b

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
32
Przebieg testowania
Instrukcja dla nauczyciela
1. Ustal z uczniami termin przeprowadzenia sprawdzianu z co najmniej jednotygodniowym
wyprzedzeniem.
2. Omów z uczniami cel stosowania pomiaru dydaktycznego.
3. Zapoznaj uczniów z rodzajem zadań podanych w zestawie oraz z zasadami punktowania.
4. Przeprowadź z uczniami próbę udzielania odpowiedzi na takie typy zadań testowych, jakie
będą w teście.
5. Omów z uczniami sposób udzielania odpowiedzi (karta odpowiedzi).
6. Zapewnij uczniom możliwość samodzielnej pracy.
7. Rozdaj uczniom zestawy zadań testowych i karty odpowiedzi, podaj czas przeznaczony
na udzielanie odpowiedzi.
8. Postaraj się stworzyć odpowiednią atmosferę podczas przeprowadzania pomiaru
dydaktycznego (rozładuj niepokój, zachęć do sprawdzenia swoich możliwości).
9. Kilka minut przed zakończeniem sprawdzianu przypomnij uczniom o zbliżającym się
czasie zakończenia udzielania odpowiedzi.
10. Zbierz karty odpowiedzi oraz zestawy zadań testowych.
11. Sprawdź wyniki i wpisz do arkusza zbiorczego.
12. Przeprowadź analizę uzyskanych wyników sprawdzianu i wybierz te zadania, które
sprawiły uczniom największe trudności.
13. Ustal przyczyny trudności uczniów w opanowaniu wiadomości i umiejętności.
14. Opracuj wnioski do dalszego postępowania, mającego na celu uniknięcie niepowodzeń
dydaktycznych – niskie wyniki przeprowadzonego sprawdzianu.
Instrukcja dla ucznia
1. Przeczytaj uważnie instrukcję.
2. Podpisz imieniem i nazwiskiem kartę odpowiedzi.
3. Zapoznaj się z zestawem zadań testowych.
4. Test zawiera 20 zadań dotyczących jednostki „Wykonywanie analizy jakościowej
i ilościowej produktów leczniczych”
5. Zadania są zamknięte wielokrotnego wyboru.
6. Tylko jedna odpowiedź jest prawidłowa.
7. Udzielaj odpowiedzi na załączonej karcie odpowiedzi.
8. Prawidłowe odpowiedzi zaznacz w odpowiedniej rubryce znakiem X.
9. na rozwiązanie testu masz 45 minut.
10. Kolejność rozwiązań jest dowolna.
11. W przypadku pomyłki błędną odpowiedź zakreśl kółkiem, a następnie prawidłową
zaznacz X.
12. Uważnie przeczytaj zestaw zadań testowych.
13. Jeżeli będziesz miał problem z udzieleniem odpowiedzi na jakieś pytanie, zostaw je,
przejdź do następnych a do niego wrócisz na końcu.
14. Po zakończeniu rozwiązywania zadań, sprawdź w karcie odpowiedz, czy dla wszystkich
zadań zaznaczyłeś odpowiedź.
15. Rozwiązuj zadania samodzielnie.
Powodzenia!

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
33
ZESTAW ZADAŃ TESTOWYCH
1. Analizę mieszaniny kationów rozpoczynamy od
a) dodania odczynnika grupowego.
b) dodania odczynnika charakterystycznego.
c) dodania odczynnika specyficznego.
d) dodania odczynnika selektywnego.
2. Do identyfikacji kationu grupy pierwszej używamy
a) H
2
SO
4
.
b) HCl.
c) AKT.
d) Na
2
CO
3
.
3. Pobraną próbkę ogólną należy
a) natychmiast dostarczyć do laboratorium.
b) hermetycznie zamknąć.
c) rozdrobnić i wymieszać.
d) zważyć.
4. Jaka jest zawartość fenobarbitalu w badanej próbce, jeżeli do oznaczania zużyto 12,5 ml
etanolowego roztworu wodorotlenku sodu (0,1 mol/l) ?
1 ml etanolowego roztworu NaOH odpowiada 23,22 mg fenobarbitalu.
a) 0,29 g.
b) 2,9 g.
c) 0,35 g
.
d) 3,5 g
.
5. Laktozę w substancji leczniczej oznaczamy za pomocą
a) areometru.
b) refraktometru.
c) piknometru.
d) polarymetru
.
6. Zgodnie z zasadami ważenia na wadze analitycznej ważymy
a) bezpośrednio na szalce.
b) przedmioty gorące.
c) przedmioty zimne.
d) na szkiełku zegarkowym.
7. Podstawową czynnością w analizie wagowej jest wytrącanie osadów. Celem otrzymania
właściwego osadu substancja badana i odczynnik strącający powinny być
a) substancja badana – rozcieńczona, odczynnik – rozcieńczony.
b) substancja badana – stężona, odczynnik – stężony.
c) substancja badana – rozcieńczona, odczynnik – stężony.
d) substancja badana – stężona, odczynnik – rozcieńczony.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
34
8. Schemat przedstawiony na rysunku przedstawia
a) kolorymetr.
b) polarymetr.
c) spektrometr.
d) spektrofotometr.
9. Do badania tożsamości CaBr
2
użyjesz
a) reakcji identyfikującej jony Ca
2+
.
b) reakcji identyfikującej jony Br
-
.
c) reakcji identyfikującej jony Ca
2+
i Br
-
.
d) wszystkie odpowiedzi są poprawne.
10. Zawartość bizmutu w substancjach leczniczych oznaczymy za pomocą roztworu
a) AgNO
3
.
b) I
2
.
c) NaOH.
d) EDTA.
11. Przy ocenie jakości roztworów leczniczych, według Farmakopei Polskiej, bierzemy pod
uwagę
a) lepkość.
b) temperaturę topnienia.
c) temperaturę krzepnięcia.
d) liczbę nadtlenkową.
12. Do rozdzielenia substancji stałych stosuje się
a) destylację.
b) krystalizację.
c) rektyfikację.
d) destylację z parą wodną.
13. Badanie zawartości kwasu acetylosalicylowego przeprowadza się za pomocą
a) refraktometrii.
b) polarymetrii.
c) kompleksometrii.
d) alkacymetrii.
14. Próbka pobrana jednym zaczerpnięciem czerpaka to próbka
a) pierwotna.
b) ogólna.
c) laboratoryjna.
d) porównawcza.
Monochromator
Próbka
Detektor

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
35
15. Wykonano analizę próbki za pomocą spektrofotometru. Każdy z badających uzyskał
następujące wyniki: 0,30 g, 0,32 g, 0,29 g, 0,32 g, 0,30 g zawartości chlorowodorku
oksytetracykliny. Średnia zawartość chlorowodorku oksytetracykliny wynosi
a) 0,31 g.
b) 0,32 g.
c) 0,30 g.
d) 0,29 g.
16. Zawartość wody w kwasie acetylosalicylowym oznaczamy metodą
a) prażenia.
b) suszenia.
c) strącania osadu.
d) destylacji.
17. W skład redoksymetrii nie wchodzi
a) jodometria.
b) manganometria.
c) merkurymetria.
d) bromianometria.
18. Właściwości redukujące środków leczniczych stwierdzamy za pomocą
a) odczynnika Fehlinga.
b) roztworu skrobi.
c) odczynnika Ehrlicha.
d) odczynnika Nesslera.
19. Do badanej substancji leczniczej dodano alkohol i stężony kwas siarkowy. W wyniku
reakcji pojawił się przyjemny zapach. Na tej podstawie można stwierdzić, że badana
substancja to
a) eter.
b) ester.
c) kwas karboksylowy.
d) aldehyd.
20. Przed przystąpieniem do mierzenia spektrofotometrem należy przeprowadzić
a) konserwację.
b) kalibrację.
c) wymianę żarówki.
d) wszystkie odpowiedzi są poprawne.
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
36
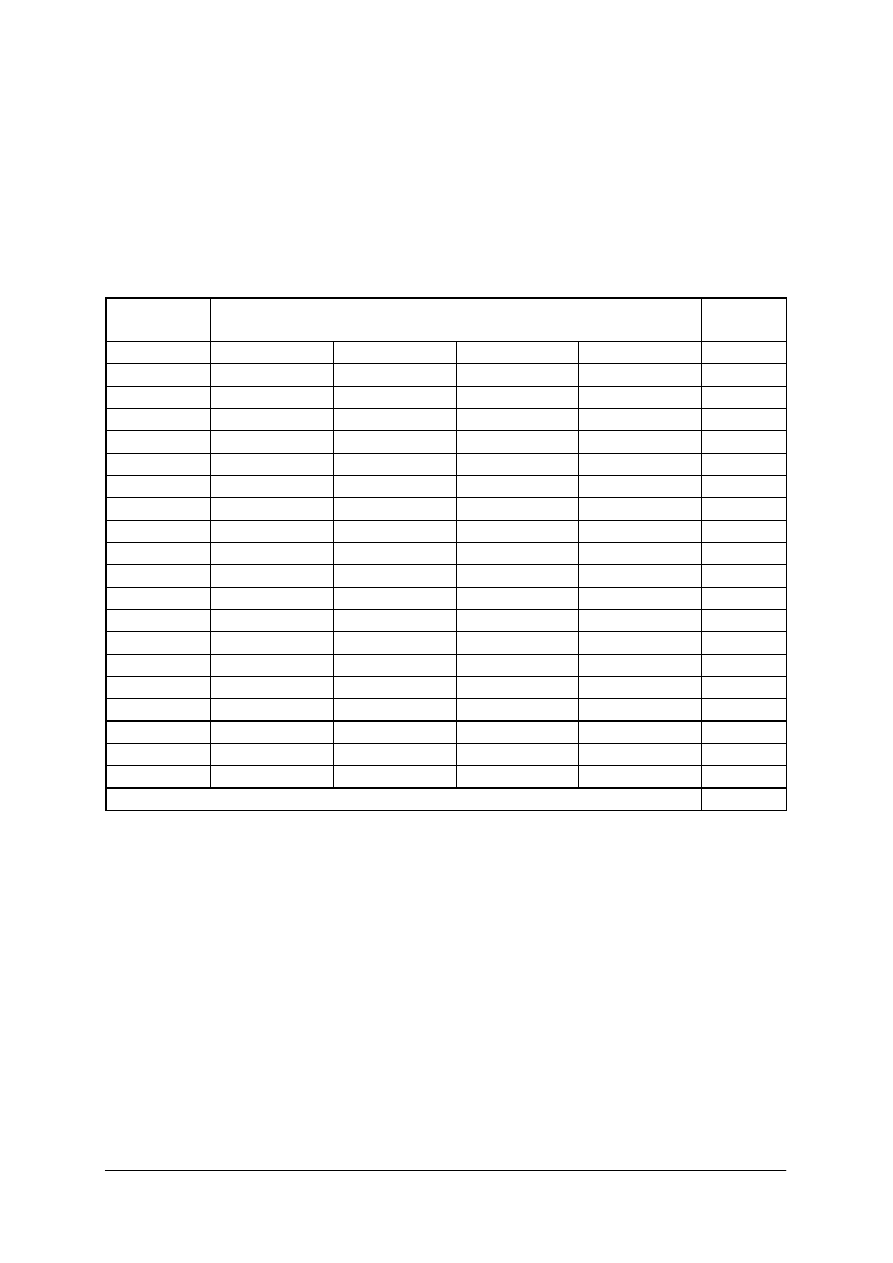
KARTA ODPOWIEDZI
Imię i nazwisko..........................................................................................
Wykonywanie analizy jakościowej i ilościowej produktów leczniczych
Zakreśl poprawną odpowiedź.
Nr
zadania
Odpowiedź
Punkty
1
a
b
c
d
2
a
b
c
d
3
a
b
c
d
4
a
b
c
d
5
a
b
c
d
6
a
b
c
d
7
a
b
c
d
8
a
b
c
d
9
a
b
c
d
10
a
b
c
d
11
a
b
c
d
12
a
b
c
d
13
a
b
c
d
14
a
b
c
d
15
a
b
c
d
16
a
b
c
d
17
a
b
c
d
18
a
b
c
d
19
a
b
c
d
20
a
b
c
d
Razem:

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
37
7. LITERATURA
1. Cygański A.: Chemiczne metody analizy ilościowej. WNT, Warszawa 1999
2. Cygański A.: Metody spektroskopowe w analizie chemicznej. WNT, Warszawa 1997
3. Kocjan R. i wsp.: Chemia analityczna Tom I i II. PZWL, Warszawa 2001
4. Kohlmunzer S.: Farmakognozja. PZWL, Warszawa 2003
5. Lipiec T., Szmal Z.: Chemia analityczna z elementami analizy instrumentalnej. PZWL,
Warszawa 1996
6. Minczewski J., Marczenko Z.: Chemia analityczna Tom I i II. PWN, Warszawa 2001
7. Pawełczyk E., Płotkowiak Z., Zając M.: Chemiczna analiza leków. PZWL, Warszawa
1981
8. Sthal E.: Chromatograficzna i mikroskopowa analiza surowców roślinnych. PZWL,
Warszawa 1987
9. Strzelecka H., Kamińska J., Kowalski J., Walewska E.: Chemiczne metody badań
roślinnych surowców leczniczych. PZWL, Warszawa 1987
10. Szczepaniak H.: Metody instrumentalne w analizie chemicznej. PWN, Warszawa 2004
11. Zejc A., Gorczyca M.: Chemia leków. PZWL, Warszawa 2002
12. Farmakopea Polska IV PZWL, Warszawa 1970
13. Farmakopea Polska V PTFarm., Warszawa 1995-1999
14. Farmakopea Polska VI PTFarm, Warszawa 2002
15. Farmakopea Polska VII PTFarm, Warszawa 2006
Literatura metodyczna
1. Figurski J., Symela K. (red.): Modułowe programy nauczania w kształceniu zawodowym,
Wyd. ITEE, Radom 2001
2. Okoń W.: Wprowadzenie do dydaktyki ogólnej, Wydawnictwo Akademickie „Żak”,
Warszawa 2003
3. Plewka Cz.: Metodyka nauczania teoretycznych przedmiotów zawodowych, cz.I i II,
Wyd. ITEE, Radom 1999
4. Szlosek F.:Wstęp do dydaktyki przedmiotów zawodowych, Instytut Technologii
Eksploatacji, Radom
5. Symela K.(red.): Skuteczność kształcenia modułowego w Polsce w systemie szkolnej
i pozaszkolnej edukacji zawodowej, Wyd. ITEE, Radom 2003
Wyszukiwarka
Podobne podstrony:
więcej podobnych podstron