
16
FIZYKA ATOMOWA
LICZBY KWANTOWE W MODELU ATOMU BOHRA
Stan fizyczny elektronu poddanego działaniu jądra atomowego określają cztery
liczby kwantowe: główna (n), poboczna (l), magnetyczna (m), i spinowa (s).
1. Główna liczba kwantowa.
Liczba ta określa moment pędu elektronu związany z jego ruchem orbitalnym
h
n
L
====
; n
∈
∈
∈
∈
N
2. Poboczna liczba kwantowa.
Liczba ta jest związana z kształtem orbity elektronowej, a zatem również ma wpływ
na orbitalny moment pędu elektronu. Jeśli wielkości półosi orbity elektronowej
oznaczymy: a i b, to wielkość małej półosi jest równa:
b
a
l
n
====
++++
1
; l
∈
∈
∈
∈
{0,1,2,...... n-1}
m
ke
n
a
2
2
2
h
====
Energia kinetyczna elektronu zmienia się wraz ze zmianą momentu pędu. Zmiana
energii całkowitej jest zawsze związana ze zmianą energii kinetycznej, a zatem
zmiana momentu pędu oznacza zawsze zmianę energii całkowitej elektronu.
3. Magnetyczna liczba kwantowa.
Elektron poruszający się wokół jądra atomowego może być traktowany jako swoisty
prąd. Takiemu elektronowi można zatem przypisać moment magnetyczny. Jeśli
torem ruchu jest okrąg, otrzymujemy:
µµµµ
ππππ
ππππ
l
Is
e
T
s
eV
r
r
eVr
====
==== ⋅⋅⋅⋅ ====
====
2
2
2
Korzystając z pierwszego postulatu Bohra, otrzymujemy:
h
n
mVr
L
====
====
m
n
2
e
l
h
====
µµµµ
;
B
m
2
e
µµµµ
====
h
µµµµ
l
L
e
m
====
2
µµµµ
µµµµ
l
B
n
====
µµµµ
B
- magneton Bohra
Orbitalny moment magnetyczny ma ten sam kierunek co orbitalny moment pędu,
lecz wektory te mają przeciwne zwroty, bowiem ładunek elektronu jest ujemny.
17
Elektron krążący wokół jądra atomowego znajduje się w polu magnetycznym
wytworzonym przez macierzyste jądro, inne elektrony, lub wytworzonym przez
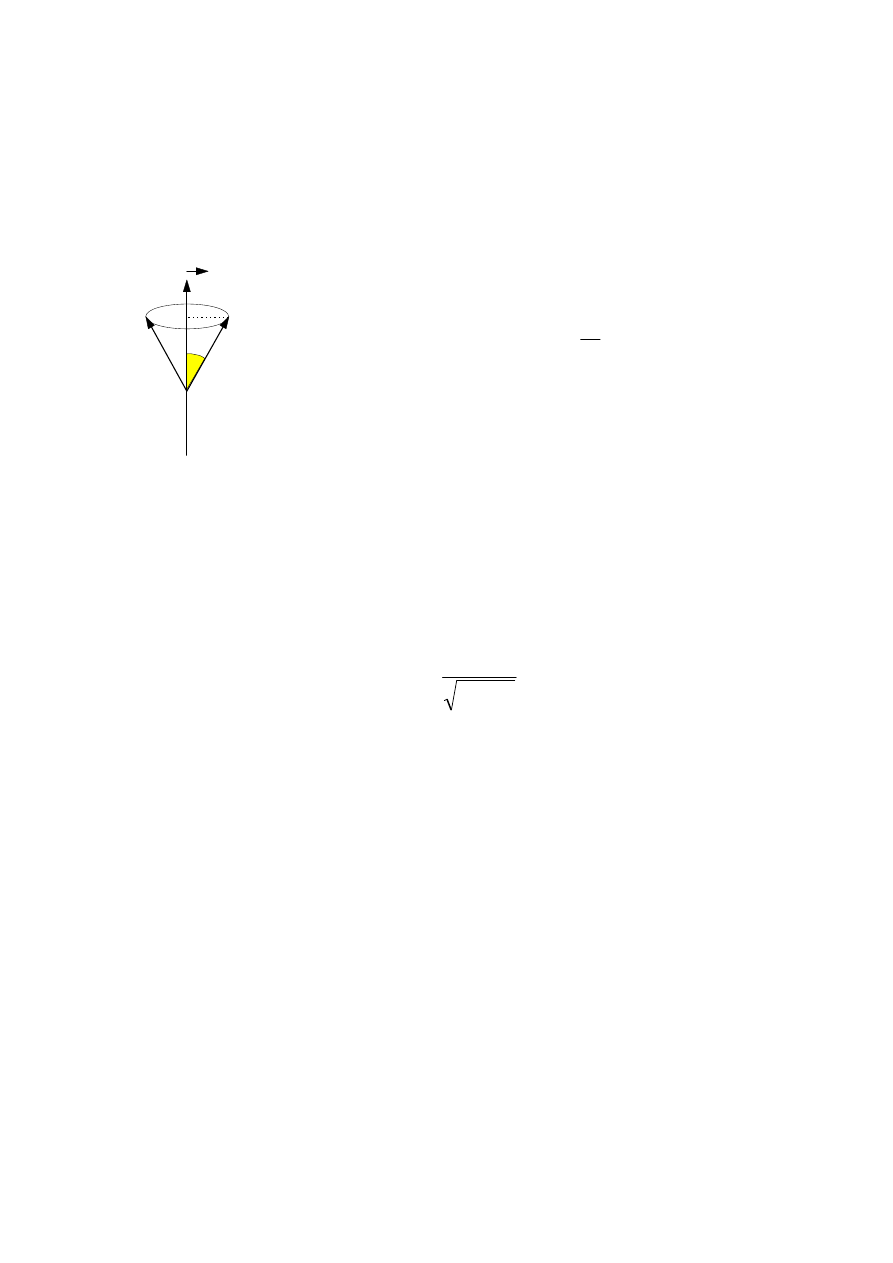
czynnik zewnętrzny. Wektor momentu pędu ustawia się w takim polu pod pewnym
kątem do indukcji tego pola. Liczbę możliwych ustawień, jak również wartości
kątów określa tzw. magnetyczna liczba kwantowa.
m
∈
∈
∈
∈
{-L, -l + 1...... 0 ....... + l }
W pierwszej wersji modelu atomu Bohra wartość kąta
αααα
określona była równaniem :
cos
αααα ====
m
l
Wektor momentu magnetycznego, jak również wektor
momentu pędu wykonuje obrót wokół osi
B
. Z takim
obrotem wiąże się energia:
E = -
µµµµ
L
B cos
αααα
Magnetyczna liczba kwantowa ma zatem także wpływ na energię elektronu.
Doświadczalne badania światła wysyłanego przez atomy w różnych warunkach
pozwalają określić wartość energii elektronu związanego z jądrem atomowym.
Wzrost dokładności pomiarów doprowadził do naniesienia poprawki. Obecnie uważa
się, że kąt jaki tworzy wektor momentu magnetycznego z kierunkiem
B
jest
określony równaniem:
(((( ))))
cos
αααα ====
++++
m
l l
1
Ostatecznie związek ten został potwierdzony przez falową teorię atomu.
4. Spinowa liczba kwantowa.
Ś
wiatło wysyłane przez pary sodu jest praktycznie monochromatyczne, jednakże
przy dokładnym badaniu okazuje się, że światło to zawiera dwie długości fali o
wartościach
5,890
⋅⋅⋅⋅
10
-7
m
i
5,896
⋅⋅⋅⋅
10
-7
m
. Oznacza to, że elektrony odpowiedzialne
za emisję tego promieniowania muszą nieznacznie różnić się energią. Podobne
efekty zaobserwowano także w przypadku innych pierwiastków. Aby wyjaśnić to
zjawisko przyjęto, że oprócz ruchu obiegowego elektron porusza się także ruchem
wirowym wokół własnej osi. Z ruchem wirowym elektronu jest związany zarówno
mechaniczny moment pędu zwany spinem, jak również spinowy moment
magnetyczny.
W roku 1925 S. Goudsmit i G.E. Uhlenbeck opierając się na danych
doświadczalnych przypisali spinowemu momentowi magnetycznemu elektronu
wartość równą magnetonowi Bohra.
µµµµ
µµµµ
s
B
====
µµµµ
B
= 0,9273
⋅⋅⋅⋅
10
-23
A m
2
B
µµµµ
L
αααα

18
Traktując elektron jak kulkę o promieniu
10
-15
m
, której ładunek jest równomiernie
rozłożony w przestrzeni, biorąc pod uwagę efekty relatywistyczne określono
spinowy moment pędu elektronu i spinowy moment magnetyczny:
ω
ω
ω
ω
ππππ
====
r
r
2
s
mr
8
L
ω
ω
ω
ω
ππππ
−−−−
====
µµµµ
r
r
2
s
er
8
Wynika stąd, że ich stosunek jest równy:
m
e
L
s
s
====
µµµµ
Spinowy moment pędu elektronu ma wartość:
h
h
2
1
m
2
e
e
m
e
m
L
B
s
====
====
µµµµ
⋅⋅⋅⋅
====
Ponieważ spinowy moment pędu elektronu jest wektorem, więc względna wartość
spinowego momentu pędu wynosi:
h
h
⋅⋅⋅⋅
====
±±±±
====
s
2
1
L
s
s
∈
∈
∈
∈ −−−−
1
2
1
2
,
Różne znaki odpowiadają przeciwnym zwrotom wektora
r
L
s
.
Z mechaniki kwantowej wynika poprawka, zgodnie z któr
ą
warto
ść
spinowego
momentu p
ę
du jest równa:
((((
))))
h
⋅⋅⋅⋅
++++
====
1
s
s
L
s
;
s
====
1
2
- spinowa liczba kwantowa
Uwzgl
ę
dniaj
ą
c powy
ż
sz
ą
poprawk
ę
, spinowy moment magnetyczny jest równy:
((((
))))
h
⋅⋅⋅⋅
++++
====
====
µµµµ
1
s
s
m
e
L
m
e
s
s
(((( ))))
µµµµ
µµµµ
s
B
s s
====
++++ ⋅⋅⋅⋅
2
1
µµµµ
µµµµ
s
B
====
⋅⋅⋅⋅
3
Spinowy moment magnetyczny powoduje,
ż
e wyst
ę
puje oddziaływanie mi
ę
dzy
wiruj
ą
cym elektronem i zewn
ę
trznym polem magnetycznym. Wektor
s
µµµµ
r
ustawia si
ę
w tym polu w taki sposób,
ż
e tworzy z wyró
ż
nionym kierunkiem k
ą
t okre
ś
lony przez
tzw. spinow
ą
magnetyczn
ą
liczb
ę
kwantow
ą
:
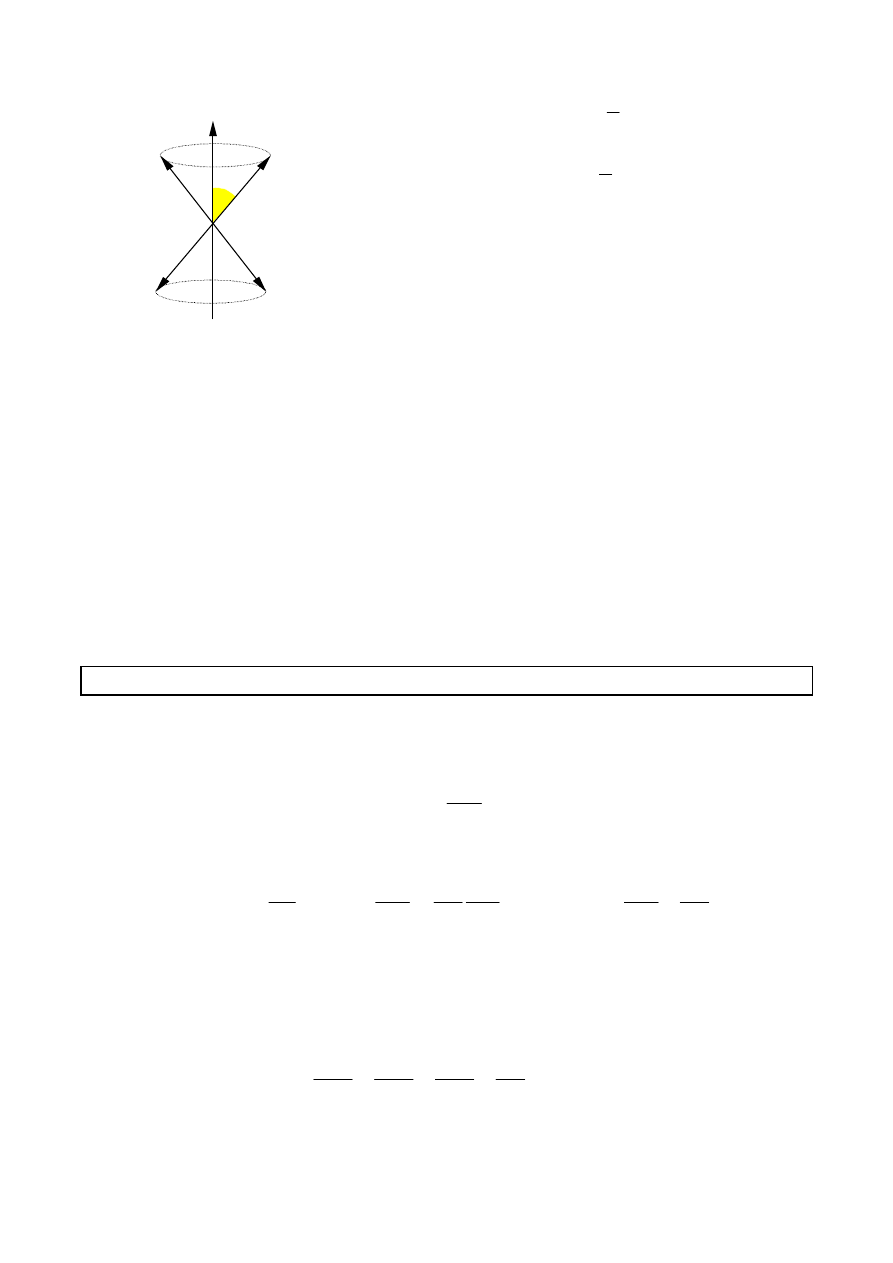
19
m
s
==== ±±±±
1
2
cos
αααα ====
1
2
Wektor spinowego momentu magnetycznego, jak
równie
ż
wektor spinowego momentu p
ę
du wykonuje
obrót wokół osi B
.
Z takim obrotem wi
ąż
e si
ę
energia: E = -
µµµµ
s
B cos
αααα
O energii elektronu zwi
ą
zanego z j
ą
drem atomowym
decyduj
ą
zatem cztery liczby kwantowe, chocia
ż
w ró
ż
nym stopniu. Zalet
ą
modelu
atomu Bohra jest mo
ż
liwo
ść
pogl
ą
dowego przedstawienia budowy atomu. Liczne
trudno
ś
ci jakie powstaj
ą
przy wyja
ś
nianiu zjawisk znanych z do
ś
wiadczenia
(nadprzewodnictwo, nadciekło
ść
, efekt tunelowy i inne) bior
ą
si
ę
st
ą
d,
ż
e cz
ą
stki
materialnej nie mo
ż
na traktowa
ć
jak małej, twardej kuleczki o ograniczonych
rozmiarach.
Słabo
ś
ci
ą
tego modelu jest narzucanie praw obowi
ą
zuj
ą
cych w
ś
wiecie atomu w
formie postulatów. Trudno
ś
ci modelu atomu Bohra usuwa model falowy atomu. Jest
to model matematyczny i jako taki mało pogl
ą
dowy. Obydwa modele wzajemnie si
ę
uzupełniaj
ą
. Posługuj
ą
c si
ę
modelem atomu nie mo
ż
na jednak zapomina
ć
o tym,
ż
e
ka
ż
dy model stanowi jedynie przybli
ż
enie rzeczywisto
ś
ci.
FALOWY MODEL ATOMU
Ka
ż
dej ruchomej cz
ą
stce mo
ż
na przypisa
ć
fal
ę
de Broglie’a o długo
ś
ci
λλλλ ====
h
mV
Fal
ę
jednowymiarow
ą
, biegn
ą
c
ą
w kierunku osi x
opisuje równanie:
y
A
t
x
V
====
−−−−
sin
ω
ω
ω
ω
ω
ω
ω
ω
lub
∂∂∂∂
∂∂∂∂
∂∂∂∂
∂∂∂∂
2
2
2
2
2
1
y
x
V
y
t
====
wzgl
ę
dnie
∂∂∂∂
∂∂∂∂
ω
ω
ω
ω
2
2
2
2
0
y
x
V
y
++++
====
Fala taka odpowiadałaby cz
ą
stce poruszaj
ą
cej si
ę
w kierunku
x
.
W przestrzeni
wokół j
ą
dra atomowego znajduj
ą
si
ę
elektrony, które poruszaj
ą
si
ę
pod działaniem
sił kulombowskich. Ka
ż
demu z nich mo
ż
na przypisa
ć
przestrzenn
ą
fal
ę
kulist
ą
opisan
ą
równaniem :
∂∂∂∂ ψ
ψ
ψ
ψ
∂∂∂∂
∂∂∂∂ ψ
ψ
ψ
ψ
∂∂∂∂
∂∂∂∂ ψ
ψ
ψ
ψ
∂∂∂∂
ω
ω
ω
ω ψψψψ
2
2
2
2
2
2
2
2
0
x
y
z
V
++++
++++
++++
====
αααα
B
r
s
µµµµ
r
s
µµµµ
r

20
W przypadku fal mechanicznych czy akustycznych
ψ
ψ
ψ
ψ
jest funkcj
ą
opisuj
ą
c
ą
wychylenie cz
ą
steczek o
ś
rodka uczestnicz
ą
cych w ruchu falowym. Dla elektronu w
polu sił j
ą
dra atomowego,
ψ
ψ
ψ
ψ
jest to tzw. funkcja falowa, opisuj
ą
ca stan fizyczny
elektronu. Stała
ω
ω
ω
ω
jest zwi
ą
zana z okresem funkcji
ψ
ψ
ψ
ψ
,
a zatem równie
ż
z długo
ś
ci
ą
fali.
ω
ω
ω
ω
ππππ
2
2
2
2
2
4
V
T V
====
;
VT
h
p
==== ====
λλλλ
ω
ω
ω
ω
ππππ
V
h
p
p
2
2
2
2
2
2
2
4
====
====
h
Energia kinetyczna ruchomej cz
ą
stki wi
ąż
e si
ę
z jej p
ę
dem:
E
p
m
k
====
2
2
ω
ω
ω
ω
2
2
2
2
V
m
E
k
====
h
Energi
ę
kinetyczn
ą
mo
ż
na okre
ś
li
ć
jako ró
ż
nic
ę
pomi
ę
dzy energi
ą
całkowit
ą
i
potencjaln
ą
.
E
k
= E - E
p
((((
))))
ω
ω
ω
ω
2
2
2
2
V
m
E
E
p
====
−−−−
h
Stan fizyczny elektronu pozostaj
ą
cego w polu sił kulombowskich j
ą
dra atomowego
opisuje zatem funkcja
ψ
ψ
ψ
ψ
spełniaj
ą
ca równanie:
((((
))))
∂∂∂∂ ψ
ψ
ψ
ψ
∂∂∂∂
∂∂∂∂ ψ
ψ
ψ
ψ
∂∂∂∂
∂∂∂∂ ψ
ψ
ψ
ψ
∂∂∂∂
ψ
ψ
ψ
ψ
2
2
2
2
2
2
2
2
0
x
y
z
m
E
E
p
++++
++++
++++
−−−−
====
h
Powy
ż
sze równanie zostało podane w roku 1926 przez austriackiego fizyka -
teoretyka Erwina Schrödingera (1887 - 1961) - profesora wielu uczelni, m.in. w
Berlinie, Oxfordzie i Wrocławiu. Schrödinger jest jednym z twórców mechaniki
kwantowej. Za falow
ą
teori
ę
atomu otrzymał nagrod
ę
Nobla (w roku 1933).
Znalezienie rozwi
ą
zania równania Schrödingera jest mo
ż
liwe tylko w najprostszych
przypadkach. Zwykle trzeba stosowa
ć
przybli
ż
one metody rozwi
ą
za
ń
. Rozwi
ą
zaniem
równania Schrödingera jest funkcja
ψ
ψ
ψ
ψ
okre
ś
lona jedynie dla niektórych warto
ś
ci
energii. Poszczególnym warto
ś
ciom energii przypisuje si
ę
liczby kwantowe,
analogicznie jak w modelu atomu Bohra. W pierwszym przybli
ż
eniu warto
ś
ci
energii, dla których istniej
ą
funkcje falowe okre
ś
laj
ą
ce stan elektronu zale
żą
od
głównej liczby kwantowej (n). Zespół stanów o tej samej warto
ś
ci głównej liczby
kwantowej nazywa si
ę
powłok
ą
elektronow
ą
. Zbiór funkcji falowych opisuj
ą
cych
powłok
ę
elektronow
ą
zawiera n
2
funkcji. Ró
ż
ni
ą
si
ę
one nieznacznie warto
ś
ci
ą
21
energii, dla której s
ą
okre
ś
lone. Mo
ż
liwe warto
ś
ci energii w ramach powłoki okre
ś
la
przede wszystkim orbitalna liczba kwantowa l. Nazwa tej liczby kwantowej
wywodzi si
ę
z modelu atomu Bohra, gdzie liczba l
okre
ś
lała warto
ść
orbitalnego
momentu p
ę
du elektronu.
(((( ))))
h
1
l
l
L
++++
====
; l
∈
∈
∈
∈
{ 0,1,2....... n-1}
Dla l = 0
warto
ść
momentu p
ę
du elektronu byłaby równa zeru. Takiej mo
ż
liwo
ś
ci
model atomu Bohra nie przewidywał. W modelu falowym nie istnieje poj
ę
cie orbity
elektronowej, a zatem nazwa liczby kwantowej mo
ż
e by
ć
myl
ą
ca. Orbitaln
ą
liczb
ę
kwantow
ą
nale
ż
y rozumie
ć
jako jedn
ą
z liczb okre
ś
laj
ą
cych pewien podzbiór funkcji
falowych. Dla ka
ż
dej warto
ś
ci liczby l
istnieje zatem podzbiór funkcji falowych
okre
ś
lonych dla stanów ró
ż
ni
ą
cych si
ę
nieznacznie energi
ą
. Ten podzbiór funkcji
okre
ś
la podpowłok
ę
.
Mo
ż
liwe warto
ś
ci energii w ramach podpowłoki okre
ś
la magnetyczna liczba
kwantowa m
.
W modelu atomu Bohra okre
ś
lała ona rzut momentu magnetycznego
zwi
ą
zanego z ruchem orbitalnym, na kierunek pola magnetycznego.
(((( ))))
cos
αααα ====
++++
m
l l
1
; m
∈
∈
∈
∈
{ -l.....0.....+l }
W modelu falowym atomu liczba m
okre
ś
la nast
ę
pny podzbiór funkcji falowych, z
których ka
ż
da wyznacza jeden z mo
ż
liwych stanów układu j
ą
dro - elektron.
Funkcja falowa
ψ
ψ
ψ
ψ
jest funkcj
ą
o zmiennej zespolonej i jej warto
ś
ci nie mog
ą
by
ć
okre
ś
lone w zbiorze liczb rzeczywistych. Kwadrat funkcji
Ψ
Ψ
Ψ
Ψ
2
,
a dokładniej iloczyn
funkcji
ψ
ψ
ψ
ψ
i funkcji z ni
ą
sprz
ęż
onej
Ψ
Ψ
Ψ
Ψ
∗∗∗∗
jest funkcj
ą
okre
ś
lon
ą
w zbiorze liczb
rzeczywistych. Okre
ś
la on prawdopodobie
ń
stwo znalezienia si
ę
elektronu w
przestrzeni
wokół
j
ą
dra
atomowego.
Zbiór
punktów
przestrzeni
gdzie
prawdopodobie
ń
stwo znalezienia si
ę
elektronu jest najwi
ę
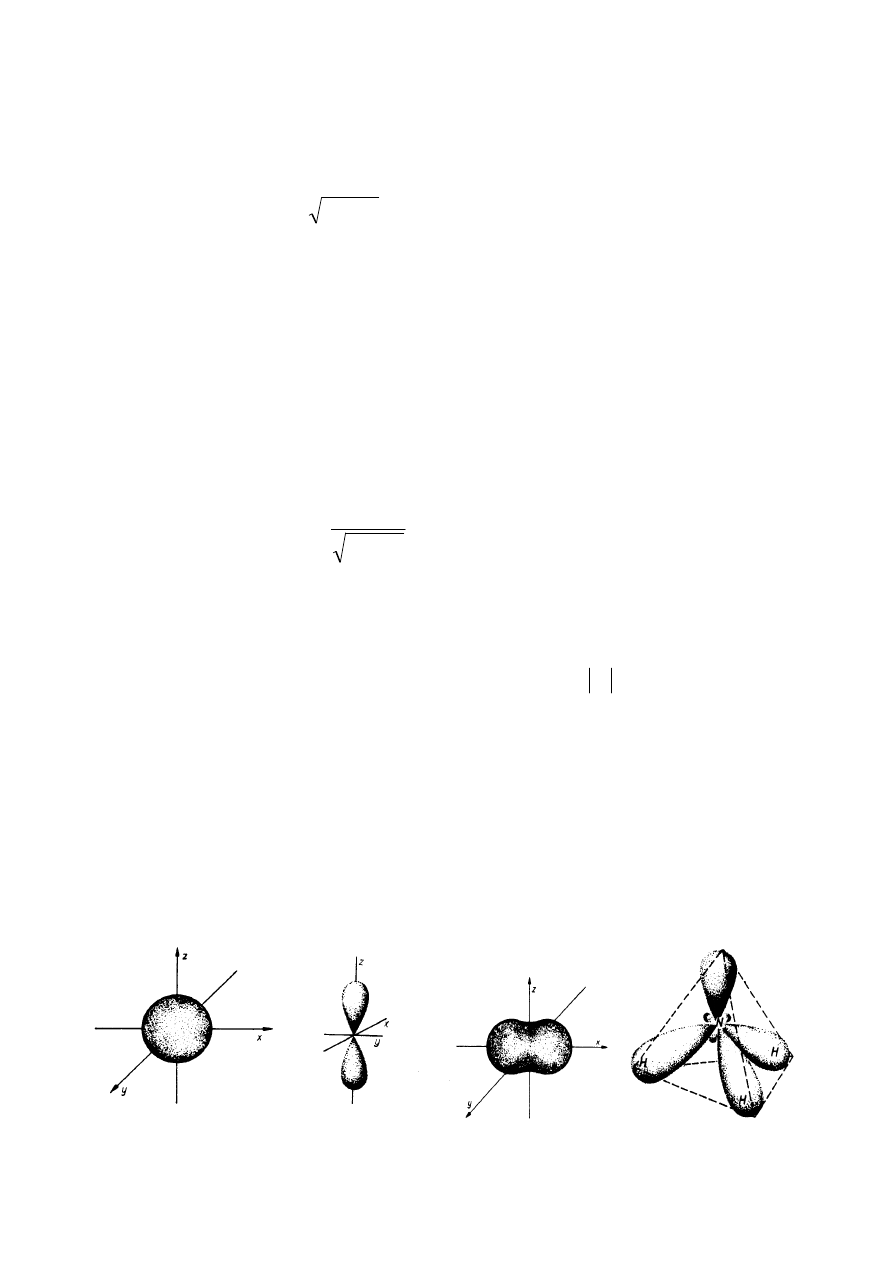
ksze, tworzy tzw. orbital.
Orbital okre
ś
la kształt chmury elektronowej wokół j
ą
dra atomowego. Cz
ą
steczce
mo
ż
na przypisywa
ć
orbitale cz
ą
steczkowe, które s
ą
kombinacj
ą
orbitali atomowych.
Nakładanie si
ę
chmur elektronowych decyduje o kierunkach powstałych wi
ą
za
ń
chemicznych.
Poni
ż
ej przedstawiono kilka charakterystycznych kształtów orbitali.
Orbital cząsteczkowy dla H
2
Orbital cząsteczkowy dla NH
3
Orbital atomowy S
Orbital atomowy P
z

22
Mechanika kwantowa Schrödingera nie przewidywała spinu elektronowego.
Istnienie spinu nale
ż
ało wprowadzi
ć
jako odr
ę
bny postulat. Wynika to st
ą
d,
ż
e teoria
ta była teori
ą
przybli
ż
on
ą
, zaniedbuj
ą
c
ą
efekty relatywistyczne. Wa
ż
nym
uzupełnieniem mechaniki kwantowej jest teoria spinu elektronowego opracowana
przez wielkiego angielskiego fizyka - teoretyka P.A.M. Diraca, profesora
uniwersytetów w Cambridge i w Oxfordzie, członka Royal Society. Teoria powstała
w roku 1929. W roku 1933 Dirac został laureatem nagrody Nobla. Stosuj
ą
c podobne
postulaty co Schrödinger, ale zast
ę
puj
ą
c nierelatywistyczny wzór na energi
ę
jego
odpowiednikiem relatywistycznym, Dirac wykazał,
ż
e elektron musi mie
ć
wewn
ę
trzny moment p
ę
du i wewn
ę
trzny moment magnetyczny. Był to wielki triumf
teorii relatywistycznej; nadało to poj
ę
ciu spinu elektronu solidn
ą
podstaw
ę
teoretyczn
ą
i nierozł
ą
cznie zwi
ą
zało go z efektami relatywistycznymi.
Spin elektronowy jest z samej swej natury wielko
ś
ci
ą
nieklasyczn
ą
. Wi
ą
zanie spinu
elektronowego z modelem klasycznym, w którym elektron jest wiruj
ą
c
ą
kulk
ą
przynosi wi
ę
cej szkody ni
ż
po
ż
ytku. Jedn
ą
z najbardziej imponuj
ą
cych cech
współczesnych teorii kwantów jest sposób, w jaki teorie te stopniowo prowadz
ą
do
bardziej
ś
cisłego opisu atomu. Pierwotny model atomu Bohra pozwalał jedynie na
wyja
ś
nienie najprostszych zjawisk zachodz
ą
cych w atomie wodoru, takich jak np.
serie widmowe. Model ten zawodził ju
ż
jednak nawet w przypadku atomu helu.
Falowy model atomu Schrödingera, z uzupełnieniami Diraca pozwala na poprawny
opis atomów zło
ż
onych. Posługiwanie si
ę
modelem falowym wymaga jednak
solidnego przygotowania matematycznego. Istotn
ą
trudno
ś
ci
ą
jest tak
ż
e konieczno
ść
zrezygnowania z wyobra
ż
enia sobie atomu w taki sposób, jaki nasuwa model atomu
Bohra.
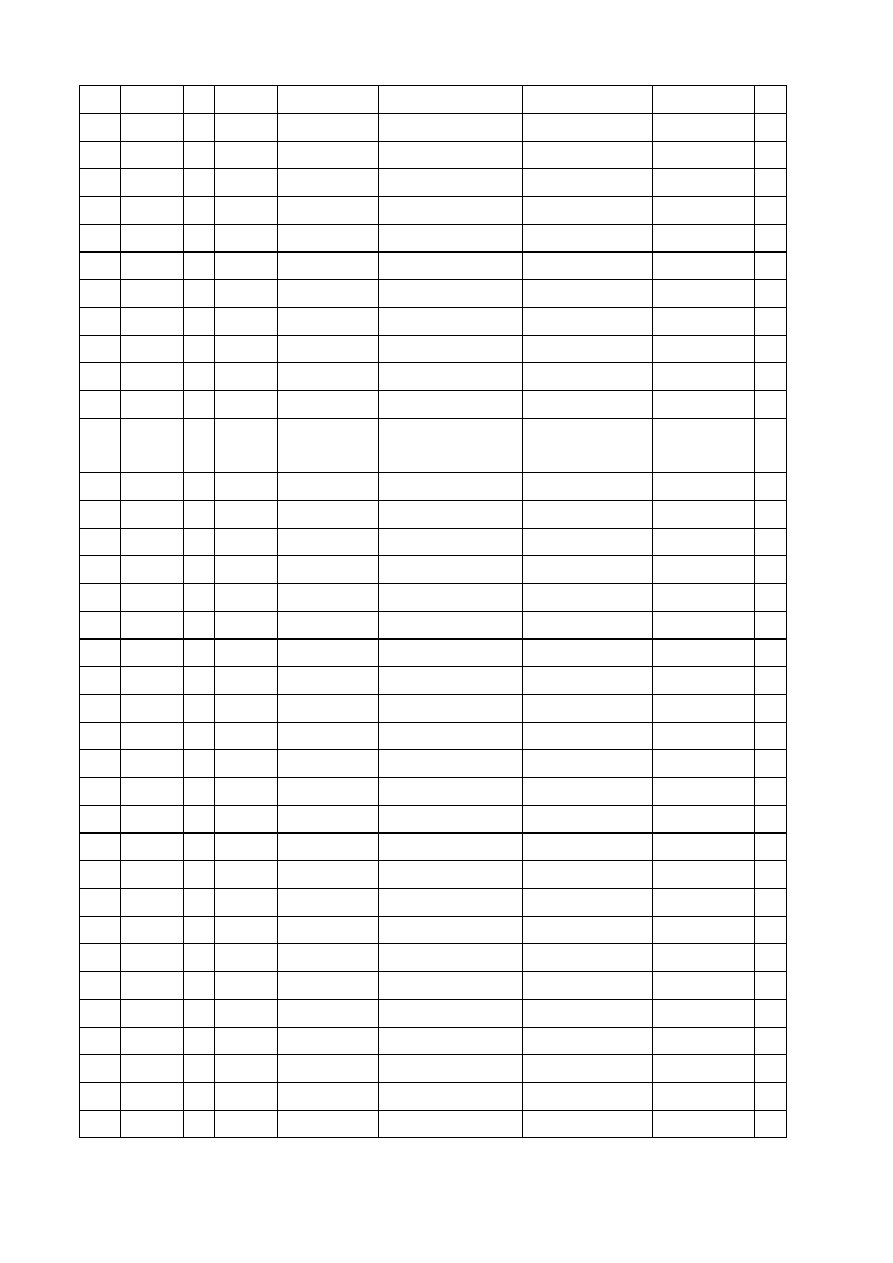
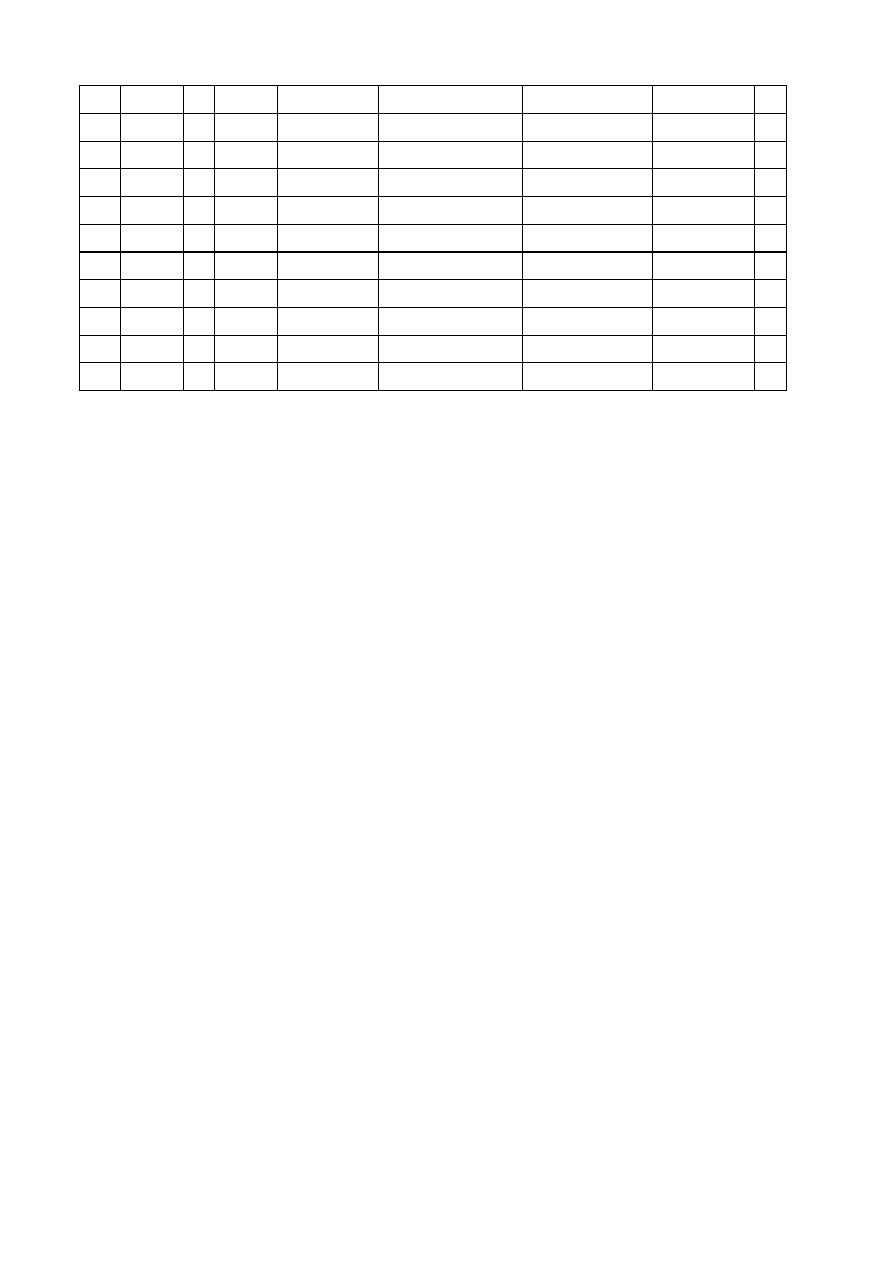
STANY PODSTAWOWE ATOMÓW
Warto
ść
energii elektronu zwi
ą
zanego z j
ą
drem atomowym jest okre
ś
lona przez
warto
ś
ci liczb kwantowych: głównej ( n )
,
orbitalnej ( l ), magnetycznej (
m
)
,
i
magnetycznej spinowej ( m
s
). Zbiór elektronów ka
ż
dego atomu podlega zakazowi
Pauliego, zgodnie z którym elektrony mog
ą
pozostawa
ć
w takich stanach energii,
które ró
ż
ni
ą
si
ę
przynajmniej jedn
ą
liczb
ą
kwantow
ą
. W stanie podstawowym
elektrony zajmuj
ą
stany o najmniejszej energii. Zamieszczona poni
ż
ej tabela
przedstawia
rozmieszczenie
elektronów
w
poszczególnych
powłokach
i
podpowłokach w stanie podstawowym.
l.p.
symbol
K
1s
L
2s 2p
M
2s 2p 2d
l.p
symbol
K
1s
L
2s 2p
M
3s 3p 3d
N
4s 4p 4d 4f
1
H
1
17
Cl
2
2 6
2 5
2
He
2
18
Ar
2
2 6
2 6
3
Li
2
1
19
K
2
2 6
2 6
1
4
Be
2
2
20
Ca
2
2 6
2 6
2
5
B
2
2 1
21
Sc
2
2 6
2 6 1
2
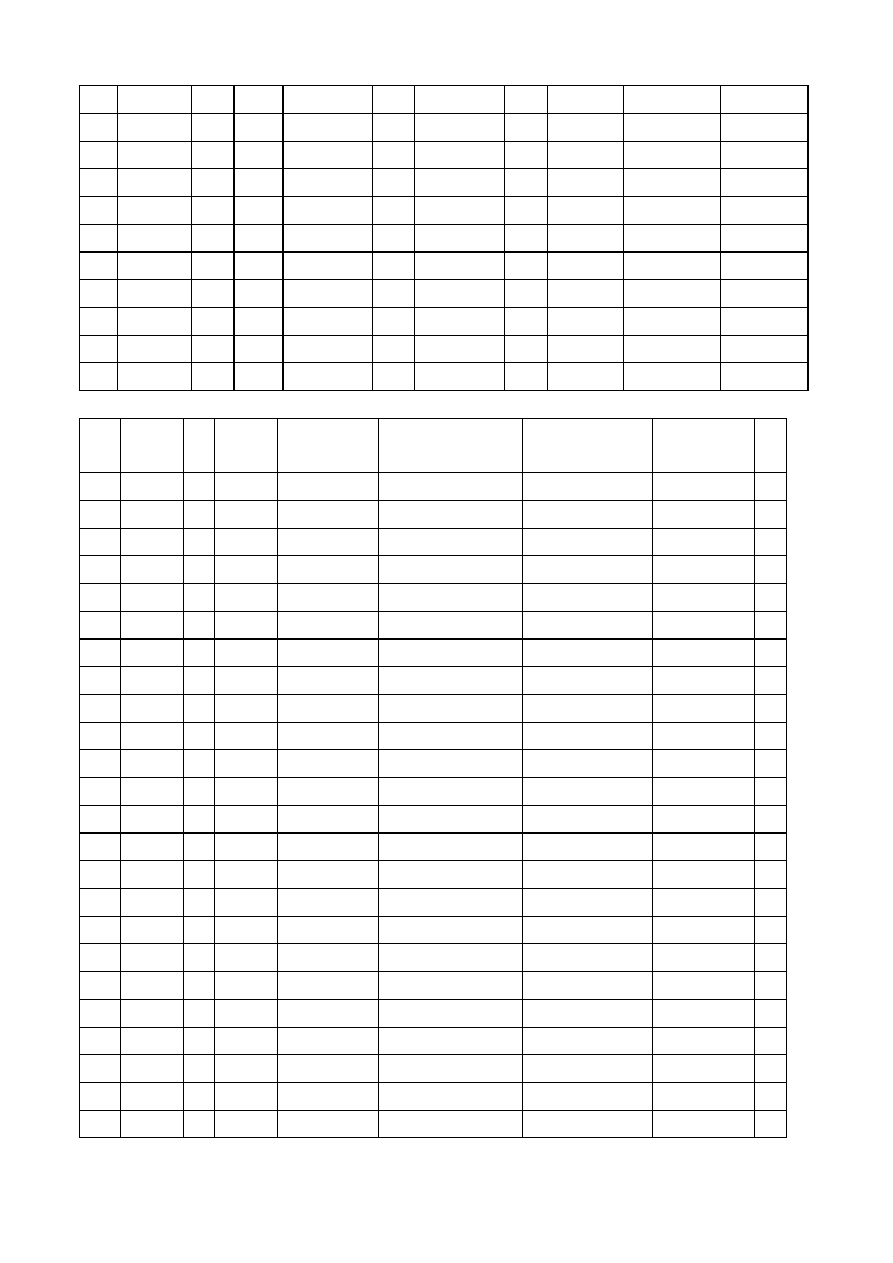
23
6
C
2
2 2
22
Ti
2
2 6
2 6 2
2
7
N
2
2 3
23
V
2
2 6
2 6 3
2
8
O
2
2 4
24
Cr
2
2 6
2 6 4
1
9
F
2
2 5
25
Mn
2
2 6
2 6 5
2
10
Ne
2
2 6
26
Fe
2
2 6
2 6 6
2
11
Na
2
2 6
1
27
Co
2
2 6
2 6 7
2
12
Mg
2
2 6
2
28
Ni
2
2 6
2 6 8
2
13
Al
2
2 6
2 1
29
Cu
2
2 6
2 6 9
1
14
Si
2
2 6
2 2
30
Zn
2
2 6
2 6 10
2
15
P
2
2 6
2 3
31
Ga
2
2 6
2 6 10
2 1
16
S
2
2 6
2 4
32
Ge
2
2 6
2 6 10
2 2
l.p
symbol
K
1s
L
2s 2p
M
3s 3p 3d
N
4s 4p 4d 4f
O
5s 5p 5d 5f
P
6s 6p 6d
Q
7s
33
As
2
2 6
2 6 10
2 3
34
Se
2
2 6
2 6 10
2 4
35
Br
2
2 6
2 6 10
2 5
36
Kr
2
2 6
2 6 10
2 6
37
Rb
2
2 6
2 6 10
2 6
1
38
Sr
2
2 6
2 6 10
2 6
2
39
Y
2
2 6
2 6 10
2 6 1
2
40
Zr
2
2 6
2 6 10
2 6 2
2
41
Nb
2
2 6
2 6 10
2 6 4
1
42
Mo
2
2 6
2 6 10
2 6 5
1
43
Tc
2
2 6
2 6 10
2 6 5
2
44
Ru
2
2 6
2 6 10
2 6 7
1
45
Rh
2
2 6
2 6 10
2 6 8
1
46
Pd
2
2 6
2 6 10
2 6 10
47
Ag
2
2 6
2 6 10
2 6 10
1
48
Cd
2
2 6
2 6 10
2 6 10
2
49
In
2
2 6
2 6 10
2 6 10
2 1
50
Sn
2
2 6
2 6 10
2 6 10
2 2
51
Sb
2
2 6
2 6 10
2 6 10
2 3
52
Tc
2
2 6
2 6 10
2 6 10
2 4
53
I
2
2 6
2 6 10
2 6 10
2 5
54
Xe
2
2 6
2 6 10
2 6 10
2 6
55
Cs
2
2 6
2 6 10
2 6 10
2 6
1
56
Ba
2
2 6
2 6 10
2 6 10
2 6
2
24
57
La
2
2 6
2 6 10
2 6 10
2 6 1
2
58
Ce
2
2 6
2 6 10
2 6 10 2
2 6
2
59
Pr
2
2 6
2 6 10
2 6 10 3
2 6
2
60
Nd
2
2 6
2 6 10
2 6 10 4
2 6
2
61
Pm
2
2 6
2 6 10
2 6 10 5
2 6
2
62
Sm
2
2 6
2 6 10
2 6 10 6
2 6
2
63
Eu
2
2 6
2 6 10
2 6 10 7
2 6
2
64
Gd
2
2 6
2 6 10
2 6 10 7
2 6 1
2
65
Tb
2
2 6
2 6 10
2 6 10 9
2 6
2
66
Dy
2
2 6
2 6 10
2 6 10 10
2 6
2
67
Ho
2
2 6
2 6 10
2 6 10 11
2 6
2
68
Er
2
2 6
2 6 10
2 6 10 12
2 6
2
l.p.
symbol
K
1s
L
2s 2p
M
3s 3p 3d
N
4s 4p 4d 4f
O
5s 5p 5d 5f
P
6s 6p 6d
Q
7s
69
Tm
2
2 6
2 6 10 2 6 10 13
2 6
2
70
Yb
2
2 6
2 6 10
2 6 10 14
2 6
2
71
Lu
2
2 6
2 6 10
2 6 10 14
2 6 1
2
72
Hf
2
2 6
2 6 10
2 6 10 14
2 6 2
2
73
Ta
2
2 6
2 6 10
2 6 10 14
2 6 3
2
74
W
2
2 6
2 6 10
2 6 10 14
2 6 4
2
75
Re
2
2 6
2 6 10
2 6 10 14
2 6 5
2
76
Os
2
2 6
2 6 10
2 6 10 14
2 6 6
2
77
Ir
2
2 6
2 6 10
2 6 10 14
2 6 7
2
78
Pt
2
2 6
2 6 10
2 6 10 14
2 6 9
1
79
Au
2
2 6
2 6 10
2 6 10 14
2 6 10
1
80
Hg
2
2 6
2 6 10
2 6 10 14
2 6 10
2
81
Tl
2
2 6
2 6 10
2 6 10 14
2 6 10
2 1
82
Pb
2
2 6
2 6 10
2 6 10 14
2 6 10
2 2
83
Bi
2
2 6
2 6 10
2 6 10 14
2 6 10
2 3
84
Po
2
2 6
2 6 10
2 6 10 14
2 6 10
2 4
85
At
2
2 6
2 6 10
2 6 10 14
2 6 10
2 5
86
Rn
2
2 6
2 6 10
2 6 10 14
2 6 10
2 6
87
Fr
2
2 6
2 6 10
2 6 10 14
2 6 10
2 6
1
88
Ra
2
2 6
2 6 10
2 6 10 14
2 6 10
2 6
2
89
Ac
2
2 6
2 6 10
2 6 10 14
2 6 10
2 6
2
90
Th
2
2 6
2 6 10
2 6 10 14
2 6 10
2 6 1
2
91
Pa
2
2 6
2 6 10
2 6 10 14
2 6 10 2
2 6 2
2
92
U
2
2 6
2 6 10
2 6 10 14
2 6 10 3
2 6 1
2
25
93
Np
2
2 6
2 6 10
2 6 10 14
2 6 10 4
2 6 1
2
94
Pu
2
2 6
2 6 10
2 6 10 14
2 6 10 5
2 6 1
2
95
Am
2
2 6
2 6 10
2 6 10 14
2 6 10 6
2 6 1
2
96
Cm
2
2 6
2 6 10
2 6 10 14
2 6 10 7
2 6 1
2
97
Bk
2
2 6
2 6 10
2 6 10 14
2 6 10 8
2 6 1
2
98
Cf
2
2 6
2 6 10
2 6 10 14
2 6 10 10
2 6
2
99
Es
2
2 6
2 6 10
2 6 10 14
2 6 10 11
2 6
2
100
Fm
2
2 6
2 6 10
2 6 10 14
2 6 10 12
2 6
2
101
Md
2
2 6
2 6 10
2 6 10 14
2 6 10 13
2 6
2
102
No
2
2 6
2 6 10
2 6 10 14
2 6 10 14
2 6
2
103
Lw
2
2 6
2 6 10
2 6 10 14
2 6 10 14
2 6 1
2
Wyszukiwarka
Podobne podstrony:
Fizyka atomowa
10 fizyka atomowa, POLITECHNIKA WROCŁAWSKA (2009), Semestr II, Fizyka 2
31, MIBM WIP PW, fizyka 2, laborki fiza(2), 25-Interferencja światła, pierścienie Newtona i interfer
cwicz-5, MIBM WIP PW, fizyka 2, laborki fiza(2), 25-Interferencja światła, pierścienie Newtona i int
16 (25)
FIZYKA ATOMOWA
zadania fizyka atomowa
Irak chce prawa do energii atomowej (16 11 2009)
zestaw 6-fizyka atomowa
Fizyka Kąkol wykład 25
II 13 Fizyka atomowa
fizyka atomowa, Studia, fizyka
Francuski Park jądrowy, Fizyka Atomowa
LABORATORIUM FIZYKI I - sprawko nr25, MIBM WIP PW, fizyka 2, laborki fiza(2), 25-Interferencja świat
FIZYKA ATOMOWA W GSI
Fizyka atomowa wzory
Fizyka atomowa
więcej podobnych podstron