Agnieszka Magiera Ewelina Zielińska
Sprawozdanie nr 9 - Konduktometryczne wyznaczanie stałej dysocjacji
Wstęp teoretyczny
Słaby jednoprotonowy kwas HA dysocjuje zgodnie z równaniem:
Równowaga tej reakcji zgodnie z prawem działania mas opisywana jest następującym równaniem:
Uwzględniając stopień dysocjacji α, stężenia poszczególnych składników roztworu można wyrazić jako część całkowitego stężenia kwasu c:
Po wstawieniu powyższych równań do równania i uproszczeniu otrzymujemy równanie opisujące prawo rozcieńczeń Ostwalda:
Stopień dysocjacji α można wyrazić jako stosunek przewodnictwa równoważnikowego λ danego elektrolitu do jego granicznego przewodnictwa równoważnikowego λ∞ (postulat Arrheniusa):
Po przekształceniu otrzymujemy równanie opisujące stałą dysocjacji Ka słabego kwasu z wykorzystaniem przewodnictwa równoważnikowego:
Dalsze przekształcenie prowadzi do równania o następującej formie:
Równanie to jest równaniem prostej typu
:
Po zmierzeniu przewodnictwa właściwego κ roztworu słabego kwasu dla różnych stężeń c można wyliczyć przewodnictwo równoważnikowe roztworu λ. Z wykresu funkcji 1/λ = f(cλ) w pierwszej kolejności wyznacza się λ∞ (z przecięcia prostej z osią y przy zerowej wartości na osi x), a następnie z nachylenia prostej stałą dysocjacji Ka.
Obliczenia
Obliczyłyśmy ze wzoru
stałą oporową sondy, gdzie:
S - przewodnictwo roztworu wzorcowego zmierzonego przez nas S=
H - przewodnictwo właściwe substancji wzorcowej (KCl), wartość tablicowa H= 0,0012211
Wyliczyłyśmy, korzystając z wcześniejszego wzoru, przewodnictwo badanych roztworów dla wszystkich stężeń:
Dla poszczególnych stężeń danych substancji, z wyznaczoną przez nas przewodnością na zajęciach, sporządziłyśmy tabelę, w której umieściłyśmy obliczone za pomocą powyższego wzoru przewodnictwa właściwe:
co |
CH3COOH |
CH3COONa |
HCl |
NaCl |
||||
|
S [mS] |
H[ |
S [mS] |
H[ |
S [mS] |
H[ |
S [mS] |
H[ |
1/16 |
0,35 |
4,55 |
|
|
|
|
|
|
1/32 |
0,22 |
2,86 |
1,87 |
24,3 |
9,90 |
128,70 |
2,77 |
36,0 |
1/64 |
0,16 |
2,08 |
1,04 |
13,5 |
5,13 |
66,69 |
1,44 |
18,7 |
1/128 |
0,12 |
1,56 |
0,54 |
7,0 |
2,57 |
33,41 |
0,73 |
9,5 |
1/256 |
0,08 |
1,04 |
0,32 |
4,2 |
1,29 |
16,77 |
0,37 |
4,8 |
1/512 |
0,05 |
0,65 |
0,17 |
2,2 |
0,65 |
8,45 |
0,19 |
2,5 |
1/1014 |
0,03 |
0,39 |
0,10 |
1,3 |
0,33 |
4,29 |
0,10 |
1,3 |
Korzystając z poniższego wzoru obliczyłyśmy dla wszystkich pomiarów wartości λ.
, gdzie:
c - stężenie roztworu
H - przewodnictwo właściwe
Jeżeli:
a:
wtedy:
gdzie 1000 oznacza 1000cm3 na 1dm3
stąd:
(Jednostki tej nie umieszczamy w tabeli poniżej, bo zajmowała ona zbyt dużo miejsca w kolumnach).
Wyniki umieściłyśmy w tabeli niżej, zestawiając w niej wcześniej obliczone przez nas wielkości.
co [M] |
CH3COOH |
CH3COONa |
HCl |
NaCl |
||||||||
|
S [mS] |
H[ |
λ |
S [mS] |
H[ |
λ |
S [mS] |
H[ |
λ |
S [mS] |
H[ |
λ |
1/16 |
0,35 |
4,55 |
7,2800 |
|
|
|
|
|
|
|
|
|
1/32 |
0,22 |
2,86 |
9,1520 |
1,87 |
24,3 |
77,7920 |
9,90 |
128,70 |
411,840 |
2,77 |
36,0 |
115,232 |
1/64 |
0,16 |
2,08 |
13,3120 |
1,04 |
13,5 |
86,5280 |
5,13 |
66,69 |
426,816 |
1,44 |
18,7 |
119,808 |
1/128 |
0,12 |
1,56 |
19,9680 |
0,54 |
7,0 |
89,8560 |
2,57 |
33,41 |
427,648 |
0,73 |
9,5 |
121,472 |
1/256 |
0,08 |
1,04 |
26,6240 |
0,32 |
4,2 |
106,4960 |
1,29 |
16,77 |
429,312 |
0,37 |
4,8 |
123,136 |
1/512 |
0,05 |
0,65 |
33,2800 |
0,17 |
2,2 |
113,1520 |
0,65 |
8,45 |
432,640 |
0,19 |
2,5 |
126,464 |
1/1024 |
0,03 |
0,39 |
39,9360 |
0,10 |
1,3 |
133,1200 |
0,33 |
4,29 |
439,296 |
0,10 |
1,3 |
133,120 |
Wykonałyśmy wykres zależności
dla roztworów badanych i ekstrapolowałyśmy graficznie powyższą funkcję do
by wyznaczyć wartości przewodnictwa granicznego mocnych elektrolitów.
Poniżej umieściłyśmy pomocniczą tabelę:
|
co [M] |
CH3COOH |
CH3COONa |
HCl |
NaCl |
|
|
λ |
λ |
λ |
λ |
0,2500 |
1/16 |
7,2800 |
|
|
|
0,1768 |
1/32 |
9,1520 |
77,7920 |
411,840 |
115,232 |
0,1250 |
1/64 |
13,3120 |
86,5280 |
426,816 |
119,808 |
0,0884 |
1/128 |
19,9680 |
89,8560 |
427,648 |
121,472 |
0,0625 |
1/256 |
26,6240 |
106,4960 |
429,312 |
123,136 |
0,0442 |
1/512 |
33,2800 |
113,1520 |
432,640 |
126,464 |
0,0313 |
1/1024 |
39,9360 |
133,1200 |
439,296 |
133,120 |
Obliczyłyśmy przewodnictwo graniczne słabego kwasu korzystając ze wzoru
Na podstawie wzoru
obliczyłyśmy stałe dysocjacji słabego kwasu dla wszystkich stężeń, gdzie:
α - stopień dysocjacji elektrolitu,
Kdys - stała dysocjacji elektrolitu
c0 - stężenie początkowe elektrolitu
Wyniki zamieściłyśmy w tabeli:
co [M] |
K |
|
|
1/16 |
2,7080 |
1/32 |
1,3540 |
1/64 |
0,6770 |
1/128 |
0,3385 |
1/256 |
0,1693 |
1/512 |
0,0846 |
1/1024 |
0,0423 |
Obliczamy wartość średnią stałej dysocjacji, jej średni błąd kwadratowy i odchylenie standardowe:
Wartość średnia stałej dysocjacji wynosi : 7,677
Odchylenie standardowe wynosi: 9,706
Średni błąd kwadratowy średniej aryt. wynosi: 3,962
Wartość średnia stałej dysocjacji po uwzględnieniu odchylenia standardowego zgadza się z wartością tablicową:
Wykonałyśmy wykres zależności
i obliczyłyśmy z wykresu stałą dysocjacji kwasu korzystając z zależności
. Następnie porównałyśmy wartość przez nas uzyskaną z otrzymaną z wykresu oraz z wartością literaturową.
Poniżej prezentujemy pomocniczą tabelę, która posłużyła nam do sporządzenia wykresu:
λ |
c |
1/ λ |
c* λ |
7,2800 |
0,0625 |
0,1374 |
0,455 |
9,1520 |
0,0312 |
0,1093 |
0,286 |
13,3120 |
0,0156 |
0,0751 |
0,208 |
19,9680 |
0,0078 |
0,0501 |
0,156 |
26,6240 |
0,0039 |
0,0376 |
0,104 |
33,2800 |
0,0020 |
0,0301 |
0,065 |
39,9360 |
0,0010 |
0,0251 |
0,039 |
Równanie to jest równaniem prostej typu
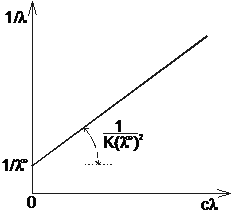
Korzystając z regresji liniowej wyliczyłyśmy współczynnik korelacji, współczynnik kierunkowy a oraz wyraz wolny b:
a=0,291 i b=0,012
r=0,97 - tak duża wartość współczynnika korelacji świadczy o zależności liniowej
Wiedząc, że:
oraz
otrzymujemy:
Wartość tablicowa wynosi:
Błąd względny wynosi:
Odchylenie standardowe wartości współczynnika kierunkowego wynosi Sa= 0,023.
Wnioski
W przypadku mocnych elektrolitów, takich jak HCl i NaCl oraz CH3COONa zależność opisana wzorem Kohlrauscha jest prostoliniowa i umożliwia wyznaczanie granicznej przewodności molowej na drodze ekstrapolacji. Dla elektrolitów słabych, takich jak CH3COOH, zależność Kohlrauscha nie jest już liniowa, dlatego ekstrapolacji dla elektrolitów słabych nie można dokonać. Dla tych elektrolitów przewodnictwo równoważnikowe wzrasta gwałtownie, gdy stężenie zmierza do zera (krzywa zbliża się asymptotycznie do osi rzędnych nie przecinając jej). Wartość granicznej przewodności mogłyśmy obliczyć korzystając z prawa niezależnego ruchu jonów Kohlrauscha poprzez zsumowanie stałych udziałów jonowych. Nasze doświadczenie i wykonane przez nas obliczenia dowodzą prawdziwości tej teorii.
Jak widać na wykresach przez nas sporządzonych, w obszarze niskich stężeń dla obu grup elektrolitów - i słabych, i mocnych - obserwujemy monotoniczny spadek przewodności molowej ze stężeniem. Jest on jednak znacznie szybszy dla elektrolitów słabych - już dla roztworów średnio stężonych wartości przewodności są niskie. Wytłumaczeniem tego faktu jest zmniejszanie się stopnia dysocjacji ze wzrostem stężenia. Wpływ wzrostu stężenia roztworów silnych elektrolitów na spadek wartości przewodności jest znacznie słabszy, bo w obszarze wysokich stężeń wartość przewodności dla mocnych elektrolitów pozostaje na znaczącym poziomie - mocne elektrolity są w roztworze praktycznie całkowicie zdysocjowane.
Otrzymane przez nas wartości dowodzą, że założenie Arrheniusa dotyczące braku wpływu stężenia na ruchliwość jonów jest wystarczające - obliczona przez nas stała dysocjacji jest bardzo zbliżona do wartości tablicowej. Prawo rozcieńczeń Ostwalda, z którego korzystałyśmy, pozwoliło nam sprawdzić, że słuszne są założenia klasycznej teorii dysocjacji elektrolitycznej. Obliczona przez nas stała dysocjacji w granicach błędu również zgadza się z wartością tablicową.
Wyszukiwarka
Podobne podstrony:
konduktometryczne wyznaczanie stałej dysocjacji kwasu octowgeo
ćwiczenie 6 wyznaczanie stałej dysocjacji pKa słabego kwasu metodą konduktometryczną
Pomiary pH roztworów oraz wyznaczanie stałej dysocjacji słabego kwasu Ćw 4
3 0 Wyznaczanie stałej dysocjacji słabego elektrolitu
Spektrofotometryczne wyznaczanie stałej dysocjacji błękitu bromotymolowego, spektroskopia
WYZNACZANIE STAŁEJ DYSOCJACJI WSKAŹNIKA KWASOWO-ZASADOWEGO METODĄ ABSORPCJOMETRYCZNĄ, NAUKA, WIEDZA
Wyznaczanie stałej dysocjacji wskaźnika kwasowo zasadowego metodą?sorpcjometryczną
wyznaczanie stalej dysocjacji slabego elektrolitu
Wyznaczanie stałej dysocjacji wskaźnika kwasowo-zasadowego, Wyznaczanie stałej dysocjacji wskaźnika
Wyznaczanie stałej dysocjacji wskaźnika kwasowo zasadowego
Wyznaczanie stałej dysocjacji wskaźnika kwasowo zasadowego metodą?sorpcjometryczną
Pomiary pH roztworów oraz wyznaczanie stałej dysocjacji słabego kwasu Ćw 4
Cw 10 Spektrofotometryczne wyznaczanie stałej dysocjacji
Cw 10 Spektrofotometryczne wyznaczanie stałej dysocjacji
12 Wyznaczanie stałej dysocjacji kwasu mlekowego metodą potencjometryczną
12 Wyznaczanie stałej dysocjacji kwasu mlekowego metodą pot
Cw 10 Spektrofotometryczne wyznaczanie stałej dysocjacji
Sprawozdanie Wyznaczanie stałej naczynka konduktometrycznego
,chemia fizyczna, wyznaczanie stałej i stopnia dysocjacji słabych elektrolitów, Gr
więcej podobnych podstron