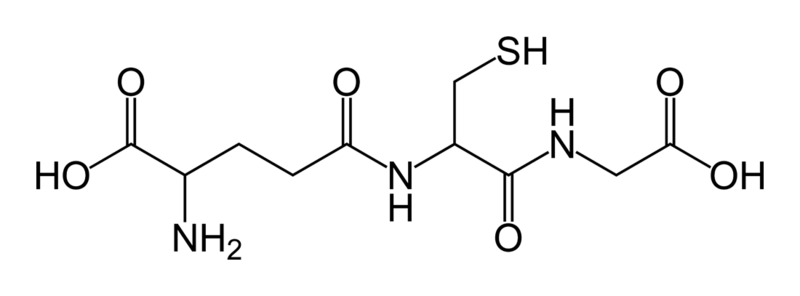
9. Narysuj dowolny tripeptyd
Glutation
8.BetaOksydacja kwasu palmitynowego
Beta-oksydacja polega na kolejnym odcinaniu jednostek dwuwęglowych (w postaci acetylokoenzymu-A) od łańcucha węglowodorowego kwasu tłuszczowego, co skutkuje jego stopniowym skracaniem, aż do całkowitego zmetabolizowania.
Powstające jednostki acetylokoenzymu-A (acetylo-CoA) są substratem dla cyklu Krebsa, gdzie ulegają dalszemu utlenieniu z pozyskaniem energii.
Dodatkowo, podczas beta-oksydacji redukowane są nośniki NAD i FAD, które następnie włączają się bezpośrednio w produkcję nośników energii w łańcuchu oddechowym.
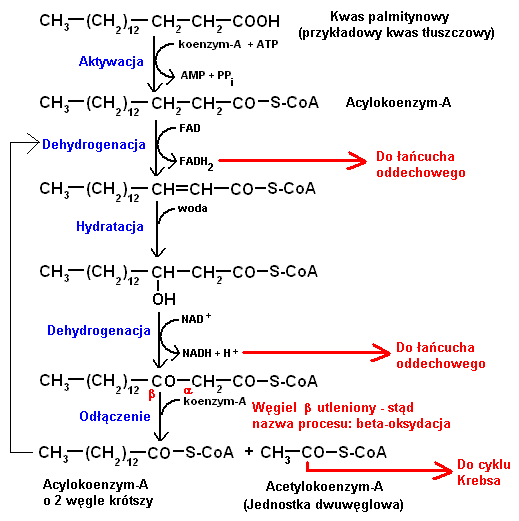
Przykładowo: kwas palmitynowy C15H31COOH ma 16 atomów węgla, więc w procesie jego całkowitej beta-oksydacji powstanie 8 jednostek dwuwęglowych. Natomiast z kwasu stearynowego C17H35COOH powstanie tych jednostek 9.
Podsumowując: całkowite utlenienie (wszystkie 3 procesy) 1 cząsteczki popularnego kwasu tłuszczowego - kwasu palmitynowego daje aż 129 cząsteczek ATP - nośnika energii dla komórki. Dla porównania: z jednej cząsteczki cukru - glukozy, uzyskujemy tylko 36 cząsteczek ATP.
Beta-oksydacja nienasyconych kwasów tłuszczowych przebiega podobnie, ale celem poradzenia sobie z ich wiązaniami podwójnymi typu cis, w procesie tym dodatkowo uczestniczą enzymy z grupy izomeraz (zamiana wiązań cis na trans lub położenia wiązań trans) i reduktaz (uwodorowanie wiązań podwójnych cis).
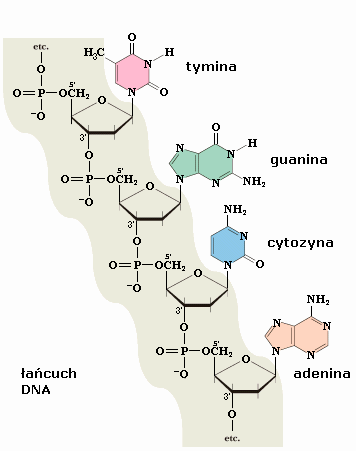
6. łańcuch DNA narysować i podpisać wiązania
5. wyjaśnić pojęcia: izoenzymy, koloenzymy, epimery, centrum aktywne enzymu
Izoenzymy - homologiczne enzymy w obrębie danego organizmu, które katalizują tę samą reakcję, ale różnią się nieznacznie strukturą, wartościami Km i Vmax oraz właściwościami regulacyjnymi. Izoenzymy często ulegają ekspresji w różnych tkankach lub organellach lub w różnych stadiach rozwojowych. Są kodowane przez geny zajmujące różne loci, które zwykle powstają w wyniku duplikacji genu i dywergencji. Izoenzymy można często odróżnić od siebe na podstawie właściwości biochemicznych, takich jak ruchliwość elektroforetyczna.Przykładem izoenzymu może być dehydrogenaza mleczanowa (LDH), enzym uczestniczący w beztlenowym metabolizmie glukozy i syntezie glukozy. W organizmie człowieka istnieją dwa izozymowe łańcuchy polipeptydowe tego enzymu: izozym H, ulegający silnej ekspresji w sercu i izozym M, występujący w mięśniach. Ich sekwencja aminokwasowa jest identyczna w 75%. Funkcjonalny enzym jest tetramerem i zawiera różne kombinacje wspomnianych podjednostek. Izozym H4, wystęujący w sercu wykazuje mniejsze powinowactwo względem substratu niż izozym M4. Te dwa izozymy różni również cecha, iż duże stężenie pirogronianu allosterycznie hamuje izozym H4, ale nie izozym M4. Inne połączenie takie jak H3M, mają właściwości pośrednie, zależne od proporcji między dwoma typami łańcuchów.
HOLOENZYM cząsteczka enzymu będącego białkiem złożonym. Składa się z części białkowej - apoenzymu i części niebiałkowej - kofaktora (koenzym lub grupa prostetyczna). Dopiero gdy obydwie te części są ze sobą połączone, enzym stanowi funkcjonalną całość - holoenzym.
Epimery to stereoizomery sacharydów, różniące się konfiguracją przy jednym asymetrycznym atomie węgla. Epimerami są np. D-glukoza i D-galaktoza, D-erytroza i D-treoza, D-glukoza i D-mannoza.
Centrum aktywne - miejsce w cząsteczce enzymu odpowiedzialne za wiązanie substratów i przebieg reakcji katalizowanej przez enzym. Często ma postać wąskiej szczeliny albo wgłębienia w powierzchni białka. Prawidłowy kształt centrum aktywnego jest szczególnie ważny dla prawidłowego działania enzymu: mutacje powodujące zmianę struktury centrum aktywnego często pozbawiają enzym aktywności.
3. do jakich klas należą- oksydaza ksantynowa, heksokinaza, trombina, dekarboksylaza pirogronianowa, izomeraza maleinianowa, karboksylaza pirogronianowa
Oksydoreduktazy: oksydaza ksantynowa
Transferazy: heksokinaza,
Hydrolazy: trombina
Liazy: dekarboksylaza pirogronianowa
Izomerazy: izomeraza maleinianowa
Ligazy: karboksylaza pirogronianowa
2. hydrolazy- charakterystyka, przykłady
HYDROLAZY [gr.], bardzo liczna klasa enzymów katalizujących hydrolityczny (z udziałem cząsteczki wody) rozpad substratu.
Do hydrolaz należą enzymy rozkładające wiązanie:
1) estrowe (hydrolazy estrów)
2) glikozydowe (hydrolazy glikozydowe, nukleozydazy)
3) peptydowe (hydrolazy peptydów), wiązania C-N różne od peptydowych (amidazy, deaminazy), wiązania bezwodników kwasowych (fosfohydrolaza ATP) i in.; są to typowe reakcje rozkładu, na ogół nieodwracalne. Hydrolazy występują w znacznych ilościach poza komórką (w sokach trawiennych zwierząt), w dużej rozmaitości w komórkach i płynach ustrojowych.
Wyszukiwarka
Podobne podstrony:
Zerowka biochemia, Zerówka biochemia
Egzamin biochemia zerówka (ustna)
biochemia pytania, Pytania zerówka Biochemia, Pytania zerówka Biochemia 26
Zerówka, Sem. III, Biochemia, Egzamin
biochemia zeszłoroczna- zerówka i pisemny, Zaliczone, Biochemia
zerowka z biochemii, Biotechnologia, Semestr III, Biochemia
biochemia pytania, biochemia zeszłoroczna- zerówka i pisemny
11 BIOCHEMIA horyzontalny transfer genów
Biochemia z biofizyką Seminarium 2
Podstawy biochemii
08 BIOCHEMIA mechanizmy adaptac mikroor ANG 2id 7389 ppt
BIOCHEMICZNE EFEKTY STRESU (2B)
Biochemia, ATP
biochemia krwi 45
ENZYMY prezentacja biochemia
więcej podobnych podstron