Imię i nazwisko:
|
Ćwiczenie nr C4 Wyznaczanie κ = cp /cv dla powietrza metodą Clementa-Desormesa. |
||
Kierunek i rok:
|
Ocena z kolokwium:
....................................... data ....................... podpis........................... |
Ocena ze sprawozdania:
....................................... data ....................... podpis........................... |
Ocena końcowa:
....................................... data ....................... podpis........................... |
Nazwisko prowadzącego zajęcia:
|
|
|
|
Gaz doskonały - hipotetyczny gaz obdarzony następującymi cechami:
cząstki gazu są punktami materialnymi lub sztywnymi układami punktów materialnych, atomów (mających pomijalnie małą objętość własną),
zderzenia między cząsteczkami gazu są doskonale sprężyste,
między cząsteczkami nie występują oddziaływania z wyjątkiem chwil zderzeń,
między kolejnymi zderzeniami cząsteczki poruszają się ruchem jednostajnym prostoliniowym w dowolnych kierunkach.
Gazy rzeczywiste w wysokich temperaturach i przy niskich ciśnieniach można traktować jak gazy doskonałe. Z wszystkich rzeczywistych gazów hel jest najbliższy ideałowi gazu doskonałego.
Równanie stanu gazu doskonałego - wzór łączący trzy parametry: ciśnienie, objętość i temperaturę bezwzględną masy stałej gazu przed przemianą (p0, V0, T 0) i po przemianie (p, V, T):
Równanie Clapeyrona - równanie opisujące stan gazu doskonałego, które wiąże ze sobą podstawowe parametry gazu: ciśnienie p, objętość V, temperaturę T i ilość materii (wyrażoną w molach) n:
R - uniwersalna stała gazowa:
Przemiany gazowe:
* Przemiana izotermiczna - przemiana termodynamiczna zachodząca przy stałej temperaturze ( T = const).
Prawo przemiany izotermicznej gazu doskonałego:
W izotermicznej przemianie stałej masy gazu iloczyn jego ciśnienia p i objętości V jest stały:
Możemy też powiedzieć, że ciśnienie gazu jest odwrotnie proporcjonalne do jego objętości. Wykres tej zależności nazywa się izotermą (jest nią w układzie (p,V) hiperbola):
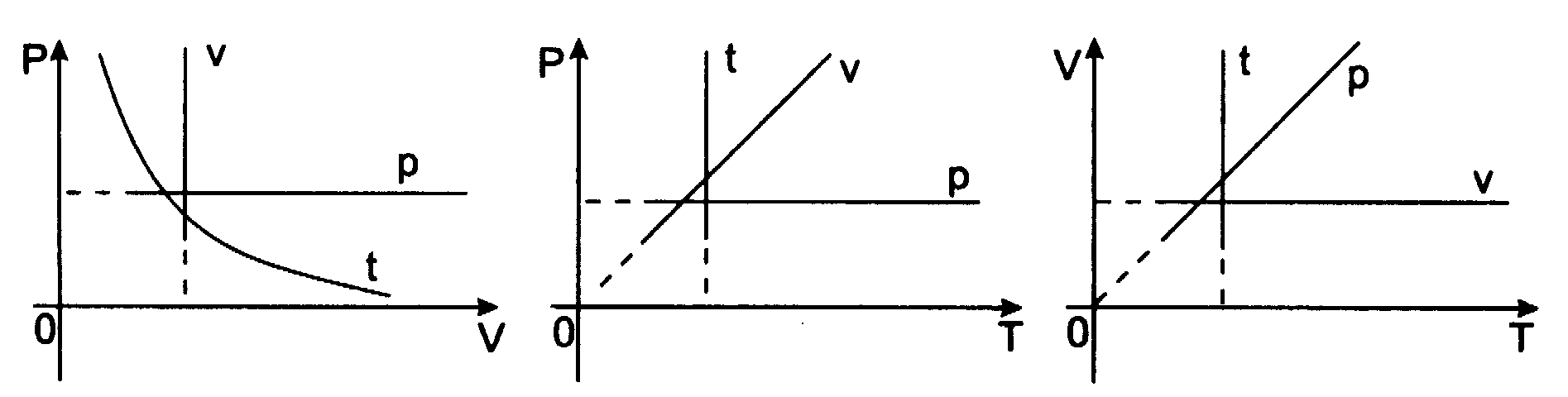
Prawo Boyle'a-Mariotte'a - prawo przemiany izotermicznej dla gazu doskonałego.
* Przemiana izochoryczna - przemiana termodynamiczna zachodząca przy stałej objętości (V = cosnt).
Prawo przemiany izochorycznej gazu doskonałego:
W izochorycznej przemianie stałej masy gazu ciśnienie jest wprost proporcjonalne do jego temperatury bezwzględnej:
Wykres tej zależności nazywa się izochorą (jest nią w układzie (p,T) linia prosta przechodząca przez początek układu):
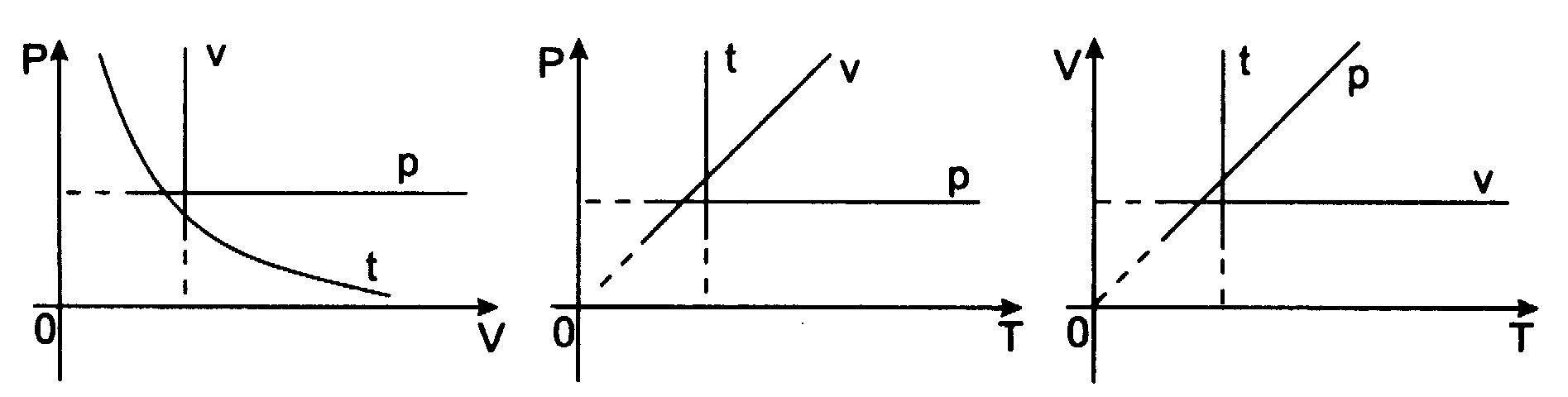
Prawo Charlesa - prawo przemiany izochorycznej dla gazu doskonałego, które w postaci zależności podanej w 1787 roku:
p - ciśnienie stałej masy gazu w temperaturze t wyrażonej w skali Celsjusza
p0 - ciśnienie tego gazu w 0˚C
β = (273,15˚C)-1 - współczynnik termicznej prężności gazu,
odegrało wielką rolę poznawczą. Wynikało z niej, że w temperaturze t = 273,15˚C ciśnienie gazu powinno być równe zeru. Była to pierwsza wyraźna wskazówka, że skala temperatury nie rozciąga się nieograniczenie w dół na temperatury ujemne, lecz się urywa.
* Przemiana izobaryczna - przemiana termodynamiczna zachodząca przy stałym ciśnieniu (p = const).
Prawo przemiany izobarycznej gazu doskonałego:
W izobarycznej przemianie stałej masy gazu objętość zajmowana przez gaz jest wprost proporcjonalne do jego temperatury bezwzględnej:
Wykres tej zależności nazywa się izobarą (jest nią w układzie (V,T) linia prosta przechodząca przez początek układu):
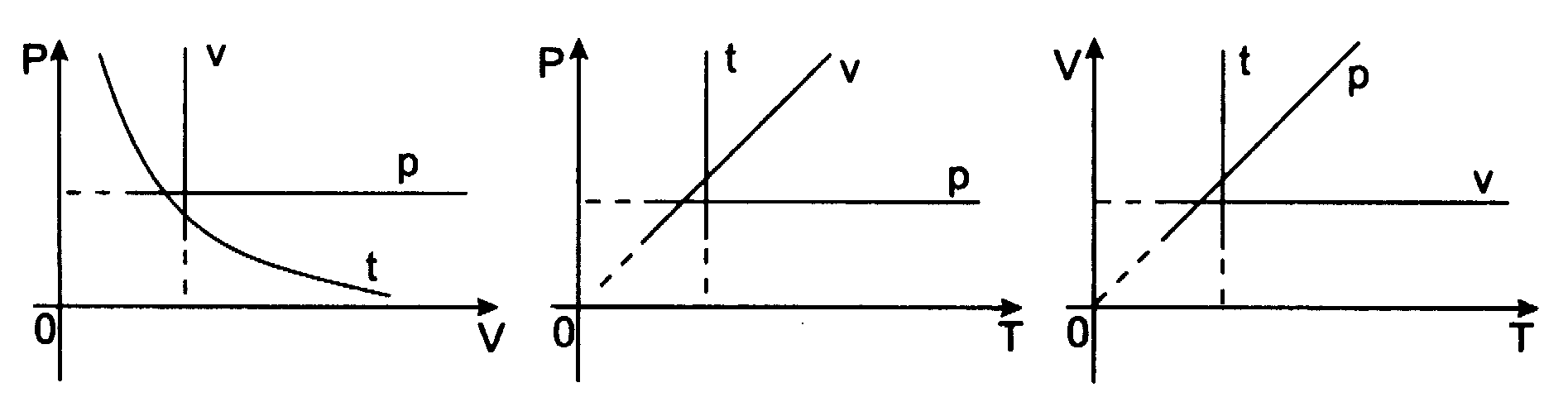
Prawo Gay-Lussaca - prawo przemiany izobarycznej dla gazu doskonałego, które można także zapisać w postaci podanej w 1802 roku:
V - objętość gazu w temperaturze t wyrażonej w skali Celsjusza
V0 - objętość tego gazu w 0˚C
α = (273,15˚C)-1 - współczynnik rozszerzalności objętościowej gazu.
* Przemiana adiabatyczna - przemiana termodynamiczna, która przebiega bez przepływu ciepła (Q = 0) i materii (m = const) między układem a otoczeniem.
Równanie przemiany adiabatycznej (Równanie Poissona):
Równanie opisujące zależność między objętością V gazu doskonałego, a jego ciśnieniem p w
przemianie adiabatycznej:
κ - jest stosunkiem ciepła molowego gazu pod stałym ciśnieniem cp do ciepła molowego gazu przy stałej objętości cv :
dla gazów cząsteczkach jednoatomowych c = 5/3
dla gazów o cząsteczkach dwuatomowych κ = 7/5
dla gazów o cząsteczkach wieloatomowych κ = 4/3.
Równanie Poissona można, po skorzystaniu z równania Clapeyrona, zapisać w równoważnej postaci:
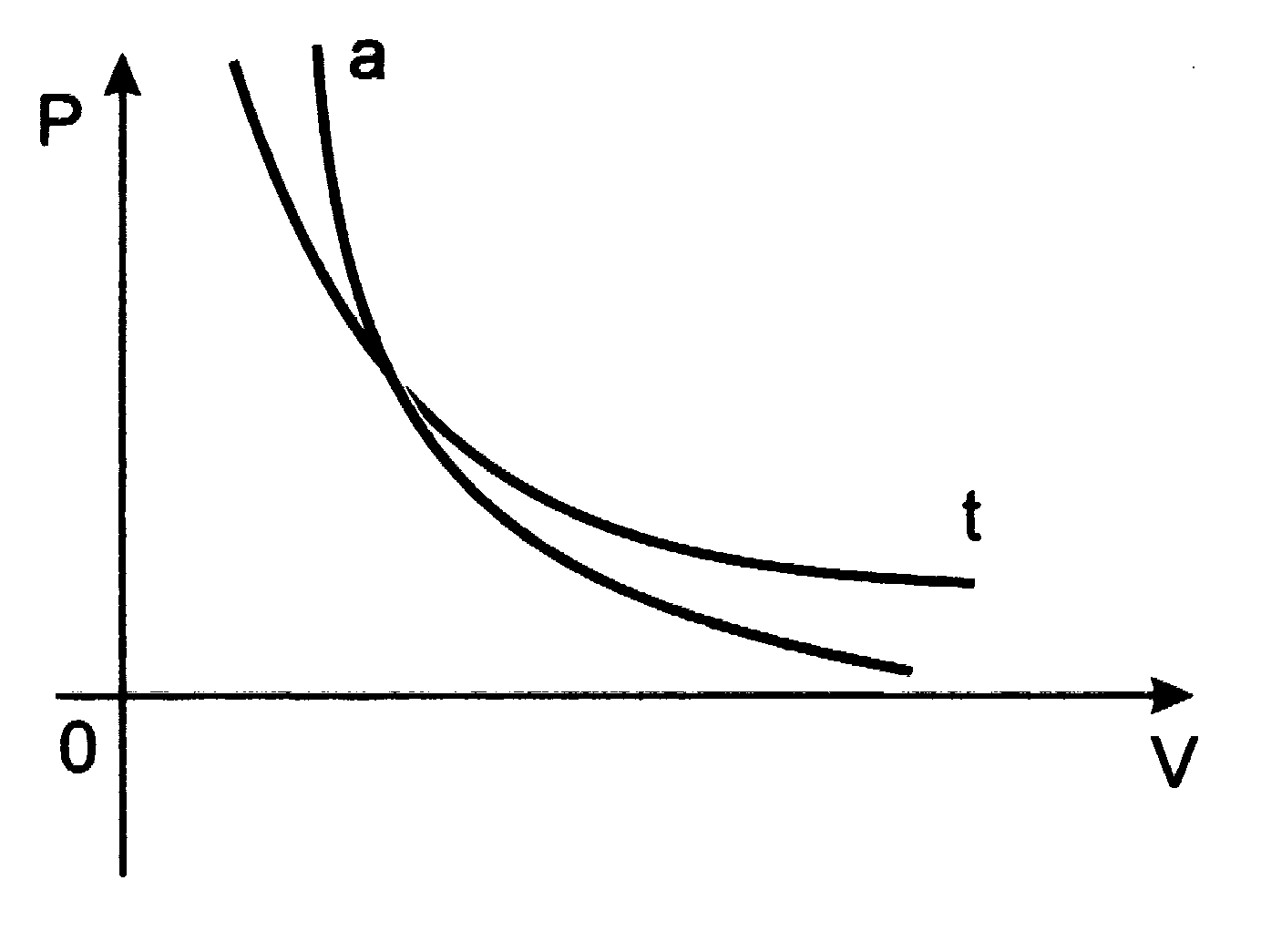
Wykresem przemiany adiabatycznej w układzie (p,V) jest adiabata:
Podstawowy wzór kinetycznej teorii gazów - wzór na ciśnienie gazu p wyprowadzony dla modelu gazu doskonałego:
V - objętość naczynia, w którym znajduje się N cząsteczek gazu,
EKśr - średnia energia kinetyczna cząstek (ruchu postępowego). Średnia energia kinetyczna gazu doskonałego EKśr jest proporcjonalna do temperatury gazu i zależy od liczby stopni swobody cząsteczki:
Wzór na ciśnienie możemy zapisać w postaci:
ρ - gęstość gazu,
vśr2 - średnia prędkość kwadratowa ruchu postępowego cząstek gazu, wyrażająca się wzorem:
m - masa cząsteczki gazu.
Ciepło (cieplny przepływ energii) Q - ta część energii wewnętrznej ∆U, którą ciało o temperaturze wyższej przekazuje ciału o temperaturze niższej bez wykonywania pracy W
Q = ∆U, gdy W = 0.
Jednostką ciepła jest kaloria, cal - pozaukładowa jednostka energii używana przy określaniu ilości ciepła, równa ilości ciepła, jakiej potrzeba do ogrzania 1g czystej wody o 1˚C. 1cal = 4,1868J.
Ciepło właściwe substancji c - stosunek ilości ciepła Q pobranego przez ciało do iloczynu masy m substancji i przyrostu jego temperatury ∆T wywołanego pobraniem tego ciepła:
Jednostką ciepła właściwego jest dżul na kilogram i kelwin:
.
Jest to ciepło właściwe ciała o masie 1 kg, którego temperatura wzrasta o 1 K po pobraniu przez nie ciepła w ilości 1 J.
Ciepło molowe cm - stosunek ilości ciepła Q pobranego przez ciało do iloczynu liczności materii (wyrażonej przez liczbę moli) n ciała i przyrostu temperatury ∆T wywołanego jej pobraniem:
Ciepłem molowym posługuje się głównie w przypadku gazów. Ponieważ gazy charakteryzują się dużą ściśliwością istotny jest sposób przepływu ciepła (ciepło molowe zależy od przemiany termodynamicznej). Z tego względu posługujemy się ciepłami molowymi:
ciepło molowe przy stałej objętości (dla przemiany izochorycznej):
ciepło molowe przy stałym ciśnieniu (dla przemiany izobarycznej):
Jednostką ciepła molowego jest dżul na mol i kelwin:
Jest to ciepło molowe 1 mola substancji, którego temperatura wzrasta o 1 K po pobraniu przez niego 1 J ciepła.
Zależności między ciepłem molowym przy stałej objętości cv i ciepłem molowym przy stałym ciśnieniu cp:
Równanie Mayera - określa związek między cp, cv i R mówiący, że dla każdego gazu doskonałego różnica ciepła molowego przy stałym ciśnieniu i ciepła molowego przy stałej objętości jest równa uniwersalnej stałej gazowej:
cp jest większe od cv, ponieważ przy stałym ciśnieniu (a zmiennej objętości) nie cała energia dostarczona na sposób ciepła ma wpływ na wzrost temperatury gazu - część energii zostaje zużyta na wykonanie pracy.
Pojemność cieplna C - stosunek ilości ciepła Q dostarczonego ciału (układowi), do zmiany jego temperatury ∆T:
Pojemność cieplna C ciała o masie m zawierającego n moli substancji jest równa:
c - ciepło właściwe,
cm - ciepło molowe substancji tego ciała.
Bilans cieplny - zestawienie ilości ciepła doprowadzonego do układu i ilości ciepła odprowadzonego z układu.
Jeżeli między ciałami o różnych temperaturach, które są w kontakcie termicznym między sobą i tworzą układ odizolowany termicznie od otoczenia, następuje wymiana energii tylko na sposób ciepła, to jej ilość Q jest równa (co do wartości) przyrostowi energii wewnętrznej ∆Un ciała o temperaturze niższej od pozostałych i jest równa zmniejszeniu energii wewnętrznej ∆Uw ciał o temperaturze wyższej. Powyższy warunek można zapisać w postaci:
.
Wyprowadzenie wzoru na obliczanie κ:
Równanie adiabaty:
Równanie izotermy:
Logarytmując, następnie różniczkując powyższe równania otrzymujemy następujące związki:
Przechodząc do przyrostów skończonych otrzymamy:
Dzieląc oba równania stronami otrzymamy:
Sposób wykonania ćwiczenia:
Pomiar stosunku cp / cv , tj. stosunku ciepła właściwego przy stałym ciśnieniu do ciepła właściwego przy stałej objętości, przeprowadza się przez podanie powietrza w butli kolejno przemianom adiabatycznej /1 - 2/ i izochorycznej /2 - 3/.
Rozprężanie adiabatyczne od ciśnienia p+h /p - ciśnienie atmosferyczne, h - różnica ciśnień wskazana przez manometr cieczowy/ i objętości V od ciśnienia atmosferycznego p i objętości V' przebiega zgodnie z prawem Poissona:
W trakcie przemiany adiabatycznej temperatura gazu ulega obniżeniu i poprzez pozostawienie butli zamkniętej w temperaturze otoczenia realizuje się przemiana izochoryczna, w wyniku której powietrze w butli ponownie osiąga temperaturę otoczenia, końcowy punkt izochory o ciśnieniu p+h' / na wykresie punkt 3/ musi leżeć na tej samej izotermie co punkt 1, co oznacza że musi być spełnione prawo Boyle'a i Mariotte'a:
Z prawa Poissona oraz prawa Boyle'a i Mariotte'a wynika związaek:
Tabela wyników pomiarów:
Lp. |
h [mm] |
h' [mm] |
h - h' [mm] |
|
1 |
27 |
5 |
22 |
1,227 |
2 |
25 |
5 |
20 |
1,250 |
3 |
24 |
4 |
20 |
1,200 |
4 |
27 |
6 |
21 |
1,286 |
5 |
26 |
5 |
21 |
1,238 |
6 |
26 |
6 |
20 |
1,300 |
7 |
26 |
6 |
20 |
1,300 |
8 |
27 |
5 |
22 |
1,227 |
9 |
25 |
5 |
20 |
1,250 |
10 |
24 |
4 |
20 |
1,200 |
|
h = 25,7 ∆h = ± 0,5 |
h' = 5,1 ∆h' = ± 0,5 |
|
κ = 1,2478 σ = ± 0,0118 ∆κ = ± 0,0266 |
Wyznaczam wartość średnią κ:
i - numer pomiaru,
n - ilość pomiarów.
Wyznaczam odchylenie standardowe od wartości średniej κ:
i - numer pomiaru,
n - ilość pomiarów.
Wyznaczam niepewność pomiaru κ metodą Studenta-Fishera dla poziomu ufności α = 0,95:
Wartość współczynnika tαn = 2,262.
∆κ = ± 0,0266
Wyznaczam niepewność procentową pomiaru:
WNIOSKI:
Wykonane przeze mnie pomiary obarczone są niepewnościami. Spowodowane są one niedokładnością eksperymentatora, panujący w danym momencie warunkami otoczenia, niedokładnością sprzętu. W butli, której używałam do wykonania doświadczenia, znajdowała się skroplona para wodna. Ten fakt miał również wpływ na wyniki moich pomiarów. Mimo tego wyniki pomiarów obarczone są stosunkowo małą niepewnością (około 2%).
Wyszukiwarka
Podobne podstrony:
Wyznaczanie stosunku C p - C v metodą Clementa - Desormesa-3, cp/cv
Wyznaczanie stosunku C p C v metodą Clementa - Desormesa, Cp/Cv
Wyznaczanie stosunku C p - C v metodą Clementa - Desormesa-7, cp/cv
Wyznaczanie stosunku C p - C v metodą Clementa - Desormesa-6, cp/cv
Fzyka- Wyznaczanie stosunku C p C v metodą Clementa - Desormesa , Cp/Cv
102, 102, Temat : Wyznaczanie stosunku Cp/Cv metodą Clementa - Desormesa
115, #115A, Temat : Wyznaczanie stosunku Cp/Cv metodą Clementa - Desormesa
10 WYZNACZANIE STOSUNKU Cp Cv DLA POWIETRZA METODĄ CLEMENTA DESORMESA(1)
Cw 20 - Wyznaczanie stosunku cp-cv dla powietrza metoda Clementa-Desormesa, Studia, Budownictwo UTP,
Wyznaczanie stosunku Cp,Cv dla powietrza metodą Clemensa Desormesa
Wyznaczanie stosunku Cp Cv metodą Clementa-Desormesa, Wyznaczanie stosunku Cp Cv metodą Clementa Des
Wyznaczanie stosunku Cp Cv dla powietrza metodą Clementa Desormesa
106, 106OLA, Temat : Wyznaczanie stosunku Cp/Cv metodą Clementa - Desormesa
Wyznaczanie stosunku Cp Cv metodą Clementa-Desormesa, Sprawozdanie z fizyki
115, 115(1), Temat : Wyznaczanie stosunku Cp/Cv metodą Clementa - Desormesa
115, teoria, Temat : Wyznaczanie stosunku Cp/Cv metodą Clementa - Desormesa
więcej podobnych podstron