I Pracownia ZakЕ‚adu Fizyki PL
Nazwisko Staniszewski PaweЕ‚ i imiД™ |
WydziaЕ‚ ZiM 3,5 Grupa |
|||||||
Data 07,12,98 wyk. Д‡wicz |
Numer Д‡wicz 7.1 |
Temat Wyznaczanie rГіwnowaЕјnikГіw elektrochemicznych, metali staЕ‚ej Faraday`a i Е‚adunku elementarnego. |
||||||
Zaliczenie
|
Ocena |
Data |
Podpis
|
|||||
Zestawienie wynikГіw:
J = 1A
t = 1800s
m1 = 0,2886 kg
m2 = 0,2892 kg
Podstawy teoretyczne:
W wodnym roztworze siarczanu miedzi, pod wpЕ‚ywem wody czД…steczki CuSO4 rozpada siД™ na jony Cu2+ i SO42-. Pole elektryczne wytworzone miД™dzy katodД… i anodД… powoduje wД™drГіwkД™ jonГіw do odpowiednich elektrod. Kationy Cu2+ dД…ЕјД… do katody, gdzie ulegajД… zobojД™tnieniu i osadzajД… siД™ w postaci cienkiej warstwy miedzi. zachodzi wtedy reakcja:
Cu+2 + 2e в†’ Cu
RГіwnoczeЕ›nie aniony SO2-4 dД…ЕјД… do anody. Reszty kwasowe i grupy wodorotlenkowe nie wystД™pujД… w stanie wolnym, reagujД… wiД™c z materiaЕ‚em anody lub teЕј czД…steczkami rozpuszczalnika.
JeЕ›li jednym ze skЕ‚adnikГіw materiaЕ‚u anody bД™dzie miedЕє, wГіwczas zajdzie reakcja:
SO2-4 + Cu в†’ CuSO4 + 2e
Utworzona w ten sposГіb czД…steczka CuSO4 przechodzi do roztworu i ulega znowu dysocjacji. W ten sposГіb roztwГіr siarczanu miedzi regeneruje siД™, na skutek czego stД™Ејenie roztworu, mimo osiadania jonГіw na elektrodach, nie ulega zmianie.
RГіwnowaЕјnik chemiczny wyliczamy z I prawa Faraday`a i jest rГіwny liczbowo masie substancji wydzielonej w procesie elektrolizy na jednej z elektrod podczas przepЕ‚ywu Е‚adunku jednostkowego (q).
Ładunek (q), można wyrazić przez natężenie prądu i czas trwania elektrolizy (q= i * t) , a więc ostatecznie wzór na równoważnik chemiczny ma postać:
Stała Faraday`a ma postać:
gdzie rГіwnowaЕјnik chemiczny (R) jest rГіwny ilorazowi masy atomowej (A)przez wartoЕ›ciowoЕ›Д‡ (Z)
Natomiast wartoЕ›Д‡ Е‚adunku elementarnego jest ilorazem staЕ‚ej Faraday`a (F) przez liczbД™ Avogadra (NA)
Wykonanie Д‡wiczeni:
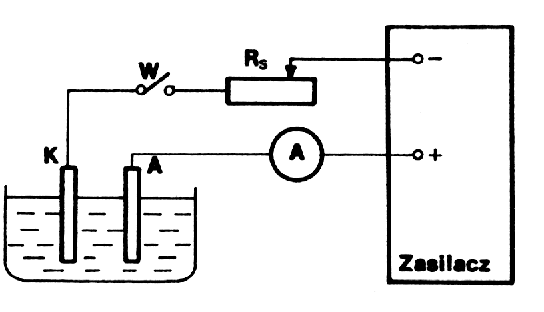
Schemat poЕ‚Д…czeЕ„ przedstawia rysunek.
Elektrody oczyszczamy odpowiednio papierem Е›ciernym, spЕ‚ukujemy wodД… destylowanД… i osuszamy. NastД™pnie do woltametru wstawiamy katodД™ prГіbnД… , wlewamy elektrolit, wЕ‚Д…czamy wyЕ‚Д…cznik W
i opornikiem RS regulujemy natД™Ејenie prД…du w obwodzie. WartoЕ›Д‡ natД™Ејenia ustalamy na 1A. Po tych czynnoЕ›ciach wstД™pnych waЕјymy elektrodД™ pomiarowД… (m1) i wstawiamy w miejsce elektrody prГіbnej. Zamykamy obwГіd wЕ‚Д…cznikiem W, wЕ‚Д…czajД…c jednoczeЕ›nie sekundomierz. Czas trwania elektrolizy 30min (1800s). Po zakoЕ„czeniu elektrolizy, katodД™ opЕ‚ukujemy wodД… zakwaszonД… kwasem siarkowym, osuszamy i ponownie waЕјymy (m2).
Opracowanie wynikГіw:
RГіwnowaЕјnik chemiczny wyliczamy ze wzoru:
StaЕ‚Д… Faraday`a :
a Е‚adunek elementarny wynosi:
Dyskusja bЕ‚Д™du metodД… rГіЕјniczkowД…:
BЕ‚Д…d wzglД™dny maksymalny wyliczamy logarytmujД…c, a nastД™pnie rГіЕјniczkujД…c rГіwnanie
, gdzie ∆m = m2 - m1
gdzie
∆(∆m) = 2*10-5kg
∆m = 0,0006 kg
∆i = (1 * 1,5)A/100 +1,5/75 = 0,015A + 0,02A = 0,035A
∆t = 3 * 0,2s = 0,6s
BЕ‚Д…d wzglД™dny maksymalny wynosi:
6,86%
Wnioski:
Д†wiczenie nie nastrД™cza wiele kЕ‚opotГіw w czasie jego wykonania. DuЕјy wpЕ‚yw na bЕ‚Д…d ma niedokЕ‚adnoЕ›Д‡ wagi technicznej ,na ktГіrej waЕјono elektrodД™, oraz bЕ‚Д…d wskazania amperomierza.
4
1
Wyszukiwarka
Podobne podstrony:
Wyznaczanie równoważników elektrochemicznych metali, stałej?raday’a i ładunku elementarnego
Wyznaczanie równoważników elektrochemicznych metali, stałej?raday’a i ładunku elementarnego (2)
sprawozdanie? Wyznaczanie rГіwnowaЕјnika elektrochemicznego miedzi i staЕ‚ej?radaya
Wyznaczanie rГіwnowaЕјnika elektrochemicznego miedzi i staЕ‚ej?radaya na podstawie elektrolizy CuSO4x
Wyznaczanie rГіwnowaЕјnika elektrochemicznego miedzi i staЕ‚ej?radaya na podstawie elektrolizy CuSO4
24.WYZNACZANIE RГ“WNOWAЕ»NIKA ELEKTROCHEMICZNEGO MIEDZI ORAZ STAЕЃEJ FARADAYA., Fizyka
23 Wyznaczanie rГіwnowaЕјnika elektrochemicznego miedzi oraz staЕ‚ej Faradaya
Wyznaczanie rГіwnowaЕјnika elektro-chemicznego miedzi i staЕ‚ej Faraday'a, LABORATORIUM Z PRZETWORNI
24 WYZNACZANIE RГ“WNOWAЕ»NIKA ELEKTROCHEMICZNEGO MIEDZI ORAZ STAЕЃEJ FARADAYA doc
wyznaczanie rГіwnowaЕјnika elektorchemicznego miedzi i staЕ‚ej?radaya
1Wyznaczanie rГіwnowaЕјnika elektrochemicznego miedzi i staЕ‚ej
WYZNACZANIE RГ“WNOWAЕ»NIKA ELEKTROCHEMICZ, LABORATORIUM Z PRZETWORNIKЛ™W
Cw 25 - Wyznaczenie rownowaznika elektrochemicznego miedzi, AKADEMIA TECHNICZNO-ROLNICZA W BYDGOSZCZ
Wyznaczanie rГіwnowaЕјnika elektrochemicznego miedzi, laboratorium fizyczne, Laboratorium semestr 2 RГ“
3. Wyznaczanie współczynnika elektrochemicznego miedzi i stałej Faraday’a, LAB10 02, Wyznaczanie r˙w
wyznaczanie rownowaznika elektrochemicznego miedzi
Wyznaczanie rГіwnowaЕјnika elektrochemicznego, Л™wiczenie 20
wiД™cej podobnych podstron