PRODUKTY PRZEMIANY AZOTOWEJ
ZAGADNIENIA DO PRZYGOTOWANIA
1. Powstawanie kwasu moczowego i jego rola w organizmie człowieka.
2. Synteza mocznika (reakcje i enzymy).
3. Metabolizm kreatyny (reakcje i enzymy).
4. Zasada metod wykorzystywanych na ćwiczeniach do oznaczania stężenia kwasu moczowego, kreatyniny oraz mocznika w surowicy krwi.
5. Zakres normy dla mocznika, kwasu moczowego i kreatyniny w surowicy
WPROWADZENIE
Kwas moczowy
Kwas moczowy jest końcowym produktem katabolizmu zasad purynowych w organizmie człowieka. Nukleotydy w komórkach ulegają stałym przemianom. Związki te są rozkładane z udziałem enzymów, a także w pewnym stopniu ulegają samorzutnemu rozpadowi.
Nukleotydazy rozkładają hydrolitycznie nukleotydy do nukleozydów. Z nukleozydów fosforylazy nukleozydowe uwalniają zasady purynowe i rybozo-1-fosforan. Większość uwolnionych zasad purynowych zostaje ponownie użyta do tworzenia nukleotydów na drodze rezerwowych szlaków metabolicznych w których uczestniczy fosforybozylotransferaza adeninowa i fosforybozylotransferaza hipoksantyno-guaninowa.
Część uwolnionych zasad ulega przekształceniu do kwasu moczowego i jest wydalana z moczem.
Główne szlaki metaboliczne przemiany AMP i GMP prowadzące do utworzenia kwasu moczowego nieco się różnią. Katabolizm AMP rozpoczyna deaminaza AMP.
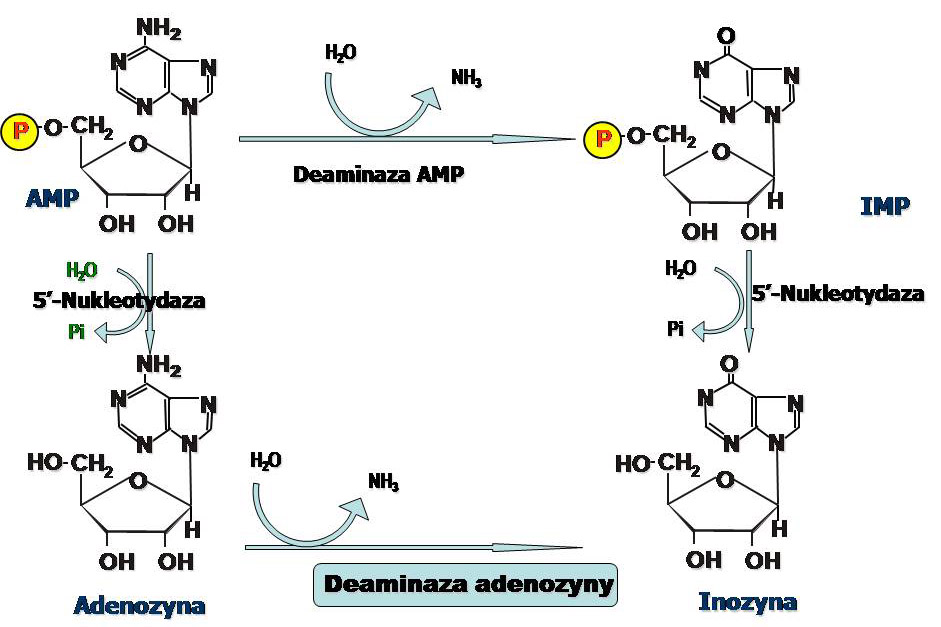
IMP i GMP są substratami dla 5' nukleotydazy, która przekształca je w nukleozydy. W kolejnym etapie nukleozydy są rozkładane za pomocą fosforylazy nukleozydów purynowych. Guanina pod wpływem hydrolazy - guanazy (deaminazy guaninowej) przekształcana jest do ksantyny.
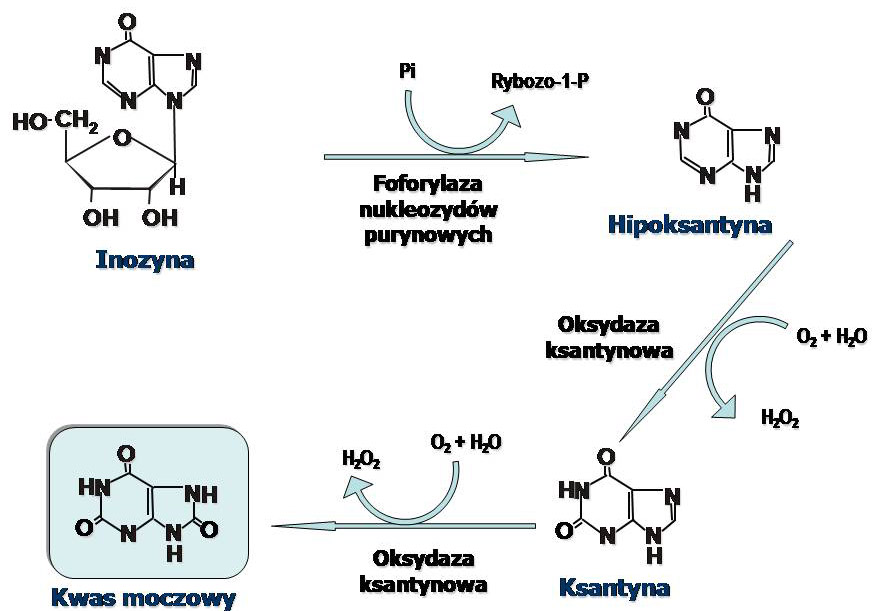
Hipoksantyna i ksantyna są przekształcane w kwas moczowy przy udziale oksydazy ksantynowej.
Mechanizm tej reakcji jest złożony, enzym do swojego działania wymaga udziału O2, FAD, jonów molibdenu i żelaza. Jeden atom tlenu cząsteczkowego, utleniacza w obu reakcjach, zostaje dołączony do pierścienia puryny, drugi zaś zostaje zredukowany do H2O2. Nadtlenek wodoru następnie jest rozkładany przez katalazę do H2O i O2.
Przyłączenie tlenu do pierścienia puryny powoduje zwiększenie polarności, a zatem zwiększa rozpuszczalność związku w wodzie. Jednak kwas moczowy jest nadal związkiem trudno rozpuszczalnym. Lepiej rozpuszczalne są jego sole - moczany, które tworzą się w pH obojętnym i zasadowym. Kryształy moczanów wytrącają się z roztworu jeżeli stężenie przekracza 7 miligramów tego związku na 100 cm3 wody. Dlatego też znaczna część moczanów w osoczu zaadsorbowana jest na albuminach, co przeciwdziała ich wytrącaniu.
Zakres normy dla kwasu moczowego w surowicy krwi wynosi: od 2 do 6 mg/100 cm3 (dla dorosłych kobiet) oraz od 3 do 7,5 mg/100 cm3 (dla mężczyzn). Stężenie kwasu moczowego w krążeniu zależy także od diety; niższe stężenia tego związku występują u ludzi stosujących dietę wegetariańską.
W ciągu doby organizm zdrowego, dorosłego człowieka wytwarza przeciętnie od 400 do 800 miligramów kwasu moczowego, który następnie jest wydalany z moczem.
Nadmierne jego wytwarzanie powoduje podwyższenie jego stężenia we krwi (hiperurykemia) i jest przyczyną zmian chorobowych, wywołanych przez wytrącanie się kryształów moczanu sodu szczególnie w stawach i nerkach. Choroba ta jest znana jako dna moczanowa. Większość ssaków przekształca dalej kwas moczowy do łatwo rozpuszczalnej substancji - alantoiny. Brak możliwości przekształcania kwasu moczowego do alantoiny jest jednak korzystnym czynnikiem selekcyjnym. Moczany bardzo łatwo się utleniają i są bardzo wydajną substancją usuwającą wysoce reaktywne, szkodliwe formy tlenu, np.: rodniki hydroksylowe, aniony ponadtlenkowe. Obecność moczanów w osoczu może wydatnie przyczyniać się do wydłużenia życia ludzkiego i do zmniejszenia zapadalności na choroby nowotworowe. Moczany jak również bilirubina są przykładami reguły, że niektóre produkty końcowe pochodzące ze szlaków metabolicznych odgrywają ważną rolę jako czynniki ochronne.
Mocznik
Mocznik powstaje w organizmie w tzw. cyklu mocznikowym. Związek ten pochodzi głównie z przemiany azotowej białek.
Podczas deaminacji aminokwasów tworzy się bardzo toksyczny amoniak. Powstaje on również w mniejszej ilości, w przemianach innych związków, np. nukleotydów purynowych i pirymidynowych oraz amin. Proces syntezy mocznika pełni ważną biologiczną rolę w przekształcaniu amoniaku w łatwo rozpuszczalny, nietoksyczny w stężeniach fizjologicznych związek, który następnie jest wydalany z moczem.
Zdrowy, dorosły człowiek, na prawidłowej diecie ma zachowaną równowagę azotową. Dobowa ilość azotu wydalana z organizmu jest równa ilości azotu przyjmowanego z pożywieniem. Przy spożyciu białka w ilości około 100 gramów na dobę wydalane jest 16 gramów azotu. 80 - 90% całkowitej puli wydalanego azotu stanowi mocznik. Ilość wytworzonego w organizmie dorosłego człowieka mocznika zależy głównie od zawartości białka w pożywieniu i przeciętnie wynosi od 20 do 40 g na dobę. Stężenie tego związku we krwi w warunkach prawidłowych waha się w szerokich granicach, od 20 do 40 mg/100 cm3.
Synteza mocznika zachodzi wyłącznie w wątrobie. Amoniak łączy się z CO2 tworząc karbamoilofosforan, reakcja ta wymaga udziału dwóch cząsteczek ATP, jako źródła energii. Karbamoilofosforan następnie reaguje z ornityną, tworząc cytrulinę. Cytrulina przy udziale energii pochodzącej z hydrolizy ATP kondensuje z asparaginianem, który jest dawcą drugiego atomu azotu. Powstały argininobursztynian ulega rozszczepieniu na argininę i fumaran. Arginina hydrolizuje dając mocznik i ornitynę, zamykając w ten sposób jeden obrót cyklu. Dwie pierwsze reakcje zachodzą w mitochondriach komórek wątroby, pozostałe trzy przebiegają w cytoplazmie.
Kreatynina
Kreatynina jest produktem degradacji kreatyny. Kreatyna występuje głównie w mięśniach i w postaci fosforanu jest magazynem energii. Cykl mocznikowy jest także punktem wyjścia do syntezy tego ważnego metabolitu. Arginina, metabolit cyklu mocznikowego, ulega w komórkach nerki kondensacji z glicyną. Powstaje guanidynooctan, który jest metylowany przez S-adenozylometioninę (SAM) do kreatyny. Kreatyna jest następnie fosforylowana za pomocą ATP i przechodzi w fosforan kreatyny, stanowiący zapas łatwo uruchamianej energii w mięśniu. Ostatni etap przemiany odbywa się bez udziału enzymów. W ciągu doby około 1,6% fosfokreatyny przekształca się w bezwodnik - kreatyninę (Rys. 2).
Kreatynina jest wydalana z moczem, przeciętnie od 1 do 1,8 gramów na dobę. Prawidłowe stężenie kreatyniny w surowicy wynosi u dorosłych kobiet od 0,5 do 1 mg/100 cm3, a u mężczyzn 0,6 - 1,2 mg/100 cm3. Znacznie niższe stężenie kreatyniny występuje u małych dzieci do trzech lat (0,2-0,4 mg/100 cm3). W miarę dorastania stężenie to stopniowo wzrasta, aby osiągnąć w wieku 17 lat wartości charakterystyczne dla ludzi dorosłych. Podwyższone stężenie kreatyniny we krwi może wystąpić w chorobach nerek, mięśni i zatruciach witaminą D.
CZĘŚĆ DOŚWIADCZALNA
1. Oznaczanie kwasu moczowego w surowicy krwi
Zasada metody
Kwas moczowy w środowisku alkalicznym redukuje sole kwasu fosforowolframowego do tlenków wolframu na niższym stopniu utlenienia, mających zabarwienie niebieskie, a sam utlenia się do alantoiny. Natężenie powstałej barwy oceniane jest kolorymetrycznie. Wykonanie doświadczenia wymaga uprzedniego odbiałczenia surowicy za pomocą soli metali ciężkich (w tym przypadku jonów wolframu). Równolegle przeprowadza się analogiczne reakcje z wzorcowym kwasem moczowym (bez etapu odbiałczania).
Odczynniki
1. 10% roztwór wolframianu sodu.
2. 0,3 mol/dm3 roztwór H2SO4.
3. Wzorcowy roztwór kwasu moczowego o stężeniu 1 mg/100 cm3.
4. 10,3% roztwór Na2CO3.
5. Odczynnik fosforowolframowy (4% Na2WO4 x 2 H2O w 3% roztworze H3PO4).
a) Odbiałczanie surowicy
Wykonanie doświadczenia
Do probówki odmierzyć 8 cm3 wody i 1 cm3 surowicy.
Dodać 0,5 cm3 10% roztworu wolframianu sodu, a następnie 0,5 cm3 0,3 mol/dm3 roztworu H2SO4 i dokładnie wymieszać.
Odstawić na 30 minut.
Odwirować (15 min, 3000 obr./min),
Do dalszych oznaczeń pobrać płyn znad osadu.
b) Oznaczenie ilościowe kwasu moczowego
Wykonanie doświadczenia
Przygotować 3 probówki.
1-próba badana - odmierzyć 3 cm3 płynu znad osadu po odbiałczeniu surowicy
2-próba wzorcowa - 3 cm3 roztworu wzorcowego kwasu moczowego.
3-próba ślepa - 3 cm3 wody.
Do wszystkich probówek dodać po 0,5 cm3 10.3% roztworu węglanu sodu i wymieszać.
Następnie dodać po 0,15 cm3 odczynnika fosforowolframowego, dokładnie wymieszać.
Odczytać absorbancję po 15 minutach, przy 610 nm wobec próby ślepej.
Uwaga: Jeśli w badanej próbce wytrącił się osad, należy przed pomiarem spektrofotometrycznym roztwór przesączyć.
Obliczenia:
Współczynnik 10 wynika z faktu, że surowica w trakcie doświadczenia została dziesięć razy rozcieńczona.
2. Oznaczanie mocznika w surowicy krwi metodą ureazową
Zasada metody
Mocznik ulega hydrolizie w reakcji katalizowanej przez ureazę (enzym pochodzenia roślinnego lub bakteryjnego). Powstałe jony amonowe reagują z odczynnikiem Nesslera i tworzy się barwny produkt. Natężenie barwy oceniane jest kolorymetrycznie. Przeprowadzenie reakcji z odczynnikiem Nesslera wymaga uprzedniego odbiałczenia surowicy za pomocą soli metali ciężkich (10% roztwór ZnSO4.i 0,5 mol/dm3 roztwór NaOH). Równolegle przeprowadza się analogiczne reakcje (bez etapu odbiałczania) stosując jako wzorzec roztwór NH4Cl o znanym stężeniu
Odczynniki
1. Roztwór ureazy z ziaren soi w buforze Tris-HCl o pH 7,4.
2. 10% roztwór ZnSO4.
3. 0,5 mol/dm3 roztwór NaOH.
4. Wzorzec do oznaczania mocznika (roztwór NH4Cl o stężeniu 1 mg N/100 cm3).
5. Odczynnik Nesslera (zasadowy roztwór K2[HgJ4]).
a) Hydroliza mocznika i odbiałczanie surowicy
Wykonanie doświadczenia
Do probówki wirówkowej odmierzyć 1 cm3 wody i 0,2 cm3 surowicy.
Następnie dodać 2 cm3 roztworu ureazy w buforze Tris-HCl, pH 7,4.
Probówkę zakryć parafilmem, wstawić do łaźni wodnej o temp. 370 C i inkubować 20 minut.
Po inkubacji dodać 0,5 cm3 10% roztworu ZnSO4 i 0,3 cm3 0,5 mol/dm3 roztworu NaOH w celu wytrącenia białek.
Zawartość probówki dokładnie wymieszać i odwirować (5 min, 3000 obr./min).
b) Oznaczenie ilościowe mocznika
Wykonanie doświadczenia
1. Przygotować trzy probówki.
1- próba badana - pobrać 2 cm3 płynu nadosadowego i dodać 5 cm3 wody,
2- próba wzorcowa - do 1 cm3 roztworu wzorcowego dodać 6 cm3 wody
3. próba ślepa - 7 cm3 wody
2. Zawartość probówek wymieszać.
3. Do wszystkich trzech probówek dodać po 1 cm3 odczynnika Nesslera, wymieszać.
4. Odczytać absorbancję po upływie pięciu minut, przy długości fali 470 nm, wobec próby ślepej.
Obliczenia
1 mg azotu odpowiada 2,14 mg mocznika (60:28, 60 - względna masa cząsteczkowa mocznika, 28 - względna masa cząsteczkowa azotu), współczynnik 10 wynika z rozcieńczenia surowicy - w końcowej objętości znajduje się 0,1 cm3 surowicy, a 1 cm3 wzorca.
3. Oznaczanie kreatyniny w surowicy krwi i w zadaniu
Zasada metody
Kreatynina tworzy z kwasem pikrynowym kompleks o zabarwieniu czerwonym. Natężenie powstałej barwy oceniane jest kolorymetrycznie. Wykonanie doświadczenia wymaga uprzedniego odbiałczenia surowicy za pomocą soli metali ciężkich (w tym przypadku jonów wolframowych). Równolegle przeprowadza się w taki sam sposób (bez etapu odbiałczania) reakcję z wzorcowym roztworem kreatyniny (znanym stężeniu).
[Powyższa metoda oznaczania kreatyniny jest mało swoista i w zależności od warunków (temperatura, czas inkubacji, pH środowiska) intensywność zabarwienia może zmieniać się nieproporcjonalnie. Rzeczywista zawartość kreatyniny w osoczu stanowi zwykle około 80% wartości oznaczanej tą metodą].
Odczynniki
1. 10% roztwór Na2WO4.
2. 0,3 mol/dm3 roztwór H2SO4,
3. 1 mol/dm3 roztwór NaOH.
4. 1,5% roztwór kwasu pikrynowego.
5. Wzorcowy roztwór kreatyniny o stężeniu 4 mg/ 100 cm3.
Wykonanie doświadczenia
a) Odbiałczanie surowicy
Do probówki wirówkowej pobrać 3 cm3 surowicy.
Dodać 1,5 cm3 10% roztworu Na2WO4 i 1,5 cm3 0,3 mol/dm3 roztworu H2SO4 celem zdenaturowania białek.
Dokładnie wymieszać.
Odstawić na 30 minut.
Odwirować (15 min, 4000 obr./min).
Płyn znad osadu zlać do suchej probówki.
b) Wykonanie oznaczenia ilościowego
Przygotować 5 probówek.
1 -próba badana - odmierzyć 2cm3 płynu znad osadu po odbiałczeniu surowicy
2 - próba wzorcowa - 1 cm3 roztworu wzorcowego kreatyniny i 1 cm3 wody.
3- próba ślepa - 2 cm3 wody.
4, 5 - zadanie ilościowe indywidualne - z otrzymanej próby pobrać po 1 cm3 zadania i dodać1 cm3 wody.
Do wszystkich probówek dodać po 1 cm3 1,5% roztworu kwasu pikrynowego i 1 cm3 1 mol/dm3 roztworu NaOH i wymieszać.
Po 15 min odczytać absorbancję przy 520 nm wobec próby ślepej.
Obliczenia
7
Wyszukiwarka
Podobne podstrony:
Kreatynina i kwas moczowy
V przemiana azotowa
PRODUKCJA PRZEMIANY, Inne
PRZEMIANY AZOTOWE RM
Kolokwium VI. Przemiana azotowa 2013, Biochemia
Produkcyjność przemiennych użytków zielonych
FIZJOLOGICZNIE WAŻNE PRODUKTY PRZEMIAN AMINOKWASÓW
Zbędne produkty przemiany materii
Kwas moczowy
Kotler prof Philip Produkty przemijają, idee marketingowe – nie
Wykład 5 Mocznik i kreatynina
Przemiany aminokwasów w biologicznie ważne, wyspecjalizowane produkty
kwas azotowy
Narko Odczynnik kwas azotowy stężony
więcej podobnych podstron