INSTRUKCJA OZNACZANIA
KWASOWOŚĆ I ZASADOWOŚĆ
Kwasowość i zasadowość
Do oznaczania kwasowości i zasadowości można wykorzystać metody:
miareczkową potencjometryczną
oraz miareczkową wobec wskaźników.
W badaniach analitycznych wody wykorzystuje się przede wszystkim zasadę oznaczania kwasowości wobec wskaźników polegającą na miareczkowaniu badanej próbki mianowanym roztworem wodorotlenku sodu (NaOH) wobec oranżu metylowego do pH około 4,5 (kwasowość mineralna) i następnie wobec fenoloftaleiny do pH około 8,3 (kwasowość ogólna). Podczas miareczkowania roztworem zasady zachodzą poniższe reakcje:![]()
H+ + OH- → H2O
CO2 + OH- → HCO3-
HCO3- + OH- → CO32- + H2O
Kwasowość definiuje się jako zdolność wody do zobojętnienia zasad. Spowodowana jest obecnością:
wolnego dwutlenku węgla (kwasu węglowego),
słabych oraz mocnych kwasów mineralnych,
kwasów organicznych,
produktów hydrolizy soli mocnych kwasów i słabych zasad.
Kwasowością mineralna (Kw) pochodzi wyłącznie od mocnych kwasów mineralnych obejmujących m.in.: kwas solny (HCl), kwas azotowy (HNO3), kwas siarkowy (H2SO4) oraz kwas fosforowy (H3PO4).
Kwasowość wody jest właściwością, która może występować jednocześnie z zasado-wością. Ma to miejsce w wodach o wysokiej twardości i dużej zawartości dwutlenku węgla.
Pojęcie zasadowości określane jest jako zdolność wody (ścieków) do zobojętniania kwasów mineralnych.
Zasadowość ogólna (Zog.) oznacza sumę wszystkich związków chemicznych w środowisku wodnym, które reagują zasadowo wobec oranżu metylowego (pH około 4,5).
Zasadowość mineralna (Zm) oznacza sumę wszystkich związków reagujących zasadowo wobec fenoloftaleiny (pH powyżej 8,3).
Podczas miareczkowania roztworem kwasu zachodzą poniższe reakcje:![]()
OH- + H+ → H2O
CO32- + H+ → HCO3-
HCO3- + H+ → CO2 + H2O
Wskaźniki wykorzystywane przy oznaczaniu kwasowości oraz zasadowości charakteryzują się swoistym zakresem pH, w którym zmienia się ich barwa. Przykłady najczęściej stosowanych wskaźników przedstawiono w Tabeli 2.
Tabela 2. Zmiany barwy wybranych wskaźników w zależności od zakresu pH
Wskaźnik |
Wzór sumaryczny |
Barwa w środowisku |
Zakres pH zmiany barwy |
|
|
|
kwasowym |
zasadowym |
|
Oranż metylowy |
C14H14N3O3SNa |
czerwona |
żółta |
3,2 ÷ 4,4 |
Fenoloftaleina |
C20H14O4 |
bezbarwna |
czerwona |
8,2 ÷ 10,0 |
Czerwień metylowa |
C15H14N3O2Na |
czerwona |
żółta |
4,5 ÷ 6,2 |
W zależności od rodzaju związków, powodujących zasadowość wody rozróżnia się:
zasadowość węglanową (
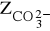
) wywołaną obecnością węglanów,zasadowość wodorowęglanową (
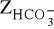
) wywołaną obecnością wodorowęglanów,zasadowość wodorotlenową (
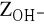
) wywołaną obecnością wodorotlenków.
Obok wodorowęglanów i węglanów wapnia oraz magnezu w niektórych wodach mogą występować węglany oraz wodorowęglany sodu i potasu. W takich przypadkach zasadowość wody jest wyższa od twardości ogólnej. Występująca różnica:
Zog. - Twog. = Zalk.
jest określana jako zasadowość alkaliczna.
W oznaczaniu przeszkadzają następujące czynniki:
barwa wyższa od 50 mg Pt/dm3,
mętność wyższa od 30 mg/dm3,
duże ilości łatwo hydrolizujących soli żelaza i glinu,
substancje utleniające (np. wolny chlor) odbarwiające wskaźnik,
twardość węglanowa powyżej 3,6 mval/dm3.
Za podstawę oznaczania kwasowości oraz zasadowości przyjęto metodę wg PN-90/C-04540/03.
Kwasowość mineralna (Kwm.) i kwasowość ogólna (Kwog.)
Do kolby stożkowej o pojemności 200 - 250 cm3 odmierzyć pipetą 100 cm3 próbki lub mniejszą jej objętość rozcieńczoną wodą destylowaną do 100 cm3. Wykonać oznaczenie:
kwasowości mineralnej - miareczkując próbką badaną po dodaniu 3 kropli oranżu metylowego, roztworem 0,05 M NaOH do zmiany zabarwienia z różowego na słomkowożółte. Objętość roztworu NaOH użytego do miareczkowania, oznaczyć jako (a). Jeżeli badana próbka nie zabarwi się na różowo po dodaniu roztworu fenoloftaleiny, oznacza to, że ten rodzaj kwasowości w wodzie badanej nie występuje (Km. = 0).
kwasowości ogólnej - miareczkując tą samą próbkę po oznaczeniu kwasowości mineralnej oraz po dodaniu 10 kropli fenoloftaleiny, roztworem 0,05 M NaOH do wy-raźnego różowego zabarwienia utrzymującego się przez 3 min. Objętość roztworu NaOH użytego do łącznego zmiareczkowania próbki wobec oranżu metylowego i fenoloftaleiny, oznaczyć jako (b).
Kwasowość mineralną (Kwm.) i ogólną (Kwog.) (w mval/dm3) obliczyć z równań:
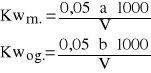
gdzie:
a - objętość 0,05 M NaOH użytego do miareczkowania próbki badanej wobec fenoloftaleiny, cm3
b -łączna objętość 0,05 M NaOH użytego do miareczkowania próbki badanej wobec wskaźników, cm3
V - objętość próbki badanej użytej do oznaczania, cm3.
Zasadowość mineralna (Zm.) i zasadowość ogólna (Zog.)
Do kolby stożkowej o pojemności 200 - 250 cm3 odmierzyć pipetą 100 cm3 próbki lub mniejszą jej objętość rozcieńczoną wodą destylowaną do 100 cm3. Wykonać oznaczenia:
zasadowości mineralnej - miareczkując próbką badaną, po dodaniu 4 kropli fenoloftaleiny, roztworem 0,1 M HCl do zaniku różowego zabarwienia. Objętość roztworu HCl użytego do miareczkowania, oznaczyć jako (a). Jeżeli badana próbka nie zabarwi się na różowo po dodaniu roztworu fenoloftaleiny, oznacza to, że ten rodzaj zasadowości w wodzie badanej nie występuje (Zm. = 0).
zasadowości ogólnej - miareczkując tą samą próbkę po oznaczeniu zasadowości mineralnej oraz po dodaniu 4 kropli oranżu metylowego, roztworem 0,1 M HCl do zmiany zabarwienia z żółtego na pomarańczowe. Objętość roztworu HCl użytego do łącznego zmiareczkowania próbki wobec oranżu metylowego i fenoloftaleiny, ozna-czyć jako (b).
Zasadowość mineralną (Zm.) i ogólną (Zog.) (w mval/dm3), obliczyć z równań:
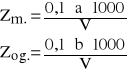
gdzie:
a - objętość 0,1M HCl użytego do miareczkowania próbki badanej wobec fenoloftaleiny, cm3
b - łączna objętość 0,1M HCl użytego do miareczkowania próbki badanej wobec wskaźników, cm3
V - objętość próbki badanej, cm3.
Na podstawie oznaczeń zasadowości ogólnej i mineralnej można dokonać obliczeń stężenia poszczególnych jonów wywołujących zasadowość wody (Tabela 3).
Tabela 3. Zależność między rodzajem zasadowości a stężeniem jonów: wodorotlenkowych (OH-), węglanowych (CO3-2) i wodorowęglanowych (HCO3-), w mval/dm3
Wyniki oznaczeń zasadowości |
Zasadowość, mval/dm3 |
||
|
OH- |
CO32- |
HCO3- |
Zm. = 0 |
0 |
0 |
Zog. |
2 Zm. < Zog. |
0 |
2 Zm. |
Zog. - 2 Zm. |
2 Zm. = Zog. |
0 |
2 Zm. |
0 |
2 Zm. > Zog. |
2 Zm. - Zog. |
2 (Zog. - Zm..) |
0 |
Zm.. = Zog. |
Zog. |
0 |
0 |
W celu uzyskania wyników poszczególnych jonów w mg/dm3, należy skorzystać z następujących zależności:
1 mval OH-/dm3 = 17,01 mg OH-/dm3
1 mval CO32-/dm3 = 30,0 mg CO32-/dm3
1 mval HCO3-/dm3 = 61,02 mg HCO3-/dm3
Strona 3 z 3
Wyszukiwarka
Podobne podstrony:
InstrukcjaChZT, Studia, Przyszle lata, II rok pg, chemia
INSTRUKCJASO4, Studia, Przyszle lata, II rok pg, chemia
INSTRUKCJAbarwa, Studia, Przyszle lata, II rok pg, chemia
INSTRUKCJACO2, Studia, Przyszle lata, II rok pg, chemia
PYTK 2007, Studia, Przyszle lata, II rok pg, tech betonu
SPRAWOZDANIE Z METOD-8, Studia, Przyszle lata, II rok pg, metody Doświadczalne
Badania cementu II, Studia, Przyszle lata, II rok pg, tech betonu
sciągi(1), Studia, Przyszle lata, II rok pg, geodezja
bo, Studia, Przyszle lata, II rok pg, BO
CEMENT I LAB , Studia, Przyszle lata, II rok pg, tech betonu
Odpowiedzi na pytania z Budownictwa Ogolnego, Studia, Przyszle lata, II rok pg, BO
Bezpieczeństwo instalacji elektrycznych(1), Studia, Przyszle lata, II rok pg, instalacje budowlane
BETONY-sciaga, Studia, Przyszle lata, II rok pg, tech betonu
Odczytywanie charakterystyk, Studia, Przyszle lata, II rok pg, instalacje budowlane
Wybrane, Studia, Przyszle lata, II rok pg, instalacje budowlane
więcej podobnych podstron