CHEMIA FIZYCZNA- KOLOIDY
Koloidy
Układy, najczęściej 2składnikowe, w których wielkość cząstki mieści się w granicach 1mm do 500 mm. Są stanem pośrednim między roztworami rzeczywistymi, a zawiesinami i mieszaninami niejednorodnymi. Sprawiają wrażenie układów fizycznie jednorodnych, chociaż w rzeczywistości oba składniki nie SA zmieszane cząsteczkowo.
ROZDROBNIENIE I JEGO WPŁYW NA WŁAŚCIWOŚCI UKŁADU |
|
Mechaniczne >500mm
|
Układ dwufazowy, cząstki fazy rozproszonej nie przechodzą przez błony półprzepuszczalne, nie dyfundują, nie wykazują ruchów Browna |
Koloidalne 1-500 mm
|
Układ pozornie jednofazowy, cząstki fazy rozproszonej widoczne tylko w mikroskopie, przechodzą przez sączki z bibuły, nie dyfundują, wykazują ruchy Browna |
Cząsteczkowe <1mm |
1 fazowy układ, cząstki fazy rozproszonej przechodzą przez sączki z bibuły, dyfundują przez błony półprzepuszczalne, wykazują ruchy Browna |
W koloidzie wyróżniamy:
- ośrodek dyspersyjny (rozpraszający)- część układu, tworzy fazę ciągłą
- faza zdyspergowana (rozproszona) - cząstki rozproszone
Podział koloidów ze względu na wielkość cząstek:
- monodyspersyjne - cząstki fazy rozproszonej mają jednakową wielkość
- polidyspersyjne - cz. Fazy rozproszonej maja różna wielkość
Podział ze względu na to, co rozprasza i jest rozpraszane:
FAZA ROZPRASZAJACA |
FAZA ROZPROSZONA |
PRZYKŁADY |
NAZWA |
GAZ |
Gaz |
- |
- |
|
Ciecz |
Mgły, chmury, dezodorant |
GAZOZOLE AEROZOLE |
|
Ciało stałe |
Kurz, dymy, pyły koloidalne |
GAZOZOLE |
CIECZ |
Gaz |
Piany |
PIANY |
|
Ciecz |
Żelatyna, mleko, białka, emulsje olejów w wodzie |
EMULSJE |
|
Ciało stałe |
Zole Tl. I wodorotl. Metali |
ZOLE |
CIAŁO STAŁE |
Gaz |
Pumeks, okluzje gaz. w miner. |
PIANY ST. |
|
Ciecz |
Kwarce mleczne, woda okludowała w kryształach |
EMULSJE STAŁE |
|
Ciało stałe |
Kryształy, ametyst, rubin |
ZOLE STAŁE |
Podział ze względu na budowę cząstki koloidalnej:
Koloidy fazowe- cząstka koloidalna nie jest cząstka chemiczną fazy rozproszonej (AgCl, Agi)
Koloidy cząsteczkowe- cząstka koloidalna jest cząstką chemiczną fazy rozproszonej (cz. białek, polimerów, hemoglobina)
Koloidy asocjacyjne- powstają przez samorzutne skupienie się dużej liczby małych cząstek w agregaty o wymiarze koloidalnym po przekroczeniu pewnego stężenia (asocjaty oleinianu sodowego)
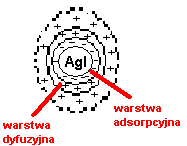
O tym czy dany koloid jest 0, +,- decyduje 1 warstwa adsorpcyjna
Micella- naładowana cząstka koloidalna np. micella Agi wytrącona z roztworu KI
-jony I- +jony K+
Koloid fazowy
Podział w zależności od powinowactwa cząstki fazy rozproszonej do rozpuszczalnika:
- KOLOIDY LIOFILOWE - HYDROFILOWE - dla układów, gdzie ośrodkiem rozpraszającym jest woda, mające duże powinowactwo względem rozpuszczalnika BIAŁKA, Żelatyna, Tanina)
-KOLOIDY LIOFOBOWE - HYDROFOBOWE- dla układów, gdzie ośrodkiem rozpraszającym jest woda, mające małe powinowactwo względem rozpuszczalnika (Zole metali, soli, wodorotlenków)
Właściwość |
LIOFILOWE |
LIOFOBOWE |
||
Otrzymywanie |
Rozpuszczanie |
Metody dyspersji i kondensacji |
||
Struktura cząstek |
Makrocząsteczki |
Przeważnie zespoły zwykłych cząstek |
||
Stężenie fazy rozproszonej |
Może być duże |
Nieznaczne |
||
Ruchy Browna |
Bardzo niewyraźne |
Występują wyraźnie |
||
Efekt Tyndalla |
Niewyraźny |
Wyraźny |
||
Barwa układu |
Bezbarwne |
Często barwne |
||
Ładunek elektryczny |
Brak lub nieznaczny |
Często/zawsze naładowane |
||
Lepkość |
Duża |
Nieznaczna |
||
Tworzenie pian |
Łatwo tworzą piany |
Nie tworzą pian |
||
Pęcznienie |
Pęcznieją znacznie zwiększając objętość |
Nie pęcznieją |
||
Tworzenie galaret |
Łatwo tworzą galarety |
Nie tworzą galaret |
||
Wrażliwość na elektrolity
|
Mała wrażliwość, koagulacja przy dużych stężeniach elektrolitów |
Koagulacja pod wpływem małych stężeń elektrolitów |
||
Wrażliwość na odwadnianie |
Przy dużych stężeniach znaczna |
Nieznaczna |
||
Charakter koagulacji |
Odwracalna |
Nieodwracalna |
||
Właściwości kinetyczne ukł koloidalnych:
Ruchy Browna
Dyfuzja
Sedymentacja
Lepkość
Ciśnienie osmotyczne
Cząstki koloidalne znajdują się w nieustannym ruchu będącym wynikiem zderzeń cząstek w fazie rozpraszającej
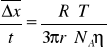
Δx- średnie przesunięcie cząsteczki w czasie Na- licz. Avogadra
r- promień pow. O okrągłym kształcie T- temperatura R- stała gazowa 8,31J/mol*K n-lepkość
Dyfuzja
Ruch cząstek substancji stanowiącej fazę rozproszona pod wpływem różnicy stężeń pomiędzy różnymi częściami układu. Miarą szybkości zachodzenia jest współczynnik zachodzenia dyfuzji, który podaje jaka masa substancji będącej fazą rozproszoną przedyfunduje przez pow. 1cm2 w czasie 1 s pod wpływem gradientu stężenia
Czynnik dyfuzji jest odwrotnie proporcjonalny do lepkości.
Współczynnik dyfuzj D
(Einsteina- Smoluchowskiego)
![]()
η t-lepkość ośrodka dyspersyjnego
r-promień cząstki
N-liczba Avogerda
R-stała gazowa
T-temperatura bezwzględna
Prawo Ficka
Szybkość dyfuzji , czyli ilość gramów substancji rozproszonej przeniesiona przez granicę zetknięcia w jednostce czasu, jest proporcjonalna do stężenia oraz powierzchni zetknięcia.
Sedymentacja
W wyniku działania sił ciężkości w układach koloidalnych następuje opadanie cząstek fazy rozproszonej, powodujące w konsekwencji zniszczenie struktury koloidu
f1 = 4/3 * Πr3(dr - doś)g
gdzie:
dr - gęstość fazy rozproszonej
doś - gęstość fazy rozpraszającej
g - przyspieszenie ziemskie
Turbidymetryczne wyznaczanie średniej wielkości cząstki koloidalnej
Wykorzystując absorpcję pozorną (technika analityczna), pozwala oznaczyć średnią wielkość cząstki koloidalnej według wzoru:
Ap= lg lo/lp= k b*c/ d*a *λ4
Gdzie:
b-natężenie światła padającego
lp-natężenie światła padającego
k,a-stałe zależne od rodzaju substancji
d-średni wymiar cząsteczki
λ4-długość fali
Układ |
Śr.promień cząstki |
Vopadania W cm/godz. |
Czas opadania
|
Krople Deszczu |
10-2 |
10-2 |
0,01 sekundy |
Mgła |
10-4 |
10-4 |
100 sekund |
Emulsja |
10-4 |
10-5 |
50 godzin |
Zol |
10-6 |
10-7 |
2 miesiące |
Albumina w wodzie |
10-7 |
10-10 |
90 lat |
Sedymentacja wymuszona w ultradźwiękach
Wyznaczanie masy cząstek koloidalnych
dr/dt
S= ---------
rw2
s-współczynnik sedymentacji wymuszonej w wirówce o promieniu r
w-prędkość kątowa w wirówce
dr-zmiana stężenia w roztworze koloidalnym na drodze x
dr/dt- zmiana położenia cząstki koloidalnej dr, w czasie dt
Masę cząsteczki można oznaczyć uwzględniając lepkość roztworu koloidalnego, oraz promień cząstki wyliczonej na podstawie współczynnika dyfuzji D Einsteina- Smoluchowskiego.
KTS
M= -----------------
D(1-do/d)
K-stała
T-temperatura bezwzględna
Do-gęstość rozpuszczalnika
d-gęstość cząstki koloidalnej
Tworzenie pian
Niszczenie Pian (Wytrącanie)
2C15H31COONa + Ca 2+- (C15H31COO)2 Ca↓ + 2Na+
Ruchy Browna
Ruchami Browna nazywamy zjawisko polegające na tym, że niewielkie cząsteczki, pyłki znajdujące się w gazie, lub w zawiesinie samorzutnie i pozornie bez powodu wykonują stałe chaotyczne ruchy w różne strony.
Metody oczyszczania koloidów:
To proces oddzielania subst. Rozpuszczających (najczęściej w postaci jonów) od układu koloidowego wykorzystującym dyfuzję tych subst. Przez błony półprzepuszczalne (błony zwierzęce, celofanowe, kuprofonowe)> Proces dializy przebiega bardzo powoli dlatego przyspiesza się go przykładając pole elektryczne (elektroliza).
W dializatorze po jednej stronie membrany znajduje się zanieczyszczony roztwór koloidalny a druga strona omywana jest czystym rozpuszczalnikiem. Subst. O rozdrobnieniu cząsteczkowym przechodzą przez membraną do zew. Cieczy i mogą być w ten sposób usunięte z koloidu, zwłaszcza gdy ciecz zew. Będzie wymieniana w sposób ciągły. W przypadku elektrolizy proces oczyszczania przeprowadzony jest w polu elektrycznym.
Ciśnienie osmotyczne- roztworu koloidalnego ma taki sam sens fizyczny jak dla roztworów rzeczywistych, miarą ciśnienia osmotycznego jest ciśnienie, które należy przyłożyć do membrany, półprzepuszczalnej od strony roztworu, aby zahamować przechodzenie czystego rozpuszczalnika do roztworu. Ciśnienie osmotyczne roztworu koloidalnego jest znacznie niższe niż dla roztworów rzeczywistych i wynosi:
Π= RT/V1 * lnx1
V1-objętośc molowa rozpuszczalnika
x1-ułamek molowy rozpuszczalnika
ciśnienie osmotyczne roztworu jest tym większe, im więcej cząsteczek znajduje się w określonej ilości płynu
Równowaga membranowa Donnana
Przez określoną membranę półprzepuszczalną mogą przejść jedynie jony o pewnej wielkości. Niektóre membrany mają właściwości selektywne, przepuszczają tylko ściśle określone jony, cząstki.
Ma to praktyczne zastosowanie w filtracji membranowej
Membrany stosowane w procesach filtracyjnych:
RO - odwrócona osmoza (hiperfiltracja) - otwory w membranie są najmniejsze co pozwala przejść przez nie tylko w wodzie;
NF - nanofiltracja - otwory są nieco większe niż w RO i pozwalają oprócz wody przejść przez nie także solom mineralnym;
Typowe zastosowanie RO i NF:
zagęszczanie mleka, serwatki, soków owocowych, warzywnych;
demineralizacja mleka, serwatki;
oczyszczanie i zagęszczanie preparatów po ultrafiltracji (produkcja enzymów, antybiotyków, koncentratów białek);
koncentracja i oczyszczanie enzymów, antybiotyków;
oczyszczanie i zagęszczanie koncentratów białek, np.: jaj;
oczyszczanie wody.
UF - ultrafiltracja - otwory są jeszcze większe, tak, że oprócz wody i soli przechodzą przez nie cukry, a w roztworze pozostają białka.
Typowe zastosowanie:
zagęszczanie wszystkich białek mleka;
koncentrcja białek serwatkowych;
produkcja twarożków z mleka ukwaszonego;
przygotowanie mleka w technologii serów, jogurtu;
koncentracja i oczyszczanie enzymów;
koncentracja i oczyszczanie antybiotyków;
izolowanie enzymów, antybiotyków, białek;
oczyszczanie octu;
oczyszczanie soku jabłkowego i innych soków owocowych;
MF - mikrofiltracja - otwory są na tyle duże, że nie przechodzą przez nie jedynie koloidy, zawiesiny, bakterie i wirusy, a przepuszczane są substancje rozpuszczone jak białka.
Typowe zastosowania:
filtracja sterylna mleka, solanki;
oczyszczanie roztworów z zawiesin, będąca alternatywą dla wytrącania i odwirowania;
Lepkość
W wyniku działania sił kohezji (wzajemnego oddziaływania) między cząsteczkami cieczy występuje przy przemieszczaniu się jednych warstw cieczy względem drugich pewne tarcie wewnętrzne zwany lepkością.
Lepkość koloidu
Jest na ogół większa niż lepkość ośrodka dyspersyjnego, przy czym dla koloidów liofobowych różnice te są nieznaczne, a dla koloidów liofilowych mogą być bardzo duże. Układ, w którym cząstki fazy rozproszonej maja większy ładunek elektryczny, wykazują większą lepkość
Ciśnienie osmotyczne
Ciśnienie, jakie należy przyłożyć od strony roztworu koloidalnego, aby zahamować przechodzenie rozpuszczalnika (fazy rozpraszającej do koloidu). Ciśnienie o. koloidów wykazuje niższe wartości niż dla roztworów rzeczywistych
Właściwości optyczne koloidów:
Rozpraszanie światła
Zmętnienie roztworu
Efekt Tyndalla
to zjawisko fizyczne polegające na rozpraszaniu światła przez koloid z wytworzeniem charakterystycznego stożka świetlnego
Właściwości elektrokinetyczne koloidów:
Elektroosmoza- ruch ośrodka dyspersyjnego pod wpływem pola elektrycznego, wykorzystuje się do odwadniania skór, oczyszczania żelatyny, demineralizacji wody, osuszania budynków (ciecz + przesuwa się do ośrodka -, - do +, kapilara naładowana odwrotnie do ładunku cieczy)
Elektroforeza- ruch naładowanych cząstek koloidalnych pod wpływem pola elektrycznego wzdłuż nieruchomego ośrodka rozpraszającego (wykorzystuje się do rozdzielania białek, witamin, izomerów optycznych, w analityce chemicznej, przy oznaczaniu pestycydów (- do +, + do -, kapilara naładowana zgodnie z ładunkiem cieczy)
Katoforeza- ruch cząstek w kierunku katody
Anoforeza- ruch cząstek w kierunku anody
Potencjał przepływu- potencjał elektryczny uzyskany na elektrodach przy wymuszonym przepływie cieczy (odwrócenie zjawiska elektroosmozy)
METODY OTRZYMYWANIA KOLOIDÓW
Rozdrobnienie mechaniczne koloidalne cząsteczkowe
Dyspersja -> KOLOID <- Kondensacja
Koagulacja <- ROZPAD KOLOIDÓW -> Rozpuszczanie
Metody dyspersyjne
Rozdrobnienie do wielkości rozdrobnienia koloidalnego, osiąga się mechanicznie, elektrycznie, przy pomocy ultradźwięków lub przy użyciu peptyzatorów, wyróżnia się
-dyspersje mechaniczną i ultra dźwiękową
-fotodyspersje
-termodyspersje
-rozpylanie w tzw. „Atomizerach”
-peptyzajcca (dyspersja chemiczna)
Metody kondensacyjne
Maja zapewnić połączenie małych cząstek w zespoły o rozmiarach koloidu. Do osiągnięciu efektu wykorzystuje się reakcje polimeryzacji, redukcji, utleniania, wymiany lub zmniejszenia rozpuszczalności.
Metody oczyszczania:
-dializa
-elektroliza
Koagulacja
Polega na zmniejszeniu stopnia dyspersji układów koloidalnych, a więc na łączeniu się cząstek fazy rozproszonej w większe zespoły. Dzielimy je na odwracalne (piana, żelatyna) i nieodwracalne (białko kurze, zole Tl. I wodorotl. Metali)
Można je wywołać:
Dodaniem elektrolitu- próg koagulacji - minimalna liczba milimoli elektrolitu potrzebna do skoagulowania 1dm3 r. koloid.
Zmiana temp. - płyn do kąpieli - ciepła woda- pieni się, zimna piana ucieka
Czynnikiem mechanicznym (mieszając, wytrącając- otrz. masła niszczenie struktur k) Dodatkiem nieelektrolitu- wlanie roztworu wodnego do alkoholu
Przepływem prądu, działalnością światła.
Przewodniki I rodzaju (metale i ich stopy)
W których przenoszenie prądu odbywa się poprzez przemieszczanie się elektrolitów tworzących gaz elektroosmozy w strukturze kryształu metalicznego wskutek przyłożonej różnicy potencjałów.
Przewodniki II rodzaju (wodne roztwory elektrolitów lub stopione)
W których nośnikami prądu są obecne w roztworze jony, a przepływ prądu zawsze jest związany z zajściem reakcji RED-OX.
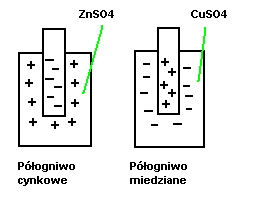
Zawsze góruje przechodzenie z metalu roztworzonego na metal w postaci płytki i na odwrót. W przypadku Zn góruje przechodzenie do roztworu, zatem płytka ładuje się ujemnie. Miedź z roztworu osadza się na płytce/ ładuje się dodatnio. Taki sposób to półogniwa.
Ogniwa galwaniczne
są układami, z których można czerpać energię elektryczną. Ogniwo chemiczne, w którym źródłem prądu są reakcje chemiczne zachodzące między elektrodą, a elektrolitem. Dwie elektrody zanurzone w elektrolicie (półogniwa) tworzą ogniwo galwaniczne
Anoda Elektroda, na której zachodzą procesy utleniania
Katoda Elektroda, na której zachodzą procesy redukcji
METODY OTOCZENIA KOLOIDÓW
Dializa (elektrodializa) Zdolność przechodzenia niektórych cząsteczek i jonów przez błonę półprzepuszczalną, rozdzielającą dwa roztwory; metoda badania składu niektórych roztworów zawiesin, oparta na zdolności przechodzenia niektórych ich składników przez błonę półprzepuszczalną.
Filtracja (ultrafiltracja) metoda oddzielania substancji stałych od cieczy i gazów, poprzez mechaniczne zatrzymanie jednej z substancji (zwykle ciała stałego) w przegrodach porowatych (filtrach) przy użyciu odpowiednich aparatów. Ciecz lub gaz otrzymywane po filtracji nazywa się filtratem.
Ultrafiltracja (filtracja molekularna) - to proces filtracji z użyciem sit molekularnych, membran i wszelkich materiałów porowatych, o porach których rozmiary są zbliżone do wielkości pojedynczych cząsteczek. Ultrafiltracja wymaga zwykle stosowania znacznych ciśnień i jest czasochłonna
Emulsja, układ koloidalny składający się z dwóch nierozpuszczalnych wzajemnie cieczy, z których jedna jest rozproszona w drugiej w postaci kropelek. Dwie ciecze mogą tworzyć różne emulsje w zależności od stosunku ilościowego fazy rozproszonej i rozpraszającej. Emulsja może być trwała wskutek obecności utrwalających ją emulgatorów.
Emulgatory hydrofilowe- o małych cząsteczkach (mydła sodowe i potasowe, trójenaoamina) dają emulsje typu O/W
Emulgatory hydrofobowe- magnezu, wapnia, dają emulsję typu W/O
Jedną z codziennie spotykanych emulsji jest mleko.
8
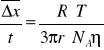
Wyszukiwarka
Podobne podstrony:
CHEMIA FIZYCZNA- spektrografia sc, Ochrona Środowiska pliki uczelniane, Chemia
CHEMIA FIZYCZNA-zanieczyszczenia sc, Ochrona Środowiska pliki uczelniane, Chemia
CHEMIA FIZYCZNA- Elektrochemia sc, Ochrona Środowiska pliki uczelniane, Chemia
CHEMIA FIZYCZNA- spektrografia sc, Ochrona Środowiska pliki uczelniane, Chemia
CHEMIA FIZYCZNA-Proces analityczny sc, Ochrona Środowiska pliki uczelniane, Chemia
CHEMIA FIZYCZNA - kinetyka reakcji sc, Ochrona Środowiska pliki uczelniane, Chemia
CHEMIA FIZYCZNA- srodowisko sc, Ochrona Środowiska pliki uczelniane, Chemia
CHEMIA FIZYCZNA-Proces analityczny sc, Ochrona Środowiska pliki uczelniane, Chemia
CHEMIA FIZYCZNA, Ochrona Środowiska pliki uczelniane, Chemia
alkalodiy, Ochrona Środowiska pliki uczelniane, Chemia
Alkaloidy cz, Ochrona Środowiska pliki uczelniane, Chemia
Alkaloidy c1, Ochrona Środowiska pliki uczelniane, Chemia
genetyka21, Ochrona Środowiska pliki uczelniane, Chemia
Natura 2000 a autostrada A1, Ochrona Środowiska pliki uczelniane, Natura 2000
113MOJA, Ochrona Środowiska pliki uczelniane, Fizyka
Niszczenie drobnoustrojów, Ochrona Środowiska pliki uczelniane, Mikrobiologia
zestawy opracowane eko, Ochrona Środowiska pliki uczelniane, Ekologia lądowa
więcej podobnych podstron