Wykonanie: Mazurkiewicz Marek
Ćwiczenie 6 31-03-2010
Temat: Preparatyka: synteza aspiryny
odczynniki:
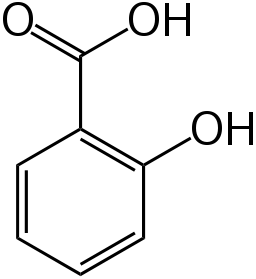
Kwas salicylowy - Występuje w postaci białego, krystalicznego proszku lub bezbarwnych igiełek o gęstości 1,443 g/cm³. Słabo rozpuszcza się w wodzie (w temp. 20 °C - 0,18 g na 100 cm³ H2O, w 100 °C - 7 g na 100 cm³; roztwór ma umiarkowanie kwaśny odczyn), bardzo dobrze w etanolu. Działa drażniąco na skórę i oczy. W dużych ilościach może być toksyczny (LD50rat(oral)) wynosi 891 mg/kg). Kwas salicylowy ma również zdolność do tworzenia wewnątrzcząsteczkowych wiązań wodorowych. Dzięki temu jest lotny z parą wodną i ulega sublimacji.
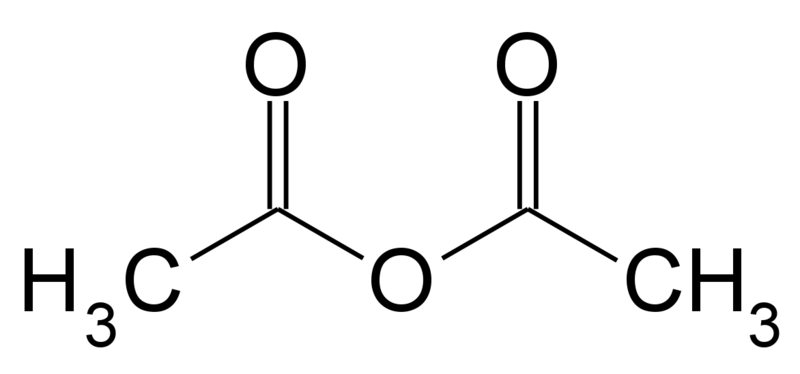
Bezwodnik octowy, (bezwodnik kwasu octowego) - organiczny związek chemiczny o wzorze (CH3CO)2O, należący do klasy bezwodników kwasów karboksylowych. W temperaturze pokojowej jest to bezbarwna ciecz o ostrym zapachu octu (produkt reakcji bezwodnika z parą wodną z powietrza). Zapach bezwodnika octowego różni się nieznacznie od kwasu octowego - jest bardziej drażniący.
Przebieg doświadczenia:
umieszczono w kolbie okrągłodennej (100 cm3) 5g kwasu salicylowego i 7 cm3 bezwodnika octowego
do kolby wkroplono się 5 kropli stężonego kwasu siarkowego
mieszaninę reakcyjną ogrzewano (łaźnia wodna) przez 10min
do gorącej mieszaniny dodano (chłodnica zwrotna) 5 cm3 wody
ochłodzona zawartość kolby w łaźni wodnej
dodano 50 cm3 wody
ochłodzona zawartość kolby w łaźni lodowej
produkt odsączone na lejku Büchnera
kryształy suszono na powietrzu
Obserwacje:
W wyniku reakcji otrzymano białe kryształy.
Wnioski:
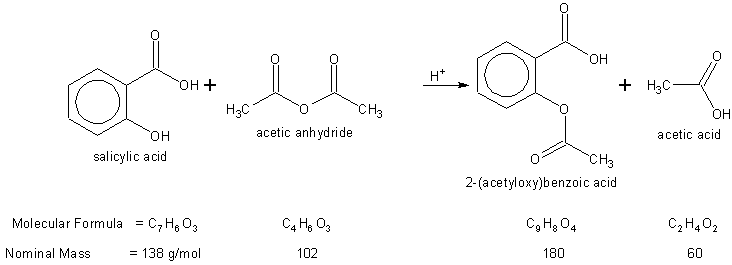
Zaszła reakcje
obliczenia:
związek |
kwas salicylowy |
bezwodnik octowy |
aspiryna |
||
masa molowa (M) [g/mol] |
138 |
102 |
180 |
||
do reakcji użyto (m) |
5 |
g |
7 |
cm3=* |
- |
|
|
|
7,56 |
g |
|
liczba moli (n=m/M) |
0,0362 |
0,0741 |
0,0362 |
||
w reakcji można było otrzymać [g](m=n*M) |
6,5217 |
||||
*7 cm3 * 108 g/cm3 = 7,56g
wydajność:
Wyszukiwarka
Podobne podstrony:
chem org ćw 5 Analiza chromatograficzna, chemia, organiczna, sprawozdania 2010
chem org ćw 2 destylacja, chemia, organiczna, sprawozdania 2010
chem org ćw 7 polarymetria, chemia, organiczna, sprawozdania 2010
chem org ćw 3 ekstrakcja, chemia, organiczna, sprawozdania 2010
chem org ćw 1 Krystalizacja, chemia, organiczna, sprawozdania 2010
chem org ćw 4, chemia, organiczna, sprawozdania 2010
sprawozdanie- cw 8, Studia Biologia, Chemia organiczna
sprawozdanie- cw 8, Studia Biologia, Chemia organiczna
sprawozdanie- cw 9, Studia Biologia, Chemia organiczna
Egzaminy z org. 2011, III semestr, Chemia organiczna, dodatkowe pliki z płyty - chemia organiczna, e
Chemia org. - Izomeria optyczna 1, SZKOŁA, CHEMIA, Organiczna
Przykladowy egzamin chemia organiczna - ICiP - 2010-zima. , Egzamin
Przykladowy egzamin chemia organiczna - ICiP - 2010-zima. , Egzamin
chemia techniczna organiczna sprawozdania synteza oranżu metylowego[1]
chemia fizyczna 1-1, SGGW - Technologia żywnosci, II semestr, SEMESTR 2, wyklady II rok, chem org,
kolokwium chem.org, Studia PŁ, Ochrona Środowiska, Chemia, organiczna
bromoacetanilid, Studia, Sprawozdania, Chemia organiczna
Syntezy alkenów i alkinów przykłady zadań, Chemia, Organiczna
chemia techniczna organiczna sprawozdania nitrowanie?lulozy
więcej podobnych podstron